Способ лечения демиелинизирующих заболеваний или состояний
Номер патента: 11319
Опубликовано: 27.02.2009
Авторы: Смит Крэйг П., Рэмп Дэвид, Рэтбоун Мишель П., Петти Маргарет
Формула / Реферат
1. Способ лечения демиелинизирующих заболеваний, включающий введение пациенту, который в этом нуждается, терапевтически эффективного количества соединения формулы I

где m равно 0, 1 или 2;
n равно 0, 1 или 2;
p равно 0 или 1;
каждый R независимо представляет собой водород, галоген, трифторметил, C1-C6алкил, C1-C6алкокси, бензилокси, гидрокси, нитрогруппу или аминогруппу;
каждый R1 независимо представляет собой водород, C1-C6алкил, C1-C6алкенил, C1-C6алканоил, галоген, цианогруппу, -C(O)C1-C6алкил, -C1-C6алкиленCN, -C1-C6алкиленNR'R'', где R' и R'', каждый независимо, представляет собой водород или C1-C6алкил; -C1-C6алкиленOC(О)C1-C6алкил или -CH(OH)R4, где R4 представляет собой водород или C1-C6алкил;
R2 представляет собой водород, C1-C6алкил, необязательно замещенный галогеном, гидрокси или бензилокси, C1-C6алкенил, C1-C6алкинил, -СО2С1-С6алкил или -R5-NR'R'', где R5 представляет собой C1-C6алкилен, C1-C6алкенилен или C1-C6алкинилен, a R' и R'', каждый независимо, представляет собой водород, C1-C6алкил или, альтернативно, группа -NR'R'' как целое представляет собой 1-пирролидинил; и
R3 представляет собой водород, нитрогруппу, аминогруппу, галоген, C1-C6алкокси, гидрокси или C1-C6алкил,
или его фармацевтически приемлемой соли.
2. Способ по п.1, где R представляет собой водород, галоген, трифторметил или C1-C6алкил; R1 представляет собой водород или C1-C6алкил; R2 представляет собой водород или C1-C6алкил; R3 представляет собой водород, C1-C6алкил или галоген; и p равно 0.
3. Способ по п.2, где соединение имеет следующую формулу:

4. Способ по п.1, где демиелинизирующее заболевание представляет собой рассеянный склероз.
5. Способ по п.1, где демиелинизирующее заболевание представляет собой травматическое повреждение головного мозга.
6. Способ по п.1, где демиелинизирующее состояние представляет собой удар.
7. Способ по п.1, где демиелинизирующее состояние представляет собой повреждение спинного мозга.
8. Способ лечения рассеянного склероза, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.3 (HP 184).
9. Способ улучшения мышечной функции у пациента с травматическим повреждением головного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
10. Способ лечения потери подвижности, возникшей в результате повреждения спинного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
11. Способ улучшения двигательной функции у пациента, страдающего от повреждения спинного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
12. Способ лечения потери чувствительности, возникшей в результате повреждения спинного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
13. Способ по любому из пп.9-12, в котором соединением является соединение, определенное в п.3.
14. Способ обеспечения симптоматического облегчения спастического парапареза, вызванного рассеянным склерозом, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы 1 согласно п.1 или его фармацевтически приемлемой соли.
15. Способ по п.14, где соединение имеет следующую формулу:
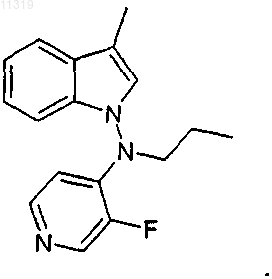
16. Способ обеспечения симптоматического облегчения шаткой походки, вызванной рассеянным склерозом, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I согласно п.1 или его фармацевтически приемлемой соли.
17. Способ по п.16, где соединение имеет следующую формулу:
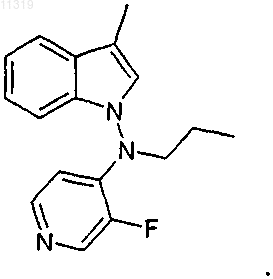
18. Способ обеспечения симптоматического облегчения диплопии, вызванной рассеянным склерозом, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I согласно п.1 или его фармацевтически приемлемой соли.
19. Способ по п.18, где соединение имеет следующую формулу:
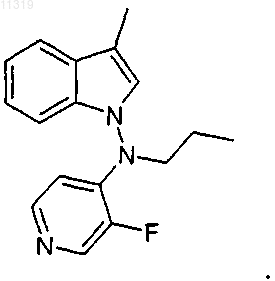
Текст
011319 Предпосылки к созданию изобретения Рассеянный склероз (MS) представляет собой дегенеративное и воспалительное неврологическое заболевание, которое поражает центральную нервную систему и связано с образованием нейрональных бляшек и нарушением нейрональной проводимости вследствие демиелинизации (утраты миелина). Подобно этому, имеется множество сообщений об обширной демиелинизации при травме спинного мозга и ударе (Bunge et al., 1993; Blight and DeCrescito, 1986; Pendlebury et al., 2000). Фундаментальное исследование в области физиологии распространения потенциала действия в миелинизированных волокнах показало, что блок проведения в демиелинизированных волокнах возникает частично вследствие появления чувствительных к аминопиридину калиевых каналов в областях с утраченным миелином (Bever, 1996). Потенциалы действия распространяются вдоль нормальных миелинизированных нервных волокон с помощью процесса нормального проведения, которое обеспечивается натриевым потоком, возникающим в результате открытия потенциалочувствительных натриевых каналов в перехвате Ранвье. Таким образом, при начале электрической стимуляции ионы натрия (Na+) проникают в нейрон, придавая нейрону более положительный заряд. Когда положительный заряд нейрона достигает критического уровня,наблюдается "деполяризация". Деполяризация позволяет положительным ядрам ионов течь вниз по нейрону, вдоль аксона и к концу нерва. Для "установки на ноль" самого нейрона избыточный положительный заряд должен рассеяться. Это происходит в результате выхода наружу ионов калия (далее в настоящем документе "K+") через калиевые каналы. В случае, когда миелин разрушен, потенциалочувствительные натриевые каналы, которые открываются во время деполяризации, появляются на аксолемме. Поток калия, текущий в обратном направлении по отношению к потоку натрия, уменьшает амплитуду и продолжительность потенциала действия, что вносит свой вклад в недостаточность проведения путем уменьшения плотностей дистального эффективного тока. Данный дефицит проведения связан с симптомами, включая мышечную слабость. Благодаря блокированию выхода K+ через калиевые каналы наружу,нейрон остается в деполяризованном состоянии более продолжительное время и более легко повторно стимулируется. Таким образом, полагают, что блокаторы калиевых каналов являются полезными для лечения заболеваний и состояний, при которых нарушена передача потенциала действия, таких как MS,травматическое повреждение головного мозга (далее в настоящем документе "TBI") и повреждение спинного мозга (далее в настоящем документе "SCI"). Блокаторы калиевых каналов, такие как 4-аминопиридин (далее в настоящем документе "4-АР"),увеличивают продолжительность и амплитуду потенциала действия в демиелинизированных волокнах и улучшают распространение потенциала действия in vitro (Bostock et al., 1978; 1981; Targ and Kocsis, 1985; 1986; Shi and Blight, 1997), облегчают высвобождение нейромедиаторов (Bostock et al., 1981; Hirsh andQuandt, 1993; Sherratt et al., 1980) и усиливают сократительную способность мышц (Agoston et al., 1982;Savage et al., 1985). Данные наблюдения предполагают, что блокаторы калиевых каналов, такие как 4-АР,могут восстанавливать проведение в демиелинизированных волокнах у пациентов с MS. Последующее клиническое испытание также подтвердило предположение о том, что лечение аминопиридином может улучшить симптомы у некоторых пациентов с MS (Jones et al., 1983; Stefoski et al., 1987; Davis et al., 1990;van Diemen et al., 1992; Bever et al., 1994; Schwid et al., 1997). Описана также эффективность 4-АР при лечении неврологических состояний, включая SCI, уменьшение хронической боли и спазмов у пациентов с SCI, болезнь Альцгеймера, постполиомиелитный синдром, миастению гравис, болезнь Хантингтона, возрастные нарушения памяти, посттравматические, постинсультные или посттоксические синдромы, влияющие на память или познавательную функцию, и семейная вегетативная дисфункция (Wurtman R.J. and Buyukuysal R., 1989; Hansebout R.R. and Blight A.,1996; Hansebout R.R. and Blight A., 1994). Начаты клинические испытания по применению фампридинаSR для лечения пациентов с долговременными повреждениями спинного мозга (Potter et al., 1998 а,b),несмотря на проблемы, связанные с безопасностью при применении 4-АР в общей популяции пациентов(Multiple Sclerosis, Cognos Study51, Decisions Resources, октябрь 1999 г., стр. 77-8). В нескольких исследованиях было показано, что однократные дозы 4-АР могут восстановить некоторые функции у пациентов с SCI, если их вводят спустя один год или более после повреждения (Potter et al., 1998 а,b; Qiao etal., 1997; Hayes et al., 1993; 1994). Также сообщается о положительных эффектах после длительного применения. Клинически значимые функциональные улучшения наблюдались у 16 из 16 пациентов после 3 месяцев ежедневного перорального приема 4-АР в дозе 30 мг/кг, у пациентов с SCI 2-летней давности или более. Некоторых пациентов, которых ранее расценивали как имеющих полное повреждение, были переклассифицированы как имеющие уровень неполного повреждения (Segal et al., 1999). У всех пациентов наблюдалось в некоторой степени улучшение в отношении, по крайней мере, некоторого типа неврологической или легочной функции через 3 месяца ежедневного перорального лечения 4-АР (30 мг в день или приблизительно 0,5 мг/кг). Более низкая доза была неактивной. Как было сказано выше, 4-АР блокирует калиевые каналы, эффективно пролонгируя потенциал действия. К сожалению, указанный механизм, посредством которого блокаторы калиевых каналов могут улучшать симптомы, связанные с заболеваниями и состояниями, которые нарушают передачу потенциала действия, может также вызывать эпилептоидную активность. В самом деле, 4-АР представляет собой-1 011319 признанный агент, вызывающий судороги у животных и человека. Следовательно, пригодность 4-АР в качестве терапевтического агента при MS, TBI и SCI ограничена его способностью вызывать судороги и другими нежелательными побочными эффектами. Сообщается о возбужденном состоянии, спутанности сознания и генерализованных тонико-клонических припадках при применении доз выше 0,8 мг/кг (Ball etal., 1979; Bever et al., 1994). Van Diemen et al. (1993) сообщают, что степень улучшения у пациентов с MS(определяемая как увеличение расстояния ходьбы по ровной поверхности) достоверно связана с уровнем 4-АР в сыворотке крови (33-75 нг/мл необходимо для существенного улучшения после перорального введения). Однако при тех же дозах наблюдались побочные эффекты (парестезия/дизестезия, головокружение/ощущение пустоты в голове и даже шаткая походка). В результате другого исследования на людяхBever et al. (1994) сообщают о сильном эпилептическом припадке при уровне в сыворотке крови 104 нг/мл. Обе группы исследователей предполагают, что более высокие дозы и уровни в сыворотке крови должны, вероятно, вызывать большее улучшение у тех пациентов с MS, которые реагировали на более низкие дозы 4-АР. Таким образом, степень эффективности 4-АР ограничивается дозой и побочными эффектами. Проблемы, связанные с побочными эффектами из-за более высоких уровней 4-АР в сыворотке крови, привели к разработке композиций с замедленным высвобождением (фампридин-SR) (Masterson J.G.and Myers M., 1994; 1996 а; 1996b). Фампридин-SR в настоящее время проходит 2 фазу клинических испытаний на больных с MS. В первичных клинических испытаниях фампридина-SR у пациентов наблюдалось улучшение различных функций. В зависимости от индивидуума, указанные улучшения включали улучшение функций мочевого пузыря, кишечника и половой функции, возрастание легкости в движениях и ощущениях и уменьшение спазмов мышц, утомляемости и хронической боли. Другой подход к устранению нежелательных побочных эффектов, связанных с 4-АР, заключается в совместном введении 4-АР и блокаторов потенциалочувствительных натриевых каналов. Блокаторы натриевых (Na+) каналов блокируют входящий поток ионов Na+ и снижают чувствительность нейрона к деполяризации. Это эффективно снижает возбудимость нейронов. В самом деле, имеются сообщения о том, что совместное введение блокаторов потенциалочувствительных натриевых каналов и 4-АР предотвращает индуцированные 4-АР судороги у мышей (Yamaguchi and Rogawski, 1992). 4-АР не обладает способностью блокировать натриевые каналы. Соединения, применяемые в способах, заявленных в настоящем изобретении, можно синтезировать с помощью методик, описанных в патенте США 4970218. Все патенты и другие публикации, приведенные в настоящем документе, включены сюда в качестве ссылок. Известно, что определенные соединения в объеме настоящего изобретения могут индуцировать потенциалочувствительную блокаду натриевых каналов in vitro и in vivo (Tang et al., 1995; 1998; Tang andKongsamut, 1996). Блокаторы потенциалочувствительных натриевых каналов действуют более эффективно в условиях клеточной деполяризации. Указанные соединения оказывают незначительное действие или не оказывают его на нормальный процесс прохождение сигналов в нейронах, но позволяют блокировать натриевые каналы во время припадков, травмы головы или ишемии. Многие из данных агентов оказывают церебропротективное действие на животных моделях указанных патологических состояний(Madge et al., 1998). Без ограничения рамками теории, блокаторы калиевых каналов представляют собой также агенты,которые имеют право на существование, для лечения невропатической боли и боли, связанной с цитокинами, включая боль при артритах. Sweitzer et al. (1999) предположили, что активация микроглии и высвобождение цитокинов могут играть роль в гипералгезии после периферического воспаления или повреждения периферических нервов. Блокаторы калиевых каналов, такие как 4-АР, как сообщают, блокируют активацию микроглии у крыс, мышей и человека (Eder, 1998). Руо et al. (1997) сообщают, что 4-АР может уменьшить высвобождение нитрита из активированной микроглии, что указывает на возможность контроля над болью посредством данного механизма. Кроме того, 4-АР, как сообщают, уменьшает индуцированное липополисахаридами (LPS) продуцирование NO в мышиных макрофагах (Lowry et al., 1998). Введение LPS мышам используют также в качестве модельной системы для выявления противоартритной эффективности нескольких различных агентов с различными механизмами действия (Mcllay et al.,2001). Было разработано несколько экспериментальных моделей, которые включают сдавливание седалищного нерва или спинно-мозгового нерва L5 или L6, для того, чтобы изучить невропатическую боль(Bennet and Xie, 1988; Seltzer et al., 1990; Kim and Chung, 1992). Краткое описание изобретения В настоящее время установлено, что соединения формулы I обладают свойством блокировать калиевые каналы. Уникальная комбинация блокирующих свойств как по отношению к калиевым, так и по отношению к натриевым каналам, означает, что указанные соединения являются полезными в качестве терапевтических агентов для лечения демиелинизирующих заболеваний или состояний. Например, они являются полезными для лечения MS, SCI, TBI (травматического повреждения головного мозга) и удара. Указанные соединения представляют собой более безопасные терапевтические агенты, чем 4-АР, поскольку 4-АР блокирует только калиевые каналы, что может приводить к нежелательным побочным эф-2 011319 фектам, таким как возбужденное состояние, спутанность сознания и припадки. Подробное описание изобретения Соединения формулы I обладают уникальной комбинацией блокирующих свойств как в отношении калиевых, так и натриевых каналов. Указанные соединения являются полезными для лечения демиелинизирующих заболеваний и состояний, таких как рассеянный склероз, повреждение спинного мозга,травматическое повреждение головного мозга и удар.p равно 0 или 1; каждый R независимо представляет собой водород, галоген, трифторметил, C1-С 6 алкил, C1 С 6 алкокси, бензилокси, гидроксил, нитрогруппу или аминогруппу; каждый R1 независимо представляет собой водород, C1-C6 алкил, C1-C6 алкенил, C1-C6 алканоил, галоген, цианогруппу, -C(O)C1-C6 алкил, -C1-C6 алкиленCN, -C1-C6 алкиленNR'R, где R' и R, каждый независимо, представляют собой водород или C1-C6 алкил, -C1-C6 алкиленOC(О)C1-C6 алкил или -CH(OH)R4,где R4 представляет собой водород или C1-C6 алкил;R2 представляет собой водород, C1-C6 алкил, необязательно замещенный галогеном, гидрокси или бензилокси, C1-C6 алкенил, C1-C6 алкинил, -CO2C1-C6 алкил или -R5-NR'R, где R5 представляет собой C1C6 алкилен, C1-C6 алкенилен или C1-C6 алкинилен, a R' и R, каждый независимо, представляют собой водород, C1-C6 алкил или, альтернативно, группа -NR'R как целое представляет собой 1-пирролидинил; иC1-C6 алкил. Определения. 1) Демиелинизирующие заболевания. В настоящем описании демиелинизирующие заболевания определяются как такие заболевания, при которых миелин является основной мишенью. Они подразделяются на две главные группы: приобретенные заболевания и наследственные метаболические нарушения. Рассеянный склероз подпадает под категорию приобретенного заболевания. Рассеянный склероз обычно проявляется между 20-м и 50-м годами жизни. MS поражает белое вещество центральной нервной системы. В своем классическом проявлении (90% всех случаев) он характеризуется перемежающимися рецидивирующими/ремиттирующими фазами - с периодами ремиссии, которые со временем становятся короче. Его симптомы включают любую комбинацию спастического парапареза, шаткой походки,диплопии и недержания мочи. Категория наследственных метаболических нарушений включает восемь идентифицированных лейкодистрофий: метахроматическую лейкодистрофию, болезнь Рефсума, адренолейкодистрофию, болезнь Краббе, фенилкетонурию, болезнь Канавана, болезнь Пелицеуса-Мерцбахера и болезнь Александера. Первые шесть представляют собой нарушения накопления. Отсутствие или нарушение функции фермента вызывает токсическое образование химических веществ. С другой стороны, этиология болезни Пелицеуса-Мерцбахера и болезни Александера остается неизвестной. Клиническое течение наследственных демиелинизирующих нарушений, которые обычно имеют тенденцию проявляться в младенческом или раннем детском возрасте, трагично. Ранее здоровые дети теряют, при быстром прогрессировании, зрение, слух, речь и способность двигаться. Прогноз - смерть в течение нескольких лет. 2) Демиелинизирующие состояния. В настоящем описании демиелинизирующее состояние определяется как состояние, которое приводит к дефициту миелинизации. Подобные демиелинизирующие состояния включают, без ограничения,повреждение спинного мозга, травматическое повреждение головного мозга и удар. 3) Повреждение спинного мозга (SCI). В настоящем описании SCI определяется как повреждение спинного мозга, которое приводит к потере функций, таких как движение или чувствительность. 4) Травматическое повреждение головного мозга (TBI). В настоящем описании травматическое повреждение головного мозга определяется как повреждение, которое приводит к разрушению головного мозга. Травма головы может существовать в одной из двух форм.-3 011319 Закрытая травма головы наблюдается, когда движущаяся голова быстро останавливается, как это бывает при ударе о лобовое стекло автомобиля или при ударе тупым предметом, что приводит к тому,что головной мозг ударяется о твердую костную поверхность внутри черепа. Закрытая травма головы может также наблюдаться в отсутствие непосредственной внешней травмы головы, если головной мозг подвергается быстрому движению вперед или назад, как это бывает при хлыстовой травме. Проникающая травма головы наблюдается, когда быстро движущийся предмет, такой как пуля,пронизывает череп. Как закрытые, так и проникающие травмы головы могут вызывать локализованное и распространенное или диффузное повреждение головного мозга. Полученные инвалидизирующие проявления могут включать потерю памяти и эмоциональное беспокойство, двигательные затруднения, включая паралич, и нарушения пяти чувств. Кроме того, многие пациенты от полученных травм умирают. В настоящее время лечение фокусируется на сдерживании распространения повреждения насколько это возможно, в течение первых 24 ч после получения травмы. При повреждении головного мозга последующие повреждения распространяются за пределы первичного повреждения. В результате наблюдается каскад вторичного повреждения. Собственные иммунные клетки головного мозга запускают набухание и накопление жидкости, а поврежденные нервные клетки начинают высвобождать нейромедиатор,называемый глутаматом, который может вскоре накопиться до уровней, которые являются токсичными для окружающих нейронов. 5) Удар. Как определяется в настоящем изобретении, удар имеет место, когда кровяные сгустки блокируют кровеносный сосуд или артерию, или когда кровеносный сосуд разрывается, прекращая приток крови к области мозга. Когда удар имеет место, это приводит к гибели клеток головного мозга на прилегающем участке. Врачи называют указанный участок мертвых клеток инфарктом. Указанные клетки обычно погибают в течение периода времени от нескольких минут до нескольких часов после начала удара. При ударе показатели демиелинизации, такие как соотношение магнитного переноса (MTR), тесно связаны с повреждением аксонов, которое коррелирует с моторным дефицитом (Pendlebury et al., 2000). 6) Алкил или алкилен. Если не утверждается или не указано иное, термин алкил или алкилен означает алкильную или алкиленовую группу с разветвленной или прямой цепью, подходящую для данной формулы, которая описывается количеством атомов углерода в алкиле, например, C1-C6 алкил означает один, два, три, четыре, пять или шесть атомов углерода алкила или алкилена с разветвленной или прямой цепью, как это может быть в случае, или любых его пределах, без ограничения, например, C1-2, C1-3, С 1-4, С 1-5, С 2-3,С 2-4, С 2-5, С 2-6, С 3-4, С 3-5, С 3-6, С 4-5, С 4-6, С 5-6 и т.п. 7) C1-C6 алкокси. Если не утверждается или не указано иное, термин C1-C6 алкокси обозначает алкоксигруппу с прямой или разветвленной цепью, имеющей от 1 до 6 атомов углерода. Примеры указанной группы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, т-бутокси и пентокси и гексокси с прямой и разветвленной цепью. 8) Галоген. Если не утверждается или не указано иное, термин галоген означает фтор, хлор, бром или иод. 9) C1-C6 алкановая кислота. Если не утверждается или не указано иное, термин C1-C6 алкановая кислота будет означать карбоновую кислоту, в которой карбоксильная группа соединена с водородом или алкильной группой из 1-5 атомов углерода. 10) C1-C6 алканоил. Термин C1-C6 алканоил означает группу, полученную удалением гидроксильной группы от карбоксильной группы C1-C6 алкановой кислоты, и, таким образом, он включает, например, формил, ацетил и подобные. Термины алканоил, алкеноил и алкиноил будут означать группы, полученные удалением гидроксильной группы от карбоксильной группы алкановой кислоты, алкеновой кислоты и алкиновой кислоты соответственно. Так, например, линолеильная группа, полученная из линолевой кислоты, представляет собой пример термина алкеноил, как определено выше. 11) Фармацевтически приемлемые соли означает как кислотно-аддитивную соль, так и основноаддитивную соль, которая является совместимой с лечением пациентов для предназначенного применения. 12) Фармацевтически приемлемая кислотно-аддитивная соль представляет собой любую нетоксичную органическую или неорганическую кислотно-аддитивную соль основных соединений, представленных формулой I, или любого из ее промежуточных соединений. Примеры неорганических кислот,которые образуют подходящие соли, включаютхлористо-водородную, бромисто-водородную, серную и фосфорную кислоты и кислые соли металлов, такие как моногидроортофосфат натрия и гидросульфат калия. Примеры органических кислот, которые образуют подходящие соли, включают моно-, ди- и трикарбоновые кислоты. Примерами указанных кислот являются, например, уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскор-4 011319 биновая, малеиновая, гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная, коричная,салициловая, 2-феноксибензойная, п-толуолсульфоновая кислота и суфоновые кислоты, такие как метансульфоновая кислота и 2-гидроксиэтансульфоновая кислота. Могут образовываться как моно-, так и дикислые соли, и указанные соли могут существовать в гидратированной, сольватированной или практически безводной форме. Обычно, кислотно-аддитивные соли указанных соединений являются в большей степени растворимыми в воде и различных гидрофильных органических растворителях, и, по сравнению со своими свободноосновными формами, обычно имеют более высокие температуры плавления. 13) Фармацевтически приемлемые основно-аддитивные соли означает нетоксичные органические или неорганические основно-аддитивные соли соединений формулы I или любого из ее промежуточных соединений. Примерами являются гидроксиды щелочных металлов или щелочно-земельных металлов,такие как гидроксиды натрия, калия, кальция, магния или бария; аммиак, а алифатические, алициклические или ароматические органические амины, такие как метиламин, триэтиламин и пиколин. Критерии отбора подходящих солей должны быть известны специалисту в данной области. 14) Стереоизомеры представляет собой общий термин для всех изомеров индивидуальных молекул, которые отличаются друг от друга только ориентацией атомов в пространстве. Он включает изомеры зеркального отражения (энантиомеры), геометрические (цис/транс) изомеры и изомеры соединений,имеющих более одного хирального центра, которые не являются зеркальными отражениями друг друга(диастереоизомеры). 15) Пациент означает теплокровное животное, такое как, например, крыса, мыши, собаки, кошки,морские свинки и приматы, такие как человек. 16) Лечить или лечение означает облегчение симптомов, устранение причины симптомов как на временной, так и на постоянной основе, или предотвращение или замедление появления симптомов названного расстройства или состояния. 17) Терапевтически эффективное количество означает количество соединения, которое является эффективным для лечения названного расстройства, заболевания или состояния. 18) Фармацевтически приемлемый носитель представляет собой нетоксичный растворитель, диспергирующий агент, наполнитель, адъювант или другой материал, которые смешивают с активным ингредиентом с целью формирования фармацевтической композиции, т.е. лекарственной формы, которую можно вводить пациенту. Один пример указанного носителя представляет собой фармацевтически приемлемое масло, которое обычно используют для парентерального введения. Соединения формулы I могут эффективно улучшать скорость и степень восстановления при остром повреждении спинного мозга и долговременном повреждении спинного мозга. Они обладают свойствами, которые состоят в блокаде натриевых каналов, зависимых от использования, и с блокадой потенциалочувствительных калиевых каналов in vivo. Они являются более безопасными терапевтическим агентами, чем 4-АР. Особенно предпочтительными являются соединения, в которых R представляет собой водород, галоген, трифторметил или C1-C6 алкил; R1 представляет собой водород или C1-C6 алкил; R2 представляет собой водород или C1-C6 алкил; R3 представляет собой водород, C1-C6 алкил или галоген; и p равно 0. Другими предпочтительными соединениями являются те соединения, в которых аминогруппа присоединена в 4 положении пиридиновой группы. Еще более предпочтительными соединениями являются соединения формул II [также называемые в настоящем описании НР 184 или N-(3-фтор-4-пиридинил)-N-пропил-3-метил-1 Н-индол-1-амин] и III НР 184 очень хорошо переносится в микромолярных концентрациях в головном мозге через 1 ч после в/б введения 30 мг/кг НР 184 крысам (Smith et al., 1996). Уникальная комбинация блокады натриевых каналов, зависимых от использования, и блокады по-5 011319 тенциалочувствительных калиевых каналов также отличает соединения по настоящему изобретению от чистых блокаторов натриевых каналов, таких как карбамазепин и фенитоин. Данные агенты успешно применялись для облегчения положительных симптомов MS (болезненного тонического припадка и дизестезии). Однако они ухудшали отрицательные симптомы (паралич и гипестезию) (Sakurai and Kanazawa, 1999). Соединения по настоящему изобретению усиливают нейрональную функцию, благодаря тому факту, что они блокируют калиевые каналы. Это способствует функциональному восстановлению. В настоящее время полагают, что блокаторы натриевых каналов являются полезными для лечения болезненных симптомов и/или в качестве нейропротективных агентов. От них, однако, не ожидают усиления достижений в области реабилитации. При лечении пациента, страдающего состоянием или расстройством, описанным выше, соединение формулы I можно вводить в любой форме или любым способом, которые делают соединение биодоступным в терапевтически эффективных количествах, включая пероральный, сублингвальный, трансбуккальный, подкожный, внутримышечный, внутривенный, чрескожный, интраназальный, ректальный, местный способы и подобные. Специалист в области изготовления композиций может определить подходящую форму и способ введения, в зависимости от конкретных свойств соединения, выбранного для состояния или заболевания, которое следует лечить, стадии заболевания, состояния пациента и других относящихся к делу обстоятельств. Например, см. Remington's Pharmaceutical Sciences, 18-e издание, Mack PublishingCo. (1990), которая включена сюда в качестве ссылки. Соединения формулы I можно вводить в чистом виде или в форме фармацевтической композиции в комбинации с фармацевтически приемлемыми носителями, соотношение и природа которых определяются растворимостью и химическими свойствами выбранного соединения, выбранным путем введения,стандартной фармацевтической практикой и другими относящимися к делу критериями. Соединения по настоящему изобретению можно вводить перорально, например, в форме таблеток,пастилок, капсул, эликсиров, суспензий, растворов, сиропов, облаток, жевательных резинок и подобных,и они могут содержать один или более следующих вспомогательных агентов: связывающие агенты, такие как микрокристаллическая целлюлоза, камедь трагакант или желатин; наполнители, такие как крахмал или лактоза; разрыхлители, такие как альгиновая кислота, Primogel, кукурузный крахмал и подобные; смазывающие агенты, такие как стеарат магния или Sterotex; агенты, обеспечивающие скольжение,такие как коллоидный диоксид кремния, и можно добавлять подсластители, такие как сахароза или сахарин, или корригент, такой как мята перечная, метилсалицилат или апельсиновый корригент. В случае,когда лекарственная форма представляет собой капсулу, она может содержать, помимо материалов указанного выше типа, жидкий носитель, такой как полиэтиленгликоль или жирное масло. Другие дозированные лекарственные формы могут содержать другие материалы, которые изменяют физическую форму лекарственной формы, например, покрытия. Так, таблетки или пилюли можно покрывать сахаром, шеллаком или другими энтеросолюбильными покрывающими агентами. Сироп может содержать, помимо соединений по настоящему изобретению, сахарозу в качестве подсластителя и определенные консерванты, красители и корригенты. Соединения формулы I по настоящему изобретению можно также применять местно, и в этом случае носитель может включать раствор, мазь или гелевую основу. Основа, например, может включать одно или более из следующих веществ: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. Растворы или суспензии могут также включать одно или более из следующих вспомогательных веществ: стерильные разбавители, такие как вода для инъекций, физиологический раствор, жирные масла,полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для корректировки тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения можно помещать в ампулы, одноразовые шприцы или флаконы, содержащие множество доз. Высоколипофильные сложные эфиры, амиды и карбаматы по настоящему изобретению способны к замедленному высвобождению в организме млекопитающих в течение периода времени в несколько дней или приблизительно от одной до четырех недель, если они изготовлены и введены в форме препаратов-депо, как, например, при инъекции в должным образом выбранном фармацевтически приемлемом масле. Предпочтительными маслами являются масла растительного происхождения, такие как кунжутное масло, хлопковое масло, кукурузное масло, кокосовое масло, соевое масло, оливковое масло и подобные, или они представляют собой синтетические эфиры жирных кислот и многоатомных спиртов,таких как глицерин или пропиленгликоль. Композиции-депо по настоящему изобретению изготавливают растворением высоколипофильного сложного эфира, амида или карбамата по настоящему изобретению в фармацевтически приемлемом масле в стерильных условиях. Масло выбирают таким образом, чтобы получить высвобождение активного ингредиента в течение желательного периода времени. Подходящее масло специалист может легко определить по уже известным данным или без излишнего экспериментирования.-6 011319 Предел доз, в котором соединения формулы I обладают способностью действовать терапевтически,может варьироваться в зависимости от конкретного заболевания или состояния, которое подвергается лечению, и его тяжести, пациента, композиции, других болезненных состояний, от которых страдает пациент, и других лекарственных средств, которые могут одновременно вводиться пациенту. В общем случае соединения формулы I будут обладать терапевтической активностью в дозах приблизительно от 0,001 до 100 мг/кг массы тела пациента в день. Следующие примеры служат иллюстративным целям и не предназначены каким бы то ни было образом для ограничения объема изобретения. Пример 1. Данные in vivo, которые подтверждают блокаду потенциалочувствительных натриевых каналов. Методы. Экспериментальная методика основана на методе Bachau et al. (1992). Самцам мыши CD1 весом 35-40 г давали наркоз хлоральгидратом (400 мг/кг). Под хирургическим микроскопом производили 3 мм вертикальный разрез кожи на 2 мм позади правой глазной впадины. Смещали височную мышцу и осуществляли малую трепанацию черепа для обнажения твердой мозговой оболочки. Твердую мозговую оболочку рассекали и смещали и обнажали дистальную часть правой средней сонной артерии. Артерию закупоривали кверху по ходу кровотока по отношению к главной бифуркации с помощью биполярной электрокоагуляции с использованием атравматического пинцета. Объем инфаркта определяли спустя 24 ч с помощью 2% раствора хлорида трифенилтетразолия. В данной экспериментальной парадигме мышам (по 10 в группе) без периода голодания перорально вводили HP 184 за один час до закупорки артерии. Уменьшение объема инфаркта у леченых мышей оценивали в сравнении с 1% уксусной кислотой, носителем. Результаты представлены в табл. 1. Таблица 1 Неврологическая активность HP 184 на экспериментальной модели удара у мышей рМСАО=р 0,05; =р 0,01 Неврологическая защита, которая наблюдалась на модели постоянной окклюзии сонной артерии у мышей (рМСАО), согласуется с in vivo блокадой потенциалочувствительных натриевых каналов при данной дозе и времени. Пример 2. Влияние HP 184 на отек после фототромботического церебрального повреждения у крыс. Обоснование/Цель. Тромбоэмболический удар представляет собой третью по частоте причину смерти в странах Запада. Его вызывает кровяной сгусток или разрушающийся тромб, как образовавшийся внутри церебрального кровотока, так и образовавшийся в сердце или крупных сосудах и перенесенный в церебральный кровоток. Кровоток затем прерывается и развивается ишемическое повреждение с отеком, некрозом и апоптозом ткани. Отек представляет собой повреждающий фактор, поскольку он сдавливает головной мозг, способствуя ишемии, а также лизису клеток и механическому повреждению. Лечение с использованием HP 184 блокатора одновременно Na+ и K+ каналов изучали для оценки его влияния на указанный церебральный отек. Метод. Самцам крысы Sprague Dawley (вес 180-200 г) давали наркоз хлоральгидратом (400 мг/кг в/б) и помещали в стереотаксический аппарат. Вскрывали кожу для обнажения черепа и приводили холодный свет (Bioblock 150 W) в контакт с правой стороной черепа по направлению вперед от ламбды. Внутривенно вводили краситель бенгальский розовый (10 мг/кг в/в в физиологическом растворе) и немедленно начинали освещение черепа, которое продолжали в течение 5 мин. На кожу затем накладывали швы, закрывая череп, и животное возвращали в клетку. Через 24 ч после нанесения фототромботического повреждения животные получали HP 184 в 1% растворе Tween в воде внутривенным путем, в дозе 0,10 или 20 мг/кг массы тела, в объеме 5 мл/кг. Через час животных умерщвляли путем обезглавливания и удаляли головной мозг (см. приложение к протоколу). С места повреждения и с участка, противоположного повреждению, отбирали сердцевинные образцы с помощью полого бора диаметром 6 мм. Содержание воды определяли по соотношению масса сырой ткани/масса сухой ткани, и отек выражали в % избытка воды в поврежденном образце по сравнению с контрольным образцом, взятым из противоположного повреждению полушария, для каждой крысы. Результаты представлены в табл. 2. Таблица 2HP 184 продемонстрировал значительное (22%) уменьшение отека в правой части коры головного мозга через 1 ч после в/в введения в дозе 20 мг/кг и через 25 ч после фототромботического повреждения. Пример 3. Влияние HP 184 на размеры повреждения и неврологическую функцию после преходящей очаговой ишемии головного мозга у крыс. Обоснование/Цель. В данном исследовании HP 184 вводили через 1 ч после начала ишемии крысам с моделью преходящей очаговой ишемии головного мозга. Измеряемыми параметрами были размеры повреждения и неврологическая функция. Методы. Самцам крысы Sprague Dawley [Iffa Credo, Франция] весом около 220-240 г давали наркоз галотаном (1,4%) в смеси закись азота-кислород (70:30). Выделяли обе общие сонные артерии (ССА). Левую среднюю церебральную артерию (МСА), обнаженную посредством височной трепанации черепа,зажимали микрозажимом и одновременно перекрывали ССА на 1 ч. Температуру тела и головного мозга поддерживали в пределах нормы. После оперативного вмешательства животных возвращали в их клетки в помещение с температурой 24-26 С.HP 184, растворенный в 1% растворе Tween (в стерильной воде для инъекций), вводили в дозе 10 и 20 мг/кг в/в через 1 ч после начала ишемии, а контрольные крысы получали носитель, согласно указанному протоколу. Через 24 ч после ишемии слепым способом изучали неврологическую функцию, используя 9-балльную шкалу. Балльная шкала для определения неврологической функции После этого крыс умерщвляли и удаляли головной мозг. Свежие срезы получали с помощью матрицы для головного мозга и окрашивали 2% хлоридом трифенилтетразолия при 37 С в течение 5 мин. Срезы затем хранили в 10% формалине при 4 С в течение 24 ч. Площадь инфаркта измеряли с помощью анализатора изображения (Leica Q500). Результаты. Ишемия индуцировала развитие церебральных повреждений как в коре, так и в полосатом теле головного мозга (см. фиг. 1, которая иллюстрирует влияние HP 184 на повреждение головного мозга в дозе 10 и 20 мг/кг в/в болюсно, через 1 ч после окклюзии MCA). HP 184 в дозе 10 мг/кг в/в значительно уменьшал повреждения головного мозга на 41% (р 0,05). Указанное уменьшение было значительным в коре головного мозга (-45%, p0,05). Пример 4. Измерение блокады калиевых каналов. Методы. Клетки РС 12 (АТСС, Rockville, MD) выращивали на модифицированной по способу Игла среде Дульбекко с добавлением 10% фетальной бычьей сыворотки (GIBCO BRL Grand Island, NY). Ток в калиевых каналах измеряли с использованием стандартных электрофизиологических протоколов фиксации потенциала, как описано ранее (Rampe et al., 1998). Результаты и обсуждение. Ток в калиевых каналах возбуждали с помощью 200 мс кламп-импульсов до +40 мВ от потенциала удерживания -80 мВ. В результате указанной схемы получали поддерживаемый направленный вовне ток. Применение HP 184 (10 мкМ) уменьшало амплитуду указанного тока и увеличивало скорость его исчезновения. В случае, когда ток измеряли в конце импульса, HP 184 уменьшал амплитуду тока на 754% (n=4). Данные результаты согласуются с мнением, что HP 184 действует как антагонист потенциалочувствительных K+ каналов путем блокирования активированного состояния. Пример 5. In vivo данные, подтверждающие усиление мышечной функции. Обоснование. Неорганический краситель рутениевый красный (RuR), как сообщается, блокирует потенциалочувствительный ток Са+2 в клетках различных типов, включая чувствительные нейроны мыши (Duchen, 1992), синаптосомах и нейромышечных препаратах (Hamilton and Lundy, 1995; Tapia andVelasco, 1997). Кроме того, RuR блокирует высвобождение нейромедиаторов в синаптосомах головного-8 011319 мозга (Meza-Ruiz and Tapia, 1978; Tapia and Meza-Ruiz, 1977) и нейромышечном синапсе (Alnaes and Rahamimoff, 1975; Person and Kuhn, 1979). In vivo внутрибрюшинное (в/б) введение RuR вызывает периферический паралич у мышей (Tapia et al., 1976), и данному эффекту противодействует 4-аминопиридин (4 АР), блокатор потенциалочувствительных K+ каналов (Tapia, 1982). Tapia и Velasco (1997) проанализировали эффекты RuR in vivo и in vitro и предположили, что RuR взаимодействует с сайтами Са+2, расположенными на мембране нервного окончания. Исследования связывания показали, что RuR селективно блокирует Са+2 каналы N-типа, и указанные каналы регулируют приток Са+2, необходимый для высвобождения нейромедиатора. Указанные авторы также предположили, что в/б введение RuR может представлять собой экспериментальную модель синдрома миастении гравис Итона-Ламберта, аутоиммунного заболевания, которое характеризуется блокадой входа Са+2 и высвобождения Ach, благодаря антителам,которые связываются с Са+2 каналами N-типа. Имеется сообщение, которое согласуется с указанной возможностью, о том, что 4-АР улучшает мышечную слабость и восстанавливает нейромышечную передачу у пациентов (Lundh et al., 1977a; 1977b; 1979; McEvoy et al., 1989; Aisen et al., 1995). Способность 4-аминопиридина (4-АР) и гуанидина противодействовать индуцированному RuR периферическому параличу проявляется, возможно, благодаря их способности облегчать высвобождение нейромедиаторов (Lundh, 1978; Lundh and Thesleff, 1977; Tapia and Stiges, 1982). В любом случае, Tapia и соавторы (Tapia and Stiges, 1982) сообщили, что RuR блокирует высвобождение, индуцированное 4-АР, в синаптосомах.In vitro HP 184 усиливает высвобождение нейромедиаторов с помощью механизма, который отличается от механизма действия 4-АР. В высоких концентрациях 4-АР усиливает как стимулированное электричеством, так и спонтанное высвобождение, но указанные эффекты являются зависимыми от кальция. Напротив, HP 184 усиливает только не зависящее от кальция спонтанное высвобождение нейромедиаторов (Smith et al., 1993). Было высказано также предположение о том, что спонтанное высвобождение играет функциональную роль in vivo (Smith et al., 1996). Целью следующего эксперимента было определение, могут ли HP 184 и 4-АР противодействовать парализующему эффекту RuR после одновременной инъекции. Метод и результаты. Группам по 4-5 мышей (CD-1; Charles River; 25-35 г) по отдельности, но одновременно инъецировали в/б рутениевый красный и носитель (1% ледяную уксусную кислоту), рутениевый красный и 4-АР или рутениевый красный и HP 184. В данном эксперименте испытывали также соединение, известное как 8183. Начиная спустя 15 мин после инъекций, мышей помещали около аппарата флагшток и отмечали их способность поддерживать вес собственного тела (т.е. держаться за флагшток и не падать). Результаты фиксировали как количество мышей, которые могли поддерживать вес собственного тела, по сравнению с общим количеством мышей в испытании. Данные результаты представлены в табл. 3. Все эксперименты выполняли в период времени между 14 ч и 16 ч 30 мин. Таблица 3 Заключение. Как 4-АР (в/б), так и HP 184 (в/б) могут противодействовать периферическому параличу, индуцированному в/б введением RuR. Это означает, что HP 184 способен усиливать нейрональную передачу in vivo, возможно, посредством блокады K+ каналов. Возможно также, как в случае 4-АР, чтоHP 184 усиливает нейрональную передачу, поскольку эксперименты со срезами головного мозга in vitro подтвердили повышенное высвобождение нейромедиаторов в головном мозге (Smith et al., 1993; 1996). Дозы блокаторов натриевых каналов дифенилгидантоина (DPH) и рилузола (RIL), изученные в данном эксперименте, ранее были показаны как нейропротективные на моделях очаговой ишемии (Rataud etal., 1994; O'Neill et al., 1997). Отсутствие их эффекта на описанной модели подтверждает интерпретацию,что способность HP 184 противодействовать периферическому параличу, индуцированному RuR, воз-9 011319 можно, не обусловлена блокадой натриевых каналов in vivo. Это также подтверждают клинические данные. Отрицательные симптомы MS (утрата движения) часто ухудшаются блокаторами натриевых каналов (Sakurai and Kanazawa, 1999). Пример 6. Модели заболеваний, повреждающих спинной мозг. Обоснование и цель. Gruner и Yee (1999) показали, что через 25 дней после повреждения спинного мозга, 4-АР усиливает mMEP после повреждения спинного мозга различной степени у крыс. Функциональные поведенческие изменения измеряли с помощью идентичных процедур. Указанные проявления,как было показано, коррелировали с минимальным mMEP. Цель данных экспериментов была двоякой: 1) определить, может ли HP 184 ослабить моторные нарушения умеренной интенсивности, индуцированные повреждением спинного мозга, при немедленном введении, и сравнить его эффективность с эффективностью метилпреднизолона сукцината (MPSS), и 2) определить, может ли HP 184 улучшать моторную функцию у крыс с долговременным (25 дней) повреждением спинного мозга малой интенсивности, и сравнить его эффективность с эффективностью 4 аминопиридина (4-АР). Немедленное лечение - в/б введение. Спинной мозг самок крыс подвергали ламинэктомии (контроль, n-12) или сдавливали до диаметра 1,4 мм (5 групп, n=12 в каждой). Нормальный диаметр спинного мозга составляет приблизительно 2,5 мм. Данная компрессия представляет собой умеренное повреждение, которое характеризуется первоначальными баллами по ходьбе на открытом пространстве 1,5-2,5 по шкале ходьбы на открытом пространстве. Определения шкалы ходьбы на открытом пространстве (OFT) следующие: 0,0 - Отсутствие спонтанного движения 0,7 - Слабые движения 1,0 - Движение в бедренном и/или в коленном суставе (не в голеностопном суставе) 1,3 - Активное движение в бедренном и в коленном суставе, не в голеностопном суставе 1,7 - Сомнительное движение в голеностопном суставе 2,0 - Движение конечности во всех трех больших суставах 2,3 - Попытки опоры 2,7 - Опора только в отдельных случаях 3,0 - Активная опора, некоординированная походка 3,3 - Перемежающиеся эпизоды координированной походки 3,7 - Отсутствие контроля голеностопного сустава и стопы, ходит на суставах пальцев или на медиальной поверхности стопы 4,0 - Координация передних конечностей и задних конечностей при ходьбе 4,3 - Улучшенная постуральная опора на задние конечности, живот не низко над землей 4,7 - Один или два пальца стопы волочатся, легкая неустойчивость при повороте на полной скорости 5,0 - Нормальная походка и основа опоры, нет потери равновесия при быстрых поворотах, нет волочения пальцев стопы Медикаментозное лечение. Через 15 мин после повреждения (день 1) крысы в группах HP 184 получали данный агент в виде в/б инъекции 20, 10, 5 или 0 мг/кг в носителе - 1% ледяной уксусной кислоте. Введение повторяли на день 2 и 3. С другой стороны, MPSS вводили в дозе 30 мг/кг в/б через 15 мин, 2 ч, 4 ч и 6 ч после повреждения в день 1. Данная схема введения MPSS была описана как оптимальная в литературе, и параллельная схема введения была использована для человека. В настоящее время MPSS представляет собой единственный разрешенный вид медикаментозного лечения для людей с повреждением спинного мозга. Фиг. 2 показывает поведенческие баллы (OFT) в различных группах лечения с течением времени. Нормальный балл до оперативного вмешательства составляет 5. Скорость и степень улучшения существенно отличались от тех же показателей у крыс, получавших носитель, в группах, получавших дозу как 20, так и 5 мг/кг. Каждая величина представляет собой среднее плюс СКО среднего для 8-12 крыс. Немедленное лечение - введение п/о. Спинной мозг самок крыс подвергали ламинэктомии или сдавливали до диаметра 1,4 мм. В группахHP 184 крысам перорально вводили лекарственное средство за 5-10 мин до повреждения, а затем - один раз в день на день 2 и 3. MPSS давали, как описано ранее. Поведенческие баллы (OFT) показаны на фиг. 3. Нормальный балл до оперативного вмешательства составляет 5. Скорость и степень улучшения улучшались при всех дозах, включая группу, получавшую 10 мг/кг,по сравнению с группой, получавшей носитель. Каждая величина представляет собой среднее плюс СКО среднего для 12 крыс. Эксперимент с хроническим повреждением. Спинной мозг самок крыс подвергали ламинэктомии или сдавливали до диаметра 1,6 мм. Это представляло собой незначительное повреждение, и было предпринято для получения баллов OFT 4,0 через 25 дней, в течение которых лечение не проводилось. Данная схема была избрана в попытке воспроизве- 10011319 сти ту же степень моторных нарушений, которая описана у Gruner и Yee (1999), которые показали улучшения, вызванные 4-АР, величин миниатюрного потенциала концевой пластинки задней конечности. Данная процедура, а также продолжительность повреждения, в течение которого лечение не проводилось, также, как было показано, приводит к демиелинизации. Поведенческие баллы (OFT) представлены на фиг. 4. Фиг. 4 показывает средние величины и стандартные ошибки в группах, с использованием определений для шкалы ходьбы на открытом пространстве, описанной выше в настоящем описании. В данном эксперименте баллы OFT были немного выше (4,3-4,5), что оставляло лишь маленькое окно для улучшения. Используя каждую крысу в качестве ее собственного контроля, устойчивое улучшение наблюдали после перорального введения один раз в день HP 184 в день 26, 27 и 28. Устойчивое улучшение также наблюдалось после в/б введения один раз в день 4-АР в дозе 0,6 мг/кг. Статистические различия были основаны на изменениях для каждой отдельной крысы (каждая крыса служила своим собственным контролем), с использованием U-критерия Манна-Уитни. Все поведенческие тесты проводили на день 1, день 2 и день 3 через 3 ч после введения лекарства через зонд. На день 3 лекарственные средства не вводились (первым днем введения лекарственных средств был день 0). Статистический анализ был следующим: 20 мг/кг - значительное улучшение от 3-го ч до дня 3 (р=0,002) по сравнению с контролем, носитель,10 мг/кг - значительное улучшение от 30 мин и 3 ч до 12 ч (р=0,014) по сравнению с контролем, носитель,3 мг/кг - значительное улучшение от 30 мин и 6 ч до дня 1 (р=0,0027) по сравнению с контролем,носитель,4-АР - значительное улучшение от 90 мин до 3 ч и от 12 ч до дня 2 (р=0,0027) по сравнению с контролем, носитель. Табл. 4 иллюстрирует изменения суммы баллов для каждой группы от времени до получения дозы до 3 ч после третьей ежедневной дозы подряд. Таблица 4 Фиг. 5 показывает изменения в сумме баллов, нормализованной для каждой крысы. График показывает изменение, наблюдавшееся через три дня введения подряд (от времени до введения доз до 3 ч после трех ежедневных введений подряд), дозы величиной 0,6 мг/кг 4-АР (в/б), 20 или 10 или 3 мг/кг (п/о). Ламинэктомия относится к контрольной группе. Средняя величинаСКО среднего для каждой группы(n=12) показана на фиг. 5. Эффективность при долговременном повреждении спинного мозга. Через 35 дней после повреждения спинного мозга умеренной степени пероральное введение 3 мг/кгHP 184 (п/о) улучшает моторное восстановление после однократной дозы, а ежедневное введение в течение 4 и более дней приводит к продолжительному и устойчивому улучшению, на основании определений по шкале ходьбы на открытом пространстве, представленной выше в настоящем описании. 4-АР в дозе 0,6 мг/кг (в/б) имела аналогичную эффективность. Табличная обработка результатов обоих исследований хронических повреждений спинного мозга (лекарственные средства первый раз вводили через 25 дней после легкого сдавливания спинного мозга и через 35 дней после умеренного сдавливания спинного мозга) представлена в табл. 5. Как показано выше, HP 184 в дозе 3 мг/кг в день, перорально через желудочный зонд, через 35-41 день после умеренного повреждения сдавливанием вызывал значительное улучшение. В данном исследовании отмечено, что в области повреждения в поврежденном спинном мозге крыс, получавших HP 184, было больше миелина. Эти данные свидетельствуют в пользу утверждения, что HP 184 либо усиливает процесс ремиелинизации или уменьшает уже происходящий процесс демиелинизации. Были также проведены исследования для определения наименьшей эффективной дозы HP 184 для умеренного хронического (35 дней после повреждения) сдавливания, с двойным слепым плацебо и положительным контролем. Эффекты HP 184, которые ранее наблюдались при использовании дозы 3 мг/кг,п/о, были подтверждены при использовании 4-АР (0,6 мг/кг, в/б) в качестве положительного контроля. Кроме того, влияние всех видов лечения на окрашивание миелина изучали гистологически. 1. Оценка поведения. Сто пятьдесят взрослых самок крыс Wistar, весом 250-300 г, полученных от Charles River, помещали в виварий Central Animal Facilities (CAF) McMaster University Health Sciences Centre (HSC) по меньшей мере на одну неделю. В течение указанного периода времени их подвергали постановочным тестам, описанным ниже, чтобы гарантировать, что они были знакомы с ними. Крыс ежедневно тренировали в течение 2 недель до оперативного вмешательства. Крысам давали наркоз смесью изофлюран (3-5%): О 2 (1 л/мин) в должным образом оборудованном оперблоке в CAF. Перед оперативным вмешательством для облегчения боли вводили темгезик(0,03 мг/кг массы тела, подкожно (п/к. Спинной мозг сдавливали (подвергали компрессии) модифицированным зажимом coverslip шириной 3,5 мм (Blight 1991, методика, модифицированная в лабораторииRathbone). Зажим закрывали до 1,4 мм в течение 15 с, что вызывало уровень повреждения, эквивалентный результату среднего уровня (умеренному) по шкале Gruner (1996). Компрессионное повреждение осуществляли иным способом, по методике, описанной Blight (1991). За животными наблюдали, чтобы установить болевое поведение, наличие инфекции мочевыводящих путей или задержки мочи. Боль лечили препаратом Tynenol (0,8 мг/кг массы тела, перорально). Для профилактики инфекции мочевыводящих путей животным перорально вводили препарат Septra(триметоприн-сульфаметоксазол) (4,5 мл в 300 мл воды) в течение периода времени от 1 дня до вмешательства и до 5 дней после вмешательства и лечили выдавливанием мочевого пузыря вручную. В случае инфекций, т.е. любой инфекции мочевыводящих путей, проявлявшейся помутнением или примесью крови в моче, подкожно (п/к) инъецировали препарат Baytril (энрофлоксацин, 7 мг/кг м.т.) дважды в день. Изменения опорно-двигательного поведения и сегментных рефлексов оценивали вплоть до 5 недель после повреждения. Животных тестировали в ходьбе на открытом пространстве, положении задней конечности и ориентации стопы. Животных оценивали на дни 2, 7, 14, 21, 28 и 35 после оперативного вмешательства. К 35 дню после оперативного вмешательства почти не наблюдалось дальнейших случаев спонтанного выздоровления. Таким образом, лечение начинали на день 35.HP 184 растворяли в стерилизованной (автоклавированной) деионизированной обратным осмосом воде, подкисленной ледяной уксусной кислотой (0,1 мл кислоты на 10 мл воды). 4-АР (Sigma, молекулярная масса 94,12; Jankowska E. et al., 1982; Gruner et al., 1999) растворяли в физиологическом растворе(0,6 мг/кг м.т.) и вводили путем в/б инъекции. Одна группа крыс (контроль-1, носитель) получала через желудочный зонд носитель. Поведенческое тестирование осуществляли непосредственно перед установкой желудочного зонда и спустя 3 ч после этого. Затем крыс на день 35 умерщвляли. Все остальные крысы получали либо HP 184 через желудочный зонд (0,3, 1 или 3 мг/кг м.т., в зависимости от группы) или 4-АР (0,6 мг/кг, в/б) или носитель (контроль-2, носитель) один раз в день с 35 по 42 дни после оперативного вмешательства. В указанные дни поведенческие тесты осуществляли непосредственно перед уста- 12011319 новкой желудочного зонда и спустя 3 и 24 ч после этого. Затем крысам производили перфузию на день 43 после проведения последнего поведенческого теста. В дни с 35 по 43 после оперативного вмешательства осуществляли видеозапись поведенческого теста с помощью Hi-8. Статистический анализ выполняли на компьютере Макинтош с использованием программы GB-Statppc 6.5.2. Поведенческие баллы анализировали с помощью дисперсионного непараметрического анализа(ANOVA) Крускал-Уэллиса. Post hoc сравнения выполняли с помощью U-критериев Манна-Уитни. Видимое восстановление опорно-двигательной способности на открытом пространстве оценивали по средним баллам OFT для каждой группы; результаты представлены на фиг. 6. Данные результаты показывают, что способность животных, леченных HP 184 или 4-АР, выполнять тесты достоверно отличалась от указанной способности у контрольных животных, получавших носитель. ANOVA для повторных измерений показал эффект лечения (р 0,01) на дни 35-42. Результаты показывают, что как 4-АР, так и HP 184 оказывают благоприятное действие, улучшая результаты поведенческого тестирования после умеренной хронической компрессии спинного мозга. Несмотря на то, что все три концентрации HP 184 оказывали благоприятное действие, HP в дозе 3 мг/кг вызывал наилучшее восстановление опорно-двигательной функции, подтверждая, таким образом, эффекты HP 184, которые наблюдались при этой дозе ранее. Указанные результаты также показывают, что самая низкая (0,3 мг/кг) концентрация HP 184 может не являться самой низкой эффективной дозой HP 184 в данном примере. Гистологическое исследование спинного мозга. Исследование для изучения, влияет ли лечение HP 184 на количество миелина у крыс с умеренным долговременным компрессионным повреждением спинного мозга, при введении спустя длительные период времени после повреждения спинного мозга. Для оценки в данном исследовании использовали спинной мозг крыс, описанных выше. На день 21 после оперативного вмешательства экспериментальным животным давали глубокий наркоз пентобарбиталом натрия (50-60 мг/кг массы тела, в/б) и осуществляли транскардиальную перфузию сначала 100 мл физиологического раствора с 0,05 М фосфатным буфером (PBS), содержавшего 0,1% гепарин, а затем 300-500 мл 4% параформальдегида (PFA). Извлекали сегменты с Т 9 по L1 спинного мозга, которые затем подвергали криозащите в 30% растворе сахарозы и замораживали при -70 С в 10,24% поливиниловом спирте и 4,26% полиэтиленгликоле. Сегмент каждого спинного мозга, включающий участок повреждения плюс 10 мм краниально и каудально от участка повреждения заливали средой Tissue Tek. Осуществляли серию продольных срезов с интервалами 20 мкм на криостате. Каждый третий срез окрашивали люксолом быстрым голубым для миелина. Оценку осуществляли наблюдатели, не осведомленные об обработанных образцах, на кодированных срезах. Срезы исследовали под световым микроскопом на предмет степени демиелинизации(площади, неокрашенной люксолом быстрым голубым). Для определения максимальной демиелинизированной площади в спинном мозге целый срез дискретизировали на фотографии с помощью микроскопа Цейсса. Степень демиелинизации в центре повреждения измерял исследователь, не осведомленный о группе лечения, используя программу визуального анализа Bioquant BQ-TCW98. Статистический анализ выполняли на компьютере Макинтош с использованием программы GB-Statppc 6.5.2. Гистологические результаты анализировали с помощью дисперсионного непараметрического анализа (ANOVA) Крускал-Уэллиса. Post hoc сравнения выполняли с помощью U-критериев МаннаУитни. Степень демиелинизации для шести экспериментальных групп (0,3, 1 или 3 мг/кг м.т., в зависимости от группы, или 4-АР 0,6 мг/кг или контроль 1 и 2, носитель) показана на фиг. 7. Столбцы представляют количество минимальных элементов демиелинизированной площади в центре сдавливания.(Р 0,001, Р 0,05, дисперсионный непараметрический анализ (ANOVA) Крускал-Уэллиса). Количественные результаты показывают, что спинной мозг у животных, леченных HP 184 или 4-АР, имел значительно большую миелинизированную площадь, чем у контрольных животных, получавших физиологический раствор. То есть спинной мозг животных, которые получали инъекции носителя, имел значительно большую демиелинизированную площадь, чем у животных, леченных HP 184 или 4-АР. Гистологический анализ показал, что как HP 184 (при всех трех концентрациях), так и 4-АР оказывали благоприятное действие на миелинизацию, что коррелировалось с результатами поведенческих тестов. Из указанных групп, животные, леченные HP в дозе 3 мг/кг, показали наименьшую демиелинизацию. Таким образом, представляется, что 4-АР или HP 184 способны усиливать ремиелинизацию на стадии, наступившей через длительный период времени после повреждения спинного мозга. Маловероятно,что указанные данные просто представляют снижение скорости потери миелина, поскольку не наблюдалось разницы в степени демиелинизации в двух контрольных группах, контроле 1 и контроле 2, оцененной в начале и конце эксперимента. Пример 8. Влияние HP 184 на продуцирование NO у мышей. Мышам инъецировали 30 мг/кг HP 184 (в/б) за 30 мин до LPS (3 мг/кг, в/б). Мышей умерщвляли- 13011319 через 5 ч после инъекции LPS и собирали плазму крови. Уровни нитратов определяли с помощью анализа Griess. Группы были составлены из 9-10 мышей каждая. Как показано графически на фиг. 9, HP 184 ингибирует продуцирование NO. После одностороннего ANOVA оказалось, что только воздействие LPS достоверно отличалось (р 0,01) от воздействия носителя. Пример 9. Оценка HP 184 на модели невропатической боли. Взрослым самцам крыс Sprague-Dawley производили одностороннее сдавливание нерва L6 для получения хронического повреждения нерва. После выздоровления от оперативного вмешательства (через 3-7 дней после оперативного вмешательства) животных тестировали для оценки порога отдергивания лапы в ответ на механическое раздражение пораженной лапы. Это устанавливали путем нанесения уколов калиброванными монофиламентами von Frey в плантарную поверхность каждой задней лапы. В исследование включали только животных с 50% снижением порога отдергивания в лигированной лапе, и их слепым способом разделяли на 6 групп: три группы, получавшие одну из трех доз HP 184 (0,3, 3 и 20 мг/кг, п/о), четвертую группу, получавшую однократную дозу другого соединения, называемого MDL(10 мг/кг, в/б), пятую группу, получавшую габапентин (90 мг/кг, п/к) и шестую группу, получавшую только носитель. Поведенческие тесты проводили через 45 мин после введения габапентина (90 мг/кг,п/к) и через 3 ч после введения HP 184, MDL и носителя. Для каждого животного подсчитывали разницу в баллах по порогу отдергивания лигированной и нелигированной лапы, и данную разницу обрабатывалиANOVA, с использованием группы в качестве главного фактора. Результаты показаны на фиг. 10. График показывает среднюю (+/-СКО) разницу между порогами отдергивания левой (лигированной) и правой (нормальной) лапы, до и после первого введения лекарственного средства (острая фаза исследования). Статистический анализ выявил дозозависимое ослабление механической гипералгезии, вызванной лигированием L5, при введении HP 184 в дозе 20 мг/кг, и отчетливое обратное развитие гипералгезии после введения габапентина в дозе 90 мг/кг. Анализ проводился между/внутри повторных измеренийAMOVA. Далее следовало post hoc сравнение (LSD) в условиях временного взаимодействия на группе X,для изучения величин порога отдергивания до введения лекарственного средства по сравнению с указанными величинами после введения лекарственного средства. Группа: F(5,43)=8,18, р 0,001 Время: F(1,43)=47,34, р 0,001 Время X группы: F(5,43)=9,25, р 0,001 У животных, получавших носитель, наблюдалась большая разница порогов отдергивания при механическом раздражении между двумя лапами. Список литературыdisorders". ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения демиелинизирующих заболеваний, включающий введение пациенту, который в этом нуждается, терапевтически эффективного количества соединения формулы Ip равно 0 или 1; каждый R независимо представляет собой водород, галоген, трифторметил, C1-C6 алкил, C1C6 алкокси, бензилокси, гидрокси, нитрогруппу или аминогруппу; каждый R1 независимо представляет собой водород, C1-C6 алкил, C1-C6 алкенил, C1-C6 алканоил, галоген, цианогруппу, -C(O)C1-C6 алкил, -C1-C6 алкиленCN, -C1-C6 алкиленNR'R, где R' и R, каждый независимо, представляет собой водород или C1-C6 алкил; -C1-C6 алкиленOC(О)C1-C6 алкил или -CH(OH)R4,где R4 представляет собой водород или C1-C6 алкил;R2 представляет собой водород, C1-C6 алкил, необязательно замещенный галогеном, гидрокси или бензилокси, C1-C6 алкенил, C1-C6 алкинил, -СО 2 С 1-С 6 алкил или -R5-NR'R, где R5 представляет собой C1C6 алкилен, C1-C6 алкенилен или C1-C6 алкинилен, a R' и R, каждый независимо, представляет собой водо- 17011319 род, C1-C6 алкил или, альтернативно, группа -NR'R как целое представляет собой 1-пирролидинил; иC1-C6 алкил,или его фармацевтически приемлемой соли. 2. Способ по п.1, где R представляет собой водород, галоген, трифторметил или C1-C6 алкил; R1 представляет собой водород или C1-C6 алкил; R2 представляет собой водород или C1-C6 алкил; R3 представляет собой водород, C1-C6 алкил или галоген; и p равно 0. 3. Способ по п.2, где соединение имеет следующую формулу: 4. Способ по п.1, где демиелинизирующее заболевание представляет собой рассеянный склероз. 5. Способ по п.1, где демиелинизирующее заболевание представляет собой травматическое повреждение головного мозга. 6. Способ по п.1, где демиелинизирующее состояние представляет собой удар. 7. Способ по п.1, где демиелинизирующее состояние представляет собой повреждение спинного мозга. 8. Способ лечения рассеянного склероза, включающий введение пациенту, нуждающемуся в этом,терапевтически эффективного количества соединения по п.3 (HP 184). 9. Способ улучшения мышечной функции у пациента с травматическим повреждением головного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. 10. Способ лечения потери подвижности, возникшей в результате повреждения спинного мозга,включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. 11. Способ улучшения двигательной функции у пациента, страдающего от повреждения спинного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. 12. Способ лечения потери чувствительности, возникшей в результате повреждения спинного мозга, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. 13. Способ по любому из пп.9-12, в котором соединением является соединение, определенное в п.3. 14. Способ обеспечения симптоматического облегчения спастического парапареза, вызванного рассеянным склерозом, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы 1 согласно п.1 или его фармацевтически приемлемой соли. 15. Способ по п.14, где соединение имеет следующую формулу: 16. Способ обеспечения симптоматического облегчения шаткой походки, вызванной рассеянным склерозом, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I согласно п.1 или его фармацевтически приемлемой соли. 17. Способ по п.16, где соединение имеет следующую формулу:- 18011319 18. Способ обеспечения симптоматического облегчения диплопии, вызванной рассеянным склерозом, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I согласно п.1 или его фармацевтически приемлемой соли. 19. Способ по п.18, где соединение имеет следующую формулу:
МПК / Метки
МПК: A61K 31/4439, A61P 25/02, A61P 25/28
Метки: состояний, способ, заболеваний, демиелинизирующих, лечения
Код ссылки
<a href="https://eas.patents.su/24-11319-sposob-lecheniya-demieliniziruyushhih-zabolevanijj-ili-sostoyanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения демиелинизирующих заболеваний или состояний</a>
Предыдущий патент: Устройство и способ импульсной электромагнитной разведки с использованием магнитной компоненты электромагнитной антенны
Следующий патент: N-арилсульфонил-3-замещенные индолы, обладающие афинностью к серотониновому рецептору, способ их получения и содержащая их фармацевтическая композиция
Случайный патент: Циклопропильные ингибиторы полимеразы












