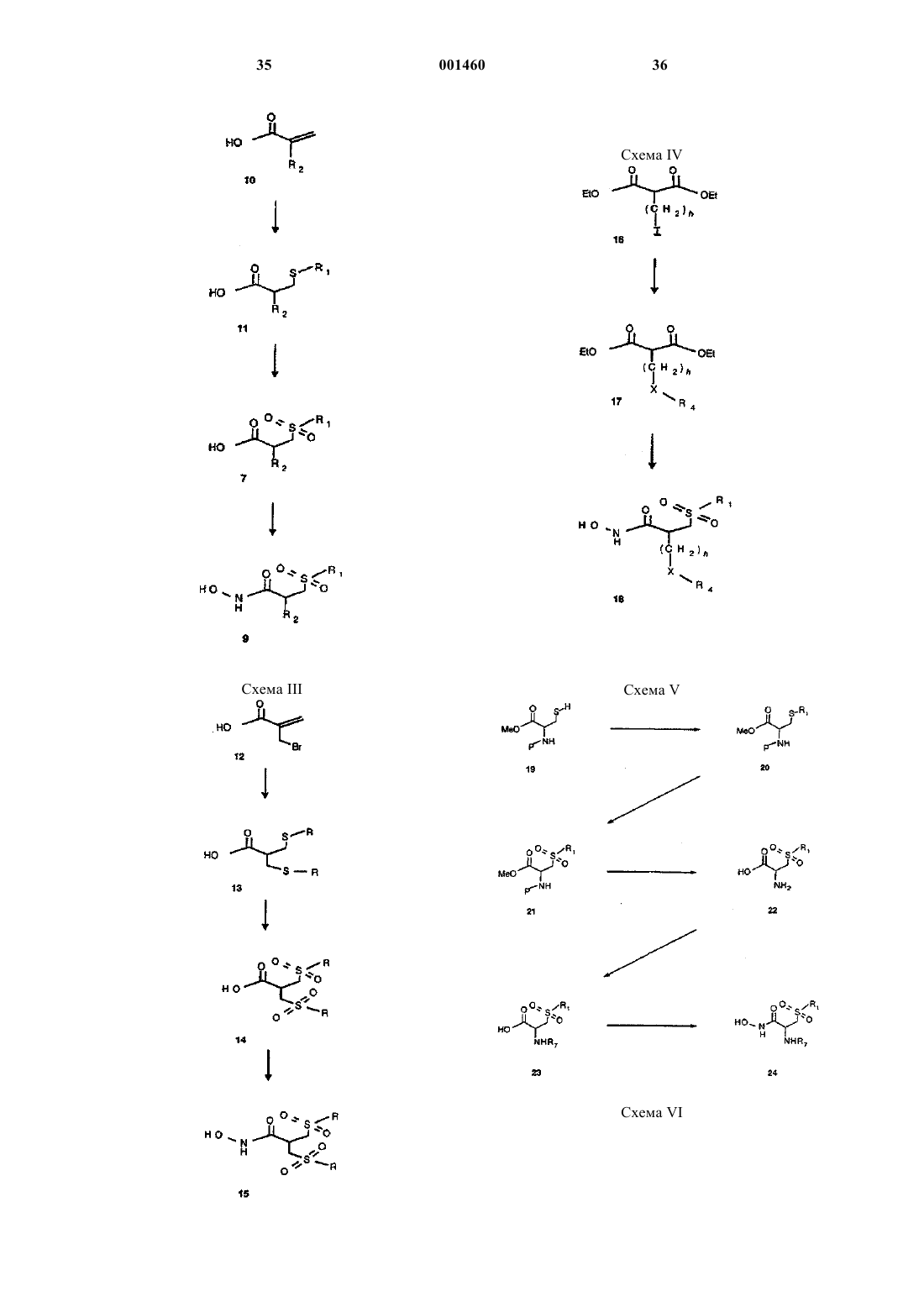
Бетта-сульфонил гидроксамовые кислоты в качестве ингибиторов матричных металлопротеиназ.
Формула / Реферат
1. Соединение формулы I
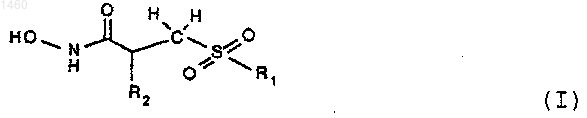
или его фармацевтически приемлемые соли,
где R1 представляет собой
a) С4-12алкил,
b) C4-12алкенил,
c) C4-12алкинил,
d) -(СН2)h-С3-8циклоалкил,
e) -(СН2)h-арил,
f) -(СН2)h-арил, замещенный C1-4алкилом, C1-4алкокси, галогеном, -NO2, -CF3, -CN, -N(С1-4алкил)2,
g) -(СН2)h-гет или
h) -(CH2)h-гет, замещенный C1-4алкилом или галогеном;
R2 представляет собой
a) C1-12алкил,
b) C1-12алкил, замещенный от одного до трех галогенами, -CN, -NO2, -CF3, -N(R3)2, -SR3, или ОН,
с) C2-12алкенил,
d) C2-12алкенил, замещенный от одного до трех галогенами, -CN, -NO2, -CF3,
e) C2-12алкинил,
f) C2-12алкинил, замещенный от одного до трех галогенами, -CN, -NO2 или -CF3,
g) -(CH2)h-C3-8циклоалкил,
h) -(CH2)h-C3-8циклоалкил, замещенный от одного до трех C1-4алкилами, C1-4алкокси или галогенами,
i) -(CH2)h-C3-8циклоалкенил,
j) -(CH2)h-C3-8циклоалкенил, замещенный от одного до трех C1-4алкилами, C1-4алкокси или галогенами,
k) -(CH2)h-арил,
l) -(СН2)h-арил, замещенный от одного до трех C1-4 алкилами, C1-4алкокси, -CF3, -ОН, -NO2, -CN, -N(R3)2, -SR3, -SO2(C1-4алкокси), -C(=O)R3 или NC(=O)R3,
m) -(СН2)h-арил, замещенный от одного до пяти галогенами,
n) -(СН2)h-гет,
о) -(CH2)h-гет, замещенный от одного до двух C1-4алкилами или галогенами,
p) -(CH2)h-Q,
q) -(CH2)h-Q, замещенный от одного до трех C1-4алкилами, C1-4алкокси, галогенами или фенилами,
r) -(CH2)i-X-R4, где цепь -(CH2)i- может быть необязательно замещена C1-4алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех галогенами или C1-4алкилами или
s) -(CH2)iCHR5R6;
R3 представляет собой
a) Н,
b) С1-4алкил,
c) -(СН2)h-фенил, или
d) -(СН2)h-фенил, замещенный от одного до трех C1-4алкилами, C1-4алкокси или галогенами,
X представляет собой
a) -O-,
b) -S(=O)j-,
c) -NR7-,
d) -S(=O)2NR8- или
e) -С(=O)-;
R4 представляет собой
a) Н,
b) C1-4алкил,
c) -(СН2)h-фенил,
d) -(СН2)h-фенил, замещенный от одного до трех C1-4алкилами, C1-4алкокси, галогенами, -NO2 или -CN, или
e) -(СН2)h-гет;
R5 представляет собой
a) C1-4алкил, или
b) -С(=O)R3;
R6 представляет собой
a) -C(=O)R3, или
b) -(CH2)hC(=O)R3:
R7 представляет собой
a) Н,
b) C1-4алкил,
c) -(СН2)h-фенил,
d) -(СН2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4алкокси или галогенами,
e) -C(=O)R3,
f) -S(=O)2R3, или
g) -C(=O)OR3;
R8 представляет собой
a) C1-4алкил,
b) -(СН2)h-фенил, или
c) -(СН2)h-фенил, замещенный от одного до трех С1-4алкилами, C1-4алкокси или галогенами;
арил представляет собой монокарбоциклическую или дикарбоциклическую ароматическую группу;
гет представляет 5-10-членную ненасыщенную гетероциклическую группу, имеющую от одного до трех атомов, выбранных из группы, состоящей из кислорода, азота и серы;
Q представляет 5-10-членную насыщенную гетероциклическую группу, имеющую один или два атома, выбранных из группы, состоящей из кислорода, азота и серы;
h представляет собой 0, 1, 2, 3, 4, 5 или 6;
i представляет собой 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10; и
j представляет собой 0, 1 или 2.
2. Соединение формулы I по п.1, где R2 представляет собой
a) C1-12алкил, замещенный от одного до трех галогенами, -CN, -NO2, -CF3-, -N(R3)2, -SR3 или ОН,
b) C2-12алкенил,
c) C2-12алкенил, замещенный от одного до трех галогенами, -CN, -NO2 или CF3,
d) С2-12алкинил,
e) C2-12алкинил, замещенный от одного до трех галогенами, -CN, -NO2 или CF3,
f) -(СН2)h-C3-8циклоалкил, замещенный от одного до трех C1-4алкилами, C1-4алкокси или галогенами,
g) -(CH2)h-C3-8циклоалкенил,
h) -(СН2)h-С3-8циклоалкенил, замещенный от одного до трех С1-4алкилами, C1-4алкокси или галогенами,
i) арил,
j) арил, замещенный от одного до трех C1-4алкилами, C1-4алкокси, CF3, -ОН, -NO2, -CN, -N(R3)2, -SR3, -SO2(C1-4алкокси), -C(=O)R3 или -NC(=O)R3,
k) -(СН2)h-гет,
l) -(СН2)h-гет, замещенный одним или двумя C1-4алкилами или галогенами,
m) -(CH2)i-Q,
n) -(CH2)i-Q, замещенный от одного до трех C1-4алкилами, C1-4алкокси, галогенами или фенилами;
о) -(CH2)iX-R4, где цепь -(CH2)i- может быть необязательно замещена C1-4алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех галогенами или C1-4алкилами или
р) -(CH2)hCHR5R6,
где R3, X, R4, r5, R6, R7, R8, арил, гет и Q являются такими, как определены в п.1,
h представляет собой 0, 1, 2, 3, 4, 5 или 6, и
i представляет собой 1, 2, 3, 4, 5 или 6.
3. Соединение формулы I по п.1, где R2 представляет собой
a) -(CH2)h-гет,
b) -(CH2)h-гет, замещенный одним или двумя C1-4алкилами или галогенами,
c) -(CH2)i-Q,
d) -(CH2)i-Q, замещенный от одного до трех C1-4алкилами, C1-4алкокси, галогенами или фенилами или
e) -(CH2)i-X-R4, где цепь -(СН2)i- может быть необязательно замещена C1-4алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех C1-4 алкилами или галогенами,
где X, R4, R7, R8, арил, гет и Q определены как в п.1,
h представляет собой 0, 1, 3, 3, 4, 5 или 6; и
i представляет собой 1, 2, 3, 4, 5 или 6.
4. Соединение формулы I по п.1, где R1 представляет собой
a) С4-8алкил,
b) -(CH2)h-фенил или
c) -(СН2)h-фенил, замещенный C1-4алкилом, C1-4алкокси, фтором, хлором или бромом;
R2 представляет собой
a) -(СН2)h-пиридил, хинолинил, пирролил, тиенил или тиазолил или индолил, которые могут быть необязательно замещены от одного до трех C1-4алкилами, C1-4алкокси, фенилами, фторами, хлорами или бромами,
b) -(СН2)h-пиперидинил, пиперазинил, морфолино, 4-тиоморфолинил, бутиролактамил, 2-оксо-оксазолидинил или 2,4-диоксоимидазолидинил, которые могут быть необязательно замещены от одного до трех C1-4алкилами, фенилами, фторами, хлорами или бромами;
c) -(CH2)h-X-R4;
X представляет собой
а) -S(=O)j-;
R4 представляет собой
a) C1-8алкил
b) фенил или
c) фенил, замещенный C1-4алкилом, C1-4алкокси или галогеном,
h представляет собой 0, 1, 2, 3, 4, 5 или 6,
i представляет собой 1, 2, 3, 4, 5 или 6 и
j представляет собой 0, 1 или 2.
5. Соединение по п.1, где R1 выбирают из группы, состоящей из n-бутила, изобутила, 1-метилпропила, трет-бутила, n-пентила, 3-метилбутила, n-гексила, n-гептила, n-октила, фенила, 4-метилфенила, 4-этилфенила, 4-трет-бутилфенила, 4-изопропилфенила, 4-хлорфенила, 4-бромфенила, 4-фторфенила, 4-трифторметилфенила, 4-метоксифенила, 4-этоксифенила, 4-n-бутилоксифенила, бензила, 4-фенилбензила, 2-, 3- или 4-фторбензила, 2-, 3-, 4-хлорбензила, 2-, 3-, 4-бромбензила, 4-этоксибензила.
6. Соединение по п.1, где R2 выбирают из группы, состоящей из метила, 1-циано-1-фенилметила, 2-цианоэтила, 2-фенилэтила, 2-бром-2-фенилэтила, 2-бромэтила, пропила, изопропила, 3-хлорпропила, 3-бромпропила, n-бутила, изобутила, 3-метилбутила, 1-метилпропила, трет-бутила, n-пентила, 3-метилбутила, n-гексила, n-гептила, n-октила, n-гексадецила, n-октадецила, 2-пропенила, 2-пропинила, 3-бутенила, 4-пентенила, 3-бутенинила, 4-пентенинила, циклопентила, циклогексила, циклогексилметила, 2-циклогексилэтила, 4-циклогексилбутила, диметиламиноэтила, диметиламинопропила, диэтиламинопропила, фениламинометила, фениламиноэтила, фенила, 4-метилфенила, 4-хлорфенила, 4-бромфенила, 4-фторфенила, 4-трифторметилфенила, 2-метоксифенила, 4-метоксифенила, 4-нитрофенила, 4-этоксифенила, бензила, 4-метилбензила, 2-фторбензила, 3-фторбензила, 4-фторбензила, 2-хлорбензила, 3-хлорбензила, 4-хлорбензила, 2-бромбензила, 3-бромбензила, 4-бромбензила и 2-метилбензила, 3-метилбензила, 4-метилбензила, 4-этоксибензила, 4-нитробензила, метилкарбонила, 1-метилкарбонилметила, 2-фенилкарбонилэтила, изопропилкарбонила, метоксикарбонила, этоксикарбонила, 1,1-этоксикарбонилметила, 2,2-этоксикарбонилэтила, 1,2-этоксикарбонилэтила, 2-метоксикарбонилпропила, 3-метоксикарбонилпропила, 1-этоксикарбонилметила, 1-этоксикарбонилэтила, фенилкарбонила, фенилкарбонилметила, пиридилкарбонилметила, пиридилметила, пиридилэтила, хинолинилметила, пиролилметила, индолилметила, тиенила, тиазолила, тиенилметила, тиенилэтила, пиперидинила, пиперидинилметила, пиперазинилметила, морфолинометила, морфолиноэтила, морфолинопропила, тиоморфолинометила, тиоморфолинопропила, 4-метоксибензолсульфонилметила, 3-(4-метоксибензолсульфонил)аминопропила, 3-(4-метоксибензолсульфонил)пропила, 3-гидрокси, амино, 3-феноксипропила, 2-фенилэтилокси, (4-бутоксибензолсульфонил)метила, метил-3-(1,5,5-триметилгидантоина), метил-3-(1-бутил-5,5-диметилгидантоина), (4-метоксибензолсульфонил)метила, (4-хлорбензолсульфонил)метила, (4-бромбензолсульфонил)метила, (n-бутилсульфонил)метила, (n-октилсульфонил)метила, 3-(4-метоксибензолсульфонил)пропила, (4-метилбензолсульфонил)метила, (бензолсульфонил)метила, метил-3-(1-метилгидантоина), метил-3-(1-бутилгидантоина) и метил-3-(5,5-диметилгидантоина).
7. Соединение по п.1, где R2 выбирают из группы, состоящей из (4-метоксибензолсульфонил)метила, (4-хлорбензолсульфонил)метила, (4-бромбензолсульфонил)метила, (n-бутилсульфонил)метила, (n-октилсульфонил)метила, 3-(4-метоксибензолсульфонил)пропила, (4-метилбензолсульфонил)метила, (бензолсульфонил)метила, метил-3-(1-метилгидантоина), метил-3-(1-бутилгидантоина) и метил-3-(5,5-диметилгидантоина).
8. Соединение по п.1, которое представляет собой
(1) N-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-фенил-пропионамид,
(2) N-гидрокси-2-[(бензолсульфонил)метил]-3-фенил-пропионамид,
(3) N-гидрокси-2-[(бензолсульфонил)метил]-пропионамид,
(4) N-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(5) N-гидрокси-2-[(4-хлорбензолсульфонил)метил]-3-(4-хлорбензолсульфонил)-пропионамид,
(6) N-гидрокси-2-[(4-бромбензолсульфонил)метил]-3-(4-бромбензолсульфонил)-пропионамид,
(7) N-гидрокси-2-[(n-бутилсульфонил)метил]-3-(n-бутилсульфонил)-пропионамид,
(8) N-гидрокси-2-[(n-октилсульфонил)метил]-3-(n-октилсульфонил)-пропионамид,
(9) N-гидрокси-2-[(4-метилбензолсульфонил)метил]-3-(4-метилбензолсульфонил)-пропионамид,
(10) N-гидрокси-2-[(бензолсульфонил)метил]-3-(бензолсульфонил)-пропионамид,
(11) N-гидрокси-2-[(4-метоксибензолсульфонил)метил]-5-(4-метоксибензолсульфонил)-пентанамид,
(12) N-гидрокси-2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(13) N-гидрокси-2-[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(14) N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-4-(бутоксибензолсульфонил)-пропионамид,
(15) N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(16) N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(17) (+)-N-гидрокси-2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(18) (-)-N-гидрокси-2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(19) (+)-N-гидрокси-2-[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(20) (-)-N-гидрокси-2-[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(21) (+)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионамид,
(22) (-)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионамид,
(23) (+)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(24) (-)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(25) (+)-N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид или
(26) (-)-N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид.
9. Соединение по п.1, которое представляет собой
(1) N-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(2) N-гидрокси-2-[(4-хлорбензолсульфонил)метил]-3-(4-хлорбензолсульфонил)-пропионамид,
(3) N-гидрокси-2-[(4-бромбензолсульфонил)метил]-3-(4-бромбензолсульфонил)-пропионамид,
(4) N-гидрокси-2-[(n-бутилсульфонил)метил]-3-(n-бутилсульфонил)-пропионамид,
(5) N-гидрокси-2-[(n-октилсульфонил)метил]-3-(n-октилсульфонил)-пропионамид,
(6) N-гидрокси-2-[(4-метилбензолсульфонил)метил]-3-(4-метилбензолсульфонил)-пропионамид,
(7) N-гидрокси-2-[(бензолсульфонил)метил]-3-(бензолсульфонил)-пропионамид,
(8) N-гидрокси-2-[(4-метоксибензолсульфонил)метил]-5-(4-метоксибензолсульфонил)-пентанамид,
(9) N-гидрокси-2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(10) N-гидрокси-2-[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(11) N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-4-(бутоксибензолсульфонил)-пропионамид,
(12) N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(13) N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(14) (+)-N-гидрокси-2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(15) (-)-N-гидрокси-2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамид,
(16) (+)-N-гидрокси-2-[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(17) (-)-N-гидрокси-2-[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(18) (+)-N-гидрокси-[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионамид,
(19) (-)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионамид,
(20) (+)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(21) (-)-N-гидрокси-2-[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид,
(22) (+)-N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид или
(23) (-)-N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамид.
10. Соединение формулы 7
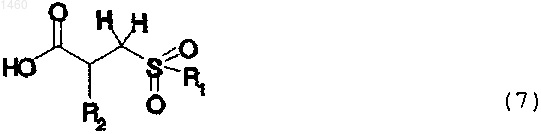
где R1 и R2 являются такими, как определены в п.1.
11. Фармацевтическая композиция, содержащая эффективное для ингибирования избыточной матричной металлопротеиназной активности количество соединения по п.1 и фармацевтически приемлемый носитель.
Текст
1 Область техники, к которой относится изобретение Данное изобретение относится к новым сульфонил гидроксамовым кислотам, содержащим их фармацевтическим композициям, и промежуточным соединениям для их получения. Предлагаемые соединения являются ингибиторами матричных металлопротеиназ, которые участвуют в деградации ткани. Обоснование изобретения Потеря целостности соединительной ткани имеет место при многих болезнях, включая остеоартрит, ревматоидный артрит, септический артрит, нарушение остеогенеза, такое как остеопороз, при метастазе опухоли (инвазии и росте), периодонтите, гингивите, язве роговицы,кожной язве, язве желудка, воспалении, астме и других болезнях, связанных с деградацией соединительной ткани. Несмотря на широкое распространение данных болезней в развитых странах, в настоящее время не существует средств, которые предупреждают происходящее при этом повреждение ткани. Ряд научных доказательств указывает на то, что неконтролируемая активность металлопротеиназ соединительнотканного матрикаса (ММП) отвечает за это повреждение и поэтому ингибирование этих ферментов стало целью терапевтического вмешательства (Matrisian, L.M., Bases, Vol. 14, рр 445-463 (1992); Emonard, H. et al., Cellular andDocherty, A.J. P.et al., Annals of the Rheumatic,Vol. 49, pp 469-479 (1990. Производные гидроксамовой кислоты являются классом известных терапевтически активных ингибиторов ММП и существуют многочисленные ссылки в данной области, раскрывающие разнообразие производных гидроксамовой кислоты. Например, Европейская патентная публикация 0,606,046 А 1 раскрывает арил-сульфонамид-замещенные гидроксамовые кислоты в качестве ингибиторов матричной металлопротеиназы. Международная публикацияWO 95/35275 и WO 95/35276 раскрывает производные сульфонамид гидроксамовой и карбоновых кислот в качестве ингибиторов матричных металлопротеиназ. Все эти ссылки сообщают о сульфонамид гидроксамовых кислотах. Соединения данного изобретения новые и отличаются от других сульфонамид гидроксамовых кислот тем, что обычный атом азота сульфонамидной группы заменен атомом углерода. Изобретение представляет производные сульфонил гидроксамовой кислоты. Соединения данного изобретения ингибируют различные ферменты из семейства матричных металлопротеиназ, главным образом,стромелизин и желатиназу, и, следовательно,полезны при лечении болезней, связанных с матричной металлоэндопротеиназой, таких как остеопороз, метастаз опухоли (инвазия и рост),периодонтит, гингивит, язва роговицы, кожная язва, язва желудка, воспаление, астма и другие 2 болезни, связанные с деградацией соединительной ткани. Раскрытие информации Следующие ссылки раскрывают производные сульфонил гидроксамовой кислоты. Международная публикацияWO 95/09841 раскрывает соединения гидроксамовой кислоты в качестве ингибиторов фактора опухолевого некроза (ФОН) и матричных металлопротеиназ. Международная публикацияWO 93/20047 раскрывает соединения гидроксамовой кислоты в качестве ингибиторов образования фактора опухолевого некроза и матричных металлопротеиназ. Международная публикацияWO 90/05719 раскрывает соединения гидроксамовой кислоты для использования их в случае болезней, включающих в себя деградацию ткани и/или в случае стимулирования заживления ран. Соединения гидроксамовой кислоты в указанных выше ссылках имеют обязательную пептидную основу. Соединения данного изобретения отличаются от указанных в ссылках выше тем, что они не имеют пептидной основы. Европейская патентная заявка ЕР 0780386 А 1 раскрывает ингибиторы матричных металлопротеиназ для лечения млекопитающих, когда болезненные состояния облегчают ингибированием таких матричных металлопротеиназ. Международная публикацияWO 97/24117 раскрывает соединения замещенной арил, гетероарил, арилметил или гетероарилметил гидроксамовой кислоты, особенно активные для ингибирования образования или физиологического действия ФОН при лечении пациента,страдающего от болезненного состояния, связанного с физиологически вредным избытком фактора опухолевого некроза (ФОН). Краткое изложение изобретения Настоящее изобретение касается новых соединений формулы I или их фармацевтически приемлемых солей, гдеb) C1-12 алкил, замещенный от одного до трех гало, -CN, -NO2, -CF3, -N(R3)2, -SR3, или ОН,c) C2-12 алкенил,d) C2-12 алкенил, замещенный от одного до трех гало, -CN, -NO2, -CF3,e) С 2-12 алкинилf) C2-12 алкинил, замещенный от одного до трех гало, -CN, -NO2, или -CF3,g) - (СН 2)h-С 3-8 циклоалкил,h) -(CH2)h-C3-8 циклоалкил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или гало,i) -(СН 2)h-С 3-8 циклоалкенил,j) -(CH2)h-C3-8 циклоалкенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или гало,k) -(СН 2)h-арил,l) -(СН 2)h-арил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, -CF3, -ОН, -NО 2,-CN, -N(R3)2, -SR3, -SО 2(C1-4 алкокси), -C(=O)R3 или NC(=О)R3,m) -(CH2)h-арил, замещенный от одного до пяти гало,n) -(СН 2)h-гет,о) -(СН 2)h-гет, замещенный от одного до двух C1-4 алкилами или гало,p) -(CH2)h-Q,q) -(CH2)h-Q, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, гало или фенилами,r) -(CH2)i-X-R4, где цепь -(CH2)i- может быть необязательно замещена C1-4 алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех гало или C1-4 алкилами илиd) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или гало,X представляет собойa) H,b) C1-4 алкил,c) -(СН 2)h-фенил,d) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, гало, -NO2 или -CN, илиa) Н,b) C1-4 алкил,c) -(CH2)h-фенил,d) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или гало,e) -C(=О)R3,f) -S(=О)2R3, илиc) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или гало,арил представляет монокарбоциклическую или дикарбоциклическую ароматическую группу; гет представляет 5-10-членную ненасыщенную гетероциклическую группу, имеющую от одного до трех атомов, выбранных из группы, состоящей из кислорода, азота и серы;Q представляет 5-10-членную насыщенную гетероциклическую группу, имеющую один или два атома, выбранных из группы, состоящей из кислорода, азота и серы;j представляет 0, 1 или 2. Соединения данного изобретения ингибируют различные ферменты из семейства матричных металлопротеиназ, главным образом,стромелизин и желатиназу, и, следовательно,полезны для лечения болезней, связанных с матричной металлоэндопротеиназой. Детальное раскрытие существа изобретения Содержание углерода в различных углеводородных группах специально в данном изобретении обозначили префиксом, указывающим на минимальное и максимальное число атомов углерода в группе, т.е. префикс Сi-j указывает, что число атомов углерода представляет целое число "i" до целого числа "j" включительно. Таким образом, C1-4 алкил относится к алкилу из одного до четырех атомов углерода включительно или метилу, этилу, пропилу, бутилу и их изомерным формам. Выражения "C1-4 алкил", "C4-8 алкил", "C1-12 алкил" и "C1-18 алкил" относятся к алкильной группе, имеющей от одного до четырех, от четырех до восьми, от одного до двенадцати или от одного до восемнадцати соответственно атомов углерода, как таковых: например, метил,этил, пропил, бутил, пентил, гексил, гептил,октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил и их изомерные формы, при этом алкильная группа R1 предпочтительно имеет от четырех до восьми атомов углерода, а алкильная группа R2 имеет от одного до восьми атомов углерода. 5 Выражения "C2-12 алкенил" и "С 4-8 алкенил" относятся к алкенильной группе, по крайней мере, с одной двойной связью и имеющей, соответственно, от двух до двенадцати атомов углерода как таковых: например, этенил, пропенил,бутенил, пентенил, гексенил, гептенил, гептдиенил, октенил, октадиенил, октатриенил,ноненил, ундеценил, додеценил и их изомерные формы, при этом алкенильная группа R1 предпочтительно имеет от четырех до восьми атомов углерода и алкенильная группа R2 имеет от двух до восьми атомов углерода. Выражение "C2-12 алкинил" относится к алкинильной группе, по крайней мере, с одной тройной связью и имеющей от двух до двенадцати атомов углерода, как таковых: например,этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, октадиинил, октатриинил, нонинил, нонидиинил и их изомерные формы, при этом алкинильная группа R1 имеет предпочтительно от четырех до восьми атомов углерода, алкинильная группа R2 имеет от двух до восьми атомов углерода. Выражение "С 3-8 циклоалкил" относится к циклоалкилу, имеющему от трех до восьми атомов углерода, таким как, например, циклопропил, циклобутил, циклопентил, циклогексил,циклогептил, циклооктил и их изомерным формам, при этом циклоалкильная группа предпочтительно имеет от трех до шести атомов углерода. Выражение "С 3-8 циклоалкенил" относится к циклоалкенилу, имеющему от трех до восьми атомов углерода, таким как, например, циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и их изомерным формам, при этом циклоалкенильная группа предпочтительно имеет от пяти до шести атомов углерода. Выражения "C1-4 алкокси", "C1-6 алкокси" и"C1-8 алкокси" относятся к алкильной группе,имеющей от одного до четырех, от одного до шести или от одного до восьми, соответственно атомов углерода, связанной с атомом кислорода гидроксильной группы, такими, например, являются метокси, этокси, пропилокси, бутилокси,пентилокси, гексилокси, гептилокси или октилокси и их изомерные формы. Выражение "арил" относится к монокарбоциклической или дикарбоциклической ароматической группе, такой как, например, фенил,нафтил, дифенил. Каждая из этих групп может соответственно замещаться. Арил это, главным образом, фенил или фенил замещенный C1-4 алкилом, C1-4 алкокси, фтором, хлором, бромом,-NO2, -CF3, N(C1-4 алкил)2, -C(=O)R3 или-NC(=O)R3. Выражение "гет" относится к 5-10 членной ненасыщенной гетероциклической группе,имеющей один или более атомов, выбранных из группы, состоящей из кислорода, азота и серы,например, 2-пиридил, 3-пиридил, 4-пиридил, 2 001460 6 пиримидинил, 4-пиримидинил, 5-пиримидинил,3-пиридазинил, 4- пиридазинил, 3-пиразинил, 2 хинолил,3-хинолил,1-изохинолил,3 изохинолил, 4-изохинолил, 2-хиназолинил, 4 хиназолинил, 2-хиноксалинил, 1-фталазинил, 2 имидазолил, 4-имидазолил, 3-изоксазолил, 4 изоксазолил, 5-изоксазолил, 3-пиразолил, 4 пиразолил,5-пиразолил,2-оксазолил,4 оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил,5-тиазолил,3-изотиазол,4-изотиазол,5 изотиазол, 2-индолил, 3-индолил, 3-индазолил,2-бензоксазолил, 2-бензотиазолил, 2-бензимидазолил, 2-бензофуранил, 3-бензофуранил, бензоизотиазол, бензоизоксазол, 2-фуранил, 3 фуранил, 2-тиенил, 3-тиенил, 2-пирролил, 3 пирролил, 3-изопирролил, 4-изопирролил, 5 изопирролил, 1-индолил, 1-индазолил, 2 изоиндолил, 1-пуринил, 3-изотиазолил, 4 изотиазолил, и 5-изотиазолил, предпочтительно пиридил, хинолинил, пирролил, тиенил, тиазолил или индолил. Каждая из этих групп может замещаться одним, двумя C1-4 алкилами, -NO2, атомами фтора, хлора или брома соответственно. Выражение "Q" относится к 5-10 членной насыщенной гетероциклической группе, имеющей один или два атома, выбранных из группы,состоящей из кислорода, азота и серы: например, пиперидинил, 2-, 3-, или 4-пиперидинил,[1,4]пиперазинил, морфолинил, 2- или 3 морфолинил, тиоморфолинил, диоксоланил,имидазолидинил, [1,3]оксатиоланил, [1,3]оксазолидинил, пирролидинил, бутиролактонил,бутиролактамил, сукцинимидил, глутаримидил,валеролактамил, 2,5-диоксо-[1,4]пиперазинил,пиразолидинил, 3-оксопиразолидинил, 2-оксоимидазолидинил, 2,4-диоксоимидазолидинил, 2 оксо-[1,3]-оксазолидинил,2,5-диоксо[1,3]оксазолидинил, изоксазолидинил, 3-оксоизоксазолидинил, [1,3]-тиазолидинил, 2- или 4-оксо[1,3]-тиазолидинил, предпочтительно бутиролактамил, сукцинимидил, глутаримидил, валеролактамил, 2,5-диоксо-[1,4]пиперазинил, 3 оксопиразолидинил,2-оксоимидазолидинил,2,4-диоксоимидазолидинил, 2-оксо-[1,3]-оксазолидинил, 2,5-диоксо-[1,3]-оксазолидинил, 3 оксоизоксазолидинил, 2- или 4-оксо-[1,3]тиазолидинил. Выражение гало относится к фтору, хлору брому или йоду, но предпочтительно к фтору,хлору или брому. Соединения данного изобретения могут быть превращены в их соли, согласно соответствующим принятым способам. Выражение "фармацевтически приемлемые соли" относится к кислотно-аддитивным солям, которые пригодны для введения соединений данного изобретения и включают гидрохлорид, гидробромид, гидроиодид, сульфат,фосфат, ацетат, пропионат, лактат, мезилат, малеат, малат, сукцинат, тартрат, лимонную кислоту, 2-гидроксиэтил сульфонат, фумарат и 7 тому подобное. Эти соли могут быть в гидратированной форме. Некоторые соединения данного изобретения могут образовывать соли металлов, такие как соли натрия, калия, кальция и магния и они охватываются выражением "фармацевтически приемлемые соли". Соединения формулы I данного изобретения содержат хиральный центр, в -положении гидроксамовых кислот, и поэтому существуют два энантиомера или рацемическая смесь обоих. Данное изобретение относится к обоим энантиомерам, так же как к их смесям, содержащим оба изомера. Кроме того, в зависимости от природы заместителей, могут быть представлены дополнительные хиральные центры и другие изомерные формы в любой из R2 групп, и данное изобретение охватывает все возможные стереоизомеры и геометрические формы в этой группе.R1 предпочтительно представляет собой nбутил, изобутил, 1-метилпропил, трет-бутил, nпентил, 3-метилбутил, n-гексил, n-гептил, nоктил, фенил, 4-метилфенил, 4-этилфенил, 4 трет-бутилфенил, 4-изопропилфенил, 4-хлорфенил, 4-бромфенил, 4-фторфенил, 4-трифторметилфенил, 4-метоксифенил, 4-этоксифенил, 4n-бутилоксифенил, бензил, 4-фенилбензил, 2-,3-, или 4-фторбензил, 2-,3-,4-хлорбензил, 2-,3-,4-брoмбензил, 4-этоксибензил. Более предпочтительным R1 является n-бутил, n-пентил, nгексил, n-гептил, n-октил, фенил, 4-метилфенил,4-этилфенил, 4-изопропилфенил, 4-хлорфенил,4-бромфенил, 4-фторфенил, 4-метоксифенил, 4 бутоксифенил,бензил,4-фторбензил,4 хлорбензил, 4-бромбензил и 4-этоксибензил.R2 предпочтительно представляет собой метил, 1-циан-1-фенилметил, 2-цианоэтил, 2 фенилэтил, 2-бром-2-фенилэтил, 2-бромэтил,пропил,изопропил,3-хлорпропил,3 бромпропил, n-бутил, изобутил, 3-метилбутил,1-метилпропил,трет-бутил,n-пентил,3 метилбутил, n-гексил, n-гептил, n-октил, nгексадецил,n-октадецил,2-пропенил,2 пропинил, 3-бутенил, 4-пентенил, 3-бутенинил,4-пентенинил, циклопентил, циклогексил, циклогексилметил, 2-циклогексилэтил, 4-циклогексилбутил, диметиламиноэтил, диметиламинопропил, диэтиламинопропил, фениламинометил, фениламиноэтил, фенил, 4-метилфенил, 4 хлорфенил, 4-бромфенил, 4-фторфенил, 4 трифторметилфенил, 2-метоксифенил, 4-метоксифенил, 4-нитрофенил, 4-этоксифенил, бензил, 4-метилбензил, 2-фторбензил, 3-фторбензил,4-фторбензил,2-хлорбензил,3 хлорбензил, 4-хлорбензил, 2-бромбензил, 3 бромбензил, 4-бромбензил, и 2-метилбензил, 3 метилбензил, 4-метилбензил, 4-этоксибензил, 4 нитробензил, метилкарбонил, 1-метилкарбонилметил, 2-фенилкарбонилэтил, изопропилкарбонил, метоксикарбонил, этоксикарбонил, 1,1 этоксикарбонилметил, 2,2-этоксикарбонилэтил,1,2-этоксикарбонилэтил,2-метоксикарбонил 001460 8 пропил, 3-метоксикарбонилпропил, 1-этоксикарбонилметил, 1-этоксикарбонилэтил, фенилкарбонил, фенилкарбонилметил, пиридилкарбонилметил, пиридилметил, пиридилэтил, хинолинилметил, пиролилметил, индолилметил,тиенил, тиазолил, тиенилметил, тиенилэтил,пиперидинилметил, пиперазинилметил, морфолинометил, морфолиноэтил, морфолинопропил,тиоморфолинометил, тиоморфолинопропил, 4 метоксибензолсульфонилметил, 3-(4-метоксибензолсульфонил)аминопропил, 3-(4-метоксибензолсульфонил)пропил, 3-гидрокси, амино, 3 феноксипропил, 2-фенилэтилокси, (4-бутоксибензолсульфонил)метил, метил-3-(1,5,5-триметилгидантоин),метил-3-(1-бутил-5,5 диметилгидантоин),(4-метоксибензолсульфонил)метил,(4-хлорбензолсульфонил)метил, (4-бромбензолсульфонил)метил, (n-бутилсульфонил)метил, (поктилсульфонил)метил,3-(4-метоксибензолсульфонил)пропил, (4-метилбензолсульфонил) метил, (бензолсульфонил)метил, метил-3-(1 метилгидантоин), метил-3-(1-бутилгидантоин) и метил-3-(5,5-диметилгидантоин). Более предпочтительным R2 является (4-метоксибензолсульфонил)метил,(4-хлорбензолсульфонил) метил,(4-бромбензолсульфонил)метил,(nбутилсульфонил)метил,(п-октилсульфонил) метил,3-(4-метоксибензолсульфонил)пропил,(4-метилбензолсульфонил)метил, (бензолсульфонил)метил, метил-3-(1-метилгидантоин), метил-3-(1-бутилгидантоин) и метил-3-(5,5 диметилгидантоин). Особенно предпочтительными соединениями данного изобретения являются следующие:(26) (-)-N-гидрокси-2-[метил-3-(5,5-диметилгидантоин)]-3-(4-метоксибензолсульфонил)пропионамид. Соединения данного изобретения можно синтезировать в соответствии с процессом описанным ниже. На cхеме I R1 и R2 представляют собой группы, определенные ранее. Замещенные малонатные эфиры 2 получают либо готовыми,либо готовят из соединения 1 способами хорошо известными специалистам в данной области. Например, реакция енолята со структурой 1 вызывается соответствующим основанием в соответствующем растворителе, с алкилирующим агентом R2-I (где I это бром, хлор, тозилат, мезилат, эпоксиды и т.д.) дает желаемые замещенные малонатные эфиры 2 См. (Organic Synthesis, 001460Vol. 1 р 250 (1954); Organic Synthesis, Vol. 3 p 495 (1955. Соединение 2 гидролизуют до соединения, представляющего моноэфир кислоты 3, реакцией с одним эквивалентом соответствующего основания, такого как гидроксид щелочного металла в соответствующем растворителе при температуре от 0 до 30 С. Соединение 3, превращают в акриловые эфиры 4 в присутствии формальдегида и пиперидина в соотвествующем растворителе таком как пиридин, этанол, диоксан при температуре дефлегмации. Во многих случаях акриловые эфиры 4 являются коммерчески доступными. Tиoл(H-SR1) добавляют к акриловому эфиру 4 при комнатной температуре, чтобы получить сульфидные эфиры 5 в присутствии либо каталитического количества алкоксида в спиртовом растворителе, либо в присутствии третичного амина в хлорoформе. Полученные сульфиды 5 окисляют до сульфонов 6 окисляющим агентом, таким как метахлорнадбензойная кислота (МХНБК) в соответствующем растворителе, таком как метиленхлорид, либо используя перекись водорода в уксусной кислоте в качестве растворителя. Эфиры можно гидролизовать способами, хорошо известными в данной области, такими как использование 6N НСl и кипячение с обратным холодильником в течение 10-20 ч или использование иодтриметилсилана в хлороформе для получения свободных кислот 7. Взаимодействия кислот 7 с гидрохлоридами гидроксиламина с образованием гидроксаматов можно достичь несколькими способами, хорошо известными специалистам в данной области. Например, кислоты 7 можно активировать хлорэтилформатом в сухом ТГФ или другом подобном растворителе,либо карбодиимид конденсирующим агентом,таким как дихлорэтан (EDC) с/или без гидроксибензтриазола (НОВТ) в ДМФ (DMF) и метиленхлориде. Третичный амин требуется в обоих случаях. Последующая реакция активированного 7 с гидроксиламином дает желаемые производные гидроксамовой кислоты. В другом варианте кислоты 7 можно конденсировать, используя те же реактивы, описанные выше с бензилзащищенным гидрохлоридом гидроксиламина и получить при этом защищенные гидроксаматы 8. Соединения 8 часто легче очищаются и могут быть легко расщеплены методом гидрогенолиза до свободных гидроксаматов, с использованием палладиевого катализатора в спиртовых растворителях. Можно также использовать другие защищенные гидроксиламины, такие как третичный бутилгидроксиламин, и обрабатывая его трифторуксусной кислотой можно получить свободный гидроксамат. Второй способ получения соединений изобретения заключается в использовании готовых акриловых кислот 10, как показано на cхеме II. Обработка акриловых кислот тиолами приводит к образованию соединений 11. Реакцию можно осуществить путем кипячения с обратным хо 11 лодильником в соответствующем растворителе,таком как диоксан, с пиперидином в качестве катализатора. См.(Annelen, Vol. 564, рр 73-78(1949. Вариант этого способа показан на cхемеIII, на которой -бромметилакриловые кислоты 12 реагируют с двумя молями тиолов, образуя бис-сульфиды 13. Окисление полученных сульфидов метахлорнадбензойной кислотой или избытком перекиси водорода дает соединение 7 на cхеме II и соединение 14 на cхеме III, соответственно. Остальные стадии синтеза, которые ведут к соединениям 9 и 15, подобны процессам, показанным на cхеме I. Схемы IV, V, и VI описывают способы,особенно пригодные для получения соединений формулы I, где группа R2 содержит гетероатомы. На cхеме IV заместитель R4 имеет значения, как указано ранее. Группа I в соединении 16 представляет собой бром, хлор, тозилат, мезилат или эпоксиды и может быть замещена агентом R4-XH, согласно способам хорошо известным в данной области (х может быть О, NR7, S и т.д.). Остальные стадии синтеза, которые ведут к образованию соединения 18, аналогичны способам синтеза, которые представлены на cхеме I. На cхеме V соответственно защищенный цистеин (Р в соединении 19 представляет защищающую группу) можно превратить в соответствующий тиол 20. После удаления защищающей группы группу R7, определенную выше, можно присоединить к атому азота, как показано на соединении 23. Дополнительные детали способа, описанного на cхеме V, обсуждаются в Synthesis Communication, Vol. 16, No. 5,p. 565 (1986). Этот способ можно осуществить и с рацематом и с отдельным энантиомером. Осуществляя общие методики, как описано выше, но исходя из энантиомерно обогащенных изомеров, можно получать желательный отдельный энантиомер, или R, или S. На cхеме VI соединение 12 вначале реагирует с одним эквивалентом тиола или сульфината в соответствующем растворителе, таком как толуол, в отсутствие или в присутствии соответствующего основания, такого как бикарбонат натрия или триэтиламин при температуре окружающей среды или температуре дефлегмации с получением соединения 25 или 26, соответственно. Превращение 25 в 26 осуществляют при 0 С с окислителем, таким как метахлорнадбензойная кислота в соответствующем растворителе, таком как метиленхлорид. Чтобы получить промежуточное соединение 7, в котором группа-CH2-Q, проводят реакцию промежуточного соединения 26 с анионом или коньюгатом кислоты W (где W представляет группу присоединенную через гетероатом, такой как атом кислорода, азота или серы) в растворителе, таком как толуол или диметилформамид, в присутст 001460 12 вии или отсутствии основного катализатора,такого как бикарбонат натрия или триэтиламин,предпочтительно реакцию проводить при кипячении с дефлегмацией. Остальные стадии синтеза, которые ведут к целевым гидроксамовым продуктам 9 аналогичны процессам, описанным на cхеме I. В дополнение к cхемам IV, V и VI соединения формулы I, где группа R2 содержит гетероатомы, можно получить в соответствии соcхемой II, используя для этого соединение 12. В данном способе -бромметилакриловую кислоту 12 подвергают взаимодействию с одним эквивалентом аниона или коньюгата кислоты W с образованием акриловых кислот 10, в которых группа R2 может представлять СН 2-W, где W определен выше. Остальные стадии синтеза,которые ведут к конечным гидроксамовым продуктам 9, сходны с процессами, описанными на Схеме II. Когда W представляет тиол или тиолат, сера, содержащаяся в R2, может быть окислена до сульфоксида или сульфона, приводя,например, к несимметричным бис-сульфонил гидроксаматам. Химическое взаимодействие на cхемах I,II, IV и VI протекает с использованием ахиральных или рацемических промежуточных соединений, а чистые энантиомеры целевых продуктов могут быть получены разделением промежуточных продуктов 5-9 или 11, с использованием хиральной хроматографии или классических способов превращений, таких как образование хиральной соли промежуточного продукта 7. Фармацевтические композиции данного изобретения можно приготовить, объединяя соединения формулы I данного изобретения с твердым или жидким фармацевтически приемлемым носителем и, возможно, с фармацевтически приемлемыми адьювантами и эксципиентами, используя для этого стандартные и общепринятые методы. Твердые формы композиций включают пудры, таблетки, рассыпающиеся гранулы, капсулы и свечи. Твердый носитель представляет, по крайней мере, одно вещество,которое также функционирует как разбавитель,ароматизирующее вещество, растворитель,смазка, суспендирующий агент, связующее вещество, фактор дезинтеграции таблеток и капсулирующий агент. Инертные твердые носители включают карбонат магния, стеарат магния,тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, целлюлозные материалы, воск с низкой температурой плавления, кокосовое масло и тому подобное. Жидкие формы включают растворы, суспензии и эмульсии. Например, можно приготовить растворы соединений данного изобретения, растворенные в воде, системах вода-пропиленгликоль и вода-полиэтиленгликоль, возможно содержащих общепринятые красители, ароматизирующие агенты, стабилизаторы и наполнители. 13 Фармацевтическую композицию получают, используя общепринятые способы. Желательно, чтобы вещество было в дозированной в единицах форме, содержащей эффективное количество активного компонента, т.е. соединений формулы I данного изобретения. Количество активного компонента, т.е, соединений формулы I согласно данному изобретению в фармацевтической композиции и в дозированной в единицах форме можно широко изменять или регулировать в зависимости от данного способа применения, активности данного соединения и желаемой концентрации. Обычно количество активного компонента колеблется от 0,5% до 90% от веса композиции. При терапевтическом использовании для лечения пациента, страдающего от или восприимчивого к болезням, связанным с деградацией соединительной ткани или ингибированием различных ферментов из семейства матричных металлопротеиназ, включающих коллагеназу,соединения или фармацевтические композиции из них применяют орально, парентерально и/или местно в дозах, чтобы обеспечить концентрацию т.е. концентрацию активного компонента в крови пациента, которое будет эффективным, чтобы ингибировать эти ферменты. В общем, эффективное количество активного компонента будет примерно от 0,1 до 100 мг/кг. Нужно понимать, что дозы могут варьировать в зависимости от пациента, степени деградации соединительной ткани, которую обрабатывают и особенностей используемых соединений. Также нужно понимать, что примененную вначале дозу можно увеличить с превышением верхнего уровня для того, чтобы быстро достичь желаемый уровень в крови, или первоначальную дозу можно снизить ниже оптимума, а ежедневную дозу можно постепенно увеличивать в процесса лечения в зависимости от ситуации. По желанию ежедневную дозу можно разделить на несколько доз, например на двачетыре приема в день. Соединения данного изобретения ингибируют различные ферменты из семейства матричных металлопротеиназ, главным образом стромелизин и желатиназу и, следовательно,полезны при лечении болезней, связанных с матричной металлоэндопротеиназой, таких как остеоартрит, ревматоидный артрит, септический артрит, нарушение остеогенеза, такое как остеопороз, метастаз опухоли (инвазия и рост),периодонтит, гингивит, язва роговицы, кожная язва, язва желудка, и другие болезни, связанные с деградацией соединительной ткани. Такие болезни и состояния хорошо известны и легко диагносцируются обычным врачом. Фармацевтические композиции для парентерального введения содержат фармацевтически пригодное количество соединений формулы I в виде растворимой соли (кислотно-аддитивной или основной соли), растворенной в фармацев 001460 14 тически пригодном жидком носителе таком как,например, вода для инъекций и соответственно забуфференный изотонический раствор с рН около 3,5-6. Подходящие буфферные смеси включают, например, тринатрий ортофосфат,натрий бикарбонат, натрий цитрат, Nметилглюкамин, L(+)-лизин и L(+)-аргинин. Соединения, соответствующие формуле I,обычно растворяют в носителе в количестве достаточном, чтобы обеспечить фармацевтически пригодную концентрацию для инъекций в пределах от 1 мг/мл до примерно 400 мг/мл. Конечная жидкая фармацевтическая композиция применяется таким образом, чтобы получить выше упомянутую эффективно ингибирующую дозу. Соединения формулы I в соответствии с данным изобретением предпочтительнее применять орально в жидкой и твердой дозированной формах. Соединения данного изобретения и способы их получения будут лучше поняты через предлагаемые примеры, на которые надо смотреть как на иллюстрацию, а не как на ограничение объема изобретения. Пример 1. Получение N-гидрокси 2-[(4 метоксибензолсульфонил)метил]-3-фенилпропионамида. Стадия 1. Получение моноэтилового эфира бензилмалоновой кислоты. Диэтиловый эфир бензилмалоновой кислоты (10 г, 40 ммол) в 25 мл этанола охлаждают до 0 С. Гидроксид калия (2,5 г, 40 ммол), растворенный в 25 мл этанола добавляют по каплям в течение 50 мин. Охлаждающую баню убирают,а смесь перемешивают в течение еще одного часа. Объем растворителя уменьшают, упаривая под вакуумом, а оставшийся раствор выливают в водный раствор бикарбоната натрия и экстрагируют дважды этилацетатом. Водную фазу подкисляют водной 10% НСl и экстрагируют дважды этилацетатом. Органическую фазу высушивают солевой экстракцией, отфильтровывают от безводного сульфата натрия и концентрируют под вакуумом, получая 8,08 г названного в заглавии соединения в виде бесцветного масла. Стадия 2 Получение этилового эфира 2 бензил-2-пропеновой кислоты. Моноэтиловый эфир бензилмалоновой кислоты (8,0 г, 36 ммол), 7 мл пиридина, 0,36 мл(3,6 ммол) пиперидина и 1,06 г (35 ммол) параформальдегида подвергают кипячению с обратным холодильником в атмосфере азота в течение 1,5 ч на масляной бане при 130 С. После охлаждения в течение 0,5 ч смесь разделяют между 100 мл воды и 100 мл гексана. Органиче 15 скую фазу промывают водной 10% НСl, водой,1 М бикарбонатом натрия и рассолом. Ее высушивают над безводным сульфатом натрия под вакуумом, получая 5,8 г названного в заглавии соединения в виде бесцветного масла. Стадия 3. Получение этилового эфира 2[(4-метоксифенилтио)метил]-3-фенилпропеновой кислоты. 4-метоксибензтиол (0,6 мл, 4,7 ммол) в 1 мл этанола охлаждают на ледяной бане с перемешиванием. Добавляют 0,13 мл (0,34 ммол) этанольного раствора этоксида натрия, после 15 мин добавляют по каплям в течение 2 мин 1,0 г(5,3 ммол) этилового эфира 2-бензил-2 пропеновой кислоты в 1 мл этанола. Ледяную баню убирают, а реакционную смесь продолжают перемешивать в течение 17 ч. Смесь упаривают под вакуумом и разделяют между этилацетатом и водной 5% НСl. Затем органическую фазу концентрируют и хроматографируют на силикагеле, элюируя смесью Гексан:ацетон(98:2). При этом получают 1,04 г названного в заглавии соединения в виде бесцветного масла. Стадия 4. Получение этилового эфира 2[(4-метоксибензол-сульфонил)метил]-3 фенилпропионовой кислоты. К раствору этилового эфира 2-[(4-метоксифенилтио)метил]-3-фенилпропионовой кислоты(1,51 г, 4,6 ммол) в 50 мл метиленхлорида, охлажденному на ледяной бане, добавляют 2,17 г(10 ммол) твердого МХНБК порциями в течение 5 мин. Охлаждающую баню убирают, смесь перемешивают при комнатной температуре в течение ночи. Суспензию фильтруют, и твердый осадок промывают метиленхлоридом. Органический раствор экстрагируют тремя порциями 1 М бикарбоната натрия, высушивают экстракцией рассолом, отфильтровывают от безводного сульфата натрия и концентрируют. Хроматография на силикагеле с элюированием смесью метиленхлорид:ацетон (99:1) позволяет получить 1,31 г названного в заглавии соединения в виде бесцветного масла. Стадия 5. Получение 2-[(4-метоксибензолсульфонил)метил]-3-фенилпропионовой кислоты. Смесь 0,56 г (1,5 ммол) этилового эфира 2[(4-метоксибензолсульфонил)метил)-3-фенилпропионовой кислоты и 8 мл 6N НСl нагревают при 115 С в течение 17 ч. Смесь переносят в 100 мл ледяной воды и экстрагируют двумя порциями этилацетата. Органическую фазу экстрагируют 50 мл порциями водного 5% бикарбоната натрия. Раствор бикарбоната выливают на лед и подкисляют концентрированной НСl. Подкисленную водную смесь экстрагируют тремя 50 мл порциями этилацетата, и объединенные органические экстракты концентрируют под вакуумом с выходом 0,45 г названного в заглавии соединения в виде белой твердой массы. 16 Стадия 6. Получение N-бензилокси-2-[(4 метоксибензолсульфонил)метил)-3-фенилпропионамида. Раствор 2-[(4-метоксибензолсульфонил) метил]-3-фенилпропионовой кислоты (1,05 г,3,14 ммол) и 0,69 мл (6,3 ммол) NMM в сухом ТГФ охлаждают в атмосфере азота на ледяной бане. Добавляют по каплям в течение 5 мин этилхлорформат (0,33 мл 3,5 ммол) в 7 мл ТГФ. Суспензию перемешивают при 0 С в течение 10 мин, после чего в нее вводят несколькими порциями тестообразный O-бензилгидроксиламин гидрохлорид (0,64 г, 4 ммол)и NММ (0,44 мл, 4 ммол) в 7 мл ТГФ. Смесь перемешивают 10 мин и оставляют на ночь при 10 С. Смесь нагревают до комнатной температуры в течение 0,5 ч, и затем разделяют между этилацетатом и водной 10% НСl. Органическую фазу промывают водой, тремя порциями 1 М бикарбоната натрия и рассолом. Затем сушат над безводным сульфатом натрия, концентрируют и хроматографируют на силикагеле, элюируя 40%-50% этилацетатом в гексане. Выход составляет 1,26 г названного в заглавии соединения в виде бесцветного масла. Стадия 7. Получение N-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-фенилпропионамида.N-бензилокси-2-[(4-метоксибензолсульфонил)метил)-3-фенилпропионамид (1,25 г, 2,85 ммол) растворяют в 45 мл этанола. Добавляют туда 0,36 г гидроксида палладия на угле (катализатор Перлмана) и суспензию, помещают в стряхивающий аппарат при давлении водорода 15 psi (103,4 кПа) на 2 ч 25 мин. Катализатор отфильтровывают, промывают этанолом и этанольный раствор концентрируют под вакуумом, чтобы выделить после упаривания метиленхлорида 0,875 г названного в заглавии соединения в виде белой твердой массы. 1(стадии 3-7) и допуская непринципиальные вариации в ней, но исходя из тиофенола на стадии 3, получают названное в заглавии соединение в виде твердой белой массы. Н ЯМР (ДМСО)10,6; 8,8; 7,73; 7,58; 7,17; 7,02; 3,60; 3,07; 2,81-2,7; 2,65-2,60; 13 С ЯМР (ДМСО)168,2; 139,4; 138,1; 134,3; 129,9; 129,3; 128,8; 128,0; 126,9; 60,2; 55,8; 38,4; ИК (mull) см-1 3346; 2925; 1633; 1525; 1450; 1284; 1139; МС (ЭУ) м/z 319; 287; 184; 164; 145; 125; 117; 91. Элементный анализ для C16H17NО 4S: расчитано С, 60,17; Н, 5,36; N, 4,39; S,10,04; найдено С, 60,04; Н, 5,46; N, 4,28; S, 9,88. Пример 3. N-гидрокси-2-[(бензолсульфонил)метил]-пропионамида. Стадия 1. Приготовление 2-[(бензолсульфонил)метил]-пропионовой кислоты. К 1 ммол 2-[(бензолтио)метил-пропионовой кислоты в 10 мл метиленхлорида, охлажденного на ледяной бане, добавляют 0,5 г (2,3 ммол) твердой МХНБК несколькими порциями. Реакционную смесь перемешивают 6 ч при комнатной температуре и оставляют на ночь в холодильнике. Суспензию фильтруют, а фильтрат концентрируют и хроматографируют на силикагеле, элюируя сначала 25% этилацетатом и 0,5% уксусной кислотой в гексане, а после этого 50% этилацетатом и 0,5% уксусной кислотой в гексан. После упаривания растворителей получали 0,225 г названного в заглавии соединения в виде твердой белой массы. Стадия 2. Получение N-гидрокси-2[(бензолсульфонил)метил]-пропионамида. Следуя общей методике, описанной в примере 1 (стадии 6-7) и допуская непринципиальные вариации в ней, но исходя из 2[(бензолсульфонил)метил]-пропионовой кислоты на стадии 6, получают названное в заглавии соединение в виде твердой белой массы. 1 Н ЯМР (ДМСО)10,6,: 8,8; 7,87; 7,74; 7,64; 3,53; 3,27; 2,58; 1,05. 13 С ЯМР (ДМСО)170,0; 139,8; 134,4; 129,9; 128,0; 57,6; 32,3; 19,0; МС (ЭУ) м/z 243; 211; 141; 125; 77. Пример 4. Получение N-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамида. 18 Стадия 1. Получение 2-(4-метоксибензолтиометил)-3-(4-метоксибензолтио)-пропионовой кислоты. К перемешиваемой смеси 2-бромметилакриловой кислоты (10 г, 60 ммол) в 125 мл толуола при комнатной температуре добавляют бикарбонат натрия (15 г, 180 ммол) и 4 метоксибензолтиол (16,5 мл, 140 ммол), и полученную смесь подвергают дефлегмации в течение ночи. Смесь разделяют между водным бикарбонатом натрия и этилацетатом, водную фазу подкисляют до рН 2 концентрированной соляной кислотой и экстрагируют этилацетатом. Объединенные органические экстракты концентрируют под вакуумом, при этом получают названное в заглавии соединение в виде твердой белой массы. 1 Н ЯМР (ДМСО)12,1; 7,25; 6,85; 3,74; 3,05; 2,50; 13 С ЯМР (ДМСО)174,60; 159,59; 134,05; 125,57; 115,66; 55,93; 55,63; 45,38; 36,93. Стадия 2. Получение 2-(4-метоксибензолсульфонилметил)-3-(4-метоксибензолсульфонил)-пропионовой кислоты. Перемешиваемую смесь 2-(4-метоксифенилтиометил)-3-(4-метоксифенилтио)-пропионовой кислоты (18,5 г, 5 ммол) в метиленхлориде (250 мл) охлаждают на бане из сухого льда в ацетоне и добавляют небольшими порциями mхлорнадбензойную кхслоту (МХНБК) (54,5 г,213 ммол) в течение приблизительно 30 мин. После перемешивания при комнатной температуре в течение двух дней и выдерживания дополнительно еще один день смесь фильтруют под вакуумом через силикагель 60 (230-400 меш) и фильтрат элюируют вначале хлороформом, а затем смесью хлороформ/метиловый спирт/уксусная кислота (89:10:1). Фильтрат концентрируют и растирают с гексаном, чтобы получить соединение в виде твердой белой массы. Т.пл. 174-5 С. МС (FAB) (бомбардировка быстрыми атомами) м/z 430; 429; 239; 171; 109; 107; 103; 89; 61; 1H ЯМР (ДМСО)7,66; 7,12; 3,86; 3,57; 2,69; 13 С ЯМР (ДМСО)171,57; 163,97; 130,61; 130,12; 115,13; 56,28; 55,84; 30,04; Стадия 3. Получение N-бензилокси-2-(4 метоксибензолсульфонилметил)-3-(4-метоксибензолсульфонил)-пропионамида. В течение ночи перемешивают смесь 2-(4 метоксибензолсульфонилметил)-3-(4-метоксибензолсульфонил)-пропионовой кислоты (5,0 г,12 ммол) в тетрагидрофуране (30 мл) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (4,3 г, 23 ммол), гидрохлорида бензилгидроксидамина (2,3 г, 14 ммол) и дистиллированную воду (30 мл). Смесь фильтруют, получают белый осадок, который растворяют в хло 19 роформе (200 мл) и снова фильтруют. Фильтрат экстрагируют рассолом (100 мл), органическую фазу концентрируют под вакуумом, получаютN-бензилокси-2-(4-метоксибензолсульфонилметил)-3-(4-метоксибензолсульфонил)-пропионамид (2,24 г, 36%). Первоначальный фильтрат от ночной реакции переносят в этилацетат и экстрагируют 10% соляной кислотой, водой, водным бикарбонатом натрия и рассолом, концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. т.пл. 151 С (разл.). 1N-бензилокси-2-(4 метоксибензолсульфонилметил)-3-(4-метоксибензолсульфонил)-пропионамида (5,0 г, 9,4 ммол), катализатора Пeрлмана (0,9 г) и этилового спирта (50 мл) встряхивают при давлении водорода 20 psi при комнатной температуре в течение ночи. Реакционную смесь фильтруют через броунмиллерит AlCaFeO5, а растворимые осадки растворяют с помощью метилового спирта, а затем смеси хлороформ/метиловый спирт (9:1). Объединенные фильтраты концентрируют под вакуумом, чтобы получить N-гидрокси-2-(4 метоксибензолсульфонилметил)-3-(4-метоксибензолсульфонил)-пропионамид в виде твердой белой массы. Т.пл. 173-4,5 С. ИК (mull) 3292; 1640; 1597; 1579; 1500; 1320; 1313; 1304; 1294; 1282; 1266; 1145; 1089; 1023; 838 см-1; 1 Н ЯМР (ДМСО)10,9; 8,9; 7,69; 7,12; 3,87; 3,48; 2,82; 13 С ЯМР (ДМСО)166,13; 163,93; 130,55; 130,20; 115,15; 55,24; 55,97; 33,47. Пример 5. Получение N-гидрокси-2-[(4 хлорбензолсульфонил)метил]-3-(4 хлорбензолсульфонил)-пропионамида. Стадия 1. Получение 2-(4-хлорбензолсульфонилметил)-3-(4-хлорбензолсульфонил)пропионовой кислоты. Следуя общей методике, описанной в примере 4 (стадии 1 и 2), и допуская непринципиальные вариации в ней, но начиная с 4 001460 20 хлортиофенола на стадии 1, получают названное в заглавии соединение в виде твердой белой массы. т.пл. 197 С (разл.) 1 Н ЯМР (ДМСО)7,77; 7,67; 3,74; 3,54; 2,58; 13 С ЯМР (ДМСО)171,24; 139,38; 138,34; 130,26; 129,91; 56,66; 37,59. Стадия 2. Получение N-гидрокси-2-[(4 хлорбензолсульфонил)метил]-3-(4-хлорбензолсульфонил)-пропионамида. Смесь 2-(4-хлорбензолсульфонилметил)-3(4-хлорбензолсульфонил)-пропионовой кислоты(0,25 г, 1,3 ммол) и гидрохлорида гидроксиламина (0,083 г, 1,2 ммол) перемешивают на ледяной бане в течение 20 мин и затем добавляют 4 метилморфолин (0,28 мл, 2,5 ммол) в диметилформамиде (10 мл). После перемешивания в течение ночи при комнатной температуре смесь разделяют между этилацетатом и водной 10% соляной кислотой. Затем органическую фазу экстрагируют водной кислотой, водным бикарбонатом натрия, рассолом, высушивают над безводным сульфатом натрия и концентрируют под вакуумом. Концентрат хроматографируют на силикагеле (230-400 меш) с хлороформ/ацетон/уксусной кислотой (79/20/1) и элюат концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде твердой белой массы, т.пл. 196-7,5 С; МС (FAB) м/z 452; 439; 437; 278; 243; 161; 159; 111; 1 Е ЯМР (ДМСО)10,8; 8,93; 7,78; 7,70; 3,59; 2,77; 13 С ЯМР (ДМСО)165,72; 140,09; 138,08; 130,66; 130,48; 56,01; 33,67. Пример 6. Получение N-гидрокси-2-[(4 бромбензолсульфонил)метил]-3-(4-бромбензолсульфонил)-пропионамида. Следуя общей методике, описанной в примере 5 (стадии 1 и 2) и допуская непринципиальные вариации в ней, но исходя из 4 бромтиофенола на стадии 1, получают названное в заглавии соединение в виде твердой белой массы. Т.пл. 187 С (разл.) МС (FAB) м/z 469; 421; 291; 245; 71; 69; 57; 55; 43; 41; 1 Н ЯМР (ДМСО)10,9; 8,96; 7,85; 7,70 3,61; 2,79; Стадия 1. Получение этилового эфира 2[(n-бутилтио)метил]-3-(n-бутилтио)-пропионовой кислоты. Смесь этилового эфира 4-бромметилакриловой кислоты (1,0 г, 6 ммол), n-бутилтиола(1,4 мл, 13 ммол), карбоната калия (1,7 г, 13 ммол)в абсолютном этиловом спирте (25 мл) перемешивают при комнатной температуре в течение ночи. Смесь переносят в этилацетат,экстрагируют водной 10% соляной кислотой и концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде прозрачного бесцветного масла. 1 Н ЯМР (ДМСО)4,07; 2,72; 2,47; 1,47; 1,36; 1,18; 0,86; 13 С ЯМР (ДМСО)173,08; 60,65; 46,36; 32,89; 31,61; 21,72; 14,52; 13,90. Стадия 2. Получение этилового эфира 2[(n-бутисульфонил)метил]-3-(n-бутилсульфонил)-пропионовой кислоты. После охлаждения к перемешиваемой смеси этилового эфира 2-[(n-бутилтио)метил]-3-(nбутилтио)-пропионовой кислоты (1,0 г, 3,4 ммол) в метиленхлориде (30 мл) добавляют mхлорнадбензойную кислоту (3,0 г, 14 ммол) и смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют и фильтрат концентрируют под вакуумом, чтобы получить этиловый эфир 2-[(n-(бутилсульфонил)метил]-3(n-бутилсульфонил)-пропионовой кислоты в виде прозрачного бесцветного масла. 1 Н ЯМР (ДМСО)4,10; 3,51; 3,38; 3,14; 1,63; 1,39; 1,18; 0,85; 13 С ЯМР (ДМСО) d 170,99; 61,79; 52,82; 52,53; 34,20; 23,72; 21,40; 14,22; 13,89; Стадия 3. Получение 2-[(n-бутилсульфонил)метил]-3-(n-бутилсульфонил)-пропионовой кислоты. Смесь этилового эфира 2-[(n-бутилсульфонил)метил]-3-(n-бутилсульфонил)-пропионовой кислоты (1,0 г, 3,0 ммол) в 6 Н соляной кислоте (20 мл) подвергают дефлегмации в течение ночи. Смесь переносят в дистиллированную воду в экстрагируют этилацетатом. Объединенные органические экстракты концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде прозрачного бесцветного масла. 1 Н ЯМР (ДМСО)3,50; 3,30; 3,14; 1,62; 1,37; 0,87; С ЯМР (ДМСО)172,33; 52,88; 52,48,34,49; 23,75; 21,41; 13,88. Стадия 4. Получение N-гидрокси-2-[(nбутилсульфонил)метил]-3-(n-бутилсульфонил)пропионамида. Следуя общей методике, описанной в примере 4 (стадии 3 и 4) и допуская непринципиальные вариации в ней, но исходя из 2-[nбутилсульфонил)метил]-3-(n-бутилсульфонил)пропионовой кислоты на стадии 3, получают названное в заглавии соединение в виде твердой белой массы. 1 Н ЯМР (ДМСО)10,9; 9,0; 3,37; 3,15; 3,09; 1,63; 1,38; 0,88; 13 С ЯМР (ДМСО)166,52; 52,93; 52,55; 32,58; 23,73; 21,43; 13,90; Пример 8. Получение N-гидрокси-2-[(nоктилсульфонил)метил]-3-(n-октилсульфонил)пропионамида. Следуя общей процедуре, описанной в примере 7 (стадии от 1 до 4) и допуская непринципиальные вариации в ней, но исходя изn-октилтиола на стадии 1, получают названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)10,9; 9,05; 3,40; 3,08; 1,61; 1,32; 1,23; 0,84; МС (FAB) m/z 456, 440, 245, 133, 71, 69,57, 55, 43, 41; 13 С ЯМР (ДМСО)166,53; 52,92; 55,77; 32,60; 31,64; 28,90; 28,87; 28,14; 22,51; 21,71; 14,40; Пример 9. Получение N-гидрокси-2-[(4 метилбензолсульфонил)метил]-3-(4 метилбензолсульфонил)-пропионамида. Стадия 1. Получение 2-[(4-метилбензолсульфонил)метил]-3-(4-метилбензолсульфонил)пропионовой кислоты. Смесь 2-бромметилакриловой кислоты (2,0 г, 12 ммол), р-толуолсульфиновой кислоты, в виде моногидрата натриевой соли (6,4 г, 27 ммол) и бикарбонат натрия (1,0 г, 12 ммол) в толуоле (50 мл) подвергают дефлегмации в течение ночи. Смесь переносят в этилацетат и экстрагируют водной 10% соляной кислотой. Органическую фазу концентрируют под вакуумом и растирают в порошок с гексаном, чтобы 23 получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)7,66; 7,41; 3,47; 2,82; 2,69; 13 С ЯМР (ДМСО)171,46; 145,33; 135,72; 130,44; 128,29; 55,47; 36,15; 21,60; Стадия 2. Получение N-гидрокси-2-[(4 метилбензолсульфонил)метил]-3-(4-метилбензолсульфонил)-пропионамида. К N-метилпирролидину (20 мл), охлажденному на ледяной бане, добавляют 2-[(4 метилбензолсульфонил)метил]-3-(4-метилбензолсульфонил)-пропионовую кислоту (4,4 г, 11 ммол), гидрохлорид 1-(3-диметиламинопропил)3-этилкарбодиимида (4,2 г, 22 ммол) и гидрохлорид гидроксиламина (1,5 г, 22 ммол). После перемешивания в течение ночи при комнатной температуре смесь переносят в этилацетат и экстрагируют водной 10% соляной кислотой,дистиллированной водой, водным бикарбонатом натрия, рассолом и высушивают над безводным сульфатом натрия. Органическую фазу концентрируют под вакуумом и растирают в порошок с гексаном, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Следуя общей процедуре, описанной в примере 9 и допуская непринципиальные вариации в ней, но начиная с натриевой соли бензолсульфиновой кислоты, (2,5 г, 15 ммол) на стадии 1, получают названное в заглавии соединение в виде белой твердой массы. Найдено: С 50,06; Н 4,56; N 3,7; S 16,44; МС (FAB) м/z 386, 385, 384, 383, 351, 279,242, 209, 149, 125; 1 24 Стадия 1. Получение диэтилового эфира 3(4-метоксибензолтио)-пропилмалоновой кислоты. К перемешиваемой смеси диэтилового эфира 3-хлорпропилмалоновой кислоты (2,1 г,8,6 ммол) в диметилформамиде (20 мл) добавляют 4-метоксибензолтиол (1,2 мл, 9,5 ммол) в диметилформамиде (20 мл) и бикарбонат натрия(0,72 г, 8,6 ммол). После перемешивания в течение ночи при комнатной температуре смесь переносят в этилацетат и экстрагируют водной 10% соляной кислотой, дистиллированной водой, водным бикарбонатом натрия, рассолом и затем концентрируют под вакуумом. Концентрат растирают в порошок с гексаном, экстрагируют дистиллированной водой, концентрируют под вакуумом и хроматографируют на силикагеле, используя смесь метиленхлорида и гексана(9:1), чтобы получить названное в заглавии соединение в виде прозрачного бесцветного масла. 1H ЯМР (ДМСО)7,29; 6,89; 4,08; 3,73; 3,45; 2,83; 1,85; 1,49; 1,14; 13 С ЯМР (ДМСО)169,66; 159,19; 133,05; 126,51; 115,52; 61,66; 55,99; 51,48; 34,65; 28,00; 27,01; 14,70. Стадия 2. Получение диэтилового эфира 3(4-метоксибензолсульфонил)-пропилмалоновой кислоты. Перемешиваемую смесь диэтилового эфира 3-(4-метоксибензолтио)-пропилмалоновой кислоты (2,4 г, 7,0 ммол) в хлороформе (150 мл) охлаждают и добавляют небольшими порциямиm-хлорнадбензойную кислоту (3,3 г, 15 ммол). После перемешивания в течение ночи при комнатной температуре смесь переносят в хлороформ/метиловый спирт (9/1) и экстрагируют водным бикарбонатом натрия, рассолом и концентрируют под вакуумом. Концентрат хроматографируют на силикагеле, используя хлороформ/метиловый спирт (99,5/0,5), и элюат концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде прозрачного бесцветного масла. 1 Н ЯМР (ДМСО)7,77; 7,14; 4,06; 3,84; 3,49; 3,26; 1,79; 1,51; 1,11; 13 С ЯМР (ДМСО)169,16; 163,67; 130,92; 115,04; 61,36; 56,23; 54,84; 50,90; 27,03; 20,69; 14,32. Стадия 3. Получение моноэтилового эфира 3-(4-метоксибензолсульфонил)-пропилмалоновой кислоты. К перемешиваемой смеси диэтилового эфира 3-(4-метоксибензолсульфонил)-пропилмалоновой кислоты (2,0 г, 5,4 ммол) в абсолютном этиловом спирте (50 мл) добавляют гидроксид калия (0,41 г, 5,9 ммол) в абсолютном этиловом спирте. После перемешивания в течение ночи при комнатной температуре смесь разделяют между хлороформ/метиловым спиртом и водным гидроксидом натрия. Водную фазу под 25 кисляют концентрированной соляной кислотой,экстрагируют хлороформ/метиловым спиртом(9/1), и органические экстракты концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде прозрачного бесцветного масла. 1 Н ЯМР (ДМСО)7,18; 7,15; 4,06; 3,85; 3,36; 3,27; 1,80; 1,54; 1,13; 13 С ЯМР (ДМСО)170,97; 169,99; 164,03; 131,32; 130;73; 61,54; 56,60; 55,33; 51,57; 27,53; 21,17; 14,73. Стадия 4. Получение этилового эфира 2[(4-метоксибензолсульфонил)пропил)-2-пропеновой кислоты. Смесь моноэтилового эфира 3-(4 метоксибензолсульфонил)-пропилмалоновой кислоты (1,1 г, 3,2 ммол), параформальдегида(0,11 г, 3,5 ммол), пиперидина (0,03 мл, 0,32 ммол), и пиридина (20 мл) подвергают дефлегмации в течение трех часов. Смесь переносят в этилацетат и экстрагируют водной 10% соляной кислотой, дистиллированной водой, водным бикарбонатом натрия, рассолом и органическую фазу концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде прозрачного бесцветного масла. 1 Н ЯМР (ДМСО)7,79; 7,15; 6,05; 5,59; 4,09; 3,84; 3,21; 2,29; 1,67; 1,16; 13 С ЯМР (ДМСО)166,80; 164,05; 139,74; 131,30; 130,78; 126,72; 115,44; 61,17; 56,61; 55,23; 30,45; 22,33; 14,80. Стадия 5. Получение этилового эфира 2[(4-метоксибензолтио)метил]-5-(4-метоксибензолсульфонил)-пентановой кислоты. К перемешиваемой смеси 4-метоксифенилтиола (0,30 мл, 2,2 ммол) в абсолютном этиловом спирте (1 мл), охлажденной на ледяной бане, добавляют раствор этоксида натрия (0,2 мл,0,22 ммол), а через 15 мин этиловый эфир 2-[(4 метоксибензолсульфонил)пропил]-2-пропеновой кислоты (0,70 г, 2,2 ммол) в абсолютном этиловом спирте (2 мл). После перемешивания в течение ночи при температуре окружающей среды смесь переносят в этилацетат и экстрагируют водной 10% соляной кислотой, дистиллированной водой, водным бикарбонатом натрия,рассолом, высушивают над безводным сульфатом натрия и концентрируют под вакуумом. Концентрат растирают в порошок с гексаном,отфильтрованное твердое вещество экстрагируют хлороформом и концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)7,76; 7,31; 7,14; 6,86; 3,96; 3,83; 3,72; 3,16; 2,90; 1,58; 1,44; 1,08; 13 С ЯМР (ДМСО)173,70; 163,70; 159, 18; 133,49; 130,87; 125,42; 115,23; 115,04; 60,56; 56,23; 55,66; 55,00; 45,05; 37,08; 29,88; 20,81; 14,48. 26 Стадия 6. Получение этилового эфира 2[(4-метоксибензолсульфонил)метил]-5-(4 метоксибензолсульфонил)-пентановой кислоты. К перемешиваемой смеси этилового эфира 2-[(4-метоксифенилтио)метил]-5-(4-метоксибензолсульфонил)-пентановой кислоты (0,8 г, 1,8 ммол) в хлороформе (50 мл), охлажденной на ледяной бане, добавляют m-хлорнадбензойную кислоту (0,81 г, 3,7 ммол). После перемешивания в течение ночи при комнатной температуре смесь переносят в этилиацетат, который экстрагируют водным бикарбонатом натрия и рассолом. Органическую фазу концентрируют под вакуумом, растирают в порошок с гексаном,отфильтрованное твердое вещество растворяют в хлороформе. Хлороформную смесь затем экстрагируют водным бикарбонатом натрия и рассолом, а органическую фазу концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)7,75; 7,15; 3,89; 3,85; 3,50; 3,39; 3,16; 2,59; 1,57; 1,42; 1,57; 1,41; 1,08; 13 С ЯМР (ДМСО)172,94; 164,27; 164,06; 131,21; 130,95; 130,73; 115,46; 61,37; 57,29; 56,66; 56,62; 55,17; 30,78; 20,81; 14,65. Стадия 7. Получение 2-[(4-метоксибензолсульфонил)метил]-5-(4 метоксибензолсульфонил)пентановой кислоты. Смесь этилового эфира 2-[(4-метоксибензолсульфонил)метил]-5-(4-метоксибензолсульфонил)пентановой кислоты (0,70 г, 1,4 ммол) в 6 Н соляной кислоте (20 мл) подвергают дефлегмации в течение ночи. Смесь переносят в этилацетат, который экстрагируют водным бикарбонатом натрия. Объединенный водный экстракт подкисляют концентрированной соляной кислотой и экстрагируют этилацетатом. Полученный органический экстракт концентрируют под вакуумом с образованием названного в заглавии соединения в виде белой твердой массы. 1 Н ЯМР (ДМСО)12,5; 7,77; 7,14; 3,85; 3,50; 3,32; 3,16; 2,49; 1,57; 1,45; 13 С ЯМР (ДМСО)174,41; 164,20; 164,03; 131,29; 131,17; 130,90; 130,67; 115,45; 80,03; 57,24; 56,62; 55,28; 30,68; 20,73. Стадия 8. Получение N-бензилокси-2-[(4 метоксибензолсульфонил)метил]-5-(4-метоксибензолсульфонил)-пентанамида. Смесь 2-[(4-метоксибензолсульфонил) метил]-5-(4-метоксибензолсульфонил)-пентановой кислоты (0,5 г, 1,1 ммол) гидрохлорид бензилгидроксиламина (0,21 г, 1,3 ммол), гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (0,42 г, 2,2 ммол) и тетрагидрофуран/вода (1/1, 10 мл) перемешивают при температуре окружающей среды в течение ночи. Смесь переносят в этилацетат, который экстрагируют водной 10% соляной кислотой, дистиллированной водой, водным бикарбонатом натрия и рассолом. Органическую фазу концентрируют под вакуумом, чтобы получить назван 27 ное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)11,2; 7,76; 7,37; 7,12; 4,60; 3,84; 3,78; 3,50; 3,22; 3,10; 2,39; 1,48; 1,35. Стадия 9. Получение N-гидрокси-2-[(4 метоксибензолсульфонил)метил]-5-(4-метоксибензолсульфонил)-пентанамида. Смесь N-бензилокси-2-[(4-метоксибензолсульфонил)метил]-5-(4-метоксибензолсульфонил)-пентанамида (0,3 г, 0,5 ммол), катализатора Перлмана (0,11 г) и абсолютного этилового спирта встряхивают под давлением водорода(15 psi) в течение ночи при комнатной температуре. Смесь фильтруют и фильтрат концентрируют под вакуумом. Концентрат хроматографируют на силикагеле, используя смесь хлороформ/этилацетат/метиловый спирт/уксусная кислота (50/40/10/1) и элюат концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. ИК (mull) 1667, 1596, 1578, 1499, 1317,1294, 1263, 1141, 1089, 1024, 837, см-1 МС (FAB) м/z 473, 472, 391, 371, 149, 129,71, 57, 55, 43; Удельное вращение []25D = 0; 1 Н ЯМР (ДМСО)10,5; 8,8; 7,76; 7,14; 3,86; 3,42; 3,18; 2,3; 1,46. Пример 12. Получение N-гидрокси-2-(nоктилсульфонилметил)-3-(4 метоксибензолсульфонил)-пропионамида. Стадия 1. Получение 2-[(n-октилтио)метил]-2-пропеновой кислоты. Смесь 2-бромметилакриловой кислоты (1,0 г, 6,0 ммол), n-октилтиола (1,2 мл, 6,6 ммол) и диметилформамида (10 мл) подвергают дефлегмации в течение ночи. Смесь затем переносят в этилацетат и экстрагируют водной 10% соляной кислотой и дистиллированной водой. Органическую фазу концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)6,00; 5,60; 3,27; 2,37; 1,46; 1,28; 1,22; 0,84; 13 С ЯМР (ДМСО)167,62; 138,23; 125,42; 32,28; 31,69; 31,07; 29,15; 29,06; 29,02; 28,70; 22,53; 14,37. Стадия 2. Получение 2-[(nоктилтио)метил]-3-(4-метоксибензолтио)пропеновой кислоты. Смесь 2-[(n-октилтиометил]-2-пропеновой кислоты (1,0 г, 4,3 ммол), 4-метоксибензолтиола(1,1 мл, 8,6 ммол), и диметилформамида (25 мл) подвергают дефлегмации в течение ночи. Смесь разделяют между этилацетатом и водной 10% соляной кислотой и органическую фазу концен 001460 28 трируют под вакуумом. Концентрат хроматографируют на силикагеле, используя смесь хлороформ/метиловый спирт/уксусная кислота(98/1/1) и элюат концентрируют под вакуумом,чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)12,5; 7,36; 6,90; 3,73; 3,04; 2,72; 2,55; 2,38; 1,42; 1,21; 0,84; 13 С ЯМР (ДМСО)174,76; 159,33; 133,66; 152,92; 152,95; 115,58; 55,98; 46,02; 36,80; 33,12; 32,28; 32,07; 29,87; 29,56; 29,47; 29,39; 22,93; 14,75. Стадия 3. Получение 2-[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил) пропионовой кислоты. К перемешиваемой смеси 2-[(n-октилтио)метил]-3-(4-метоксибензолтио)-пропеновой кислоты (0,6 г, 1,6 ммол) в хлороформе (15 мл),охлажденной на ледяной бане, добавляют тхлорнадбензойную кислоту (1,4 г, 6,6 ммол). После перемешивания при температуре окружающей среды в течение ночи смесь разделяют между гексаном и водной 10% соляной кислотой и затем водную фазу экстрагируют гексаном и этилацетатом. Этилацетатный экстракт концентрируют под вакуумом и хроматографируют на силикагеле, используя смесь хлороформ/метиловый спирт/уксусная кислота (98/1/1), чтобы получить названное в заглавии вещество в виде белой твердой массы. 1 Н ЯМР (ДМСО)7,80; 7,17; 3,68; 3,61; 3,49; 3,38; 3,02; 1,59; 1,32; 1,23; 0,85. Стадия 4. Получение N-Гидрокси-2-[(nоктилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамида. Следуя общей процедуре, описанной в примере 4 (стадии 3 и 4) и допуская непринципиальные вариации в ней, но исходя из 2-[(nоктилсульфонил)метил-3-(4 метоксибензолсульфонил)-пропионовой кислоты (0,5 г, 1,2 ммол) на стадии 3, получают названное в заглавии соединение в виде белой твердой массы, т.пл. 134,5 С. МС (FAB) м/z 451, 450, 434, 239, 133, 57,43, 41, 39; 1 Н ЯМР (ДМСО)10,9; 8,9; 7,80; 7,15; 3,86; 3,73; 3,50; 3,01; 2,70; 2,36; 1,55; 1,08; 0,82; 13 С ЯМР (ДМСО)166,20; 163,90; 130,82; 130,58; 115,13; 60,87; 56,27; 52,90; 52,68; 44,69; 32,98; 31,63; 28,87, 28,13; 22,51; 21,63; 14,40. Пример 13. Получение N-гидрокси-2[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)]-пропионамида. 29 Стадия 1. Получение 2-[метил-3-(1 метилгидантоин)]-2-пропеновой кислоты. Смесь 2-бромметилакриловой кислоты (1,0 г, 6,0 ммол), 1-метилгидантоина (0,85 г, 7,2 ммол), бикарбоната натрия (1,1 г, 13 ммол), и толуола (50 мл) подвергают дефлегмации в течение ночи. Смесь переносят в этилацетат и экстрагируют водным бикарбонатом натрия. Водную фазу подкисляют концентрированной соляной кислотой и экстрагируют этилацетатом и смесью хлороформ/метиловый спирт (9/1). Концентрирование органических экстрактов приводит к получению названного в заглавии соединения в виде твердой массы. 1 Н ЯМР (ДМСО)6,08; 5,47; 4,08; 4,00; 2,85. Стадия 2. Получение 2-[метил-3-(1 метилгидантоин)]-3-(4-метоксибензолтио)пропионовой кислоты. Смесь 2-метенил-2-[метил-3-(1-метилгидантоин)]-пропеновой кислоты (1,1 г, 5,5 ммол),4-метоксибензолтиола (0,75 мл, 6,0 ммол), бикарбоната натрия (0,92 г, 11 ммол) и толуола (50 мл) подвергают дефлегмации в течение ночи. Смесь концентрируют под вакуумом и хроматографируют на силикагеле, используя смесь хлороформ/метиловый спирт/уксусная кислота(97/2/1). Элюат концентрируют под вакуумом и растирают в порошок с гексаном, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)12,3; 7,33; 6,90; 3,92; 3,74; 3,60; 2,95; 2,83; 2,74; 13 С ЯМР (ДМСО)173,90; 171,02; 159,58; 156,98; 133,87; 152,92; 115,61; 56,02; 62,01; 44,45; 40,13; 35,63; 30,01. Стадия 3. Получение 2-[(метил-3-(1 метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионовой кислоты. Смесь 2-[метил-3-(1-метилгидантоин)]-3(4-метоксибензолтио)-пропеновой кислоты (1,0 г, 3,0 ммол) в метиленхлориде (50 мл) охлаждают и добавляют m-хлорнадбензойную кислоту(1,4 г, 6,3 ммол). После перемешивания при комнатной температуре в течение ночи смесь концентрируют под вакуумом и хроматографируют на силикагеле 60 (230-400 меш), используя смесь хлороформ/метиловый спирт/уксусная кислота (94/5/1). Элюат концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Е ЯМР (ДМСО)7,75; 7,14; 3,87; 3,54; 3,35; 2,92; 2,80. Стадия 4. Получение N-гидрокси-2-[метил 3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамида. Следуя общей процедуре, описанной в примере 4 (стадии 3 и 4) и допуская непринципиальные вариации в них, но начиная с 2[метил-3-(1-метилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионовой кислоты (0,6 г, 1,6 Стадия 1. Получение натриевой соли 4 бутоксибензолсульфиновой кислоты. К перемешиваемой смеси йодида натрия(8,8 г, 58 ммол) в ацетоне (250 мл) добавляют 4 бутоксибензолсульфонилхлорид (5,0 г, 20 ммол). После перемешивания при комнатной температуре в течение ночи смесь фильтруют и отфильтрованное твердо вещество промывают ацетоном, чтобы получить натриевую соль 4 бутоксибензолсульфиновой кислоты в виде белой твердой массы. 1 Н ЯМР(ДМСО)7,49, 5,81, 3,93, 1,67,1,40, 0,90. Стадия 2. Получение 2-[(4-бутоксибензолсульфонил)метил]-2-пропеновой кислоты. Смесь 2-бромметилакриловой кислоты (1,0 г,6,0 ммол) натриевой соли 4 бутоксибензолсульфиновой кислоты (3,1 г, 13 ммол), карбоната натрия (1,9 г, 18 ммол) и диметилформамида (20 мл) подвергают дефлегмации в течение ночи. Затем реакционную смесь разделяют между этилацетатом и водной 10% соляной кислотой и органическую фазу концентрируют под вакуумом. Концентрат хроматографируют на силикагеле 60 (230-400 меш), используя смесь хлороформ/метиловый спирт/уксусная кислота (94/5/1) и элюат концентрируют под вакуумом, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)12,9; 7,67; 7,10; 6,28; 5,70; 4,22; 4,03; 1,68; 1,41; 0,90; 13 С ЯМР (ДМСО)167,04; 163,63; 133,06; 131,33; 130,91; 130,47; 114,08; 68,69; 57,60; 31,33; 19,48; 14,47. Стадия 3. Получение 2-[метил-3-(1 бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионовой кислоты. Смесь 2-[(4-бутоксибензолсульфонил)метил]-2-пропеновой кислоты (1,0 г, 3,4 ммол), 1 бутилгидантоина (0,78 г, 5,0 ммол), бикарбоната натрия (0,63 г, 7,4 ммол) и толуола (50 мл) под 31 вергают дефлегмации в течение ночи. Реакционную смесь переносят в этилацетат, экстрагируют водной 10% соляной кислотой и концентрируют под вакуумом. Концентрат растирают в порошок с гексаном и диэтиловым эфиром, чтобы получить названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)7,73; 7,14; 5,74; 4,07; 3,90; 3,59; 3,54; 3,23; 2,95; 1,72; 1,42; 1,24; 0,93; 0,87; 13 С ЯМР (ДМСО)172,46; 171,21; 163,73; 156,63; 130,89; 130,63; 115,88; 68,73; 55,72; 55,52; 49,94; 42,42; 31,32; 29,83; 20,02; 19,47; 14,47; 14,34. Стадия 4. Получение N-гидрокси-2-[метил 3-(1-бутилгидантоин]-3-(4-бутоксибензолсульфонил)-пропионамида. Следуя общей процедуре, описанной в примере 4 (стадии 3 и 4) и допуская непринципиальные вариации в ней, но исходя из 2[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропеновой кислоты (0,59 г, 1,3 ммол) на стадии 3, получают названное в заглавии соединение в виде белой твердой массы. МС (FAB) м/z 471, 470, 469, 223, 197, 149,57, 41, 23; 1 Следуя общей методике, описанной в примере 14 (стадии с 1 по 4) и допуская непринципиальные вариации в них, но исходя из 4 метоксибензолсульфонилхлорида на стадии 1,получают названное в заглавии соединение в виде белой твердой массы. МС (FAB) м/z 428 (МН+), 429, 428, 223,149, 129, 71, 57, 55, 43, 41; 1 32 Следуя общей методике, описанной в примере 14 (стадии с 1 по 4) и допуская непринципиальные вариации в ней, но исходя из 5,5 диметилгидантоина (1,5 г, 11 ммол) на стадии 3,получают названное в заглавии соединение в виде белой твердой массы. 1 Н ЯМР (ДМСО)10,8; 8,2; 7,77; 7,12; 3,84; 3,41; 3,17; 2,85; 1,21; 13 С ЯМР (ДМСО)177,62; 166,35; 163,82; 155,28; 130,85; 130,49; 115,14; 58,16; 56,26; 55,37; 37,20; 24,95; 24,87. Пример 17. Получение (+)-N-гидрокси-2[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамида и (-)-N-гидрокси-2[(n-октилсульфонил)метил]-3-(4-метоксибензолсульфонил)-пропионамида. Рацемическую смесь N-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-(n-октилсульфонил)пропионамида (пример 12) элюируют с колонки Chiralpak AD абсолютным этиловым спиртом и элюаты, собранные при Rf=13,5 мин и Rf=23,5 мин, концентрируют под вакуумом, чтобы получить энантиомер (17 А)([]25D=+4) и энантиомер (17 В) ([]25D=-4),соответственно. Пример 18. Получение (+)-N-гидрокси-2[метил-3-(1-метилгидантоин)-3-(4-метоксибензолсульфонил)-пропионамида и (-)-N-гидрокси 2-[метил-3-(1-метилгидантоин)]-3-(1-метоксибензолсульфонил)-пропионамида. Рацемическую смесь N-гидрокси-2-[метил 3-(1-метилгидантоин]-3-(4-метоксибензолсульфонил)-пропионамида (пример 13) элюируют с колонки Chiralpak AD абсолютным этиловым спиртом и элюаты, собранные при Rf=8,6 мин иRf=10,5 мин, концентрируют под вакуумом,чтобы получить энантиомеры, 18 А и соответственно 18 В. Пример 19. Получение (+)-N-гидрокси-2[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионамида и (-)-N-гидрокси 2-[метил-3-(1-бутилгидантоин)]-3-(4-бутоксибензолсульфонил)-пропионамида. Рацемическую смесь N-гидрокси-2-[метил 3-(1-бутилгидантоин]-3-(4-бутоксибензолсульфонил)-пропионамида (пример 14) элюируют с колонки Chiralpak AD абсолютным этиловым спиртом и элюаты, собранные при Rf=16,5 минут и Rf=17,8 мин, концентрируют под вакуумом, чтобы получить энантиомер (19 А) ([]25D=-3) и энантиомер (19 В) ([]25D=+3), соответственно. Пример 20. Получение (+)-N-гидрокси-2[метил-3-(1-бутилгидантоин)]-3-(4-метоксибензолсульфонил)-пропионамида и (-)-N-гидрокси 2-[метил-3-(1-бутилгидантоин]-3-(4-метоксибензолсульфонил)-пропионамида. Рацемическую смесь N-гидрокси-2-[метил 3-(1-бутил-гидантоин)]-3-(4-метоксибензолсульфонил)-пропионамида смывают с колонки Chiralpak AD абсолютным этиловым спиртом и 33 элюаты, собранные при Rf=13,4 мин и Rf=15,8 мин, концентрируют под вакуумом, чтобы получить энантиомер (20 А) ([]25D=-4) иcоответственно энантиомер (20 В) ([]25D=+4). Пример 21. Тест на биологическую активность. Ингибиторную активность определяют invitro на одном или более ММП ферментах(стромелизине, желатиназе или коллагеназе),используя метод флуоресцентной оценки концентрации частиц. Ингибитор связывается с ММП ферментами, что препятствует разрушению субстрата стромелизином, желатиназой или коллагеназой. К субстрату присоединяют флуоресцин и биотиновую составляющую. Затем неповрежденный субстрат связывают с частицей, покрытой авидином, через биотиновую составляющую. Как только частица отмыта и высушена, возникает флуоресцентный сигнал,так как флуоресцентная группа оказывается прикрепленной к частице. В отсутствие ингибитора субстрат разрушается под действием ММП ферментов и флуоресцентная группа удаляется,поэтому невозможно обнаружить флуоресцентный сигнал. Испытываемые соединения растворяют в ДМСО до нужной концентрации, затем растворы разбавляют 1:5 с помощью буффера для ММП (50 мМ трис-HCl, рН 7,5; 150 мМNaCl; 0,02% NaN3). Готовят серийные двукратные разбавления каждого соединения. Концентрированный раствор активированного фермента вносят в каждую ячейку с испытуемыми соединениями и смесь инкубируют при комнатной температуре в течение 15 мин. Оттаявший субстрат для ММП добавляют во все ячейки и инкубируют в темноте в течение 1-3 ч при комнатной температуре. На этой стадии образцы смешивают с 0,1% покрытых авидином полистироловых частиц. После 15 мин проводят фильтрование и промывку гранул и затем измеряют величину флуоресценции. Рассчитывают Величины Ки. Данные по ингибированию для соединений данного изобретения показаны в таблице 1. Предполагается, что соединения с низкими значениями Ки являются более эффективными в качестве ингибиторов ММП. Предполагается, что соединение с Ки меньше, чем 15 мкМ в отношении стромелизина обладает терапевтическим действием при повреждениях соединительной ткани. Таблица 1. Константы ингибирования ММП (Ки, мкМ) для соединений данного изобретения ПримерСтромелизин Ки, мкМ Желатиназа Ки, мкМ 1 0,049 0,0092 2 1,1 0,087 3 3,6 0,081 4 0,0039 0,00019 5 0,072 0,0019 6 0,092 0,0025 7 1 0,35 8 0,44 0,19 9 0,13 0,0038 10 0,16 0,008 или его фармацевтически приемлемые соли,где R1 представляет собойa) C1-12 алкил,b) C1-12 алкил, замещенный от одного до трех галогенами, -CN, -NO2, -CF3, -N(R3)2, -SR3,или ОН,с) C2-12 алкенил,d) C2-12 алкенил, замещенный от одного до трех галогенами, -CN, -NO2, -CF3,e) C2-12 алкинил,f) C2-12 алкинил, замещенный от одного до трех галогенами, -CN, -NO2 или -CF3,g) -(CH2)h-C3-8 циклоалкил,h) -(CH2)h-C3-8 циклоалкил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или галогенами,i) -(CH2)h-C3-8 циклоалкенил,j) -(CH2)h-C3-8 циклоалкенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или галогенами,k) -(CH2)h-арил, 001460l) -(СН 2)h-арил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, -CF3, -ОН, -NО 2,-CN, -N(R3)2, -SR3, -SO2(C1-4 алкокси), -C(=O)R3 или NC(=O)R3,m) -(СН 2)h-арил, замещенный от одного до пяти галогенами,n) -(СН 2)h-гет,о) -(CH2)h-гет, замещенный от одного до двух C1-4 алкилами или галогенами,p) -(CH2)h-Q,q) -(CH2)h-Q, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, галогенами или фенилами,r) -(CH2)i-X-R4, где цепь -(CH2)i- может быть необязательно замещена C1-4 алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех галогенами или C1-4 алкилами илиd) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или галогенами,X представляет собойa) Н,b) C1-4 алкил,c) -(СН 2)h-фенил,d) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, галогенами,-NO2 или -CN, илиa) Н,b) C1-4 алкил,c) -(СН 2)h-фенил,d) -(СН 2)h-фенил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или галогенами,e) -C(=O)R3,f) -S(=O)2R3 илиc) -(СН 2)h-фенил, замещенный от одного до трех С 1-4 алкилами, C1-4 алкокси или галогенами; 39 арил представляет собой монокарбоциклическую или дикарбоциклическую ароматическую группу; гет представляет 5-10-членную ненасыщенную гетероциклическую группу, имеющую от одного до трех атомов, выбранных из группы, состоящей из кислорода, азота и серы;Q представляет 5-10-членную насыщенную гетероциклическую группу, имеющую один или два атома, выбранных из группы, состоящей из кислорода, азота и серы;a) C1-12 алкил, замещенный от одного до трех галогенами, -CN, -NO2, -CF3-, -N(R3)2, -SR3 или ОН,b) C2-12 алкенил,c) C2-12 алкенил, замещенный от одного до трех галогенами, -CN, -NO2 или CF3,d) С 2-12 алкинил,e) C2-12 алкинил, замещенный от одного до трех галогенами, -CN, -NO2 или CF3,f) -(СН 2)h-C3-8 циклоалкил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси или галогенами,g) -(CH2)h-C3-8 циклоалкенил,h) -(СН 2)h-С 3-8 циклоалкенил, замещенный от одного до трех С 1-4 алкилами, C1-4 алкокси или галогенами,i) арил,j) арил, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, CF3, -ОН, -NO2, -CN,-N(R3)2, -SR3, -SO2(C1-4 алкокси), -C(=O)R3 или-NC(=O)R3,k) -(СН 2)h-гет,l) -(СН 2)h-гет, замещенный одним или двумя C1-4 алкилами или галогенами,m) -(CH2)i-Q,n) -(CH2)i-Q, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, галогенами или фенилами; о) -(CH2)iX-R4, где цепь -(CH2)i- может быть необязательно замещена C1-4 алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех галогенами или C1-4 алкилами или р) -(CH2)hCHR5R6,где R3, X, R4, R5, R6, R7, R8, арил, гет и Q являются такими, как определены в п.1,h представляет собой 0, 1, 2, 3, 4, 5 или 6, иa) -(CH2)h-гет,b) -(CH2)h-гет, замещенный одним или двумя C1-4 алкилами или галогенами,c) -(CH2)i-Q, 001460d) -(CH2)i-Q, замещенный от одного до трех C1-4 алкилами, C1-4 алкокси, галогенами или фенилами илиe) -(CH2)i-X-R4, где цепь -(СН 2)i- может быть необязательно замещена C1-4 алкилом или фенилом, которые, в свою очередь, могут быть замещены от одного до трех C1-4 алкилами или галогенами,где X, R4, R7, R8, арил, гет и Q определены как в п.1,h представляет собой 0, 1, 2, 3, 4, 5 или 6; иa) -(СН 2)h-пиридил, хинолинил, пирролил,тиенил или тиазолил или индолил, которые могут быть необязательно замещены от одного до трех C1-4 алкилами, C1-4 алкокси, фенилами, фторами, хлорами или бромами,b) -(СН 2)h-пиперидинил, пиперазинил,морфолино, 4-тиоморфолинил, бутиролактамил,2-оксооксазолидинил, или 2,4-диоксоимидазолидинил, которые могут быть необязательно замещены от одного до трех C1-4 алкилами, фенилами, фторами, хлорами, или бромами; где R1 и R2 являются такими, как определены в п.1. 11. Фармацевтическая композиция, содержащая эффективное для ингибирования избыточной матричной металлопротеиназной активности количество соединения по п.1 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61P 1/04, A61K 31/164, C07D 233/72, C07C 317/44
Метки: качестве, ингибиторов, матричных, металлопротеиназ, бетта-сульфонил, гидроксамовые, кислоты
Код ссылки
<a href="https://eas.patents.su/23-1460-betta-sulfonil-gidroksamovye-kisloty-v-kachestve-ingibitorov-matrichnyh-metalloproteinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Бетта-сульфонил гидроксамовые кислоты в качестве ингибиторов матричных металлопротеиназ.</a>
Предыдущий патент: Способ намотки высоковольтной обмотки катушки зажигания
Следующий патент: Способ изготовления контейнера и сам контейнер
Случайный патент: Способ и устройство для полимеризации олефинов в газовой фазе