Оксазолидиноны, обладающие сульфоксиминовой функциональностью
Формула / Реферат
1. Соединение формулы I
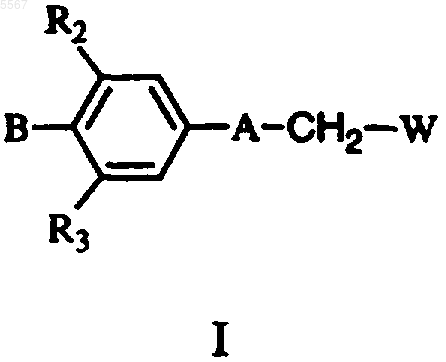
или его фармацевтически приемлемая соль, где
A представляет собой структуру ii
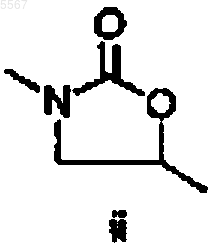
B представляет собой
или

W представляет NHC(=X)R1;
X представляет O или S; при условии, что когда X представляет O, B не является группой из подпункта (b);
R1 представляет метил, циклопропил или пропил;
Z представляет S(=O)(=N-R5);
R2 и R4 представляют H;
R3 представляет F;
R5 представляет H, Me, MeOCO, PhOCO, гидроксиэтил, этоксикарбонилметил, карбамоилметил, 4-нитрофенилкарбамоил, карбомоил, фенилпропил, этил, бензил, ацил;
p равно 2;
j равно 2;
n равно 2.
2. Соединение формулы I, которое является соединением формулы IA
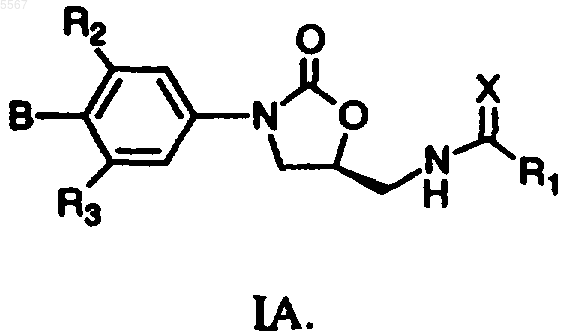
3. Соединение по п.2, где R1 является метилом.
4. Соединение по п.2, где R1 является циклопропилом.
5. Соединение по пп.2-4, где X является атомом серы.
6. Соединение по пп.2-4, где X является атомом кислорода.
7. Соединение по п.5, где R2 представляет H, а R3 является F.
8. Соединение по п.6, где R2 представляет H, а R3 является F.
9. Соединение по п.5, где структура B представляет собой
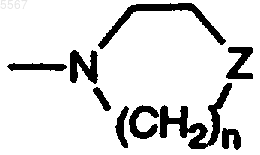
где Z является S(=O)(=NR5).
10. Соединение по п.6, где структура B представляет собой
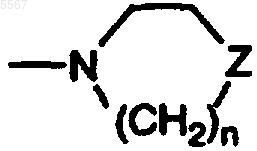
где Z является S(=O)(=NR5).
11. Соединение по п.5, где структура B представляет собой
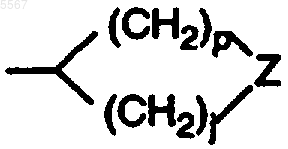
где Z является S(=O)(=NR5).
12. Соединение по п.6, где структура B представляет собой
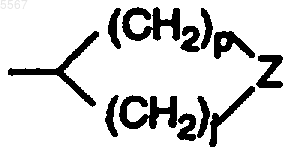
где Z является S(=O)(=NR5).
13. Соединение по пп.9-12, где R5 является H.
14. Соединение по пп.9-12, где R5 представляет собой Me, MeOCO, PhOCO, гидроксиэтил, этоксикарбонилметил, карбамоилметил, 4-нитрофенилкарбамоил, карбомоил, фенилпропил, этил, бензил, ацил.
15. Соединение по пп.9-12, где R5 является CH3 или этилом.
16. Соединение по пп.9-12, где R5 является бензилом, фенилпропилом.
17. Соединение по пп.9-12, где R5 является MeOCO, карбамоилом или карбамоилметилом.
18. Соединение по пп.9-12, где R5 является карбамоилметилом.
19. Соединение по пп.9-12, где R5 представляет собой ацетил.
20. Соединение по пп.9-12, где R5 представляет собой MeOCO.
21. Соединение по п.2, которое представляет собой
(1) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)этантиоамид;
(2) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамид;
(3) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропанкарботиоамид;
(4) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)ацетамида (E)-изомер;
(5) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)этантиоамида (E)-изомер;
(6) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (E)-изомер;
(7) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропанкарботиоамида (E)-изомер;
(8) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)ацетамида (Z)-изомер;
(9) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)этантиоамида (Z)-изомер;
(10) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(11) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропантиоамида (Z)-изомер;
(12) N-({(5S)-3-[3-фтор-4-[1-(ацетилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)ацетамида (Z)-изомер;
(13) N-({(5S)-3-[3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
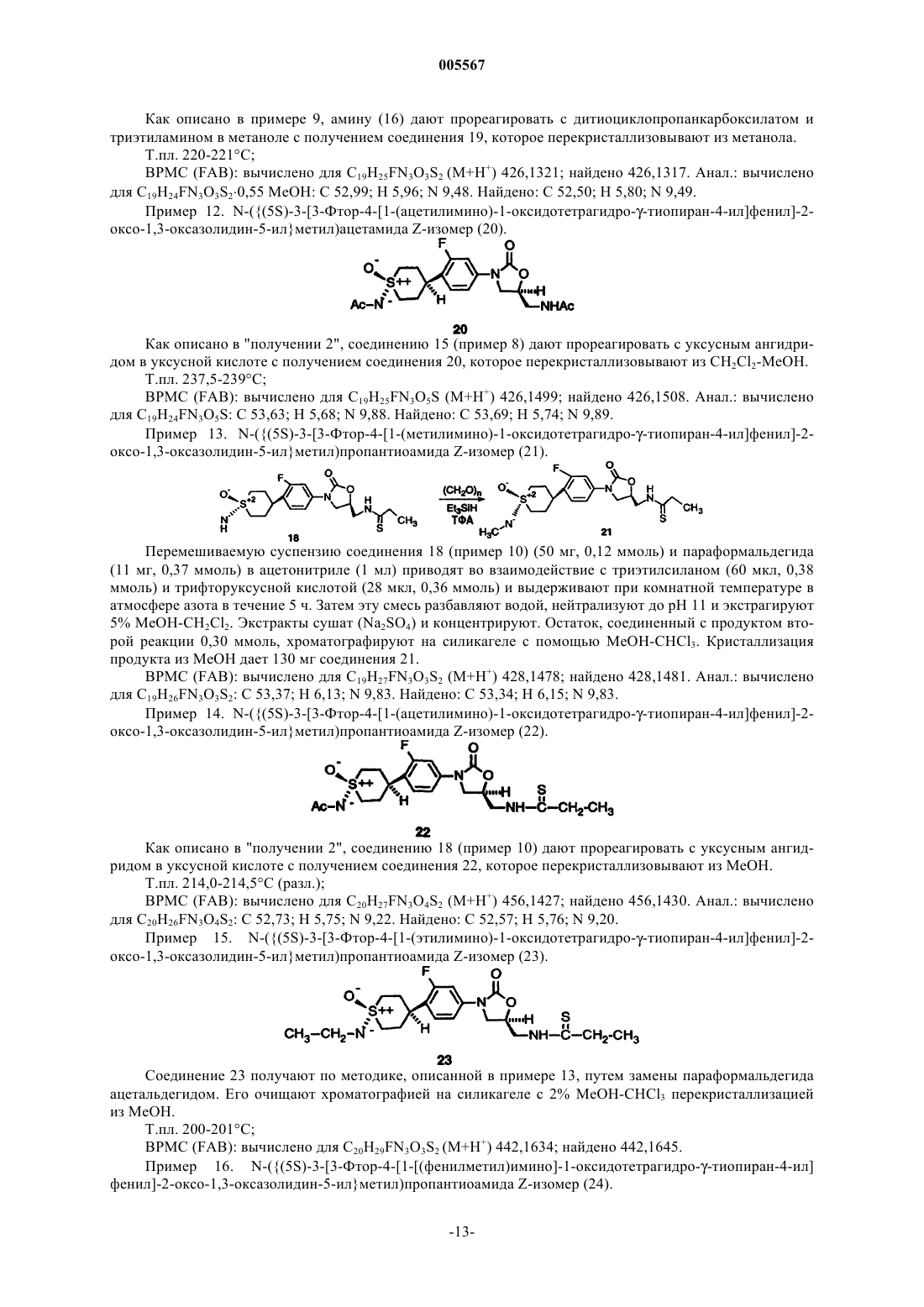
(14) N-({(5S)-3-[3-фтор-4-[1-(ацетилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(15) N-({(5S)-3-[3-фтор-4-[1-(этилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(16) N-({(5S)-3-[3-фтор-4-[1-[(фенилметил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(17) N-({(5S)-3-[3-фтор-4-[1-[(3-фенилпропил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(18) N-({(5S)-3-[3-фтор-4-[1-{[(метиламино)карбонил]имино}-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(19) N-({(5S)-3-[3-фтор-4-(1-[(метоксикарбонил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(20) N-({(5S)-3-[3-фтор-4-(1-[[(этоксикарбонил)метил]имино]-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(21) N-({(5S)-3-[3-фтор-4-(1-{[[(4-нитрофенил)амино]карбонил]имино}-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(22) N-({(5S)-3-[3-фтор-4-[1-[(аминокарбонил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(23) N-({(5S)-3-[3-фтор-4-[1-[[(аминокарбонил)метил]имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(24) N-({(5S)-3-[3-фтор-4-[1-[(2-гидроксиэтил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(25) N-[((5S)-3-{3-фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]пропантиоамид;
(26) N-[((5S)-3-{3-фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамид;
(27) N-[((5S)-3-{3-фтор-4-(1-[(метоксикарбонил)имино]-1-оксидо-1,4-тиазинан-4-ил)фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]пропантиоамид;
(28) N-[((5S)-3-{3-фтор-4-(1-[(метоксикарбонил)имино]-1-оксидю-1,4-тиазинан-4-ил)фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамид;
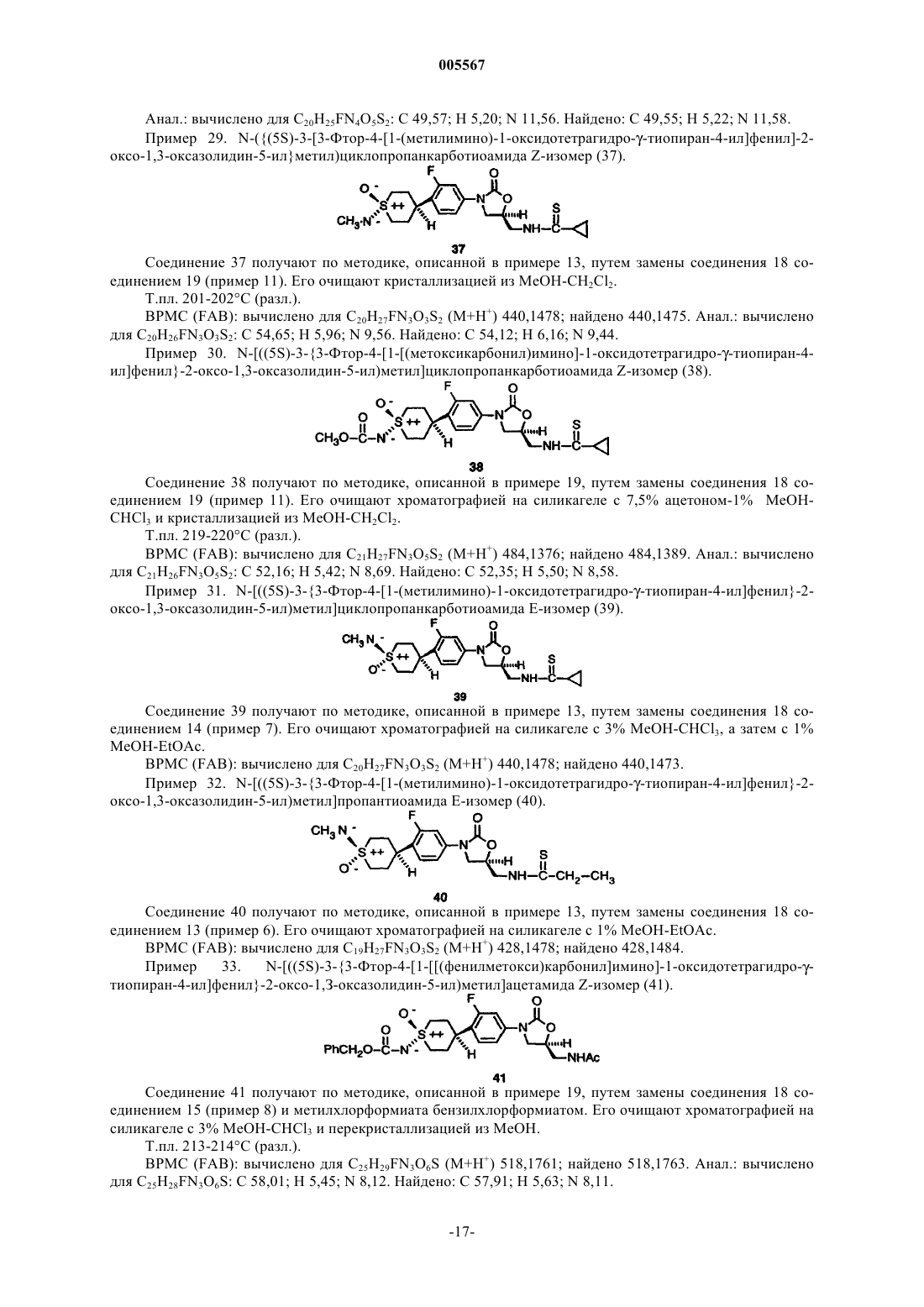
(29) N-({(5S)-3-[3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропанкарботиоамида Z-изомер;
(30) N-[((5S)-3-{3-фтор-4-[1-[(метоксикарбонил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамида Z-изомер;
(31) N-[((5S)-3-{3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамида E-изомер;
(32) N-[((5S)-3-{3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]пропантиоамида E-изомер;
(33) N-[((5S)-3-{3-фтор-4-[1-[[(фенилметокси)карбонил]имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]ацетамида Z-изомер или
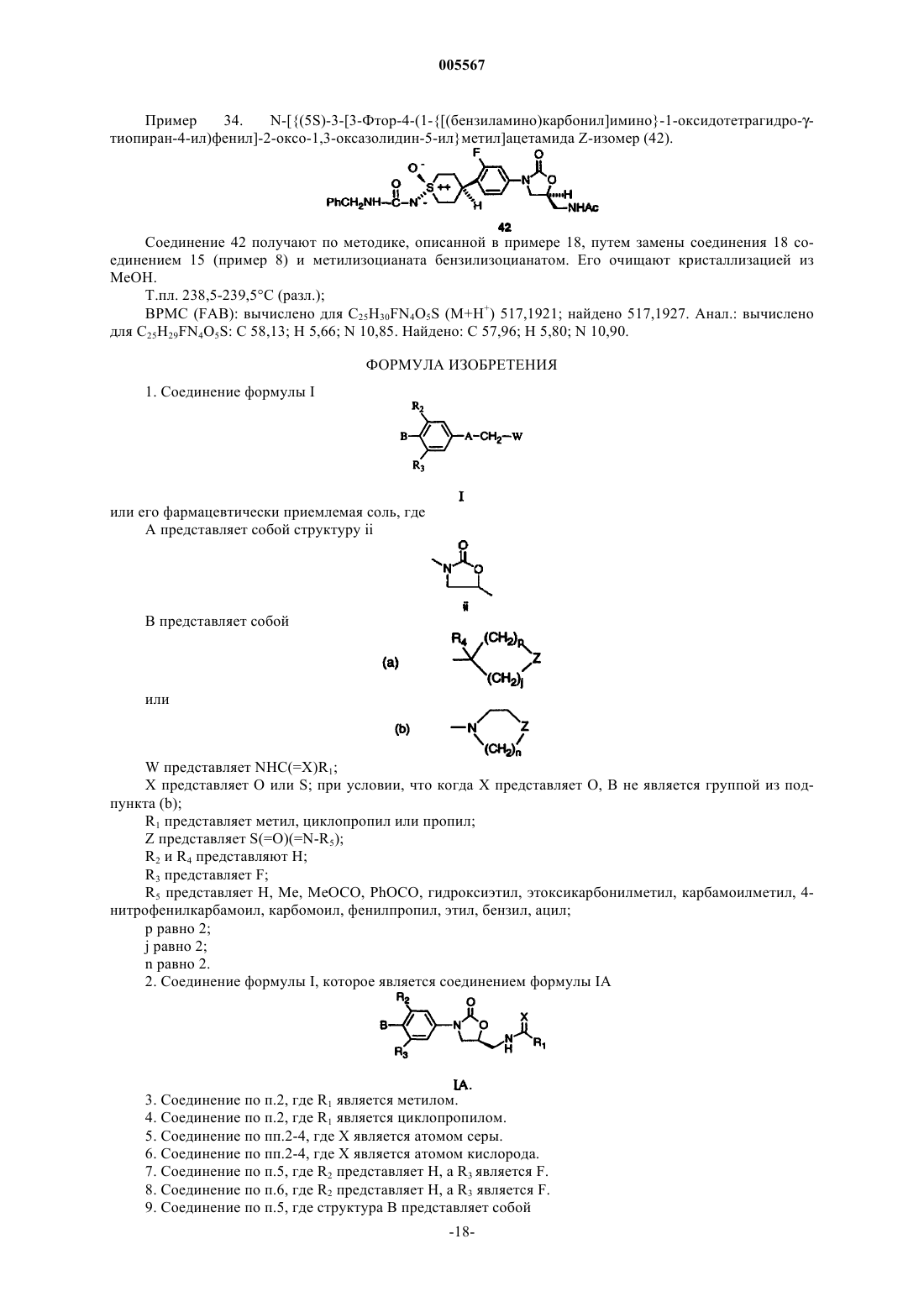
(34) N-({(5S)-3-[3-фтор-4-(1-{[(бензиламино)карбонил]имино}-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)ацетамида Z-изомер.
22. Соединение по п.2, которое представляет собой
(1) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)этантиоамид;
(2) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамид;
(3) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропанкарботиоамид;
(4) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)этантиоамида (Z)-изомер;
(5) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер или
(6) N-({(5S)-3-[3-фтор-4-(1-имино-1-оксидотетрагидро-g-тиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропантиоамида (Z)-изомер.
23. Соединение по п.2, которое представляет собой
(1) N-({(5S)-3-[3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(2) N-({(5S)-3-[3-фтор-4-[1-(ацетилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(3) N-({(5S)-3-[3-фтор-4-[1-[(метоксикарбонил)имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(4) N-({(5S)-3-[3-фтор-4-[1-{[[(4-нитрофенил)амино]карбонил]имино}-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(5) N-({(5S)-3-[3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)циклопропанкарботиоамида (Z)-изомер или
(6) N-[((5S)-3-{3-фтор-4-[1-[(метоксикарбонил]имино]-1-оксидотетрагидро-g-тиопиран-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамида (Z)-изомер.
24. Соединение по п.2, которое представляет собой
(1) N-({(5S)-3-[3-фтор-4-[1-(метилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(2) N-({(5S)-3-[3-фтор-4-[1-(этилимино)-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(3) N-({(5S)-3-[3-фтор-4-[1-{[(метиламино)карбонил]имино}-1-оксидотетрагидро-g-тиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамида (Z)-изомер;
(4) N-({(5S)-3-[3-фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)пропантиоамид или
(5) N-[((5S)-3-{3-фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамид.
25. Применение соединения формулы I, представленной в п.1, для производства лекарственных средств для лечения микробных инфекций.
26. Применение по п.25, где указанное соединение формулы I вводится перорально, парентерально, трансдермально или местно в фармацевтической композиции.
27. Применение по п.25, где указанное соединение вводят в количестве от примерно 0,1 до примерно 100 мг/кг веса тела в сутки.
28. Применение по п.25, где указанное соединение вводят в количестве от примерно 1 до примерно 50 мг/кг веса тела в сутки.
29. Применение по п.25, где указанная инфекция является кожной инфекцией.
30. Применение по п.25, где указанная инфекция является инфекцией глаза.
31. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
Текст
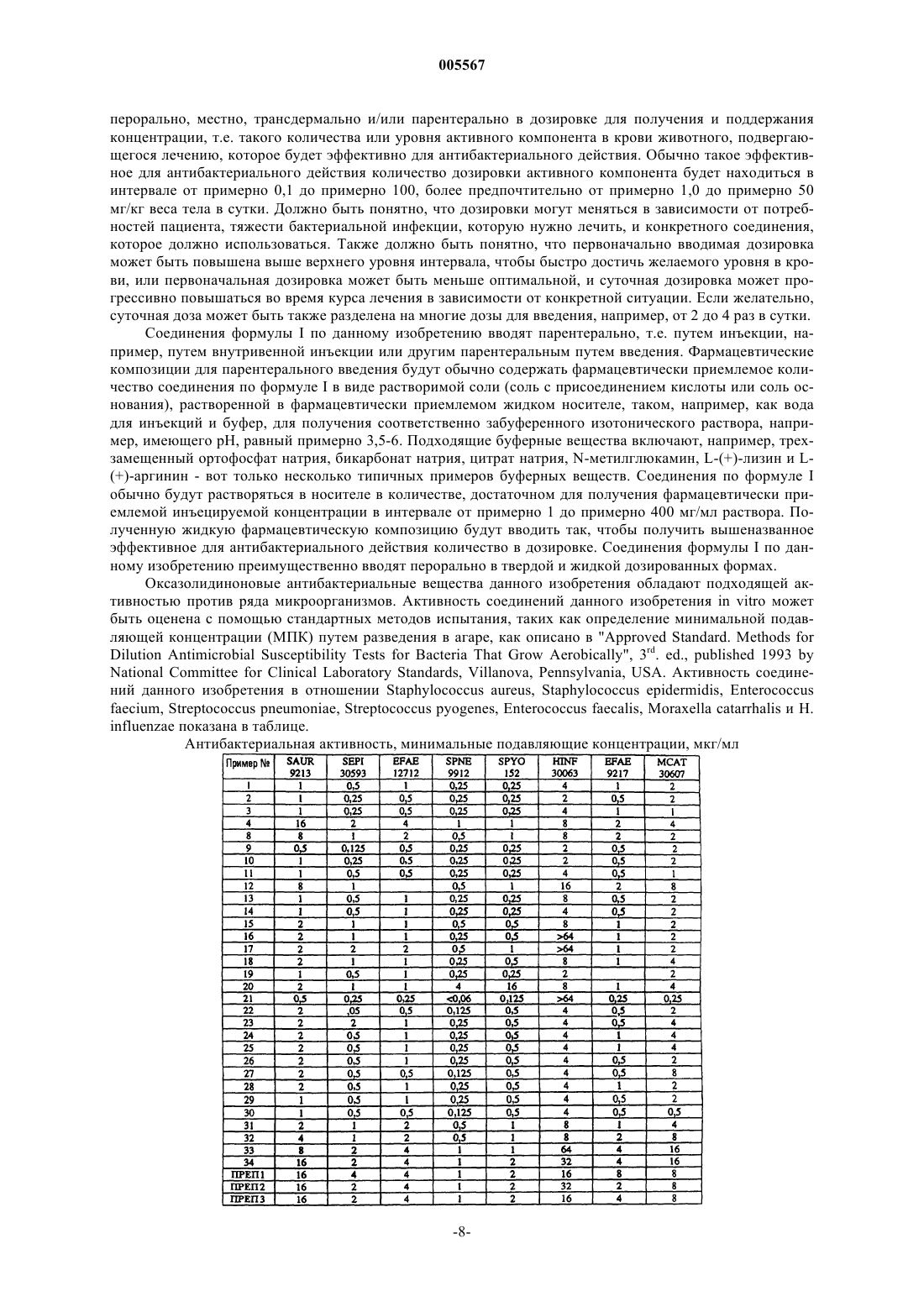
005567 Область изобретения Данное изобретение относится к новым оксазолидинонам, которые обладают сульфоксиминовой функциональностью, и их получению. Эти соединения обладают высокой активностью в отношении грамположительных и грамотрицательных бактерий. Предпосылки создания изобретения Оксазолидиноновые антибактериальные средства являются новой группой синтетических антимикробных средств с высокой активностью против ряда возбудителей заболеваний у людей и животных,включая грамположительные аэробные бактерии, такие как полирезистентные стафилококки и стрептококки, анаэробные микроорганизмы, такие как некоторые виды бактероидов и клостридий, и кислотоустойчивые микроорганизмы, такие как Mycobacterium tuberculosis и Mycobacterium avium. Однако оксазолидиноны в основном не проявляют активности на подходящем уровне против грамотрицательных микроорганизмов. Таким образом, применение оксазолидиноновых антибактериальных средств ограничено инфекционными заболеваниями, вызванными грамположительными бактериями. Соответственно, объектом данного изобретения является получение фармацевтических соединений, которые обладают более широкой антибактериальной активностью, включая активность против аэробных грамотрицательных микроорганизмов. Было открыто, что оксазолидиноны данного изобретения расширяют спектр активности так, что он включает и грамотрицательные микроорганизмы, такие как Haemophilus influenza и Moraxella catarrhalis. Описание предшествующей патентной информации В патенте США 5688792 описаны замещенные оксазины и тиазиноксазолидиноны, пригодные в качестве антибактериальных средств. В публикации РСТ WO 98/54161 описаны оксазолидиноновые антибактериальные средства, обладающие тиокарбонильной функциональностью. В патенте США 5968962 и в публикации РСТ WO 99/29688 описаны фенилоксазолидиноны, имеющие С-С связь с 4-8-членными гетероциклическими кольцами. В патенте США 5952324 описаны бициклический оксазин- и тиазиноксазолидинон, пригодные в качестве антибактериальных средств. В публикациях РСТ WO 99/64416, WO 99/64417 и WO 00/21960 описаны оксазолидиноновые производные, пригодные в качестве антибактериальных средств. В публикации РСТ WO 00/10566 описаны изоксазолиноны, пригодные в качестве антибактериальных средств. Краткое описание изобретения Данное изобретение представляет соединение формулы I или его фармацевтически приемлемую соль, где А представляет собой структуру i, ii, iii или iv-1 005567 Х представляет О или S; при условии, что когда Х представляет О, В не является группой из подпункта (b);(h) (СН 2)рС 3-6 циклоалкил; в каждом случае, алкил или циклоалкил в R1 является необязательно замещенным одним или более из F,Cl или CN;R6 представляет H, C1-4 алкил или фенил; в каждом случае алкил в R5 и R6 является необязательно замещенным одним или более из галогена, CN,NO2, фенила, С 3-6 циклоалкила, OR7, C(=O)R7, OC(=O)R7, C(=O)OR7, S(=O)mR7, S(=O)mNR7R7, NR7SO2R7,NR7SO2NR7R7, NR7C(=O)R7, C(=O)NR7R7, NR7R7, оксо или оксима;R7 представляет H, C1-4 алкил или фенил; в каждом случае фенил является необязательно замещенным одним или более из галогена, CN, NO2, фенила, С 3-6 циклоалкила, OR7, C(=O)R7, OC(=O)R7, C(=O)OR7, S(=O)mR7, S(=O)mNR7R7, NR7SO2R7,NR7SO2NR7R7, NR7C(=O)R7, C(=O)NR7R7 или NR7R7;n равно 2 или 3; и - - - в структуре iii является или двойной связью, или одинарной связью. В другом аспекте данное изобретение представляет также фармацевтическую композицию, содержащую соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель (основу),способ лечения грамположительных бактериальных инфекций у людей и других теплокровных животных путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, и способ лечения грамотрицательных бактериальных инфекций у людей и других теплокровных животных путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Данное изобретение представляет также некоторые новые промежуточные соединения и процессы,которые пригодны для получения соединений формулы I. Детальное описание изобретения Если не указано иначе, применяются следующие определения. Термин алкил, алкенил и т.д. относится как к линейным, так и к разветвленным группам, но упоминание конкретного радикала, такого как "пропил", включает только радикал с прямой цепью, причем изомер с разветвленной цепью, такой как "изопропил", упоминается особо. Содержание атомов углерода в различных углеводородсодержащих составляющих (заместителях) показано префиксом, обозначающим минимальное и максимальное число атомов углерода в составляющей (заместителе), т.е. префикс Ci-j показывает заместитель, содержащий от целого числа "i" до целого числа "j" атомов углерода. Так, например, C1-7 алкил относится к алкилу, содержащему от одного до семи атомов углерода. Термин "галоген" относится к фтору (F), хлору (Сl), брому (Вr) или йоду (I).-2 005567 Термин "het" представляет С-связанное пяти(5)-членное гетероарильное кольцо, имеющее 1-4 гетероатома, выбранных из группы, состоящей из кислорода, серы и азота, или het представляет С-связанное шести(6)-членное гетероарильное кольцо, имеющее 1-3 атома азота. Примеры "het" включают пиридин, тиофен, фуран, пиразол, пиримидин, 2-пиридил, 3-пиридил, 4 пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 4-пиридазинил, 3-пиразинил,4-оксо-2-имидазолил, 2-имидазолил, 4-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 3 пиразолил, 4-пиразолил, 5-пиразолил, 2-оксазолил, 4-оксазолил, 4-оксо-2-оксазолил, 5-оксазолил, 1,2,3 оксатиазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 2-тиазолил, 4 тиазолил, 5-тиазолил, 3-изотиазол, 4-изотиазол, 5-изотиазол, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил,2-пирролил, 3-пирролил, 3-изопирролил, 4-изопирролил, 5-изопирролил, 1,2,3-оксатиазол-1-оксид, 1,2,4 оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 5-оксо-1,2,4-оксадиазол-3-ил, 1,2,4-тиадиазол-3-ил, 1,2,4 тиадиазол-5-ил, 3-оксо-1,2,4-тиадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-оксо-1,3,4-тиадиазол-5-ил, 1,2,4 триазол-3-ил, 1,2,4-триазол-5-ил, 1,2,3,4-тетразол-5-ил, 5-оксазолил, 3-изотиазолил, 4-изотиазолил и 5 изотиазолил, 1,3,4-оксадиазол, 4-оксо-2-тиазолинил или 5-метил-1,3,4-тиадиазол-2-ил, тиазолдион,1,2,3,4-тиатриазол или 1,2,4-дитиазолон. Млекопитающее относится к человеку или животным. Соединения данного изобретения в основном названы по номенклатурной системе ИЮПАК илиCAS. Могут использоваться аббревиатуры, хорошо известные специалистам в данной области (например, "Ph" для фенила, "Me" для метила, "Et" для этила, "час" для часа или часов и "к.т." для комнатной температуры). Конкретные и предпочтительные значения, перечисленные ниже, для радикалов, заместителей и номенклатуры представлены только для иллюстрации; они не исключают другие значения по определению или другие значения в пределах определения для радикалов и заместителей. А именно, алкил обозначает как линейные, так и разветвленные группы; но упоминание конкретного радикала, такого как "пропил", относится только к радикалу с прямой цепью, а изомер с разветвленной цепью, такой как "изопропил", указывается особо. А именно, C1-4 алкил может быть метилом, этилом,пропилом, изопропилом, бутилом, изобутилом, вторичным бутилом и их изомерными формами. Конкретно, C2-4 алкенил может быть винилом, пропенилом, аллилом, бутенилом и их изомерными формами; С 3-6 циклоалкил может быть циклопропилом, циклобутилом, циклопентилом, циклогексилом и их изомерными формами. Конкретным значением для А является структура ii, которой дано определение выше. Конкретным значением для Х является атом серы. Конкретным значением для Х является атом кислорода. Конкретным значением для R1 является C1-4 алкил. Более конкретным значением для R1 является метил или этил. Конкретным значением для R1 является циклопропил. Конкретным значением для R1 является NH2. Конкретным значением для R2 и R3 являются независимо Н и F. Конкретным значением для R2 и R3 является то, что когда один из них представляет собой Н, то другой является F. Конкретным значением для R4 является Н или СН 3. Конкретным значением для R5 является Н. Конкретным значением для R5 является C1-4 алкил, необязательно замещенный ОН. Конкретным значением для R5 является СН 3 или этил. Конкретным значением для R5 является C1-4 алкил, замещенный С(=O)NНС 1-4 алкилом илиC(=O)NH2. Конкретное значение для R5 представляет C1-4 алкил, замещенный фенилом, причем фенил, необязательно, является замещенным ОН, метилом, NO2, СF3 или CN. Конкретное значение для R5 представляет C1-4 алкил, замещенный фенилом, причем фенил, необязательно, является замещенным NO2. Конкретным значением для R5 является C(=O)NH2 или С(=O)NH-C1-4 алкил. Конкретным значением для R5 является С(=O)NНСН 3 или С(=O)NНСН 2 СН 3. Конкретным значением для R5 является С(=O)С 1-4 алкил. Конкретным значением для R5 является С(=O)СН 3. Конкретным значением для R5 является С(=O)OC1-4 алкил. Конкретным значением для R5 является С(=O)ОСН 3. Конкретными значениями для het являются изоксазол-3-ил, изоксазол-5-ил, 1,2,4-оксадиазол-3-ил,изотиазол-3-ил, 1,2,4-тиадиазол-3-ил или 1,2,5-тиадиазол-3-ил. Предпочтительными соединениями данного изобретения являются те, где структуры i, ii или iii имеют оптическую конфигурацию, представленную ниже Более предпочтительными соединениями данного изобретения являются соединения формулы Эти абсолютные конфигурации называются (S)-конфигурацией по номенклатурной системе CahnIngold-Prelog. Опытным специалистам будет понятно, что соединения данного изобретения могут иметь дополнительные хиральные центры и могут быть выделены в оптически активной и рацемической формах. Данное изобретение включает любые рацемические, оптически активные, таутомерные или стереоизомерные формы или их смеси соединения данного изобретения. Примерами данного изобретения являются(34) N-5S)-3-[3-фтор-4-(1-[(бензиламино)карбонил]имино-1-оксидотетрагидротиопиран-4 ил)фенил]-2-оксо-1,3-оксазолидин-5-илметил)ацетамида Z-изомер. В следующих далее схемах описано получение соединений данного изобретения. Все исходные вещества получают с помощью методик, описанных в этих схемах, или по методикам, которые хорошо известны специалисту по органической химии. Переменные, применяемые в данных схемах, указаны ниже или в формуле изобретения. Соединения данного изобретения могут быть получены по одной или более из схем, обсуждаемых ниже. Оптически чистое вещество можно получать или с помощью одного из ряда методов асимметрического синтеза, или альтернативно, путем выделения из рацемической смеси. В схеме I исходные вещества из 1-a могут быть получены по методикам, описанным в патенте США 5688792 или публикации РСТ WO 98/54161. Соединению из 1-а дают возможность прореагировать с азидом натрия в полифосфорной кислоте при температуре в интервале от примерно 40 до примерно 70 С с получением соединения 1-b. Соединение 1-b может быть проалкилировано путем реакции с альдегидами или кетонами и муравьиной кислотой с применением условий реакции Лейкарт-Валлаха или Эшвейлера-Кларка для получения 1-с (R'=C1-4 алкил). Иллюстрация этого способа в отношении метилирования соединения 1-b представлена в "получении 3" данного изобретения. При альтернативном способе для данного алкилирования соединению 1-b или 1-е (R'=Н) дают возможность прореагировать с альдегидом или кетоном, триэтилсиланом и трифторуксусной кислотой. Параформальдегид является удобным источником формальдегида для этой реакции, и можно также использовать альдегиды, защищенные в виде ацеталей. Могут применяться такие растворители, как толуол, дихлорметан, ТГФ, а предпочтительно ацетонитрил, при температурах, зависящих от растворителя, в интервале 10-120 С. Этот способ иллюстрируется в примерах 13 и 16. Для этой реакции можно использовать альдегиды с различными функциональными группами, что иллюстрируется использованием этилглиоксалата в примере 20. Сложный эфир, полученный в этом примере, может быть восстановлен до спирта с помощью борогидрида лития(пример 24) или может быть превращен в амид с помощью гидроксида аммония (пример 23). Соединения, в которых R5 представляет C1-4 алкил, замещенный NH2 или NH-алкилом, могут быть получены с применением защищающей амин группы, такой как бензилоксикарбонил или трет-бутилоксикарбонил,которая затем может быть удалена. Другие соединения, где R5 является замещенным алкилом, могут быть получены с помощью соответствующих модификаций этой процедуры восстановительного алкилирования. Ацетамид 1-с гидролизуют до соответствующего амина, 1-d, с помощью соляной кислоты в таком растворителе, как метанол, при температуре дефлегмации. Ацилирование амина с помощью соответствующих дитиоэфиров и третичноаминового основания, такого как триэтиламин, дает соответствующее соединение 1-е. Для этой реакции подходят такие растворители, как CH2Cl2, ТГФ или предпочтительно МеОН и температура от 24 С до температуры дефлегмации растворителя. Получение других тиокарбонильных соединений 1-е описаны в публикации РСТ WO 98/54161. Когда R' является водородом, 1-е может быть превращено в соединение 1-f с помощью дополнительных функциональных групп у азота сульфоксимина. Реакции с хлорангидридами или ангидридами карбоновых кислот в растворителях, таких как пиридин, при температуре в интервале от примерно 24 до 100 С дают соответствующие ациль-5 005567 ные производные (R5 является С(=O)С 1-4 алкилом). Можно также использовать ангидриды карбоновых кислот в соответствующей карбоновой кислоте в качестве растворителя, что проиллюстрировано в отношении уксусного ангидрида в уксусной кислоте в "получении 2". Карбаматы (R5 является С(=O)ОС 1-4 алкилом) получают путем реакций 1-е (R' является Н) с соответствующими алкилхлорформиатами в пиридине при температуре от 0 до 100 С. Кроме того, для катализа этой реакции можно использовать 4(диметиламино)пиридин, что проиллюстрировано в примере 19. Алкилмочевины и алкилтиомочевины(R6 является C1-4 алкилом) получают нагреванием 1-е (R' является Н) с соответствующим алкилизоцианатом или алкилизотиоцианатом при температуре в интервале от примерно 30 до примерно 100 С. Для этой реакции предпочтительным растворителем является ДМФ. Соединения, где R6 является фенилом или замещенным фенилом, получают одинаково. Соединения, где R6 является водородом, получают путем реакций 1-е (R' является Н) с цианатом натрия или тиоцианатом натрия в уксусной кислоте при температуре в интервале от примерно 24 до примерно 100 С. Для получения соединения, где Х является кислородом, амин 1-d может быть ацилирован с помощью соответствующих карбонильных производных, таких как ангидриды карбоновых кислот, алкилхлорформиаты, алкилизоцианаты и цианат натрия в растворе в уксусной кислоте. Соединения формулы I, где В представляет подпункт (с), могут быть получены методами, показанными на схеме I, с исходным материалом, сульфоксидами. Сульфоксиды могут быть получены по методике, описанной в патенте США 5952324. Схема II иллюстрирует получение соединений 2-е и 2-f. Исходное вещество 2-а может быть получено по методикам, описанным в патенте США 5968962, публикации РСТ WO 99/29688 и публикации РСТ WO 98/54161. В этой серии сульфоксидов может быть или цис-, или транс-связь с бензольным кольцом. Реакция соединений 2-а с O-меситиленсульфонилгидроксиламином (МСГ) происходит с сохранением стереохимии сульфоксида в продуктах 2-b. Эта реакция обычно осуществляется при комнатной температуре в таких растворителях, как дихлорметан. Последующие реакции на схеме II осуществляются, как описано для соответствующих стадий на схеме I. Соединения 2-е, где Х=О, получают ацилированием соединений 2-d с помощью соответствующих карбонильных производных, таких как ангидриды карбоновых кислот, алкилхлорформиаты, алкилизоцианаты и цианат натрия в уксусной кислоте. Схема I Фармацевтические композиции данного изобретения можно получить путем сочетания соединений формулы I данного изобретения с твердой или жидкой фармацевтически приемлемой основой (носителем) и, необязательно, с фармацевтически приемлемыми вспомогательными веществами и наполнителем, применяя стандартные и общепринятые методики. Твердые виды композиций включают порошки,таблетки, диспергируемые гранулы, капсулы, пакетики и суппозитории. Твердая основа (носитель) может быть по меньшей мере одним веществом, которое может функционировать также и в качестве разбавителя, улучшающего вкус и запах вещества, солюбилизатора, смазывающего вещества, суспендирующего вещества, связывающего вещества, таблеточного дезинтегратора и инкапсулирующего средства. Инертные твердые носители включают карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин,декстрин, крахмал, желатин, целлюлозные материалы, воск с низкой температурой плавления, масло какао и т.п. Жидкие формы композиций включают растворы, суспензии и эмульсии. Например, здесь могут быть представлены растворы соединений данного изобретения, растворенных в воде и в системах водапропиленгликоль и вода-полиэтиленгликоль, необязательно содержащих подходящие общепринятые подкрашивающие вещества, вкусовые добавки, стабилизаторы и загустители. Предпочтительно фармацевтическая композиция создается с применением общепринятых методик в единичной дозированной форме, содержащей эффективные или подходящие количества активного компонента, т.е. соединения формулы I по данному изобретению. Количество активного компонента, т.е. соединение формулы I по данному изобретению, в фармацевтической композиции и единичной дозированной формы может изменяться или широко регулироваться в зависимости от конкретного применения, активности конкретного соединения и желаемой концентрации. Обычно количество активного компонента будет находиться в интервале между 0,5 и 90 вес.% от композиции. При терапевтическом использовании для лечения бактериальных инфекций или борьбы с ними у теплокровных животных данные соединения или фармацевтические композиции с ними будут вводиться-7 005567 перорально, местно, трансдермально и/или парентерально в дозировке для получения и поддержания концентрации, т.е. такого количества или уровня активного компонента в крови животного, подвергающегося лечению, которое будет эффективно для антибактериального действия. Обычно такое эффективное для антибактериального действия количество дозировки активного компонента будет находиться в интервале от примерно 0,1 до примерно 100, более предпочтительно от примерно 1,0 до примерно 50 мг/кг веса тела в сутки. Должно быть понятно, что дозировки могут меняться в зависимости от потребностей пациента, тяжести бактериальной инфекции, которую нужно лечить, и конкретного соединения,которое должно использоваться. Также должно быть понятно, что первоначально вводимая дозировка может быть повышена выше верхнего уровня интервала, чтобы быстро достичь желаемого уровня в крови, или первоначальная дозировка может быть меньше оптимальной, и суточная дозировка может прогрессивно повышаться во время курса лечения в зависимости от конкретной ситуации. Если желательно,суточная доза может быть также разделена на многие дозы для введения, например, от 2 до 4 раз в сутки. Соединения формулы I по данному изобретению вводят парентерально, т.е. путем инъекции, например, путем внутривенной инъекции или другим парентеральным путем введения. Фармацевтические композиции для парентерального введения будут обычно содержать фармацевтически приемлемое количество соединения по формуле I в виде растворимой соли (соль с присоединением кислоты или соль основания), растворенной в фармацевтически приемлемом жидком носителе, таком, например, как вода для инъекций и буфер, для получения соответственно забуференного изотонического раствора, например, имеющего рН, равный примерно 3,5-6. Подходящие буферные вещества включают, например, трехзамещенный ортофосфат натрия, бикарбонат натрия, цитрат натрия, N-метилглюкамин, L-(+)-лизин и L(+)-аргинин - вот только несколько типичных примеров буферных веществ. Соединения по формуле I обычно будут растворяться в носителе в количестве, достаточном для получения фармацевтически приемлемой инъецируемой концентрации в интервале от примерно 1 до примерно 400 мг/мл раствора. Полученную жидкую фармацевтическую композицию будут вводить так, чтобы получить вышеназванное эффективное для антибактериального действия количество в дозировке. Соединения формулы I по данному изобретению преимущественно вводят перорально в твердой и жидкой дозированных формах. Оксазолидиноновые антибактериальные вещества данного изобретения обладают подходящей активностью против ряда микроорганизмов. Активность соединений данного изобретения in vitro может быть оценена с помощью стандартных методов испытания, таких как определение минимальной подавляющей концентрации (МПК) путем разведения в агаре, как описано в "Approved Standard. Methods forNational Committee for Clinical Laboratory Standards, Villanova, Pennsylvania, USA. Активность соединений данного изобретения в отношении Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus(S)-N-3-[3-Фтор-4-(1-оксотиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамид (соединение 1, полученное по методике, описанной в WO 95/07271, пример 3) (1,01 г, 2,73 ммоль) и азид натрия (0,38 г, 5,8 ммоль) добавляют при комнатной температуре в атмосфере азота при перемешивании к полифосфорной кислоте (40 г) и смесь нагревают при 50-55 С в течение 6 ч и при 60 С в течение 4 ч,медленно охлаждают до 0 С и приводят во взаимодействие, добавляя каплями, с водой (20 мл) и достаточным количеством 50 вес.% гидроксида натрия для того, чтобы повысить рН до 10,5-11,0. Эту смесь разбавляют достаточным количеством воды, чтобы получить раствор, который экстрагируют СНСl3. Экстракт сушат (Na2SO4) и концентрируют. Хроматография остатка на силикагеле с помощью смесей МеОН-СНСl3, содержащих 2-3% МеОН дает 691 мг продукта. Кристаллизация этого материала из ацетона-гексана дает соединение 2. Т.пл. 165-166 С; ВРМС (FAB): вычислено для C16H22FN4O4S (М+Н+) 385,1346; найдено 385,1352. Анал.: вычислено для C16H21FN4O4S: С 49,99; Н 5,51; N 14,57. Найдено: С 50,01; Н 5,56; N 14,49. Получение 2. N-5S)-3-[3-Фтор-4-(1-ацетилимино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)ацетамид (7). Перемешиваемый раствор соединения 2 (100 мг, 0,26 ммоль) в уксусной кислоте (1 мл) в атмосфере азота приводят во взаимодействие с уксусным ангидридом (55 мкл, 0,58 ммоль), выдерживают при комнатной температуре (24 С) в течение 66 ч и концентрируют под вакуумом. Хроматография остатка на силикагеле с помощью 3% МеОН-СНСl3 дает продукт, который перекристаллизовывают из МеОН с получением 68 мг соединения 7. Т.пл. 219,5-221,0 С; ВРМС (FAB): вычислено для C18H24FN4O5S (M+H+) 427,1451; найдено 427,1458. Анал.: вычислено для C18H23FN4O5S: С 50,69; Н 5,44; N 13,14. Найдено: С 50,64; Н 5,49; N 13,12. Получение 3. N-5S)-3-[3-Фтор-4-(1-метилимино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)ацетамид (8). Перемешиваемую смесь соединения 2 (230 мг, 0,60 ммоль), 37,5% водного раствора формальдегида(75 мкл, 1,0 ммоль) и муравьиной кислоты (75 мкл, 2,0 ммоль) нагревают при 80 С в течение 4 ч, приводят во взаимодействие с дополнительным количеством формальдегида (75 мкл) и муравьиной кислоты(75 мкл) и нагревают при 80 С в течение еще 4 ч. Охлажденную смесь растворяют в СНСl3 и воде и подвергают воздействию 1 н. NaOH до достижения рН 10. Эту смесь экстрагируют СНСl3, и экстракт сушат(Na2SO4) и концентрируют. Остаток объединяют с неочищенным продуктом от такой же реакции с 53 мг соединения 2 и подвергают хроматографии на силикагеле с помощью смесей МеОН-СНСl3, содержащих 2-4% МеОН с получением 140 мг соединения 8. ВРМС (ESI): вычислено для C17H24FN4O4S (M+H+) 399,1502; найдено 399,1498. Пример 1. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксo-1,3-оксазолидин-5-илметил)этантиоамид (4). Перемешиваемую смесь соединения 2 (691 мг, 1,80 ммоль), МеОН (30 мл) и 6 н. соляной кислоты(10 мл) осторожно нагревают с обратным холодильником в течение 21 ч, охлаждают и нейтрализуют (рН 7) 1 н. NaOH. Эту смесь концентрируют под вакуумом и остаток растворяют в небольшом количестве воды, доводят до рН 11 при помощи NaOH и экстрагируют СНСl3 и 5% MeOH-CH2Cl2. Экстракты сушат Перемешиваемый раствор соединения 3 (371 мг, 1,08 ммоль) в МеОН (10 мл) подвергают воздействию триэтиламина (302 мкл, 2,17 ммоль) и этилдитиоацетата (162 мкл, 1,41 ммоль) и нагревали до 40 С в атмосфере азота в течение 17 ч. Твердый продукт подвергают хроматографии на силикагеле с помощьюMeOH-CH2Cl2 и полученный продукт кристаллизуют из EtOH-CH3CN с получением 298 мг соединения 4. Т.пл. 197-198 С; ВРМС (FAB): вычислено для С 16 Н 22FN4O3S2 (М+Н+) 401,1117; найдено 401,1115. Анал.: вычислено для C16H21FN4O3S2: С 47,98; Н 5,28; N 13,99. Найдено: С 47,98; Н 5,34; N 14,01. Пример 2. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-oкco-1,3-оксазолидин-5-илметил)пропантиоамид (5). Как описано в примере 1, стадия 2, реакция соединения 3 с этилдитиопропионатом и триэтиламином в метаноле дает соединение 5, которое кристаллизуется из МеОН. Т.пл. 189-190 С; ВРМС (FAB): вычислено для C17H24FN4 О 3S2 (М+Н+) 415,1273; найдено 415,1278. Анал.: вычислено для C17H23FN4O3S2: С 49,26; Н 5,59; N 13,52. Найдено: С 49,89; Н 5,81; N 13,18. Пример 3. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидо-1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-илметил)циклопропанкарботиоамид (6). Как описано в примере 1, стадия 2, реакция соединения 3 с этилдитиоциклопропанкарбоксилатом и триэтиламином в МеОН дает соединение 6, которое кристаллизуется из МеОН. Т.пл. 209-210 С (разл.); ВРМС (FAB): вычислено для C18H24FN4 О 3S2 (М+Н+) 427,1273; найдено 427,1289. Анал.: вычислено для C18H23FN4O3S2: С 50,69; Н 5,43; N 13,14. Найдено: С 50,70; Н 5,50; N 13,00. Пример 4. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)ацетамида Е-изомер (10). Стадия 1. Перемешиваемый охлажденный льдом раствор этил-О-(меситиленсульфонил)ацетогидроксамата(1,28 г, 4,49 ммоль) в диоксане (3 мл) в атмосфере азота приводят во взаимодействие, добавляя каплями в течение 5 мин, с 70% перхлорной кислотой (0,48 мл, 5,57 ммоль) и выдерживают на ледяной бане в течение 4 ч. Эту смесь затем выливают при перемешивании в ледяную воду (30 мл), перемешивают в течение 30 мин при 0 С и фильтруют. Твердое вещество промывают холодной водой и растворяют в небольшом-10 005567 количестве диэтилового эфира. Раствор промывают водой, сушат (К 2 СО 3), и продукт (Омеситиленсульфонилгидроксиламин, МСГ) кристаллизуют в атмосфере азота из холодного Et2O-пентана.CH2Cl2 раствор этого продукта используют на стадии 2. Стадия 2. Перемешиваемый раствор соединения 9 (S)-транс-(-)-N-3-[3-фтор-4-(тетрагидро-1-оксидо-2 Нтиопиран-4-ил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамида (полученного по методике, описанной вWO 95/07271, пример 9, стадия 1) (470 мг, 1,28 ммоль) в CH2Cl2 (5 мл) подвергают воздействию CH2Cl2 раствора МСГ, полученного на стадии 1, и выдерживают при комнатной температуре (24 С) в течение 19 ч. Эту смесь перемешивают с водой и 5% MeOH-CH2Cl2, добавляют 1 н. NaOH до рН 11 и экстрагируют 5% MeOH-CH2Cl2. Экстракт сушат (Na2SO4) и концентрируют. Хроматография остатка на силикагеле с помощью 2,5% МеОН - 0,1% NH4OH-CH2Cl2 дает соединение 10, которое может быть перекристаллизовано из МеОН. Т.пл. 225-226 С; ВРМС (FAB): вычислено для С 17 Н 23FN3 О 4S (М+Н+) 384,1393; найдено 384,1398. Анал.: вычислено для C17H22FN3O4S: С 53,25; Н 5,78; N 10,96. Найдено: С 53,18; Н 5,90; N 10,79. Пример 5. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)этантиоамида Е-изомер (12). Стадия 1. Перемешиваемую смесь соединения 10 (586 мг, 1,53 ммоль), МеОН (24 мл) и воды (4 мл) подвергают воздействию концентрированной соляной кислоты (4 мл), нагревают с обратным холодильником в течение 22 ч, нейтрализуют 50% NaOH и концентрируют под вакуумом для удаления МеОН. Остаток разбавляют насыщенным раствором соли, добавляют 1 н. NaOH до рН 11 и экстрагируют 5% MeOHCH2Cl2. Экстракт сушат (Na2SO4) и концентрируют с получением 464 мг соединения 11. Стадия 2. Перемешиваемый раствор соединения 11 (159 мг, 0,47 ммоль) в МеОН (5 мл) приводят во взаимодействие с этилдитиоацетатом (73 мкл, 0,64 ммоль) и триэтиламином (130 мкл, 0,93 ммоль), выдерживают при примерно 40 С в течение 24 ч, охлаждают и концентрируют в потоке азота. Хроматография остатка на силикагеле сначала с 2% МеОН - 0,1% Et3N-CHCl3, а затем 4% EtOH - 0,1% Et3N-CHCl3 и кристаллизация продукта из ацетона дает 94 мг названного в заголовке соединения 12. Т.пл. 193-194 С (разл.); ВРМС (FAB): вычислено для С 17 Н 23FN3 О 3S2 (М+Н+) 400,1165; найдено 400,1157. Анал.: вычислено для С 17 Н 22FN3 О 3S2: С 51,11; Н 5,55; N 10,52. Найдено: С 51,07; Н 5,61; N 10,37. Пример 6. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)пропантиоамида Е-изомер (13). Как описано в примере 5, стадия 2, реакция соединения 11 с этилдитиопропионатом и триэтиламином в МеОН при 40 С дает соединение 13, которое кристаллизуется из ацетона. Т.пл. 191-192 С (разл.); ВРМС (FAB): вычислено для C18H25FN3 О 3S2 (М+Н+) 414,1321; найдено 414,1329. Анал.: вычислено для C18H24FN3 О 3S2: С 52,28; Н 5,85; N 10,16. Найдено: С 52,30; Н 5,90; N 10,14. Пример 7. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)циклопропанкарботиоамида Е-изомер (14). Как описано в примере 5, стадия 2, реакция соединения 11 с этилдитиоциклопропанкарбоксилатом и триэтиламином в МеОН при 40 С дает соединение 14, которое кристаллизуется из ацетона-МеОН. Т.пл. 210-211 С (разл.); ВРМС (FAB): вычислено для С 19 Н 25FN3 О 3S2 (М+Н+) 426,1321; найдено 426,1309. Анал.: вычислено для С 19 Н 24FN3 О 3S2: С 53,63; Н 5,68; N 9,87. Найдено: С 53,68; Н 5,74; N 9,84. Пример 8. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)ацетамида Z-изомер (15). Как описано в примере 4, реакция (S)-цис-(-)-N-3-[3-фтор-4-(тетрагидро-1-оксидо-2 Н-тиопиран-4 ил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамида (см. WO 98/54161, пример 7, стадия 1) с МСГ дает соединение 15, которое кристаллизуется из EtOAc. Т.пл. 189,5-190,5 С; ВРМС (FAB): вычислено для C17H23FN3O4S (М+Н+) 384,1393; найдено 384,1389. Анал.: вычислено для C17H22FN3O4S: С 53,25; Н 5,78; N 10,96. Найдено: С 53,21; Н 5,82; N 10,88. Пример 9. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)этантиоамида Z-изомер (17). Как описано в примере 5, соединение 15 гидролизуют 6 н. соляной кислотой в метаноле, и полученный амин (16) конденсируют с этилдитиоацетатом и триэтиламином в метаноле с получением соединения 17, которое кристаллизуют из МеОН. Т.пл. 206-207 С; ВРМС (FAB) : вычислено для С 17 Н 23FN3 О 3S2 (М+Н+) 400,1165; найдено 400,1171. Анал.: вычислено для С 17 Н 22FN3 О 3S2: С 51,11; Н 5,55; N 10,52. Найдено: С 51,65; Н 5,77; N 10,28. Пример 10. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)пропантиоамида Z-изомер (18). Как описано в примере 9, амину (16) дают прореагировать с этилдитиопропионатом и триэтиламином в метаноле с получением соединения 18, которое кристаллизуют из метанола. Т.пл. 211-213 С; ВРМС (FAB): вычислено для С 18 Н 25FN3 О 3S2 (М+Н+) 414,1321; найдено 414,1313. Анал.: вычислено для С 18 Н 24FN3 О 3S2: С 52,28; Н 5,85; N 10,16. Найдено: С 52,33; Н 5,95; N 10,11. Пример 11. N-5S)-3-[3-Фтор-4-(1-имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3 оксазолидин-5-илметил)циклопропантиоамида Z-изомер (19).-12 005567 Как описано в примере 9, амину (16) дают прореагировать с дитиоциклопропанкарбоксилатом и триэтиламином в метаноле с получением соединения 19, которое перекристаллизовывают из метанола. Т.пл. 220-221 С; ВРМС (FAB): вычислено для С 19 Н 25FN3 О 3S2 (М+Н+) 426,1321; найдено 426,1317. Анал.: вычислено для С 19 Н 24FN3 О 3S20,55 МеОН: С 52,99; Н 5,96; N 9,48. Найдено: С 52,50; Н 5,80; N 9,49. Пример 12. N-5S)-3-[3-Фтор-4-[1-(ацетилимино)-1-оксидотетрагидротиопиран-4-ил]фенил]-2 оксо-1,3-оксазолидин-5-илметил)ацетамида Z-изомер (20). Как описано в "получении 2", соединению 15 (пример 8) дают прореагировать с уксусным ангидридом в уксусной кислоте с получением соединения 20, которое перекристаллизовывают из CH2Cl2-MeOH. Т.пл. 237,5-239 С; ВРМС (FAB): вычислено для C19H25FN3 О 5S (М+Н+) 426,1499; найдено 426,1508. Анал.: вычислено для C19H24FN3 О 5S: С 53,63; Н 5,68; N 9,88. Найдено: С 53,69; Н 5,74; N 9,89. Пример 13. N-5S)-3-[3-Фтор-4-[1-(метилимино)-1-оксидотетрагидротиопиран-4-ил]фенил]-2 оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (21). Перемешиваемую суспензию соединения 18 (пример 10) (50 мг, 0,12 ммоль) и параформальдегида(11 мг, 0,37 ммоль) в ацетонитриле (1 мл) приводят во взаимодействие с триэтилсиланом (60 мкл, 0,38 ммоль) и трифторуксусной кислотой (28 мкл, 0,36 ммоль) и выдерживают при комнатной температуре в атмосфере азота в течение 5 ч. Затем эту смесь разбавляют водой, нейтрализуют до рН 11 и экстрагируют 5% MeOH-CH2Cl2. Экстракты сушат (Na2SO4) и концентрируют. Остаток, соединенный с продуктом второй реакции 0,30 ммоль, хроматографируют на силикагеле с помощью МеОН-СНСl3. Кристаллизация продукта из МеОН дает 130 мг соединения 21. ВРМС (FAB): вычислено для С 19 Н 27FN3 О 3S2 (М+Н+) 428,1478; найдено 428,1481. Анал.: вычислено для С 19 Н 26FN3 О 3S2: С 53,37; Н 6,13; N 9,83. Найдено: С 53,34; Н 6,15; N 9,83. Пример 14. N-5S)-3-[3-Фтор-4-[1-(ацетилимино)-1-оксидотетрагидротиопиран-4-ил]фенил]-2 оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (22). Как описано в "получении 2", соединению 18 (пример 10) дают прореагировать с уксусным ангидридом в уксусной кислоте с получением соединения 22, которое перекристаллизовывают из МеОН. Т.пл. 214,0-214,5 С (разл.); ВРМС (FAB): вычислено для С 20 Н 27FN3O4S2 (М+Н+) 456,1427; найдено 456,1430. Анал.: вычислено для С 20 Н 26FN3O4S2: С 52,73; Н 5,75; N 9,22. Найдено: С 52,57; Н 5,76; N 9,20. Пример 15. N-5S)-3-[3-Фтор-4-[1-(этилимино)-1-оксидотетрагидротиопиран-4-ил]фенил]-2 оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (23). Соединение 23 получают по методике, описанной в примере 13, путем замены параформальдегида ацетальдегидом. Его очищают хроматографией на силикагеле с 2% МеОН-СНСl3 перекристаллизацией из МеОН. Т.пл. 200-201 С; ВРМС (FAB): вычислено для С 20 Н 29FN3 О 3S2 (М+Н+) 442,1634; найдено 442,1645. Пример 16. N-5S)-3-[3-Фтор-4-[1-[(фенилметил)имино]-1-оксидотетрагидротиопиран-4-ил] фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (24). Перемешиваемую суспензию соединения 18 (пример 10) (151 мг, 0,37 ммоль) в ацетонитриле (3 мл) приводят во взаимодействие с бензальдегидом (115 мкл, 1,13 ммоль), трифторуксусной кислотой (85 мкл, 1,10 ммоль) и триэтилсиланом (175 мкл, 1,10 ммоль) и выдерживают при 50 С в атмосфере азота в течение 20 ч. Эту смесь перемешивают с водой, нейтрализуют до рН 11 и экстрагируют 5% MeOHCH2Cl2. Экстракт сушат (Na2SO4) и концентрируют. Хроматография остатка на силикагеле сначала с 2% МеОН-СНСl3, а затем 15% ацетоном-1% МеОН-СНСl3 и кристаллизация полученного продукта из МеОН дает соединение 24. Т.пл. 207-208 С; ВРМС (FAB): вычислено для С 25 Н 31FN3 О 3S2 (М+Н+) 504,1790; найдено 504,1796. Анал.: вычислено для С 25 Н 30FN3 О 3S2: С 59,62; Н 6,00; N 8,34. Найдено: С 59,55; Н 6,03; N 8,33. Пример 17. N-5S)-3-[3-Фтор-4-[1-[(3-фенилпропил)имино]-1-оксидотетрагидротиопиран-4 ил]фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (25). Соединение 25 получают по методике, описанной в примере 16, путем замены бензальдегида 3 фенилпропиональдегидом. Т.пл. 165,5-167 С; ВРМС (FAB): вычислено для С 27 Н 35FN3 О 3S2 (M+H+) 532,2104; найдено 532,2114. Анал.: вычислено для С 27 Н 34FN3 О 3S2: С 60,99; Н 6,45; N 7,90. Найдено: С 60,65; Н 6,53; N 7,78. Пример 18. Перемешиваемый раствор соединения 18 (пример 10) (152 мг, 0,37 ммоль) в диметилформамиде (3 мл) в атмосфере азота приводят во взаимодействие с метилизоцианатом (24 мкл, 0,41 ммоль) и выдерживают при комнатной температуре (24 С) в течение 67 ч. Эту смесь концентрируют под вакуумом и остаток подвергают хроматографии на силикагеле с 30% ацетоном-1% МеОН-СНСl3. Кристаллизация продукта из МеОН дает 133 мг соединения 26. Т.пл. 203-204 С; ВРМС (FAB): вычислено для C20H28FN4O4S2 (М+Н+) 471,1536; найдено 471,1538. Анал.: вычислено для C20H27FN4O4S2: С 51,05; Н 5,78; N 11,91. Найдено: С 51,01; Н 5,83; N 11,88. Пример 19. N-5S)-3-[3-Фтор-4-(1-[(метоксикарбонил)имино]-1-оксидотетрагидротиопиран-4 ил)фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (27). Перемешиваемый раствор соединения 18 (пример 10) (151 мг, 0,365 ммоль) и 4(диметиламино)пиридин (5,3 мг, 0,043 моль) в пиридине (3 мл) в атмосфере азота приводят во взаимодействие с метилхлорформиатом (56 мкл, 0,72 ммоль) и выдерживают при комнатной температуре (24 С) в течение 5 ч. Добавляют дополнительное количество метилхлорформиата (56 мкл) и смесь выдерживают при комнатной температуре в течение 2 ч и концентрируют под вакуумом. Хроматография остатка на силикагеле с 2% МеОН-СНСl3 и кристаллизация продукта из ацетонитрила-МеОН дает 132 мг соединения 27. Т.пл. 217-218 С; ВРМС (FAB): вычислено для С 20 Н 27FN3O5S2 (М+Н+) 472,1376; найдено 472,1385. Анал.: вычислено для C20H26FN3O5S2: С 50,92; Н 5,56; N 8,91. Найдено: С 51,02; Н 5,59; N 8,90. Соединение 28 получают по методике, описанной в примере 16, путем замены бензальдегида глиоксалатом. Его очищают хроматографией на силикагеле с помощью 20% ацетона-1% МеОН-СНСl3 и кристаллизацией из МеОН. Т.пл. 183,5-184,5 С; ВРМС (FAB): вычислено для С 22 Н 31FN3O5S2 (М+Н+) 500,1689; найдено 500,1699. Анал.: вычислено для С 20 Н 30FN3O5S2: С 52,89; Н 6,05; N 8,41. Найдено: С 52,76; Н 6,04; N 8,39. Пример 21. N-5S)-3-[3-Фтор-4-(1-(4-нитрофенил)амино]карбонил]имино-1-оксидотетрагидротиопиран-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (29). Перемешиваемую смесь соединения 18 (пример 10) (151 мг, 0,37 ммоль), 4-нитрофенилизоцианата(79 мг, 0,48 ммоль) и диметилформамида (3 мл) выдерживают в атмосфере азота в течение 18 ч и концентрируют под вакуумом. Хроматография остатка на силикагеле с 4% МеОН-СНСl3, а затем с 12,5% ацетоном-1% МеОН-СНСl3 дает продукт, который растирают с MeOH-CH2Cl2 с получением 166 мг соединения 29. Т.пл. 222-228 С; ВРМС (FAB): вычислено для C25H29FN5O6S2 (М+Н+) 578,1543; найдено 578,1534. Анал.: вычислено для C25H28FN5O6S2: С 51,98; Н 4,89; N 12,12. Найдено: С 51,83; Н 4,91; N 12,01. Пример 22. N-5S)-3-[3-Фтор-4-(1-[(аминокарбонил)имино]-1-оксидотетрагидротиопиран-4 ил)фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (30). Перемешиваемый раствор соединения 18 (пример 10) (151 мг, 0,365 ммоль) в уксусной кислоте (5 мл) приводят во взаимодействие с изоцианатом натрия (245 мг, 3,77 ммоль) и выдерживают в атмосфере азота при комнатной температуре в течение 19 ч. Эту смесь концентрируют под вакуумом. Смесь остатка в воде и 5% МеОН-СН 2 Сl2 нейтрализуют до рН 5 1 н. NaOH и затем концентрируют под вакуумом. Смесь остатка, МеОН и силикагеля концентрируют, и остаток экстрагируют 5% МеОН-СНСl3. Экстракт концентрируют и остаток подвергают хроматографии на силикагеле с 5% МеОН-СНСl3, а затем 4% МеОНСНСl3. Кристаллизация продукта из МеОН-СНСl3 дает 50 мг соединения 30. Т.пл. 236-238 С (разл.); ВРМС (FAB): вычислено для C19H26FN4O4S2 (M+H+) 457,1379; найдено 457,1382. Анал.: вычислено для C19H25FN4O4S2: С 49,98; Н 5,52; N 12,27. Найдено: С 49,65; Н 5,61; N 12,05. Пример 23. N-5S)-3-[3-Фтор-4-[1-(аминокарбонил)метил]имино]-1-оксидотетрагидротиопиран-4-ил]фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (31). Перемешиваемую суспензию соединения 28 (пример 20) (161 мг, 0,322 ммоль) в МеОН (13 мл) приводят во взаимодействие с 28% гидроксидом аммония (3,2 мл), выдерживают при комнатной температуре в течение 65 ч и концентрируют под вакуумом. Хроматография остатка на силикагеле с 6% МеОН-СНСl3 и кристаллизация продукта из МеОН дает 98 мг соединения 31. Т.пл. 221-222 С; ВРМС (FAB): вычислено для C20H28FN4O4S2 (M+H+) 471,1536; найдено 471,1540. Анал.: вычислено для C20H27FN4O4S2: С 51,05; Н 5,78; N 11,91. Найдено: С 51,02; Н 5,80; N 11,90. Пример 24. N-5S)-3-[3-Фтор-4-[1-[(2-гидроксиэтил)имино]-1-оксидотетрагидротиопиран-4 ил]фенил]-2-оксо-1,3-оксазолидин-5-илметил)пропантиоамида Z-изомер (32). Перемешиваемый раствор соединения 28 (пример 20) (240 мг, 0,48 ммоль) в ТГФ (5 мл) приводят во взаимодействие с 2,0 М раствором борогидрида лития в ТГФ (0,24 мл, 0,48 ммоль) и выдерживают в атмосфере азота при комнатной температуре в течение 4 ч. Эту смесь затем смешивают с небольшим количеством воды, каплями добавляют достаточное количество 10% водного раствора NaHSO4 для получения рН 2, перемешивают в течение 5 мин и выливают в насыщенный водный раствор NаНСО 3. Показатель рН повышают до 10 1 н. NaOH и смесь экстрагируют 5% MeOH-CH2Cl2. Экстракт сушат (Na2SO4) и концентрируют. Хроматография остатка на силикагеле с 5% MeOH-CH2Cl2 и кристаллизация продукта из МеОН дает 73 мг соединения 32. Т.пл. 180-181 С (разл.); ВРМС (FAB): вычислено для C20H29FN3O4S2 (M+H+) 458,1583; найдено 458,1580. Анал.: вычислено для C20H28FN3O4S2: С 52,50; Н 6,17; N 9,18. Найдено: С 52,64; Н 6,34; N 8,98. Пример 25. N-[5S)-3-3-Фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил-2-оксо-1,3 оксазолидин-5-ил)метил]пропантиоамид (33). Соединение 33 получают по методике, описанной в примере 13, путем замены соединения 18 соединением 5 (пример 2). Его очищают хроматографией на силикагеле сначала с помощью 20% ацетона 1% МеОН-СНСl3, а затем 4% МеОН-СНСl3. ВРМС (FAB): вычислено для С 18 Н 26FN4O3S2 (M+H+) 429,1430; найдено 429,1436. Пример 26. N-[5S)-3-3-Фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил-2-оксо-1,3 оксазолидин-5-ил)метил]циклопропанкарботиоамид (34). Соединение 34 получают по методике, описанной в примере 13, путем замены соединения 18 соединением 6 (пример 3). Его очищают хроматографией на силикагеле с 3% MeOH-CH2Cl2. ВРМС (FAB): вычислено для С 19 Н 26FN4O3S2 (М+Н+) 441,1430; найдено 441,1425. Анал.: вычислено для C19H25FN4O3S2: С 51,80; Н 5,72; N 12,72. Найдено: С 51,60; Н 6,03; N 12,34. Пример 27. N-[5S)-3-3-Фтор-4-(1-[(метоксикарбонил)имино]-1-оксидо-1,4-тиазинан-4-ил)фенил 2-оксо-1,3-оксазолидин-5-ил)метил]пропантиоамид (35). Соединение 35 получают по методике, описанной в примере 19, путем замены соединения 18 соединением 5 (пример 2). Его очищают хроматографией на силикагеле с 3% МеОН-СНСl3 и кристаллизацией из ацетонитрила-МеОН. Т.пл. 211-212 С. ВРМС (FAB): вычислено для C19H26FN4O5S2 (М+Н+) 473,1328; найдено 473,1329. Анал.: вычислено для C19H25FN4O5S2: С 48,29; Н 5,33; N 11,86. Найдено: С 48,34; Н 5,41; N 11,87. Пример 28. Соединение 36 получают по методике, описанной в примере 19, путем замены соединения 18 соединением 6 (пример 3). Его очищают хроматографией на силикагеле сначала с 2,5% МеОН-СНСl3, а затем с 10% ацетоном-СНСl3 и кристаллизацией из ацетонитрила-МеОН. Т.пл. 208-209 С (разл.). Соединение 37 получают по методике, описанной в примере 13, путем замены соединения 18 соединением 19 (пример 11). Его очищают кристаллизацией из МеОН-СН 2 Сl2. Т.пл. 201-202 С (разл.). ВРМС (FAB): вычислено для С 20 Н 27FN3 О 3S2 (М+Н+) 440,1478; найдено 440,1475. Анал.: вычислено для С 20 Н 26FN3 О 3S2: С 54,65; Н 5,96; N 9,56. Найдено: С 54,12; Н 6,16; N 9,44. Пример 30. N-[5S)-3-3-Фтор-4-[1-[(метоксикарбонил)имино]-1-оксидотетрагидротиопиран-4 ил]фенил-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамида Z-изомер (38). Соединение 38 получают по методике, описанной в примере 19, путем замены соединения 18 соединением 19 (пример 11). Егo очищают хроматографией на силикагеле с 7,5% ацетоном-1% МеОНСНСl3 и кристаллизацией из MeOH-CH2Cl2. Т.пл. 219-220 С (разл.). ВРМС (FAB): вычислено для C21H27FN3O5S2 (M+H+) 484,1376; найдено 484,1389. Анал.: вычислено для C21H26FN3O5S2: С 52,16; Н 5,42; N 8,69. Найдено: С 52,35; Н 5,50; N 8,58. Пример 31. N-[5S)-3-3-Фтор-4-[1-(метилимино)-1-оксидотетрагидротиопиран-4-ил]фенил-2 оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамида Е-изомер (39). Соединение 39 получают по методике, описанной в примере 13, путем замены соединения 18 соединением 14 (пример 7). Его очищают хроматографией на силикагеле с 3% МеОН-СНСl3, а затем с 1% Соединение 40 получают по методике, описанной в примере 13, путем замены соединения 18 соединением 13 (пример 6). Его очищают хроматографией на силикагеле с 1% MeOH-EtOAc. ВРМС (FAB): вычислено для С 19 Н 27FN3 О 3S2 (М+Н+) 428,1478; найдено 428,1484. Пример 33. Соединение 41 получают по методике, описанной в примере 19, путем замены соединения 18 соединением 15 (пример 8) и метилхлорформиата бензилхлорформиатом. Его очищают хроматографией на силикагеле с 3% МеОН-СНСl3 и перекристаллизацией из МеОН. Т.пл. 213-214 С (разл.). ВРМС (FAB): вычислено для С 25 Н 29FN3 О 6S (М+Н+) 518,1761; найдено 518,1763. Анал.: вычислено для C25H28FN3O6S: С 58,01; Н 5,45; N 8,12. Найдено: С 57,91; Н 5,63; N 8,11. Соединение 42 получают по методике, описанной в примере 18, путем замены соединения 18 соединением 15 (пример 8) и метилизоцианата бензилизоцианатом. Его очищают кристаллизацией из МеОН. Т.пл. 238,5-239,5 С (разл.); ВРМС (FAB): вычислено для C25H30FN4O5S (M+H+) 517,1921; найдено 517,1927. Анал.: вычислено для C25H29FN4 О 5S: С 58,13; Н 5,66; N 10,85. Найдено: С 57,96; Н 5,80; N 10,90. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль, где А представляет собой структуру iiW представляет NHC(=X)R1; Х представляет О или S; при условии, что когда Х представляет О, В не является группой из подпункта (b);n равно 2. 2. Соединение формулы I, которое является соединением формулы IAN-[5S)-3-3-фтор-4-[1-(метилимино)-1-оксидо-1,4-тиазинан-4-ил]фенил-2-оксо-1,3-оксазолидин-5-ил)метил]циклопропанкарботиоамид. 25. Применение соединения формулы I, представленной в п.1, для производства лекарственных средств для лечения микробных инфекций. 26. Применение по п.25, где указанное соединение формулы I вводится перорально, парентерально,трансдермально или местно в фармацевтической композиции. 27. Применение по п.25, где указанное соединение вводят в количестве от примерно 0,1 до примерно 100 мг/кг веса тела в сутки. 28. Применение по п.25, где указанное соединение вводят в количестве от примерно 1 до примерно 50 мг/кг веса тела в сутки. 29. Применение по п.25, где указанная инфекция является кожной инфекцией. 30. Применение по п.25, где указанная инфекция является инфекцией глаза. 31. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: C07D 417/10
Метки: оксазолидиноны, функциональностью, обладающие, сульфоксиминовой
Код ссылки
<a href="https://eas.patents.su/22-5567-oksazolidinony-obladayushhie-sulfoksiminovojj-funkcionalnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Оксазолидиноны, обладающие сульфоксиминовой функциональностью</a>
Предыдущий патент: Способ удаления кальция из сульфатного раствора процесса получения цинка
Следующий патент: Тиксотропная дезинфицирующая композиция гидрогеля
Случайный патент: Гербицидные смеси