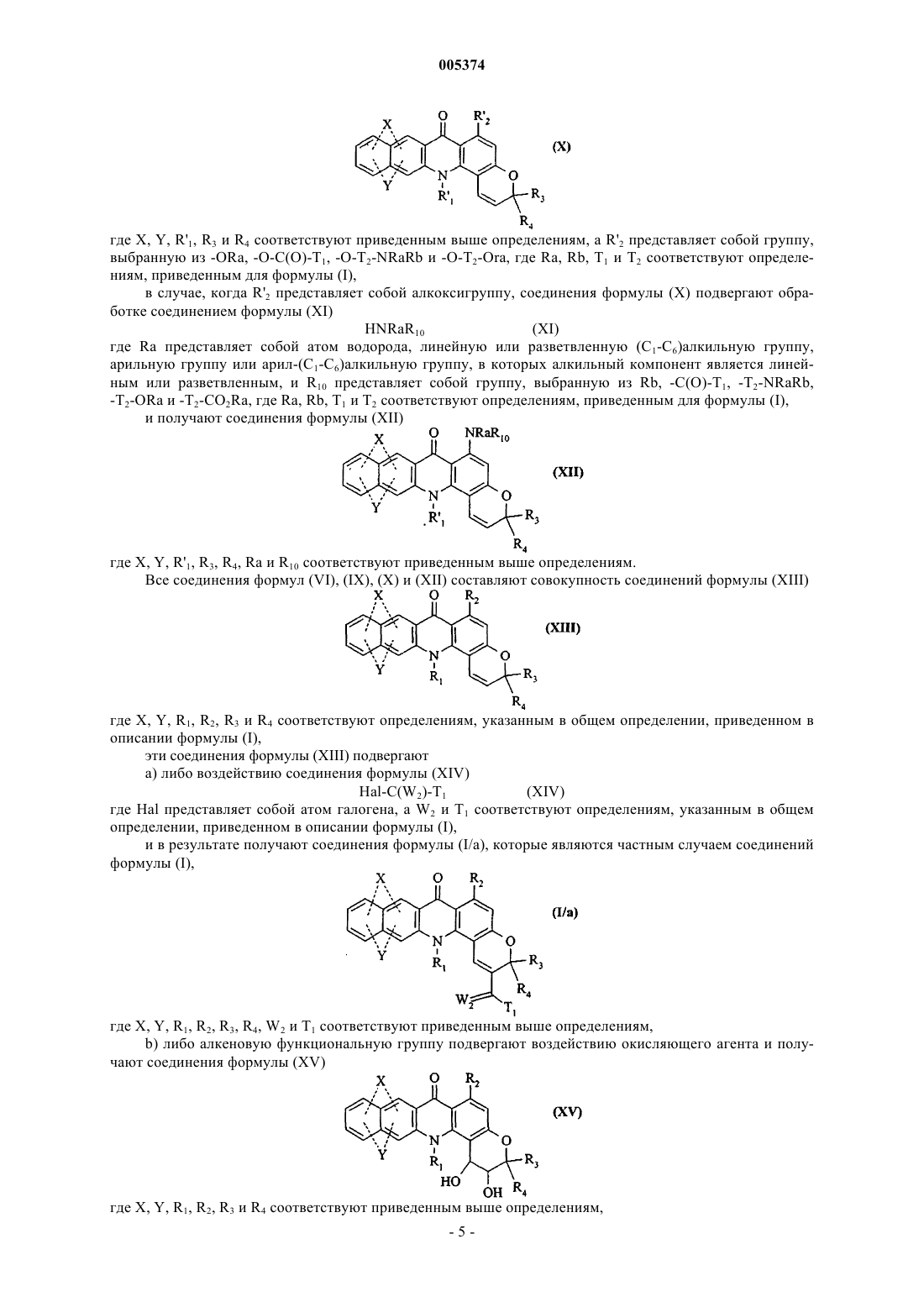
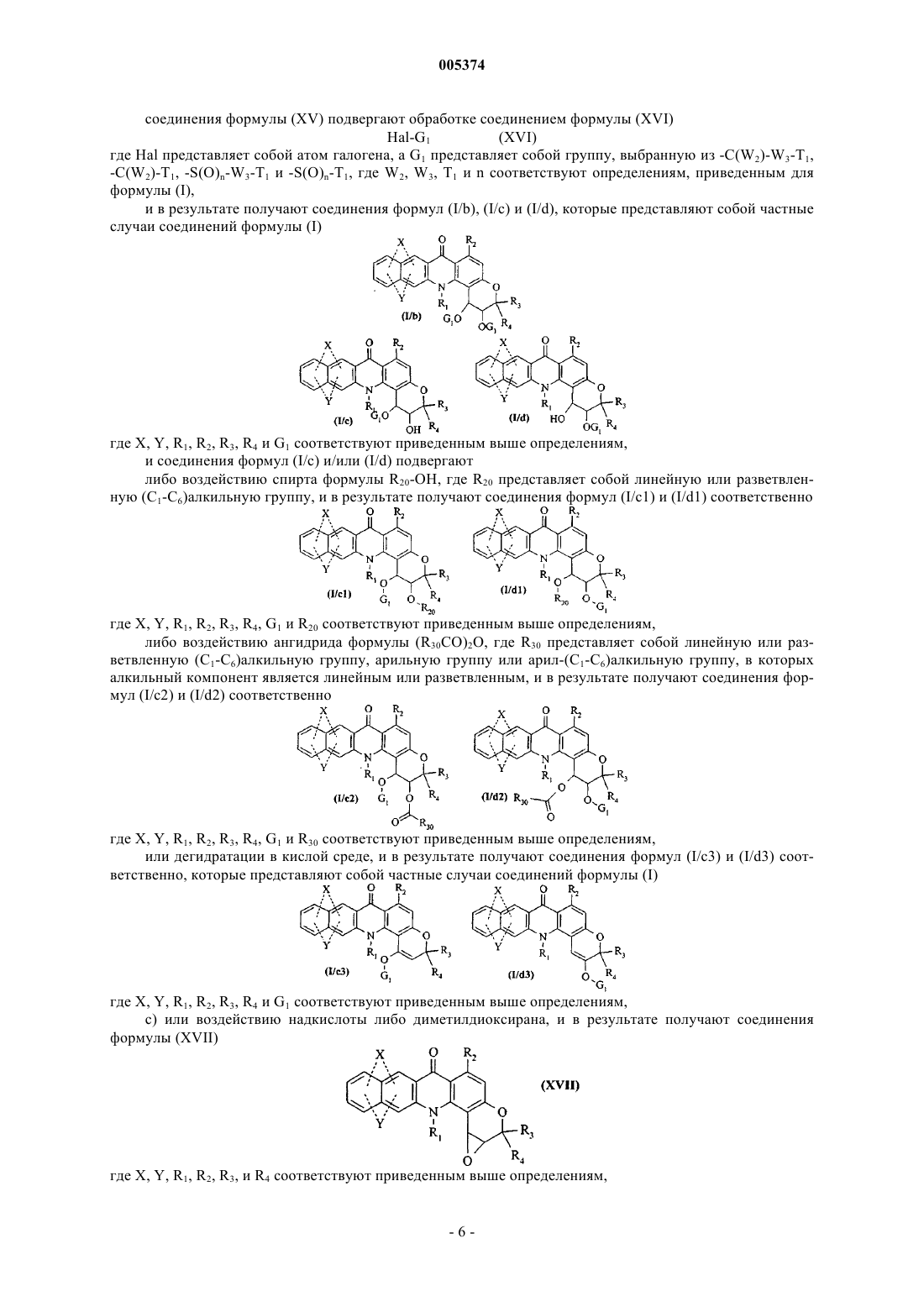
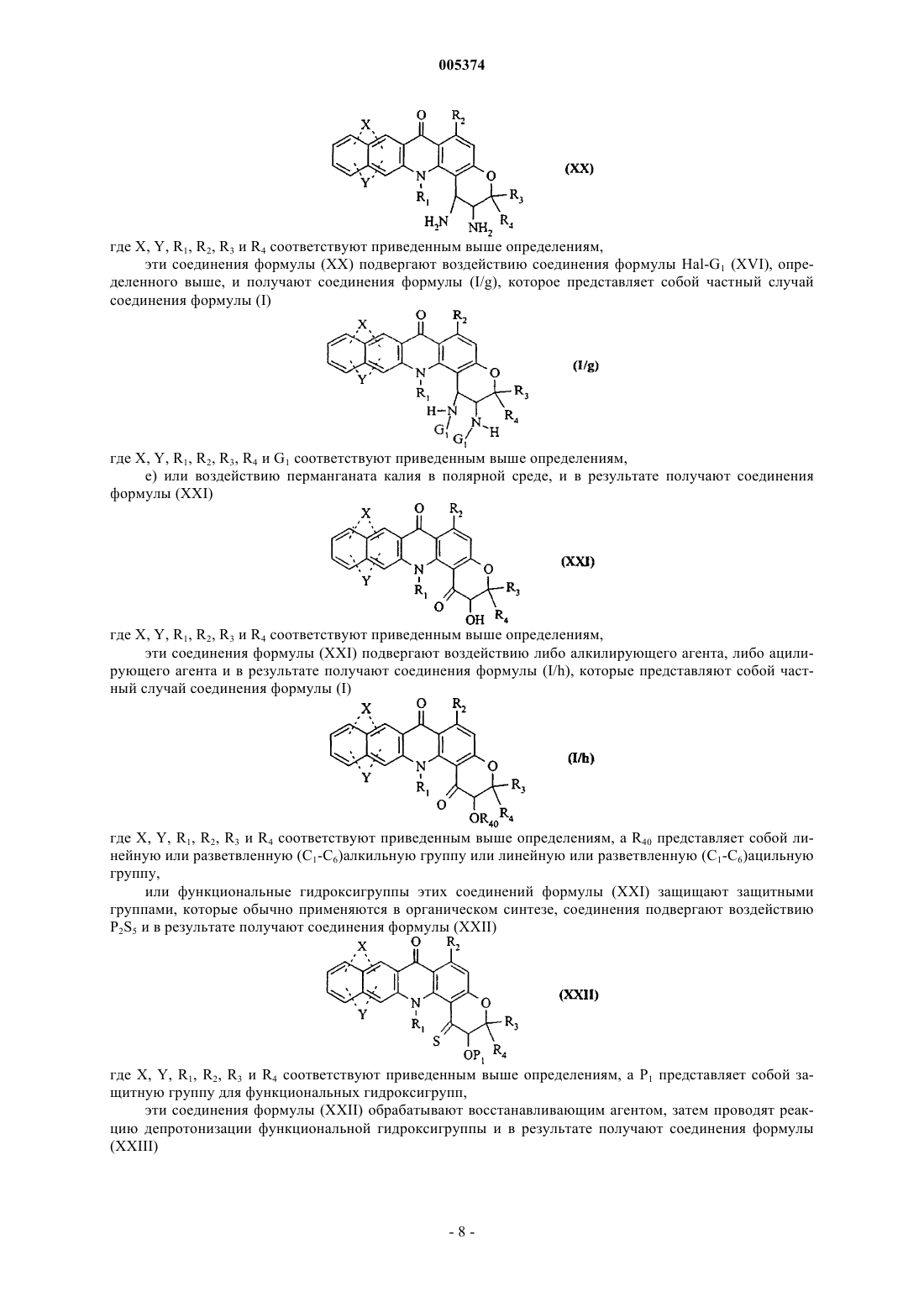
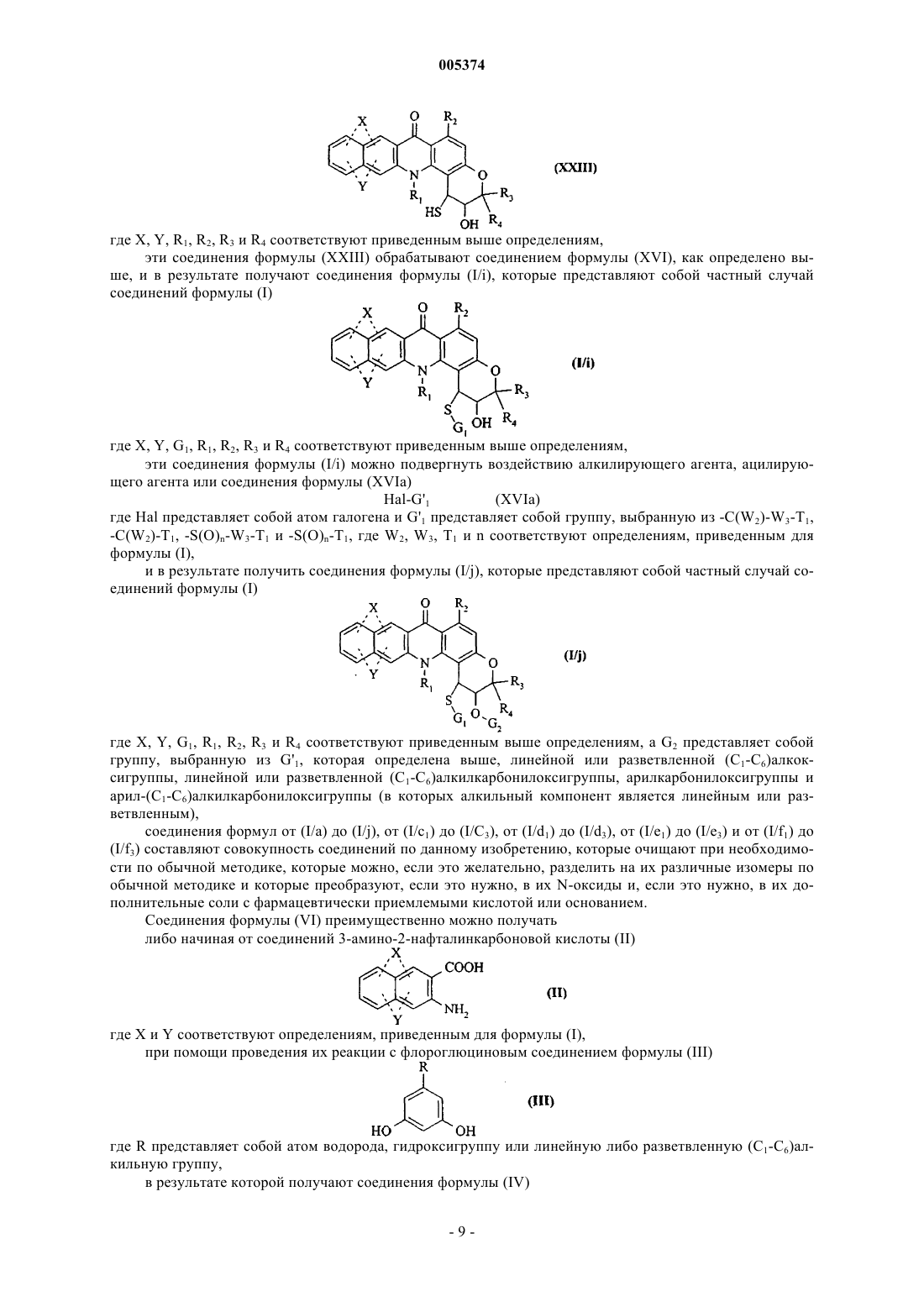
Новые соединения бензо [b]пирано[3,2-h]акридин-7-она, способ их получения и содержащие их фармацевтические композиции
Номер патента: 5374
Опубликовано: 24.02.2005
Авторы: Пьер Ален, Кош Мишель, Пфейффер Брюно, Сеген Элизабет, Тийекен Франсуа, Эль Омри Абдельхаким, Мишель Сильви, Хикмен Джон, Ренар Пьер
Формула / Реферат
1. Соединения формулы (I)
в которой X и Y, которые могут быть одинаковыми или различными, представляют собой независимо друг от друга группу, выбранную из
атомов водорода или галогена,
меркапто, циано, нитро, линейной или разветвленной (C1-C6)алкильной, линейной или разветвленной (C1-C6)тригалоалкильной и линейной или разветвленной тригало-(C1-C6)алкилкарбониламиногруппы,
групп формул -ORa, -NRaRb, -NRa-C(O)-T1, -O-C(O)-T1, -OT2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb, -NRa-T2-ORa и -NRa-T2-CO2Ra, в которых
Ra представляет собой группу, выбранную из атома водорода и линейной или разветвленной (C1-C6)алкильной группы, арильной группы и арил-(C1-C6)алкильной группы, в которых алкильный компонент является линейным или разветвленным,
Rb представляет собой группу, выбранную из атома водорода и линейной или разветвленной (C1-C6)алкильной группы, арильной группы и арил-(C1-C6)алкильной группы, в которых алкильный компонент является линейным или разветвленным, или
Ra+Rb, вместе с несущим их атомом азота, образуют моноцоклическое 5- или 6-членное гетероциклическое соединение, которое может содержать в циклической системе второй гетероатом, выбранный из кислорода и азота,
T1 представляет собой группу, выбранную из линейной или разветвленной (C1-C6)алкильной, линейной или разветвленной (C2-C6)алкенильной, арильной, арил(C1-C6)алкильной (в которых алкильный компонент является линейным или разветвленным) и линейной или разветвленной (C1-C6)алкиленовой цепочки, замещенной группой, выбранной из -ORa и -NRaRb, где Ra и Rb соответствуют приведенным выше определениям,
T2 представляет собой линейную или разветвленную (C1-C6)алкиленовую цепочку,
или X и Y, если они находятся на соседних положениях, вместе образуют метилендиоксигруппу или этилендиоксигруппу, причем подразумевается, что заместители X и Y могут находиться на любом из двух соседних бензольных колец,
R1 представляет собой атом водорода или линейную либо разветвленную (C1-C6)алкильную группу,
R2 представляет собой группу, выбранную из атома водорода и линейной или разветвленной (C1-C6)алкильной, -ORa, -NRaRb, -NRa-C(O)-T1, -O-C(O)-T1, -O-T2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb, -NRa-T2-ORa и -NRa-T2-CO2Ra групп, где Ra, Rb, T1 и T2 соответствуют приведенным выше определениям,
R3, R4, которые могут быть одинаковыми или различными, представляют собой независимо друг от друга атом водорода или линейную либо разветвленную (C1-C6)алкильную группу,
W представляет собой группу формулы -CH(R5)-CH(R6)-, -CH=C(R7)-, -C(R7)-CH- или C(O)-CH(R8)-, где
R5 и/или R6 представляет(ют) собой группу, выбранную из -W1-C(W2)-W3-T1, -W4-C(W2)-T'1, -W1-S(O)n-W3-T1 и -W1S(O)n-T1, где
W1 представляет собой атом кислорода или серы либо атом азота, замещенный атомом водорода или линейной или разветвленной (C1-C6)алкильной группой, арильной группой или арил-(C1-C6)алкильной группой, в которых алкильный компонент является линейным или разветвленным,
W2 представляет собой атом кислорода или серы,
W3 представляет собой атом водорода или серы либо атом азота, замещенный атомом водорода или линейной либо разветвленной (C1-C6)алкильной группой, арильной группой или арил-(C1-C6)алкильной группой, в которых алкильный компонент является линейным или разветвленным, связь, когда T1 представляет собой линейную или разветвленную (C2-C6)алкенильную группу,
W4 представляет собой атом серы или атом азота, замещенный атомом водорода или линейной или разветвленной (C1-C6)алкильной группой, арильной группой или арил-(C1-C6)алкильной группой, в которых алкильный компонент является линейным или разветвленным,
T1 соответствует приведенному выше определению,
T'1 представляет собой группу, выбранную из линейной или разветвленной (C2-C6)алкенильной, арильной, арил-(C1-C6)алкильной (в которых алкильный компонент является линейным или разветвленным) и линейной или разветвленной (C1-C6)алкиленовой цепочки, замещенной группой, выбранной из -ORa и -NraRb, где Ra и Rb соответствуют приведенным выше определениям,
n обозначает целое число, выбранное из 1 и 2,
и в случае, когда только одна из двух групп R5 и R6 представляет собой группу, соответствующую приведенным выше определениям, то вторая из названных групп R5 или R6 представляет собой группу, выбранную из атома водорода, гидрокси-, линейной или разветвленной (C1-C6)алкокси-, линейной или разветвленной (C1-C6)алкилкарбонилокси-, арилкарбонилокси-, арил-(C1-C6)алкилкарбонилокси- (в которых алкильный компонент является линейным или разветвленным) и аминогруппы, которая может быть замещенной одной или двумя, одинаковыми или различными, линейными или разветвленными (C1-C6)алкильными группами,
R7 представляет собой группу, выбранную из гидрокси-, линейной или разветвленной (C1-C6)алкокси-, -C(W2)-T1, -W1-C(W2)-W3-T1, -W1-C(W2)-T1, -W1-S(O)n-W3-T1 и -W1-S(O)n-T1, где W1, W2, W3, T1 и n соответствуют приведенным выше определениям, или R7 может дополнительно обозначать атом водорода, когда R2 представляет собой группу -O-T2-ORa и/или когда X представляет собой атом водорода и Y, расположенный на 13-м положении нафтильной системы пентациклического скелета, представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейной или разветвленной (C1-C6)алкильной, линейной или разветвленной (C1-C6)ацильной и линейной или разветвленной тригало-(C1-C6)алкилкарбонильной групп,
R8 представляет собой линейную или разветвленную (C1-C6)алкокси- или линейную или разветвленную (C1-C6)алкилкарбонилоксигруппу или может дополнительно принимать значение гидроксигруппы, когда R2 представляет собой группу -O-T2-ORa, которая определена выше,
их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотами или основаниями;
подразумевается, что арил представляет собой фенильную или нафтильную группу, которая может содержать один или более одинаковых или различных заместителей, выбранных из гидроксигруппы, галогена, карбокси-, нитро-, амино-, линейной или разветвленной (C1-C6)алкиламино-, ди(C1-C6)алкиламиногруппы, где каждый алкильный компонент может быть линейным или разветвленным, линейной или разветвленэющ (C1-C6)алкоксигруппы, линейной или разветвленной (C1-C6)ацильной группы и линейной или разветвленной (C1-C6)алкилкарбонилоксигруппы, и подразумевается, что в число изомеров входят оптические изомеры.
2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA)
где X, Y, R1, R2, R3, R4, R5 и R6 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
3. Соединения формулы (I) по п.2, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1-C(W2)-W3-T1 или -W1-S(O)n-T1, где W1, W2, W3, T1 и n соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1-C(W2)-W3-T1, где W1 представляет собой атом кислорода, W2 представляет собой атом кислорода, W3 представляет собой атом азота, замещенный атомом водорода, линейную или разветвленную (C1-C6)алкильную группу, арильную группу или арил-(C1-C6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, а T1 соответствует определению, приведенному для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
5. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы(IA), в которой R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1-S(O)n-T1, где W1 представляет собой атом кислорода, T1 соответствует определению, приведенному для формулы (I), и n равно 2, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
6. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB)
где X, Y, R1, R2, R3, R4 и R7 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
7. Соединения формулы (I) по любому из пп.1 или 6, отличающиеся тем, что они представляют собой соединения формулы (IB), в которой R7 обозначает группу, выбранную из -C(W2)-T1 и -W1-C(W2)-T1, где W1, W2 и T1 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
8. Соединения формулы (I) по п.7, отличающиеся тем, что они представляют собой соединения формулы (IB), в которой W1 обозначает атом кислорода, W2 обозначает атом кислорода и T1 представляет собой линейную или разветвленную (C1-C6)алкильную группу, арильную группу или арил-(C1-C6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
9. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IC)

где X, Y, R1, R2, R3, R4 и R5 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
10. Соединения формулы (I) по любому из пп.1-9, отличающиеся тем, что R3 и R4, которые могут быть одинаковыми или различными, представляют собой линейную или разветвленную (C1-C6)алкильную группу, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
11. Соединения формулы (I) по любому из пп.1-9, отличающиеся тем, что R2 представляет собой группу, выбранную из линейной или разветвленной (C1-C6)алкокси, -NRaRb, -O-T2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb и -NRa-T2-ORa, где Ra, Rb, T1 и T2 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
12. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB1)
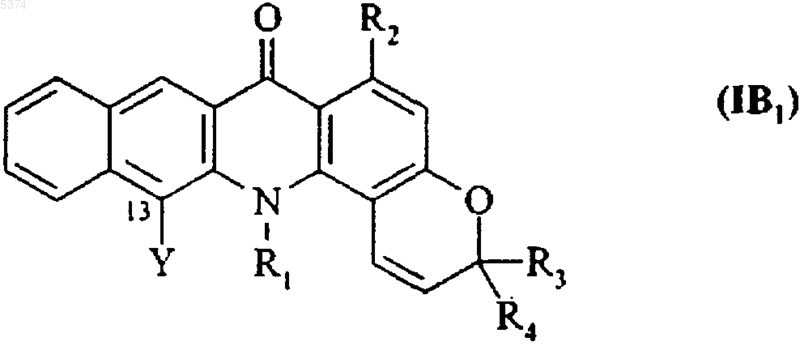
где R1, R2, R3 и R4 соответствуют определениям, приведенным для формулы (IB), а Y представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного (C1-C6)ацила и линейного или разветвленного тригало-(C1-C6)алкилкарбонила, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
13. Соединения формулы (I) по п.1, которые представляют собой
(1S,2S)-1-{[(диметиламино)карбонил]окси}-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил диметилкарбамат и
(1S,2S)-6-метокси-3,3,14-триметил-2-{[(4-метилфенил)сульфонил]окси}-7-оксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-1-ил 4-метилбензолсульфонат,
их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
14. Соединения формулы (I) по п.1, которые представляют собой
6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат,
2-бензоил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,
2-бутирил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,
2-ацетил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,
6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил бутират,
6-(2-гидроксиэтокси)-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,
13-амино-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он и
N-(6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-13-ил)ацетамид,
их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
15. Соединение формулы (I) по п.1, которое представляет собой 6-метокси-3,3-диметил-1,7-диоксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат, его энантиомеры, диастереоизомеры и N-оксшфы, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием.
16. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение по любому из пп.1-15, самостоятельно или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми эксципиентами или носителями.
17. Фармацевтические композиции по п.16, включающие по крайней мере один активный ингредиент по любому из пп.1-15 для применения в качестве медицинских препаратов для лечения раковых заболеваний.
18. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение формулы (XXI)
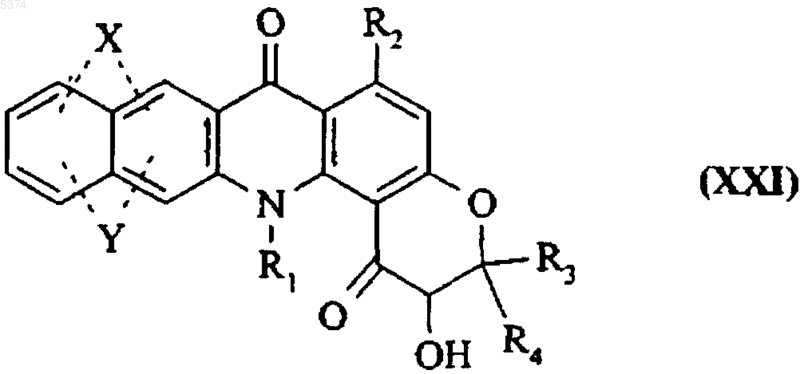
где X, Y, R1, R2, R3 и R4 соответствуют определениям, приведенным в п.1 для соединения формулы (I), самостоятельно или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми эксципиентами или носителями.
19. Фармацевтические композиции по п.18, включающие в качестве активного ингредиента 2-гидрокси-6-метокси-3,3-диметил-2,3-дигидро-1H-бензо[b]пирано[3,2-h]акридин-1,7(14H)-дион, самостоятельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями.
20. Фармацевтические композиции по любому из пп.18 или 19 для применения в качестве медицинских препаратов для лечения раковых заболеваний.
Текст
005374 Настоящее изобретение относится к новым соединениям бензо[b]пирано[3,2-h]акридин-7-она, к способу их получения и к содержащим их фармацевтическим композициям. Соединения по данному изобретению представляют собой производные акроницина, алкалоида, который обладает противоопухолевыми свойствами, которые можно продемонстрировать на экспериментальных моделях (J. Pharm. Sci., 1966, 55 (8), 758-768). Тем не менее, несмотря на довольно широкий спектр действия, акроницин малоэффективен и характеризуется невысокой активностью. Кроме того, у этого соединения низкая растворимость, что ограничивает его биоаккумулирование, так же как и его применение в фармацевтических композициях, предназначенных для внутривенного применения. Можно осуществить различные модификации молекулы, например те, которые описаны в J. Med.Chem., 1996, 39, 4762-4766 или ЕР 1 042 326, которые обеспечивают значительное улучшение действенности, противоопухолевой эффективности и растворимости продуктов. Тем не менее, противораковая терапия требует систематической разработки новых противоопухолевых агентов, на основе которых можно было бы создавать медицинские препараты, более действенные и одновременно с лучшей переносимостью. Если говорить более конкретно, твердые опухоли представляют основную проблему для противораковой химиотерапии в связи с их исходной и/или приобретенной устойчивостью по отношению к существующим соединениям. Более того, обнаружено, что определенные соединения, о которых известно, что они проявляют высокую активность по отношению к определенным линиям клеток, неактивны по отношению к другим линиям клеток, или в большой мере токсичны. Таким образом, задача первостепенной важности состоит в получении доступа к широкому классу соединений, проявляющих сильную цитотоксическую активность, которые позволят проводить наиболее эффективное лечение всех опухолевых заболеваний, и при этом побочные эффекты будут в большой мере ограничены, а их целевое действие будет продолжаться долее, чем у других препаратов. Обнаружилось, что соединения по данному изобретению отличаются не только новизной, но и активностью, которая in vitro и in vivo превышает активность всех других соединений, известных в настоящее время. Соответственно, раскрытые заявителем соединения обладают противоопухолевыми свойствами, которые делают их особенно полезными для лечения раковых заболеваний и, особенно твердых опухолей. Более конкретно, настоящее изобретение относится к соединениям формулы (I) в которой Х и Y, которые могут быть одинаковыми или различными, представляют собой независимо друг от друга группу, выбранную из атомов водорода или галогена,меркапто, циано, нитро, линейной или разветвленной (С 1-С 6)алкильной, линейной или разветвленной (С 1-С 6)тригалоалкильной и линейной или разветвленной тригало-(С 1-С 6)алкилкарбониламиногруппы,групп формул -ORa, -NRaRb, -NRa-C(O)-T1, -O-C(O)-T1, -OT2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb,-NRa-T2-ORa и -NRa-T2-CO2Ra, в которыхRa представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной группы, арильной группы и арил-(С 1-С 6)алкильной группы, в которых алкильный компонент является линейным или разветвленным,Rb представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной группы, арильной группы и арил-(С 1-С 6)алкильной группы, в которых алкильный компонент является линейным или разветвленным, или Ra+Rb, вместе с несущим их атомом азота, образуют моноцоклическое 5- или 6-членное гетероциклическое соединение, которое может содержать в циклической системе второй гетероатом, выбранный из кислорода и азота,T1 представляет собой группу, выбранную из линейной или разветвленной (С 1-С 6)алкильной, линейной или разветвленной (С 2-С 6)алкенильной, арильной, арил(С 1-С 6)алкильной (в которых алкильный компонент является линейным или разветвленным), и линейной или разветвленной (С 1-С 6)алкиленовой цепочки, замещенной группой, выбранной из -ORa и -NraRb, где Ra и Rb соответствуют приведенным выше определениям,Т 2 представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепочку,или Х и Y, если они находятся на соседних положениях, вместе образуют метилендиоксигруппу или этилендиоксигруппу, причем подразумевается, что заместители Х и Y могут находиться на любом из двух соседних бензольных колец,R1 представляет собой атом водорода или линейную либо разветвленную (С 1-С 6)алкильную группу,-1 005374R2 представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной, -ORa, -NRaRb, -NRa-C(O)-T1, -О-С(О)-T1, -O-T2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb, -NRaT2-ORa и -NRa-Т 2-CO2Ra групп, где Ra, Rb, T1 и Т 2 соответствуют приведенным выше определениям,R3, R4, которые могут быть одинаковыми или различными, представляют собой независимо друг от друга атом водорода или линейную либо разветвленную (С 1-С 6)алкильную группу,W представляет собой группу формулы -СН(R5)-СН(R6)-, -CH=C(R7)-, -C(R7)=CH- или C(O)-CH(R8)-, гдеW1 представляет собой атом кислорода или серы, либо атом азота, замещенный атомом водорода или линейной или разветвленной (С 1-С 6)алкильной группой, арильной группой или арил-(С 1 С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным,W2 представляет собой атом кислорода или серы,W3 представляет собой атом водорода или серы, либо атом азота, замещенный атомом водорода или линейной либо разветвленной (С 1-С 6)алкильной группой, арильной группой или арил-(С 1-С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным, связь, когда T1 представляет собой линейную или разветвленную (С 2-С 6)алкенильную группу,W4 представляет собой атом серы или атом азота, замещенный атомом водорода или линейной или разветвленной (С 1-С 6)алкильной группой, арильной группой или арил-(С 1-С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным,T1 соответствует приведенному выше определению,T'1 представляет собой группу, выбранную из линейной или разветвленной (С 2-С 6)алкенильной,арильной, арил-(С 1-С 6)алкильной (в которых алкильный компонент является линейным или разветвленным), линейной или разветвленной (C1-С 6)алкиленовой цепочки, замещенной группой, выбранной из-ORa и -NRaRb, где Ra и Rb соответствуют приведенным выше определениям,n обозначает целое число, выбранное из 1 и 2,и в случае, когда только одна из двух групп R5 и R6 представляет собой группу, соответствующую приведенным выше определениям, то вторая из названных групп R5 или R6 представляет собой группу,выбранную из атома водорода, гидрокси-, линейной или разветвленной (С 1-С 6)алкокси-, линейной или разветвленной (С 1-С 6)алкилкарбонилокси-, арилкарбонилокси-, apил-(C1-С 6)алкилкарбонилокси- (в которых алкильный компонент является линейным или разветвленным), и аминогруппы, которая может быть замещенной одной или двумя, одинаковыми или различными, линейными или разветвленными (C1 С 6)алкильными группами,R7 представляет собой группу, выбранную из гидрокси-, линейной или разветвленной (С 1-С 6)алкокси, -C(W2)-T1, -W1-C(W2)-W3-T1, -W1-C(W2)-T1, -W1-S(O)n-W3-T1 и -W1-S(O)n-T1, где W1, W2, W3, T1 и n соответствуют приведенным выше определениям, или R7 может дополнительно обозначать атом водорода,когда R2 представляет собой группу -О-Т 2-ORa и/или когда Х представляет собой атом водорода и Y,расположенный на 13-м положении нафтильной системы пентациклического скелета, представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейной или разветвленной (С 1-С 6)алкильной, линейной или разветвленной (С 1-С 6)ацильной и линейной или разветвленной тригало-(C1-C6)алкилкарбонильной групп,R8 представляет собой линейную или разветвленную (С 1-С 6)алкокси- или линейную или разветвленную (С 1-С 6)алкилкарбонилоксигруппу или может дополнительно принимать значение гидроксигруппы, когда R2 представляет собой группу -O-T2-ORa, которая определена выше,к их энантиомерам, диастереоизомерам и N-оксидам, а также к их дополнительным солям с фармацевтически приемлемыми кислотами или основаниями. Арил представляет собой фенильную или нафтильную группу, которая может содержать один или более одинаковых или различных заместителей, выбранных из гидроксигруппы, галогена, карбокси-,нитро-, амино-, линейной или разветвленной (С 1-С 6)алкиламино-, ди(С 1-С 6)алкиламиногруппы, где каждый алкильный компонент может быть линейным или разветвленным, линейной или разветвленной (С 1 С 6)алкоксигруппы, линейной или разветвленной (С 1-С 6)ацильной группы и линейной или разветвленной(С 1-С 6)алкилкарбонилоксигруппы. Термин изомеры охватывает оптические изомеры, т.е. энантиомеры и диастереомеры. Среди фармацевтически приемлемых кислот следует особо упомянуть, не ограничивая общности,соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту,янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винно-каменную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту,камфорную кислоту, лизин и т.д. Среди фармацевтически приемлемых оснований следует особо упомянуть, не ограничивая общности, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д.-2 005374 По преимущественному воплощению изобретения предпочтительными соединениями являются соединения формулы (IA) где X, Y, R1, R2, R3, R4, R5 и R6 соответствуют определениям, приведенным для формулы (I). Предпочтительными соединениями формулы (IA) являются такие, в которых R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1-C(W2)-W3-T1 или -W1-S(O)n-T1, где W1, W2, W3, T1 и n соответствуют определениям, приведенным для формулы (I). В варианте, представляющем особый интерес, предпочтительными соединениями формулы (IA) являются соединения, в которых R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1C(W2)-W3-T1, где W1 представляет собой атом кислорода, W2 представляет собой собой атом кислорода,W3 представляет собой атом азота, замещенный атомом водорода, линейной или разветвленной (С 1 С 6)алкильной группой, арильной группой или арил-(С 1-С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным, и T1 соответствует определению, приведенному для формулы (I). В другом варианте, который тоже представляет особый интерес, предпочтительными соединениями формулы (IA) являются такие, в которых R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1-S(O)n-T1, где W1 представляет собой атом кислорода, T1 соответствует определению, приведенному для формулы (I), и n равно 2. По второму из преимущественных вариантов воплощения изобретения предпочтительными соединениями являются соединения формулы (IB) где X, Y, R1, R2, R3, R4 и R7 соответствуют определениям, приведенным для формулы (I). Предпочтительными соединениями формулы (IB) являются такие, в которых R7 представляет собой группу, выбранную из -C(W2)-T1 и -W1C(W2)-T1, где W1, W2 и T1 соответствуют определениям, приведенным для формулы (I). В варианте воплощения изобретения, представляющем особый интерес, предпочтительными соединениями формулы (IB) являются такие, в которых W1 представляет собой атом кислорода, W2 представляет собой атом кислорода и T1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу или арил-(С 1-С 6)алкильную группу, в которых алкильный компонент является линейным или разветвленным. По третьему преимущественному варианту воплощения изобретения предпочтительными являются соединения формулы (IC) где X, Y, R1, R2, R3, R4 и R8 соответствуют определениям, приведенным для формулы (I). Заместители R3 и R4, которые являются предпочтительными по данному изобретению, представляют собой линейные или разветвленные (С 1-С 6)алкильные группы. Заместители R2, которые являются предпочтительными по данному изобретению, представляют собой группы, выбранные из линейной или разветвленной (С 1-С 6)алкоксигруппы, -NRaRb, -O-T2-NRaRb,-O-T2-ORa, -NRa-T2-NRaRb и -NRa-T2-Ora, где Ra, Rb, T1 и Т 2 соответствуют определениям, приведенным для формулы (I). По четвертому преимущественному варианту воплощения изобретения предпочтительными являются соединения формулы (IB1) где R1, R2, R3 и R4 соответствуют определениям, приведенным для формулы (IB), а Y представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)ацила и линейного или разветвленного тригало-(С 1-С 6)алкилкарбонила. В особенно преимущественном варианте предпочтительными соединениями по данному изобретению являются следующие:(1S,2S)-1-[(диметиламино)карбонил]ок-си-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро 1H-бензо[b]пирано[3,2-h]акридин-2-ил диметилкарбамат,(1S,2S)-6-метокси-3,3,14-триметил-2-[(4-метилфенил)сульфонил]окси-7-oкco-2,3,7,14-тeтpaгидpo1H-бeнзo[b]пиpaнo[3,2-h]aкpидин-1-ил 4-метилбензолсульфонат,6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат,2-бензоил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,2-бутирил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,2-ацетил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил бутират,6-(2-гидроксиэтокси)-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,13-амино-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,N-(6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-13-ил) ацетамид,6-метокси-3,3-диметил-1,7-диоксо-2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-2-ил ацетат. Энантиомеры, диастереоизомеры, N-оксиды и дополнительные соли предпочтительных соединений с фармацевтически приемлемыми кислотой или основанием составляют неотъемлемую часть данного изобретения. Настоящее изобретение относится также к способу получения соединений формулы (I), который отличается тем, что по этому способу в качестве исходного материала применяют соединение формулы где X, Y, R, R3 и R4 соответствуют приведенным выше определениям,атом азота этого соединения формулы (VI) может быть замещенным при помощи воздействия алкилгалидом или диалкилсульфатом в присутствии депротонизирующего агента в апротонном полярном растворителе или при условиях фазового перехода, в результате чего получают соединения формулы где X, Y, R, R3 и R4 соответствуют приведенным выше определениям, a R'1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,соединения формулы (IX) подвергают воздействию алкилирующего агента или ацилирующего агента при обычных условиях органического синтеза и в результате получают соединения формулы (X) где X, Y, R'1, R3 и R4 соответствуют приведенным выше определениям, a R'2 представляет собой группу,выбранную из -ORa, -O-C(O)-T1, -O-T2-NRaRb и -O-Т 2-Оrа, где Ra, Rb, T1 и T2 соответствуют определениям, приведенным для формулы (I),в случае, когда R'2 представляет собой алкоксигруппу, соединения формулы (X) подвергают обработке соединением формулы (XI)(XI) где Ra представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу,арильную группу или арил-(С 1-С 6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, и R10 представляет собой группу, выбранную из Rb, -C(O)-T1, -T2-NRaRb,-T2-ORa и -T2-CO2Ra, где Ra, Rb, T1 и T2 соответствуют определениям, приведенным для формулы (I),и получают соединения формулы (XII) где X, Y, R'1, R3, R4, Ra и R10 соответствуют приведенным выше определениям. Все соединения формул (VI), (IX), (X) и (XII) составляют совокупность соединений формулы (XIII) где X, Y, R1, R2, R3 и R4 соответствуют определениям, указанным в общем определении, приведенном в описании формулы (I),эти соединения формулы (XIII) подвергают а) либо воздействию соединения формулы (XIV)(XIV) где Hal представляет собой атом галогена, a W2 и T1 соответствуют определениям, указанным в общем определении, приведенном в описании формулы (I),и в результате получают соединения формулы (I/a), которые являются частным случаем соединений формулы (I), где X, Y, R1, R2, R3, R4, W2 и T1 соответствуют приведенным выше определениям,b) либо алкеновую функциональную группу подвергают воздействию окисляющего агента и получают соединения формулы (XV) где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям,-5 005374 соединения формулы (XV) подвергают обработке соединением формулы (XVI)(XVI) где Hal представляет собой атом галогена, a G1 представляет собой группу, выбранную из -C(W2)-W3-T1,-C(W2)-T1, -S(O)n-W3-T1 и -S(O)n-T1, где W2, W3, T1 и n соответствуют определениям, приведенным для формулы (I),и в результате получают соединения формул (I/b), (I/с) и (I/d), которые представляют собой частные случаи соединений формулы (I) где X, Y, R1, R2, R3, R4 и G1 соответствуют приведенным выше определениям,и соединения формул (I/с) и/или (I/d) подвергают либо воздействию спирта формулы R20-OH, где R20 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, и в результате получают соединения формул (I/c1) и (I/d1) соответственно где X, Y, R1, R2, R3, R4, G1 и R20 соответствуют приведенным выше определениям,либо воздействию ангидрида формулы (R30 СO)2 О, где R30 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу или арил-(С 1-С 6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, и в результате получают соединения формул (I/с 2) и (I/d2) соответственно где X, Y, R1, R2, R3, R4, G1 и R30 соответствуют приведенным выше определениям,или дегидратации в кислой среде, и в результате получают соединения формул (I/с 3) и (I/d3) соответственно, которые представляют собой частные случаи соединений формулы (I) где X, Y, R1, R2, R3, R4 и G1 соответствуют приведенным выше определениям,с) или воздействию надкислоты либо диметилдиоксирана, и в результате получают соединения формулы (XVII) где X, Y, R1, R2, R3, и R4 соответствуют приведенным выше определениям,-6 005374 и эти соединения формулы (XVII) подвергают обработке аммиаком или первичным амином и в результате получают соединения формул (XVIII/a) и/или (XVIII/b) где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям, Rc обозначает атом водорода иRa обозначает атом водорода в случае, когда применяемым реагентом был аммиак, или представляет собой группу, выбранную из линейного или разветвленного (С 1-С 6)алкила, арила и арил-(С 1-С 6)алкила (в которых алкильный компонент является линейным или разветвленным) в случае, когда применяемым реагентом был первичный амин,спиртовую функциональную группу этих соединений формул (XVIII/a) и (XVIII/b) защищают защитной группой гидроксигруппы, затем соединения подвергают воздействию соединения формулы HalG1 (XVI), которая определена выше, и получают соединения формул (XIX/a) и (XIX/b) соответственно где X, Y, R1, R2, R3, R4, Ra и G1 соответствуют приведенным выше определениям, а Р 1 представляет собой защитную группу функциональных гидроксигрупп,удаляют защитные группы гидроксигруппы этих соединений формул (XIX/a) и (XIX/b), получают соединения формул (I/е 1) и (I/f1) соответственно, которые представляют собой частные случаи соединений формулы (I) где X, Y, R1, R2, R3, R4, Ra и G1 соответствуют приведенным выше определениям,эти соединения формул (I/е 1) и (I/f1) подвергают либо воздействию ангидрида формулы (R30 СO)2 О, где R30 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу или арил-(С 1-С 6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, и в результате получают соединения формул (I/е 2) и (I/f2), которые представляют собой частные случаи соединений формулы (I) где X, Y, R1, R2, R3, R4, Ra, G1 и R30 соответствуют приведенным выше определениям,либо дегидратации в кислой среде, и в результате получают соединения формул (I/е 3) и (I/f3), которые представляют собой частные случаи соединений формулы (I) где X, Y, R1, R2, R3, R4, Ra и G1 соответствуют приведенным выше определениям,d) или воздействию NaN3 в присутствии пероксида водорода с последующим этапом восстановления при помощи три-н-бутилтин гидрида, например, чтобы получить соединения формулы (XX) где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям,эти соединения формулы (XX) подвергают воздействию соединения формулы Hal-G1 (XVI), определенного выше, и получают соединения формулы (I/g), которое представляет собой частный случай соединения формулы (I) где X, Y, R1, R2, R3, R4 и G1 соответствуют приведенным выше определениям,е) или воздействию перманганата калия в полярной среде, и в результате получают соединения формулы (XXI) где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям,эти соединения формулы (XXI) подвергают воздействию либо алкилирующего агента, либо ацилирующего агента и в результате получают соединения формулы (I/h), которые представляют собой частный случай соединения формулы (I) где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям, а R40 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или линейную или разветвленную (С 1-С 6)ацильную группу,или функциональные гидроксигруппы этих соединений формулы (XXI) защищают защитными группами, которые обычно применяются в органическом синтезе, соединения подвергают воздействиюP2S5 и в результате получают соединения формулы (XXII) где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям, a P1 представляет собой защитную группу для функциональных гидроксигрупп,эти соединения формулы (XXII) обрабатывают восстанавливающим агентом, затем проводят реакцию депротонизации функциональной гидроксигруппы и в результате получают соединения формулы где X, Y, R1, R2, R3 и R4 соответствуют приведенным выше определениям,эти соединения формулы (XXIII) обрабатывают соединением формулы (XVI), как определено выше, и в результате получают соединения формулы (I/i), которые представляют собой частный случай соединений формулы (I) где X, Y, G1, R1, R2, R3 и R4 соответствуют приведенным выше определениям,эти соединения формулы (I/i) можно подвергнуть воздействию алкилирующего агента, ацилирующего агента или соединения формулы (XVIa)(XVIa) где Hal представляет собой атом галогена и G'1 представляет собой группу, выбранную из -C(W2)-W3-T1,-C(W2)-T1, -S(O)n-W3-T1 и -S(O)n-T1, где W2, W3, T1 и n соответствуют определениям, приведенным для формулы (I),и в результате получить соединения формулы (I/j), которые представляют собой частный случай соединений формулы (I) где X, Y, G1, R1, R2, R3 и R4 соответствуют приведенным выше определениям, a G2 представляет собой группу, выбранную из G'1, которая определена выше, линейной или разветвленной (С 1-С 6)алкоксигруппы, линейной или разветвленной (С 1-С 6)алкилкарбонилоксигруппы, арилкарбонилоксигруппы и арил-(С 1-С 6)алкилкарбонилоксигруппы (в которых алкильный компонент является линейным или разветвленным),соединения формул от (I/a) до (I/j), от (I/c1) до (I/С 3), от (I/d1) до (I/d3), от (I/e1) до (I/е 3) и от (I/f1) до(I/f3) составляют совокупность соединений по данному изобретению, которые очищают при необходимости по обычной методике, которые можно, если это желательно, разделить на их различные изомеры по обычной методике и которые преобразуют, если это нужно, в их N-оксиды и, если это нужно, в их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. Соединения формулы (VI) преимущественно можно получать либо начиная от соединений 3-амино-2-нафталинкарбоновой кислоты (II) где Х и Y соответствуют определениям, приведенным для формулы (I),при помощи проведения их реакции с флороглюциновым соединением формулы (III) где R представляет собой атом водорода, гидроксигруппу или линейную либо разветвленную (С 1-С 6)алкильную группу,в результате которой получают соединения формулы (IV) где X, Y и R соответствуют приведенным выше определениям,которые затем обрабатывают при щелочных условиях в апротонном растворителе алкином формулы (V) где Hal представляет собой атом галогена, а R3 и R4 соответствуют определениям, приведенным для формулы (I),и в результате получают соединения формулы (VI), которые определены выше,либо начиная от соединений 3-гало-2-нафталинкарбоновой кислоты формулы (VII) где Х и Y соответствуют определениям, приведенным для формулы (I), a Hal представляет собой атом галогена,при помощи реакции этих соединений с амино-хроменовым соединением формулы (VIII) где R3 и R4 соответствуют определениям, приведенным для формулы (I), и R соответствует приведенному выше определению,в результате которой тоже получают соединения формулы (VI), которые определены выше. Соединения формулы (XIII) представляют собой промежуточные продукты синтеза, полезные для получения соединений формулы (I). Среди этих соединений формулы (XIII) выделяют соединения формулы (IB1) где R1, R2, R3 и R4 соответствуют определениям, приведенным для формулы (IB), a Y представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)ацила и линейного или разветвленного тригало-(С 1-С 6)алкилкарбонила,и соединения формулы (IB2) где R1, R3, R4, Т 2, Ra, X и Y соответствуют определениям, приведенным для формулы (I). Эти соединения формул (IB1) и (IВ 2) являются новыми и обладают цитотоксической активностью. Следовательно, они могут быть полезными для лечения раковых заболеваний. Аналогично, соединения формулы (XXI) представляют собой промежуточные продукты синтеза,полезные для получения соединений формулы (I) и особенно соединений формулы (IC). Эти соединения- 10005374 формулы (XXI) тоже обладают цитотоксической активностью. Их применение в качестве активных ингредиентов в фармацевтических композициях делает последние полезными для лечения раковых заболеваний. Соединения формул (II), (III), (V), (VII), (VIII), (XI), (XIV) и (XVI) либо имеются в продаже, либо могут быть получены по обычным методикам органического синтеза, которые хорошо известны специалистам. Соединения формулы (I) обладают особенно ценными противоопухолевыми свойствами. Они обнаруживают прекрасную цитотоксичность in vitro no отношению к линиям клеток, происходящим от опухолей мышей и человека, за счет специфического блокирования клеточного цикла и проявляют активность in vivo в организмах мышей по отношению к трансплантируемым мышиным и человеческим опухолям. Характеристические свойства этих соединений позволяют их терапевтическое применение в качестве противоопухолевых агентов. Настоящее изобретение относится также к фармацевтическим композициям, включающим в качестве активного ингредиента по крайней мере одно соединение формулы (I), его энантиомер или диастереоизомер либо его N-оксид или дополнительную соль с фармацевтически приемлемыми кислотой или основанием, индивидуально или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями. Среди фармацевтических композиций по данному изобретению особого упоминания заслуживают те, которые пригодны для орального, парентерального (внутривенного, внутримышечного или подкожного), внутрикожного или накожного, внутривлагалищного, ректального, носового, подъязычного, ротового, глазного или дыхательного назначения. Фармацевтические композиции по данному изобретению для парентеральных инъекций включают,главным образом, водные и неводные стерильные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для воссоздания инъекционных растворов или дисперсий. Фармацевтические композиции по данному изобретению для оральных назначений в виде твердой фазы включают, главным образом, таблетки или драже, подъязычные таблетки, саше, желатиновые капсулы и гранулы, а для приема в жидком виде для орального, носового, ротового или глазного назначений они включают, главным образом, эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или влагалищного назначения предпочтительно представляют собой суппозитории, а предназначенные для чрескожного или накожного назначения включают, главным образом, порошки, аэрозоли, кремы, мази, гели и саше. Упомянутые выше и ниже фармацевтические композиции иллюстрируют изобретение, но никоим образом его не ограничивают. Среди инертных, нетоксичных, фармацевтически приемлемых эксципиентов или носителей можно упомянуть, в качестве примера, не ограничивающего общность, разбавители, растворители, консерванты, смачивающие агенты, эмульгаторы, диспергирующие агенты, связующие, агенты набухания, разрыхляющие агенты, замедлители, смазочные вещества, абсорбенты, суспендирующие агенты, красители,ароматизаторы и т.д. Полезная дозировка варьируется в зависимости от возраста и веса пациента, способа назначения,применяемой фармацевтической композиции, природы и степени тяжести расстройства и назначения каких-либо дополнительных средств. Дозировку можно варьировать в интервале от 0,1 до 1000 мг в день,которую назначают для однократного или нескольких приемов. Приведенные ниже примеры иллюстрируют изобретение, но никоим образом не ограничивают его общности. Применяемыми исходными материалами являются либо известные вещества, либо такие, которые можно приготовить по известным методикам. Различные препараты приводят к синтезу промежуточных соединений, которые полезны для получения соединений по данному изобретению. Структура соединений, описанных в примерах и препаратах, была определена по стандартным спектрофотометрическим методикам (инфракрасная спектрометрия, ядерный магнитный резонанс, массспектрометрия, ). Точки плавления были определены при помощи либо плитки Кофлера, либо плитки под микроскопом. Если соединение находится в виде соли, то приведенная точка плавления относится к солевой форме соединения. Препарат 1. 6-Метокси-3,3,14-триметил-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-7-он. Этап А. 1,3-Дигидрокси-5,12-дигидробензо[b]акридин-12-он. К раствору 5 г 3-амино-2-нафталинкарбоновой кислоты в 50 мл гептан-1-ола добавили 3,5 г 1,3,5 тригидроксибензола и 62,5 мг паратолуолсульфоновой кислоты. Смесь перемешивали в течение 48 ч при нагревании на установке Dean-Stark, а затем реакционную смесь концентрировали в вакууме. Осадок подвергали хроматографии на силикагеле (элюэнт: циклогексан/ацетон: 90/10). Выделенный продукт кристаллизовали из смеси циклогексан/ацетон, что позволило получить 5,2 г целевого продукта.- 11005374 Этап В. 6-Гидрокси-3,3-димeтил-7,14-дигидро-3 Н-бензо[b]пирано[3,2-h]акридин-7-он. К раствору 2 г продукта, полученного на этапе А, в 50 мл безводного диметилформамида, в атмосфере инертного газа, добавили 2 г безводного карбоната калия. После перемешивания в течение 15 мин при 65 С добавили 2,4 г безводного иодида калия и 4,4 г 3-хлор-3-метил-1-бутина и реакционную смесь выдерживали при 65 С в течение 24 ч, а затем при 130 С в течение 1 ч. После охлаждения произвели гидролиз раствора, а затем его экстрагирование дихлорметаном. Органические фазы объединили, промыли их сначала водой, а затем 1 М раствором гидроксида калия, высушили над сульфатом натрия, затем выпарили. После хроматографии на силикагеле (циклогексан/ацетон: 90/10) выделили 1,10 г целевого продукта. Точка плавления: 225 С. Этап С. 6-Метокси-3,3,14-триметил-7,14-дигидро-3 Н-бензо[b]пирано[3,2-h]акридин-7-он. К раствору 0,5 г продукта, полученного на этапе В, в 20 мл безводного диметилформамида медленно добавили при 0 С в атмосфере инертного газа 0,16 г гидрида натрия и затем, через 15 мин, 0,65 мл диметилсульфата (6 эквивалентов). Через 1 ч реакционную смесь гидролизовали при помощи льда и затем экстрагировали этилацетатом. После промывки органической фазы водным раствором гидроксида натрия, ее высушили над сульфатом натрия и затем выпарили в вакууме. Хроматография на силикагеле(циклогексан/ацетон: 98/2) позволила получить 0,42 г целевого продукта. Точка плавления: 188 С. Препарат 2. -цис-1,2-Дигидрокси-6-метокси-3,3,14-триметил-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-7-он. К раствору 2 г продукта, полученного в примере Препарат 1, и 0,9 г 4-метилморфолин-N-оксида моногидрата в 40 мл смеси трет-бутанол/тетрагидрофуран/вода (10/3/1) добавили осмия тетроксид в в виде 2,5% раствора в 3,8 мл 2-метил-2-пропанола. После 2 дней при температуре окружающей среды добавили 105 мл насыщенного раствора NaHSCO3 и после перемешивания смеси в течение 1 ч произвели ее экстракцию дихлорметаном. Органические фазы объединили, высушили над сульфатом натрия и сконцентрировали в вакууме. Хроматография на силикагеле (дихлорметан/метанол: 95/5) позволила выделить 1,3 г целевого продукта. Точка плавления: 194 С. Препарат 3. 6-(Диэтиламинопропиламино)-3,3,14-триметил-7,14-дигидро-3H-бензо[b]пирано[3,2h]акридин-7-он. К 0,15 г продукта, полученного в примере Препарат 1, добавили 4 мл N,N-диэтилпропилендиамина. После проведения реакции в течение 5 дней при 70 С в атмосфере инертного газа реакционную смесь выпарили при пониженном давлении. Полученный осадок подвергли хроматографии на силикагеле(циклогексан/этилацетат: 80/20), что позволило выделить целевой продукт. Спектр масс: (DIС/NН 3): m/z: 470 (M+H)+ Препарат 4. 6-[(2-Морфолин-4-ил)этиламино]-3,3,14-триметил-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-7-он. Продукт получили по методике, описанной в Препарат 3, в качестве реагента применяли 4-(2 аминоэтил)морфолин. Спектр масс: (DIC/NH3): m/z: 470 (М+Н)+ Препарат 5. -цис-1,2-Дигидрокси-6-(диэтиламинопропиламино)-3,3,14-триметил-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-7-он. Продукт получили по методике, описанной в Препарат 2, в качестве основы применили соединение Препарат 3. Препарат 6. -1-Амино-2-гидрокси-6-метокси-3,3,14-триметил-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-7-он. Этап А. -1-Азидо-2-гидрокси-6-метокси-3,3,14-триметил-2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-7-он. К раствору 0,15 г соединения Препарат 2 и 0,5 г NaN3 в 6 мл хлороформа медленно добавили при температуре окружающей среды 3 мл трифторуксусной кислоты. После перемешивания в течение 12 ч добавили 1 эквивалент NaN3 и реакционную смесь выдерживали при температуре окружающей среды в течение следующих 12 ч. Далее реакционную смесь промыли сначала водой, а затем насыщенным раствором NaCl и высушили над сульфатом натрия. Хроматография на силикагеле (дихлорметан/метанол: 95/5) позволила выделить целевой продукт. Этап В. -1-Амино-2-гидрокси-6-метокси-3,3,14-триметил-2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-7-он. Раствор, содержащий 0,2 г соединения, полученного на этапе А, и 0,09 г Pd/C в 5 мл этанола перемешивали при температуре окружающей среды в атмосфере Н 2 в течение 48 ч. Затем катализатор отфильтровали и фильтрат сконцентрировали в вакууме. Осадок подвергли хроматографии на силикагеле(дихлорметан/метанол: 95/5), что позволило выделить нужный продукт.- 12005374 Препарат 7. 6-(Диметиламиноэтилокси)-3,3,14-триметил-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-7-он. Этап А. 6-Гидрокси-3,3,14-триметил-7,14-дигидро-3 Н-бeнзо[b]пирано[3,2-h]акридин-7-он. Продукт получили по методике, описанной в примере Препарат 1, с применением только 1,5 эквивалента гидрида натрия и 2 эквивалентов диметилсульфата. Точка плавления: 138 С. Этап В. 6-(Диметиламиноэтилокси)-3,3,14-триметил-7,14-дигидро-3 Н-бензо[b]пирано[3,2-h]акридин-7-он. В атмосфере азота к раствору 0,2 г соединения, полученного на этапе А, в 20 мл диметилформамида добавили 1 эквивалент гидрида натрия и 1 эквивалент 2-диметиламиноэтилхлорида гидрохлорида. Через 48 ч при 70 С реакционную смесь охладили; затем ее залили в 80 мл ледяной воды и экстрагировали дихлорметаном. После промывки и высушивания над MgSO4 раствор выпарили при пониженном давлении. Хроматография на силикагеле (этилацетат/циклогексан: 80/20) позволила выделить целевой продукт. Спектр масс: (DIC/NH3): m/z: 429 (M+Н)+ Препарат 8. 1,2-Диамино-6-метокси-3,3,14-триметил-2,3,7,14-тетрагидро-1 Н-бензо[b]пирaно[3,2-h]aкридин-7-он. Хроматография на силикагеле позволила выделить этот попутный продукт, который образуется в процессе синтеза соединения Препарат 6. Пример 1. 6-(2-Гидроксиэтокси)-3,3,14-триметил-3,14-дигидро-7 Н-бензо[b]пирано[3,2-h]акридин-7-он. Раствор 500 мг соединения Препарат 1 в 5 мл дихлорэтана в присутствии 36 мг АlСl3 выдерживали при 70 С в течение 3 ч. Затем реакционную смесь вылили в 10% раствор НСl и экстрагировали дихлорметаном. После обычной обработки органических фаз и их выпаривания при пониженном давлении хроматография осадка на силикагеле (дихлорметан/метанол: градиент от 0,2 до 10%) позволила выделить целевой продукт. Точка плавления: 230 С. Пример 2. 2-Бутирил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7 он. Смесь 0,81 ммоля бутирилхлорида и 0,673 ммоля АlСl3 в 2 мл безводного дихлорметана добавили небольшими порциями к 0,135 ммоля продукта, полученного в примере Препарат 1, в 2 мл дихлорметана при 0 С. Реакционную смесь перемешивали в течение 4 ч при температуре окружающей среды и затем влили в 10% раствор НСl. После обычной обработки органических фаз и их выпаривания при пониженном давлении хроматография осадка на силикагеле (дихлорметан/метанол: градиент от 0,1 до 6%) позволила выделить целевой продукт. Точка плавления: 302 С. Пример 3. 2-Бензоил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7 он. Продукт получили по методике, описанной в примере 2, при применении в качестве реагента бензоилхлорида. Точка плавления: 319 С. Пример 4. 2-Ацетил-6-метокси-3,3,14-триметил-3,14-дигидро-7 Н-бензо[b]пирано[3,2-h]акридин-7 он. Продукт получили по методике, описанной в примере 2, при применении в качестве реагента ацетилхлорида. Точка плавления: 277 С. Пример 5. 2-Бутирил-6-(диэтиламинопропиламино)-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он. Продукт получили по методике, описанной в примере 2, при применении в качестве основы соединения Препарат 3. Пример 6. 2-Бутирил-6-[(2-морфолин-4-ил)этиламино]-3,3,14-триметил-3,14-дигидро-7H-бензо[b] пирано[3,2-h]акридин-7-он. Продукт получили по методике, описанной в примере 2, при применении в качестве основы соединения Препарат 4. Пример 7. -цис-1,2-Дипентеноилокси-6-метокси-3,3,14-триметил-2,3,7,14-тeтparидpo-1H-бeнзo[b] пиpaнo[3,2-h]aкpидин-7-oн. Раствор 1,48 ммоля соединения Препарат 2 в 15 мл безводного пиридина добавили к 14,8 ммоля пентеноилхлорида. Реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч и затем экстрагировали дихлорметаном. Органические фазы объединили и высушили над сульфатом магния, профильтровали, затем выпарили при пониженном давлении. Хроматография осадка на силикагеле (дихлорметан/метанол: градиент от 0,2 до 2%) позволила выделить целевой продукт. Точка плавления: 152 С. Пример 8. -цис-1-Гидрокси-6-метокси-2-пентеноилокси-3,3,14-триметил-2,3,7,14-тетрагидро-1Hбензо[b]пирано[3,2-h]акридин-7-он.- 13005374 Попутный продукт выделили в процессе хроматографии на силикагеле соединения, полученного в примере 7. Точка плавления: 194 С. Пример 9. 6-Метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил бутират. Этап 1. -цис-1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-2-ил бутират. К раствору 0,74 ммоля соединения Препарат 2 в 7 мл безводного пиридина в присутствии 4 диметиламинопиридина добавили 2 эквивалента бутирилхлорида. Реакционную смесь перемешивали при температуре окружающей среды. Через 72 ч добавили 5 эквивалентов бутирилхлорида и смесь опять перемешивали в течение 72 ч, затем выпаривали досуха. Хроматография на силикагеле позволила выделить целевой продукт. Точка плавления: 197 С. Этап 2. 6-Метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3 Н-бвнзо[b]пирано[3,2-h]акридин-2-ил бутират. К раствору 0,29 ммоля соединения, полученного на этапе 1, в 6 мл дихлорметана добавили 4 капли 10% раствора НСl. Реакционную смесь перемешивали при температуре окружающей среды в течение 3 дней, затем высушили и выпарили при пониженном давлении. Хроматография осадка на силикагеле (дихлорметан/метанол: градиент от 0,2 до 5%) позволила выделить целевой продукт. Точка плавления: 180 С. Пример 10. 6-Метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано-[3,2-h]акридин-2 ил ацетат. Этап 1. -цис-1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-2-ил ацетат. Продукт получили по методике, описанной применительно к этапу 1 примера 9, с применением в качестве реагента ацетилхлорида. Этап 2. 6-Метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3 Н-бeнзо[b]пирано-[3,2-h]акридин-2-ил ацетат. Продукт получили по методике, описанной применительно к этапу 2 примера 9, с применением в качестве основы соединения, полученного на описанном выше этапе 1. Точка плавления: 165 С. Пример 11. (1S,2S)-1-[(Диметиламино)карбонил]окси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14 тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил диметилкарбамат. В колбе 0,698 ммоля гидрида калия трижды промыли гексаном, затем охладили до -10 С и добавили раствор 0,123 ммоля соединения Препарат 2 в 4 мл безводного тетрагидрофурана. После капельного добавления 0,327 ммоля N,N-диметилкарбамоилхлорида при -10 С производили перемешивание в течение 3 ч 30 мин при температуре окружающей среды. Реакцию остановили при помощи добавления 50 мл этилацетата и 10 мл насыщенного раствора NaHCO3, имея целью получить рН 8. Органическую фазу промыли водой и высушили над сульфатом магния. После выпаривания при пониженном давлении и кристаллизации из этилацетата выделили целевой продукт. Точка плавления: 173 С. Пример 12. (1S,2S)-6-Метокси-3,3,14-триметил-2-[(4-метилфенил)сульфонил]окси-7-оксо-2,3,7,14 тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-1-ил 4-метилбензолсульфонат. Продукт получили по методике, описанной в примере 11, с применением в качестве реагента тозилхлорида. Пример 13. (1S,2S)-6-[3-(Диэтиламино)пропил]амино-1-[(диметиламино)карбонил]окси-3,3,14 триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил диметилкарбамат. Продукт получили по методике, описанной в примере 11, этапы 1-2, с применением в качестве основы продукта Препарат 5. Пример 14. (1S,2S)-1-[(Диметиламино)карбонил]амино-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14 тетрaгидpо-1 Н-бензо[b]пирано-[3,2-h]акридин-2-ил диметилкарбамат. Продукт получили по методике, описанной в примере 11, этапы 1-2, с применением в качестве основы продукта Препарат 6. Пример 15. N'-(1S,2S)-1-[(Диметиламино)карботиоил]aмино-6-метокси-3,3,14-триметил-7-оксо 2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-2-ил-N,N-диметилтиомочевина. Продукт получили по методике, описанной в примере 11, этапы 1-2, с применением продукта Препарат 8 в качестве основы и диметилтиокарбамоилхлорида в качестве реагента. Пример 16. 6-[2-(Диметиламино)этокси]-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил бутират. Продукт получили по методике, описанной в примере 9, этапы 1-2, с применением соединения Препарат 7 в качестве основы на этапе 1.- 14005374 Пример 17. 13-Амино-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано-[3,2-h]акридин 7-он. Этап 1. 3-Ацетамидо-4-нитро-2-нафталинкарбоновая кислота. Раствор 5 г 3-амино-2-нафталинкарбоновой кислоты в 40 мл уксусного ангидрида перемешивали при температуре окружающей среды в течение 30 мин и затем капельно добавили 5 мл азотной кислоты. Далее реакционную смесь перемешивали на ледяной бане в течение 7 дней, а затем вылили на лед. Образовавшийся осадок отфильтровали, промыли водой, затем высушили и промыли в 40 мл метанола, что позволило после высушивания выделить целевой продукт. Точка плавления: 235 С. Этап 2. 3-Амино-4-нитро-2-нафталинкарбоновая кислота. Раствор 1 г соединения, полученного на этапе 1, в 18 мл соляной кислоты нагревали в течение 4 ч и затем вылили на лед. Образовавшийся осадок отфильтровали и промывали водой до тех пор, пока не довели рН до 5-6, затем высушили, что позволило выделить целевой продукт. Точка плавления: 238 С. Этап 3. 3-Хлор-4-нитро-2-нафталинкарбоновая кислота. 1,2 г нитрита натрия медленно добавили к 13 мл концентрированной серной кислоты; поддерживали температуру 70 С до тех пор, пока нитрит натрия не растворился полностью; затем раствор охладили до 20 С. Раствор 3 г соединения, полученного на описанном выше этапе 2, в 27 мл уксусной кислоты осторожно добавили к реакционной смеси. Далее раствор нагрели до 40 С и поддерживали эту температуру в течение 30 мин, затем охладили на ледяной бане. Раствор хлористой меди (3,3 г) в 30 мл концентрированной соляной кислоты охладили на ледяной бане и медленно добавили приготовленный заранее раствор диазойного соединения. Затем температуру реакционной смеси довели до 80 С и реакционную смесь перемешивали до тех пор, пока не прекратилось выделение газа. В процессе охлаждения реакционной смеси на ледяной бане к ней добавили воду. Сформировавшийся осадок отфильтровали, тщательно промыли водой и высушили. Кристаллизация из дихлорметана позволила получить целевой продукт. Точка плавления: 246 С. Этап 4. 3-[(2,2-Диметил-7-метокси-2 Н-хромен-5-ил)амино]-4-нитро-2-нафталинкарбоновая кислота. К 3,3 г 5-амино-7-метокси-2,2-диметилхромена добавили 3 г соединения, полученного на описанном выше этапе 3, 3,4 г ацетата калия, 375 мг Сu(ОАс)2H2 О и 120 мл 2-пропанола, содержащего 3,8 мл триэтиламина. Раствор нагревали в течение 5 дней и затем выпарили при пониженном давлении. Осадок внесли в смесь 1/1 дихлорметана и 1N водного раствора НСl. После экстрагирования водной фазы органические фазы объединили и подвергли обычной обработке. Хроматография на силикагеле (дихлорметан/метанол: градиент от 0,1 до 1%) позволила выделить целевой продукт. Точка плавления: 165 С. Этап 5. 6-Метокси-3,3-диметил-13-нитро-3,14-дигидро-7 Н-бензо[b]пирано[3,2-b]акридин-7-он. 772 мг соединения, полученного на этапе 4, растворили в 45 мл безводного дихлорметана и добавили 3 мл трифторуксусного ангидрида. После перемешивания в течение 5 мин при температуре окружающей среды реакционную смесь выпарили. Осадок перенесли в смесь дихлорметана и насыщенного раствора NaHCO3. После экстрагирования водной фазы дихлорметаном органические фазы объединили и подвергли обычной обработке, затем произвели дистилляцию, что позволило выделить целевой продукт. Точка плавления: 350 С. Этап 6. 6-Метокси-3,3,14-триметил-13-нитро-3,14-дигидро-7 Н-бензо[b]пирано[3,2-h]акридин-7-он. К раствору 300 мг соединения, полученного на этапе 5, в 30 мл диметилформамида добавили 1,48 г гидрида натрия и затем 1,8 мл иодметана. Реакционную смесь нагревали в атмосфере азота в течение 3 дней и затем медленно произвели гидролизацию при помощи добавления льда. Образовавшийся осадок отфильтровали, затем высушили и подвергли хроматографии на силикагеле (дихлорметан/метанол: градиент от 0,1 до 0,5%), что позволило выделить целевой продукт. Точка плавления: 283 С. Этап 7. 13-Амино-6-метокси-3,3,14-триметил-3,14-дигидро-7 Н-бензо[b]пирано[3,2-h]акридин-7-он. К 178 мг соединения, полученного на описанном выше этапе 6, в 10 мл уксусной кислоты и 1 мл воды добавили 621 мг цинковой ваты. Реакционную смесь перемешивали при температуре окружающей среды в течение 2,5 ч, затем профильтровали. Фильтрат перевели в щелочную область при помощи 10% водного раствора гидроксида аммония; образовавшийся осадок отделили фильтрацией. Нерафинированный осадок очистили хроматографией на силикагеле (дихлорметан/метанол: градиент от 0,1 до 0,5%),что позволило выделить целевой продукт. Точка плавления: 157 С. Пример 18. 2,2,2-Трифтор-N-(6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензo[b]пирано[3,2-h]акридин-13-ил)ацетамид. Раствор 0,039 ммоля соединения, полученного в примере 17, в 7 мл безводного пиридина перемешивали в атмосфере аргона при -20 С и добавили 0,15 ммоля трифторуксусного ангидрида. Реакцион- 15005374 ную смесь перемешивали в течение 6 ч при -20 С, затем разбавили при помощи 15 мл метанола и сконцентрировали при пониженном давлении. Хроматография осадка на силикагеле (дихлорметан/метанол: 99,9/0,1) позволила выделить целевой продукт. Пример 19. N-(6-Метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин 13-ил)ацетамид. Продукт получили по методике, описанной в примере 18, с применением уксусного ангидрида в качестве реагента. Пример 20. 6-Метокси-3,3,14-триметил-1,7-диоксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h] акридин-2-ил ацетат. Этап 1. 2-Гидрокси-6-метокси-3,3,14-триметил-2,3-дигидро-1H-бензо[b]пирано-[3,2-h]акридин-1,7(14 Н)-дион. Суспензию 1,28 г КМnO4 в 15 мл воды капельно в течение 30 мин добавляли к раствору 0,5 г продукта, полученного в примере Препарат 1, растворенного в 25 мл ацетона. Реакционную смесь перемешивали при температуре окружающей среды в течение 8 ч, затем экстрагировали 2-бутаноном. Органическую фазу подвергли обычной обработке, и хроматография осадка на силикагеле (дихлорметан/метанол: 98/2) позволила выделить целевой продукт. Точка плавления: 272 С. Этап 2. 6-Метокси-3,3,14-триметил-1,7-диоксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат. Продукт получили по методике, описанной на этапе 1 примера 9, с применением уксусного ангидрида в качестве реагента. Точка плавления: 206 С. Пример 21. 6-Метокси-3,3,14-триметил-1,7-диоксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил пропионат. Продукт получили по методике, описанной в примере 20, с применением пропионового ангидрида в качестве реагента на этапе 2. Точка плавления: 218 С. Пример 22. 6-Метокси-3,3-диметил-1,7-диоксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат. Этап 1. 3-[(8-Метокси-2,2-диметил-2 Н-хромен-5-ил)амино]-2-нафтойная кислота. Раствор, содержащий 1,2 ммоля 3-бромнафталин-2-карбоновой кислоты, 1,19 ммоля 7-метокси-2,2 диметил-2H-1-бензопиран-5-иламина, 2,38 ммоля ацетата калия, 10 мг Сu(ОАс)2 Н 2 О и 1,19 ммоля триэтиламина в 17 мл 2-пропанола, нагревали в течение 24 ч, затем сконцентрировали при пониженном давлении. Полученный осадок поместили в смесь 2/1 дихлорметан/1N НСl. Водную фазу экстрагировали дихлорметаном, органические фазы объединили и подвергли обычной обработке. Хроматография осадка на силикагеле (дихлорметан) позволила выделить целевой продукт. Этап 2. 6-Метокси-3,3-диметил-3,14-дигидро-7 Н-бензо[b]пирано[3,2-h]акридин-7-он. К раствору, содержащему 1,94 ммоля соединения, полученного на этапе 1, в 20 мл безводного дихлорметана, который выдерживали при 0 С в атмосфере аргона, добавили 9,71 ммоля трифторуксусного ангидрида. После проведения реакции в течение 3 дней при температуре окружающей среды реакционную смесь сконцентрировали при пониженном давлении. Осадок перенесли в смесь дихлорметана и водного раствора NaHCO3. После экстрагирования дихлорметаном органические фазы объединили и подвергли обычной обработке. Хроматография осадка на силикагеле (дихлорметан) позволила выделить целевой продукт, впоследствии произвели его перекристаллизацию из этилового эфира. Точка плавления: 278 С. Этап 3. 2-Гидрокси-6-метокси-3,3-диметил-2,3-дигидро-1H-бензо[b]пирано[3,2-h]акридин-1,7(14H)дион. К раствору 1,33 ммоля соединения, полученного на этапе 2, в 30 мл смеси 10/3/1 третбутанол/тетрагидрофуран/вода добавили тетроксид осмия в в виде 2,5% раствора в 0,67 мл 2-метил-2 пропаноле и 1,35 ммоля 4-метилморфолин-N-оксида моногидрата. После перемешивания в течение 2 дней при температуре окружающей среды добавили раствор NаНSО 3. После перемешивания в течение 1 ч реакционную смесь экстрагировали дихлорметаном. Органическую фазу высушили, профильтровали,затем выпарили при пониженном давлении. Хроматография осадка на силикагеле (дихлорметан/метанол: 98/2) позволила выделить целевой продукт. Точка плавления: 230 С. Этап 4. 6-Метокси-3,3-диметил-1,7-диоксо-2,3,7,14-тетрагидро-1 Н-бензо[b]пирано[3,2-h]акридин-2 ил ацетат. Продукт получили по методике, описанной на этапе 2 примера 20, с применением избытка уксусного ангидрида. Точка плавления: 206 С.- 16005374 Пример 23: -цис-1-[(Диэтиламино)карбонил]окси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14 тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил-диэтилкарбамат. Продукт получили по методике, описанной в примере 11, с применением N,N-диэтилкарбамоилхлорида в качестве реагента. Точка плавления: 193 С. Пример 24. -цис-1-[(Диизопропиламино)карбонил]окси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-илдиизопропилкарбамат. Продукт получили по методике, описанной в примере 11, с применением N,N-диизопропилкарбамоилхлорида в качестве реагента. Точка плавления: 149,5 С. Пример 25. -цис-1-[(Дибутиламино)карбонил]окси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14 тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-илдибутилкарбамат. Продукт получили по методике, описанной в примере 11, с применением N,N-дибутилкарбамоилхлорида в качестве реагента. Точка плавления: 138 С. Пример 26. 6-Метокси-3,3-диметил-1,7-диоксо-2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил пропионат. К предварительно охлажденному раствору безводного пиридина (1,5 мл) и избытку пропионового ангидрида добавили 0,26 ммоля соединения, полученного на этапе 3 примера 22. Реакционную смесь перемешивали при температуре окружающей среды, в закрытом от света месте, в течение 24 ч, затем вылили в ледяную воду (10 мл). Полученный осадок отфильтровали, промыли водой и высушили в вакууме с фосфором. Хроматография осадка на силикагеле (дихлорметан) позволила выделить целевой продукт. Точка плавления: 231 С. Фармакологическое исследование соединений по данному изобретению Пример 27. Активность in vitro. Мышиная лейкемия L1210 была применена in vitro. Клетки культивировали в клеточной среде комплекта RPMI 1640, содержащей 10% эмбриональной сыворотки телят, 2 мМ глютамина, 50 единиц/мл пенициллина, 50 мкг/мл стрептомицина и 10 мМ Hepes, pH: 7,4. Клетки распределили по микропластинкам и подвергали воздействию цитотоксических соединений в течение 4 периодов удвоения или 48 ч. Затем подсчитывали количество жизнеспособных клеток при помощи колориметрического анализатораMicroculture Tetrazolium Assay (J. Carmichael et al., Cancer Res., 47, 936-942, (1987. Результаты выражены в виде IС 50, концентрации цитотоксического агента, которая ингибирует пролиферацию обработанных клеток на 50%. В качестве иллюстрации можно указать, что у соединений из примеров 11 и 7 IС 50 составила 0,78 мкМ и 0,52 мкМ соответственно, и, таким образом, они проявляют более высокую активность,чем выбранное для сравнения соединение (акроницин). Пример 28. Aктивность in vitro. 1. Противоопухолевая активность по отношению к лейкемии Р 388. Линия Р 388 (мышиная лейкемия) была приобретена у National Cancer Institute (Frederick, USA). Клетки опухоли (106 клеток) были инокулированы в день 0 в брюшную полость самки мыши B6D2F1(Iffa Credo, France). В каждой экспериментальной группе было по 6 мышей весом от 18 до 20 г. Продукты назначали внутривенно в день 1. Противоопухолевую активность выражали в % Т/С: В этой модели соединения по данному изобретению проявляют весьма высокую активность, они имеют Т/С 150%, в то время как акроницин проявляет только минимальную активность. 2. Противоопухолевая активность по отношению к аденокарциноме С 38 толстого кишечника. Фрагменты опухоли аденокарциномы толстого кишечника С 38, которые весили примерно 30 мг,были имплантированы под кожу мыши B6D2F1 (Iffa Credo, France) в день 0. После вырастания опухоли мышей разделяли на контрольную (18 животных) и обработанную (6 или 7 животных) группы, которые были однородны в отношении размеров опухоли. Продукты назначали внутривенно 1 раз в неделю в течение 3 недель (на 10, 17 и 24 день), в их максимально переносимой дозе(MTD), MTD/2 и MTD/4. Опухоли измеряли дважды в неделю и рассчитывали объемы опухоли в соответствии со следующей формулой: объем (мм 3) = длина (мм)ширина (мм 2)/2. Противоопухолевую активность выражали как % Т/С:V0 и Vt обозначают исходный объем опухоли и ее объем на момент измерения t соответственно.- 17005374 Оптимальной дозой является такая, которая приводит к самым низким значениям Т/С, не будучи токсичной (ранняя гибель или потеря веса более чем на 20%). Например, соединения из примеров 7 и 11 проявляют противоопухолевую активность 30% при оптимальной дозе 12,5 мг/кг и 41% при оптимальной дозе 25 мг/кг соответственно, в то время как акроницин проявляет противоопухолевую активность 27% при оптимальной дозе 100 мг/кг, что, таким образом,свидетельствует об их значительном терапевтическом потенциале. Пример 29. Фармацевтические композиции: раствор для инъекций. Соединение из примера 11 10 мг Дистиллированная вода для инъекционных препаратов 25 мл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой Х и Y, которые могут быть одинаковыми или различными представляют собой независимо друг от друга, группу, выбранную из атомов водорода или галогена,меркапто, циано, нитро, линейной или разветвленной (С 1-С 6)алкильной, линейной или разветвленной (С 1-С 6)тригалоалкильной и линейной или разветвленной тригало-(С 1-С 6)алкилкарбониламиногруппы,групп формул -ORa, -NRaRb, -NRa-C(O)-T1, -O-C(O)-T1, -OT2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb,-NRa-T2-ORa и -NRa-T2-CO2Ra, в которыхRa представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной группы, арильной группы и арил-(С 1-С 6)алкильной группы, в которых алкильный компонент является линейным или разветвленным,Rb представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной группы, арильной группы и арил-(С 1-С 6)алкильной группы, в которых алкильный компонент является линейным или разветвленным, илиRa+Rb, вместе с несущим их атомом азота, образуют моноцоклическое 5- или 6-членное гетероциклическое соединение, которое может содержать в циклической системе второй гетероатом, выбранный из кислорода и азота,T1 представляет собой группу, выбранную из линейной или разветвленной (С 1-С 6)алкильной, линейной или разветвленной (С 2-С 6)алкенильной, арильной, арил(С 1-С 6)алкильной (в которых алкильный компонент является линейным или разветвленным) и линейной или разветвленной (С 1-С 6)алкиленовой цепочки, замещенной группой, выбранной из -ORa и -NRaRb, где Ra и Rb соответствуют приведенным выше определениям,Т 2 представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепочку,или Х и Y, если они находятся на соседних положениях, вместе образуют метилендиоксигруппу или этилендиоксигруппу, причем подразумевается, что заместители Х и Y могут находиться на любом из двух соседних бензольных колец,R1 представляет собой атом водорода или линейную либо разветвленную (С 1-С 6)алкильную группу,R2 представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной, -ORa, -NRaRb, -NRa-C(O)-T1, -О-С(О)-T1, -O-T2-NRaRb, -O-T2-ORa, -NRa-T2-NRaRb, -NRaT2-ORa и -NRa-Т 2-CO2Ra групп, где Ra, Rb, T1 и Т 2 соответствуют приведенным выше определениям,R3, R4, которые могут быть одинаковыми или различными, представляют собой независимо друг от друга атом водорода или линейную либо разветвленную (С 1-С 6)алкильную группу,W представляет собой группу формулы -СН(R5)-СН(R6)-, -CH=C(R7)-, -С(R7)-СН- или C(O)-CH(R8)-,гдеW1 представляет собой атом кислорода или серы либо атом азота, замещенный атомом водорода или линейной или разветвленной (С 1-С 6)алкильной группой, арильной группой или арил-(С 1-С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным,W2 представляет собой атом кислорода или серы,- 18005374W3 представляет собой атом водорода или серы либо атом азота, замещенный атомом водорода или линейной либо разветвленной (С 1-С 6)алкильной группой, арильной группой или арил-(С 1-С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным, связь, когда T1 представляет собой линейную или разветвленную (С 2-С 6)алкенильную группу,W4 представляет собой атом серы или атом азота, замещенный атомом водорода или линейной или разветвленной (С 1-С 6)алкильной группой, арильной группой или арил-(С 1-С 6)алкильной группой, в которых алкильный компонент является линейным или разветвленным,T1 соответствует приведенному выше определению,T'1 представляет собой группу, выбранную из линейной или разветвленной (С 2-С 6)алкенильной,арильной, арил-(С 1-С 6)алкильной (в которых алкильный компонент является линейным или разветвленным) и линейной или разветвленной (С 1-С 6)алкиленовой цепочки, замещенной группой, выбранной из ORa и -NraRb, где Ra и Rb соответствуют приведенным выше определениям,n обозначает целое число, выбранное из 1 и 2,и в случае, когда только одна из двух групп R5 и R6 представляет собой группу, соответствующую приведенным выше определениям, то вторая из названных групп R5 или R6 представляет собой группу,выбранную из атома водорода, гидрокси-, линейной или разветвленной (С 1-С 6)алкокси-, линейной или разветвленной (С 1-С 6)алкилкарбонилокси-, арилкарбонилокси-, арил-(С 1-С 6)алкилкарбонилокси- (в которых алкильный компонент является линейным или разветвленным) и аминогруппы, которая может быть замещенной одной или двумя, одинаковыми или различными, линейными или разветвленными (C1 С 6)алкильными группами,R7 представляет собой группу, выбранную из гидрокси-, линейной или разветвленной (С 1-С 6)алкокси-,-C(W2)-T1, -W1-C(W2)-W3-T1, -W1-C(W2)-T1, -W1-S(O)n-W3-T1 и -W1-S(O)n-T1, где W1, W2, W3, T1 и n соответствуют приведенным выше определениям, или R7 может дополнительно обозначать атом водорода,когда R2 представляет собой группу -O-T2-ORa и/или когда Х представляет собой атом водорода и Y,расположенный на 13-м положении нафтильной системы пентациклического скелета, представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейной или разветвленной (С 1-С 6)алкильной, линейной или разветвленной (С 1-С 6)ацильной и линейной или разветвленной тригало-(С 1 С 6)алкилкарбонильной групп,R8 представляет собой линейную или разветвленную (С 1-С 6)алкокси- или линейную или разветвленную (С 1-С 6)алкилкарбонилоксигруппу или может дополнительно принимать значение гидроксигруппы, когда R2 представляет собой группу -O-T2-ORa, которая определена выше,их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотами или основаниями; подразумевается, что арил представляет собой фенильную или нафтильную группу, которая может содержать один или более одинаковых или различных заместителей, выбранных из гидроксигруппы, галогена, карбокси-, нитро-, амино-, линейной или разветвленной (С 1-С 6)алкиламино-, ди(С 1 С 6)алкиламиногруппы, где каждый алкильный компонент может быть линейным или разветвленным,линейной или разветвленной (С 1-С 6)алкоксигруппы, линейной или разветвленной (С 1-С 6)ацильной группы и линейной или разветвленной (С 1-С 6)алкилкарбонилоксигруппы, и подразумевается, что в число изомеров входят оптические изомеры. 2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA) где X, Y, R1, R2, R3, R4, R5 и R6 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 3. Соединения формулы (I) по п.2, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 одинаковы и каждый из них обозначает группу формулы -W1-C(W2)-W3T1 или -W1-S(O)n-T1, где W1, W2, W3, T1 и n соответствуют определениям, приведенным для формулы (I),их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 одинаковы и каждый из них обозначает группу формулы-W1-C(W2)-W3-T1, где W1 представляет собой атом кислорода, W2 представляет собой атом кислорода,- 19005374W3 представляет собой атом азота, замещенный атомом водорода, линейную или разветвленную (С 1 С 6)алкильную группу, арильную группу или арил-(С 1-С 6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, а T1 соответствует определению, приведенному для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 5. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 одинаковы и каждый из них обозначает группу формулы-W1-S(O)n-T1, где W1 представляет собой атом кислорода, T1 соответствует определению, приведенному для формулы (I), и n равно 2, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 6. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IВ) где X, Y, R1, R2, R3, R4 и R7 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 7. Соединения формулы (I) по любому из пп.1 или 6, отличающиеся тем, что они представляют собой соединения формулы (IВ), в которой R7 обозначает группу, выбранную из -C(W2)-T1 и -W1-C(W2)-T1,где W1, W2 и T1 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 8. Соединения формулы (I) по п.7, отличающиеся тем, что они представляют собой соединения формулы (IB), в которой W1 обозначает атом кислорода, W2 обозначает атом кислорода и T1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу или арил-(С 1 С 6)алкильную группу, в которых алкильный компонент является линейным или разветвленным, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 9. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IС) где X, Y, R1, R2, R3, R4 и R5 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 10. Соединения формулы (I) по любому из пп.1-9, отличающиеся тем, что R3 и R4, которые могут быть одинаковыми или различными, представляют собой линейную или разветвленную (С 1 С 6)алкильную группу, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 11. Соединения формулы (I) по любому из пп.1-9, отличающиеся тем, что R2 представляет собой группу, выбранную из линейной или разветвленной (С 1-С 6)алкокси, -NRaRb, -О-T2-NRaRb, -О-Т 2-ОRа,-NRa-T2-NRaRb и -NRa-T2-ORa, где Ra, Rb, T1 и Т 2 соответствуют определениям, приведенным для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 12. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB1) где R1, R2, R3 и R4 соответствуют определениям, приведенным для формулы (IB), а Y представляет собой аминогруппу, которая может быть замещенной одной или двумя одинаковыми или различными группами, выбранными независимо друг от друга из линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)ацила и линейного или разветвленного тригало-(С 1-С 6)алкилкарбонила, их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 13. Соединения формулы (I) по п.1, которые представляют собой(1S,2S)-6-метокси-3,3,14-триметил-2-[(4-метилфенил)сульфонил]окси-7-оксо-2,3,7,14-тетрагидро 1H-бензо[b]пирано[3,2-h]акридин-1-ил 4-метилбензолсульфонат,их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 14. Соединения формулы (I) по п.1, которые представляют собой 6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат,2-бензоил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,2-бутирил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,2-ацетил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-2-ил бутират,6-(2-гидроксиэтокси)-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он,13-амино-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[b]пирано[3,2-h]акридин-7-он иN-(6-метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[b]пирано[3,2-h]акридин-13-ил)ацета-мид,их энантиомеры, диастереоизомеры и N-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 15. Соединение формулы (I) по п.1, которое представляет собой 6-метокси-3,3-диметил-1,7-диоксо 2,3,7,14-тетрагидро-1H-бензо[b]пирано[3,2-h]акридин-2-ил ацетат, его энантиомеры, диастереоизомеры иN-оксиды, а также их дополнительные соли с фармацевтически приемлемыми кислотой или основанием. 16. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение по любому из пп.1-15, самостоятельно или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми эксципиентами или носителями. 17. Фармацевтические композиции по п.16, включающие по крайней мере один активный ингредиент по любому из пп.1-15 для применения в качестве медицинских препаратов для лечения раковых заболеваний. 18. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение формулы (XXI) где X, Y, R1, R2, R3 и R4 соответствуют определениям, приведенным в п.1 для соединения формулы (I),самостоятельно или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми эксципиентами или носителями. 19. Фармацевтические композиции по п.18, включающие в качестве активного ингредиента 2 гидрокси-6-метокси-3,3-диметил-2,3-дигидро-1H-бензо[b]пирано[3,2-h]акридин-1,7(14H)-дион, самостоятельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями. 20. Фармацевтические композиции по любому из пп.18 или 19 для применения в качестве медицинских препаратов для лечения раковых заболеваний. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 491/052, A61K 31/4741, A61P 35/00, C07D 221/04, C07D 311/00
Метки: фармацевтические, бензо, получения, композиции, новые, соединения, b]пирано[3,2-h]акридин-7-она, содержащие, способ
Код ссылки
<a href="https://eas.patents.su/22-5374-novye-soedineniya-benzo-bpirano32-hakridin-7-ona-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения бензо [b]пирано[3,2-h]акридин-7-она, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Производные 3 (5)-аминопиразола, способ их получения и их применение в качестве противоопухолевых средств
Следующий патент: Производные арилметилкарбониламинотиазола и их применение в качестве противоопухолевых средств
Случайный патент: Суперабсорбционные материалы на основе бутилкаучука, способ их получения и их применение