3, 4, 5-тризамещенные арилнитроны и содержащие их фармацевтические композиции
Номер патента: 4931
Опубликовано: 28.10.2004
Авторы: Мавандади Фарах, Вилкокс Аллан Л., Даниелзадех Альберт, Вотербери Л.Дэвид, Карни Джон М.
Формула / Реферат
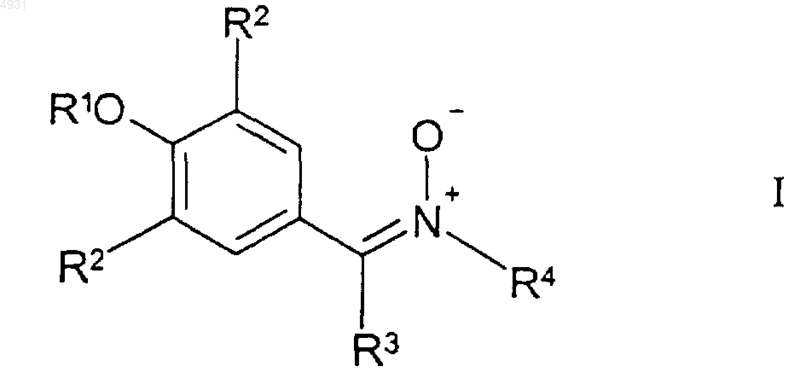
1. Соединение формулы I
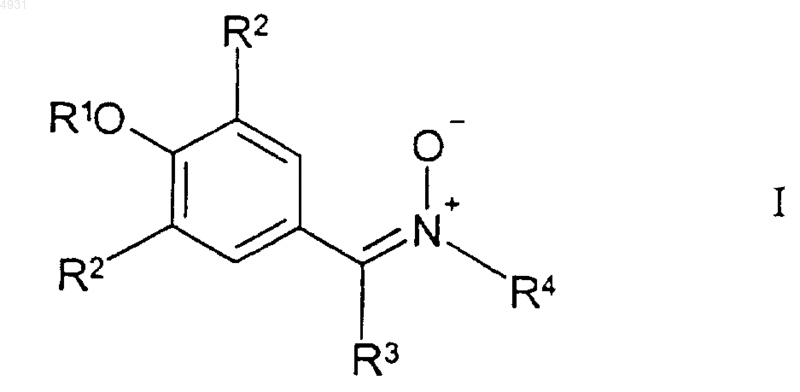
где R1 выбран из группы, включающей
каждый R2 независимо выбран из группы формулы
R3 представляет собой атом водорода;
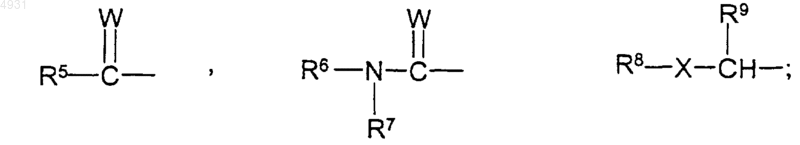
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметильной или C1-6алкоксигруппой, или C3-10циклоалкил;
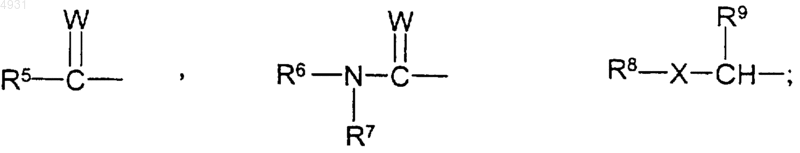
R5 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкильную группу, C3-10циклоалкил;
R6 и R7 независимо выбраны из группы, включающей атом водорода, C1-10алкил, который может быть замещен C1-6алкоксикарбонилом или C1-6алкоксигруппой, C3-10циклоалкил; или R6 и R7 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R8 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкильную группу и C3-10циклоалкил;
R9 выбран из группы, включающей атом водорода, C1-10алкил, C3-10циклоалкил; или R8 и R9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
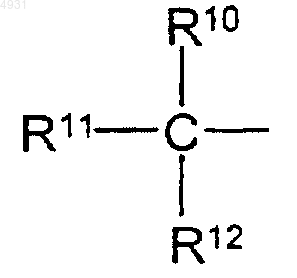
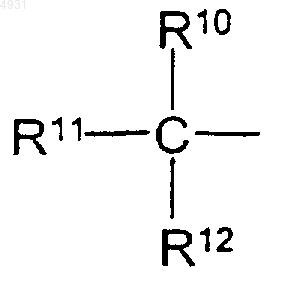
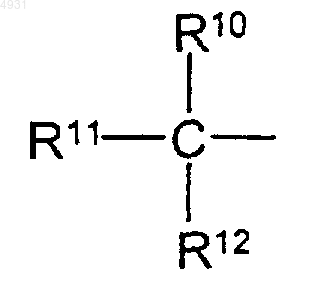
R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода,
X представляет собой атом кислорода,
W представляет собой атом кислорода;
а также их фармацевтически приемлемые соли.
2. Соединение по п.1, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкокси или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, или C3-10циклоалкил.
3. Соединение по п.2, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-тиометилпропил, 3-(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
4. Соединение по п.1, где R5 выбран из группы, включающей C1-6алкил, C1-6алкоксиалкильную группу и C3-10циклоалкил.
5. Соединение по п.4, где R5 выбран из группы, включающей метил, этил, н-пропил, изопропил и н-бутил.
6. Соединение по п.1, где R7 представляет собой атом водорода и R6 выбран из группы, включающей C1-6алкил или C1-6алкоксикарбонилалкил.
7. Соединение по п.6, где R6 выбран из группы, включающей этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этил.
8. Соединение по п.1, где X представляет собой атом кислорода, R9 представляет собой атом водорода и R8 представляет собой C1-6алкил или C1-6алкоксиалкил.
9. Соединение по п.8, где R8 выбран из группы, включающей метил и метоксиэтил.
10. Соединение по п.9, где R10, R11 и R12 представляют собой метил.
11. Соединение по п.1, имеющее формулу
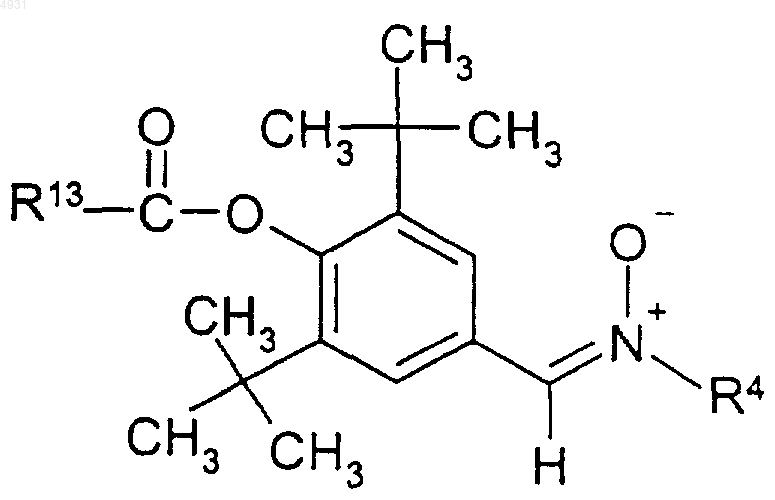
где R13 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкил, C3-C10циклоалкил;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметильной или C1-6алкоксигруппой, и C3-10 циклоалкил;
а также его фармацевтически приемлемые соли.
12. Соединение по п.11, где R13 представляет собой алкил, содержащий 1-6 атомов углерода.
13. Соединение по п.11, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил.
14. Соединение по п.13, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-тиометилпропил, 3-(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
15. Соединение по п.1, имеющее формулу
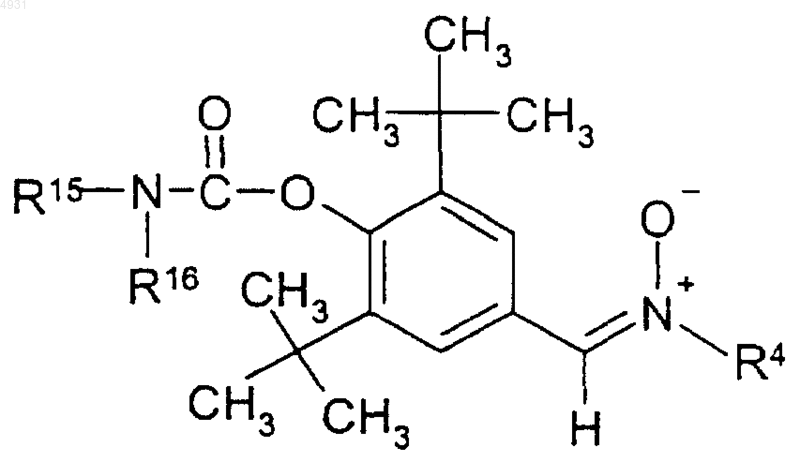
где R15 и R16 независимо выбраны из группы, включающей атом водорода, C1-10алкил, который может быть замещен C1-6алкоксикарбонилом или C1-6алкоксигруппой, C3-10циклоалкил; или R15 и R16 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, или C3-10 циклоалкил;
и его фармацевтически приемлемые соли.
16. Соединение по п.15, где R16 представляет собой атом водорода и R15 выбран из группы, включающей C1-10алкил или C1-6алкоксиалкильную группу.
17. Соединение по п.16, где R15 выбран из группы, включающей этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил, 2-(этоксикарбонил)этил.
18. Соединение по п.15, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, или C3-10циклоалкил.
19. Соединение по п.18, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.бутил, циклогексил, 3-тиометилпропил, 3-(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
20. Соединение по п.1, имеющее формулу
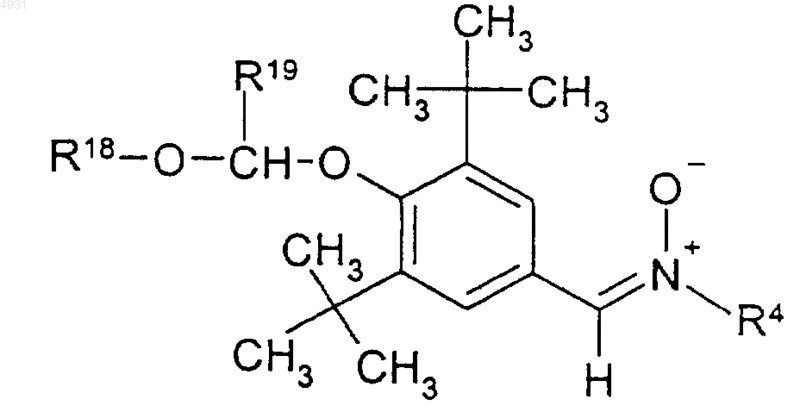
где R18 выбран из группы, включающей C1-10алкил, C1-10 алкоксиалкил или C3-10циклоалкил;
R19 выбран из группы, включающей атом водорода, C1-10алкил, C3-10циклоалкил; или R18 и R19 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил;
и его фармацевтически приемлемые соли.
21. Соединение по п. 20, где R19 представляет собой атом водорода и R18 представляет собой C1-10алкил или C1-10алкоксиалкил.
22. Соединение по п.21, где R18 представляет собой метил или метоксиэтил.
23. Соединение по п.20, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, или C3-10циклоалкил.
24. Соединение по п.23, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-тиометилпропил, 3-(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
25. Соединение по п.1, выбранное из группы, включающей
a -(4-ацетокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон;
a -(4-изобутаноилокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон;
a -(4-н-бутаноилоксш-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон;
a -(4-ацетокси-3,5-ди-трет.-бутилфенил)-N-изопропилнитрон;
a -(4-ацетокси-3,5-ди-трет.-бутилфенил)-N-1-гидрокси-2-метилпроп-2-илнитрон;
a -(4-н-пентаноилокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон;
a -(4-ацетокси-3,5-ди-трет.-бутилфенил)-N-4-трифторметилфенилнитрон;
a -(4-пропионилокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон;
a -(4-ацетокси-3,5-ди-трет.-бутилфенил)-N-метилнитрон;
a -(4-ацетокси-3,5-ди-трет.-бутилфенил)-N-3,4,5-триметоксифенилнитрон;
a -[(4-этиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.-бутилнитрон;
a -[4-(н-пропиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.-бутилнитрон;
a -[4-(н-бутиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.-бутилнитрон;
a -[4-(2-этоксикарбонилэтиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.-бутилнитрон;
a -[4-(2-этоксикарбонил)метиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.-бутилнитрон;
a -(4-метоксиметокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон;
a -[4-(2-метоксиэтоксиметокси)-3,5-ди-трет.-бутилфенил]-N-трет.-бутилнитрон;
a -[4-метоксиметокси-3,5-ди-трет.-бутилфенил]-N-3-(тиометокси)бут-1-илнитрон;
a -[4-метоксиметокси-3,5-ди-трет.-бутилфенил]-N-3-тиометоксипропилнитрон;
и их фармацевтически приемлемые соли.
26. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы I
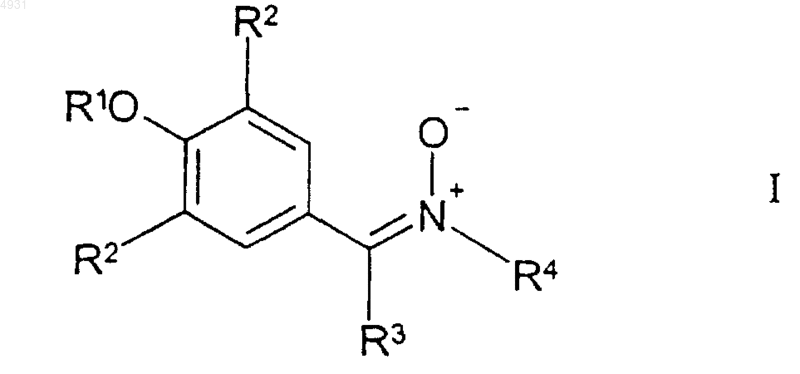
где R1 выбран из группы, включающей
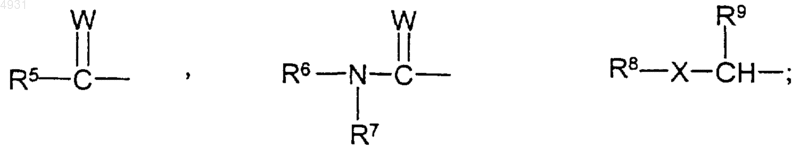
каждый R2 независимо выбран из группы формулы
R3 представляет собой атом водорода;
R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой или фенилом, замещенным трифторметильной или C1-6алкоксигруппой, и C3-10циклоалкил;
R5 выбран из группы, включающей C1-10 алкил, C1-10алкоксиалкильную группу, C3-10циклоалкил;
R6 и R7 независимо выбраны из группы, включающей атом водорода, C1-10алкил, который может быть замещен C1-6алкоксикарбонилом или C1-6алкоксигруппой, C3-10циклоалкил; или R6 и R7 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R8 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкильную группу и C3-10циклоалкил;
R9 выбран из группы, включающей атом водорода, C1-10алкил, C3-10циклоалкил; или R8 и R9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода,
X представляет собой атом кислорода,
W представляет собой атом кислорода;
а также их фармацевтически приемлемые соли.
27. Фармацевтическая композиция по п.26, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксируппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил.
28. Фармацевтическая композиция по п.27, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-(тиометокси)бут-1-ил, 3-тиометилпропил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
29. Фармацевтическая композиция по п.26, где R5 выбран из группы, включающей C1-6 алкил, C1-6алкоксиалкильную группу и C3-10 циклоалкил.
30. Фармацевтическая композиция по п.29, где R5 выбран из группы, включающей метил, этил, н-пропил, изопропил и н-бутил.
31. Фармацевтическая композиция по п.26, где R7 представляет собой атом водорода и R6 выбран из группы, включающей C1-10алкил и C1-6алкоксикарбонилалкильную группу.
32. Фармацевтическая композиция по п.31, где R6 выбран из группы, включающей этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этил.
33. Фармацевтическая композиция по п.26, где X представляет собой атом кислорода, R9 представляет собой атом водорода и R8 представляет собой C1-6алкил или C1-6алкоксиалкил.
34. Фармацевтическая композиция по п.33, где R8 выбран из группы, включающей метил и метоксиэтил.
35. Фармацевтическая композиция по п.26, где R10, R11 и R12 представляют собой метил.
36. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы II
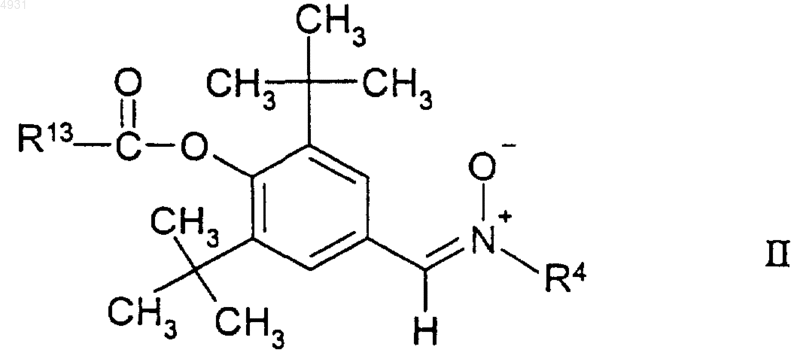
где R13 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкил, C3-C10циклоалкил;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметильной или C1-6алкоксигруппой, и C3-10циклоалкил;
а также его фармацевтически приемлемые соли.
37. Фармацевтическая композиция по п.36, где R13 представляет собой алкил, содержащий 1-6 атомов углерода.
38. Фармацевтическая композиция по п.36, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил.
39. Фармацевтическая композиция по п.38, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-(тиометокси)бут-1-ил, 3-тиометилпропил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
40. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы III
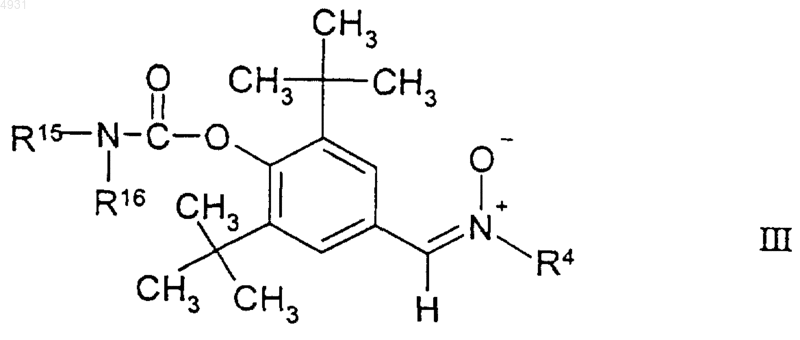
где R15 и R16 независимо выбраны из группы, включающей атом водорода, C1-10алкил, который может быть замещен C1-6алкоксикарбонил или C1-6алкоксигруппой, C3-10циклоалкил; или R15 и R16 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил;
и его фармацевтически приемлемые соли.
41. Фармацевтическая композиция по п.40, где R16 представляет собой атом водорода и R15 выбран из группы, включающей C1-10алкил и C1-6алкоксикарбонилалкильной группой.
42. Фармацевтическая композиция по п.41, где R15 выбран из группы, включающей этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этшы.
43. Фармацевтическая композиция по п.40, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил.
44. Фармацевтическая композиция по п.43, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-тиометилпропил, 3-(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
45. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы IV
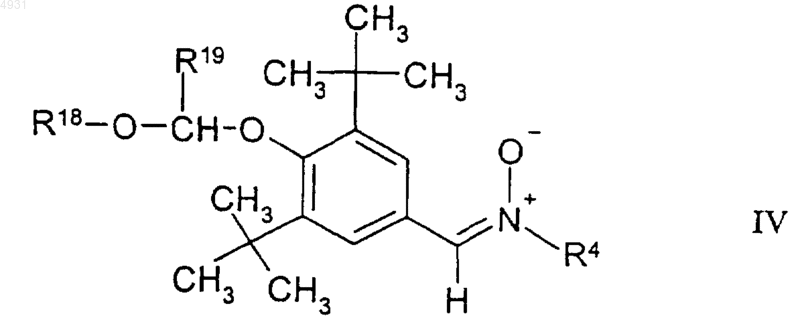
где R18 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкил, C3-10циклоалкил;
R19выбран из группы, включающей атом водорода, C1-10алкил, C1-10алкоксиалкила, C3-10циклоалкил; или R18 и R19 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, и C3-10циклоалкил;
и его фармацевтически приемлемые соли.
46. Фармацевтическая композиция по п.44, где R19 представляет собой атом водорода и R18 представляет собой C1-10алкил и C1-10алкоксиалкил.
47. Фармацевтическая композиция по п.46, где R18 представляет собой метил или метоксиэтил.
48. Фармацевтическая композиция по п.45, где R4 выбран из группы, включающей C1-6алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6алкоксигруппой, или C3-10циклоалкил.
49. Фармацевтическая композиция по п.48, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил, трет.-бутил, циклогексил, 3-(тиометокси)бут-1-ил, 3-тиометилпропил, 4-трифторметилфенил и 3,4,5-триметоксифенил.
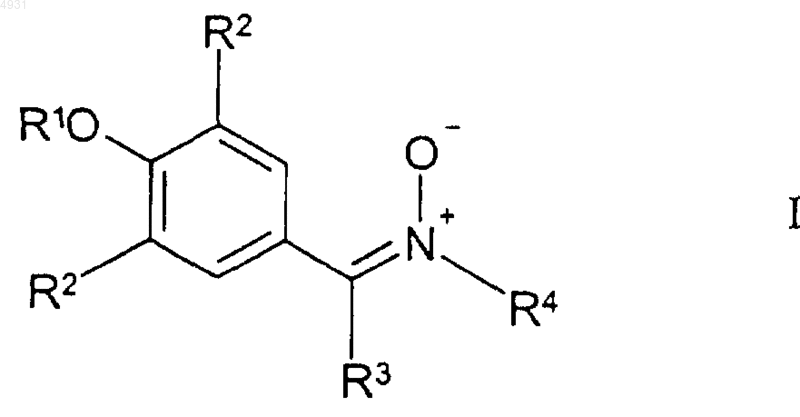
50. Способ лечения у млекопитающего состояния, связанного с воспалением, отличающийся тем, что он включает введение указанному млекопитающему фармацевтической композиции, содержащей фармацевтически приемлемый носитель и эффективное для ослабления воспаления количество соединения формулы I
где R1 выбран из группы, включающей
каждый R2 независимо выбран из группы формулы
R3 представляет собой атом водорода;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкокси или гидроксигруппой или фенилом, замещенным трифторметильной или C1-6алкоксигруппой, и C3-10циклоалкил;
R5 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкил, C3-10циклоалкил;
R6 и R7 независимо выбраны из группы, включающей атом водорода, C1-10алкил, который может быть замещен C1-6алкоксикарбонилом или C1-6алкоксигруппой, C3-10циклоалкил; или R6 и R7 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R8 выбран из группы, включающей C1-10алкил, C1-10алкоксиалкил, C3-10циклоалкил;
R9 выбран из группы, включающей атом водорода, C1-10алкил, C3-10циклоалкил; или R8 и R9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;
R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода,
X представляет собой атом кислорода,
W представляет собой атом кислорода;
а также их фармацевтически приемлемые соли.
51. Способ по п.50, где связанное с воспалением состояние представляет собой ревматоидный артрит.
52. Способ по п.50, где связанное с воспалением состояние представляет собой остеоартрит.
53. Способ по п.50, где связанное с воспалением состояние представляет собой анкилозирующий спондилит.
54. Способ по п.50, где связанное с воспалением состояние представляет собой системную красную волчанку.
55. Соединение формулы I
где R1 выбран из группы, включающей
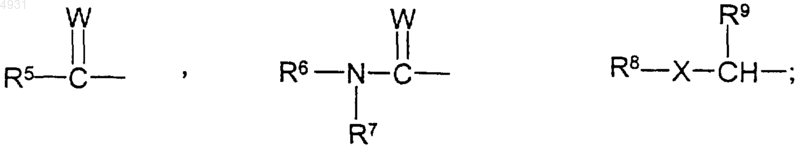
каждый R2 независимо выбран из группы формулы
R3 представляет собой атом водорода;
R4 выбран из группы, включающей C1-10алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенилом, замещенным трифторметильной или C1-6алкоксигруппой;
R5 представляет собой C1-10алкил;
R6 представляет собой C1-10алкил;
R7 представляет собой атом водорода;
R8 выбран из группы, включающей C1-10алкил и C1-10алкоксиалкил;
R9 представляет собой атом водорода;
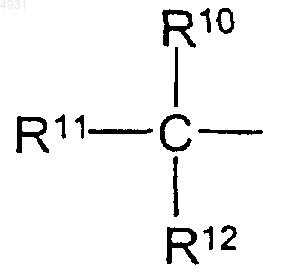
R10, R11 и R12 каждый представляет собой метил;
X представляет собой атом кислорода и
W представляет собой атом кислорода;
и его фармацевтически приемлемые соли.
56. Соединение по п.55, где R5 выбран из группы, включающей метил, этил, н-пропил, изопропил и н-бутил.
Текст
1 Настоящее изобретение относится к новым 3,4,5-тризамещенным арилнитроновым соединениям и их применению в качестве терапевтических агентов для лечения у млекопитающих состояний, связанных с воспалением, таких как артрит, а также в качестве аналитических реагентов для обнаружения свободных радикалов. Артрит и родственные болезненные воспалительные состояния встречаются более чем в 100 различных формах, включая ревматоидный артрит (PA, RA), остеоартрит (ОА, ОА), анкилозирующий спондилит и системную красную волчанку (СКВ, SLE). Большинство форм артрита характеризуется некоторым видом хронического воспаления. Например, РА обычно включает хроническое воспаление выстилки суставов и/или внутренних органов. Такое хроническое воспаление обычно вызывает боль и распухание суставов, подверженных заболеванию, и может привести к поражению хряща,кости, сухожилий, связок и т.д., приводя, в конечном итоге, к уродливости и нетрудоспособности. Простагландины, как давно известно, вовлечены в воспалительный процесс. Соответственно, разработан ряд ингибиторов синтеза простагландина для лечения артрита и родственных болезненных воспалительных состояний. Эти нестероидные противовоспалительные лекарственные средства (НПВЛС, NSAIDS), такие как аспирин, ибупрофен, напроксен и индометацин,обычно предупреждают продуцирование простагландинов путем ингибирования ферментов на метаболическом пути арахидоновая кислота/простагландин, в том числе фермент циклоксигеназу (СОХ). Фермент СОХ катализирует превращение арахидоновой кислоты в простагландин Н 2, первая стадия в биосинтезе простагландинов, таких как простациклин и тромбоксаны. Фермент СОХ, как известно, существует в двух формах. СОХ-1 представляет собой конститутивный фермент, обнаруженный в большинстве тканей и органов. Наряду с другими свойствами, СОХ-1 продуцирует относительно небольшие количества простагландинов, необходимых для поддержания целостности желудочно-кишечного тракта. СОХ-2, с другой стороны, представляет собой индуцируемую форму фермента, ассоциирующуюся с повышенным продуцированием простагландинов при воспалительных состояниях. Так как многие НПВЛС ингибируют обе формы СОХ, они вмешиваются в процессы, регулируемые простагландином,несвязанные с воспалительным процессом. В результате многие НПВЛС вызывают серьезные побочные эффекты, такие как язва желудка и почечное поражение, что ограничивает их эффективность как терапевтических агентов. В настоящем изобретении используются некоторые представители класса соединений,известных как нитроны. Нитроны используются в качестве фармацевтических средств и находят 2 другое применение. См., например, публикацию ЕР 0945426 А 1, в которой представлена одна группа нитронов, содержащих 1 или 2 ароматических заместителя; публикацию GB 2137619, в которой представлены различные нитроны в качестве антиозонантов в каучуках; патент США 5025032, в котором представлены N-трет.бутилфенилнитрон (ФБН) и производные ФБН, которые могут быть использованы при лечении удара; публикацию WO 99/20601, в которой представлены -арил-N-алкилнитроны,содержащие до трех заместителей в кольце, и их применение в качестве терапевтических агентов при лечении нейродегенеративного, аутоиммунного и воспалительного состояния; публикацию WO 97/39751, в которой представлены нитроны, содержащие до 3 заместителей в кольце, включая алкилы, алкоксигруппы, аминоарилы, ацилоксигруппы, гидроксильные группы и карбоксильные группы; публикацию WO 95/11227, в которой показаны различные парагидроксинитроны, содержащие два расположенных по краям алкильных заместителя, а также их применение при лечении и профилактике липидного пероксидирования; и публикацию WO 91/05552, в которой указано, что ФБН и различные производные ФБН могут быть использованы для лечения заболеваний, ассоциирующихся с окислительным повреждением. Таким образом, существует потребность в новых классах терапевтических соединений,которые эффективно лечат артрит и другие связанные с воспалением состояния без нежелательных побочных эффектов. Настоящее изобретение относится к новым 3,4,5-тризамещенным арилнитроновым соединениям, которые могут быть полезны в качестве терапевтических агентов для ослабления воспаления у млекопитающих. В частности, соединения настоящего изобретения могут быть использованы для лечения артрита и других связанных с воспалением состояний. Таким образом, в соответствии с одним из своих аспектов, настоящее изобретение относится к соединениям формулы I каждый из R2 независимо выбран из группы формулыC1-10 алкил, который может быть замещен тиоалкокси группой или гидроксигруппой, или фенил, замещенный трифторметильной или C1-6 алкоксигруппой, или С 3-10 циклоалкил;R6 и R7 независимо выбраны из группы,включающей атом водорода, C1-10 алкил, который может быть замещен C1-6 алкоксикарбонилом или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R6 и R7 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода.X представляет собой атом кислорода,W представляет собой атом кислорода; а также их фармацевтически приемлемые соли.R4 предпочтительно выбран из группы,включающей C1-6 алкил, который может быть замещен тиоалкокси или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, или С 3-10 циклоалкил. Более предпочтительно R4 представляет собой алкил, содержащий от 3 до 6 атомов углерода, или циклоалкил, содержащий от 5 до 6 атомов углерода. Особенно предпочтительными группами R4 являются метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил,трет.-бутил, 3-тиометилпропил, 3-(тиометокси) бут-1-ил, циклогексил, 4-трифторметилфенил и 3,4,5-триметоксифенил.R5 предпочтительно выбран из группы,включающей C1-6 алкил, C1-6 алкоксиалкильную группу и С 3-10 циклоалкил. Более предпочтительно, когда R5 представляет собой низший алкил. Особенно предпочтительными группамиR6 предпочтительно выбран из группы,включающей C1-6 алкил и C1-6 алкоксикарбонилалкил (то есть, ROC(О)-алкил-, где R представляет собой алкил или циклоалкил). Особенно предпочтительными группами R6 являются этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этил.R7 предпочтительно представляет собой атом водорода. Предпочтительно R8 представляет собойR9 предпочтительно представляет собой атом водорода. Предпочтительно X представляет собой атом кислорода. Предпочтительно R10, R11 и R12, независимо друг от друга, представляют собой низший алкил. Более предпочтительно R10, R11 и R12 представляют собой метил. В предпочтительном варианте осуществления изобретение относится к соединению формулы IIR4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметильной или С 1-6 алкоксигруппой, и С 3-10 циклоалкил и; а также его фармацевтически приемлемые соли. Предпочтительно R13 представляет собойR4 предпочтительно выбран из группы,включающей C1-6 алкил, замещенный тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметильной группой илиR4 метил, н-пропил, изопропил, 1-гидрокси-2 метилпроп-2-ил, н-бутил, трет.-бутил, 3 тиометилпропил, 3-(тиометокси)бут-1-ил, циклогексил, 4-трифторметил-фенил и 3,4,5 триметоксифенил. В другом предпочтительном варианте осуществления изобретение относится к соединению формулы III где R15 и R16 независимо выбраны из группы, включающей атом водорода, C1-10 алкил,который может быть замещен C1-6 алкоксикарбонилом или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R15 и R16 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, 5 замещенный трифторметилом или C1-6 алкоксигруппой, или С 3-10 циклоалкил; а также его фармацевтически приемлемые соли.R15 предпочтительно выбран из группы,включающей C1-10 алкил или C1-6 алкоксиалкильную группу (то есть, ROC(О)-алкил-). Особенно предпочтительными группами R15 являются этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этил. R16 предпочтительно представляет собой атом водорода.R4 предпочтительно выбран из группы,включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, или С 3-10 циклоалкил. Более предпочтительно R4 представляет собой алкил, содержащий от 3 до 6 атомов углерода, или циклоалкил, содержащий от 5 до 6 атомов углерода. Особенно предпочтительными группами R4 являются метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил,трет.-бутил, 3-тиометилпропил, 3-(тиометокси) бут-1-ил, циклогексил, 4-трифторметилфенил и 3,4,5-триметоксифенил. В еще одном предпочтительном варианте осуществления изобретение относится к соединению формулы IV 6 атомов углерода. Особенно предпочтительными группами R4 являются метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил,трет.-бутил, 3-тиометилпропил, 3-(тиометокси) бут-1-ил, циклогексил, 4-трифторметилфенил и 3,4,5-триметоксифенил. Особенно предпочтительными 3,4,5-тризамещенными арилнитроновыми соединениями являются соединения,имеющие формулы, представленные в табл. I, II и III. Таблица IR19 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил; а также его фармацевтически приемлемые соли. Предпочтительно R18 представляет собойC1-10 алкил или C1-10 алкоксиалкил (то есть, ROалкил-). Особенно предпочтительными группами R являются метил и метоксиэтил. R19 предпочтительно представляет собой атом водорода.R4 предпочтительно выбран из группы,включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или С 1-6-алкоксигруппой, или С 3-10 циклоалкил. Более предпочтительно R4 представляет собой алкил, содержащий от 3 до 6 атомов углерода, или циклоалкил, содержащий от 5 до 6 Таким образом, в соответствии с другим аспектом настоящее изобретение относится к каждому из отдельных соединений:-(4-н-бутаноилокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон,-(4-ацетокси-3,5-ди-трет.-бутилфенил)-Nизопропилнитрон,-(4-ацетокси-3,5-ди-трет.-бутилфенил)-N1-гидрокси-2-метил-проп-2-илнитрон,-(4-н-пентаноилокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон,-(4-ацетокси-3,5-ди-трет.-бутилфенил)-N4-трифторметилфенилнитрон,-(4-пропионилокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон,-(4-ацетокси-3,5-ди-трет.-бутилфенил)-Nметилнитрон,-(4-ацетокси-3,5-ди-трет.-бутилфенил)-N3,4,5-триметоксифенилнитрон,-[(4-этиламинокарбонилокси)-3,5-дитрет.-бутилфенил]-N-трет.-бутилнитрон,-[4-(н-пропиламинокарбонилокси)-3,5 ди-трет.-бутилфенил]-N-трет.-бутилнитрон,-[4-(н-бутиламинокарбонилокси)-3,5-дитрет.-бутилфенил]-N-трет.-бутилнитрон,-[4-(2-этоксикарбонилэтиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.бутилнитрон,-[4-(2-этоксикарбонилметиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.бутилнитрон,-(4-метоксиметокси-3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрон,-[4-(2-метоксиэтоксиметокси)-3,5-дитрет.-бутилфенил]-N-трет.-бутилнитрон,-(4-метоксиметокси-3,5-ди-трет.-бутилфенил)-N-3-(тиометокси)бут-1-илнитрон,-(4-метоксиметокси-3,5-ди-трет.-бутилфенил)-N-3-тиометоксипропилнитрон,и их фармацевтически приемлемые соли. В соответствии с другими аспектами настоящее изобретение относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы I где R1-R4 принимают значения, определенные выше. В соответствии с дополнительными аспектами настоящее изобретение относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формул II, III или IV, приведенных выше. Наряду с другими свойствами, 3,4,5 тризамещенные арилнитроны, как полагают,обладают способностью ингибировать индукцию циклооксигеназы, связанную с синтезом простагландина Е 2 (PGE2) и воспалением. Со 004931 8 единения, имеющие такие свойства, могут быть использованы для ослабления воспаления, в том числе воспаления, возникающего при артрите и родственных воспалительных состояниях. Таким образом, в соответствии с еще одним из аспектов настоящее изобретение относится к способу лечения у млекопитающего состояния, связанного с воспалением, и этот способ включает введение указанному млекопитающему композиции, содержащей фармацевтически приемлемый носитель и эффективное для ослабления воспаления количество соединения формул I, II, III или IV, которые приведены выше. В предпочтительных вариантах осуществления настоящего изобретения состояние, связанное с воспалением и подвергаемое лечению в указанном выше способе, представляет собой ревматоидный артрит, остеоартрит, анкилозирующий спондилит, системную красную волчанку или псориатический артрит. Подробное описание изобретения В настоящем изобретении 3,4,5-тризамещенные арилнитроны формулы I называют с использованием обычной номенклатуры для нитронов, то есть, атом углерода двойной связи углерод-азот (C=N) обозначается -положением, а заместителям у атома азота двойной связи углерод-азот дается приставка N. В некоторых случаях 3,4,5-тризамещенные арилнитроны настоящего изобретения могут содержать один или более хиральных центров. Обычно такие соединения будут получены в виде рацемической смеси. Однако, если необходимо, то такие соединения могут быть получены или выделены в виде чистых стереоизомеров, то есть, в виде индивидуальных энантиомеров или диастереомеров, или в виде смесей, обогащенных стереоизомером. Чистые стереоизомеры(или обогащенные смеси) могут быть получены с использованием, например, оптически активных исходных материалов или стереоселективных реагентов, хорошо известных в данной области. С другой стороны, рацемические смеси таких соединений могут быть разделены с использованием, например, хиральной хроматографической колонки или хиральных разрешающих агентов. Определения При описании 3,4,5-тризамещенных арилнитронов, фармацевтических композиций и способов настоящего изобретения следующие термины имеют, если не оговорено особо, следующие значения. Алкокси представляет собой группу-OR, где R представляет собой алкил. Предпочтительными алкоксигруппами являются, например, метокси, этокси, н-пропокси, изопропокси,н-бутокси, трет.-бутокси, втор.-бутокси, нпентокси, н-гексокси и 1,2-диметилбутокси. Алкил представляет собой моновалентную разветвленную или неразветвленную на 9 сыщенную углеводородную группу, предпочтительно содержащую от 1 до 10 атомов углерода,более предпочтительно от 1 до 8 атомов углерода, и еще более предпочтительно от 1 до 6 атомов углерода. Примерами являются такие группы, как метил, этил, н-пропил, изопропил, нбутил, изобутил, трет.-бутил, н-гексил, н-октил и трет.-октил. Определение низший алкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода. Замещенный алкил представляет собой алкильную группу, содержащую от 1 до 5 заместителей, и предпочтительно от 1 до 3 заместителей, например, алкоксигруппу, тиоалкоксигруппу, фенильную группу, замещенную 1-3 заместителями, такими как трифторметил и алкокси. Циклоалкил представляет собой циклическую алкильную группу, содержащую 3-10 атомов углерода, имеющую одно циклическое кольцо или множество конденсированных или мостиковых колец, которые могут быть необязательно замещены 1-3 алкильными группами. К таким циклоалкильным группам относятся,например, структуры с одним кольцом, такие как циклопропил, циклобутил, циклопентил,циклооктил, 1-метилциклопропил, 2-метилциклопентил, 2-метилциклооктил, или с конденсированными или мостиковыми кольцами, такие как адамантанил. Определение низший циклоалкил относится к циклоалкильной группе, содержащей от 3 до 6 атомов углерода. Понятие фармацевтически приемлемая соль относится к любой соли соединения настоящего изобретения, которая сохраняет биологические свойства и которая является приемлемой с биологической или иной точки зрения. Такие соли могут быть получены из различных органических и неорганических противоионов,хорошо известных в данной области, и которые представляют собой, например, ионы натрия,калия, кальция, магния, аммония и тетраалкиламмония; и если молекула имеет основную функциональность, соли органических или неорганических кислот, такие как гидрохлорид,гидробромид, тартрат, мезилат, ацетат, малеат и оксолат. Понятие фармацевтически приемлемый катион относится к фармацевтически приемлемому катиону кислотной функциональной группы. Такими катионами являются, например,катионы натрия, калия, кальция, магния, аммония и тетраалкиламмония. Общая методика синтеза 3,4,5-Тризамещенные арилнитроны настоящего изобретения могут быть получены из легко доступных исходных материалов с использованием следующих общих способов и методик. Понятно, что, когда приведены типичные или предпочтительные условия процесса(то есть, температура реакции, время, мольные соотношения реагентов, растворители или давление), также могут быть использованы другие 10 условия процесса, если не оговорено особо. Оптимальные реакционные условия могут меняться в зависимости от конкретных используемых реагентов или растворителей, но такие условия могут быть определены квалифицированным в данной области специалистом с помощью традиционных методик оптимизации. Кроме того, для квалифицированного в данной области специалиста понятно, что для защиты некоторых функциональных групп от нежелательных реакций может быть необходимо использование обычных защитных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для введения и снятия защиты также хорошо известен в данной области. Например, большое число защитных групп, а также способы их введения и удаления описаны в публикации T.W. Greene, G.M. Wuts, ProtectingGroups in Organic Synthesis, Second Edition,Wiley, New York, 1991, а также в ссылках, цитируемых в этой публикации. В предпочтительном способе синтеза 3,4,5 тризамещенные арилнитроны настоящего изобретения получают путем сочетания арилкарбонильного соединения формулы VVI,4 где R принимает значения, определенные выше, при обычных условиях реакции. Такую реакцию сочетания обычно проводят путем контактирования арилкарбонильного соединения V, по меньшей мере, с одним эквивалентом, предпочтительно приблизительно 1,12 эквивалентами, гидроксиламина VI в инертном полярном растворителе, таком как метанол,этанол, 1,4-диоксан, тетрагидрофуран, диметилсульфоксид или диметилформамид. Реакцию предпочтительно проводят при температуре приблизительно от 0 до 100 С в течение приблизительно от 1 до 48 ч. Необязательно в этой реакции может быть использовано каталитическое количество кислоты, такой как соляная кислота, уксусная кислота, п-толуол-сульфокислота или силикагель. Когда R1 в формуле V представляет собой -C(O)R3, в реакции сочетания используется, по меньшей мере, два эквивалента гидроксиламина VI. По окончании реакции 3,4,5-тризамещенный арилнитрон формулыV, используемые в описанной выше реакции сочетания, являются или известными соедине 11 ниями или соединениями, которые могут быть приготовлены из известных соединений по обычным методикам. Например, арилкарбонильные соединения формулы V, где R1 представляет собой -C(O)R5, можно легко получить ацилированием соответствующего 4-гидроксипроизводного. Например, в предпочтительном варианте осуществления изобретения, 3,5-дитрет.-бутил-4-гидроксибензальдегид (поставляется фирмой Aldrich Chemical Co., 1001W. St.Paul Avenue, Milwaukee, WI, USA 53233-2641) ацетилируют путем контактирования бензальдегида с избытком уксусного ангидрида в присутствии кислого катализатора, такого как перхлорная кислота, после чего следует гидролиз промежуточного ацеталя с образованием 4 ацетокси-3,5-ди-трет.-бутилбензальдегида. Другие ангидриды карбоновых кислот также могут быть использованы в этой реакции, включая,например, пропионовый ангидрид, масляный ангидрид или изомасляный ангидрид. С другой стороны, такие соединения могут быть получены путем ацилирования 4-гидрокси-соединения с помощью других ацилирующих агентов, таких как ацилгалогениды, при обычных условиях реакции. Ацилгалогениды, предпочтительно используемые в этой реакции, представляют собой ацилхлориды или ацилбромиды, такие как ацетилхлорид, ацетилбромид, пропионилхлорид, хлорангидрид н-масляной кислоты или изомасляной кислоты. Обычно эту реакцию проводят в присутствии триалкиламина, такого как триэтиламин, чтобы нейтрализовать кислоту, выделяющуюся в ходе реакции. Аналогично арилкарбонильные соединения формулы V, где R1 представляет собой-C(O)NR6R7 можно легко получить реакцией соответствующего 4-гидроксипроизводного с изоцианатом (то есть, соединением R6R7N=C=O). Например, в предпочтительном варианте осуществления изобретения 3,5-ди-трет.-бутил 4-гидроксибензальдегид реагирует с этилизоцианатом с образованием 4-(этиламинокарбонилокси)-3,5-ди-трет.-бутилбензальдегида. Обычно эту реакцию проводят при комнатной температуре в инертном разбавителе, таком какN,N-диметилформамид, в присутствии избытка триалкиламина, такого как триэтиламин. В этой реакции могут быть использованы другие изоцианаты, например, н-пропилизоцианат или нбутилизоцианат. Кроме того, арилкарбонильные соединения формулы V, где R1 представляет собой-CHR9-X-R8, можно легко получить реакцией соответствующего 4-гидроксипроизводного с соединением формулы L-CHR9-X-R8, где L представляет собой удаляемую группу, такую как атом галогена или сульфонатный эфир, a R8,R9 и X принимают значения, определенные выше. Обычно эту реакцию проводят путем контактирования 4-гидроксипроизводного с избытком алкилирующего агента в присутствии экви 004931 12 молярного количества триалкиламина, такого как N,N-диизопропилэтиламин, в инертном разбавителе, таком как 1,2-дихлорэтан. Предпочтительными алкилирующими агентами для использования в этой реакции являются, например, метоксиметилхлорид и 2-метоксиэтоксиметил(МЭМ)хлорид. Гидроксиламины формулы VI, описанные выше, также являются известными соединениями или соединениями, которые могут быть приготовлены из известных соединений обычными методиками. Обычно гидроксиламины формулыVI получают путем восстановления соответствующего нитросоединения (то есть, R4-NO2, гдеR4 принимает значения, определенные выше) с использованием подходящего восстанавливающего агента, такого как активированный цинк/ уксусная кислота, активированный цинк/хлорид аммония или амальгама алюминий/ртуть. Эту реакцию обычно проводят при температуре в интервале приблизительно от 15 до 100 С в течение приблизительно от 0,5 до 12 ч, предпочтительно в течение приблизительно 2-6 ч, в водной реакционной среде, такой как смесь спирт/вода в случае цинковых реагентов или смесь простой эфир/вода в случае алюминиевых амальгам. Алифатические нитросоединения (в форме их солей) также могут быть восстановлены до гидроксиламинов с использованием борана в тетрагидрофуране. Так как некоторые гидроксиламины имеют ограниченную стабильность, такие соединения обычно получают непосредственно перед проведением реакции с арилкарбонильным соединением формулы V. Предпочтительными гидроксиламинами для использования в настоящем изобретении являются N-изопропилгидроксиламин, N-h-пропилгидроксиламин, N-н-бутилгидроксиламин,N-трет.-бутилгидроксиламин и N-циклогексилгидроксиламин. Фармацевтические композиции При использовании в качестве фармацевтических средств 3,4,5-тризамещенные арилнитроны настоящего изобретения обычно вводятся в виде фармацевтической композиции. Такие композиции могут быть получены с использованием методик, хорошо известных в фармацевтической области, и содержат, по меньшей мере,один активный компонент. Обычно соединения настоящего изобретения вводят в фармацевтически эффективном количестве. Количество фактически введенного соединения будет определяться врачом с учетом относящихся к делу обстоятельств, включая состояние, которое подвергается лечению, выбранный способ введения, фактически вводимое соединение, возраст, вес и реакция отдельного пациента, а также серьезность симптомов заболевания у больного. Фармацевтические композиции настоящего изобретения могут быть введены любым подходящим способом введения, включая, на 13 пример, пероральный, местный, ректальный,трансдермальный, подкожный, внутривенный,внутримышечный и внутриназальный. В зависимости от выбранного способа доставки соединения настоящего изобретения предпочтительно готовят в виде любых пероральных композиций, местных композиций или композиций для инъекций. Фармацевтические композиции для перорального введения могут находиться в виде нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Обычно,однако, для облегчения точной дозировки такие композиции представлены в виде дозированной лекарственной формы. Понятие дозированная лекарственная форма относится к физически дискретным формам, подходящим для унитарных дозировок для человека и других млекопитающих, причем каждая форма содержит предварительно определенное количество активного материала, рассчитанное таким образом, чтобы вызвать желаемый терапевтический эффект, в сочетании с подходящим фармацевтическим наполнителем. Обычные дозированные лекарственные формы включают предварительно наполненные, заранее отмеренные ампулы или шприцы с жидкими композициями, или пилюли,таблетки, капсулы и другие подобные формы в случае твердых композиций. В таких композициях нитроны обычно находятся в небольших количествах (приблизительно от 0,1 до 50 мас.%, или предпочтительно приблизительно от 1 до 40 мас.%), причем остальное количество составляют различные растворители или носители и технологические вспомогательные вещества, способствующие формированию желаемой дозированной лекарственной формы. Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный растворитель с буферами,суспендирующими и диспергирующими агентами, красителями и добавками, корригирующими вкус и запах. Твердые формы могут содержать, например, любой из следующих ингредиентов или соединений аналогичной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, диспергирующий агент, такой как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; агент скольжения, такой как коллоидальная двуокись кремния; подслащивающий агент, такой как сахароза или сахарин; или агент, корригирующий вкус и запах, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор. Композиции для местного применения обычно получают в виде мазей или кремов, содержащих активный(е) ингредиент(ы) обычно в количестве, находящемся в интервале приблизительно от 0,01 до 20 мас.%, предпочтительно 14 приблизительно от 0,1 до 10 мас.%, и более предпочтительно приблизительно от 0,5 до 15 мас.%. При приготовлении мази активные ингредиенты обычно смешивают или с парафиновой или смешивающейся с водой основой мази. С другой стороны, активные ингредиенты могут быть приготовлены в виде крема, например, с кремовой основой масло-в-воде. Такие композиции для местного применения хорошо известны в данной области техники и обычно содержат дополнительные ингредиенты для усиления дермальной проницаемости или стабильности активных ингредиентов или рецептур. Соединения настоящего изобретения также могут быть введены с помощью трансдермальных приспособлений. Таким образом, местное применение может быть осуществлено с использованием пластыря любого типа, резервуарного или пористого мембранного, или твердого матричного. Композиции для инъекций обычно основаны на инъецируемом стерильном физиологическом растворе или физиологическом растворе с фосфатным буфером, или на других инъецируемых носителях, известных в данной области. Как указывалось выше, 3,4,5-тризамещенные арилнитроны в такой композиции обычно содержатся в небольшом количестве, часто составляющем приблизительно от 0,05 до 10 мас.%, а остальное количество составляет инъецируемый носитель. Описанные выше компоненты для перорально и локально вводимых или инъецируемых композиций являются только примерами. Другие материалы, а также технологические методики и др., представлены в 8-й части изданияedition, 1990, Mack Publishing Company, Easton,Pennsylvania, 18042, которое включено в описание в качестве справочного материала. Соединения настоящего изобретения могут быть также введены в формах с пролонгированным действием или из систем доставки лекарственного средства с пролонгированным действием. Описание примеров таких материалов с пролонгированным действием можно найти в издании Remington's PharmaceuticalSciences. Следующие рецептурные примеры иллюстрируют типичные фармацевтические композиции настоящего изобретения. Настоящее изобретение, однако, не ограничено представленными ниже фармацевтическими композициями. Рецептура 1. Таблетки. Соединение формулы I смешивают в виде сухого порошка с сухим желатиновым связующим веществом в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют небольшое количество стеарата магния. Смесь формируют в таблетки массой 240-270 мг (80-90 мг активного нитрона на таблетку) в таблетирующей машине. 15 Рецептура 2. Капсулы. Соединение формулы I в виде сухого порошка смешивают с крахмальным разбавителем в массовом соотношении приблизительно 1:1. Смесью заполняют капсулы на 250 мг (125 мг активного нитрона на капсулу). Рецептура 3. Жидкость. Соединение формулы I (125 мг), сахарозу(1,75 мг) и ксантановую камедь (4 мг) смешивают, пропускают через сито 10 меш (США) и затем смешивают с предварительно полученным раствором микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг),вкусовую добавку и краситель разбавляют водой и добавляют при перемешивании. Затем добавляют достаточное количество воды до получения суммарного объема 5 мл. Рецептура 4. Инъекции. Соединение формулы I растворяют в водной среде содержащего буфер стерильного физиологического раствора до концентрации приблизительно 5 мг/мл. Рецептура 5. Мазь. Приблизительно при 75 С плавят стеариловый спирт (250 г) и белый вазелин (250 г) и затем добавляют растворенную в воде смесь соединения формулы I (50 г), метилпарабена(0,25 г), пропилпарабена (0,15 г), лаурилсульфата натрия (10 г) и пропиленгликоля (120 г) в воде (около 370 г) и полученную смесь перемешивают до коагулирования. Применение соединения Наряду с другими свойствами, 3,4,5-тризамещенные арилнитроны настоящего изобретения, как установлено, обладают способностью ингибировать индукцию индуцируемой циклооксигеназы (СОХ-2), и/или ингибируют высвобождение физиологически активных лейкотриенов, и/или являются эффективными в различныхin vivo артритных моделях. Таким образом, соединения настоящего изобретения и фармацевтические композиции настоящего изобретения находят применение в качестве терапевтических средств для лечения связанных с воспалением состояний у млекопитающих, в том числе у человека. В частности, соединения настоящего изобретения, как установлено, эффективно ингибируют индукцию индуцируемой циклооксигеназы (СОХ-2), высвобождение которой приводит к синтезу простагландина Е 2 (PGE2). PGE2 продуцируется ферментом СОХ в качестве части метаболического пути арахидоновой кислоты. Фермент СОХ, как известно в настоящее время,существует в виде двух форм, СОХ-1 и СОХ-2. СОХ-1 представляет собой конститутивный фермент, обнаруженный в большинстве тканей и органов. СОХ-2, с другой стороны, представляет собой индуцируемую форму фермента,ассоциирующуюся с повышенным продуцированием PGE2 и воспалением. Не ограничиваясь 16 какой-либо теорией, полагают, что селективное ингибирование образования СОХ-2 будет давать терапевтические агенты, которые эффективно ослабляют воспаление при незначительном или при отсутствии побочных эффектов, связанных с ингибированием СОХ-1 и/или СОХ-2. Так как соединения настоящего изобретения, как установлено, ингибируют высвобождение PGE2,такие соединения являются полезными при лечении заболеваний или состояний, характеризующихся перепродуцированием или разрегулированным продуцированием простагландина Е 2, включая множество воспалительных состояний. Среди связанных с воспалением состояний, которые можно лечить 3,4,5-тризамещенными арилнитроновыми соединениями и фармацевтическими композициями настоящего изобретения, находятся различные формы артрита, включая, но, не ограничиваясь только ими,ревматоидный артрит, остеоартрит, анкилозирующий спондилит, системную красную волчанку или псориатический артрит. Другие связанные с воспалением состояния представляют собой, например, воспалительное заболевание желудочно-кишечного тракта (IBD), септический шок, эритемную лепру утолщений, септицемию, увеит, респираторный синдром-дистресс у взрослых (ARDS), отторжение органов, нейровоспалительные состояния и сердечные воспалительные состояния. Как описано выше, соединения, представленные в данном описании, подходят для применения в различных системах доставки лекарств. Уровни введения доз для лечения связанных с воспалением состояний находятся в интервале приблизительно от 0,1 до, по меньшей мере, 10 мг/кг/ч, причем все в течение приблизительно от 1 до 120 ч и в особенности от 24 до 96 ч. Предварительно заправленные болюсы приблизительно от 0,1 до 10 мг/кг или более также могут быть введены для достижения адекватных стационарных уровней. Максимальная суммарная доза, как ожидается, не превышает приблизительно 2 г/день для человека весом от 40 до 80 кг. Для лечения хронических состояний, таких как артрит, схема лечения может длиться в течение многих месяцев или лет, так что пероральное введение дозы лекарства является предпочтительным с точки зрения удобства и переносимости. Типичными схемами приема при пероральном введении дозы являются однапять, в особенности две-четыре и обычно три пероральные дозы в день. При таких схемах введения лекарства каждая доза обеспечивает приблизительно от 0,1 до 20 мг/кг нитрона, причем каждая предпочтительная доза дает приблизительно от 0,1 до 10 мг/кг и в особенности приблизительно от 1 до 5 мг/кг. Соединения настоящего изобретения могут быть введены в качестве единственного ак 17 тивного агента или они могут быть введены в сочетании с другими активными агентами, такими как ингибиторы циклооксигеназы, ингибиторы 5-липоксигеназы, нестероидные противовоспалительные лекарственные средства(NSAIDs), стероиды, периферические обезболивающие агенты, такие как зомепирак и дифлунизол, и другие активные нитроновые производные. Новые 3,4,5-тризамещенные арилнитроны настоящего изобретения также находят применение в качестве аналитических реагентов, то есть, спиновых ловушек, для обнаружения нестабильных свободных радикалов с использованием спектроскопии электронного парамагнитного резонанса (ЭПР) и родственных методик. При применении в качестве аналитических реагентов нитроновые соединения настоящего изобретения обычно контактируют с радикалом,который должен быть изучен, в растворе, а спектр ЭПР генерируется обычным способом. В частности, нитроны настоящего изобретения могут быть использованы для определения и идентификации свободных радикалов в биологических системах. Любые спектрометры ЭПР,такие как спектрометр JEOL JES-FE3XG, могут быть использованы в этом опыте. Обычно до проведения исследования ЭПР раствор, содержащий спиновую ловушку, деоксигенируют,например, путем барботирования через него аргона или азота. Предпочтительно в таких опытах ЭПР используется избыток нитрона. Действительные экспериментальные методики, используемые в опытах со спиновыми ловушками, будут зависеть от ряда факторов,таких как способ получения радикалов, инертность растворителя и реагентов относительно спиновой ловушки, а также продолжительность жизни спинового аддукта. Методики спинового улавливания хорошо известны в данной области техники и точная методика для применения может быть легко определена квалифицированным в данной области специалистом. Обычные методики и устройства для проведения экспериментов по спиновому улавливанию описаны,например, в публикации С.A. Evans, "Spin Trapping", Aldrichimica Acta, (1979), 12(2), 23-29, а также в цитируемых там ссылках. Следующие синтетические и биологические примеры предназначены для иллюстрации изобретения и их не следует рассматривать в качестве ограничивающих объем изобретения. Примеры В приведенных ниже примерах сокращения имеют следующие значения. Сокращения,которые не определены ниже, имеют свои общепринятые значения: уд = уширенный дублет,ус = уширенный синглет,д = дублет,дд = двойной дублет,разл. = разлагается, 004931 18 дН 2 О = дистиллированная вода,ELISA = твердофазный иммуноферментный анализ,EtOAc = этилацетат,EtOH = этанол,г = граммы,час = часы,Гц = герц,в/б = внутрибрюшинно,л = литр,м = мультиплет,мин =минуты,М = молярный,МеОН = метанол,мг = миллиграмм,МГц = мегагерц,мл = миллилитр,ммоль - миллимоль,т.пл. = температура плавления,н. = нормальный,п/о = перорально,кв = квартет,квинтет = квинтет,с = синглет,т = триплет,ТГФ = тетрагидрофуран,ТСХ = тонкослойная хроматография,мкг = микрограмм,мкл = микролитр,УФ = ультрафиолетовый. В приведенных ниже примерах все температуры даны в градусах Цельсия (если не указано особо). Примеры A-N описывают синтез промежуточных соединений, пригодных для получения нитронов настоящего изобретения. Примеры 1-19 описывают синтез различных нитронов, примеры I-VI описывают испытания этих соединений. Пример А. Синтез N-трет.-бутилгидроксиламина. К охлажденной смеси 2-метил-2 нитропропана (503 г) и хлорида аммония (207 г) в деионизированной воде (6 л) добавляют цинковую пыль (648 г) с такой скоростью, чтобы температура была ниже 18 С. Реакционную смесь перемешивают механически в течение 15 ч и затем фильтруют. Твердое вещество промывают горячей водой (1,75 л). Объединенный фильтрат насыщают карбонатом натрия (4,6 кг) и экстрагируют этилацетатом (2x1300 мл). Органический раствор сушат над безводным сульфатом натрия, фильтруют и упаривают на роторном испарителе, получают названное соединение (329 г, выход 75,7%) в виде белых кристаллов. Это вещество используют без дополнительной очистки. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 1,090 (с,3 СН 3). Пример В. Синтез 19 Используя описанную выше методику примера А и 2-нитропропан, получают названное соединение. Сырой гидроксиламиновый продукт используют без дополнительной очистки. Пример С. СинтезN-циклогексилгидроксиламина. Используя описанную выше методику примера А и нитроциклогексан, получают названное соединение. По другому варианту, гидрохлорид N-циклогексилгидроксиламина можно получить согласно Aldrich Chemical Company,Inc, Milwaukee, WI USA и нейтрализовать основанием, таким как карбонат натрия, с получением названного соединения. Пример D. Синтез 4-ацетокси-3,5-ди-трет.бутилбензальдегида. В круглодонную колбу объемом 5 л, снабженную механической мешалкой, загружают 3,5-ди-трет.-бутил-4-гидроксибензальдегид (100 г, 0,411 моль). При перемешивании добавляют уксусный ангидрид (300 мл) и затем 70%-ную перхлорную кислоту (0,600 мл). Твердое вещество немедленно растворяется и образуется раствор голубого цвета. Реакционную смесь перемешивают в течение ночи в атмосфере азота. За ходом реакции наблюдают с помощью ТСХ. По окончании реакции колбу охлаждают на ледяной бане. При интенсивном перемешивании реакционной смеси маленькими порциями добавляют ледяную воду. При добавлении воды колба становится теплой. Суммарно добавляют 2 л воды. Отделяется масло, которое при длительном перемешивании затвердевает с образованием коричневых комков. Коричневые комки отделяют на воронке Бюхнера, и твердое вещество обильно промывают водой для удаления уксусной кислоты. Твердое вещество затем сушат в вакууме. К раствору твердого вещества в этаноле(250 мл) добавляют концентрированную соляную кислоту (25 мл). Полученный раствор кипятят в течение десяти минут и затем оставляют охлаждаться. При перемешивании реакционную смесь выливают в 2 л воды, и отделяют масло. При длительном перемешивании масло затвердевает с образованием коричневых комков. Твердое вещество отделяют с помощью воронки Бюхнера и обильно промывают водой (около 1 л). Затем твердое вещество сушат посредством механического насоса, получают названное соединение (выход 99,4 %) в виде светло-коричневого твердого вещества, т.пл. 65,2-74,5 С. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 9,96 (1 Н,с, карбонильный Н), 7,86 (2 Н, с, фенильные Н),2,38 (3 Н, с, 3 СН 3), 1,39 (18 Н, с, 18 СН 3). Пример Е. Синтез 4-изобутаноил-3,5-дитрет.-бутилбензальдегида. В круглодонную колбу объемом 500 мл,снабженную механической мешалкой, загружа 004931(10 г, 0,041 моль). При перемешивании добавляют изомасляный ангидрид (40 мл), а затем 0,200 мл 40 %-ной перхлорной кислоты. Твердое вещество немедленно растворяется с образованием раствора красного цвета. Реакционную смесь перемешивают в течение ночи в атмосфере азота. За ходом реакции наблюдают с помощью ТСХ. По окончании реакции реакционную массу охлаждают на ледяной бане и добавляют к 400 мл интенсивно перемешиваемой ледяной воды. Смесь становится теплой, и отделяют масло. Масло экстрагируют метиленхлоридом, органический слой промывают 1,5 М раствором NaOH (2x100 мл), водой (2x100 мл) и затем сушат над сульфатом магния. Растворитель удаляют в вакууме, получают красное масло. К раствору красного масла в этаноле (200 мл) добавляют концентрированную соляную кислоту (50 мл). Полученный раствор кипятят в течение десяти минут и затем оставляют охлаждаться. При перемешивании реакционную смесь выливают в 2 л воды, и отделяется масло. При длительном перемешивании масло затвердевает с образованием коричневых комков. Твердое вещество отделяют с помощью воронки Бюхнера и затем обильно промывают водой для удаления уксусной кислоты (около 1 л). Затем твердое вещество сушат посредством механического насоса, получают названное соединение(выход 56,7%), которое используют без дополнительной очистки. Пример F. Синтез 4-н.-бутаноил-3,5-дитрет.-бутилбензальдегида. В круглодонную колбу объемом 500 мл,снабженную механической мешалкой, загружают 3,5-ди-трет.-бутил-4-гидроксибензальдегид(15 г, 0,062 моль). При перемешивании добавляют н.-масляный ангидрид (50 мл), а затем 0,200 мл 40 %-ной перхлорной кислоты. Твердое вещество немедленно растворяется с образованием раствора голубого цвета. Реакционную смесь перемешивают в течение ночи в атмосфере азота. За ходом реакции наблюдают с помощью ТСХ. По окончании реакции реакционную смесь охлаждают на ледяной бане и добавляют к 400 мл интенсивно перемешиваемой ледяной воды. Смесь становится теплой, и отделяется масло. Масло экстрагируют метиленхлоридом, органический слой промывают 5 %-ным раствором NaOH (4x100 мл), рассолом (1x100 мл), водой (4x100 мл) и затем сушат над MgSO4. Растворитель удаляют в вакууме, получают красное масло. К раствору красного масла в этаноле (200 мл) добавляют концентрированную соляную кислоту (40 мл). Полученный раствор кипятят в течение десяти минут и затем оставляют охлаждаться. При перемешивании реакционную смесь выливают в 2 л воды, отделяется масло. При длительном перемешивании масло не затверде 21 вает, поэтому смесь экстрагируют метиленхлоридом. Органический слой промывают насыщенным раствором NаНСО 3 (2x100 мл), водой(3x100 мл) и сушат над MgSO4. Растворитель удаляют в вакууме, получают названное соединение в виде красного масла (выход 77,6 %),которое используют без дополнительной очистки. Пример G. Синтез 4-н.-пентаноил-3,5-дитрет.-бутилбензальдегида. В круглодонную колбу объемом 500 мл,снабженную механической мешалкой, загружают 3,5-ди-трет.-бутил-4-гидроксибензальдегид(10,0 г, 0,081 моль). При перемешивании добавляют валериановый ангидрид (50 мл), а затем 0,200 мл 40%-ной перхлорной кислоты. Твердое вещество немедленно растворяется с образованием раствора зеленого цвета. Реакционную смесь перемешивают в течение ночи в атмосфере азота. За ходом реакции наблюдают с помощью ТСХ. По окончании реакции реакционную смесь охлаждают на ледяной бане и добавляют к 400 мл интенсивно перемешиваемой ледяной воды. Смесь становится теплой, и отделяется масло. Масло экстрагируют метиленхлоридом,органический слой промывают 5%-ным раствором NaOH (3x50 мл), рассолом (3x50 мл), водой(3x100 мл) и затем сушат над сульфатом магния. Растворитель удаляют в вакууме, получают густое масло. К раствору масла в этаноле (200 мл) добавляют концентрированную соляную кислоту(50 мл). Полученный раствор кипятят в течение десяти минут и затем оставляют охлаждаться. При перемешивании реакционную смесь выливают в 2 л воды, отделяется масло. При длительном перемешивании масло не затвердевает,поэтому смесь экстрагируют метиленхлоридом. Органический слой промывают насыщенным раствором NаНСО 3 (3x50 мл), водой (5x100 мл) и сушат над MgSO4. Растворитель удаляют в вакууме, получают названное соединение в виде красного масла, которое используют без дополнительной очистки. Пример Н. Синтез 4-(этиламинокарбонилокси)-3,5-ди-трет.-бутилбензальдегида. К раствору 3,5-ди-трет.-бутил-4-гидроксибензальдегида (5 г, 20 ммоль) в ДМФА (100 мл) добавляют триэтиламин (3,5 мл, 25 ммоль) и полученный раствор перемешивают 15 мин при комнатной температуре. Добавляют этилизоцианат (1,95 мл, 25 ммоль) и реакционную смесь перемешивают 2 ч при комнатной температуре до тех пор, пока данные ТСХ не укажут на отсутствие гидроксибензальдегида (Rf = 0,78 для продукта и 0,89 для исходного материала при использовании смеси гексан/EtOAc, 1:1). Реакционный раствор концентрируют азеотропным удалением ДМФА с водой. Полученную суспензию фильтруют, промывают водой и сушат в вакуумной печи, получают названное со 004931(1 Н, с, альдегидная группа СНО), 8,04 (1 Н, т,карбаматный NH), 7,83 (2 Н, с, фенильные Н),3,09 (2 Н, м, этильные СН 2) 1,34 (18 Н, с, 6 СН 3),1,07 (3 Н, т, этильные СН 3). 13 С ЯМР (ДМСО-d6, 270 МГц) , м.д.: 193,4, 155,1, 154,2, 145,0, 133,3, 127,8, 35,9, 31,4,30,5. Пример I. Синтез 4-(н.-пропиламинокарбонилокси)-3,5-ди-трет.-бутилбензальдегида. Названное соединение получают в ДМФА,используя 3,5-ди-трет.-бутил-4-гидроксибензальдегид и н-пропилизоцианат, в соответствии с методикой примера Н. Названное соединение выделяют с выходом 100% в виде почти белого твердого вещества. Пример J. Синтез 4-(н.-бутиламинокарбонилокси)-3,5-ди-трет.-бутилбензальдегида. Названное соединение получают в ДМФА,используя 3,5-ди-трет.-бутил-4-гидроксибензальдегид и н-бутилизоцианат, в соответствии с методикой примера Н. Названное соединение выделяют с выходом 87,5% в виде желтоватокоричневого твердого вещества. Пример К. Синтез 4-2-этоксикарбонил) этиламинокарбонилокси)-3,5-ди-трет.-бутилбензальдегида. Названное соединение получают в ДМФА,используя 3,5-ди-трет.-бутил-4-гидроксибензальдегид и этил-3-изоцианатопропионат, в соответствии с методикой примера Н. Названное соединение выделяют с выходом 100% в виде почти белого твердого вещества. Пример L. Синтез 4-2-этоксикарбонил) метиламинокарбонилокси)-3,5-ди-трет.-бутилбензальдегида. Названное соединение получают в ДМФА,используя 3,5-ди-трет.-бутил-4-гидроксибензальдегид и этил-2-изоцианатоацетат, в соответствии с методикой примера Н. Названное соединение выделяют с выходом 100% в виде почти белого твердого вещества. Пример М. Синтез 4-метоксиметокси-3,5 ди-трет.-бутилбензальдегида. К раствору 3,5-ди-трет.-бутил-4-гидроксибензальдегида (10 г, 40 ммоль) в 1,2 дихлорэтане (200 мл) добавляют N,N-диизопропилэтиламин (6,97 мл, 40 ммоль), и раствор перемешивают в течение 1 ч при комнатной температуре. Добавляют простой хлорметоксиметиловый эфир (3,77 мл, 50 ммоль), реакционную смесь перемешивают 1 ч при комнатной температуре и затем кипятят с обратным холодильником в течение 16 ч до тех пор, пока с помощью ТСХ не будет обнаруживаться присутствие гидроксибензальдегида (Rf = 0,78 для продукта и 0,70 для исходного материала при использовании смеси гексан/EtOAc, 1:1). Реак 23 ционную смесь охлаждают до комнатной температуры и промывают водой. Органический слой концентрируют, остаток наносят на колонку с силикагелем и элюируют смесью пентан/EtOAc. Полученное соединение выделяют с выходом 100 % в виде коричневого масла. Спектроскопические данные: 1 Н ЯМР (ДМСО-d6, 270 МГц) , м.д.: 9,89(6,97 мл, 40 ммоль), и раствор перемешивают в течение 1 ч при комнатной температуре. Добавляют 2-метоксиэтоксиметил(МЭМ)хлорид (5,7 мл, 50 ммоль), реакционную смесь перемешивают 1 ч при комнатной температуре и затем кипятят с обратным холодильником в течение 26 ч до тех пор, пока с помощью ТСХ не будет обнаруживаться присутствие гидроксибензальдегида (Rf=0,92 для продукта и 0,70 для исходного материала при использовании смеси гексан/EtOAc, 1:1). Реакционную смесь охлаждают до комнатной температуры и промывают водой. Органический слой концентрируют, остаток наносят на колонку с силикагелем и элюируют смесью пентан/EtOAc. Полученное соединение выделяют с выходом 98% в виде коричневого масла. Пример 1. Синтез -(4-ацетокси-3,5-дитрет.-бутилфенил)-N-трет.-бутилнитрона. В круглодонную колбу объемом 2 л, снабженную механической мешалкой, загружают 4 ацетокси-3,5-ди-трет.-бутилбензальдегид(113,16 г, 0,41 моль). Добавляют бензол (500 мл), и смесь перемешивают до растворения твердого вещества. К полученному красному раствору добавляют трет.-бутилгидроксиламин(43,80 г, 0,49 моль) и силикагель (20 г). Смесь кипятят с обратным холодильником в течение ночи, после чего данные ТСХ указывают на отсутствие исходного материала (Rf = 0,31 для продукта и 0,80 для исходного материала при использовании смеси гексан/EtOAc, 3:1). Бензол удаляют в вакууме на роторном испарителе с получением серого твердого вещества. Твердое вещество растворяют в минимальном количестве этилацетата, и колбу оставляют в холодильнике. Образовавшиеся белые кристаллы отделяют, промывают гексаном и сушат в вакууме,получают названное соединение в виде кристаллического белого вещества (выход 74,4%),т.пл. 227,0-248,9 С. Спектроскопические данные:(2,56 г, 0,029 моль) и п-толуолсульфоновую кислоту (0,100 г). Используя насадку Дина-Старка,полученную смесь кипятят с обратным холодильником до тех пор, пока данные ТСХ не укажут на отсутствие альдегида (Rf = 0,30 для продукта и 0,89 для исходного материала при использовании смеси гексан/EtOAc, 3:1). Растворитель удаляют в вакууме, и остаток тщательно промывают гексаном. Названное соединение выделяют с выходом 50,8 % в виде белого твердого вещества, т.пл. 197,1-208,1 С. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 8,32 (1 Н,с, фенильные Н), 7,51 (1 Н, с, нитронильный Н),2,87 (1 Н, кв, J = 7,17 Гц, изобутирильный Н),1,61 (9 Н, с, 9 СН 3), 1,38 (6 Н, д, J = 7,17 Гц,6 СН 3), 1,36 (18 Н, с, 18 СН 3). 13 С ЯМР (CDCl3, 270 МГц) , м.д.: 176,0,150,2, 142,7, 129,9, 128,1, 127,1, 70,7, 35,5, 35,2,31,3, 28,5, 18,7. Пример 3. Синтез -(4-н-бутаноил-3,5-дитрет.-бутилфенил)-N-трет.-бутилнитрона. К раствору 4-н-бутаноил-3,5-ди-трет.бутилбензальдегида (9,63 г, 0,032 моль) в бензоле (200 мл) добавляют трет.-бутилгидроксиламин (3,52 г, 0,040 моль) и п-толуолсульфоновую кислоту (0,100 г). Используя насадку Дина-Старка, полученную смесь кипятят с обратным холодильником до тех пор, пока данные ТСХ не укажут на отсутствие альдегида(Rf = 0,30 для продукта и 0,91 для исходного материала при использовании смеси гексан/EtOAc, 3:1). Растворитель удаляют в вакууме,остаток кристаллизуют с помощью EtOAc и гексана до получения названного соединения с выходом 50,2% в виде белого твердого вещества,т.пл. 216,9-236,5 С. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 8,32 (2 Н,с, фенильные Н), 7,50 (1 Н, с, нитронильный Н),2,61 (2 Н, т, J = 7,67 Гц, 2 СН 2), 1,78 (2 Н, м, J = 4,7-0 Гц, 2 СН 2), 1,61 (9 Н, с, 9 СН 3), 1,36 (18 Н, с,18 СН 3), 1,05 (3 Н, т, J = 7,42 Гц, 3 СН 3). 13 С ЯМР (CDCl3, 270 МГц) , м.д.: 173,2,149,5, 142,7, 129,8, 128,2, 127,1, 70,7, 37,6, 35,5,31,4, 28,5, 17,7, 13,8. Пример 4. Синтез -(4-ацетокси-3,5-дитрет.-бутилфенил)-N-изобутилнитрона.(5,36 г, 0,0609 моль) и концентрированную соляную кислоту (10 капель). Используя насадку Дина-Старка, полученную смесь кипятят с обратным холодильником до тех пор, пока данные ТСХ не укажут на отсутствие альдегида (Rf = 0,23 для продукта и 0,84 для исходного материала при использовании смеси гексан/EtOAc,3:1). Растворитель удаляют в вакууме, остаток представляет собой красное масло, которое при растирании с гексаном превращается в твердое вещество. Твердое вещество отделяют и промывают гексаном. Названное соединение выделяют с выходом 52,3% в виде белого твердого вещества, т.пл. 176,8-180,4 С. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 8,3 (2 Н,с, фенильные Н), 7,42 (1 Н, с, нитронильный Н),4,20 (1 Н, кв, J = 6,50 Гц, 1 СН), 2,35 (3 Н, с,3 СН 3), 1,50 (6 Н, д, J = 6,43 Гц, 6 СН 3), 1,37 (18 Н,с, 18 СН 3). 13 С ЯМР (CDCl3, 270 МГц) , м.д.: 170,7,150,1, 142,7, 131,9, 128,0, 127,0, 67,8, 35,5, 31,3,22,6, 20,9. Пример 5. Синтез -(4-ацетокси-3,5-дитрет.-бутилфенил)-N-1-гидрокси-2-метилпроп 2-илнитрона. К раствору 4-ацетокси-3,5-ди-трет.-бутилбензальдегида (10,0 г, 0,0362 моль) в бензоле(200 мл) добавляют N-(1-гидрокси-2-метилпроп-2-ил)гидроксиламин (5,55 г, 0,0543 моль) и п-толуолсульфоновую кислоту (0,090 г). Используя насадку Дина-Старка, полученную смесь кипятят с обратным холодильником до тех пор, пока данные ТСХ не укажут на отсутствие альдегида (Rf = 0,20 для продукта и 0,98 для исходного материала при использовании смеси гексан/EtOAc, 1:1). Растворитель удаляют в вакууме, остаток промывают горячим гексаном. Названное соединение выделяют с выходом 83,9% в виде белого твердого вещества,т.пл. 204,3-204,8 С. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 8,30 (2 Н,с, фенильные Н), 7,46 (1 Н, с, нитронильный Н),3,79 (2 Н, с, 2 СН 2), 2,36 (3 Н, с, 3 СН 3), 1,60 с,6 СН 3), 1,37 (18 Н, с, 18 СН 3). 13 С ЯМР (CDCl3, 270 МГц) , м.д.: 171,1,150,1, 142,9, 132,3, 127,7, 72,8, 69,8, 35,5, 31,6,31,3, 23,9, 22,6. Пример 6. Синтез -(4-н-пентаноил-3,5-дитрет.-бутилфенил)-N-трет.-бутилнитрона. К раствору 4-пентаноил-3,5-ди-трет.бутилбензальдегида (17,48 г, 0,050 моль) в бензоле (250 мл) добавляют трет.-бутилгидроксиламин (4,57 г, 0,0510 моль) и п-толуолсульфоновую кислоту (0,080 г). Используя насадку Дина-Старка, полученную смесь кипятят с обратным холодильником до тех пор, пока 26 данные ТСХ не укажут на отсутствие альдегида(Rf = 0,43 для продукта при использовании смеси гексан/EtOAc, 1:1). Растворитель удаляют в вакууме и остаток тщательно промывают гексаном. Названное соединение выделяют с выходом 56,50% в виде белого твердого вещества,т.пл. 195,5-204,8 С. Спектроскопические данные: 1 Н ЯМР (CDCl3, 270 МГц) , м.д.: 8,31 (2 Н,с, фенильные Н), 7,50 (1 Н, с, нитронильный Н),2,63 (2 Н, т, J = 7,80 Гц, 2 СН), 1,85-1,67 (2 Н, м,2 СН 2), 1,61 (9 Н, с, 9 СН 3), 1,52-1,36 (2 Н, м,2 СН 2), 1,36 (18 Н, с, 18 СН 3), 0,97 (3 Н, т, J = 7,30 Гц, 3 СН 3). 13 С ЯМР (CDC13, 270 МГц) , м.д.: 173,2,149,4, 142,7, 129,8, 128,2, 127,1, 70,7, 35,5, 35,4,31,4, 28,4, 26,2, 22,2, 13,8. Примеры 7-10. При использовании соответствующих исходных материалов и описанных здесь методик получены следующие дополнительные соединения:(т.пл. 231,7235 С). Пример 11. Синтез -[4-(этиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-N-трет.бутилнитрона. К раствору 3,5-ди-трет.-бутил-4-(этиламинокарбонилокси)бензальдегида (5 г, 16 ммоль) в бензоле (200 мл) добавляют трет.бутилгидроксиламин (2,14 г, 24 ммоль). Полученный раствор кипятят с обратным холодильником в течение 96 ч до тех пор, пока данные ТСХ не укажут на отсутствие альдегида (Rf = 0,57 для продукта и 0,78 для исходного материала при использовании смеси гексан/EtOAc,1:1). Растворитель удаляют в вакууме, остаток наносят на колонку с силикагелем и элюируют смесью гексан/EtOAc. Названное соединение выделяют с выходом 57% в виде белого твердого вещества, т.пл. 202,2-212,2 С. Спектроскопические данные: 1 Н ЯМР (ДМСО-d6, 270 МГц) , м.д.: 8,37 27 Названное соединение получают в бензоле с использованием 3,5-ди-трет.-бутил-4-(н-пропиламинокарбонилокси)бензальдегида и трет.бутилгидроксиламина в соответствии с методикой, описанной в примере 11. Названное соединение выделяют с выходом 96,6% в виде белого твердого вещества, т.пл. 206,5-214,0 С. Спектроскопические данные: 1 Н ЯМР (ДMCO-d6, 270 МГц) , м.д.: 8,38(2 Н, с, фенильные Н), 7,90 (1 Н, т, J = 5,8 Гц,карбаматный NH), 7,84 (1 Н, с, нитронильный Н), 3,02 (2 Н, кв, J = 6,5 Гц, пропильные NCH2),1,50 (9 Н, с, 3 СН 3), 1,45 (3 Н, гекстет, J = 7,2 Гц,пропильные СН 2), 1,32 (18 Н, с, 6 СН 3), 0,88 (3 Н,т, J = 7,3 Гц, пропильные СН 3). 13 С ЯМР (ДMCO-d6, 270 МГц) , м.д.: 155,7, 149,7, 143,3, 129,5, 128,7, 127,0, 70,6, 42,8,35,8, 31,7, 28,5 и 11,8. Пример 13. Синтез -[4-(н-бутиламинокарбонилокси)-3,5-ди-трет.-бутилфенил]-Nтрет.-бутилнитрона. Названное соединение получают в бензоле с использованием 3,5-ди-трет.-бутил-4-(н-бутиламинокарбонилокси)бензальдегида и трет.бутилгидроксиламина в соответствии с методикой, описанной в примере 11. Названное соединение выделяют с выходом 93,4% в виде белого твердого вещества, т.пл. 203,6-205,1 С. Спектроскопические данные: 1 Н ЯМР (ДMCO-d6, 270 МГц) , м.д.: 8,38(2 Н, с, фенильные Н), 7,88 (1 Н, т, J = 5,7 Гц,карбаматный NH), 7,84 (1 Н, с, нитронильный Н), 3,05 (2 Н, кв, J = 6,3 Гц, н-бутильные NCH2),1,50 (9 Н, с, 3 СН 3), 1,45-1,37 (4 Н, м, н-бутильные 2 СН 2), 1,31 (18 Н, с, 6 СН 3), 0,87 (3 Н, т, J = 7,1 Гц, н-бутильные СН 3). 13 С ЯМР (ДMCO-d6, 270 МГц) , м.д.: 155,6, 149,7, 143,3, 129,5, 128,7, 127,0, 70,6, 40,7,35,8, 31,9, 31,6, 28,5, 19,9 и 14,2. Пример 14. Синтез -[4-(2-этоксикарбонил)этиламинокарбонилокси-3,5-ди-трет.бутилфенил]-N-трет.-бутилнитрона. Названное соединение получают в бензоле с использованием 3,5-ди-трет.-бутил-(4-(2-этоксикарбонил)этиламинокарбонилокси)бензальдегида и трет.-бутилгидроксиламина в соответствии с методикой, описанной в примере 11. Названное соединение выделяют с выходом 88,4% в виде белого твердого вещества, т.пл. 130,5-146,3 С. Спектроскопические данные: 1 Н ЯМР (ДMCO-d6, 270 МГц) , м.д.: 8,38 С ЯМР (ДMCO-d6, 270 МГц) , м.д.: 171,5, 155,6, 149,5, 143,3, 129,4, 128,8, 127,0,70,6, 60,5, 37,2, 35,8, 34,6, 31,7, 28,5 и 14,7. Пример 15. Синтез -[4-(2-этоксикарбонилметиламинокарбонилокси)-3,5-ди-трет.бутилфенил]-N-трет.-бутилнитрона. Названное соединение получают в бензоле с использованием 3,5-ди-трет.-бутил-(4-(2-этоксикарбонил)метиламинокарбонилокси)бензальдегида и трет.-бутилгидроксиламина в соответствии с методикой, описанной в примере 11. Названное соединение выделяют с выходом 42% в виде белого твердого вещества, т.пл. 177,2181,6 С. Спектроскопические данные: 1 Н ЯМР (ДМСО-d6, 270 МГц) , м.д.: 8,38(2 Н, с, фенильные Н), 8,35 (1 Н, т, J = 5,7 Гц,карбаматный NH), 7,84 (1 Н, с, нитронильный Н), 4,10 (2 Н, кв, J = 7,0 Гц, этильные ОСН 2),3,83 (2 Н, д, J = 5,7 Гц, NCH2), 1,50 (9 Н, с, 3 СН 3),1,32 (18 Н, с, 6 СН 3), 1,19 (3 Н, т, J = 7,0 Гц,этильные СН 3). 13 С ЯМР (ДMCO-d6, 270 МГц) , м.д.: 170,3, 155,9, 143,3, 129,4, 128,9, 127,0, 70,7, 61,0,42,9, 35,8, 31,7, 28,5 и 14,6. Пример 16. Синтез -(4-метоксиметокси 3,5-ди-трет.-бутилфенил)-N-трет.-бутилнитрона. К раствору 3,5-ди-трет.-бутил-4-метоксиметоксибензальдегида (11,42 г, 40 ммоль) в бензоле (200 мл) добавляют трет.-бутилгидроксиламин (4,0 г, 50 ммоль). Полученный раствор кипятят с обратным холодильником в течение 72 ч до тех пор, пока данные ТСХ не укажут на отсутствие альдегида (Rf = 0,56 для продукта и 0,78 для исходного материала при использовании смеси гексан/EtOAc, 1:1). Растворитель удаляют в вакууме, остаток суспендируют в смеси гексан/EtOAc. Суспензию фильтруют,промывают гексаном и сушат, получают названное соединение (выход 69%) в виде белого твердого вещества, т.пл. 202,2-205,9 С. Спектроскопические данные: 1 Н ЯМР (ДМСО-d6, 270 МГц) , м.д.: 8,37(9 Н, с, 3 СН 3), 1,40 (18 Н, с, 6 СН 3). 13 С ЯМР (ДМСО-d6, 270 МГц) , м.д.: 155,3, 143,9, 129,4, 127,8, 127,4, 101,0, 70,5, 57,6,36,0, 32,3, 28,5. Пример 17. Синтез -[4-(2-метоксиэтоксиметокси)-3,5-ди-трет.-бутилфенил]-N-трет.бутилнитрона. Названное соединение получают в бензоле из 3,5-ди-трет.-бутил-4-(2-метокси)этоксиметоксибензальдегида и трет.-бутил-гидроксиламина с использованием методики, описанной в примере 16. Названное соединение выделяют в виде белого твердого вещества (выход 70,1%),т.пл. 169,6-173,5 С. Спектроскопические данные:(2 Н, с, фенильные Н), 7,80 (1 Н, с, нитронильный Н), 4,91 (2 Н, с, ОСН 2), 3,87 (2 Н, м, J = 4,76 Гц,этокси ОСН 2), 3,54 (2 Н, м, J = 4,76 Гц, ОСН 2),3,28 (3 Н, с, ОСН 3), 1,49 (9 Н, с, 3 СН 3), 1,40 (18 Н,с, 6 СН 3). 13 С ЯМР (ДМСО-d6, 270 МГц) , м.д.: 155,3, 143,9, 129,4, 127,8, 127,4, 100,1, 71,7, 70,5,69,3, 58,7, 36,0, 32,3, 28,5. Примеры 18 и 19. При использовании соответствующих исходных материалов и описанных здесь методик получены следующие дополнительные соединения:-(4-метоксиметокси-3,5-ди-трет.-бутилфенил)-N-3-тиометоксипропилнитрон (т.пл. 5563 С). Пример I. Отсутствие ингибирования СОХ-1 и СОХ-2. В этом опыте соединение примера 1 испытано с целью определения, ингибирует ли оно ферменты циклооксигеназу 1 (СОХ-1) и циклооксигеназу 2 (СОХ-2). Ингибирование СОХ-1 измеряют путем инкубирования арахидоновой кислоты с СОХ-1,полученной из семенных пузырьков барана. Ингибирование СОХ-2 измеряют путем инкубирования арахидоновой кислоты с СОХ-2, полученной из плаценты овцы. Эти методы оценки также описаны в публикации Evans et al., Biochem. Pharmacol., 36:2035, 1987. В каждом анализе образование простагландина Е 2 (PGE2) измеряют путем спектрофотометического количественного определения малондиальдегида. Соединение примера 1 добавляют к инкубационным растворам в концентрации 300 мкМ. При этой концентрации индометацин, известный ингибитор СОХ-1 и СОХ-2, полностью ингибирует оба фермента. При этих же условиях соединение примера 1 не оказывает значительного влияния на СОХ-1 или СОХ-2 при концентрации 300 мкМ. Эти результаты показывают, что соединение примера 1 не ингибирует ферменты циклооксигеназу 1 (СОХ-1) и циклооксигеназу 2(СОХ-2). Пример II. Ингибирования PGE2. В этом опыте показана способность нитронов формулы I ингибировать индукцию простагландина Е 2 (PGE2). В этом методе оценки испытуемое соединение солюбилизируют в 500 мкл EtOH и затем доводят до объема 10 мл полной DMEM с 1 мкг/мл липополисахарида (LPS) с получением 10 мМ раствора. Этот раствор затем разбавляют в соотношении 1/100 с получением 100 мкМ раствора. В качестве эталона индометацин солюбилизируют в 500 мкл ДМСО и затем объем доводят до 50 мл полной DMEM с 1 мкг/мл LPS. 30 Этот 2 мМ раствор затем разбавляют в соотношении 1/200 с получением 10 мкМ раствора. Этот раствор используют в качестве эталона. Все разбавления делают полной DMEM. Макрофаги (мышиные макрофаги RAW 264.7) получены от фирмы American Type Culture Collection, Rockville, MD. Их культивируют в колбах объемом 75 см 3 с DMEM (модифицированная по способу Дульбекко среда Игла с 10% сыворотки плода крупного рогатого скота,пенициллином, стрептомицином и глутамином) и высевают в 96-луночный планшет при концентрации 20 х 106 клеток/10 мл, по 200 мкл на лунку. При 80-100% слиянии макрофаги промывают HBSS (с пенициллином, стрептомицином и глутамином) и инкубируют с испытуемым соединением или эталоном, разбавленнымDMEM (с 10% FCS, пенициллином, стрептомицином и глутамином) с 1 мкг/мл LPS, в течение 18 ч. Затем клетки промывают HBSS и выдерживают с 30 мкМ арахидоновой кислоты вHBSS в течение 15 мин при 37 С. Надосадочную жидкость отбирают для определения уровней PGE2 с использованием обычных методик. Полученные результаты выражают в виде процента ингибирования. Соединения, уменьшающие уровень PGE2, по меньшей мере, приблизительно на 30% по сравнению с контролем, считаются эффективными в данном методе оценки. На начальной стадии испытуемые соединения проверяют при 100 мкМ. Соединения,проявляющие активность, проверяют при более низких концентрациях, чтобы получить IC50. При таком скрининге исходный раствор последовательно разбавляют с разведением 1:10, чтобы получить растворы с концентрациями 30 мкМ, 10 мкМ, 1 мкМ, 0,1 мкМ. Раствор с 10 мкМ разбавляют в соотношении 1:3 с получением 3 мкМ раствора, который затем разбавляют последовательно с получением растворов 0,3 мкМ и 0,03 мкМ. Последовательные разбавления используют для определения IC50 испытуемого соединения. Пример III. Метод оценки каррагенанового отека подушечки лапы. В этом опыте показана способность соединений формулы I уменьшать каррагенановый отек лапы у крыс. Этот метод оценки обычно используют для скрининга и оценки соединений, кандидатов в противовоспалительные лекарства. См., например, С.A. Winter et al., "Carrageenin-induced Edema in Hind Paw of the Rat asExp. Biol. Med. 111, 544-547 (1962), а также цитируемые там ссылки. В этом методе оценки готовят суспензию каррагенана (0,5%) смешением 50 мг каррагенана (Тип IV, ) в 10 мл стерильного физиологического раствора. Затем самцам крыс SpragueDawley (150-250 г) подкожно вводят инъекцию 100 мкл суспензии каррагенана в подошвенную 31 часть задней правой лапы. Испытуемое соединение (100 мг в 2 мл) или растворитель в качестве контроля (2 мл) затем вводят п/о или в/б. Начальный объем лапы определяют непосредственно перед и через 3 ч после введения каррагенана с помощью плетизмографа (Ugo-Basile). Разницу между объемом лапы через 3 ч и начальным объемом для каждой испытуемой группы животных используют для расчета процента ингибирования отека, достигаемого с помощью испытуемого соединения при испытуемой дозе в сравнении с контрольной группой,получавшей растворитель. Соединения, уменьшающие отек, по меньшей мере, на 10% по сравнению с контрольной группой, получавшей растворитель, как считают, эффективны в данном методе оценки. Пример IV. Метод оценки с адъювантом. В этом опыте показана способность соединений формулы I уменьшать индуцируемый адъювантами отек подушечки лапы у крыс. Этот метод оценки представляет собой модель хронического воспаления. См., например, В.М.in the Control of Inflammation, 363-380 (1989), а также цитируемые там ссылки. В этом методе оценки самцов крыс Lewis весом между 180 и 220 г слегка анестезируют в/б инъекцией 30 мг/кг пентобарбитала натрия(50 мг/мл). Высушенные Mycobacterium butyrium (Difco, 20 мг/мл), суспендированные в минеральном масле, впрыскивают под кожу (50 мкл) по обеим сторонам основания хвоста. На обеих задних лапах на 5 мм выше угла лодыжки татуирована линия. Объемы лапы под линией измеряют по объемному смещению с использованием плетизмографа (Ugo-Basile) в день инъекции адъюванта (0 день) и на 14 день. На 14 день животных с объемами лап, равными среднему значению объема лапстандартная ошибка, распределяют случайным образом на обрабатываемые группы. Крыс, которые не попадают в рамки ( 1 стандартная ошибка), в опыте не используют. Одна группа получает растворитель (1% метилцеллюлозу) п/о, а другая группа получает индометацин (3 мг/кг, суспендирован в 1% метилцеллюлозе). Введение доз начинают на 14 день и продолжают до получения конечного результата на 21 день после инъекции адъюванта. Отдельную группу, которая не получает ни адъювант, ни испытуемое соединение,также используют в качестве контроля. Эта группа из-за роста крыс имеет небольшое положительное увеличение объема, когда объемы лап на 21 день вычитают из значений 0 дня. Индометацин (3 мг/кг, п/о), известное противовоспалительное соединение, значительно уменьшает объем лапы по сравнению с растворителемконтролем. Соединения, снижающие объем лапы, по меньшей мере, приблизительно на 30% по сравнению с контрольной группой, получав 004931 32 шей растворитель, считаются эффективными в этом испытании. Пример V. Метод оценки коллагенового артрита. В этом опыте показана способность соединений формулы I уменьшать коллагеновый отек подушечки лапы у крыс. Этот метод оценки обычно используется для скрининга и оценки возможных противовоспалительных лекарственных средств. См., например, Larsson et al.,ArthritisRheumatism, 33, 693-701, 1990, a также цитируемые там ссылки. Для этих опытов самок крыс DA (возрастом 7-8 недель) иммунизируют коллагеном ТипII, полученным из бычьей носовой перегородки,как описано в публикации Cremer et al., J. ofImmunology, 149:1045-1053, 1992. Коллаген растворяют и вводят с неполным адъювантом Фрейнда. Придерживаются стандартных предписаний, чтобы исключить денатурацию коллагена перед его введением, то есть, раствор в процессе приготовления сохраняют холодным. Крыс иммунизируют в основание хвоста на 0 день. Введение доз начинают на 10 день с балльной оценкой крыс на 21 день по шкале жесткости симптомов. Крыс оценивают по походке (0-3), опуханию (плюсневое, лодыжечное,кистевое, пятное, 0-3) с наивысшими показателями, даваемыми наибольшему опуханию или недостаточности. Всю балльную оценку проводят по слепому методу. Соединения, снижающие показатели, по меньшей мере, на около 30% по сравнению с контролем, считаются эффективными при данном способе оценки. Артрит также оценивают путем сравнения веса лап на 21 день. Соединения, уменьшающие вес лапы,по меньшей мере, приблизительно на 30% по сравнению с контролем, также считаются эффективными в данном методе оценки. Результаты оценки Каждое соединение формулы I, которое было испытано в описанных выше методах оценки, как установлено, эффективно снижает индукцию PGE2 и/или является эффективным в методах оценки с каррагенаном, адъювантом и/или коллагеном. Пример VI. Исследование с помощью электронного парамагнитного резонанса (ЭПР). С использованием следующих методик можно показать, что нитроны настоящего изобретения улавливают свободные радикалы при проведении спинового захвата по методике ЭПР. Для дополнительного описания эксперимента см., например, K.R. Maples et al., "In Vivo(1994). В этом опыте используется генерирующая свободные радикалы система трет.-бутил 33 гидропероксид/железо. Такая генерирующая свободные радикалы система дает трет.-бутилалкоксильные радикалы,трет.-бутилпероксильные радикалы и метильные радикалы. Если нитрон настоящего изобретения обладает способностью улавливать эти радикалы с образованием стабильного радикального аддукта, то такие радикальные аддукты должны быть определяемы с помощью спектроскопии ЭПР. К 490 мкл 100 мМ раствора нитрона в воде добавляют 5 мкл 100 мМ сульфата железа. Реакцию инициируют добавлением 5 мкл 100 мМ трет.-бутилгидропероксида. Конечные концентрации реагентов составляют 1 мМ железа, 1 мМ трет.-бутилгидропероксида и 98 мМ нитронового соединения в воде. После смешения раствор быстро переносят в кварцевую плоскую ячейку, и эту ячейку помещают в полость спектрометра ЭПР Bruker ESP 300 и сканируют в пределах 5-минутного смешения. Настройка спектрометра ЭПР: центральное поле 3480 Гс,ширина поля 200 Гс, время разверстки 480 с,частота 9,76 ГГц, мощность 10 дБ, усиление ресивера 1,6 х 105, амплитуда модуляции 0,200 Гс, временная константа 0,320 с и фаза 270. Данные спектров ЭПР показывают, что нитрон эффективно улавливает свободные радикалы, и что такие соединения могут быть использованы в качестве аналитических реагентов для ЭПР. Из приведенного выше описания видно,что различные модификации и изменения композиций и способов настоящего изобретения могут быть сделаны квалифицированными в данной области специалистами. Предполагается, что все такие модификации, попадающие в объем прилагаемой формулы изобретения,включены в изобретение. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I каждый R2 независимо выбран из группы формулыR3 представляет собой атом водорода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметильной или C1-6 алкоксигруппой, или С 3-10 циклоалкил;R6 и R7 независимо выбраны из группы,включающей атом водорода, C1-10 алкил, который может быть замещен C1-6 алкоксикарбонилом или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R6 и R7 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода,X представляет собой атом кислорода,W представляет собой атом кислорода; а также их фармацевтически приемлемые соли. 2. Соединение по п.1, где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкокси или гидроксигруппой,или фенил, замещенный трифторметилом илиC1-6 алкоксигруппой, или С 3-10 циклоалкил. 3. Соединение по п.2, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил,трет.-бутил, циклогексил, 3-тиометилпропил, 3(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил. 4. Соединение по п.1, где R5 выбран из группы, включающей C1-6 алкил, C1-6 алкоксиалкильную группу и С 3-10 циклоалкил. 5. Соединение по п.4, где R5 выбран из группы, включающей метил, этил, н-пропил,изопропил и н-бутил. 6. Соединение по п.1, где R7 представляет собой атом водорода и R6 выбран из группы,включающей C1-6 алкил или C1-6 алкоксикарбонилалкил. 7. Соединение по п.6, где R6 выбран из группы, включающей этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил и 2(этоксикарбонил)этил. 8. Соединение по п.1, где X представляет собой атом кислорода, R9 представляет собой атом водорода и R8 представляет собой C1-6 алкил или C1-6 алкоксиалкил. 9. Соединение по п.8, где R8 выбран из группы, включающей метил и метоксиэтил. 10. Соединение по п.9, где R10, R11 и R12 представляют собой метил. 11. Соединение по п.1, имеющее формулуR4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметильной или C1-6 алкоксигруппой, и С 3-10 циклоалкил; а также его фармацевтически приемлемые соли. 12. Соединение по п.11, где R13 представляет собой алкил, содержащий 1-6 атомов углерода. 13. Соединение по п.11, где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил. 14. Соединение по п.13, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил,трет.-бутил, циклогексил, 3-тиометилпропил, 3(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил. 15. Соединение по п.1, имеющее формулу где R15 и R16 независимо выбраны из группы, включающей атом водорода, C1-10 алкил,который может быть замещен C1-6 алкоксикарбонилом или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R15 и R16 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметилом или C1-6 алкоксигруппой, или С 3-10 циклоалкил; и его фармацевтически приемлемые соли. 16. Соединение по п.15, где R16 представляет собой атом водорода и R15 выбран из группы, включающей C1-10 алкил или C1-6 алкоксиалкильную группу. 17. Соединение по п.16, где R15 выбран из группы, включающей этил, н-пропил, изопропил, н-бутил, этоксикарбонилметил, 2-(этоксикарбонил)этил. 18. Соединение по п.15, где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифтор 004931R19 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил; и его фармацевтически приемлемые соли. 21. Соединение по п. 20, где R19 представляет собой атом водорода и R18 представляет собой C1-10 алкил или C1-10 алкоксиалкил. 22. Соединение по п.21, где R18 представляет собой метил или метоксиэтил. 23. Соединение по п.20, где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, или С 3-10 циклоалкил. 24. Соединение по п.23, где R4 выбран из группы, включающей метил, н-пропил, изопропил, 1-гидрокси-2-метилпроп-2-ил, н-бутил,трет.-бутил, циклогексил, 3-тиометилпропил, 3(тиометокси)бут-1-ил, 4-трифторметилфенил и 3,4,5-триметоксифенил. 25. Соединение по п.1, выбранное из группы, включающей-[4-метоксиметокси-3,5-ди-трет.-бутилфенил]-N-3-тиометоксипропилнитрон; и их фармацевтически приемлемые соли. 26. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы I каждый R2 независимо выбран из группы формулыR3 представляет собой атом водорода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой или фенилом,замещенным трифторметильной или C1-6 алкоксигруппой, и С 3-10 циклоалкил;R6 и R7 независимо выбраны из группы,включающей атом водорода, C1-10 алкил, который может быть замещен C1-6 алкоксикарбонилом или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R6 и R7 вместе могут образовыватьR9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода,X представляет собой атом кислорода,W представляет собой атом кислорода; а также их фармацевтически приемлемые соли. 27. Фармацевтическая композиция по п.26,где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксируппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил. 28. Фармацевтическая композиция по п.27,где R4 выбран из группы, включающей метил, нпропил, изопропил, 1-гидрокси-2-метилпроп-2 ил, н-бутил, трет.-бутил, циклогексил, 3(тиометокси)бут-1-ил, 3-тиометилпропил, 4 трифторметилфенил и 3,4,5-триметоксифенил. 29. Фармацевтическая композиция по п.26,где R5 выбран из группы, включающей C1-6 алкил, C1-6 алкоксиалкильную группу и С 3-10 циклоалкил. 30. Фармацевтическая композиция по п.29,где R5 выбран из группы, включающей метил,этил, н-пропил, изопропил и н-бутил. 31. Фармацевтическая композиция по п.26,где R7 представляет собой атом водорода и R6 выбран из группы, включающей C1-10 алкил иC1-6 алкоксикарбонилалкильную группу. 32. Фармацевтическая композиция по п.31,где R6 выбран из группы, включающей этил, нпропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этил. 33. Фармацевтическая композиция по п.26,где X представляет собой атом кислорода, R9 представляет собой атом водорода и R8 представляет собой C1-6 алкил или C1-6 алкоксиалкил. 34. Фармацевтическая композиция по п.33,где R8 выбран из группы, включающей метил и метоксиэтил. 35. Фармацевтическая композиция по п.26,где R10, R11 и R12 представляют собой метил. 36. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы IIR4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметильной или C1-6 алкоксигруппой, и С 3-10 циклоалкил; а также его фармацевтически приемлемые соли. 37. Фармацевтическая композиция по п.36,где R13 представляет собой алкил, содержащий 1-6 атомов углерода. 38. Фармацевтическая композиция по п.36,где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил. 39. Фармацевтическая композиция по п.38,где R4 выбран из группы, включающей метил, нпропил, изопропил, 1-гидрокси-2-метилпроп-2 ил, н-бутил, трет.-бутил, циклогексил, 3(тиометокси)бут-1-ил, 3-тиометилпропил, 4 трифторметилфенил и 3,4,5-триметоксифенил. 40. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы III где R15 и R16 независимо выбраны из группы, включающей атом водорода, C1-10 алкил,который может быть замещен C1-6 алкоксикарбонил или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R15 и R16 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил; и его фармацевтически приемлемые соли. 41. Фармацевтическая композиция по п.40,где R16 представляет собой атом водорода и R15 выбран из группы, включающей C1-10 алкил иC1-6 алкоксикарбонилалкильной группой. 42. Фармацевтическая композиция по п.41,где R15 выбран из группы, включающей этил, нпропил, изопропил, н-бутил, этоксикарбонилметил и 2-(этоксикарбонил)этил. 43. Фармацевтическая композиция по п.40,где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил. 40 44. Фармацевтическая композиция по п.43,где R4 выбран из группы, включающей метил, нпропил, изопропил, 1-гидрокси-2-метилпроп-2 ил, н-бутил, трет.-бутил, циклогексил, 3 тиометилпропил, 3-(тиометокси)бут-1-ил, 4 трифторметилфенил и 3,4,5-триметоксифенил. 45. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения формулы IVR19 выбран из группы, включающей атом водорода, C1-10 алкил, C1-10 алкоксиалкил, С 3-10 циклоалкил; или R18 и R19 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил,замещенный трифторметилом или C1-6 алкоксигруппой, и С 3-10 циклоалкил; и его фармацевтически приемлемые соли. 46. Фармацевтическая композиция по п.44,где R19 представляет собой атом водорода и R18 представляет собой C1-10 алкил и C1-10 алкоксиалкил. 47. Фармацевтическая композиция по п.46,где R18 представляет собой метил или метоксиэтил. 48. Фармацевтическая композиция по п.45,где R4 выбран из группы, включающей C1-6 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенил, замещенный трифторметилом или C1-6 алкоксигруппой, или С 3-10 циклоалкил. 49. Фармацевтическая композиция по п.48,где R4 выбран из группы, включающей метил, нпропил, изопропил, 1-гидрокси-2-метилпроп-2 ил, н-бутил, трет.-бутил, циклогексил, 3(тиометокси)бут-1-ил, 3-тиометилпропил, 4 трифторметилфенил и 3,4,5-триметоксифенил. 50. Способ лечения у млекопитающего состояния, связанного с воспалением, отличающийся тем, что он включает введение указанному млекопитающему фармацевтической композиции, содержащей фармацевтически приемлемый носитель и эффективное для ослабления воспаления количество соединения формулы I каждый R2 независимо выбран из группы формулыR3 представляет собой атом водорода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкокси или гидроксигруппой или фенилом, замещенным трифторметильной или C1-6 алкоксигруппой, и С 3-10 циклоалкил;R6 и R7 независимо выбраны из группы,включающей атом водорода, C1-10 алкил, который может быть замещен C1-6 алкоксикарбонилом или C1-6 алкоксигруппой, С 3-10 циклоалкил; или R6 и R7 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R9 вместе могут образовывать алкиленовую группу, содержащую от 2 до 10 атомов углерода;R10, R11 и R12 независимо выбраны из группы, включающей алкил, содержащий 1-6 атомов углерода,X представляет собой атом кислорода,W представляет собой атом кислорода; а также их фармацевтически приемлемые соли. 51. Способ по п.50, где связанное с воспалением состояние представляет собой ревматоидный артрит. 52. Способ по п.50, где связанное с воспалением состояние представляет собой остеоартрит. 42 53. Способ по п.50, где связанное с воспалением состояние представляет собой анкилозирующий спондилит. 54. Способ по п.50, где связанное с воспалением состояние представляет собой системную красную волчанку. 55. Соединение формулы I каждый R2 независимо выбран из группы формулыR3 представляет собой атом водорода;R4 выбран из группы, включающей C1-10 алкил, который может быть замещен тиоалкоксигруппой или гидроксигруппой, или фенилом,замещенным трифторметильной или C1-6 алкоксигруппой;R7 представляет собой атом водорода;R9 представляет собой атом водорода;R10, R11 и R12 каждый представляет собой метил;X представляет собой атом кислорода иW представляет собой атом кислорода; и его фармацевтически приемлемые соли. 56. Соединение по п.55, где R5 выбран из группы, включающей метил, этил, н-пропил,изопропил и н-бутил.
МПК / Метки
МПК: A61P 19/02, A61K 31/135, C07C 291/02
Метки: композиции, арилнитроны, содержащие, фармацевтические, 5-тризамещенные
Код ссылки
<a href="https://eas.patents.su/22-4931-3-4-5-trizameshhennye-arilnitrony-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">3, 4, 5-тризамещенные арилнитроны и содержащие их фармацевтические композиции</a>
Предыдущий патент: Фармацевтическая композиция для лечения острой, хронической боли и/или невропатической боли и мигреней
Следующий патент: Имидазоимидазолы и имидазотриазолы в качестве противовоспалительных агентов
Случайный патент: Изделие, включающее подложку с нанесенным экструзионным способом покрытием, способ получения изделия и применение изделия












