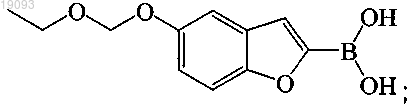
Новые бензофураны, подходящие в качестве предшественников соединений, которые являются полезными для визуализации амилоидных отложений
Номер патента: 19093
Опубликовано: 30.01.2014
Авторы: Свахн Бритт-Марие, Нильссон Нильс Андерс, Делиссер Верн, Йохнстрём Петер, Бьёрк Сет, Руда Катинка, Скоу Пер Магнус
Формула / Реферат
1. Соединение или его соль, где соединение представляет собой трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты.
2. Соединение или его соль по п.1 в кристаллической форме.
3. Соединение или его соль по п.2, где эта кристаллическая форма имеет по меньшей мере одно эндотермическое явление с началом между 70 и 300°С.
4. Соединение или его соль по п.1 в кристаллической форме, имеющей картину дифракции рентгеновских лучей на порошке, содержащую по меньшей мере один характерный пик дифракции при 2тета = 13,51±0,5°.
5. Соединение или его соль по п.1 в кристаллической форме, имеющей следующие пики дифракции: 11,27; 12,00; 13,51; 15,53; 16,82; 17,91 и 23,72 °2тета.
6. Применение соединения или его соли по п.1 или 2 в качестве синтетического предшественника для получения меченого соединения.
7. Применение по п.6, где метка представляет собой атом 18F.
8. Применение по п.6 или 7, где меченое соединение представляет собой 2-(6-[18F]-фтор-5-метиламинопиридин-2-ил)бензофуран-5-ол или его соль.
9. Способ получения трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты, включающий
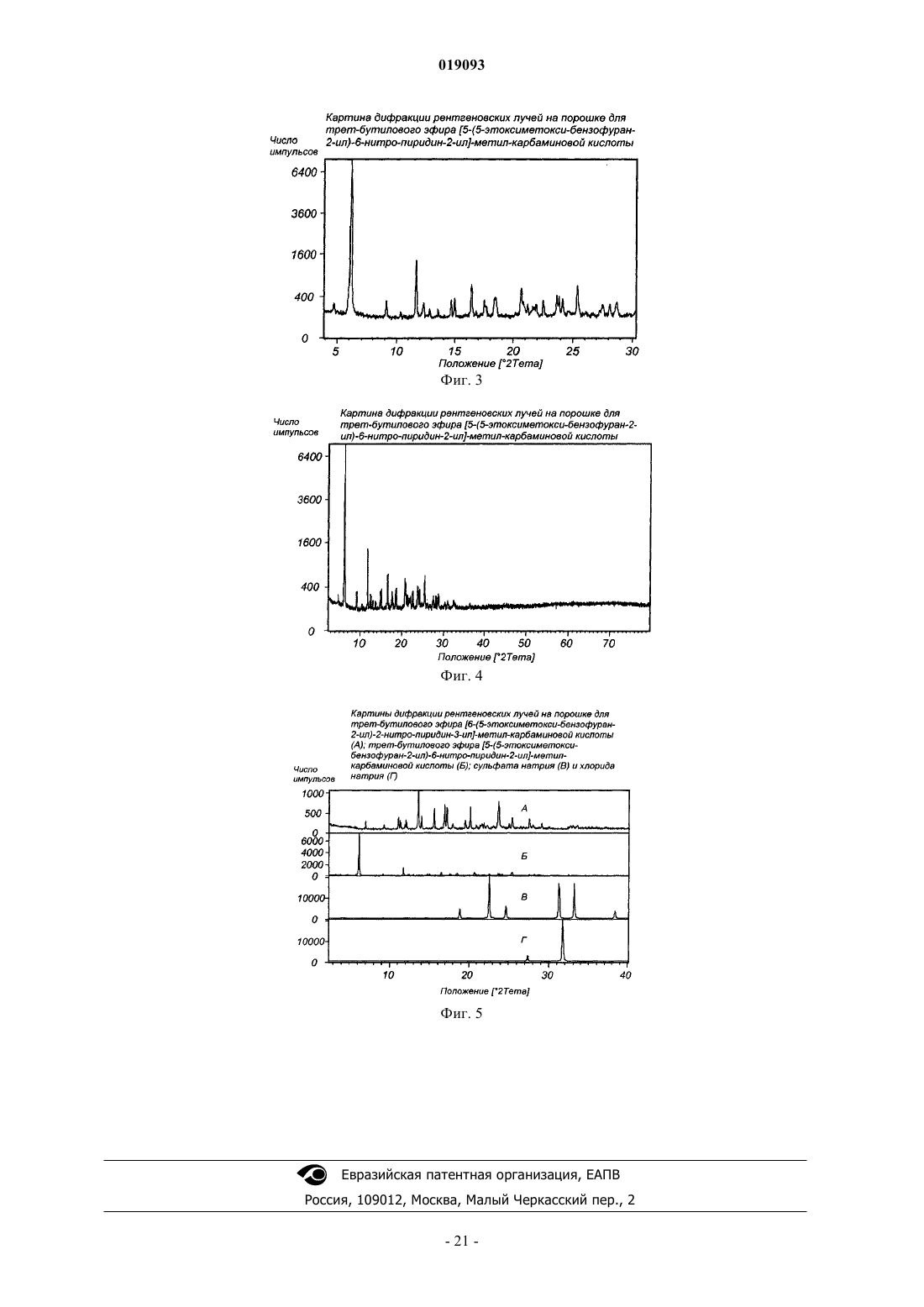
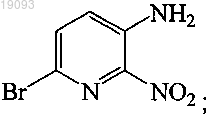
превращение соединения 5 в соединение 6 способом, включающим
введение защиты аминогруппы в соединении 5 с использованием трет-бутилдикарбоната в присутствии гексаметилдисилазида натрия;
превращение соединения 6 в соединение 7 способом, включающим алкилирование соединения 6 с использованием CH3I в присутствии NaH;
осуществление взаимодействия соединения 7 и соединения 4 в присутствии дихлор-бис-(трифенилфосфин)палладия(II) и (СН3СН2)3N в этаноле, где
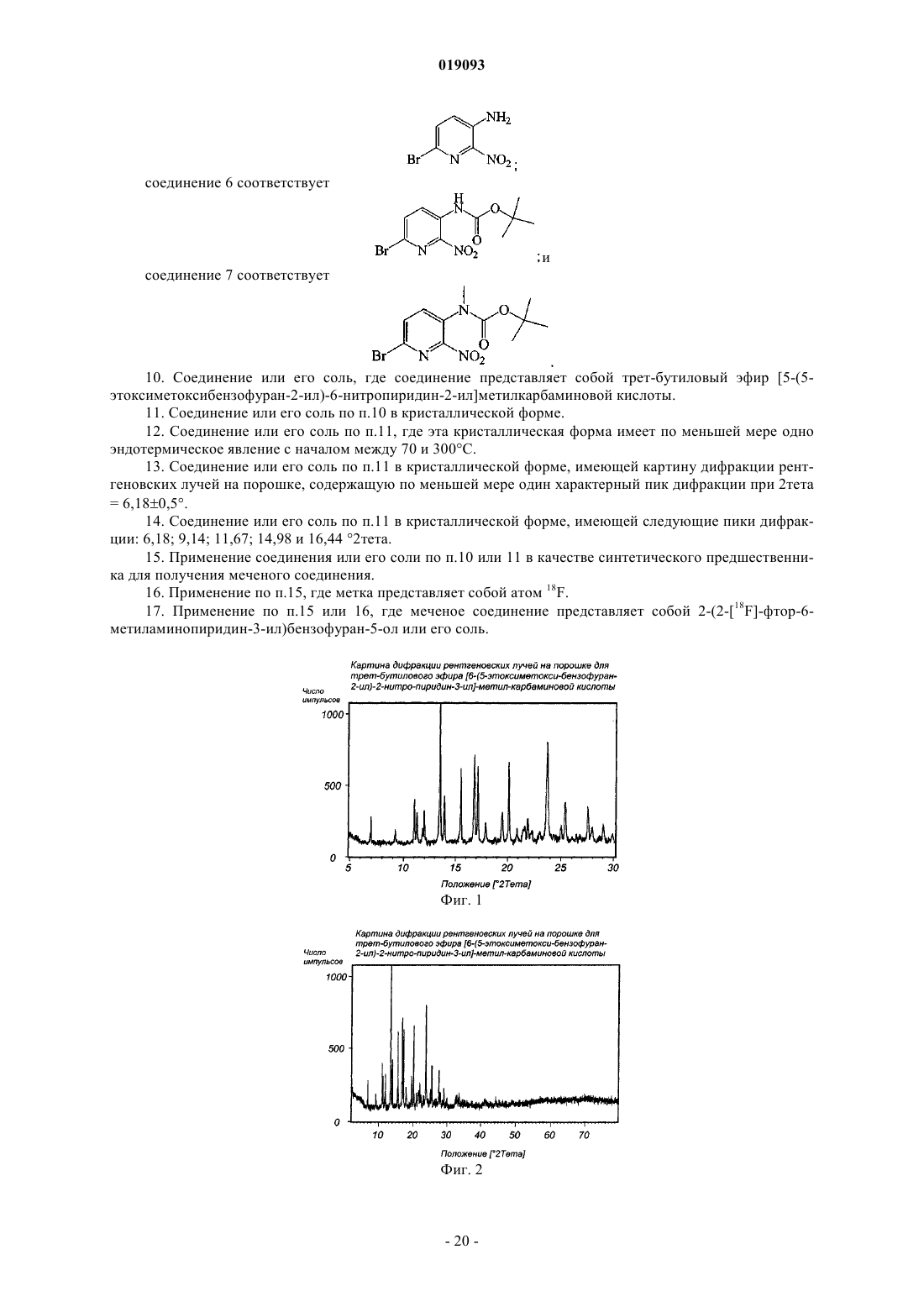
соединение 4 соответствует
соединение 5 соответствует
соединение 6 соответствует
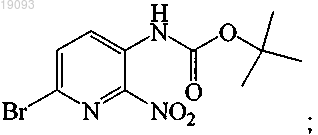
и
соединение 7 соответствует
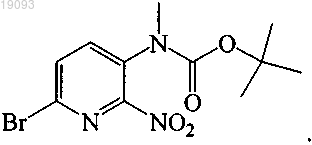
10. Соединение или его соль, где соединение представляет собой трет-бутиловый эфир [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты.
11. Соединение или его соль по п.10 в кристаллической форме.
12. Соединение или его соль по п.11, где эта кристаллическая форма имеет по меньшей мере одно эндотермическое явление с началом между 70 и 300°С.
13. Соединение или его соль по п.11 в кристаллической форме, имеющей картину дифракции рентгеновских лучей на порошке, содержащую по меньшей мере один характерный пик дифракции при 2тета = 6,18±0,5°.
14. Соединение или его соль по п.11 в кристаллической форме, имеющей следующие пики дифракции: 6,18; 9,14; 11,67; 14,98 и 16,44 °2тета.
15. Применение соединения или его соли по п.10 или 11 в качестве синтетического предшественника для получения меченого соединения.
16. Применение по п.15, где метка представляет собой атом 18F.
17. Применение по п.15 или 16, где меченое соединение представляет собой 2-(2-[18F]-фтор-6-метиламинопиридин-3-ил)бензофуран-5-ол или его соль.
Текст
НОВЫЕ БЕНЗОФУРАНЫ, ПОДХОДЯЩИЕ В КАЧЕСТВЕ ПРЕДШЕСТВЕННИКОВ СОЕДИНЕНИЙ, КОТОРЫЕ ЯВЛЯЮТСЯ ПОЛЕЗНЫМИ ДЛЯ ВИЗУАЛИЗАЦИИ АМИЛОИДНЫХ ОТЛОЖЕНИЙ Изобретение относится к новым производным, которые являются подходящими в качестве предшественников соединений, которые являются полезными для визуализации амилоидных отложений у живых пациентов, к их композициям, способам применения и способам получения таких соединений. Соединения, происходящие от этих предшественников, являются полезными в способах визуализации амилоидных отложений в мозге in vivo для обеспечения прижизненной диагностики болезни Альцгеймера позитронно-эмиссионной томографией (ПЭТ), а также измерения клинической эффективности терапевтических агентов против болезни Альцгеймера. Кроме того, настоящее изобретение также раскрывает данные соединения-предшественники в кристаллической форме. Этот патент испрашивает приоритет предварительной заявки на патент США 61/092851 (поданной 29 августа 2008). Весь текст вышеупомянутой патентной заявки включен в данный патент посредством ссылки. Настоящее изобретение относится к новым производным, которые подходят в качестве предшественников соединений, полезных для визуализации амилоидных отложений у млекопитающих, таких как живые пациенты, к их композициям, способам применения и способам получения таких соединений. Соединения, происходящие из этих предшественников, являются полезными в способах визуализации амилоидных отложений в мозге in vivo для обеспечения прижизненной диагностики болезни Альцгеймера посредством таких методик визуализации, как позитронно-эмиссионная томография (ПЭТ). Данные соединения также можно использовать для измерения клинической эффективности терапевтических агентов против болезни Альцгеймера. Кроме того, настоящее изобретение также раскрывает соединенияпредшественники в кристаллической форме. Амилоидоз представляет собой прогрессирующее неизлечимое метаболическое заболевание неизвестной причины, характеризуемое ненормальными отложениями белка в одном или более чем одном органе или системе организма. Амилоидные белки производятся, например, неправильно функционирующим костным мозгом. Амилоидоз, который имеет место, когда накапливающиеся амилоидные отложения ухудшают нормальную функцию организма, может вызвать недостаточность органа или смерть. Он представляет собой редкое заболевание, встречающееся примерно у восьми из каждых 1000000 людей. Оно в равной степени поражает мужчин и женщин и обычно развивается в возрасте старше 40 лет. Идентифицировали по меньшей мере 15 типов амилоидоза. Эти типы ассоциированы с отложением разных видов белка. Главными формами амилоидоза являются первичный системный, вторичный и семейный или наследственный амилоидоз. Также существует другая форма амилоидоза, которая ассоциирована с болезнью Альцгеймера. Первичный системный амилоидоз обычно развивается в возрасте от 50 до 60 лет. Первичный системный амилоидоз, примерно 2000 новых случаев которого диагностируется ежегодно, является наиболее распространенной формой этого заболевания в Соединенных Штатах. Также известный как амилоидоз, связанный с легкими цепями, он также может сочетаться с множественной миеломой (рак костного мозга). Вторичный амилоидоз является результатом хронической инфекции или воспалительного заболевания. Он часто ассоциирован с семейной средиземноморской лихорадкой (бактериальная инфекция, характеризующаяся ознобом, слабостью, головной болью и рецидивирующей лихорадкой), гранулематозным илеитом (воспаление тонкого кишечника), болезнью Ходжкина, лепрой, остеомиелитом и ревматоидным артритом. Семейный или наследственный амилоидоз является единственной наследуемой формой данного заболевания. Он встречается у членов большинства этнических групп, и каждая семья имеет отличную картину симптомов и вовлечения органов. Считается, что наследственный амилоидоз является аутосомным доминантным, что означает, что для развития данного заболевания необходима только одна копия дефектного гена. Ребенок родителя с семейным амилоидозом имеет 50%-ный риск развития данного заболевания. Амилоидоз может вовлекать любой орган или систему в организме. Чаще всего поражаются сердце,почки, желудочно-кишечная система и нервная система. Другие обычные места амилоидных скоплений включают мозг, суставы, печень, селезенку, поджелудочную железу, дыхательную систему и кожу. Болезнь Альцгеймера (БА) является наиболее распространенной формой деменции, неврологического заболевания, характеризующегося потерей умственных способностей, достаточно тяжелого для того, чтобы препятствовать осуществлению нормальной активности в повседневной жизни, длящегося по меньшей мере шесть месяцев и не присутствующего с момента рождения. БА обычно встречается в пожилом возрасте и отмечается по снижению когнитивных функций, таких как запоминание, осмысление и планирование. От двух до четырех миллионов американцев страдают БА; ожидается, что это число возрастет до 14 миллионов к середине 21 столетия для населения всех возрастов. Данное заболевание развивается только у небольшого числа людей в возрасте 40 или 50 лет, БА преимущественно поражает пожилых людей. БА поражает примерно 3% всех людей в возрасте от 65 до 74 лет, примерно 20% людей в возрасте от 75 до 84 лет и примерно 50% людей в возрасте более 85 лет. Накопление амилоидного A-пептида в мозге является патологическим признаком всех форм БА. В общем, принято считать, что отложение мозгового амилоидного A-пептида является первичным влиянием, управляющим патогенезом БА (Hardy J. and Selkoe D.J., Science. 297: 353-356, 2002). Методики визуализации, такие как позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ), эффективны в мониторинге накопления амилоидных отложений в мозге и являются полезными методиками для измерения корреляции с развитием БА (см.,например, Miller, Science, 313, 1376). Для применения этих методик требуются радиолиганды, которые легко поступают в мозг и селективно связываются с амилоидными отложениями in vivo. Существует потребность в амилоидсвязывающих соединениях, которые могут пересекать гематоэнцефалический барьер и, следовательно, могут использоваться в диагностике. Кроме того, важно отслеживать эффективность лечения, которое осуществляют у пациентов с БА, путем измерения эффекта указанного лечения посредством измерения изменений уровней бляшек при БА. Особенно интересные свойства детектируемого амилоидсвязывающего соединения, помимо высокой аффинности к амилоидным отложениям in vivo и значительного и быстрого поступления в мозг,включают слабое неспецифичное связывание с нормальной тканью и быстрый клиренс из нее. Эти свойства обычно зависят от липофильности данного соединения (Coimbra et al. Curr. Top. Med. Chem., 2006,6, 629). Среди предложенных небольших молекул для визуализации амилоидных бляшек были синтезированы некоторые незаряженные аналоги тиофлавина Т (Mathis et al. J. Med. Chem., 2003, 46, 2740). О различных изостерических гетероциклах сообщали как о потенциальных амилоидсвязывающих лигандах(Cai et al. J. Med. Chem., 2004, 47, 2208; Kung et al. J. Med. Chem., 2003, 46, 237). Ранее были описаны производные бензофурана для применения в качестве агентов визуализации амилоида (Ono et al. J. Med.Pharmacal Research, 2004, 27(1), 19; Twyman et al. Bioorg. Med. Chem. Lett., 2001, 11(2), 255; WO 9517095). В одном воплощении настоящего изобретения предложен трет-бутиловый эфир [6-(5 этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соли. В другом воплощении данная соль представляет собой фармацевтически приемлемую соль. В дополнительном воплощении настоящего изобретения предложено соединение, представляющее собой трет-бутиловый эфир [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль. В другом воплощении данная соль представляет собой фармацевтически приемлемую соль. Химические структуры этих соединений следующие: Соединение I относится к трет-бутиловому эфиру [6-(5-этоксиметоксибензофуран-2-ил)-2 нитропиридин-3-ил]метилкарбаминовой кислоты, а соединение II относится к трет-бутиловому эфиру [5(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты. Можно ожидать, что соединение является химически более стабильным в кристаллическом состоянии по сравнению с тем же самым соединением в аморфном состоянии, как описано в Haleblian andMcCrone J. Pharm. Sci, 1969, 58, p. 911-929, особенно р. 913. Это наблюдение является обычным для небольших молекул (т.е. не являющихся белками), но не всегда является верным для макромолекул, подобных белкам, как описано в Pikal and Rigsbee, Pharm. Res., 1997, 14, p. 1379-1387, особенно р. 1379. Кристаллическое состояние, таким образом, является полезным для небольших молекул, таких как третбутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты и трет-бутиловый эфир (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты соответственно. Рентгеновские лучи будут рассеиваться электронами в атомах в соединении. Кристаллическое вещество будет преломлять рентгеновские лучи, давая пики в направлениях конструктивной интерференции. Данные направления определяются кристаллической структурой, включая размер и форму элементарной ячейки. Все раскрытые и/или заявленные здесь значения 2 тета пиков дифракции относятся к CuKизлучению. Аморфное (некристаллическое вещество) не будет давать таких пиков дифракции; см., например, Klug, Н.Р.Alexander, L.E., X-Ray Diffraction Procedures For Polycrystalline and Amorphous Materials, 1974, John WileySons. Способность соединения бесконтрольно комковаться или слеживаться будет возрастать при нагревании данного соединения до значений, близких к его температуре плавления. Крупные куски и комки будут иметь другие свойства текучести и растворимости по сравнению с порошком. Механическая обработка порошка, например, во время уменьшения размера частиц будет сообщать данному веществу энергию и, таким образом, давать возможность увеличения температуры. Хранение соединения, а также транспортировка соединения также могут непреднамеренно приводить к повышенной температуре. Плавление представляет собой эндотермическое событие. Эндотермические события можно измерять, например, дифференциальной сканирующей калориметрией. Таким образом, для трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин 3-ил]метилкарбаминовой кислоты или его соли и трет-бутилового эфира[5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соли соответственно полезно иметь такие эндотермические события при более высокой температуре, чем наивысшая температура, ожидаемая на протяжении нормального применения, для предотвращения формирования указанными соединениями нежелательных больших кусков или комков. В другом воплощении настоящего изобретения предложен трет-бутиловый эфир [6-(5-2 019093 этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соль и третбутиловый эфир [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль в кристаллической форме. В другом воплощении настоящего изобретения предложен трет-бутиловый эфир [6-(5 этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соль и третбутиловый эфир [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль в кристаллической форме, дающей отчетливые пики дифракции рентгеновских лучей и имеющей по меньшей мере одно эндотермическое событие с началом между 70 и 300 С. В другом воплощении настоящего изобретения предложено соединение трет-бутиловый эфир [6-(5 этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соль в кристаллической форме, имеющей картину дифракции рентгеновских лучей по меньшей мере с одним характерным пиком дифракции при примерно 2 тета = 13,51. В другом воплощении настоящего изобретения предложено соединение трет-бутиловый эфир [6-(5 этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соль в кристаллической форме, имеющей следующие пики дифракции: 11,27; 12,00; 13,51; 15,53; 16,82; 17,91 и 23,72 2 тета. В дополнительном воплощении указанная кристаллическая форма имеет следующие пики дифракции: 6,97; 9,24; 11,27; 12,00; 13,51; 15,53; 16,82; 17,91 и 23,72 2 тета. В другом воплощении настоящего изобретения предложено соединение трет-бутиловый эфир [5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль в кристаллической форме, имеющей картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характерным пиком дифракции при примерно 2 тета = 6,18. В другом воплощении настоящего изобретения предложено соединение трет-бутиловый эфир [5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль в кристаллической форме, имеющей следующие пики дифракции: 6,18; 9,14; 11,67; 14,98 и 16,44 2 тета. В дополнительном воплощении указанная кристаллическая форма имеет следующие пики дифракции: 6,18; 9,14; 11,67; 12,32; 14,65; 14,98; 16,44; 17,52 и 20,66 2 тета. В другом воплощении настоящего изобретения предложено применение трет-бутилового эфира [6(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соли и трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соли в качестве синтетического предшественника для получения целевого соединения,полезного для визуализации амилоидных отложений у млекопитающих, таких как живые пациенты. В одном воплощении трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3 ил]метилкарбаминовой кислоты или его соль или трет-бутиловый эфир [5-(5-этоксиметоксибензофуран 2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль находятся в кристаллической форме. В дополнительном воплощении указанные соединения имеют описанную выше картину дифракции. В другом воплощении настоящего изобретения предложено применение трет-бутилового эфира [6(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соли или трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соли в качестве синтетического предшественника в способе получения меченого соединения. В дополнительном воплощении данная метка представляет собой атом 18F. В одном воплощении трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соль или трет-бутиловый эфир [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2 ил]метилкарбаминовой кислоты или его соль находятся в кристаллической форме. В дополнительном воплощении указанные соединения имеют описанную выше картину дифракции. Соединения трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3 ил]метилкарбаминовой кислоты или его соль и трет-бутиловый эфир [5-(5-этоксиметоксибензофуран-2 ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль являются полезными при получении В одном воплощении трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин 3-ил]метилкарбаминовой кислоты или его соль или трет-бутиловый эфир[5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль находятся в кристаллической форме. В дополнительном воплощении указанные соединения имеют описан-3 019093 ную выше картину дифракции. В другом воплощении настоящего изобретения предложено применение трет-бутилового эфира [6(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты или его соли или трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соли в получении соединений 2-(6-[18F]-фтор-5-метиламинопиридин-2-ил)бензофуран-5 ол и 2-(2-[18F]-фтор-6-метиламинопиридин-3-ил)бензофуран-5-ол. В одном воплощении трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин 3-ил]метилкарбаминовой кислоты или его соль или трет-бутиловый эфир[5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты или его соль находятся в кристаллической форме. В дополнительном воплощении указанные соединения имеют описанную выше картину дифракции. В другом воплощении соли трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2 нитропиридин-3-ил]метилкарбаминовой кислоты и трет-бутилового эфира[5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты являются фармацевтически приемлемыми солями. В одном воплощении указанную детекцию проводят методом, выбранным из гамма-визуализации,позитронно-эмиссионной томографии (ПЭТ), магнитно-резонансной визуализации и магнитнорезонансной спектроскопии. Краткое описание графических материалов На фиг. 1 представлена картина дифракции рентгеновских лучей на порошке для трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты. На вертикальной оси указана интенсивность (число импульсов), а на горизонтальной оси указано положение(2 тета для CuK-излучения). На фиг. 2 представлена картина дифракции рентгеновских лучей на порошке для трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты в другом масштабе по горизонтальной оси по сравнению с фиг. 1. На вертикальной оси указана интенсивность(число импульсов), а на горизонтальной оси указано положение (2 тета для CuK-излучения). На фиг. 3 представлена картина дифракции рентгеновских лучей на порошке для трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты. На вертикальной оси указана интенсивность (число импульсов), а на горизонтальной оси указано положение(2 тета для CuK-излучения). На фиг. 4 представлена картина дифракции рентгеновских лучей на порошке для трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты в другом масштабе по горизонтальной оси по сравнению с фиг. 1. На вертикальной оси указана интенсивность(число импульсов), а на горизонтальной оси указано положение (2 тета для CuK-излучения). На фиг. 5 представлены картины дифракции рентгеновских лучей на порошке для трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты (А); трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты (Б); сульфата натрия (В) и хлорида натрия (Г). На вертикальной оси указана интенсивность(число импульсов), а на горизонтальной оси указано положение (2 тета для CuK-излучения). Одно воплощение относится к соединению трет-бутиловый эфир [6-(5-этоксиметоксибензофуран-2 ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты, как описано на фиг. 1. Другое воплощение относится к соединению трет-бутиловый эфир [5-(5-этоксиметоксибензофуран 2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты, как описано на фиг. 3. Термин "фармацевтически приемлемый" в том виде, как он здесь используется, используется в отношении тех соединений и/или веществ, композиций и/или лекарственных форм, которые в пределах объема обоснованной медицинской оценки являются подходящими для применения в контакте с тканями млекопитающих без избыточной токсичности, раздражения, аллергического ответа или другой проблемы или осложнения и соответствуют допустимому отношению польза/риск. Термин "свободное основание или фармацевтически приемлемая соль" в том виде, как он здесь используется, относится к ансольватам, включая ангидраты и десольватированные сольваты, и к сольватам,включая гидраты. Термин "фармацевтически приемлемые соли" в том виде, как он здесь используется,относится к производным раскрытых соединений, где родительское соединение модифицировано путем получения солей кислоты или основания, или их сокристаллов. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, соли основных остатков, таких как амины, с минеральной или органической кислотой; соли щелочей или органические соли кислотных остатков, таких как остатки карбоновых кислот, и т.п. Данные фармацевтически приемлемые соли включают традиционные нетоксичные соли или четвертичные аммониевые соли родительского соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие традиционные нетоксичные соли включают соли, происходящие из неорганических кислот, таких как соляная, фосфорная и т.п.; и соли, полученные из органических кислот, таких как молочная, малеиновая, лимонная, бензойная, ме-4 019093 тансульфоновая и т.п. Фармацевтически приемлемые соли соединений по настоящему изобретению можно синтезировать из родительского соединения, которое содержит основную или кислотную группировку, традиционными химическими способами. В общем, такие соли можно получить посредством взаимодействия форм этих соединений в виде свободных кислот или оснований со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе либо в их смеси; как правило, используются неводные среды, такие как диэтиловый эфир, этилацетат, этанол, изопропанол или ацетонитрил."Изотопно меченное", "радиоактивно меченное", "меченое", "детектируемое" или "детектируемое связывающее амилоид" соединение или агент либо "радиолиганд" представляет собой соединение, где один или более чем один атом заменен или замещен атомом, имеющим атомную массу или массовое число, отличные от атомной массы или массового числа, типично обнаруживаемых в природе (т.е. встречающихся в природе). Одним неограничивающим исключением является 19F, который обеспечивает детекцию молекулы, которая содержит этот элемент, без обогащения до степени, более высокой, чем та,что встречается в природе. Соединения, несущие заместитель 19F, таким образом, также могут именоваться "мечеными". Подходящие радионуклиды (т.е. "детектируемые изотопы"), которые можно включать в соединения по настоящему изобретению, включают, без ограничения ими, 2 Н (также пишется какBr, 76Br, 77Br, 123I, 124I, 125I и 131I. Следует понимать, что изотопно меченное соединение должно быть лишь обогащено детектируемым изотопом до или свыше уровня, который обеспечивает детекцию методом, подходящим для конкретного применения, например, в детектируемом соединении, меченном 11 С,атом углерода меченой группы данного меченого соединения может быть представлен 12 С или другими изотопами углерода в части молекул. Радионуклид, который включен в данные радиоактивно меченные соединения, будет зависеть от конкретного применения этого радиоактивно меченного соединения. Например, для мечения бляшек или рецепторов in vitro и в конкурентных анализах самыми полезными обычно будут соединения, которые включают 3 Н, 14 С или 125I. Для применений с визуализацией in vivo самыми полезными обычно будут 11 С, 13 С, 18F, 19F, 120I, 123I, 131I, 75Br или 76Br. Примеры "эффективного количества" включают количества, которые обеспечивают визуализацию амилоидного(ых) отложения(ний) in vivo при уровнях биодоступности для фармацевтического применения или применения для визуализации и/или для предупреждения дегенерации клеток и токсичности,связанных с образованием волокон. Соединения по настоящему изобретению можно использовать в качестве предшественника для радиолиганда или в качестве радиолиганда для определения присутствия, локализации и/или количества одного или более чем одного амилоидного отложения(ий) в органе или в части организма, включая мозг,животного или человека. Амилоидное(ые) отложение(я) включает(ют), без ограничения, отложение(ия)A (амилоид бета). При обеспечении отслеживания временной последовательности отложения амилоидов соединения по изобретению в качестве предшественника радиолиганда или в качестве радиолиганда можно дополнительно использовать для коррелирования отложения амилоида с началом клинических симптомов, ассоциированных с заболеванием, расстройством или состоянием. Соединения по данному изобретению в конечном счете можно использовать для лечения и для диагностики заболевания, расстройства или состояния, характеризующегося отложением амилоида, такого как БА, семейная БА, синдром Дауна, амилоидоз и гомозиготность по аллелю аполипопротеина Е 4. Соединения по данному изобретению в качестве предшественника радиолиганда или в качестве радиолиганда, таким образом, можно использовать в способе in vivo для измерения амилоидных отложений у млекопитающего, включающем стадии (а) введения детектируемого количества фармацевтической композиции, как изложено в абзаце, приведенном выше, и (б) детектирования связывания данного соединения с амилоидным отложением у данного субъекта. Данный способ определяет присутствие и локализацию амилоидных отложений в органе или в части организма, предпочтительно в мозге пациента. Настоящий способ включает введение пациенту детектируемого количества фармацевтической композиции, содержащей амилоидсвязывающее соединение по настоящему изобретению, именуемое "детектируемое соединение", или его водорастворимую фармацевтически приемлемую соль."Детектируемое количество" означает, что количество детектируемого соединения, которое вводят,является достаточным для осуществления детекции связывания данного соединения с амилоидом. "Количество, эффективное для визуализации" означает, что количество детектируемого соединения, которое вводят, является достаточным для осуществления визуализации связывания данного соединения с амилоидом. В данном изобретении используются амилоидные зонды, которые в сочетании с неинвазивными методиками нейровизуализации, такими как магнитно-резонансная спектроскопия (МРС) или визуализация (MINI), или гамма-визуализация, такая как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), используются для количественного измерения отложения амилоидов in vivo. Термин "визуализация in vivo" или "визуализация" относится к любому способу, который обеспечивает детекцию производных бензофурана или бензотиофена, замещенных меченым гетероарилом. Для гамма-визуализации измеряют радиацию, испускаемую из исследуемого органа или участка, и выражают либо как общее связывание, либо как отношение, в котором общее связывание в одной ткани нормализуют (например, путем деления) к общему связыванию в другой ткани того же самого субъекта во время той же самой процедуры визуализации in vivo. Общее связывание in vivo определяется как весь сигнал,детектированный в ткани посредством методики визуализации in vivo, без необходимости коррекции посредством второй инъекции идентичного количества меченого соединения наряду с большим избытком немеченого, но в других отношениях химически идентичного соединения. "Субъект" представляет собой млекопитающее, предпочтительно человека и наиболее предпочтительно человека, у которого подозревают наличие деменции. Для целей визуализации in vivo тип доступного детектирующего прибора является главным фактором при выборе данной метки. Например, радиоактивные изотопы и 19F являются особенно подходящими для визуализации in vivo. Тип используемого прибора будет определять выбор радионуклида или стабильного изотопа. Например, выбранный радионуклид должен иметь тип распада, детектируемый данным типом прибора. Другой фактор относится к периоду полураспада радионуклида. Данный период полураспада должен быть достаточно длительным для того, чтобы он все еще определялся во время его максимального захвата мишенью, но достаточно коротким для того, чтобы у хозяина не сохранялась вредная радиация. Радиоактивно меченые соединения по данному изобретению можно детектировать с использованием гамма-визуализации, когда детектируется испускаемое гамма-излучение подходящей длины волны. Способы гамма-визуализации включают, но не ограничиваются ими, ОФЭКТ и ПЭТ. Предпочтительно для детекции ОФЭКТ выбранная радиоактивная метка не будет испускать частицы, но будет продуцировать большое количество фотонов в интервале 140-200 кэВ. Для детекции ПЭТ данная радиоактивная метка будет представлять собой позитрон-испускающий радионуклид, такой как 18F или 11C, который будет аннигилировать с образованием двух гамма-лучей,которые будут детектироваться камерой ПЭТ. В настоящем изобретении получают предшественники соединений/зондов, связывающих амилоид,и эти соединения/зонды являются полезными для визуализации in vivo и для количественного измерения амилоидных отложений. Эти соединения подлежат применению в сочетании с неинвазивными методиками нейровизуализации, такими как магнитно-резонансная спектроскопия (МРС) или визуализация(МРВ), позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ). Согласно данному изобретению производные бензофурана, замещенные 2 гетероарилом, могут быть меченными 19F или 13 С для МРС/МРВ посредством обычных методик органической химии, известных в данной области. Данные соединения также могут быть радиоактивно меченными, например, с помощью 18F, 11C, 75Br, 76Br или 120I для ПЭТ посредством методик, хорошо известных в данной области, таких как описанные Fowler, J. and Wolf, А. в "Positron Emission Tomography andAutoradiography" 391-450 (Raven Press, 1986). Данные соединения также могут быть радиоактивно меченными с помощью 123I и 131I для ОФЭКТ посредством любой из нескольких методик, известных в данной области; см., например, Kulkarni, Int. J. Rad. Appl.Inst. (Part B) 18: 647 (1991). Данные соединения также могут быть радиоактивно меченными с помощью известных металлических радиоактивных меток,таких как технеций-99m (99mTc). Соединение с металлической радиоактивной меткой можно использовать для детекции амилоидных отложений. Получение радиоактивно меченных производных Тс-99m хорошо известно в данной области; см., например, Zhuang et al. Nuclear MedicineBiology 26(2):217-24,(1999); Oya et al. Nuclear MedicineBiology 25(2): 135-40, (1998) и Horn et al. Nuclear MedicineBiology 24(6):485-98, (1997). Кроме того, данные соединения можно метить с помощью 3 Н, 14 С и 125I способами,хорошо известными специалисту в данной области, для детекции амилоидных бляшек in vitro и в пробах после смерти. Кроме того, флуоресцентные соединения можно использовать для детекции бляшек, присутствующих в пробах in vitro и post mortem, путем применения хорошо известных методик на основе детекции флуоресценции. Особенно полезные в магнитно-резонансной спектроскопии элементы включают 19F и 13 С. Подходящие радиоизотопы для целей этого изобретения включают бета-излучатели, гамма-излучатели, излучатели позитронов и излучатели рентгеновских лучей. Эти радиоизотопы включают 120I, 123I, 131I, 125I, 18F,11C, 75Br и 76Br. Подходящие стабильные изотопы для применения в магнитно-резонансной томографии(МРТ) или спектроскопии (МРС) согласно данному изобретению включают 19F и 13 С. Подходящие радиоизотопы для количественного измерения амилоида в гомогенатах биопсии in vitro или в ткани после смерти включают 125I, 14 С и 3 Н. 11 С и 18F являются предпочтительными радиоактивными метками для применения в ПЭТ визуализации in vivo, 123I - для применения в визуализации ОФЭКТ, 19F - для МРС/МРВ, а 3 Н и 14 С - для исследований in vitro. Однако согласно данному изобретению можно использовать любой традиционный способ визуализации диагностических зондов. Радиоактивно меченные конечные соединения, полученные из соединений по настоящему изобретению, можно вводить любыми способами, известными обычному специалисту в данной области. Например, введение животному может быть местным или системным и может осуществляться перорально,парентерально, спреем для ингаляции, местно, ректально, путем ингаляции, в нос, трансбуккально, ваги-6 019093 нально или через имплантированный резервуар. Термин "парентеральный" в том виде, как он здесь используется, включает методики подкожной, внутривенной, внутриартериальной, внутримышечной, интраперитонеальной, интратекальной, внутрижелудочковой, интрастернальной, внутричерепной и внутрикостной инъекции и инфузии. Уровни доз могут варьировать от примерно 0,001 мкг/кг/сутки до примерно 10000 мг/кг/сутки. В одном воплощении уровень дозы составляет от примерно 0,001 мкг/кг/сутки до примерно 10 г/кг/сутки. В другом воплощении уровень дозы составляет от примерно 0,01 мкг/кг/сутки до примерно 1,0 г/кг/сутки. В еще одном другом воплощении уровень дозы составляет от примерно 0,1 до примерно 100 мг/кг/сутки. Точный протокол введения и уровни доз будут варьировать в зависимости от разных факторов,включая возраст, массу тела, общее состояние здоровья, пол и диету пациента; определение конкретных методик введения представляет собой рутинную процедуру для любого обычного специалиста в данной области. Данная схема может включать предварительную обработку и/или совместное введение с дополнительными соединениями, такими как, например, терапевтический(ие) агент(ты). Способ получения соединений по данному изобретению Схема 1. Синтез 5-этоксиметокибензофуран-2-бороновой кислоты (4) Одно воплощение данного изобретения относится к способу получения 5-этоксиметокибензофуран 2-бороновой кислоты, который включает превращение соединения 1 в соединение 2 с использованием реагента для снятия защиты в растворителе; превращение соединения 2 в соединение 3 с использованием основания и реагента для введения защиты в растворителе; превращение соединения 3 в 5-этоксиметокибензофуран-2-бороновую кислоту посредством способа, включающего депротонирование соединения 3 с помощью основания и смешивание депротонированного продукта с триалкилборатом в растворителе, где соединение 1 соответствует Конечный продукт разных реакционных стадий может, при необходимости, быть дополнительно очищен или перекристаллизован. Подходящие растворители для стадии (а) представляют собой, без ограничения, например, хлорированные растворители, такие как дихлорметан, ароматический растворитель, такой как толуол, амиды,такие как диметилформамид и N-метилпирролидон, и алканы, такие как гексан и гептан, или их смеси. Подходящие растворители для стадии (б) представляют собой, без ограничения, например, хлорированные растворители, такие как дихлорметан, ароматические растворители, такие как толуол, амиды,такие как диметилформамид и N-метилпирролидон, простые эфиры, такие как тетрагидрофуран, 2 метилтетрагидрофуран, трет-бутилметиловый эфир, циклопентилметиловый эфир и диэтиловый эфир, и алканы, такие как гексан или гептан, или их смеси. Подходящие растворители для стадии (в) представляют собой, без ограничения, например, ароматические растворители, такие как толуол и ксилол, простые эфиры, такие как тетрагидрофуран, 2 метилтетрагидрофуран, трет-бутилметиловый эфир, циклопентилметиловый эфир и диэтиловый эфир, и алканы, такие как гексан или гептан, или их смеси. В одном воплощении растворитель, используемый на стадии (а), представляет собой дихлорметан,толуол или N-метилпирролидон. В другом воплощении растворитель, используемый на стадии (б), представляет собой циклопентилметиловый эфир, тетрагидрофуран или 2-метилтетрагидрофуран. В дополнительном воплощении растворитель, используемый на стадии (в), представляет собой гексан, тетрагидрофуран или 2-метилтетрагидрофуран. Общее количество растворителей, используемых на стадиях (а)-(в), может варьировать в диапазоне примерно 2-100 (об./мас.) исходного вещества, в частности в диапазоне 6-20 (об./мас.) исходного вещества. Подходящие реагенты для стадии (а) представляют собой, например, без ограничения ими, кислоты Льюиса, такие как BBr3 и BCl3, алкилтиоляты, такие как тиометилат натрия и тиооктилат натрия, и гидрохлорид пиридина. Подходящие реагенты для стадии (б) представляют собой, например, без ограничения ими, этоксиметоксигалогениды, такие как этоксиметоксибромид или этоксиметоксихлорид, и гидриды металлов,такие как гидрид натрия или гидрид лития. Подходящие реагенты для стадии (в) представляют собой, например, без ограничения ими, алкиллитиевые реагенты, такие как метиллитий, бутиллитий и гексиллитий, и триалкилбораты, такие как триметилборат, трипропилборат, триизопропилборат и трибутилборат. В одном воплощении реагентами, используемыми на стадии (а), являются BBr3 или гидрохлорид пиридина. В другом воплощении реагентами, используемыми на стадии (б), являются этоксиметоксихлорид с гидридом натрия или гидридом лития. В дополнительном воплощении реагентами, используемыми на стадии (в), являются бутиллитий и триизопропилборат. В одном воплощении реагент на стадии (а) представляет собой трибромид бора. В другом воплощении реагент на стадии (а) представляет собой гидрохлорид пиридина. В другом воплощении реагенты на стадии (б) представляют собой гидрид натрия в смеси с хлорметилэтиловым эфиром. В другом воплощении реагенты на стадии (б) представляют собой гидрид лития в смеси с хлорметилэтиловым эфиром. В другом воплощении реагенты на стадии (в) представляют собой н-бутиллитий в смеси с триизопропилборатом. Другое воплощение относится к способу, описанному выше на схеме 1, где данный способ включает превращение соединения 1 в соединение 2 с использованием BBr3 в дихлорметане; превращение соединения 2 в соединение 3 с использованием NaH и CH3CH2OCH2Cl в диметилформамиде; превращение соединения 3 в 5-этоксиметоксибензофуран-2-бороновую кислоту посредством способа, включающего депротонирование соединения 3 с использованием н-бутиллития и смешивание данного депротонированного продукта с триизопропилборатом в тетрагидрофуране. Температура для стадий (а)-(в) может находиться в интервале от примерно -78 до 250 С, в частности в интервале от примерно -25 до 200 С. Схема 2. Синтез трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3 ил]метилкарбаминовой кислоты (8) Одно воплощение данного изобретения относится к способу получения трет-бутилового эфира [6(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты, включающему превращение соединения 5 в соединение 6 способом, включающим введение защиты аминогруппы в соединении 5 с использованием защитной группы в присутствии основания; превращение соединения 6 в соединение 7 способом, включающим алкилирование соединения 6 с использованием алкилирующего агента в присутствии основания; осуществление взаимодействия соединения 7 и соединения 4 в присутствии палладиевого катализатора и основания в растворителе, где соединение 4 соответствует При необходимости конечный продукт разных реакционных стадий может быть дополнительно очищен или перекристаллизован. Подходящие растворители представляют собой, например, без ограничения, на стадии (г) THF (тетрагидрофуран) или диэтиловый эфир, на стадии (д) DMF (диметилформамид) или THF, на стадии (е) этанол или DMF, или их смеси. В одном воплощении растворитель на стадии (г) представляет собой THF. В другом воплощении растворитель на стадии (д) представляет собой DMF. В дополнительном воплощении растворитель на стадии (е) представляет собой этанол. Подходящие основания представляют собой, например, без ограничения, на стадии (г) NaHMDS,KHMDS или NaH, на стадии (д) NaH, NaHMDS; на стадии е) Et3-N или K2CO3. В другом воплощении основание на стадии (г) представляет собой NaHMDS. В одном воплощении основание на стадии (д) представляет собой NaH. В дополнительном воплощении основание на стадии (е) представляет собой Et3-N. Подходящие катализаторы для стадии (е) представляют собой, например, без ограничения,Pd(PPh3)2Cl2 или Pd(dppf)Cl2. Другое воплощение относится к способу, описанному выше на схеме 2, включающему превращение соединения 5 в соединение 6 способом, включающим введение защиты аминогруппы в соединении 5 с использованием трет-бутилдикарбоната в присутствии гексаметилдисилазида натрия; превращение соединения 6 в соединение 7 способом, включающим алкилирование соединения 6 с использованием CH3I в присутствии NaH; осуществление взаимодействия соединения 7 и соединения 4 в присутствии дихлор-бис(трифенилфосфин)палладия(II) и (CH3CH2)3N в этаноле. Температуры реакции для стадий (г)-(е) составляют от -80 С до комнатной температуры. Схема 3. Синтез трет-бутилового эфира (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты Одно воплощение данного изобретения относится к способу получения трет-бутилового эфира (5 бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты, включающему превращение соединения 9 в соединение 10 способом, включающим бромирование соединения 9 в растворителе с использованием бромирующего реагента; превращение соединения 10 в соединение 11 способом, включающим объединение соединения 10 и соединения 11 в растворителе в присутствии основания с последующим добавлением третбутилдикарбоната; превращение соединения 11 в трет-бутиловый эфир(5-бром-6-нитропиридин-2 ил)метилкарбаминовой кислоты способом, включающим алкилирование соединения 11 в растворителе с использованием алкилирующего агента в присутствии основания, где соединение 9 соответствует При необходимости, конечный продукт разных реакционных стадий может быть дополнительно очищен или перекристаллизован. Подходящие растворители для стадий (ж)-(и) представляют собой, например, без ограничения, нитрилы, такие как ацетонитрил и пропионитрил, хлорированные растворители, такие как дихлорметан,ароматические растворители, такие как толуол и ксилол, простые эфиры, такие как тетрагидрофуран, 2 метилтетрагидрофуран, трет-бутилметиловый эфир, циклопентилметиловый эфир и диэтиловый эфир,амиды, такие как диметилформамид и N-метилпирролидон, и алканы, такие как гексан и гептан, или их смеси. В одном воплощении растворитель, используемый на стадии (ж), представляет собой воду, ацетонитрил (MeCN), толуол, тетрагидрофуран или их смеси. В другом воплощении растворитель, используемый на стадии (з), представляет собой тетрагидрофуран, гептан, 2-метилтетрагидрофуран или их смеси. В дополнительном воплощении растворитель, используемый на стадии (и), представляет собой воду, гексан, ацетонитрил, диметилформамид, тетрагидрофуран, 2-метилтетрагидрофуран или их смеси. В одном воплощении растворитель на стадии (ж) представляет собой MeCN, смешанный с водой. В другом воплощении растворитель на стадии (з) представляет собой THF, смешанный с гептаном. В другом воплощении растворитель на стадии (з) представляет собой THF, смешанный с гексаном. В дополнительном воплощении растворитель на стадии (и) представляет собой DMF, смешанный с водой. В другом воплощении растворитель на стадии (и) представляет собой THF, смешанный с гептаном. В дополнительном воплощении растворитель на стадии (и) представляет собой MeCN, смешанный с водой. Общее количество растворителей, используемых на стадиях (ж)-(и), может варьировать в интервале примерно от 2 до 100 (об./мас.) исходного вещества, в частности в интервале 6-20 (об./мас.) исходного вещества. Подходящие реагенты для стадии (ж) представляют собой, например, без ограничения, бромирующие реагенты, такие как N-бромсукцинимид. Подходящие реагенты для стадии (з) представляют собой, например, без ограничения, ди-третбутилдикарбонат и основание, такое как бис-(триметилсилил)амид натрия, гидрид натрия или гидрид лития. В одном воплощении реагенты, используемые на стадии (з), представляют собой ди-третбутилдикарбонат с гидридом натрия, гидридом лития или бис-(триметилсилил)амидом натрия. Подходящие реагенты для стадии (и) представляют собой, например, без ограничения, алкилирующие реагенты, такие как метилйодид и диметилсульфат, и основание, такое как гидрид натрия, гидрид лития, бис-(триметилсилил)амид натрия и 1,8-диазабицикло[5.4.0]ундец-7-ен. В другом воплощении реагент на стадии (ж) представляет собой N-бромсукцинимид. В одном воплощении основание на стадии (з) представляет собой NaHMDS и Вос 2 О. В дополнительном воплощении основание на стадии (и) представляет собой DBU. В дополнительном воплощении основание на стадии (и) представляет собой NaH. Другое воплощение относится к способу, описанному выше на схеме 3, включающему превращение соединения 9 в соединение 10 способом, включающим бромирование соединения 9 вCH3CN с использованием н-бромсукцинимида; превращение соединения 10 в соединение 11 способом, включающим объединение соединения 10 и соединения 11 в растворителе в присутствии гексаметилдисилазида натрия с последующим добавлением трет-бутилдикарбоната; превращение соединения 11 в трет-бутиловый эфир(5-бром-6-нитропиридин-2 ил)метилкарбаминовой кислоты способом, включающим алкилирование соединения 11 в диметилформамиде с использованием CH3I в присутствии NaH. Температура для стадий (ж)-(и) может находиться в интервале примерно от -78 до 150 С, в частности в интервале примерно от 0 до 50 С. Продукт со стадии (и), трет-бутиловый эфир (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12), может быть очищен осаждением из смеси DMF/вода или из смеси MeCN/вода. В одном воплощении трет-бутиловый эфир (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12) очищают из смеси MeCN/вода. Схема 4. Альтернативные пути получения трет-бутилового эфира (5-бром-6-нитропиридин-2 ил)метилкарбаминовой кислоты (12) трет-Бутиловый эфир (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12) может быть получен двумя альтернативными путями. Например, соединение 12 может быть получено из 6 нитропиридин-2-иламина (9) либо через N-метил-6-нитропиридин-2-амин (14), либо трет-бутилметил-(6 нитропиридин-2-ил)карбамат (16), где в обеих последовательностях бромирование вводят последним. Схема 4. Синтез трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2 ил]метилкарбаминовой кислоты (13) Одно воплощение данного изобретения относится к способу получения соединения 13 смешиванием соединения 12 и соединения 4 в подходящем растворителе с использованием подходящего основания в присутствии подходящего катализатора с последующей экстракцией. При необходимости, конечный продукт можно дополнительно очистить или перекристаллизовать. Подходящие растворители представляют собой, например, без ограничения, спирты, такие как метанол, этанол, пропанол, изопропанол и бутанол, простые эфиры, такие как диоксан, тетрагидрофуран и 2-метилтетрагидрофуран, и ароматические растворители, такие как бензол, толуол или ксилол, или их смеси. В одном воплощении растворитель на стадии (к) представляет собой этанол. Общее количество растворителей, используемых на стадии (к), может варьировать в интервале примерно от 2 до 100 (об./мас.) исходного вещества, в частности в интервале 6-20 (об./мас.) исходного вещества. Подходящие реагенты представляют собой, например, без ограничения, амины, такие как триэтиламин, карбонаты, такие как карбонат цезия, карбонат калия и карбонат натрия, фосфаты, такие как фосфат калия и фосфат натрия, или фторид калия, совместно с палладиевыми катализаторами. Также можно рассматривать целый ряд подходящих фосфиновых лигандов и имидазол-2-илиденовых лигандов. В другом воплощении реагенты на стадии (к) представляют собой триэтиламин и PdCl2(PPh3)2. Температура для стадии (к) может находиться в интервале примерно от 0 до 150 С, в частности в интервале примерно от 25 до 100 С. Схема 5. Альтернативный синтез трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6 нитропиридин-2-ил]метилкарбаминовой кислоты (13) путем прямого арилирования[5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2 ил]метилкарбаминовой кислоты (13) мог быть получен путем прямого арилирования 5 этоксиметоксибензофурана(5-бром-6-нитропиридин-2 ил)метилкарбаминовой кислоты (12) в присутствии подходящего катализатора. Подходящие растворители представляют собой, например, без ограничения, амиды, такие как диметилацетамид, ароматические растворители, такие как толуол и ксилол. Общее количество растворителей, используемых на стадиях (ж)-(и), может варьировать в интервале примерно от 2 до 100 (об./мас.) исходного вещества, в частности в интервале 6-20 (об./мас.) исходного вещества. Подходящие реагенты представляют собой, например, без ограничения, системы палладиевых катализаторов, такие как Pd(PPh3)4 с ацетатом калия или ацетат палладия с трициклогексилфосфином, пивалоиловый спирт и карбонат калия. Примеры соединений Ниже следует целый ряд неограничивающих примеров соединений-предшественников по данному изобретению. Общие способы. Все использованные растворители имеются в продаже и были использованы без дополнительной очистки. Реакции, как правило, проводили с использованием безводных растворителях в инертной атмосфере азота. Спектры 1 Н и 13 С ЯМР записывали при 400 МГц для протона и при 100 МГц для углерода-13 на ЯМР спектрометре Varian Mercury Plus 400, оснащенном зондом Varian 400 АТВ PFG. Все дейтерированные растворители содержали, как правило, от 0,03 до 0,05% об./об. тетраметилсилана, который использовали в качестве эталонного сигнала (установленного на 0,00 как для 1 Н, так и для 13 С). Масс-спектры записывали на масс-спектрометре Waters, состоящем из Alliance 2795 (ЖХ, жидкостный хроматограф) и детектора Waters Micromass ZQ, при 120 С. Данный масс-спектрометр был оснащен электрораспылительным источником ионов (ЭР), работающим в режиме положительных или отрицательных ионов. Данный масс-спектрометр сканировал между m/z от 100 до 1000 со временем сканирования 0,3 с. Анализы ВЭЖХ (высокоэффективная жидкостная хроматография) проводили на системе Water 600Controller с автоматическим пробоотборником Waters 717 Plus и детектором на фотодиодной матрицеWaters 2996. Использовали колонку АСЕ C18, 5 мкм, 4,60150 мм. В 20-минутном прогоне наносили линейный градиент, начинающийся с 95% А (А: 0,1% Н 3 РО 4 в воде) и заканчивающийся 90% С (С: MeCN) в течение 6 мин, выдерживая при 90% С в течение 4 мин и затем возвращаясь обратно к 95% А. Данная колонка находилась при температуре окружающей среды при скорости тока 1,0 мл/мин. Детектор на диодной матрице сканировал от 200 до 400 нм. Микроволновое нагревание проводили либо на СЕМ Discover LabMate, либо на Biotage Initiator System при указанной температуре в рекомендованных пробирках для микроволнового реактора. Тонкослойную хроматографию (ТСХ) проводили на Alugram (силикагель 60 F254) от ManchereyNagel и для визуализации пятен, как правило, использовали УФ (ультрафиолет). В некоторых случаях также применяли дополнительные способы визуализации. В этих случаях для визуализации соединения пластинку ТСХ проявляли йодом (полученным добавлением приблизительно 1 г I2 к 10 г силикагеля и тщательным перемешиванием), ванилином (полученным растворением примерно 1 г ванилина в 100 мл 10%-ной H2SO4), нингидрином (имеющимся в продаже у Aldrich) или Magic Stain (полученным тщательным перемешиванием 25 г (NH4)6 Мо 7 О 244 Н 2 О, 5 г (NH4)2Ce(IV)(NO3)6, 450 мл Н 2 О и 50 мл концентрированной H2SO4). Флэш-хроматографию проводили с использованием 40-63 мкм (230-400 меш) силикагеля от Silicycle, следуя методикам, аналогичным методикам, раскрытым в Still, W.C.; Kahn, M.; and Mitra, M.Journal of Organic Chemistry, 1978, 43, 2923-2925. Типичными растворителями, используемыми для флэш-хроматографии или тонкослойной хроматографии, были смеси дихлорметан/метанол, этилацетат/метанол и гексаны/этилацетат. Препаративную хроматографию проводили либо на системе Waters Prep LC 4000 с использованием диодной матрицы Waters 2487, либо на Waters LC Module 1 plus. Использовали либо колонку WatersXTerra Prep C18, 5 мкм, 30100 мм (скорость тока 40 мл/мин), либо колонку Phenomenex Luna C18, 5 мкм,21,6250 мм (скорость тока 20 мл/мин). Для элюирования соединения использовали узкие градиенты ацетонитрил/вода, где вода содержала либо 0,1%-ную трифторуксусную кислоту, либо 10 мМ ацетат аммония, с общим временем прогона от 20 до 30 мин. Картины дифракции рентгеновских лучей на порошке (ДРЛП) получали на тета-тета системе PANalytical X'Pert PRO MPD с использованием длинно-точно-фокусного CuK-излучения (40 кВ, 50 мА) и детектора X'Celerator. Использовали программируемую дивергентную щель и программируемую противорассеивающую щель, дающую облучаемую длину 20 мм. На пути падающего и на пути дифрагированного луча использовали щели Соллера 0,02 рад. На пути падающего луча использовали 20-мм фиксированную ширму и перед детектором размещали никелевый фильтр. Тонкие плоские образцы получали с использованием шпателя на плоских кремниевых пластинах с нулевым фоном. Данные пластины монтировали в держателях образцов и вращали во время измерения в горизонтальном положении. Картины дифракции регистрировали в интервале от 2 2 тета до 80 2 тета в режиме непрерывного сканирования. Общее время для сканирования составляло 25 мин 30 с. Специалисту в области дифракции рентгеновских лучей на порошке понятно, что на относительную интенсивность пиков могут влиять, например,зерна с размером, превышающим примерно 30 мкм, и неунитарные соотношения сторон, которые могут влиять на анализ образцов. Кроме того, следует понимать, что интенсивности могут флуктуировать в зависимости от экспериментальных условий и приготовления образцов, например от предпочтительной ориентации частиц в данном образце. Применение автоматических или фиксированных дивергентных щелей также будет влиять на расчеты относительной интенсивности. Специалист в данной области может управлять такими эффектами при сравнении картин дифракции. Специалисту также понятно, что на положение отражений может влиять точная высота, на которой находится образец в дифрактометре, температура и калибровка нуля дифрактометра. Плоскостность поверхности образца также может оказывать небольшой эффект. Точное значение положения отражения может слегка варьировать между образцами, например, благодаря различиям в кристалличности вещества. Применение автоматических программ по нахождению пиков или субъективное определение пиков вручную также могут слегка влиять на доложенное положение отражения. Для специалиста очевидно,что различия в эффективности прибора могут влиять на разрешение пиков. Следовательно, представленные данные по картине дифракции не следует принимать как абсолютные значения. Обычно ошибка измерения угла дифракции на дифрактограмме рентгеновских лучей на порошке составляет примерно 5% или менее, в частности, в пределах интервала от плюс 0,5 2 тета до минус 0,5 2 тета при использовании CuK-излучения, и такой уровень ошибки измерения следует принимать во внимание при рассмотрении картин дифракции рентгеновских лучей на порошке на фиг. 1-5 и при прочтении табл. 1 и 2. Специалисту также понятно, что следы любых кристаллических примесей, образующихся при получении вещества образца, например остатков солей, таких как сульфат натрия или хлорид натрия, в результате стадий сушки, высаливания и/или доведения рН, могут вызывать дифракцию, и что пики,имеющие углы дифракции около ожидаемых пиков от таких кристаллических примесей, могут полностью или частично происходить от таких кристаллических примесей. Картины дифракции от многих соединений могут быть симулированы, например, из таких баз данных, как базы данных Powder Diffraction File (PDF) от Международного центра данных по дифракции(ICDD). Специалист может сравнить такие симулированные картины дифракции с экспериментальными картинами. Дифференциальную сканирующую калориметрию (ДСК) от 30 до 300 С проводили в атмосфере азота в алюминиевых чашках для образцов с перфорированными крышками с использованием прибора для ДСК Perkin Elmer Diamond. Скорость сканирования составляла 10 С в 1 мин. Размер образца составлял менее 1 мг. Хорошо известно, что начало ДСК и температуры пиков, а также значения энергии могут варьировать, например, в зависимости от чистоты образца и размера образца, а также параметров прибора, особенно скорости сканирования температуры. Следовательно, представленные данные ДСК не следует принимать как абсолютные значения. Специалист в данной области может задать инструментальные параметры дифференциального сканирующего калориметра так, чтобы можно было получить данные, сравнимые с представленными здесь данными, согласно стандартным способам, например способам, описанным у Hhne, G.W.H. et al. (1996),Differential Scanning Calorimetry, Springer, Berlin. Термогравиметрический анализ (ТГА) от температуры окружающей среды до 250 С проводили в атмосфере азота в платиновой чашке для образцов с использованием термогравиметрического анализатора Perkin Elmer Pyris 1 TGA. Скорость сканирования составляла 10 С в 1 мин. Размер образца составлял менее 1 мг. Хорошо известно, что кривая ТГА может варьировать, например, в зависимости от размера образца, а также параметров прибора, особенно скорости сканирования температуры. Следовательно, представленные данные ТГА не следует принимать как абсолютные значения. Были использованы следующие сокращения: Использованные исходные вещества были либо доступными из коммерческих источников, либо были получены согласно литературным методикам и имели экспериментальные характеристики в соответствии с известными. Промежуточный пример 1. 5-Этоксиметоксибензофуран-2-бороновая кислота (4) а) Бензофуран-5-ол (2). К перемешиваемому раствору 5-метоксибензофурана (1) (0,50 г, 3,38 ммоль) в дихлорметане (15 мл) медленно добавляли трибромид бора (16,87 мл, 16,87 ммоль, 1 М раствор в дихлорметане) при 0 С. Данную реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь затем охлаждали до 0 С, гасили насыщенным водным раствором NaHCO3 и экстрагировали дихлорметаном (350 мл). Объединенные органические экстракты промывали рассолом (25 мл),сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения (2) в виде беловатого твердого вещества (300 мг), которое использовали на следующей стадии без дальнейшей очистки. 1 Н ЯМР (400 МГц, хлороформ-d) : 7.59 (d, J=1,95 Гц, 1 Н), 7.35 (d, J=8,59 Гц, 1 Н), 7.00 (d, J=2,73 Гц,1 Н), 6.80 (dd, 8,59, 2,74 Гц, 1 Н), 6.67 (m, 1H), 4.66 (s, 1H) б) 5-Этоксиметоксибензофуран (3). К перемешиваемому раствору бензофуран-5-ола (2) (257 мг, 1,92 ммоль) в DMF (3 мл) добавлялиNaH (81 мг, 1,92 ммоль, 57%-ная дисперсия в масле) при 0 С. Данную реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Затем добавляли по каплям хлорметилэтиловый эфир (214 мкл, 2,30 ммоль) до достижения 0 С и данную смесь перемешивали при комнатной температуре в течение еще 1 ч. Добавляли воду (10 мл) и данную реакционную смесь экстрагировали этилацетатом(250 мл). Органические экстракты промывали водой, рассолом, сушили над Na2SO4 и концентрировали в вакууме. Очистка неочищенного продукта колоночной флэш-хроматографией с использованием 10%ного этилацетата в гексане давала соединение (3) (273 мг) в виде бесцветного масла. 1 Н ЯМР (400 МГц, хлороформ-d) : 7.59 (d, J=1,95 Гц, 1 Н), 7.39 (d, J=8,16 Гц, 1 Н), 7.27 (d, J=2,73 Гц,1 Н), 6.99 (dd, J=8,98, 2,34 Гц, 1 Н), 6.70 (m, 1H), 5.24 (s, 2 Н), 3.77 (q, J=7,03 Гц, 2 Н), 1.25 (t, J=7,03 Гц, 3 Н). в) 5-Этоксиметоксибензофуран-2-бороновая кислота (4). К перемешиваемому раствору 5-этоксиметоксибензофурана (3) (265 мг, 1,38 ммоль) в THF (5 мл) добавляли по каплям н-бутиллитий (2,5 М раствор в гексане, 0,56 мл, 1,44 ммоль) при -78 С. После перемешивания данной реакционной смеси в течение 1 ч медленно добавляй триизопропилборат (0,635 мл,2,76 ммоль) и перемешивание продолжали в течение дополнительных 20 мин при -78 С. Данную реакционную смесь гасили насыщенным раствором хлорида аммония (10 мл) и давали ей нагреться до комнатной температуры. Добавляли воду (10 мл) и образующуюся в результате смесь экстрагировали в диэтиловый эфир (250 мл). Объединенные экстракты промывали рассолом, сушили над MgSO4 и концентрировали при пониженном давлении. Очистка неочищенного продукта путем перекристаллизации из этилацетата и гексана давала целевое соединение (4) (170 мг) в виде белого твердого вещества. 1 Н ЯМР (DMSO-d6, 400 МГц) : 8.54 (s, 2 Н), 7.48 (d, J=8,6 Гц, 1 Н), 7.39 (s, 1 Н), 7.30 (d, J=2,7 Гц,1 Н), 7.02 (dd, J=8,8, 2,5 Гц, 1 Н), 5.23 (s, 2 Н), 3.68 (q, J=7,0 Гц, 2 Н), 1.14 (t, J=7,0 Гц, 3 Н). Пример 1 конечного предшественника. Синтез трет-бутилового эфира(2,99 г, 36,46 ммоль) в уксусной кислоте (40 мл) добавляли по каплям раствор брома (2,5 мл, 48,79 ммоль) в уксусной кислоте (8 мл) и данную реакционную смесь перемешивали в течение ночи. Уксусную кислоту удаляли при пониженном давлении. Остаток охлаждали до 0 С, нейтрализовали насыщен- 14019093 ным раствором бикарбоната натрия с подведением рН до приблизительно 7 и экстрагировали этилацетатом (450 мл). Объединенные органические экстракты промывали рассолом, сушили над безводнымNa2SO4 и концентрировали при пониженном давлении. Остаток растирали с этилацетатом с получением соединения (5) (5,1 г) в виде желтого твердого вещества. 1 Н ЯМР (DMSO-d6, 400 МГц) : 7.66 (d, J=8,6 Гц, 1 Н), 7.58 (s, 2 Н), 7.49 (d, J=8,6 Гц, 1 Н). МС-ЭРИ (масс-спектрометрия с электрораспылительной ионизацией): m/z 216,33 [М-1]-. г) трет-Бутиловый эфир (6-бром-2-нитропиридин-3-ил)карбаминовой кислоты (6) К перемешиваемому раствору 6-бром-2-нитропиридин-3-иламина (5) (854 мг, 3,92 ммоль) в THF (50 мл) добавляли NaHMDS (5,09 мл, 5,09 ммоль, 1 М в THF) при 0 С. После перемешивания в течение 15 мин добавляли раствор ди-трет-бутилдикарбоната (853 мг, 3,91 ммоль) в THF (5 мл) в течение периода 30 мин. Данную реакционную смесь перемешивали в течение 3,5 ч при комнатной температуре и затем добавляли насыщенный водный NaHCO3. Данную реакционную смесь экстрагировали этилацетатом(350 мл). Объединенные экстракты промывали водой, рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной флэш-хроматографией с использованием 10%-ного этилацетата в гексане с получением соединения (6) (293 мг) в виде беловатого твердого вещества. 1 Н ЯМР (400 МГц, хлороформ-d) : 9.41 (br. s., 1 Н), 9.00 (d, J=8,6 Гц, 1 Н), 7.73 (d, J=9,0 Гц, 1 Н), 1,55 К перемешиваемому раствору трет-бутилового эфира (6-бром-2-нитропиридин-3-ил)карбаминовой кислоты (6) (290 мг, 0,91 ммоль) в DMF (10 мл) добавляли NaH (57 мг, 1,36 ммоль, 57%-ная дисперсия в масле) при 0 С. После перемешивания в течение 15 мин добавляли метилйодид (79 мкл, 1,27 ммоль) и данную реакционную смесь перемешивали в течение 1 ч. Затем данную реакционную смесь гасили насыщенным раствором хлорида аммония (15 мл) и экстрагировали этилацетатом (240 мл). Объединенные органические экстракты промывали водой, рассолом, сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией с использованием 20%-ного этилацетата в гексане с получением соединения (7) (268 мг) в виде бледно-желтого твердого вещества. 1 Н ЯМР (400 МГц, хлороформ-d) : 7.78 (d, J=8,2 Гц, 1 Н), 7.66 (d, J=8,2 Гц, 1 Н), 3.29 (s, 3 Н), 1.39 (br. К дегазированному раствору 5-этоксиметоксибензофуран-бороновой кислоты (4) (140 мг, 0,593 ммоль) в этаноле (10 мл) добавляли трет-бутиловый эфир (6-бром-2-нитропиридин-3 ил)метилкарбаминовой кислоты (7) (151 мг, 0,455 ммоль), Pd(PPh3)2Cl2 (42 мг, 0,059 ммоль) и Et3N (127 мкл, 0,909 ммоль). Данную реакционную смесь перемешивали при 100 С в течение 30 мин в микроволновом реакторе. Летучие вещества удаляли при пониженном давлении. Остаток разбавляли водой (15 мл) и данную смесь экстрагировали этилацетатом (350 мл). Объединенные органические экстракты промывали водой, рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной флэш-хроматографией с использованием 20%-ного этилацетата в гексане. Выпаривание растворителя давало указанное в заголовке соединение 8 (170 мг) в виде бледножелтого твердого вещества. 1 Н ЯМР (400 МГц, хлороформ-d) : 8.10 (d, J=8,20 Гц, 1 Н), 7.84 (d, J=8,20 Гц, 1 Н), 7.50 (s, 1 Н), 7.45(d, J=8,98 Гц, 1 Н), 7.32 (d, J=1,95 Гц, 1 Н), 7.02-7.16 (m, 1 Н), 5.27 (s, 2 Н), 3.78 (q, J=6,63 Гц, 2 Н), 3.32 (s,3 Н), 1.36 (br. s., 9 Н), 1.26 (t, J=7,22 Гц, 3H). МС-ЭРИ: m/z 444,51 [М+1]+. ДСК: эндотермическое событие с началом при 109,5 С и пиком при 110,8 С. Н 89,6 Дж-1. ТГА: нет заметных событий между комнатной температурой и 160 С. Таблица 1 Репрезентативные пики картины дифракции рентгеновских лучей на порошке для трет-бутилового эфира [6-(5-этоксиметоксибензофуран-2-ил)-2-нитропиридин-3 ил]метилкарбаминовой кислоты(5-бром-6-нитропиридин-2 ж) 5-Бром-6-нитропиридин-2-иламин (10). К перемешиваемому раствору 6-нитропиридин-2-иламина (1,0 г, 7,18 ммоль) в CH3CN (100 мл), защищенному от света и в атмосфере азота, добавляли N-бромсукцинамид (636 мг, 3,59 ммоль) при 0 С. Через 1 ч добавляли другую порцию N-бромсукцинамида (636 мг, 3,59 ммоль). Давали данной реакционной смеси нагреться до комнатной температуры и продолжали перемешивание в течение ночи. Данную реакционную смесь затем гасили добавлением насыщенного водного Na2S2O3 и экстрагировали этилацетатом (330 мл). Объединенные органические экстракты промывали водой, рассолом, сушили над MgSO4(безводный) и концентрировали в вакууме. Неочищенный продукт очищали с помощью Biotage с использованием 10% этилацетата в гексане с получением 1,2 г 5-бром-6-нитропиридин-2-иламина (10). 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 7.84 (d, J=8,98 Гц, 1 Н), 7.03 (s, 2 Н), 6.66 (d, J=8,98 Гц, 1 Н). з) трет-Бутиловый эфир (5-бром-6-нитропиридин-2-ил)карбаминовой кислоты (11). К раствору 5-бром-6-нитропиридин-2-иламина (900 мг, 4,12 ммоль) в сухом THF (40 мл) добавлялиNaHMDS (1 M в THF, 5,8 мл) при 0 С. После перемешивания в течение 15 мин медленно добавляли раствор Вос 2 О (901 мг, 4,12 ммоль) в THF (5 мл) при 0 С в течение 30 мин. Полученную смесь нагревали до комнатной температуры, перемешивали в течение 3 ч, гасили насыщенным водным NaHCO3 и экстрагировали этилацетатом (330 мл). Объединенные экстракты промывали водой и рассолом, сушили надNa2SO4 и концентрировали при пониженном давлении. Остаток очищали посредством Biotage с использованием 5-10% этилацетата в гексане с получением 786 мг трет-бутилового эфира (5-бром-6 нитропиридин-2-ил)карбаминовой кислоты (11). 1 Н ЯМР (400 МГц, хлороформ-d)м.д.: 8.14 (d, J=8,98 Гц, 1 Н), 8.03 (d, J=8,59 Гц, 1 Н), 7.52 (s, 1 Н),1.53 (s, 9 Н). и) трет-Бутиловый эфир (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12). К раствору трет-бутилового эфира (5-бром-6-нитропиридин-2-ил)карбаминовой кислоты (11) (800 мг, 2,52 ммоль) в сухом DMF (15 мл) добавляли NaH (60%-ная дисперсия в минеральном масле, 191 мг,4,53 ммоль) при 0 С. Полученную смесь перемешивали в течение 30 мин при 0 С и затем добавляли метилйодид (0,23 мл, 3,68 ммоль). После перемешивания данной реакционной смеси в течение 30 мин при 10 С добавляли насыщенный водный NH4Cl (15 мл). Данную реакционную смесь экстрагировали этилацетатом (330 мл). Объединенные экстракты промывали водой, рассолом, сушили над MgSO4 (безводным) и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством Bio- 16019093tage с использованием 10%-ного этилацетата в гексане с получением трет-бутилового эфира (5-бром-6 нитропиридин-2-ил)метилкарбаминовой кислоты (12) (789 мг). 1 Н ЯМР (400 МГц, хлороформ-d)м.д.: 8.12 (d, J=8,60 Гц, 1 Н), 7.95 (d, J=8,99 Гц, 1 Н), 3.40 (s, 3 Н),1.55 (s, 9 Н). Либо альтернативная методика для трет-бутилового эфира (5-бром-6-нитропиридин-2 ил)метилкарбаминовой кислоты (12) ж) 5-Бром-6-нитропиридин-2-иламин (10). К перемешиваемому раствору 6-нитропиридин-2-иламина (9) (5,1 г, 18,4 ммоль) в MeCN (125 мл) добавляли N-бромсукцинимид (3,43 г, 19,3 ммоль) в атмосфере азота при 0 С. Через 1 ч добавляли другую порцию N-бромсукцинимида (3,57 г, 20,1 ммоль). Данной реакционной смеси давали нагреться до комнатной температуры и продолжали перемешивание в течение ночи. Продукт осаждали добавлением воды (125 мл). Данную суспензию охлаждали до 0 С и осажденный продукт выделяли фильтрованием,промывали предварительно перемешанной смесью MeCN:вода (1:1) и сушили под вакуумом при 40 С с получением 3,8 г 5-бром-6-нитропиридин-2-иламина (2). 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 7.84 (d, J=8,98 Гц, 1 Н), 7.03 (s, 2 Н), 6.66 (d, J=8,98 Гц, 1 Н). з) трет-Бутиловый эфир (5-бром-6-нитропиридин-2-ил)карбаминовой кислоты (11). К раствору 5-бром-6-нитропиридин-2-иламина (10) (3,8 г, 18,4 ммоль) в сухом THF (40 мл) добавляли NaHMDS (1 M в THF, 45 мл, 45 ммоль) при 0 С. После перемешивания в течение 15 мин медленно добавляли раствор Вос 2 О (28,3 мас.%, в THF, 14,2 г, 18,4 ммоль) при 0 С в течение 1 ч. Полученную смесь гасили водным NaHSO4 (1 М, 110 мл, 110 ммоль) и нагревали до комнатной температуры. Водную фазу отбрасывали и продукт, содержащий органическую фазу, концентрировали при пониженном давлении. Остаток растворяли в THF (40 мл), примеси осаждали путем добавления гептана (160 мл) и удаляли фильтрованием. Отфильтрованный до прозрачности раствор, содержащий продукт, выпаривали досуха,получая 4,2 г трет-бутилового эфира (5-бром-6-нитропиридин-2-ил)карбаминовой кислоты (11) в виде темного красно-коричневого остатка, который использовали на следующей стадии без дальнейшей очистки. 1 Н ЯМР (400 МГц, хлороформ-d)м.д.: 8.14 (d, J=8,98 Гц, 1 Н), 8.03 (d, J=8,59 Гц, 1 Н), 7.52 (s, 1 Н),1.53 (s, 9 Н). и) трет-Бутиловый эфир (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12). К раствору трет-бутилового эфира (5-бром-6-нитропиридин-2-ил)карбаминовой кислоты (11) (4,2 г,13,2 ммоль) в сухом DMF (21 мл) добавляли DBU (5,02 г, 33,0 ммоль) при 0 С. Медленно добавляли метилйодид (3,75 г, 26,4 ммоль) при 0 С. После перемешивания в течение 3 ч при 0 С данную реакционную смесь гасили и продукт осаждали путем добавления водного NaHSO4 (1 M). Данный неочищенный продукт выделяли фильтрованием и очищали перекристаллизацией из смеси MeCN и воды с получением трет-бутилового эфира (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12) (1,55 г). 1 Н ЯМР (400 МГц, хлороформ-d)м.д.: 8.12 (d, J=8,60 Гц, 1 Н), 7.95 (d, J=8,99 Гц, 1 Н), 3.40 (s, 3 Н),1.55 (s, 9 Н). Пример 2 конечного предшественника. Синтез трет-бутилового эфира[5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2 Получали, следуя той же самой методике, которая описана в примере 1 (стадия г), с использованием трет-бутилового эфира (5-бром-6-нитропиридин-2-ил)метилкарбаминовой кислоты (12) (100 мг, 0,30 ммоль) и 5-этоксиметоксибензофуран-2-бороновой кислоты (4) (92,5 мг, 0,39 ммоль). Обработку осуще- 17019093 ствляли, как описано в примере 1(г), с последующей очисткой неочищенного продукта колоночной флэш-хроматографией с использованием 10-25% этилацетата в гексане. Выпаривание растворителя давало 120 мг целевого соединения (13) в виде желтоватого твердого вещества. 1 Н ЯМР (400 МГц, ацетон)м.д.: 8.48 (d, J=8,59 Гц, 1 Н), 8.36 (d, J=8,98 Гц, 1 Н), 7.48 (d, J=8,98 Гц,1 Н), 7.37 (d, J=2,73 Гц, 1 Н), 7.23 (s, 1 Н), 7.09 (dd, J=8,98, 2,34 Гц, 1 Н), 5.28 (s, 2 Н), 3.74 (q, J=7,02 Гц, 2 Н),3.43 (s, 3 Н), 1.58 (s, 9 Н), 1.19 (t, J=7,02 Гц, 3 Н). МС-ЭРИ: m/z 444,44 [М+1]+; 388,45 [(М-56) +1]+. ДСК: эндотермическое событие с началом при 81,0 С и пиком при 83,4 С. Н 76,4 Дж-1. ТГА: нет заметных событий между комнатной температурой и 160 С. Либо альтернатива для трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6 нитропиридин-2-ил]метилкарбаминовой кислоты (13). к) трет-Бутиловый эфир[5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2 ил]метилкарбаминовой кислоты (13). К дегазированному раствору 5-этоксиметоксибензофуран-бороновой кислоты (4) (0,69 г, 2,63 ммоль) в этаноле (17,5 мл) добавляли трет-бутиловый эфир (5-бром-6-нитропиридин-2 ил)метилкарбаминовой кислоты 12 (0,50 г, 1,51 ммоль), Pd(PPh3)2Cl2 (0,14 г, 0,20 ммоль) и Et3N (0,48 мл,3,46 ммоль). Данную реакционную смесь перемешивали при 90 С в течение 30 мин. Реакционную смесь охлаждали до 0 С и фильтровали до прозрачности. Летучие вещества удаляли при пониженном давлении. Остаток разбавляли водой и данную смесь экстрагировали этилацетатом. Данный органический экстракт промывали рассолом и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной флэш-хроматографией. Выпаривание растворителя давало соединение 13, указанное в заголовке (выход 58%). 1 Н ЯМР (400 МГц, ацетон)м.д.: 8.48 (d, J=8,59 Гц, 1 Н), 8.36 (d, J=8,98 Гц, 1 Н), 7.48 (d, J=8,98 Гц,1 Н), 7.37 (d, J=2,73 Гц, 1 Н), 7.23 (s, 1 Н), 7.09 (dd, J=8,98, 2,34 Гц, 1 Н), 5.28 (s, 2 Н), 3.74 (q, J=7,02 Гц, 2 Н),3.43 (s, 3 Н), 1.58 (s, 9 Н), 1.19 (t, J=7,02 Гц, 3 Н). МС-ЭРИ: m/z 444,44 [М+1]+; 388,45 [(М-56) +1]+. Таблица 2 Репрезентативные пики картины дифракции рентгеновских лучей на порошке для трет-бутилового эфира [5-(5-этоксиметоксибензофуран-2-ил)-6-нитропиридин-2 ил]метилкарбаминовой кислотыF-Фторид выделяли в оперативном режиме из раствора-мишени циклотрона на картридже QMASepPak Light (Waters), который был предварительно кондиционирован водным карбонатом калия (0,5 М,10 мл) и водой (18 M, 15 мл). Через 3 мин QMA SepPak Light промывали порцией 2 мл раствора Kryptofix (4,7,13,16,21,24-гексаокса-1,10-диазобицикло[8.8.8]гексакозан) (99 мг, 0,26 ммоль) и карбоната калия(16 мг, 0,12 ммоль) в воде (0,85 мл) и сухом ацетонитриле (20 мл). Элюат нагревали при 160 С под током азота (110 мл/мин) до высыхания, охлаждали до комнатной температуры и добавляли раствор третбутил-5-(5-(этоксиметокси)бензофуран-2-ил)-6-нитропиридин-2-ил(метил)карбамата (3 мг, 6,8 мкмоль) вDMSO (1 мл). Данную смесь нагревали при 85 С в течение 15 мин, затем охлаждали до 70 С и добавляли соляную кислоту (6 М, 0,25 мл). Через 30 мин данную реакционную смесь разбавляли водой (0,5 мл) и загружали на полупрепаративную ВЭЖХ колонку (колонка АСЕ С-18, 5250 мм, 5 мкм), которую элюировали смесью MeOH/HCO2NH4 (0,1 М) (50:50 (об./об. при 6 мл/мин. Фракцию, элюируемую в момент времени 34 мин, собирали, выпаривали досуха, остаток вновь растворяли в смеси забуференного фосфатом солевого раствора (рН 7,4) и этанола (70%) в пропиленгликоле 5:3 (об./об.) и фильтровали через стерильный фильтр (0,22 мкм, Millipore). Установленный радиохимический выход: 3%. Радиохимическая чистота (ВЭЖХ): более 99%. Спектр МС/МС продукта согласуется со спектром от аутентичного немеченого 2-(2-фтор-6-метиламинопиридин-3-ил)бензофуран-5-ола. Немеченый 2-(2-фтор-6-метиламинопиридин-3-ил)бензофуран-5-ол демонстрирует ИК 50 13 нМ в анализе конкурентного связывания, описанном в WO 2007/086800. Методика получения [18F]2-(6-фтор-5-метиламино-2-пиридил)бензофуран-5-ола из трет-бутил-N-[6[5-(этоксиметокси)бензофуран-2-ил]-2-нитро-3-пиридил]-N-метилкарбамата. 18F-Фторид выделяли в оперативном режиме из раствора-мишени циклотрона на картридже QMASepPak Light (Waters), который был предварительно кондиционирован водным карбонатом калия (0,5 М,10 мл) и водой (18 M, 15 мл). Через 3 мин QMA SepPak Light промывали порцией 2 мл раствора Kryptofix (4,7,13,16,21,24-гексаокса-1,10-диазобицикло[8.8.8]гексакозан) (99 мг, 0,26 ммоль) и карбоната калия(16 мг, 0,12 ммоль) в воде (0,85 мл) и сухом ацетонитриле (20 мл). Элюат нагревали при 160 С под током азота (110 мл/мин) до высыхания, охлаждали до комнатной температуры и добавляли раствор третбутил-6-(5-(этоксиметокси)бензофуран-2-ил)-2-нитропиридин-3-ил(метил)карбамата (2,7 мг, 0,26 ммоль) в ацетонитриле (1 мл). Данную смесь нагревали при 85 С в течение 15 мин, затем охлаждали до 70 С и добавляли соляную кислоту (2 М, 1 мл). Через 30 мин данную реакционную смесь разбавляли водой (0,5 мл) и загружали на полупрепаративную ВЭЖХ колонку (колонка С-18 Waters Bondapak, 7,8300 мм, 10 мкм), которую элюировали смесью MeOH/HCO2NH4 (0,1 М) (30:70 (об./об. при 6 мл/мин. Фракцию,элюируемую в момент времени 24 мин, собирали, упаривали досуха, остаток вновь растворяли в забуференном фосфатом солевом растворе (рН 7,4) и фильтровали через стерильный фильтр (0,22 мкм, Millipore). Радиохимический выход: 11%. Радиохимическая чистота (ВЭЖХ): более 99%. Спектр МС/МС продукта согласуется со спектром от аутентичного немеченого 2-(6-фтор-5-метиламино-2 пиридил)бензофуран-5-ола. Немеченый 2-(6-фтор-5-метиламино-2-пиридил)бензофуран-5-ол демонстрирует ИК 50 44 нМ в анализе конкурентного связывания, описанном в WO 2007/086800. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение или его соль, где соединение представляет собой трет-бутиловый эфир [6-(5 этоксиметоксибензофуран-2-ил)-2-нитропиридин-3-ил]метилкарбаминовой кислоты. 2. Соединение или его соль по п.1 в кристаллической форме. 3. Соединение или его соль по п.2, где эта кристаллическая форма имеет по меньшей мере одно эндотермическое явление с началом между 70 и 300 С. 4. Соединение или его соль по п.1 в кристаллической форме, имеющей картину дифракции рентгеновских лучей на порошке, содержащую по меньшей мере один характерный пик дифракции при 2 тета = 13,510,5. 5. Соединение или его соль по п.1 в кристаллической форме, имеющей следующие пики дифракции: 11,27; 12,00; 13,51; 15,53; 16,82; 17,91 и 23,72 2 тета. 6. Применение соединения или его соли по п.1 или 2 в качестве синтетического предшественника для получения меченого соединения. 7. Применение по п.6, где метка представляет собой атом 18F. 8. Применение по п.6 или 7, где меченое соединение представляет собой 2-(6-[18F]-фтор-5 метиламинопиридин-2-ил)бензофуран-5-ол или его соль. 9. Способ получения трет-бутилового эфира[6-(5-этоксиметоксибензофуран-2-ил)-2 нитропиридин-3-ил]метилкарбаминовой кислоты, включающий превращение соединения 5 в соединение 6 способом, включающим введение защиты аминогруппы в соединении 5 с использованием трет-бутилдикарбоната в присутствии гексаметилдисилазида натрия; превращение соединения 6 в соединение 7 способом, включающим алкилирование соединения 6 с использованием CH3I в присутствии NaH; осуществление взаимодействия соединения 7 и соединения 4 в присутствии дихлор-бис(трифенилфосфин)палладия(II) и (СН 3 СН 2)3N в этаноле, где соединение 4 соответствует 10. Соединение или его соль, где соединение представляет собой трет-бутиловый эфир [5-(5 этоксиметоксибензофуран-2-ил)-6-нитропиридин-2-ил]метилкарбаминовой кислоты. 11. Соединение или его соль по п.10 в кристаллической форме. 12. Соединение или его соль по п.11, где эта кристаллическая форма имеет по меньшей мере одно эндотермическое явление с началом между 70 и 300 С. 13. Соединение или его соль по п.11 в кристаллической форме, имеющей картину дифракции рентгеновских лучей на порошке, содержащую по меньшей мере один характерный пик дифракции при 2 тета= 6,180,5. 14. Соединение или его соль по п.11 в кристаллической форме, имеющей следующие пики дифракции: 6,18; 9,14; 11,67; 14,98 и 16,44 2 тета. 15. Применение соединения или его соли по п.10 или 11 в качестве синтетического предшественника для получения меченого соединения. 16. Применение по п.15, где метка представляет собой атом 18F. 17. Применение по п.15 или 16, где меченое соединение представляет собой 2-(2-[18F]-фтор-6 метиламинопиридин-3-ил)бензофуран-5-ол или его соль.
МПК / Метки
МПК: A61K 31/443, C07D 307/78, A61P 25/28, C07D 405/04, A61K 51/04
Метки: предшественников, новые, отложений, являются, бензофураны, амилоидных, подходящие, полезными, визуализации, которые, соединений, качестве
Код ссылки
<a href="https://eas.patents.su/22-19093-novye-benzofurany-podhodyashhie-v-kachestve-predshestvennikov-soedinenijj-kotorye-yavlyayutsya-poleznymi-dlya-vizualizacii-amiloidnyh-otlozhenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Новые бензофураны, подходящие в качестве предшественников соединений, которые являются полезными для визуализации амилоидных отложений</a>
Предыдущий патент: Способ получения пиридо-пиримидиновых ингибиторов mtor киназы, их солевых форм
Следующий патент: Пирролопиримидины и их применение
Случайный патент: Слитые белки taci-иммуноглобулина