Виросомоподобные везикулы, содержащие антигены, производные от gp41, и их применение
Номер патента: 18084
Опубликовано: 30.05.2013
Авторы: Цурбригген Ринальдо, Флёри Сильвен, Бомсель Морган
Формула / Реферат
1. Виросомоподобная везикула, содержащая антиген, производный от gp41, который
представляет собой Р1 пептид, раскрытый в описании;
ковалентно связан за счет своего С-конца с липидом указанной виросомоподобной везикулы;
локализован на внешней поверхности указанной виросомоподобной везикулы;
находится в подходящей конфигурации для того, чтобы придать указанной виросомоподобной везикуле способность вызывать иммунный ответ против белка gp41 вируса иммунодефицита человека (ВИЧ), причем указанная везикула содержит по меньшей мере один функциональный вирусный белок слияния с мембраной, не происходящий из ВИЧ.
2. Виросомоподобная везикула по п.1, где указанный Р1 пептид включает по меньшей мере один расположенный на С-конце образующий ковалентную связь аминокислотный остаток.
3. Виросомоподобная везикула по п.2, где указанный аминокислотный остаток выбран из Cys или Lys.
4. Виросомоподобная везикула по п.2 или 3, где указанный Р1 пептид дополнительно содержит по меньшей мере один разделяющий остаток между указанными остатками, образующими ковалентную связь, расположенными на С-конце, и Р1 пептидом.
5. Виросомоподобная везикула по п.4, где указанный разделяющий остаток выбран из остатков Gly, Ala, Ser, Asp, Lys, Gln, His, Ile и Leu.
6. Виросомоподобная везикула по любому из пп.1-5, где указанный липид выбран из амфифильных производных полиэтиленгликоля (ПЭГ), фосфатидилэтаноламина (ФЭ), фосфатидилхолина (ФХ), фосфатидилсерина, холестерина или их смеси.
7. Виросомоподобная везикула по п.6, где указанный Р1 пептид связан с указанным липидом при помощи бифункционального сукцинатного линкера, в частности γ-малеимидомасляной кислоты N-гидроксисукцинимидного эфира или N-γ-малеимидобутирилоксисукцинимидного эфира.
8. Виросомоподобная везикула по любому из пп.1-7, где указанный Р1 пептид находится в форме моно-, ди-, три- или тетрамера и их смесей.
9. Виросомоподобная везикула по любому из пп.1-8, где указанный Р1 пептид выбран из монофилетических групп ВИЧ типа А, В, С или D.
10. Виросомоподобная везикула по любому из пп.1-9, где Р1 пептид имеет аминокислотную последовательность, выбранную из SEQ ID NO: 2 и SEQ ID NO: 3.
11. Виросомоподобная везикула по любому из пп.1-10, которая включает липидный бислой, содержащий липиды, выбранные из катионных липидов, синтетических липидов, гликолипидов, фосфолипидов, глицерофосфолипидов, гликосфинголипидов, сфинголипидов, холестерина и их производных.
12. Виросомоподобная везикула по любому из пп.1-11, дополнительно включающая по меньшей мере один адъювант, усиливающий и/или опосредующий иммунный ответ, выбранный из врожденного иммунного ответа или адаптивного иммунного ответа.
13. Виросомоподобная везикула по п.12, где адаптивный иммунный ответ выбран из TH1 и/или TH2 иммунного ответа.
14. Виросомоподобная везикула по п.12 или 13, где указанный адъювант выбран из солей алюминия, алюминийфосфатных гелей, микобактерий, таких как BCG, M. vaccae, или Corynebacterium parvum, пептидов, гемоцианина моллюска фиссурелы, дипептидных и трипептидных производных мурамила, монофосфориллипида А, интерлейкина-2 (IL-2), IL-12, колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF), лигандов хемокинового семейства, таких как RANTES (регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками), липопротеина грамположительных бактерий, компонента клеточной стенки дрожжей, двухцепочечной РНК, липополисахарида грамотрицательных бактерий, флагеллина, U-обогащенной одноцепочечной вирусной РНК, CpG-содержащей ДНК, супрессирующей цитокиновый сигнальный путь малой интерферирующей РНК (SOCS siRNA), пептидов-производных меллитина, пан DR эпитопа (PADRE) и их смесей.
15. Виросомоподобная везикула по любому из пп.12-14, где указанный адъювант инкапсулирован внутри указанной везикулы, и/или включен в липидный бислой указанной везикулы, и/или свободно комбинирован с указанной везикулой.
16. Виросомоподобная везикула по любому из пп.1-15, дополнительно содержащая нацеливающую группу, специфичную в отношении ткани или клетки, выбранную из рецептора клеточной поверхности, хемокина, цитокина, фактора роста, антитела или фрагмента антитела, пептидной последовательности, имеющей специфичность или специфический заряд, комплементарные молекуле адгезии.
17. Виросомоподобная везикула по п.16, где указанная нацеливающая группа, специфичная в отношении ткани или клетки, включена в или присоединена к липидному бислою указанной везикулы.
18. Фармацевтическая композиция, содержащая виросомоподобные везикулы по любому из пп.1-17.
19. Фармацевтическая композиция по п.18, дополнительно содержащая везикулы, включающие Р1 пептид, инкапсулированный внутри указанной везикулы, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при иммунотерапии.
20. Фармацевтическая композиция по п.18 или 19, содержащая также дополнительные виросомоподобные везикулы, содержащие антиген, отличающийся от указанного пептида Р1, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в иммунотерапии.
21. Применение по меньшей мере одной виросомоподобной везикулы по любому из пп.1-17 для изготовления фармацевтической композиции, предназначенной для того, чтобы вызывать адаптивный иммунный ответ и врожденный иммунный ответ, направленный против белка gp41 вируса иммунодефицита человека.
22. Способ лечения и/или профилактики ВИЧ-инфекции, включающий стадию введения индивиду, нуждающемуся в этом, эффективного количества виросомоподобных везикул по любому из пп.1-17.
23. Способ по п.22, где указанные виросомоподобные везикулы вводят путем инъекции, или через слизистую оболочку, или с помощью комбинации этих путей.
24. Способ по п.23, где указанный путь через слизистую оболочку выбран из мочеполового пути, желудочно-кишечного пути, аноректального пути, респираторного пути введения, через слизистые оболочки верхних дыхательных путей или назально-ротового пути и их комбинаций.
25. Способ по любому из пп.22-24, где дополнительно по отношению к указанным виросомоподобным везикулам вводят везикулы, содержащие Р1 пептид, инкапсулированный внутри указанных везикул.
26. Способ по любому из пп.22-25, где указанные виросомоподобные везикулы вводят в комбинации с дополнительным антигеном, отличающимся от указанного пептида Р1.
27. Набор для индукции иммунного ответа против белка gp41 вируса иммунодефицита человека, содержащий
виросомоподобную везикулу по любому из пп.1-17, содержащую пептид Р1, представленный последовательностью, выбранной из SEQ ID NO: 2 или SEQ ID NO: 3, и
виросомоподобную везикулу, содержащую антиген, производный от gp41, представленный последовательностью SEQ ID NO: 1.
Текст
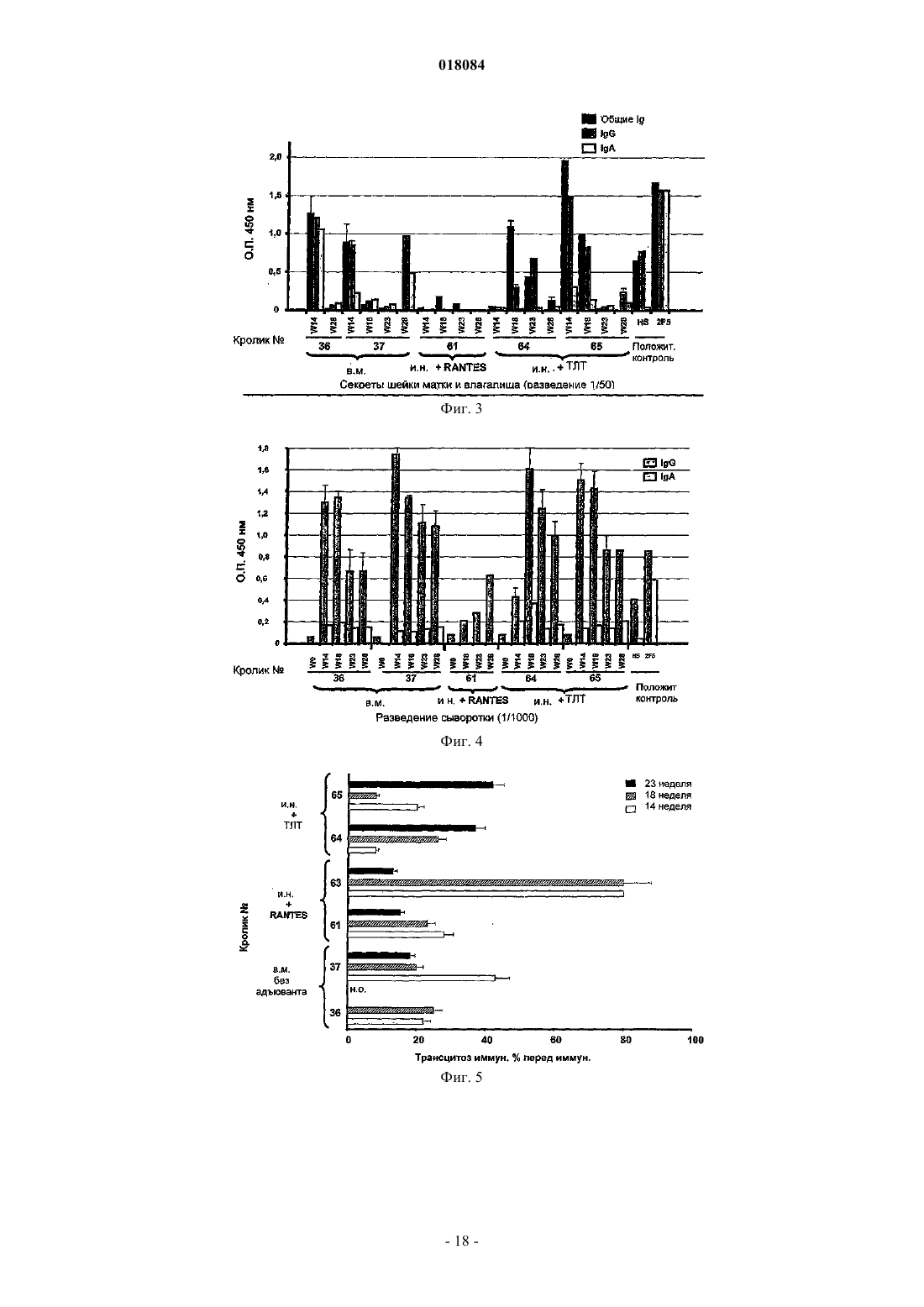
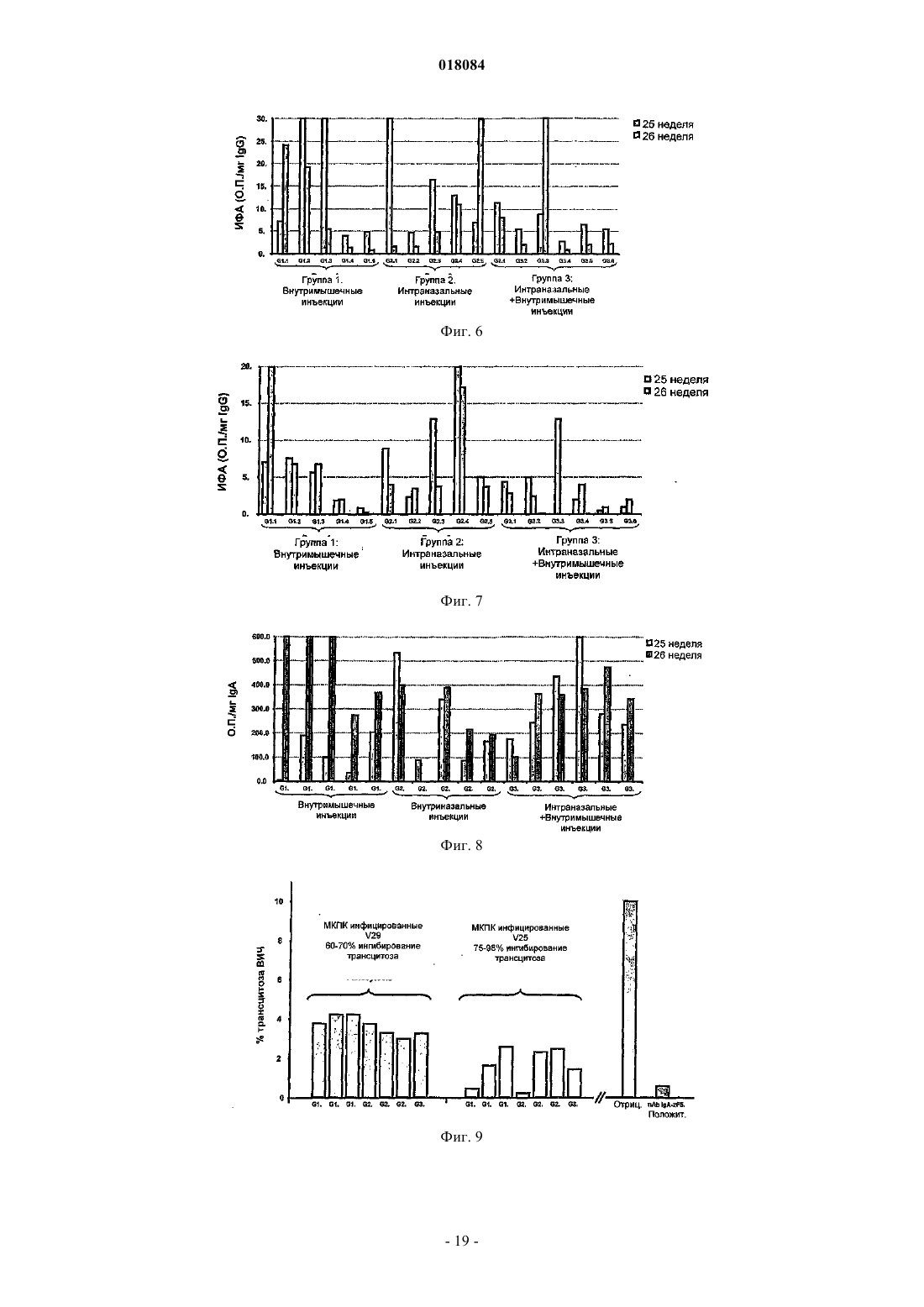
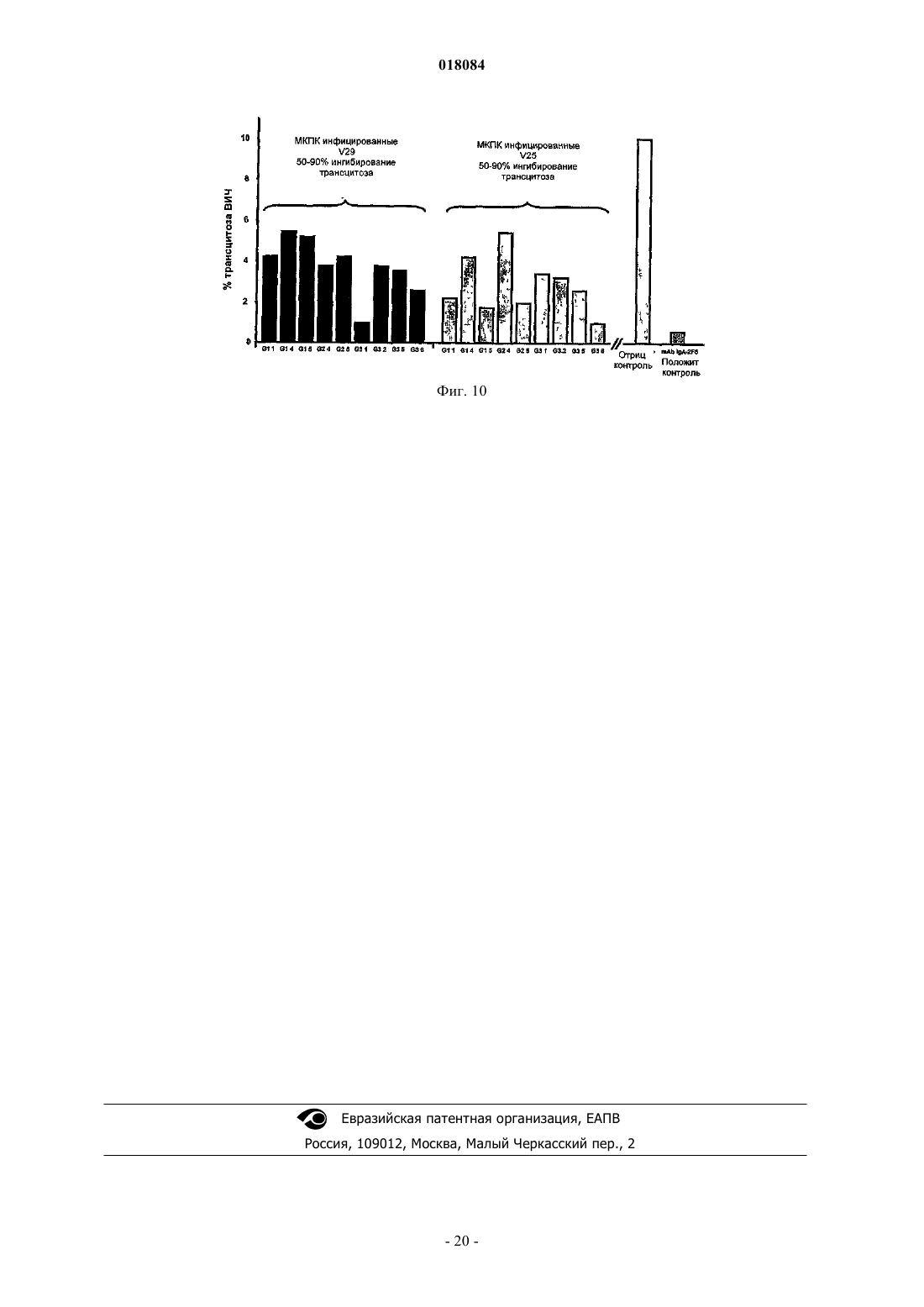
Настоящее изобретение относится к виросомоподобной везикуле, содержащей антиген, производный от gp41, который представляет собой Р 1 пептид, аминокислотная последовательность которого представлена всей или частью последовательности, выбранной из SEQ ID NO: 2 или SEQ ID NO: 3; ковалентно связан за счет своего С-конца с липидом указанной виросомоподобной везикулы; локализован на внешней поверхности указанной виросомоподобной везикулы; находится в подходящей конфигурации для того, чтобы придать указанной виросомоподобной везикуле способность вызывать иммунный ответ против белка gp41 вируса иммунодефицита человека (ВИЧ), причем указанная везикула содержит по меньшей мере один функциональный вирусный белок слияния с мембраной, не происходящий из ВИЧ.(71)(73) Заявитель и патентовладелец: МАЙМЕТИКС КОРПОРЕЙШН (US); ИНСТИТУТ НАСЬОНАЛЬ ДЕ ЛА САНТ ЭТ ДЕ ЛА РЕШЕРШ МЕДИКАЛЬ (ИНСЭРМ) Настоящее изобретение относится к новой виросомоподобной везикуле, подходящей для индукции иммунного ответа против вируса иммунодефицита человека (ВИЧ), к фармацевтическим композициям,содержащим указанные виросомоподобные везикулы, к способу лечения и к набору для индукции иммунного ответа против вируса иммунодефицита человека. ВИЧ представляет собой ретровирус, который постепенно разрушает иммунную систему и в конечном итоге приводит к синдрому приобретенного иммунодефицита (СПИД). ВИЧ существует в виде множества отличающихся вариантов, являющихся членами крупного семейства. В результате секвенирования вирусных геномов исследователи получили возможность картировать генеалогическое древо ВИЧ. В основании дерева существуют три группы, названные М, N и О, причем группа М ответственна за существующую в настоящее время пандемию СПИД. Группа М расщепляется на девять генетических подтипов, также названных девятью монофилетическими группами (обозначенными А-K, без Е или I). Исходное определение монофилетических групп основано на коротких геномных последовательностях, в основном, в оболочечном белке ВИЧ (Env:gp160). Эти девять монофилетических групп обладают неоднородными картинами географического распространения. Монофилетическая группа С распространена в Южной Африке, Индии и районах Китая. Монофилетические группы А и D обычны для Восточной Африки, а монофилетическая группа В обычна для Северной и Южной Америки и Западной Европы. В соответствии со статистикой четыре монофилетические группы А, В, С и D составляют свыше 90% от всей инфекции по всему миру, а монофилетическая группа С сама по себе представляет собой преобладающий в мире ВИЧ (60%). До недавнего времени разработка вакцин фокусировалась на штаммах монофилетической группы В, которая эпидемически доминирует в промышленно развитых странах, но вызывает всего лишь приблизительно 12% инфекций по всему миру. Большая часть подходов с использованием вакцин против ВИЧ-1 направлена на гликопротеины вирусной оболочки (Env), поскольку они представляют собой основные поверхностные антигены, экспрессирующиеся на вирионах и ВИЧ-1 инфицированных клетках. Нативный гликопротеин оболочки ВИЧ-1 представляет собой гетеродимер, содержащий три белкаgp120, нековалентно связанные стремя гликопротеинами gp41. Три наиболее сильных антитела, нейтрализующие ВИЧ-1, которые были идентифицированы до настоящего времени - b12, 2G12 и 2F5, обладают высокой аффинностью в отношении нативного тримера. Предпринимаются все более интенсивные попытки разработать рекомбинантные белки в качестве вакцин-кандидатов, которые представляют собой более хорошие антигенные имитаторы по сравнению с комплексом нативного гликопротеина оболочки, таким как gp120/gp41. Тем не менее, вследствие множества (по меньшей мере пятнадцати) молекулярных гомологий между gp120/gp41 и молекулами иммунной системы может возникать множество потенциальных случаев кросс-реактивности, которые приводят к возможным вредным аутоиммунным явлениям. Описаны различные стратегии уменьшения кросс-реактивности для получения вакцин против ВИЧ,которые не обладают или обладают меньшей кросс-реактивностью с человеческими белками, такие как введение мутаций и/или делеций в различные части белка gp41, как описано в US 6455265 и WO 2005/010033. Тем не менее, все еще существует потребность в вакцине, которая позволяет индуцировать универсальный иммунный ответ против ВИЧ инфекции и, в частности, ВИЧ инфекции 1 типа. Также существует необходимость в разработке вакцины, не относящейся к монофилетической группе В, такой как, например, штаммы монофилетической группы С. Также существует необходимость в разработке вакцины, обладающей широким ингибирующим спектром, обеспечивающим возможность ингибирования между монофилетическими группами. Существует необходимость в вакцине, позволяющей индуцировать гуморальный и/или клеточный иммунный ответ против ВИЧ инфекции. Существует необходимость в вакцине, позволяющей индуцировать иммунный ответ против ВИЧ инфекции на уровне слизистой оболочки и на уровне крови. Существует необходимость в вакцине, подходящей для индукции антител слизистой оболочки sIgA и системных антител IgG, способной влиять на проникновение ВИЧ через слизистую оболочку и раннюю инфекцию клеток под слизистой оболочкой. Существует необходимость в вакцине, подходящей для ингибирования или уменьшения проникновения ВИЧ через ткани слизистой оболочки путем различных механизмов, таких как трансцитоз. Задача изобретения заключается в том, чтобы удовлетворять все вышеупомянутые потребности. Таким образом, в соответствии с одним из первых аспектов настоящее изобретение относится к виросомоподобной везикуле, содержащей антиген, производный от gp41, который представляет собой Р 1 пептид, раскрытый далее, ковалентно связанный за счет своего С-конца с липидом указанной виросомоподобной везикулы и локализованный на внешней поверхности указанной виросомоподобной везикулы; указанный пептид находится в подходящей конфигурации для того, чтобы придать указанной виросомоподобной везикуле способность вызывать иммунный ответ против белка gp41 вируса иммунодефицита человека (ВИЧ), причем указанная везикула содержит по меньшей мере один функциональный вирусный белок слияния с мембраной, не происходящий из ВИЧ. Р 1 пептид представляет собой пептид, аминокис-1 018084 лотная последовательность которого представлена всей или частью последовательности, выбранной изSEQ ID NO: 2, SEQ ID NO: 3 или их аналога. В частности, ВИЧ может быть типа 1. Авторы изобретения неожиданно обнаружили, что можно вызвать иммунный ответ на уровне слизистой оболочки, а также системный иммунный ответ путем иммунизации кроликов внутримышечно или интраназально виросомоподобными везикулами, содержащими антиген, производный от gp41, присоединенный к внешней поверхности. Более конкретно, авторы изобретения обнаружили присутствие специфических антител против белка gp41 (IgA и IgG слизистой оболочки) в секретах шейки матки и влагалища и интестинальных секретах кроликов после внутримышечной или интраназальной иммунизации. В сыворотке крови этих кроликов также были идентифицированы специфические антитела IgG против ВИЧ. Дополнительно данные конкретные антитела способны ингибировать трансцитоз ВИЧ в различных экспериментах. Авторы изобретения также обнаружили, что антитела против gp41 (IgA и IgG слизистой оболочки) можно получать в секретах влагалища и ректальных смывах самок макак, иммунизированных вакциной по изобретению, вводимой внутримышечно и/или интраназально. Продемонстрировано, что эти секреты и смывы в значительной степени ингибируют трансцитоз ВИЧ различных первично монофилетических групп (В и С) в модели человеческого эпителия. Таким образом, вакцина против ВИЧ по изобретению проявляет свойство, заключающееся в способности вызвать иммунные ответы (цитолитические Т лимфоциты и/или антитела) в крови, а также в первичном участке проникновения, представляющем собой половые пути и интестинальные/ректальные слизистые ткани. Это свойство особенно благоприятно, поскольку ВИЧ инфекция может включать стадию трансцитоза вируса через слизистые оболочки, облегчающую перемещение вируса и распределение его в организме. Секреты семенной жидкости и секреты шейки матки и влагалища могут, потенциально, переносить ВИЧ в желудочно-кишечный, аноректальный и мочеполовой тракты, поскольку содержат бесклеточные частицы ВИЧ и множество ВИЧ-инфицированных мононуклеарных клеток. Также полагают, что основным местом, где происходит ранняя репликация вируса у субъектов, инфицированных ВИЧ, является тонкая кишка и другие слизистые оболочки. Основной причиной этого является тот факт, что подавляющее большинство чувствительных клеток (интестинальные CD4+ Тклетки) располагается в тканях слизистой оболочки и в течение первых нескольких недель после воздействия ВИЧ эти клетки разрушаются. В значении согласно настоящему изобретению предполагают, что выражение "виросомоподобная везикула" обозначает везикулу, содержащую по меньшей мере в части виросомальные липиды и слитые белки или их фрагменты, где указанные фрагменты обладают активностью слияния и характеристиками полноразмерного слитого белка, по меньшей мере, в той степени, которая служит для слияния с биологической мембраной клетки-мишени. В WO 2004/07800 предложены виросомоподобные везикулы в качестве векторов для перекрестного связывания антигенов малярийного плазмодия с внешней поверхностью указанной везикулы. В значении согласно изобретению предполагают, что выражение "антиген, производный от gp41" относится к любой части или фрагменту, а также полноразмерному белку gp41, встречающемуся в природе в любом штамме ВИЧ или содержащему любую модификацию (мутация по аминокислоте или химическая модификация), которая, по существу, не влияет на его антигенные свойства. Антигенные свойства виросомоподобных везикул по изобретению являются следствием подходящей конфигурации антигена gp41, инкапсулированного внутри и/или локализованного на поверхности указанной везикулы. В WO 2004/045582 описано приготовление виросомоподобных везикул, которые могут включать белок gp41/gp120, но которые не влияют на антигенные свойства этого белка, а только его свойство слияния. В соответствии с еще одним аспектом настоящее изобретение относится к фармацевтической композиции, содержащей виросомоподобные везикулы по изобретению. В соответствии с еще одним аспектом настоящее изобретение также относится к применению по меньшей мере одной виросомоподобной везикулы по настоящему изобретению для приготовления фармацевтической композиции, предназначенной для того, чтобы вызывать адаптивный иммунный ответ и/или врожденный иммунный ответ, направленный против белка gp41 вируса иммунодефицита человека. В соответствии с одним воплощением задача изобретения заключается в том, чтобы индуцироватьIgG и IgA слизистой оболочки. IgA слизистой оболочки могут представлять собой смесь IgA и секреторных IgA. В соответствии с еще одним воплощением задача изобретения заключается в том, чтобы ингибировать или уменьшить трансцитоз ВИЧ, в частности на уровне слизистой оболочки. В значении согласно настоящему изобретению предполагают, что "адаптивный иммунный ответ" относится к иммунному ответу, основанному на активации компонента иммунной системы, приводящего к специфичности и памяти в отношении антигена или патогена. Такой ответ может быть высокоспецифичным в отношении антигена или патогена и более эффективным при втором и последующем столкновении с антигеном или патогеном. Такой адаптивный иммунный ответ может быть основан на активации лимфоцитов, таких как Т-клетки или В-клетки. В значении по изобретению предполагают, что выражение "врожденный иммунный ответ" относится к ответу, основанному на неспецифической системе распознавания и не меняющемуся при последующем столкновении с антигеном или патогеном. Такая система может быть основана на иммунных клетках, таких как, например, моноциты, макрофаги или естественные киллеры (NK - natural killers). В соответствии с еще одним аспектом настоящее изобретение также относится к способу лечения и/или профилактики ВИЧ-инфекции, включающему стадию введения индивиду, нуждающемуся в этом,эффективного количества виросомоподобных везикул по изобретению. В соответствии с еще одним аспектом настоящее изобретение также относится набору для индукции иммунного ответа против белка gp41 вируса иммунодефицита человека, содержащему виросомоподобную везикулу по изобретению, содержащую пептид Р 1, представленный последовательностью, выбранной из SEQ ID NO: 2 или SEQ ID NO: 3, и виросомоподобную везикулу, содержащую антиген, производный от gp41, представленный последовательностью SEQ ID NO: 1. Виросомоподобная везикула Виросомоподобная везикула, подходящая для настоящего изобретения, содержит, по меньшей мере, виросомальные липиды и демонстрирует свойства слияния с мембраной. В соответствии с воплощением виросомоподобная везикула по изобретению может включать моноламеллярный липидный бислой. В соответствии с воплощением виросомоподобная везикула по изобретению может представлять собой би- или мультиламеллярную везикулу. В соответствии с одним воплощением виросомоподобная везикула может иметь диаметр, как правило, находящийся в диапазоне от 100 до 600 нм, и, в частности, диаметр от 100 до 300 нм и, в частности,от 200 до 400 нм. Виросомоподобные везикулы по изобретению могут представлять собой сферические моноламеллярные везикулы, имеющие средний диаметр приблизительно 150 нм. Виросомоподобные везикулы содержат включенные в липидный бислой слитые белки или их фрагменты. Предполагается, что выражение "слитые белки или их фрагменты" относится к белкам или их фрагментам, способным вызывать и/или способствовать реакции слияния мембраны виросомоподобной везикулы и биологической мембраны клетки-мишени. Например, слитые белки могут представлять собой мембранные гликопротеины вируса гриппа, такие как гемагглютинин (ГА). В соответствии с воплощением, могут использовать по меньшей мере два различных слитых белка или их фрагмента, которые могут демонстрировать различные характеристики слияния. В соответствии с еще одним воплощением, отличительные характеристики слияния могут представлять собой, например, отличающуюся чувствительность к температуре, к концентрации ионов, к кислотности, к типу клеток и к специфичности типа ткани. В соответствии с воплощением виросомоподобная везикула может содержать слитые белки, которые опосредуют слияние при двух отличающихся температурах. В соответствии с еще одним воплощением отличающиеся слитые белки с вирусным гемагглютинином (ГА) могут быть использованы для конструирования виросомоподобной везикулы. В качестве примера молекулы НА вирионов Х-31 и PR8/34 могут быть способны катализировать две различные реакции слияния при отличающихся температурах. Слитые белки с отличающимися характеристиками слияния могут происходить из различных штаммов вируса гриппа, а также других вирусов, таких как белок Е 1 вируса везикулярного стоматита(ВВС), белок Е 1 вируса Seliki Forest (SFV) или белок F вируса Сендай. Специфический механизм слияния виросомоподобных везикул дает возможность целевого взаимодействия с классом I (MHC I) или классом II (МНС II главного комплекса) гистосовместимости. Антиген, локализованный на внешней поверхности виросомоподобной везикулы, может разрушаться при слиянии с эндосомой в эндосоме и может быть презентирован рецепторам МНС II класса иммунной системы. Антиген, инкапсулированный внутри виросомоподобной везикулы, может быть доставлен в цитозоль при слиянии и может войти в путь МНС I класса. Таким образом, виросомоподобная везикула может быть способна вызывать гуморальный и/или клеточный иммунный ответ. В частности, виросомоподобная везикула может обладать способностью индуцировать IgA, такой как секреторный IgA, а также IgG. Протоколы получения хорошо известны специалистам в данной области техники. Подходящие протоколы для изобретения описаны, например, в WO 2004/045582 или ЕР 0538437, которые включены здесь путем ссылки. В соответствии с одним из воплощений виросомоподобную везикулу по изобретению могут получать из самой виросомальной везикулы или из везикулы, возникающей в результате слияния виросомальной везикулы с липосомальной везикулой. Изготовление виросомальных везикул могут осуществлять при помощи любого способа, известного специалисту в данной области техники, такого как описанный в Bron et al., Methods Enzymol. 22 0: 313331, 30 19 93, включенной здесь путем ссылки. Виросомальные везикулы, например, могут восстанавливать из исходных липидов мембраны вируса и введенных гликопротеинов после солюбилизации, например интактного вируса гриппа с монододецильным эфиром октаэтиленгликоля, осаждения нуклеокапсида (вирусные гликопротеины и липиды остаются в супернатанте) и удаления детергента в супернатанте с использованием гидрофобной смолы(Big-Beads SM2) (Stegmann et al., Traffic 1: 598-604, 1987). Получение виросомальных везикул, содержащих ГА различных штаммов вирусов, могут осуществлять с равными количествами белков вирусов, солюбилизированных в неионном детергенте - монододецильном эфире октаэтиленгликоля. После удаления детергента с использованием Bio-Beads SM2, могут быть образованы виросомоподобные везикулы, содержащие различные типы слитых белков. В соответствии с одним из аспектов виросомоподобную везикулу по изобретению могут получать путем слияния виросомальной везикулы с липосомальной везикулой. Таким образом, в соответствии с одним из воплощений виросомоподобная везикула по изобретению может включать виросомальные и липосомальные липиды. В соответствии с одним из воплощений виросомоподобная везикула по изобретению может включать липидный бислой, содержащий липиды, выбранные из катионных липидов, синтетических липидов,гликолипидов, фосфолипидов, глицерофосфолипидов, гликосфинголипидов, таких как галактозилцерамид, сфинголипиды, холестерин и их производные. Такие липиды могут использовать для того, чтобы лучше имитировать вирусную мембрану и микродомен raft с целью благоприятствовать оптимальным олигомерам gp41, таким как ди-, три- или тетрамеры. В соответствии с еще одним воплощением виросомоподобные везикулы по изобретению могут включать липиды, способствующие фолдингу gp41-производного антигена для того, чтобы более эффективно имитировать природный фолдинг указанного антигена. Фосфолипиды могут включать, в частности, фосфатидилхолин, сфингомиелин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерол, фосфатидную кислоту, кардиолипин и фосфатидилинозит с варьирующими композициями жирного ацила. Катионные липиды могут быть выбраны из DOTMA (N-[1-(2,3-диолеилокси)пропил]-N,N,Nтриметиламмония хлорида), DOTAP (N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония хлорида,DODAC (N,N-диолеил-N,N-диметиламмония хлорида), ДДАБ (дидодецилдиметиламмония бромида) и стеариламина или других алифатических аминов и т.д. Липиды, используемые согласно изобретению, могут получать в виде небольших моноламеллярных липосом в смеси с ДОФЭ (диолеоилфосфатидилэтаноламином), который широко используется в качестве вспомогательного липида для облегчения разрушения эндосомальной мембраны. В соответствии с воплощением липосомальные липиды липосом могут включать РОРС/ДДАБ. В соответствии с еще одним воплощением также может быть использован агент, способствующий эмульгации, для улучшения жесткости и/или закрывания везикул. В качестве примера агента, способствующего эмульгации, можно упомянуть холестерин и его производные, такие как, например, сложный эфир холестерина, заряженный или нейтральный в виде сульфата холестерина; производное стерольной цепи, такое как, например, производное растительного происхождения, такое как фитостерол (ситостерол, сигмастерол); церамиды и их смеси. Антиген, производный от gp41, может быть заключен в липосомальные везикулы перед слиянием с виросомами. Инкапсуляцию по меньшей мере одного антигена и/или адъюванта, как указано ниже, в липосомы могут осуществлять при помощи любого способа, известного в области техники, включающего способы,описанные в Monnard et al., Biochim. Biophys.; Acta 1329: 39-50; 1997, в Wagner et al., J. Liposome Res.,12(3) 271-283, 2002 или в Oberholzer et al., Biochim. Biophys. Acta 1416: 57-68i 1999, в числе многих других хорошо известных способов. В конкретном воплощении высокой эффективности липосомальной инкапсуляции могут достигать при помощи способа замораживания/оттаивания, используемого для приготовления чистых липидных везикул. В соответствии с одним из аспектов изобретения продукты реакции слияния виросом и липосом могут подвергать стадии нуклеопоровой экструзии для уменьшения размера. В качестве примера экструзия через поры 200 нм может позволить получить везикулы, имеющие размер, составляющий приблизительно половину от исходного. Большая часть частиц может находиться в диапазоне от 100 до 300 нм. После изменения размера продукты слияния липосом и виросом могут представлять собой виросо-4 018084 моподобные везикулы, которые могут включать антиген, производный от gp41, в своей внутренней полости и могут быть способны претерпевать вторую стадию слияния с биологическими мембранами в различных условиях для доставки указанного антигена. Антиген, производный от gp41, может быть локализованным на внешней поверхности и/или быть инкапсулированым внутри везикулы по изобретению, как описано ниже. В соответствии с одним из аспектов виросомоподобная везикула по изобретению дополнительно может содержать нацеливающую группировку, которая нацеливает указанную везикулу на специфическую клетку или ткань. Подходящая нацеливающая группировка может быть выбрана из рецептора клеточной поверхности, хемокина, цитокина, фактора роста, антитела или фрагмента антитела, пептидной последовательности, имеющей специфичность или специфический заряд, комплементарный молекуле адгезии, такой как интегрин. Нацеливающая группировка может быть включена в или присоединена к липидному бислою указанной везикулы при помощи любого из способов, известных специалистам в данной области техники. В соответствии с еще одним воплощением виросомоподобная везикула по изобретению дополнительно может содержать дополнительный антиген. В соответствии с одним из воплощений виросомоподобная везикула по изобретению дополнительно может содержать от одного до десяти дополнительных антигенов и, в частности, от 2 до 4 дополнительных антигенов. Дополнительные антигены могут быть выбраны из пептидов, происходящих из ВИЧ, и, в частности, пептидов, происходящих из структурных белков, кодируемых генами env (gp120, gp41), gag (p9, p17,p24) и pol (р 66, р 32), и регуляторных белков, кодируемых генами nef, rev или tat, и их смесей. Антиген, производный от gp41 Антиген, производный от gp41, подходящий для настоящего изобретения, может представлять собой любую часть белка gp41, а также полноразмерного белка gp41 и его аналогов. В значении по изобретению предполагается, что выражение "его аналог" в отношении антигена,производного от gp41, относится к пептиду, имеющему, по существу (по меньшей мере 85%, в частности по меньшей мере 90% и конкретней по меньшей мере 95%), идентичности или гомологии аминокислотной последовательности (т.е. аминокислотный остаток замещен, например, аминокислотным остатком того же самого семейства, похожей полярности или заряда) с аминокислотной последовательностью указанного антигена, производного от gp41, и который обладает похожими или консервативными биологическими свойствами, в частности, в отношении связывания фрагмента антигена с иммуноглобулином,нацеленным на белок gp41. В соответствии с одним из воплощений антиген, производный от gp41, подходящий для изобретения, может быть лишен свойства слияния в отношении клеточной мембраны. В соответствии с одним из воплощений пептид, производный от gp41, локализованный на внешней поверхности виросомоподобной везикулы по изобретению, может быть ковалентно связан с липидом указанной виросомоподобной везикулы или внедрен в липидный бислой указанной виросомоподобной везикулы при помощи трансмембранного домена пептида, отличающегося от пептидного трансмембранного домена дикого типа белка gp41 дикого типа. Соответственно, ковалентно связанный антиген, производный от gp41, может включать любую модификацию, требующуюся для локализации указанного антигена, производного от gp41, на внешней поверхности виросомоподобной везикулы по изобретению. Модификации gp41-антигена, подходящего для изобретения, и способы перекрестного связывания указанного модифицированного gp41-антигена с внешней поверхностью виросомоподобной везикулы могут быть такими, как описаны в WO 2004/078099. В соответствии с одним из воплощений антиген, производный от gp41, может быть ковалентно связан с внешней поверхностью виросомоподобной везикулы путем перекрестного связывания с липидом или фосфолипидом. В соответствии с еще одним воплощением антиген, производный от gp41, может быть ковалентно связан с внешней поверхностью виросомоподобной везикулы путем перекрестного связывания с углеводом. В соответствии с одним воплощением ковалентно связанный Р 1 пептид может включать по меньшей мере один остаток, образующий ковалентную связь, расположенный С-конце. Например, остаток, образующий перекрестную связь, может быть выбран из цистеина (Cys) или лизина (Lys). В соответствии с еще одним воплощением ковалентно связанный Р 1 пептид дополнительно может включать по меньшей мере один разделяющий остаток между указанными остатками, образующими ковалентную связь, расположенными на С-конце, и Р 1 петидом. Подходящий разделяющий остаток может быть выбран, например, из остатков Gly (глицин), Ala(лейцин). От 2 до 12, в частности от 3 до 10 и конкретней от 4 до 8 разделяющих остатков могут быть связаны с образованием разделяющих последовательностей. Подходящие разделяющие последовательности могут быть выбраны, например, из Gly-Gly или LysGly. Ковалентное связывание антигена, производного от gp41, с поверхностью виросомоподобной везикулы, например, могут осуществлять с применением амфифильных производных полиэтиленгликоля(ПЭГ), фосфатидилэтаноламина (ПЭ), фосфатидилхолина (ФХ), фосфатидилсерина, холестерина или их смеси, легко включенных в липидный бислой. Ковалентное связывание антигена, производного от gp41, с липидом виросомоподобной везикулы по изобретению могут осуществлять при помощи любого способа, известного специалистам в данной области техники. Ковалентное связывание могут осуществлять в липидном растворе, и липид-пептидный конъюгат могут затем включать в виросомоподобную везикулу. В соответствии с воплощением изобретения Р 1 пептид может быть связан с липидом везикулы по изобретению, например, при помощи бифункционального сукцинатного линкера, в частности малеимидомасляной кислоты N-гидроксисукцинимидного эфира или Nмалеимидобутирилоксисукцинимидного-эфира. В соответствии с воплощением антиген, производный от gp41, и, конкретней, интеркалированный антиген, производный от gp41, может не иметь пептидного трансмембранного домена. Пептидный трансмембранный домен подходящего интеркалированного gp41-производного антигена может быть замещен отличающимся трансмембранным пептидным доменом. Такой модифицированный антиген, производный от gp41, может представлять собой химерный белок. В значении по изобретению выражение "химерный белок" относится к белку, который может содержать одну или более чем одну область белка и одну или более чем одну область одного или более чем одного отличающегося белка. Для задачи по изобретению любой трансмембранный домен любого белка может подходить для встраивания антигена, производного от gp41, в липидный бислой виросомоподобной везикулы по изобретению. В соответствии с одним из воплощений можно использовать трансмембранные домены, которые могут способствовать олигомеризации (для получения димеров, тримеров или тетрамеров), такие как трансмембранные домены рецепторов факторов роста или оболочечных белков вирусов. В качестве примера трансмембранного домена, который может быть подходящим согласно настоящему изобретению, можно упомянуть трансмембранный домен, полученный из рецептора клеточной поверхности, такого как рецептор CD4 (например, как показано на SEQ ID NO: 5), цитокинового рецептора, как, например, рецептора IL-1, рецептора эпидермального фактора роста (EGF - Epidermal GrowthFactor), рецептора фактора роста эндотелия сосудов (VEGF - Vascular Endothelium Growth Factor), любых рецепторов, связанных с G-белком, любых тирозинкиназных рецепторов, вирусный трансмембранный домен, происходящий из оболочечных белков вирусов, таких как вирусы семейства рабдовирусов или семейства поксвирусов. Подходящий для изобретения вирусный белок может представлять собой, например, белок G вируса везикулярного стоматита (BBC-G). Такие трансмембранные домены хорошо известны в области техники и легко могут быть идентифицированы специалистом в данной области техники. Химерный белок, подходящий для настоящего изобретения, могут получать при помощи любого из способов генетической инженерии, известных специалистам в данной области техники, таких как описанные в "Molecular Cloning - A Laboratory Manual" (2nd Ed.) Sanbrook et al., 1990, Coldspring Harbor Laboratory, Coldspring Harbor Press N.Y. (Sanbrook). В соответствии с еще одним воплощением антиген, производный gp41, может быть доставлен к внешней поверхности виросомоподобной везикулы в моно-, ди-, три- и, конкретней, в тетрамерной форме и их смесях. Таким образом, количество антигена, производного от gp41, используемого для изготовления виросомоподобной везикулы по изобретению, может быть скорректировано при помощи любого из стандартных протоколов, известных специалистам в данной области техники для получения желаемой моно- или мультимерной формы. В соответствии с одним из воплощений gp41-производный антиген может быть присоединен к внешней поверхности при помощи его С-конца. В соответствии с воплощением gp41-производный антиген может быть инкапсулирован внутри виросомоподобной везикулы по изобретению.gp41-производный антиген может быть инкапсулирован в виросоме при помощи способов, хорошо известных в области техники. Например, раствор очищенного вируса гриппа А/сингапурского гемагглютинина, полученного, как описано ранее J.J. Skehe и G.C. Schild (The polypeptide composition of influenza A viruses. Virology 44(1971) 396-408), могут готовить путем растворения осадка гемагглютинина после центрифугирования в растворе ФБР-ОЭГ (фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), растворенные в физиологическом растворе, забуференном фосфатом (ФБР), содержащем октанэтиленгликольмонодециловый эфирGp41-производные антигены и фосфолипиды могут добавлять к гемагглютининовому раствору,смешивать, подвергать ультразвуковому воздействию, затем центрифугировать. Затем могут сформировать виросомы, как обсуждалось ранее, путем удаления детергента, например, с использованием BioRadSM Bio-Beads. В соответствии с еще одним примером антиген, производный от gp41, может быть инкапсулирован в липосомы с использованием способов, таких как описанные ранее или описанные в Christodoulides etal., Microbiology 144:3027-3037 (1998), перед слиянием указанных липосомальных везикул с виросомальными везикулами. В соответствии с еще одним воплощением при инкапсуляции в виросомоподобной везикуле по изобретению gp41-производный антиген также могут использовать в моно- или мультимерной форме, как указано ранее. В соответствии с воплощением антиген, производный от gp41, который может быть использован в настоящем изобретении, могут выбирать из любой монофилетической группы ВИЧ. Подходящие для изобретения монофилетические группы ВИЧ могут представлять собой, например,ВИЧ монофилетических групп А, В, С или D. Конкретней, антиген, производный от gp41, может относится к монофилетической группе ВИЧ типа С. Подходящий антиген, производный от gp41, может включать, в частности, любую консервативную аминокислотную замену (и/или вставку, и/или делецию) и/или химическую модификацию (такую как циклизацию) в отношении встречающегося в природе антигена, производного от gp41, включение которой может быть основано на стандартных навыках специалистов в данной области техники. В соответствии с одним из воплощений антиген, производный от gp41, который может подходить для осуществления настоящего изобретения, может представлять собой пептид, имеющий аминокислотную последовательность, представленную полностью или частично последовательностью SEQ ID NO: 1,полученной из штамма ВИЧ-1 НхВ 2 или его аналога. В одном из воплощений антиген, производный от gp41, может представлять собой рекомбинантные петлевые пептиды gp41, происходящие из аминокислотных последовательностей гликопротеинов ВИЧgp41 дикого типа. В качестве примера антигенов, производных от gp41, которые могут быть пригодны для осуществления настоящего изобретения, можно упомянуть антигены, производные от gp41, полученные путем введения в иммунодоминантные области некоторых мутаций (делеции, замены и/или вставки) для уменьшения гомологии с человеческим интерлейкином-2 (IL-2) для того, чтобы избежать или уменьшать риск запуска аутоиммунной реакции. Такие антигены, производные от gp41, в частности, описаны в WO 2005/010033, включенной здесь путем ссылки. В настоящей заявке на изобретение "мутация" относится к любой модификации области (возможно,уменьшенной на один аминокислотный остаток) полипептида при помощи физических средств, химических средств (ковалентная или нековалентная модификация) и/или биологических средств (мутации путем замены, делеции и/или вставки одной или более аминокислоты), приводящей к модификации функциональных потенциалов составляющих аминокислот указанной области, названной "мутировавшая область". В качестве примера можно осуществлять мутации, приводящие к модификации аминокислоты L серии в D серию, устранение, приобретение и/или модуляцию свойств дисульфидных мостиков, водородных связей, электростатических взаимодействий и/или гидрофобных взаимодействий, модификации способности белка образовывать гетерокомплекс, или альтернативно, в случае олигомерного белка, модификацию состояния олигомеризации или стабильности олигомера. Модификация иммунодоминирующих областей может привести в результате к введению в петлю,или замещению части петли гидрофильным и неиммуногенным или слабо иммуногенным гибким линкером и возможно ведению мутации(ий). Кроме того, gp41-производный антиген может включать по меньшей мере одну мутацию в его иммунодоминирующей области, которая приводит in vitro к кросс-реакции В типа и/или Т типа с белком хозяина и, в частности, с IL-2. Некоторые мутации, которые являются решающими в отношении влияния этого изменения на антигенность, раскрыты в US 6455265 и WO 2005/010033, которые включены здесь полностью путем ссылки. В соответствии с воплощением антиген, производный от gp41, подходящий для настоящего изобретения, может представлять собой пептид, названный Р 1, и может представлять собой пептид, аминокислотная последовательность которого представлена всей или частью последовательности, выбранной изSEQ ID NO: 2, SEQ ID NO: 3 или их аналога. Пептид Р 1 соответствует аминокислотной последовательности, представленной в эктодомене оболочечного белка ВИЧ gp41, который локализован на поверхности вирусных частиц перед взаимодействием вирусов с клетками-мишенями. В качестве примера в штамме ВИЧ-1 НхВ 2 эта последовательность заключена между аминокислотами с 649 по 683 белка gp41 дикого типа.gp41-Производный антиген, пригодный согласно изобретению, также может включать модификации, такие как усечение части аминокислотной последовательности по N- или С-концу или добавление пептидной последовательности с получением химерного белка, описанного в WO 2005/010033, или как описано ранее. В качестве примера антигена производного от gp41, подходящего для изобретения, можно представить последовательность Р 1, содержащую добавление разделителя Lys-Gly-Cys по С-концу, например,как показано в SEQ ID NO: 4. Адъюванты В соответствии с одним воплощением иммуностимулирующее действие виросомоподобных везикул по изобретению может быть дополнительно увеличено путем ассоциации этих виросомоподобных везикул по меньшей мере с одним адъювантом. Указанный адъювант может быть инкапсулирован внутри, и/или включен в липидный бислой,и/или свободно комбинирован с указанной везикулой. В соответствии с одним из воплощений виросомоподобная везикула дополнительно может содержать по меньшей мере один адъювант, усиливающий и/или опосредующий иммунный ответ, выбранный из врожденного иммунного ответа и/или адаптивного иммунного ответа. Адаптивный иммунный ответ может быть выбран из TH1 и/или TH2 иммунного ответа. Используемые адъюванты могут усиливать иммунологический ответ путем активации антигенпрезентирующих клеток (АПК), макрофагов и/или стимулирующих специфических наборов лимфоцитов. Адъювант, который может быть подходящим согласно настоящему изобретению, может представлять собой любой лиганд, подходящий для активации рецептора, распознающего патоген (PRR - pathogenrecognition receptor), экспрессирующегося в и на дендритных клетках (ДК) или других антигенпрезентирующих клетках. Лиганды, активирующие Toll-подобные рецепторы (TLR - toll-like receptors), также могут быть подходящими для задач изобретения. Эти рецепторы представляют собой члены семейства PRR и широко экспрессируются множеством клеток врожденного иммунитета, включающих ДК, макрофаги, тучные клетки и нейтрофилы. В качестве примера лигандов, активирующих TLR, можно упомянуть для TLR4 липополисахариды(ЛПС) Е. coli, таксол, слитой белок респираторно-синцитиального вируса (РСВ), и белки теплового шока 60 и 70, для TLR2 пептидогликан Staphylococcus aureus, липопротеины М. tuberculosis, и зимозан Sacharomyces cerevisiae, и высокочистые ЛПС P. gingivalis, для TLR3 дцРНК, для TLR5 флагеллин, дляTLR7 синтетические соединения имидазохинолины и для TLR9 некоторые типы CpG-обогащенной ДНК. Другие полезные адъюванты для изобретения могут представлять собой эпитопы Т-хелпера. Эпитоп Т-хелпера представляет собой пептид, обычно происходящий из экзогенных белков, которые претерпевают протеолитическое расщепление и процессинг в пути эндоцитоза антигенпрезентирующих клеток (АПК). В этих клетках главный комплекс гистосовместимости II класса (МНС II) переносится в эндосомы путей эндоцитоза, ассоциированных с этими пептидами. Этот комплекс, который переносится на поверхность АПК, может взаимодействовать со специфическим Т-клеточным рецептором CD4+ Тлимфоцитов, приводя к их активации. В зависимости от хелперного эпитопа Т-клеточный ответ может представлять собой ответ TH1 и/илиTH2 типа. В области техники известны TH1 эпитопы, способствующие ответу цитотоксических-Тлимфоцитов, и TH2 эпитопы, способствующие гуморальному ответу. В качестве примера эпитопа TH1-ориентированного ответа можно упомянуть эпитоп, состоящий из пептидов-производных меллитина, идентифицированных в WO 2005/049647. В качестве примера эпитопа TH2-ориентированного ответа можно упомянуть пан эпитоп DR хелперной Т-клетки (PADRE - Pan DRepitope). Этот эпитоп сконструирован таким образом, что связывается с наиболее обычными молекуламиPADRE HTL увеличивает силу вакцин, разработанных для стимуляции клеточного иммунного ответа(Alexander J. et al., Immunol Res. 1998;18(2):79-92). В соответствии с воплощением адъювант, который может быть использован с виросомоподобными везикулами по настоящему изобретению, может быть выбран из солей алюминия, алюминийфосфатных гелей, микобактерий, таких как BCG, M. vaccae, или Corynebacterium parvum, пептидов, гемоцианина лимфы улитки, дипептидных и трипептидных производных мурамила, монофосфориллипида А, интерлейкина-2 (IL-2), IL-12, колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF granulocyte-macrophage colony stimulating factor), лигандов хемокинового семейства, таких как RANTES понента клеточной стенки дрожжей, двухцепочечной РНК, липополисахарида грамотрицательных бактерий, флагеллина, U-обогащенной одноцепочечной вирусной РНК, CpG содержащей ДНК, сурессирующей цитокиновый сигнальный путь малой интерферирующей РНК (SOCS siRNA - Suppressor of CytokineSignalling small interfering RNA), пептидов-производных меллитина, пан DR эпитопа (PADRE) и их смесей. Фармацевтические препараты В соответствии с воплощением виросомоподобные везикулы по изобретению могут быть использованы для изготовления фармацевтической композиции, предназначенной для индукции адаптивного иммунного ответа и/или врожденного иммунного ответа, направленного против белка gp41 вируса иммунодефицита человека. Такая фармацевтическая композиция может включать раствор виросомоподобных везикул, суспендированных в фармацевтически приемлемом носителе, например водном носителе. Могут использовать множество водных носителей, например воду, забуференную воду, 0,4% солевой раствор, 0,3% глицин, гиалуроновую кислоту и т.д. Фармацевтическую композицию могут стерилизовать при помощи обычных хорошо известных способов стерилизации или могут подвергать стерильной фильтрации. Получающиеся в результате водные растворы могут упаковывать для применения, как они есть, или лиофилизировать, причем лиофилизированный препарат комбинируют перед введением со стерильным раствором. Фармацевтическая композиция также может содержать фармацевтически приемлемые вспомогательные вещества, требующиеся для обеспечения условий, приближенных к физиологическим, такие как агенты, регулирующие рН, и буферные агенты, агенты, регулирующие тоничность, увлажнители и т.п,например ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламинолеат и многие другие. Такие препараты обычно могут содержать фармацевтически приемлемые концентрации соли, буферных агентов, антиоксидантов, консервантов, совместимых носителей, ранее описанных адъювантов и возможно других терапевтических агентов. Виросомоподобные везикулы по изобретению и, в частности, содержащие их фармацевтические композиции могут вводить путем инъекции, или через слизистую оболочку, или с помощью комбинации этих путей. Путь инъекции может быть, например, интраперитонеальным, внутрикожным, подкожным, внутрисосудистым или внутримышечным путем. Могут использовать любой путь введения через слизистую оболочку, например мочеполовой путь,такой как, например, влагалищный путь, желудочно-кишечный путь, аноректальный путь, респираторный путь, через слизистые оболочки верхних дыхательных путей или назально-ротовой путь и их смеси. В одном из воплощений фармацевтическая композиция по изобретению может быть представлена в виде лекарственных форм для перорального введения, таких как таблетки, капсулы (каждая из которых включает препараты с рассчитанным по времени высвобождением и препараты с замедленным высвобождением), пилюли, порошки, гранулы, эликсиры, настойки, растворы, суспензии, сиропы и эмульсии. Все эти формы хорошо известны специалистам в фармацевтической области техники. В одном из воплощений для приготовления фармацевтической композиции для введения в форме вакцины могут использовать виросомоподобные везикулы. Могут использовать любые протоколы иммунизации, стандартные для данной области техники. В соответствии с одним из воплощений фармацевтическая композиция по изобретению может дополнительно содержать везикулы, включающие Р 1 пептид, инкапсулированный внутри указанной везикулы, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при иммунотерапии. В соответствии с еще одним воплощением фармацевтическая композиция по изобретению может включать дополнительные виросомоподобные везикулы, содержащие антиген иной, чем указанный антиген, производный от gp41, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в иммунотерапии. Указанный иной антиген может представлять собой ранее описанный антиген. Фармацевтическая композиция по изобретению может включать виросомоподобные везикулы по изобретению в эффективном количестве. Эффективное количество представляет собой такое количество виросомоподобных везикул, которое само по себе или вместе с дополнительными дозами может стимулировать желаемый ответ. Эффективное количество может зависеть от множества факторов, таких как путь введения, введение в виде разовой или дробных доз, и параметров конкретного пациента, включающих возраст, физическое состояние, размер, массу и стадию заболевания. Эти факторы хорошо известны специалистам в данной области техники и могут быть адресованы не более чем к стандартным экспериментам. Таким образом, в соответствии с воплощением, фармацевтическая композиция может содержать виросомоподобные везикулы по изобретению сами по себе или в комбинации по меньшей мере с одним адъювантом, как описано ранее. В соответствии с еще одним аспектом настоящее изобретение также относится к способу лечения и/или профилактики ВИЧ инфекции, включающему, по меньшей мере, стадию введения индивиду, нуждающемуся в таком введении, эффективного количества виросомоподобных везикул по настоящему изобретению. В соответствии с одним из воплощений виросомоподобные везикулы по изобретению могут вводить путем инъекции, или через слизистую оболочку, или путем комбинации указанных путей, как указано ранее. В соответствии с еще одним воплощением виросомоподобные везикулы, которые могут использовать согласно настоящему изобретению, могут представлять собой виросомоподобные везикулы, содержащие антиген, производный от gp41, локализованный на внешней поверхности, и виросомоподобные везикулы, содержащие антиген, производный от gp41, инкапсулированный внутри указанных везикул, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в иммунотерапии. В соответствии с еще одним воплощением виросомоподобную везикулу, которую могут использовать в способе по изобретению, могут вводить в комбинации с дополнительным антигеном, отличным от указанного gp41-производного антигена. В качестве примера дополнительного антигена, который может быть подходящим согласно настоящему изобретению, можно упомянуть указанные ранее отличные антигены. В соответствии с еще одним аспектом настоящее изобретение также относится к набору для индукции иммунного ответа против белка gp41 вируса иммунодефицита человека, содержащему виросомоподобную везикулу по изобретению, содержащую пептид Р 1, представленный последовательностью, выбранной из SEQ ID NO: 2 или SEQ ID NO: 3, и виросомоподобную везикулу, содержащую антиген, производный от gp41, представленный последовательностью SEQ ID NO: 1. Настоящее изобретение будет более понятно при рассмотрении следующих примеров, которые приведены в целях иллюстрации, и их не следует интерпретировать как ограничивающие объем настоящего изобретения. Различные аспекты настоящего изобретения дополнительно проиллюстрированы следующими примерами, которые в любом случае не следует рассматривать как ограничивающие объем настоящего изобретения. Описание графических материалов На фиг. 1 показаны последовательности антигена, производного от gp41, вируса НхВ 2 монофилетической группы В (SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4) и ВИЧ-монофилетической группы С (SEQID NO: 2); на фиг. 2 - последовательности трансмембранного домена молекулы CD4+ (SEQ ID NO: 5); на фиг. 3 - доза тотальных антител, IgG и sIgA, в секретах шейки матки и влагалища кроликов, иммунизированных виросомоподобными везикулами-Р 1 примера 1 без адъюванта (36 и 37, внутримышечный путь), hRANTES (61, интраназальный путь) или термолабильным токсином (64 и 65, интраназальный путь) на 0, 14, 18, 23 и 28 неделю; на фиг. 4 - доза тотальных антител, IgG и IgA, в сыворотках крови кроликов, иммунизированных виросомоподобными везикулами-Р 1 примера 1 без адъюванта (36 и 37, внутримышечный путь),hRANTES (61, интраназальный путь) или термолабильным токсином (64 и 65, интраназальный путь) на 0, 14, 18, 23 и 28 неделю; на фиг. 5 - ингибирование трансцитоза ВИЧ-1 через клетки НТ-29 с использованием мононуклеарных клеток периферической крови (МКПК), инфицированных первичными вирусами и секретами шейки матки и влагалища (разведение 1/50), достигнутое, как описано в примере 2 (недели 14, 18 и 23), виросомоподобными везикулами-Р 1 без адъюванта 36 и 37, внутримышечным путем, hRANTES 61 и 63, интраназальным путем или термолабильным токсином 64 и 65, интраназальный путь); на фиг. 6 - доза IgG согласно иммуноферментныму анализу (ИФА) в секретах влагалища самок макак, вакцинированных виросомоподобными везикулами Р 1 согласно примеру 1 в количестве 40 мкг/дозу на 0, 4, 12 и 24 неделю; на фиг. 7 - доза IgA согласно ИФА в секретах влагалища самок макак, вакцинированных виросомоподобными везикулами Р 1 примера 1 в количестве 40 мкг/дозу на 0, 4, 12 и 24 неделю; на фиг. 8 - доза IgA согласно ИФА в ректальных смывах самок макак, вакцинированных виросомоподобными везикулами Р 1 примера 1 в количестве 40 мкг/дозу на 0, 4, 12 и 24 неделю; на фиг. 9 - ингибирование штаммов R5 ВИЧ (V29 первичный ВИЧ - монофилетическая группа В из Национального института здравоохранения (NIH - National Institute of Health) или V25 первичный ВИЧ монофилетическая группа С из NIH) через клетки НТ-29 с использованием МКПК, инфицированных V29 или V25 - секретами влагалища на 25 неделе (разведение 1/25), полученными, как описано в примере 4; фиг. 10 - ингибирование штаммов R5 ВИЧ (V29 первичный ВИЧ - монофилетическая группа В из Национального института здравоохранения (NIH) или V25 первичный ВИЧ - монофилетическая группа С из NIH) через клетки НТ-29 с использованием МКПК, инфицированных V29 или V25 - ректальными смывами на 25 неделе (разведение 1/25), полученными, как описано в примере 4. Примеры Пример 1. Получение виросомоподобных везикул, содержащих антиген, производный от gp-41, локализованный на внешней поверхности. Виросомоподобные везикулы готовили, как описано в WO 2004/045582. Кратко, 32 мг яичного фосфатидилхолина (ФХ) и 8 мг фосфатидилэтаноламина (ФЭ) растворяли в 2 мл ФБР, содержащего 100 мМ октаэтиленгликольмонодециловый эфир (ОЭГ) (ФБР/ОЭГ). Вирус гриппа А/сингапурский гемагглютинин (ГА) очищали, как описано (Skehel and Schild, Virology 44:396-408, 1971), в физиологическом растворе, забуференном фосфатом (ФБР) 4 мг гемагглютинина(SEQ ID NO: 4) конъюгировали через сукцинатную связку на N-конце с региоизомером фосфатидилэтаноламина (ФЭ) в соответствии со следующим. Фосфатидилэтаноламин (ФЭ) растворяли в метаноле и добавляли 0,1% (об./об.) триэтиламина. Раствор затем смешивали с гетеробифункциональным перекрестным линкером Nмалеимидобутирилоксисукцинимидным эфиром (ГМБС), (Pierce Chemical Company, Rockford, IL) (отношение ФЭ: ГМБС = 5:1),который ранее растворяли в диметилсульфоксиде (ДМСО) (20 мкл). После инкубации в течение 30 мин при комнатной температуре растворители упаривали в течение 1 ч в вакууме в центрифуге SpeedVac. ГМБС-ФЭ затем растворяли в 1 мл ФБР, содержащего 100 me октаэтиленгликоля (ОЭГ) (Fluke(SEQ ID NO: 4) (отношение ФЭ-ГМБС:пептид = 5:1). На этой стадии фосфатидилэтаноламин-ГМБС реагирует со свободным С-концевым цистеином модифицированного пептида Р 1. Спустя 30 мин инкубации добавляли свободный цистеин для инактивации свободного ГМБС (отношение цистеин:ГМБС = 10:1). Конъюгаты пептид Р 1-фосфатидилэтаноламин (4 мг), фосфатидилхолин (32 мг; Lipoid, Ludwigshafen, Germany) и фосфатидилэтаноламин (6 мг) растворяли в общем объеме 2,66 мл ФБР-ОЭГ. Растворы фосфолипида и гемагглютинина смешивали и подвергали ультразвуковой обработке в течение 1 мин. Этот раствор центрифугировали в течение 1 ч при 100000 g и супернатант стерилизовали путем фильтрации. Виросомы образовывались в результате удаления детергента (SM BioBeads, BioRad,Glattbrueg, Switzerland). Пример 2. Иммунизация кроликов композицией вакцины, содержащей виросомоподобную везикулу, содержащую gp-41-производный антигенный пептид Р 1, локализованный на внешней поверхности. Готовили три группы самок новозеландских белых кроликов для получения виросомоподобных везикул, приготовленных, как описано в примере 1. Виросомоподобную везикулу без какого-либо адъюванта вводили внутримышечно (кролики 36 и 37), или вводили интраназально с hRANTES (кролики 61 и 63), или вводили интраназально с термолабильным токсином (ТЛТ) (кролики 64 и 65). Применяли следующую схему введения. За четыре недели до первого введения препаратов кроликам внутримышечно вводили инъекции инактивированного вируса гриппа А (100 мкл инактивированного вируса гриппа А, 0,01 мг/мл). Затем кроликам вводили виросомоподобные везикулы (20 мкг, 100 мкл) на 0, 4 и 12 неделю и внутримышечно осуществляли бустерную иммунизацию (10 мкг) на 16 и 22 неделю. Животных умерщвляли на 28 неделю и для исследования функций ответа на антитело собирали различные образцы. В качестве контроля использовали образцы перед иммунизацией (отобранные перед моментом времени 0). Образцы крови и секретов влагалища отбирали на 14, 18, 23 и 28 неделю. Кроликов, вакцинированных виросомоподобными везикулами с ТЛТ, использовали в качестве контроля по отношению к кроликам, вакцинированным hRANTES виросомоподобными везикулами. Измеряли уровни общих антител, IgG и IgA, в соответствии со следующим протоколом ИФА. Пептид Р 1 (100 нг/100 мкл/лунки, SEQ ID NO: 3) в бикарбонатном буфере 50 мМ, рН 9,6 использовали для покрытия планшетов Nunc в течение ночи при 4 С. Планшеты насыщали бычьим сывороточным альбумином (БСА) 3% или молоком 5% в течение 2 ч/37 С, затем промывали 0,5% буфером ФБР-Tween. Образцы сыворотки крови, разведенные 1/1000 с использованием 3% БСА, или секреты шейки матки и влагалища, разведенные 1/50 с 3% БСА, инкубировали в течение 2 ч при 37 С. Планшеты отмывали с использованием 0,5% буфера ФБР-Tween и инкубировали с первичными антителами. Для обнаружения общего количества антител использовали общие козьи Ig против кроличьих антител, меченные пероксидазой хрена (ПХ) (1/4000). Для обнаружения кроличьего IgA использовали козьи IgG против кроличьих антител (Vector,- 11018084France) (1/20 000) с последующей инкубацией с стрептавидином-ПХ (Immunotech), разведенным в 1/50000. Для обнаружения кроличьего IgG использовали козьи IgA против кроличьих антител (Sigma)(1/20000) с последующей инкубацией с меченным биотином антителом против козьих антител (Vector)(1/1000) и выявляли при помощи стрептавидина-ПХ (1/50000). Моноклональное антитело 2F5-lgG использовали в качестве положительного контроля с последующей инкубацией с меченным биотином козьим Fab'2 против человеческого IgA (1/5000) (Caltag) и выявляли при помощи стрептавидина-ПХ (1/50000). Моноклональное антитело 2F5-lgA использовали в качестве положительного контроля с последующей инкубацией с козьим Fab'2 против человеческого IgG (1/20000) и выявляли при помощи стрептавидина-ПХ (1/50000). Антитела инкубировали в течение 1 ч при 37 С. Колориметрические реакции запускали путем добавления субстрата тетраметилбензидина (ТМБ) и останавливали путем добавления 1 М Н 2 РО 4. Оптическую плотность (ОП) считывали при 450 нм. Полученные результаты проиллюстрированы на фиг. 3 (секрет шейки матки и влагалища) и фиг. 4(сыворотка крови). Присутствие антител обнаружено в секрете шейки матки и влагалища и сыворотке крови неиммунизированных кроликов с максимальным уровнем на 14 или 18 недели в соответствии с условиями иммунизации. Пример 3. Ингибирование трансцитоза ВИЧ секретами шейки матки и влагалища, полученными у иммунизированных кроликов согласно примеру 2. Трансцитоз ВИЧ-1 через эпителиальные клетки и нейтрализацию трансцитоза антителами осуществляли на линии эпителиальных клеток НТ-29, выращиваемых в виде плотного поляризованного монослоя в течение 7 суток на проницаемой фильтровальной подложке (размер пор 0,45 мкм) с образованием интерфейса между двумя независимыми камерами, где верхняя омывает апикальную (просвет) поверхность эпителиального монослоя, а нижняя омывает базолатеральную (серозную) поверхность. Прежде всего, получали МКПК и готовили их, как описано в Lagaye et al., (J. Virol, 2001, 75:4780). Затем МКПК активировали при помощи фитогемагглютинина (ФГА) в течение 48 ч, инокулировали первичной ВИЧ-1 монофилетической группой С и использовали на 7 сутки после инфекции. Секреты шейки матки и влагалища (разведение 1/50), полученные, как описано в примере 2 (14, 18 и 23 неделя, виросомоподобные везикулы-Р 1 без адъюванта 36 и 37 в.м., с hRANTES 61 и 63 и.н. или термолабильным токсином 64 и 65 и.н.), содержащие антитела, инкубировали при 18 С в течение 1 ч с 1106 ВИЧ-1 + МКПК. Для инициации трансцитоза вируса 2106 ВИЧ-1 + МКПК с антителами добавляли в апикальную камеру. Контакт между ВИЧ-1 + МКПК и эпителиальным клеточным монослоем привел в результате к быстрой активной репликации вирионов ВИЧ-1 с последующим их трансцитозом из апикального в базолатеральное поле эпителиальных клеток. Через 2 ч ингибирование трансцитоза антителом определяли путем обнаружения белка р 24 ВИЧ в базолатеральной среде при помощи ИФА (Coulter, France или PASTEUR SANOFI, FRANCE). Уровень р 24 в отсутствие секретов влагалища или в присутствии Р 1 не специфического Fab или в присутствии контрольного IgA 2F5 измеряли, соответственно, как отрицательный и положительный контроль. Значение для отрицательного контроля взято при 100% трансцитозе и использовано для представления результатов. Эксперименты проводили, по меньшей мере, дважды. Полученные результаты представлены на фиг. 5. Результаты указывают на то, что секреты шейки матки и влагалища кроликов, иммунизированных виросомоподобными везикулами-Р 1 без адъюванта (36 и 37), или с человеческим RANTES (61 и 63), или с термолабильным токсином (ТЛТ) (64 и 65), полученные, как описано в примере 2, способны сдерживать трансцитоз ВИЧ-1 монофилетической группы С через клетки НТ-29. Без адъюванта и с ТЛТ обнаружено ингибирование от 70 до 90% при использовании секрета шейки матки и влагалища, отобранного на 18 неделю. С hRANTES обнаружено ингибирование от 85 до более чем 90% при использовании секрета шейки матки и влагалища, отобранного на 23 неделю. Пример 4. Иммунизация макак композицией вакцины, содержащей виросомоподобную везикулу с антигенным пептидом, производным от gp-41, P1, локализованным на внешней поверхности. Три группы от 5 до 6 самок макак в возрасте приблизительно 5 лет подготовили для получения виросомоподобных везикул, приготовленных, как изложено в примере 1. Виросомоподобную везикулу вводили или внутримышечно (макаки с G1.1 по G1.5), или вводили интраназально (макаки с G2.1 по G2.5), или вводили внутримышечно и интраназально (макаки с G3.1 поG3.6). Применяли следующую схему введения. За четыре недели до первого введения препаратов макакам внутримышечно вводили инъекции инактивированного вируса гриппа А (100 мкл инактивированного вируса гриппа А, 0,01 мг/мл). Затем макакам вводили виросомоподобные везикулы (40 мкг, 100 мкл) на 0, 4 и 12 неделю. Образцы ректальных смывов и секретов влагалища отбирали на 25 и 26 недели. Уровень общих антител, IgG и IgA, измеряли в соответствии со следующим протоколом ИФА. Пептид Р 1 (100 нг/100 мкл/лунки, SEQ ID NO: 3) в бикарбонатном буфере 50 мМ, рН 9,6 использовали для покрытия планшетов Nunc в течение ночи при 4 С. Планшеты насыщали 2% БСА/0,1% ФБРТ (ФБР + Tween) в течение 1 ч при 30/37 С, затем промывали 0,1% буфером ФБР-Tween. Образцы ректальных смывов, не разбавленные, или секреты влагалища, разбавленные 1/2 0,1% ФБРТ, инкубировали в течение ночи при 4 С. Планшеты затем промывали 0,1% буфером ФБР-Tween и инкубировали с первичными антителами,разбавленными в 2% БСА/0,1% ФБРТ. Для обнаружения IgG макак использовали козье антитело против IgG макак (Rockland) (1/15000) с последующей инкубацией со стрептавидином-ПХ (Immunotech), разбавленным 1/50000. Для обнаружения IgA макак использовали козье антитело против IgA макак (Rockland) (1/15000) с последующей инкубацией со стрептавидином-ПХ (Immunotech), разбавленным 1/50000. Моноклональное антитело 2F5-IgA использовали в качестве положительного контроля с последующей инкубацией с меченным биотином козьим Fab'2 против человеческого IgA (конечная концентрация 0,14 мкг/мл) (Caltag H 14015) и выявляли при помощи стрептавидина-Х (1/50000). Моноклональное антитело 2F5-IgG использовали в качестве положительного контроля с последующей инкубацией с меченным биотином козьим Fab'2 против человеческого IgG (конечная концентрация 0,1 мкг/мл) (Rockland 609106123) и выявляли при помощи стрептавидина-ПХ (1/50000). Антитела инкубировали в течение 1 ч при 37 С. Колориметрическую реакцию запускали, добавляя субстрат тетраметилбензол, и останавливали,добавляя 1M Н 2 РО 4. Оптическую плотность (ОП) регистрировали при 450 нм. Полученные результаты представлены на фиг. 6 и 7 (IgG и IgA секреты влагалища) и фиг. 8 (ректальные смывы). Результаты демонстрируют, что от 90 до 95% самок макак имеют хорошие уровни специфических антител IgG и IgA против gp41 в генитальных секретах и более чем 95% имеют специфические антителаIgA против gp41 в ректальных смывах. В заключение, присутствие антител IgG, а также IgA обнаружено в вагинальных секретах и ректальных смывах иммунизированных самок макак. Результаты выявили, что с использованием вакцины по изобретению может быть получен иммунный ответ с антителами слизистой оболочки. Дополнительно обнаружено, что антитела IgA и IgG могут перераспределяться в генитальных и интестинальных компартментах даже после вакцинации путем внутримышечной инъекции при отсутствии мукозального адъюванта. Пример 5. Ингибирование трансцитоза ВИЧ секретами влагалища и ректальными смывами, полученными у иммунизированных макак по примеру 4. Для штаммов R5 ВИЧ-1 (V29 первичный ВИЧ - монофилетическая группа В из NIH и V25 первичный ВИЧ - монофилетическая группа С из NIH) трансцитоз через эпителиальные клетки и нейтрализацию трансцитоза антителами осуществляли на линии эпителиальных клеток НТ-29, выращиваемых в виде плотного поляризованного монослоя в течение 7 суток на проницаемой фильтровальной подложке(размер пор 0,45 мкм) с образованием интерфейса между двумя независимыми камерами, где верхняя омывает апикальную (просвет) поверхность эпителиального монослоя, а нижняя омывает базолатеральную (серозную) поверхность. Прежде всего, получали МКПК и готовили как описано в Lagaye et al., (J. Virol, 2001, 75:4780). Затем МКПК активировали при помощи фитогемагглютинина (ФГА) в течение 48 ч и инокулировали первичным ВИЧ-1 - монофилетической группой В (V29) или первичным ВИЧ-1 монофилетической группой С (V25) и использовали на 7 сутки после инфекции. Секреты влагалища (разведение 1/25) или ректальные смывы (разведение 1/25), полученные, как описано в примере 4, на 25 неделю, содержащие антитела, инкубировали при 18 С в течение 1 ч с 1106 ВИЧ-1+ МКПК. Для инициации трансцитоза вируса 2106 ВИЧ-1 + МКПК (V29 или V25) с антителами добавляли в апикальную камеру. Контакт между ВИЧ-1 + МКПК и эпителиальным клеточным монослоем привел в результате к быстрой активной репликации вирионов ВИЧ-1 с последующим их трансцитозом из апикального в базолатеральное поле эпителиальных клеток. Спустя 2 ч ингибирование трансцитоза антителом определяли путем обнаружения белка р 24 ВИЧ в базолатеральной среде при помощи ИФА (Coulter, France или PASTEUR SANOFI, FRANCE). Уровень р 24 в отсутствие секретов влагалища или в присутствии не специфичного к Р 1 Fab или в присутствии контрольного IgA 2F5 измеряли, соответственно, в качестве отрицательного и положительного контроля. Значение для отрицательного контроля было взято при 100% трансцитозе и использовано для представления результатов. Эксперименты проводили, по меньшей мере, дважды. Полученные результаты представлены на фиг. 9 (секреты влагалища) и на фиг. 10 (ректальные смывы). Результаты свидетельствуют о том, что антитела способны предотвращать по меньшей мере 60% проникновения ВИЧ через слизистый эпителий в человеческой модели in vitro и до 98% у двух из шестнадцати животных. Таким образом, вакцина по изобретению способна запускать иммунный ответ в виде IgG, а такжеIgA слизистой оболочки. Иммунный ответ слизистой оболочки способен значительно уменьшить трансцитоз ВИЧ через слизистую оболочку для различных монофилетических групп ВИЧ. Перечень последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Виросомоподобная везикула, содержащая антиген, производный от gp41, который представляет собой Р 1 пептид, раскрытый в описании; ковалентно связан за счет своего С-конца с липидом указанной виросомоподобной везикулы; локализован на внешней поверхности указанной виросомоподобной везикулы; находится в подходящей конфигурации для того, чтобы придать указанной виросомоподобной везикуле способность вызывать иммунный ответ против белка gp41 вируса иммунодефицита человека(ВИЧ), причем указанная везикула содержит по меньшей мере один функциональный вирусный белок слияния с мембраной, не происходящий из ВИЧ. 2. Виросомоподобная везикула по п.1, где указанный Р 1 пептид включает по меньшей мере один расположенный на С-конце образующий ковалентную связь аминокислотный остаток. 3. Виросомоподобная везикула по п.2, где указанный аминокислотный остаток выбран из Cys илиLys. 4. Виросомоподобная везикула по п.2 или 3, где указанный Р 1 пептид дополнительно содержит по меньшей мере один разделяющий остаток между указанными остатками, образующими ковалентную связь, расположенными на С-конце, и Р 1 пептидом. 5. Виросомоподобная везикула по п.4, где указанный разделяющий остаток выбран из остатков Gly,Ala, Ser, Asp, Lys, Gln, His, Ile и Leu. 6. Виросомоподобная везикула по любому из пп.1-5, где указанный липид выбран из амфифильных производных полиэтиленгликоля (ПЭГ), фосфатидилэтаноламина (ФЭ), фосфатидилхолина (ФХ), фосфатидилсерина, холестерина или их смеси. 7. Виросомоподобная везикула по п.6, где указанный Р 1 пептид связан с указанным липидом при помощи бифункционального сукцинатного линкера, в частности -малеимидомасляной кислоты Nгидроксисукцинимидного эфира или Nмалеимидобутирилоксисукцинимидного эфира. 8. Виросомоподобная везикула по любому из пп.1-7, где указанный Р 1 пептид находится в форме моно-, ди-, три- или тетрамера и их смесей. 9. Виросомоподобная везикула по любому из пп.1-8, где указанный Р 1 пептид выбран из монофилетических групп ВИЧ типа А, В, С или D. 10. Виросомоподобная везикула по любому из пп.1-9, где Р 1 пептид имеет аминокислотную последовательность, выбранную из SEQ ID NO: 2 и SEQ ID NO: 3. 11. Виросомоподобная везикула по любому из пп.1-10, которая включает липидный бислой, содержащий липиды, выбранные из катионных липидов, синтетических липидов, гликолипидов, фосфолипидов, глицерофосфолипидов, гликосфинголипидов, сфинголипидов, холестерина и их производных. 12. Виросомоподобная везикула по любому из пп.1-11, дополнительно включающая по меньшей мере один адъювант, усиливающий и/или опосредующий иммунный ответ, выбранный из врожденного иммунного ответа или адаптивного иммунного ответа. 13. Виросомоподобная везикула по п.12, где адаптивный иммунный ответ выбран из TH1 и/или TH2 иммунного ответа. 14. Виросомоподобная везикула по п.12 или 13, где указанный адъювант выбран из солей алюминия, алюминийфосфатных гелей, микобактерий, таких как BCG, M. vaccae, или Corynebacterium parvum,пептидов, гемоцианина моллюска фиссурелы, дипептидных и трипептидных производных мурамила,монофосфориллипида А, интерлейкина-2 (IL-2), IL-12, колониестимулирующего фактора гранулоцитовмакрофагов (GM-CSF), лигандов хемокинового семейства, таких как RANTES (регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками), липопротеина грамположительных бактерий, компонента клеточной стенки дрожжей, двухцепочечной РНК, липополисахарида грамотрицательных бактерий, флагеллина, U-обогащенной одноцепочечной вирусной РНК, CpG-содержащей ДНК, супрессирующей цитокиновый сигнальный путь малой интерферирующей РНК (SOCS siRNA),пептидов-производных меллитина, пан DR эпитопа (PADRE) и их смесей. 15. Виросомоподобная везикула по любому из пп.12-14, где указанный адъювант инкапсулирован внутри указанной везикулы, и/или включен в липидный бислой указанной везикулы, и/или свободно комбинирован с указанной везикулой. 16. Виросомоподобная везикула по любому из пп.1-15, дополнительно содержащая нацеливающую группу, специфичную в отношении ткани или клетки, выбранную из рецептора клеточной поверхности,хемокина, цитокина, фактора роста, антитела или фрагмента антитела, пептидной последовательности,имеющей специфичность или специфический заряд, комплементарные молекуле адгезии. 17. Виросомоподобная везикула по п.16, где указанная нацеливающая группа, специфичная в отношении ткани или клетки, включена в или присоединена к липидному бислою указанной везикулы. 18. Фармацевтическая композиция, содержащая виросомоподобные везикулы по любому из пп.117. 19. Фармацевтическая композиция по п.18, дополнительно содержащая везикулы, включающие Р 1 пептид, инкапсулированный внутри указанной везикулы, в виде комбинированного препарата для одно- 16018084 временного, раздельного или последовательного применения при иммунотерапии. 20. Фармацевтическая композиция по п.18 или 19, содержащая также дополнительные виросомоподобные везикулы, содержащие антиген, отличающийся от указанного пептида Р 1, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в иммунотерапии. 21. Применение по меньшей мере одной виросомоподобной везикулы по любому из пп.1-17 для изготовления фармацевтической композиции, предназначенной для того, чтобы вызывать адаптивный иммунный ответ и врожденный иммунный ответ, направленный против белка gp41 вируса иммунодефицита человека. 22. Способ лечения и/или профилактики ВИЧ-инфекции, включающий стадию введения индивиду,нуждающемуся в этом, эффективного количества виросомоподобных везикул по любому из пп.1-17. 23. Способ по п.22, где указанные виросомоподобные везикулы вводят путем инъекции, или через слизистую оболочку, или с помощью комбинации этих путей. 24. Способ по п.23, где указанный путь через слизистую оболочку выбран из мочеполового пути,желудочно-кишечного пути, аноректального пути, респираторного пути введения, через слизистые оболочки верхних дыхательных путей или назально-ротового пути и их комбинаций. 25. Способ по любому из пп.22-24, где дополнительно по отношению к указанным виросомоподобным везикулам вводят везикулы, содержащие Р 1 пептид, инкапсулированный внутри указанных везикул. 26. Способ по любому из пп.22-25, где указанные виросомоподобные везикулы вводят в комбинации с дополнительным антигеном, отличающимся от указанного пептида Р 1. 27. Набор для индукции иммунного ответа против белка gp41 вируса иммунодефицита человека,содержащий виросомоподобную везикулу по любому из пп.1-17, содержащую пептид Р 1, представленный последовательностью, выбранной из SEQ ID NO: 2 или SEQ ID NO: 3, и виросомоподобную везикулу, содержащую антиген, производный от gp41, представленный последовательностью SEQ ID NO: 1.
МПК / Метки
МПК: C07K 14/16, A61K 9/127, A61K 39/21, A61P 31/18
Метки: антигены, gp41, применение, содержащие, производные, виросомоподобные, везикулы
Код ссылки
<a href="https://eas.patents.su/21-18084-virosomopodobnye-vezikuly-soderzhashhie-antigeny-proizvodnye-ot-gp41-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Виросомоподобные везикулы, содержащие антигены, производные от gp41, и их применение</a>
Предыдущий патент: Производные пиримидина, применимые в качестве ингибиторов pi3 киназы, и способы их применения
Следующий патент: Гидрогели и гидрозоли оксидов металлов, их получение и применение
Случайный патент: Соединения на основе пиридина и пиримидина в качестве ингибиторов сигнального пути wnт для лечения рака