Бициклические антагонисты тахикининов, их получение и применение в фармацевтической композиции
Номер патента: 697
Опубликовано: 28.02.2000
Авторы: Куартара Лаура, Джаннотти Данило, Маджи Карло Альберто, Аркамоне Федерико
Формула / Реферат
1. Бициклические соединения общей формулы
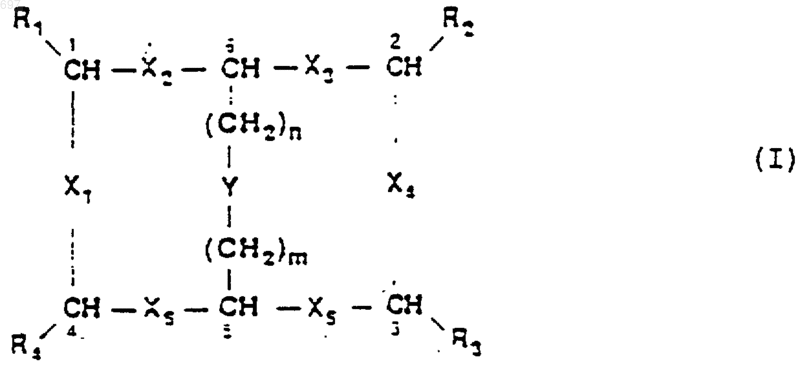
где X1, Х2, Х3, Х4, Х5 и Х6, одинаковые или различные, представляют собой группу -NR'CO- или -CONR'-, где R' является Н или C1-3-алкилом;
Y представляет собой группу, выбранную из -NRCO-, -CONR- или -SS-, где R является Н или C1-3-алкилом;
по меньшей мере, одна из групп R1, R2, R3 и R4, одинаковых или различных, является гидрофильной, а остальные группы являются гидрофобными;
m и n, одинаковые или различные, представляют собой каждый целое число от 1 до 4.
2. Соединения по п.1, где гидрофобные группы могут быть независимо выбраны из следующих групп:
a) групп, соответствующих CnH2n+1, где n=0, 1-4;
b) линейных или разветвленных алкильных групп, соответствующих CnH2n-U-W, где n=1-4; U=O, COO, CONH, S и W=алкильная, арильная или алкиларильная группа, содержащая от 1 до 15 атомов углерода;
c) (СН2)n-С6Н3-А-В, где n=0, 1-3; А и В, расположенные в любом из орто-, мета- или параположений, одинаковые или различные, представляют собой Н, галоген, OR, NHR, NR2, СН3, SR, где R представляет собой алкильную, арильную или алкиларильную группу с числом атомов углерода менее 10;
d) (СН2)n-С6Н10R', где n=0, 1-3 и R' = Н, C1-3-алкил;
e) (СН2)n-гетероцикла, где n=0, 1-3 и под термином гетероцикл имеют в виду: имидазолил-2-ил, индолил-3-ил, фуранил-3-ил, пиридил-3-ил, имидазолил-3-ил;
f) группы -(CH2)s-, где s= 3, 4, необязательно ОН-замещенной или конденсированной с ароматической группой, которая циклизуется с одной или двумя соседними группами X1-6 с образованием боковой цепи пролина, гидроксипролина, октагидроиндол-2-карбоновой кислоты, тетрагидроизохинолиновой кислоты;
g) боковой цепи природной гидрофобной аминокислоты;
h) боковой цепи природной гидрофильной аминокислоты, замещенной соответствующим образом для превращения ее в гидрофобную;
i) боковой цепи неприродных гидрофобных аминокислот, выбранных из группы, состоящей из норлейцина, норвалина, аллоизолейцина, циклогексилглицина (Chg), a -амино-н-масляной кислоты (Аbа), циклогексилаланина (Cha), аминофенилмасляной кислоты (Рbа), фенилаланинов, моно- и дизамещенных в положениях орто-, мета- и парабензольного кольца одной или несколькими из следующих групп: C1-10-алкила, C1-10-алкокси, галогена, b -2-тиенилаланина, b -3-тиенилаланина, b -2-фуранилаланина, b -3-фуранилаланина, b -2-пиридилаланина, b -3-пиридилаланина, b -4-пиридилаланина, b -(1-нафтил)аланина, b -(2-нафтил)аланина, O-алкилированных производных серина, треонина, тирозина, S-алкилцистеина, S-алкилгомоцистеина, N-алкиллизина, N-алкилорнитина, N-алкил-2,3-диаминопропионовой кислоты.
3. Соединения по п.2, в которых боковая цепь гидрофобной аминокислоты согласно параграфу g) является боковой группой аминокислоты, выбранной из группы, состоящей из глицина, аланина, валина, лейцина, изолейцина, метионина, фенилаланина, тирозина, триптофана, пролина, гистидина, аспарагина, глутамина.
4. Соединения по п.2, в которых боковая цепь гидрофильной кислоты, подходящим образом замещенной согласно параграфу h), является боковой цепью аминокислоты, выбранной из группы, состоящей из серина, треонина, цистеина, аспарагиновой кислоты, глутаминовой кислоты, т-карбоксиглутаминовой кислоты, аргинина, орнитина, лизина.
5. Соединения по п.2, в которых гидрофильные группы выбраны из группы L-Q, где L является химической связью или линейной или разветвленной C1-6-алкильной группой, a Q выбран из группы, состоящей из:
i) гидроксила, амино, гуанидина, карбоксила, сульфата, фосфоната, фосфата;
ii) линейной, разветвленной или циклической C1-6-алкильной цепи, содержащей одну или несколько таких групп, как гидроксил, амино, гуанидин, карбоксил, сульфат, фосфат;
iii) ароматической группы, моно-, ди- или тризамещенной в орто-, мета-, параположении гидроксилом, амино, гуанидином, карбоксилом, сульфатом, фосфатом;
iv) группы М, ОМ, CONHM, NHCOM, где М является гидрофильной группой;
v) гидрофильной группы согласно пунктам i)-iv), защищенной группами, которые биологически гидролизуются с повторным образованием гидрофильной группы.
6. Соединения по п.5, в которых группа М выбрана из группы, состоящей из:
i) необязательно замещенных моно-, ди-, тригликозидных остатков;
ii) линейной, разветвленной или циклической C1-6-алкильных цепей, содержащих одну или несколько таких групп, как гидроксил, амино, гуанидин, карбоксил, сульфат, фосфонат, фосфат.
7. Соединения формулы (I) по п.6, в которых гликозидные остатки выбраны из группы, состоящей из гексоз или пентоз D- или L-ряда в a или b конфигурации, выбранных из группы, где все атомы углерода несут свободную или защищенную гидроксильную группу; один или несколько гидроксилов замещены водородом, амино- или ациламиногруппой; С6 гексоз и С5 пентоз являются частью карбоциклической группы; и где необязательно присутствующие 2 или 3 гликозидные единицы соединены гликозидной связью a или b конфигурации.
8. Соединения общей формулы (I) по п.7, выбранные из группы, состоящей из D- или L-рибозы, D- или L-арабинозы, D- или L-ксилозы, D-или L-ликсозы, D- или L-аллозы, D- или L-альтрозы, D- или L-глюкозы, D- или L-маннозы, D- или L-гулозы, D- или L-идозы, D- или L-галактозы, D- или L-талозы, D- или L-аллулозы, D- или L-фруктозы, D- или L-сорбозы, D- или L-тагатозы, 5-дезокси-D- или L-арабинозы, 2-дезокси-D- или L-глюкозы, 2-дезокси-D- или L-галактозы, 2-дезокси-D-или L-арабинозы, 2-дезокси-D- или L-рибозы, D- или L-фукозы, D- или L-рамнозы; D-глюкозамина, D-маннозамина, D-галактозамина, даунозамина, акозамина и их N-ацилатных производных с низшими жирными кислотами, т. е. содержащих N-формильный, ацетильный, пропионильный, бутирильный остатки; глюкуроновой кислоты, галактуроновой кислоты; целлобиозы, лактозы, мальтозы, D-лактозамина, целлотриозы, мальтотриозы; трис(гидроксиметил)метила, D- или L-арабита, D- или L-эритрита, D- или L-персеита, D- или L-рибита, D- или L-сорбита, D- или L-ксилита; или остатков винной кислоты, глутаровой кислоты, глюконовой кислоты, бицина, хинной кислоты, слизевой кислоты, глюкозаминовой кислоты.
9. Соединения общей формулы (I) по п.1, в которых, если одна или обе группы R1 и R4 являются гидрофильными, обе группы R2 и R3 являются гидрофобными, или наоборот.
10. Соединения по п. 1, которые представляют собой
i) цикло([Asn(b -D-Glc)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 1)
ii) цикло([Ser(b -D-Glc)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 2)
iii) цикло([Asn(b -D-2-дезокси-2-амино-Glc)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 3)
iv) цикло([Аsn(b -D-2-дезокси-2-ацетамидо-Glc)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 4)
v) цикло([Nlе-Аsр-Тгр-Рhе-Dар-Аsn(b -D-2-дезокси-2-ацетамидо-Glс)]цикло(2b -5b )) (SEQ ID ь 5)
vi) цикло([Аsn(b -D-рибофуранозил)-Аsр-Тгр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь 6)
vii) цикло([Sеr(b -D-рибофуранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 7)
viii) цикло([Аsn(b -L-арабинофуранозил)-Аsр-Тгр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь 8)
ix) цикло([Sеr(b -L-арабинофуранозил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь 9)
x) цикло([Аsn(b -D-маннопиранозил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь10)
xi) цикло([Ser(b -D-маннопиранозил)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 11)
xii) цикло([Asn(b -D-галактопиранозил)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 12)
xiii) цикло([Sеr(b -D-галактопиранозил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b ))(SEQ ID ь 13)
xiv) цикло([Asn(b -D-глюкуронопиранозил)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 14)
xv) цикло([Ser(b -D-глюкуронопиранозил)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 15)
xvi) цикло([Asn(1-дезоксисорбитол-1-ил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b ))(SEQ ID ь 16)
xvii) цикло([Asn[[4-O-(a -D-Glc-b -D-Glc)]-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 17)
xviii) цикло([Аsn[(4-O-(a -D-галактопиранозил)-b -D-Glс)]-Аsр-Тrр-Рhе-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 18)
xix) цикло([Asn[O-a -D-Glc-(1-4)-O-a -D-Glc-(1-4)-a -D-Glc]-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 19)
xx) цикло([Аsn(D-2-дезоксиглюкопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь 20)
xxi) цикло([Dар[D(-)-хинил]-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь21)
xxii) цикло([Dар[D-глюконил]-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь 22)
xxiii) цикло([Dар[D-глюкурил]-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 23)
xxiv) цикло([Dар(2-сульфобензоил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 24)
xxv) цикло([Аsn(4-сульфофенил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 25)
xxvi) цикло([Asn(b -L-Glc)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь26)
xxvii) цикло([Аsn(b -D-2-дезоксиглюкопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2b -5b )) (SEQ ID ь 27)
xxviii) цикло([Аsn(b -D-2-дезоксиманнопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 28)
xxix) цикло([Asn(D-2-дезоксигалактопираноз-2-ил)-Asp-Trp-Phe-Dap-Leu]цикло(2b -5b )) (SEQ ID ь 29)
ххх) цикло([Аsn(b -D-ксилопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 30)
xxxi) цикло([Аsn(3-сульфопропионил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь31)
xxxii) цикло([Dap(лизил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 32)
xxxiii) цикло(Dар(аргинил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь33)
xxxiv) цикло([Dар(4-O-b -D-галактопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b ) (SEQ ID ь 34)
xxxv) цикло([Аsn(2-дезокси-2-трифторацетамидо-b -D-Glс)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2b -5b )) (SEQ ID ь 35).
11. Фармацевтическая композиция, включающая активное начало и подходящие носители, отличающаяся тем, что в качестве активного начала она содержит соединения общей формулы I по п.1 в эффективном количестве.
12. Способ лечения артрита, астмы, воспалений, опухолевого роста, желудочно-кишечной гипермотильности, болезни Гентингтона, неврита, невралгии, гемикрании, гипертензии, недержания мочи, крапивницы, симптомов карциноидного синдрома, гриппа и простуды, отличающийся тем, что при всех этих состояниях пациентам вводят дозу активного начала, состоящего из продуктов формулы (I) по п.1, в количестве 0,1-10 мг/кг веса тела.
Текст
1 Область изобретения Данное изобретение относится к новым бициклическим соединениям, полезным для использования в фармацевтических композициях в качестве антагонистов тахикининов, и к содержащим их фармацевтическим композициям. Предпосылки изобретения Рецептор NK2 тахикининов широко экспрессируется в периферической нервной системе млекопитающих. Одним из нескольких эффектов, вызываемых избирательной стимуляцией рецептора NR2, является сокращение гладких мышц. Поэтому, антагонисты рецептора NR2 можно рассматривать как агенты, способные контролировать гиперсокращение гладких мышц в любом патологическом состоянии, в котором высвобождение тахикининов способствует усилению соответствующего расстройства. В частности, бронхоспастический компонент астмы, кашель, легочные раздражения и местные спазмы мочевого пузыря и мочеточника во время цистита, инфекций и почечных колик могут быть рассматриваемыми состояниями, при которых введение антагонистов рецептора NK2 может быть эффективным (A. L. Magnan et al.Neuropeptides, 1993, 24, 199). Соединения, которые действуют как антагонисты тахикининов, и,в частности нейрокинин А, хорошо известны в литературе. Среди них особый интерес представляют циклические соединения (В. J. Williams et al. J. Med. Chem., 1993, 36, 2). Липофильность была определена как основное требование, для того чтобы иметь сильную антагонистическую активность в отношении рецептора NK2 тахикининов у ряда циклических псевдопептидов (L. Quartara et al. J. Med. Chem.,1994, 27) и, в частности, в случае бициклических гексапептидов (WO 93/21227). В настоящее время было неожиданно обнаружено, что продукты, структурно подобные описанным выше, но в которых, однако, присутствует, по меньшей мере, одна гидрофильная группа, не только сохраняют их высокое сродство in vitro,но также обнаруживают увеличение фармакологической активности in vivo по сравнению с соответствующими соединениями, не содержащими гидрофильных групп. Это еще более удивительно, если иметь в виду, что моноциклические пептиды, обладающие антагонистическими свойствами, подобными свойствам тахикининов, не обнаруживают какого-либо увеличения фармакологической активности при введении гидрофильных групп на структуру цикла [Int. J. Peptide Protein Res.(1984), 44:2, 105-111]. Сущность изобретения Данное изобретение относится к новым соединениям общей формулы (I) где X1, X2, Х 3, Х 4, Х 5 и Х 6, одинаковые или различные, представляют собой группу -NR'COили -CONR'-, где R' является Н или C1-3 алкилом;Y представляет собой группу, выбранную из -NRCO-, -CONR- или -SS-, где R является Н или C1-3-алкилом; по меньшей мере, одна из групп R1, R2, R3 и R4, одинаковых или различных, является гидрофильной, а остальные группы являются гидрофобными;m и n, одинаковые или различные, представляют собой каждый целое число от 1 до 4; и к содержащим их фармацевтическим композициям. Подробное описание изобретения Данное изобретение относится к новым соединениям, имеющим общую формулу (I) где группы X1, Х 2, Х 3, Х 4, Х 5, Х 6, Y, R1, R2, R3,R4, m и n имеют приведенные выше значения; способам их получения и содержащим их фармацевтическим композициям. Формула (I), приведенная выше, рассматривается в качестве формулы, дающей наилучшее представление истинной пространственной структуры бициклического пептида в соответствии с данным изобретением. Однако также и следующая формула (Iа) (которая, говоря химическим языком, идентична формуле (I приводится для того, чтобы сделать более легким понимание соединений, описываемых далее в примерах, с их химическими названиями, в частности когда дело касается групп X1-6 и Y. 3 Группы X1-6 и Y на самом деле определяются в соответствии с аминокислотной последовательностью от внешнего N- конца до Сконца пептида, как они представлены в линейной структуре, поэтому при чтении формулы(Iа) не возникает проблем в понимании линейной структуры, сообщенной в примерах. Как можно видеть, соединения формулы(I), описанные выше, предоставляют хиральные центры: понятно, что данное изобретение относится также к нескольким энантиомерам. Более конкретно, гидрофобные группы могут быть независимо выбраны из следующих групп:b) линейных или разветвленных алкильных групп, соответствующих CnH2n-U-W, где n=1-4;U = O, COO, CONH, S и W = алкильная, арильная или алкиларильная группа, содержащая от 1 до 15 атомов углерода;c) (СН 2)n-С 6 Н 3-А-В, где n=0, 1-3; А и В,расположенные в любом из орто-, мета- или параположений, одинаковые или различные,обозначают Н, галоген, OR, NHR, NR2, СН 3, SR,где R представляет собой алкильную, арильную или алкиларильную группу с числом атомов углерода менее 10;e) (CH2)n -гетероцикла, где n=0, 1-3 и под термином гетероцикл имеют в виду: имидазолил-2-ил, индолил-3-ил, фуранил-3-ил, пиридил 3-ил, имидазолил-3-ил;f) группы -(CH2)s-, где s= 3, 4, необязательно ОН-замещенной или конденсированной с ароматической группой, которая циклизуется с одной или двумя соседними группами X1-6 с образованием боковой цепи пролина, гидроксипролина, октагидроиндол-2-карбоновой кислоты, тетрагидроизохинолиновой кислоты;g) боковой цепи природной гидрофобной аминокислоты;h) боковой цепи природной гидрофильной аминокислоты, замещенной соответствующим образом для превращения ее в гидрофобную;i) боковой цепи неприродных гидрофобных аминокислот, выбранных из группы, состоящей из: норлейцина, норвалина, аллоизолейцина, циклогексилглицина (Chg), -амино-нмасляной кислоты (Аbа), циклогексилаланина(Cha), аминофенилмасляной кислоты (Рbа), фенилаланинов, моно- и дизамещенных в положениях орто-, мета- и парабензольного кольца одной или несколькими из следующих групп: 4 алкилцистеина,S-алкилгомоцистеина,Nалкиллизина, N-алкилорнитина, N-алкил-2,3 диаминопропионовой кислоты. Более конкретно, боковая цепь гидрофобной аминокислоты, согласно параграфу (g), является боковой цепью аминокислоты, выбранной из группы, состоящей из: глицина, аланина,валина, изолейцина, метионина, фенилаланина,тирозина, триптофана, пролина, гистидина, аспарагина, глутамина. Боковая цепь гидрофильной аминокислоты, соответствующим образом замещенной для превращения ее в гидрофобную, согласно параграфу (h), является цепью аминокислоты, выбранной из группы, состоящей из: серина, треонина, цистеина, аспарагиновой кислоты, глутаминовой кислоты, карбоксиглутаминовои кислоты, аргинина, орнитина, лизина. Предпочтительно гидрофильные группы выбраны из группы L-Q, где L является химической связью или остатком линейного или разветвленного C1-6-алкила, a Q является гидрофильной группой. Предпочтительно Q выбран из группы, состоящей из: гуанидина, амина, М,ОМ, -CO-NH-M, -NH-CO-M, ароматической группы, моно-, ди- или тризамещенной в орто-,мета- или параположениях группами М или ОМ,где М является гидрофильной группой. Термин "гидрофильная группа", для Q и М, предпочтительно обозначает:ii) линейные или циклические C1-6 алкильные цепи, содержащие одну или несколько полярных групп;iv) остатки, несущие замещенные группы,которые в биологической среде гидролизуются,восстанавливая гидрофильную функцию. Что касается определения согласно параграфу (i) выше, имеются в виду предпочтительно гексозы или пентозы D или L ряда виликонфигурации, выбранные из группы, в которой все атомы углерода несут свободную или защищенную гидроксильную группу; один или несколько гидроксилов замещены: водородом,аминогруппой или ациламиногруппой; С 6 гексоз и C5 пентоз являются частью карбоксильной группы; и в которых необязательно присутствующие 2 или 3 гликозидные единицы соединены гликозидной связьюиликонфигурации. Характерными примерами гликозидных групп, определенных выше, являются: D- или Lрибоза, D- или L-арабиноза, D- или L-ксилоза,D- или L-ликсоза, D- или L-аллоза, D- или Lальтроза, D- или L-глюкоза, D- или L-манноза,D- или L-гулоза, D- или L-идоза, D- или Lгалактоза, D- или L-талоза, D- или L-аллулоза,D- или L-фруктоза, D-или L-сорбоза, D- или Lтагатоза; 5-дезокси-D- или L-арабиноза, 2 5 дезокси-D- или L-глюкоза, 2-дезокси-D- или Lгалактоза, 2-дезокси-D- или L-арабиноза, 2 дезокси-D- или L-рибоза, D- или L-фукоза, Dили L-рамноза; D-глюкозамин, D-маннозамин,D-галактозамин, даунозамин, акозамин и их Nацилатные производные с низшими жирными кислотами, т. е. имеющие N-формильный, ацетильный, пропионильный, бутирильный остаток; глюкуроновая кислота, галактуроновая кислота, целлобиоза, лактоза, мальтоза, Dлактозамин, целлотриоза, мальтотриоза и их защищенные производные. Определение согласно параграфу (ii) выше относится к цепям, произведенным из остатков полиолов, таких как трис-(гидроксиметил), Dили L-арабит, D- или L-эритрит, D- или Lгалактит, мезоинозит, D-или L-маннит, D- илиL-персеит, D- или L-рибит, D- или L-сорбит, Dили L-ксилит; или к цепям, произведенным из остатка винной кислоты, глутаровой кислоты,глюконовой кислоты, бицина, хинной кислоты,слизевой кислоты, глюкозаминовой кислоты. Среди продуктов формулы (I), представленной выше, особенно предпочтительны продукты, в которых, если одна или обе группы R1 и R4 являются гидрофильными, то оба R2 и R3 являются гидрофобными и vice versa. Соединения формулы (I), являющиеся объектом данного изобретения, могут быть синтезированы различными способами, известными в литературе (см., например, М. Bodansky, "Peptide Chemistry", Springer-Verlag, 1988), например, при помощи синтеза в растворе линейной пептидной цепи через последующее связывание соответствующим образом активированных Nзащищенных аминокислот с аминокислотой или с С-защищенной пептидной цепью с выделением промежуточных продуктов, последующим избирательным удалением защитных групп С- иN-концевых цепей, циклизации в полярных органических растворителях в разбавленном растворе, затем избирательного удаления защитных групп боковых цепей и, наконец, циклизации их в полярных органических растворителях в разбавленном растворе. Гидрофильный остаток может быть введен как в виде производного защищенной аминокислоты во время синтеза пептидной цепи, так и конъюгацией с уже образованным пептидом, как это описано широко в литературе. Подобным образом для получения этих соединений можно использовать синтез в твердой фазе пептидной цепи от С-конца до Nконца на нерастворимом полимерном носителе,циклизацию в твердой фазе между предварительно защищенными боковыми цепями, последующее отделение от полимерного носителя гидролизом в безводной фтористоводородной кислоте, содержащей подходящие акцепторы,или в трифторуксусной кислоте, содержащей подходящие акцепторы, или в водных основаниях, и циклизацию моноциклического пептида в полярных органических растворителях в раз 000697 6 бавленном растворе. Гидрофильный остаток вводят согласно описанным выше указаниям. Согласно конкретному способу получения, целевой продукт может быть получен в твердой фазе с использованием 2-хлортритильной смолы(Barlos et al., Int. J. Peptide Protein Res., 37, 513520, 1991), замещенной защищенной аминокислотой, имеющей группу Fmoc при N-конце; предпочтительно, чтобы аминокислота, непосредственно связанная со смолой, была аминокислотой с боковой цепью R1 или R3. После введения других аминокислот в эту последовательность пептид отделяют от смолы разбавленной уксусной кислотой и проводят первую циклизацию между свободными С-концевым и Nконцевым участками при помощи общепринятых классических способов синтеза. Затем боковые цепи аминокислот освобождают от защитных групп в положении 5 и 6, например,трифторуксусной кислотой, и становится возможной вторая циклизация. Другие синтетические пути вполне возможны и широко описаны в литературе, как упоминалось выше. Как указано выше, было обнаружено, что соединения формулы (I) являются сильными антагонистами рецептора NK2 тахикининов и,следовательно, могут вводиться в дозах, которые не превышают доз, требующихся для известных продуктов. Эти соединения могут быть использованы для лечения артрита, астмы, воспалений, опухолевого роста, желудочно-кишечной гипермотильности, болезни Гентингтона, невритов, невралгии, гемикрании, гипертензии, недержания мочи, крапивницы, симптомов карциноидного синдрома, гриппа и простуды. Соединения формулы (I), являющиеся объектом данного изобретения, пригодны для парентерального, перорального введения, введения ингаляцией, подъязычного введения для терапевтических целей высшим животным и человеку и дают фармакологические эффекты в соответствии с описанными выше признаками. Для парентерального введения (внутривенного,внутримышечного и чрескожного) используют стерильные растворы или лиофилизированные химические препараты. Для назального, ингаляционного и подъязычного введений, в соответствии с конкретным случаем, используют водные растворы, аэрозольные препараты или капсулы. Дозы активного начала в указанных выше композициях могут быть в диапазоне между 0,1 и 10 мг/кг веса тела. Пример 1. Получение цикло([Аsn(-DGlc)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2-5 (SEQa) Синтез линейного пептида H-AsnPeptide Protein res., 1991, 37, 513-520. Степень замещения смолы определяют дозированием группы Fmoc, и она была равна 0,364 мэкв/г. Следующие 4 аминокислоты связывают в виде свободных аминокислот с использованием избытка 3 аминокислот и HOBt (4 экв.) и DCC (3 экв.) в качестве активаторов при периодах времени 1 ч. Добавляют в следующем порядке:Fmoc-Dap(Boc)-OH, Fmoc-Phe-OH, Fmoc-TrpOH, Fmoc-Asp(OtBu)-OH. Последнюю аминокислоту присоединяют в виде Fmoc-Asn[(Ac4O)-D-Glc]-OPfp (Christiansen-Brams et al., J.Chem. Soc. Perkin Trans. I. 1993, 1461-1471), 2 экв., с HOBt (2 экв.) в качестве активатора в течение 3 ч. После удаления защитной группы Fmoc отделение от смолы выполняют суспендированием ее в 10 мл смеси АсОН, ТФК, ДХМ (1/1/8,об./об.) при комнатной температуре в течение 0,5 ч. После выпаривания растворителя в вакууме при 30 С проводят опять смешивание с водой и лиофилизируют. Выход неочищенного продукта: 405 мг (90%). ВЭЖХ: 70%, FAB-MS:b) Синтез бициклического продукта цикло([Asn(Ac4O)D-Glc)-Asp-Trp-Рhе-DарLeu]цикло(2-5 (соединения 2). Линейный неочищенный продукт циклизуют в 1 мМ растворе в ДМФ при 4 С с 1 экв. РуВОР и 1,2 экв. DIEA в течение 1 ч. Смесь сушат и очищают в ВЭЖХ с получением 156 мг чистого продукта (выход 39%). ВЭЖХ: 99%.FAB-MS: [М+Н]+ = 1248; tr = 18,4 мин. Защитные группы моноциклического продукта удаляют растворением его в 15 мл ТФК,содержащей воду при 10%. После 0,5 ч смесь разбавляют водой и лиофилизируют. Остаток растворяют в 1 мМ растворе в ДМФ, раствор охлаждают до 0 С и добавляют 1 экв. РуВОР и 1,2 экв. DIEA. После 5 ч его сушат и очищают в ВЭЖХ. Выход 45% (70 мг). ВЭЖХ: 99%. FABMS: [М+Н]+ = 1074; tr = 13,5 мин. с) Синтез бициклического продукта цикло([Аsn(-D-Glс)-Аsр-Тrр-Рhе-Dap-Lеu]цикло(2-5. 70 мг тетраацетилатного продукта растворяют в безводном метаноле в 5 мМ растворе. Раствор охлаждают до -20 С и добавляют 1 мМ раствор метилата натрия в метаноле для достижения рН 11. После 10 мин добавляют уксусную кислоту до получения нейтрального рН. Затем раствор сильно разбавляют водой и лио 000697a) Синтез линейного пептида H-Ser[(Bz4O)-D-Glc]-Asp(OtBu)-Trp-Phe-Dap(Boc)-Leu-OH. Здесь используют ту же самую процедуру,которая была использована для параграфа а) примера 1, до момента добавления последней аминокислоты, которую связывают в видеChem. Soc. Perkin Trans. I, 1994, 2615, 2619). Отделение от смолы проводят, как описано выше в примере 1. Выход в неочищенном продукте: 450 мг (83%). ВЭЖХ: 93%. FAB-MS:b) Синтез бициклического продукта цикло([Ser[(Bz4O)D-Glc]-Asp-Trp-Phe-DapLeu]цикло(2-5. Линейный неочищенный продукт циклизуют в 1 мМ растворе в ДМФ при 4 С с 1 экв. РуВОР и 1,2 экв. DIEA в течение 1 ч. Смесь сушат и очищают в ВЭЖХ с получением 0,16 г чистого продукта (выход 35%). ВЭЖХ: 99%.FAB-MS: [М+Н]+ = 1469; tr = 25,3 мин. Защитные группы моноциклического продукта удаляют его ожижением в 10 мл ТФК,содержащей воду при 10%. После 0,5 ч смесь разбавляют в воде и лиофилизируют. Остаток растворяют в 1 мМ растворе в ДМФ, раствор доводят до 0 С и добавляют 1 экв. РуВОР и 1,2 экв. DIEA. После 24 ч его сушат и очищают в ВЭЖХ. Выход 63 мг (45%). ВЭЖХ: 99%. FABMS: [М+Н]+ = 1295; tr = 21,6 мин.c) Синтез бициклического продукта цикло([Ser(-D-Glc)-Asp-Trp-Phe-Dap-Lеu]цикло (2-5. 20 мг тетрабензоилатного продукта растворяют в безводном метаноле в 5 мМ растворе. Раствор доводят до -20 С и добавляют 1 мМ раствор метилата натрия в метаноле с получением рН 11. После 1,5 ч добавляют уксусную кислоту для достижения нейтрального рН,сильно разбавляют водой и лиофилизируют. Выход: 6,5 мг (48%). ВЭЖХ: 99%. FAB-MS:[М+Н]+ = 878; tr = 9,6 мин. При помощи подобных процедур были получены следующие соединения. Пример 3. Цикло([Аsn(-D-2-дезокси-2 амино-Glc)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5-CH2-CO-NH-(-D-2-дезокси-2-амино-Glс),другие заместители соответствуют описанным в примере 1].R4 = -СН 2-СО-NН-(-D-2-дезокси-2-ацетамидоGlс), а другие заместители соответствуют описанным в примере 1]. Пример 5. Цикло([Nlе-Аsр-Тгр-Рhе-DарАsn(-D-2-дезокси-2-ацетамидо-Glс)-цикло(25 (SEQ ID5) [соединение формулы (I), гдеR1 = -CH2-CO-NH-(-D-2-дезокси-2-ацетамидоGlс), R4 = -(СН 2)3-СН 3], а другие заместители соответствуют описанным в примере 1]. Пример 6. Цикло([Asn(-D-рибофуранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5 (SEQID6) [соединение формулы (I), где R4 = -CH2CO-NH-(-D-рибофуранозил), а другие заместители соответствуют описанным в примере 1]. Пример 7. Цикло([Sеr(-D-рибофуранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5 (SEQID7) [соединение формулы (I), где R4 = -CH2O-(-D-рибофуранозил), а другие заместители соответствуют описанным в примере 1]. Пример 8. Цикло([Аsn-(-L-арабинофуранозил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2-5-CH2-CO-NH-(-L-арабинофуранозил), а другие заместители соответствуют описанным в примере 1]. Пример 9. Цикло([Ser-(-L-арабинофуранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5-CH2-O-(-L-арабинофуранозил), а другие заместители соответствуют описанным в примере 1]. Пример 10. Цикло([Asn-(-D-маннопиранозил)-Asp-Trp-Phe-Dap-7-Leu]цикло(2-5= -CH2-CO-NH-(-D-маннопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 11. Цикло([Ser(-D-маннопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло (2-5 (SEQ-CH2-O-(-D-маннопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 12. Цикло([Аsn-(-D-галактопиранозил)-Аsр-Тгр-Рhе-Dар-Leu]цикло (2-5= -CH2-CO-NH-(-D-галактопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 13. Цикло([Sеr(-D-галактопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5= -CH2-O-(-D-галактопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 14. Цикло([Аsn(-D-глюкуронопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5= -CH2-CO-NH-(-D-глюкуронопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 15. Цикло([Sеr(-D-глюкуронопиранозил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2-5= -CH2-O-(-D-глюкуронопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 16. Цикло([Аsр(1-дезоксисорбитол-1-ил)Аsр-Тrр-Рhе-Dар-Lеu]цикло(2-5= -CH2-CO-NH-(1-дезоксисорбитол-1-ил), а другие заместители соответствуют описанным в примере 1]. Пример 17. Цикло([Аsn([4-O-(-D-Glc)-D-Glc)]-Asp-Trp-Phe-Dap-Leu]цикло(2-5= -CH2-CO-NH-[4-O-(-D-Glc)D-Glc)], а другие заместители соответствуют описанным в примере 1]. Пример 18. Цикло([Аsn[4-O-(-D-галактопиранозил)D-Glc]-Аsр-Тrр-Рhе-Dар-Leu] цикло(2-5 (SEQ ID18) [соединение формулы (I), где R4= -СН 2-СО-NH-[4-O-(-Dгалактопиранозил)D-Glс)], а другие заместители соответствуют описанным в примере 1]. Пример 19. Цикло([Asn[OD-Glc-(1-4)OD-Glc-(1-4)D-Glc]-Asp-Trp-Phe-Dар-Leu] цикло(2-5 (SEQ ID19) [соединение формулы (I), где R4 = -CH2-CO-NH-[OD-Glc-(14)-OD-Glc-(1-4)D-Glc), а другие заместители соответствуют описанным в примере 1]. Пример 20. Цикло([Аsn(D-2-дезоксиглюкопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(I), где R4 = -СН 2-СО-NH-(D-дезоксиглюкопираноз-2-ил), а другие заместители соответствуют описанным в примере 1]. Пример 21. Цикло([Dар[D(-)-[хинил]-АsрТrр-Рhе-Dар-Lеu]цикло(2-5 (SEQ ID21)(-)-хинил], а другие заместители соответствуют описанным в примере 1]. Пример 22. Цикло([Dap[D-глюконил]-AspTrp-Phe-Dap-Leu]цикло(2-5 (SEQ ID22)[соединение формулы (I), где R4 = -СН 2-NН-(Dглюконил), а другие заместители соответствуют описанным в примере 1]. Пример 23. Цикло([Dар[D-глюкурил]-АsрТrр-Рhе-Dар-Lеu]цикло(2-5 (SEQ ID23)[соединение формулы (I), где R4 = -СН 2-NН-(Dглюкурил), а другие заместители соответствуют описанным в примере 1]. Пример 24. Цикло([Dар(2-сульфобензоил)Аsр-Тrр-Рhе-Dар-Lеu]цикло(2-5 (SEQ ID24) [соединение формулы (I), где R4 = -CH2-NHCO-C6H4-SO3H, a другие заместители соответствуют описанным в примере 1]. 11 Пример 25. Цикло([Аsn(4-сульфофенил)Аsp-Тrр-Рhе-Dар-Lеu]цикло(2-5 (SEQ ID25) [соединение формулы (I), где R4 = -CH2-CONH-C6H4-SO3H, а другие заместители соответствуют описанным в примере 1]. Пример 26. Цикло([Asn(-L-Glc)-Asp-TrpPhe-Dap-Leu]цикло(2-5 (SEQ ID26) [соединение формулы (I), где R4 = -CH2-CO-NH(L-GIc), а другие заместители соответствуют описанным в примере 1]. Пример 27. Цикло([Аsn(-D-2-дезоксиглюкопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(I), где R4 = -CH2-CO-NH-(D-2-дезоксиглюкопираноз-2-ил), а другие заместители соответствуют описанным в примере 1]. Пример 28. Цикло([Аsn(D-2-дезоксиманнопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(25 (SEQ ID28) [соединение формулы (I),где R4 = -СН 2-СО-NН-(D-2-дезоксиманнопираноз-2-ил), а другие заместители соответствуют описанным в примере 1]. Пример 29. Цикло([Аsn(D-2-дезоксигалактопираноз-2-ил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(I), где R4 = -СН 2-СО-NН-(D-2-дезоксигалактопираноз-2-ил), а другие заместители соответствуют описанным в примере 1]. Пример 30. Цикло([Аsn(-O-ксилопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5 (SEQID30) [соединение формулы (I), где R4 = CH2-CO-NH-(-D-ксилопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 31. Цикло([Аsn(3-сульфопропионил)-Аsр-Тrр-Рhе-Dар-Lеu]цикло(2-5 (SEQID31) [соединение формулы (I), где R4 = CH2-CO-NH-(3-сульфопропионил), а другие заместители соответствуют описанным в примере 1]. Пример 32. Цикло([Dар(лизил)-Аsр-ТrрРhе-Dар-Lеu]цикло(2-5 (SEQ ID32) [соединение формулы (I), где R4 = -СН 2-СО-NН(лизил), а другие заместители соответствуют описанным в примере 1]. Пример 33. Цикло([Dар(аргинил)-Аsр-ТrрРhе-Dар-Lеu]цикло(2-5 (SEQ ID33) [соединение формулы (I), где R4 = -СН 2-СО-NН(аргинил), а другие заместители соответствуют описанным в примере 1]. Пример 34. Цикло([Dар(4-OD-галактопиранозил)-Аsр-Тrр-Рhе-Dар-Leu]цикло(2-5= -CH2-CO-NH-(4-OD-галактопиранозил), а другие заместители соответствуют описанным в примере 1]. Пример 35. Цикло([Аsn(2-дезокси-2-трифторацетамидоD-Glс)-Аsр-Тrр-Рhе-Dар-Leu] цикло(2-5 (SEQ ID35) [соединение формулы (I), где R4 = -СН 2-СО-NН-(2-дезокси-2 000697 трифторацетамидоD-Glс), а другие заместители соответствуют описанным в примере 1]. Биологическая активность Способность соединений данного изобретения взаимодействовать в качестве агонистов или антагонистов с нейрокинином A (NKA) оценивали в тесте in vitro с использованием легочной артерии кролика (RPA) (Rovero et al.,Neuropeptides, 1989, 13, 263-270) и их активность определяли как рКв (антилогарифм константы диссоциации), как описано Jenkinson etal., TIPS, 12, 53-56, 1991. Например соединение 2 показало рКв = 8,67. Способность продуктов данного изобретения взаимодействовать в качестве агонистов или антагонистов с рецепторомNKA оценивали in vivo как способность, после внутривенного введения, ингибировать индуцированные агонистом [бетаАlа 8] NKA (4-10) сокращения мочевого пузыря у анестезированной мыши, как описано Maggi et al., J. Pharmacol.Exp. Ther., 1991, 257, 1172. Соединение 1, например, вызывает при дозе 10 нмоль/кг (i.v.) ингибиторный эффект 50-70%, как это было определено в различных временных точках. Эффект сохранялся на протяжении периода более 3 ч. Аббревиатуры(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID35: Хаа Asp Trp Phe Xaa Leu 1 5 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Бициклические соединения общей формулы где X1, Х 2, Х 3, Х 4, Х 5 и Х 6, одинаковые или различные, представляют собой группу -NR'COили -CONR'-, где R' является Н или C1-3 алкилом;Y представляет собой группу, выбранную из -NRCO-, -CONR- или -SS-, где R является Н или C1-3-алкилом; по меньшей мере, одна из групп R1, R2, R3 и R4,одинаковых или различных, является гидрофильной, а остальные группы являются гидрофобными;m и n, одинаковые или различные, представляют собой каждый целое число от 1 до 4. 2. Соединения по п.1, где гидрофобные группы могут быть независимо выбраны из следующих групп:b) линейных или разветвленных алкильных групп, соответствующих CnH2n-U-W, где n=1-4;U=O, COO, CONH, S и W=алкильная, арильная или алкиларильная группа, содержащая от 1 до 15 атомов углерода;c) (СН 2)n-С 6 Н 3-А-В, где n=0, 1-3; А и В,расположенные в любом из орто-, мета- или параположений, одинаковые или различные,представляют собой Н, галоген, OR, NHR, NR2,СН 3, SR, где R представляет собой алкильную,арильную или алкиларильную группу с числом атомов углерода менее 10;e) (СН 2)n-гетероцикла, где n=0, 1-3 и под термином гетероцикл имеют в виду: имидазо 35 лил-2-ил, индолил-3-ил, фуранил-3-ил, пиридил 3-ил, имидазолил-3-ил;f) группы -(CH2)s-, где s= 3, 4, необязательно ОН-замещенной или конденсированной с ароматической группой, которая циклизуется с одной или двумя соседними группами X1-6 с образованием боковой цепи пролина, гидроксипролина, октагидроиндол-2-карбоновой кислоты, тетрагидроизохинолиновой кислоты;g) боковой цепи природной гидрофобной аминокислоты;h) боковой цепи природной гидрофильной аминокислоты, замещенной соответствующим образом для превращения ее в гидрофобную;i) боковой цепи неприродных гидрофобных аминокислот, выбранных из группы, состоящей из норлейцина, норвалина, аллоизолейцина, циклогексилглицина (Chg), -амино-нмасляной кислоты (Аbа), циклогексилаланина(Cha), аминофенилмасляной кислоты (Рbа), фенилаланинов, моно- и дизамещенных в положениях орто-, мета- и парабензольного кольца одной или несколькими из следующих групп:C1-10-алкила, C1-10-алкокси, галогена, -2 тиенилаланина,-3-тиенилаланина,-2 фуранилаланина, -3-фуранилаланина, -2 пиридилаланина, -3-пиридилаланина, -4 пиридилаланина, -(1-нафтил)аланина, -(2 нафтил)аланина, O-алкилированных производных серина,треонина,тирозина,Sалкилцистеина,S-алкилгомоцистеина,Nалкиллизина, N-алкилорнитина, N-алкил-2,3 диаминопропионовой кислоты. 3. Соединения по п.2, в которых боковая цепь гидрофобной аминокислоты согласно параграфу g) является боковой группой аминокислоты, выбранной из группы, состоящей из глицина, аланина, валина, лейцина, изолейцина,метионина, фенилаланина, тирозина, триптофана, пролина, гистидина, аспарагина, глутамина. 4. Соединения по п.2, в которых боковая цепь гидрофильной кислоты, подходящим образом замещенной согласно параграфу h), является боковой цепью аминокислоты, выбранной из группы, состоящей из серина, треонина, цистеина, аспарагиновой кислоты, глутаминовой кислоты, т-карбоксиглутаминовой кислоты, аргинина, орнитина, лизина. 5. Соединения по п.2, в которых гидрофильные группы выбраны из группы L-Q, где L является химической связью или линейной или разветвленной C1-6-алкильной группой, a Q выбран из группы, состоящей из:ii) линейной, разветвленной или циклической C1-6-алкильной цепи, содержащей одну или несколько таких групп, как гидроксил, амино,гуанидин, карбоксил, сульфат, фосфат;v) гидрофильной группы согласно пунктамi)-iv), защищенной группами, которые биологически гидролизуются с повторным образованием гидрофильной группы. 6. Соединения по п.5, в которых группа М выбрана из группы, состоящей из:ii) линейной, разветвленной или циклической C1-6-алкильных цепей, содержащих одну или несколько таких групп, как гидроксил, амино, гуанидин, карбоксил, сульфат, фосфонат,фосфат. 7. Соединения формулы (I) по п.6, в которых гликозидные остатки выбраны из группы,состоящей из гексоз или пентоз D- или L-ряда виликонфигурации, выбранных из группы,где все атомы углерода несут свободную или защищенную гидроксильную группу; один или несколько гидроксилов замещены водородом,амино- или ациламиногруппой; С 6 гексоз и С 5 пентоз являются частью карбоциклической группы; и где необязательно присутствующие 2 или 3 гликозидные единицы соединены гликозидной связьюиликонфигурации. 8. Соединения общей формулы (I) по п.7,выбранные из группы, состоящей из D- или Lрибозы, D- или L-арабинозы, D- или L-ксилозы,D-или L-ликсозы, D- или L-аллозы, D- или Lальтрозы, D- или L-глюкозы, D- или L-маннозы,D- или L-гулозы, D- или L-идозы, D- или Lгалактозы, D- или L-талозы, D- или L-аллулозы,D- или L-фруктозы, D- или L-сорбозы, D- или Lтагатозы, 5-дезокси-D- или L-арабинозы, 2 дезокси-D- или L-глюкозы, 2-дезокси-D- или Lгалактозы, 2-дезокси-D-или L-арабинозы, 2 дезокси-D- или L-рибозы, D- или L-фукозы, Dили L-рамнозы; D-глюкозамина, D-маннозамина, D-галактозамина, даунозамина, акозамина и их N-ацилатных производных с низшими жирными кислотами, т. е. содержащих Nформильный, ацетильный, пропионильный, бутирильный остатки; глюкуроновой кислоты,галактуроновой кислоты; целлобиозы, лактозы,мальтозы, D-лактозамина, целлотриозы, мальтотриозы; трис(гидроксиметил)метила, D- илиL-арабита, D- или L-эритрита, D- или Lперсеита, D- или L-рибита, D- или L-сорбита, Dили L-ксилита; или остатков винной кислоты,глутаровой кислоты, глюконовой кислоты, бицина, хинной кислоты, слизевой кислоты, глюкозаминовой кислоты. 9. Соединения общей формулы (I) по п.1, в которых, если одна или обе группы R1 и R4 являются гидрофильными, обе группы R2 и R3 являются гидрофобными, или наоборот.(2-5 (SEQ ID35). 11. Фармацевтическая композиция, включающая активное начало и подходящие носители, отличающаяся тем, что в качестве активного начала она содержит соединения общей формулы I по п.1 в эффективном количестве. 12. Способ лечения артрита, астмы, воспалений, опухолевого роста, желудочно-кишечной гипермотильности, болезни Гентингтона, неврита, невралгии, гемикрании, гипертензии, недержания мочи, крапивницы, симптомов карциноидного синдрома, гриппа и простуды, отличающийся тем, что при всех этих состояниях пациентам вводят дозу активного начала, состоящего из продуктов формулы (I) по п.1, в количестве 0,1-10 мг/кг веса тела.
МПК / Метки
МПК: A61K 38/12, C07K 7/22
Метки: тахикининов, фармацевтической, антагонисты, композиции, применение, бициклические, получение
Код ссылки
<a href="https://eas.patents.su/20-697-biciklicheskie-antagonisty-tahikininov-ih-poluchenie-i-primenenie-v-farmacevticheskojj-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические антагонисты тахикининов, их получение и применение в фармацевтической композиции</a>
Предыдущий патент: Способ получения 2н-1-бензопиранов
Следующий патент: Способ получения n-метил-2-(3, 4 -диметоксифенил)этиламина
Случайный патент: Сульфоновые соединения в качестве лигандов 5-ht6 рецептора
























