Таксоиды, способы их получения и фармацевтическая композиция на их основе
Формула / Реферат
1. Таксоиды общей формулы (I)
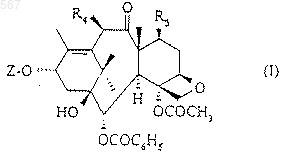
в которой Z означает радикал общей формулы (II)
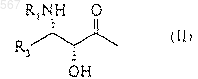
в которой R1 означает бензоильный радикал или радикал
R2-O-CO-,
в котором R2 означает алкильный радикал с 1-8 атомами углерода,
R3 означает фенил,
R4 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи,
R5 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи, возможно замещенный алкоксирадикалом с 1-4 атомами углерода.
2. Таксоиды по п.1, отличающиеся тем, что Z означает радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикал
R2-O-CO-,
в котором R2 означает трет.-бутильный радикал и R3 означает фенил.
3. Таксоиды по п.1, отличающиеся тем, что Z означает радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикал
R2-O-CO-,
в котором R2 означает трет.-бутильный радикал, и
R3 означает фенил, R4 и R5, одинаковые или разные, означают, каждый, метокси-, этокси-, или пропоксирадикал.
4. Способ получения таксоидов, описанных в любом из пп.1, 2 или 3, где Z означает радикал общей формулы (II), заключающийся в том, что этерифицируют соединение общей формулы (III):
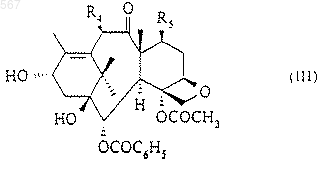
в которой R4 и R5 имеют значения, указанные в любом из пп.1, 2 или 3, с помощью кислоты общей формулы (IV)
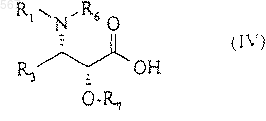
в которой R1 и R3 имеют вышеуказанные значения,
R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл, или с помощью производного этой кислоты для получения сложного эфира общей формулы (V)
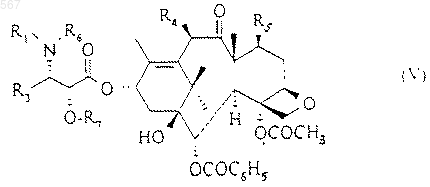
в которой R1, R3, R4, R5, R6 и R7 имеют вышеуказанные значения, защитные группы которого, обозначаемые R6 и R7, заменяют атомами водорода.
5. Способ по п.4, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в присутствии агента конденсации и активирующего агента в органическом растворителе при температуре от -10шС до 90шС.
6. Способ по п.4, отличающийся тем, что если R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл общей формулы (VI)
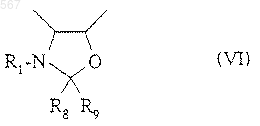
в котором R1 имеет вышеуказанное значение,
R8 и R9, одинаковые или разные, означают атом водорода или фенил, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода,
защитную группу, образуемую R6 и R7, заменяют атомами водорода следующим образом:
когда R1 означает бензоильный радикал или радикал R2O-CO-, в котором R2 имеет вышеуказанное значение;
R8 означает фенил, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода; и
R9 означает атом водорода,
защитную группу, образуемую R6 и R7, заменяют атомами водорода в присутствии неорганической или органической кислоты, используемой индивидуально или в смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе, выбираемом среди спиртов, при температуре от -10шС до 60шС, предпочтительно при 15-30шС.
7. Способ получения таксоидов, описанных в любом из пп.1, 2 или 3, в котором Z означает радикал общей формулы (II), R4 и R5 имеют указанное в любом из пп.1, 2 или 3 значение, заключающийся в том, что продукт общей формулы (XVI)
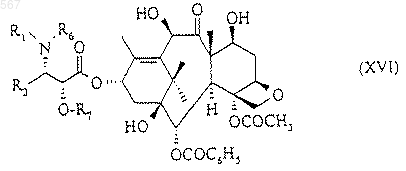
в которой R1, R3, R6 и R7 имеют указанное в любом из пп.1, 2, 3 или 4 значение, обрабатывают с помощью соединения общей формулы (X)
(R)3-Si-Гал (X),
в которой значения радикала R, одинаковые или разные, означают алкильный радикал с 1-6 атомами углерода, с получением соединения общей формулы (XVII)

в которой R, R1, R3, R6 и R7 имеют вышеуказанное значение, которое переводят в функциональные производные по положению 10 с помощью соединения общей формулы (XII)
R'4-X1 (XII),
в которой R'4 означает радикал такой, что R'4-O идентичен R4, который имеет указанное в любом из пп.1, 2 или 3 значение, и X1 означает атом галогена или остаток реакционноспособного сложного эфира, с получением соединения общей формулы (XVIII)
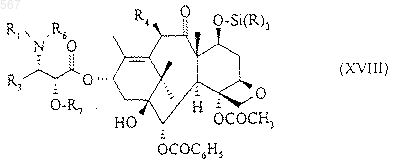
в которой R, R1, R3, R4, R6 и R7 имеют вышеуказанное значение, силилированную защитную группу которого заменяют атомом водорода для получения продукта общей формулы (XIX)
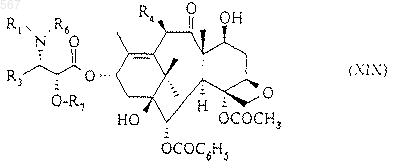
который после взаимодействия с соединением общей формулы (XV) приводит к соединению общей формулы (V), защитные группы которого заменяют атомами водорода для получения продукта общей формулы (I), в которой Z означает радикал общей формулы (II).
8. Способ получения таксоидов, описанных в любом из пп.1, 2 или 3, заключающийся в том, что активированный никель Ренея в присутствии алифатического спирта с 1-3 атомами углерода или простого эфира вводят во взаимодействие с соединением общей формулы (XXI)
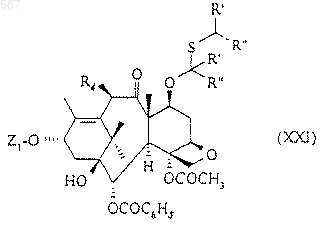
в которой R4 имеет указанное в любом из пп.1, 2 или 3 значение,
R' и R" означают атом водорода, и
Z1 означает атом водорода или радикал общей формулы (XXII)
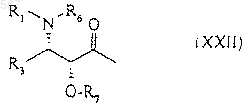
в которой R1 и R3 имеют указанное в любом из пп.1-3 значение, и
R6 и R7 имеют указанное в п. 4 значение, с получением соединения формулы (XXIII)
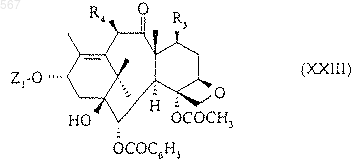
а в случае, когда Z1 означает радикал общей формулы (XXII), заменяют защитные группы, обозначаемые как R6 и R7, на атомы водорода в условиях по п.6
9. Способ получения по п.8, отличающийся тем, что работают при температуре от -10шС до 60шС.
10. Таксоид по п.1, отличающийся тем, что он представляет собой 4a -ацетокси-2a -бензоилокси-5b ,20-эпокси-1b -гидрокси-7b ,10b -диметокси-9-оксо-такс-11-ен-13a -ил-(2R,3S) -3-трет.бутоксикарбониламино-2-гидрокси-3-фенил-пропионат.
11. Таксоид по п.1, отличающийся тем, что он представляет собой 4a -ацетокси-2a -бензоилокси-1b -гидрокси-5b ,20-эпокси-7b -метокси-10b -этокси-9-оксо-такс-11-ен-13a -ил-(2R,3S)-3-тЁхт.бутоксикарбониламино-2-гидрокси-3-фенил-пропионат.
12. Таксоид по п.1, отличающийся тем, что он представляет собой 4a -ацетокси-2a -бензоилокси-1b -гидрокси-5b ,20-эпокси-7b -метокси-10b -(1-пропил)окси-9-оксо-такс-11-ен-13a -ил(2R,3S)-3-трет.бутоксикарбониламино-2-гидрокси-3-фенил-пропионат.
13. Способ получения соединения по п.10, заключающийся в том, что на первом этапе 4a -ацетокси-2a -бензоилокси-5b ,20-эпокси-1b ,7b ,10b -тригидрокси-9-оксо-такс-11-ен-13a -ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил-4-фенил-1,3-оксазолидин-5-карбоксилат обрабатывают диметилсульфоксидом в присутствии уксусной кислоты, на втором этапе полученный 4a -ацетокси-2a -бензоилокси-5b ,20-эпокси-1b -гидрокси-7b ,10b -бис(метилтиометокси)-9-оксо-такс-11-ен-13a -ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат подвергают взаимодействию с этанольной суспензией никеля Ренея, и на третьем этапе полученный 4a -ацетокси-2a -бензоилокси-5b ,20-эпокси-1b -гидрокси-7b , 10b -диметокси-9-оксо-такс-11-ен-13a -ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат подвергают взаимодействию с этанольным раствором соляной кислоты.
14. Таксоиды общей формулы (I), в которой Z означает атом водорода, a R4 и R5 имеют значения, указанные в п.1.
15. Способ получения таксоидов, описанных в п.14, заключающийся в том, что 10-дезацетил-баккатин III формулы (IX)
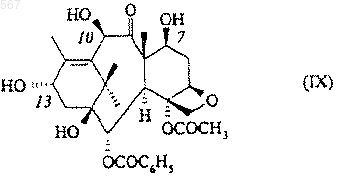
обрабатывают силилгалогенидом общей формулы:
(R)3-Si-Гал (X),
в которой значения радикала R, одинаковые или разные, означают алкильный радикал с 1-6 атомами углерода, с получением соединения общей формулы (XI)
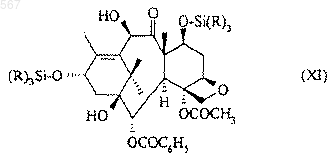
в которой R имеет вышеуказанное значение, которое обрабатывают соединением общей формулы (XII)
R'4-X1 (XII),
в которой R'4 означает радикал такой, что R'4-O идентичен радикалу R'4, имеющему указанное в любом из пп.1, 2 или 3 значение, и
X1 означает атом галогена или остатка реакционноспособного сложного эфира с получением соединения общей формулы (XIII)
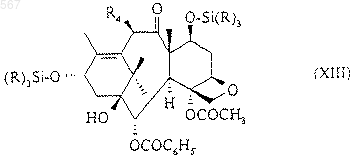
в которой R и R4 имеют вышеуказанное значение, в котором силилированные защитные группы заменяют атомами водорода с получением соединения общей формулы (XIV)
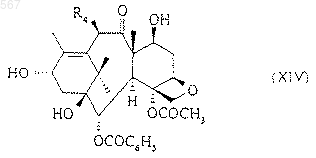
в которой R4 имеет вышеуказанное значение, которое селективно этерифицируют в положении 7 путем обработки соединением общей формулы (XV)
R'5-X2 (XV),
в которой R'5 означает радикал такой, что R'5-O идентичен R'5, имеющему указанное в любом из пп.1, 2 или 3 значение, и Х2 означает атом галогена, с получением соединения общей формулы (I), в которой Z означает атом водорода.
16. 4a -Ацетокси-2a -бензоилокси-5b , 20-эпокси-1b -гидрокси-7b ,10b -бис (метилтиометокси)-9-оксо-такс-11-ен-13a -ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат.
17. Фармацевтическая композиция на основе таксоидного соединения, отличающаяся тем, что в качестве таксоидного соединения она содержит, по крайней мере, одно соединение по любому из пп.1, 2 или 3, в котором Z означает радикал общей формулы (II), в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и, возможно, одним или несколькими совместимыми и фармакологически активными соединениями.
18. Фармацевтическая композиция по п. 17, отличающаяся тем, что она содержит, по крайней мере, одно соединение по п.10 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и, возможно, с одним или несколькими совместимыми и фармакологически активными соединениями.
19. Фармацевтическая композиция по п.17, отличающаяся тем, что она содержит, по крайней мере, одно соединение по п.11 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и, возможно, с одним или несколькими совместимыми и фармакологически активными соединениями.
20. Фармацевтическая композиция по п. 17, отличающаяся тем, что она содержит, по крайней мере, одно соединение по п.12 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и, возможно, одним или несколькими совместимыми и фармакологически активными соединениями.
Текст
Изобретение относится к области синтеза новых биологически активных соединений. Более конкретно, изобретение относится к новым таксоидам общей формулы (I) в которой R4 и R5 имеют вышеуказанное значение, с помощью кислоты общей формулы (IV): в которойZ означает атом водорода или радикал общей формулы (II) :R1 означает бензоильный радикал или радикалR2 означает алкильный радикал с 1-8 атомами углерода,R3 означает фенил,R4 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи,R5 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи (возможно, замещенный алкоксирадикалом с 1-4 атомами углерода). Предпочтительно, радикалы R4 и R5, одинаковые или разные, означают линейные или разветвленные алкоксильные радикалы с 1-6 атомами углерода, возможно замещенные метокси- или этокси- радикалом. Более предпочтительно, настоящее изобретение относится к продуктам общей формулы(I), в которой Z означает атом водорода или радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикал R2-O-CO-,в котором R2 означает трет.-бутильный радикал,и R3 означает фенил. Еще более предпочтительно, настоящее изобретение относится к продуктам общей формулы (I), в которой Z означает атом водорода или радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикалR5, одинаковые или разные, означают, каждый,метокси-, этокси-, или пропокси-радикал. Соединения общей формулы (I), в которойZ означает радикал общей формулы (II), обладают ценными противоопухолевыми и антилейкемическими свойствами. Согласно настоящему изобретению, новые продукты общей формулы (I), в которой Z означает радикал общей формулы (II), могут быть получены путем этерификации соединения общей формулы (III): в которой R1 и R3 имеют вышеуказанное значение,R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл,или с помощью производного этой кислоты для получения сложного эфира общей формулы (V): в которой R1, R3, R4, R5, R6 и R7 имеют вышеуказанное значение, с последующей заменой защитных групп, обозначаемых как R6 и R7, атомами водорода. Этерификацию до сложного эфира с помощью кислоты общей формулы (IV) можно осуществлять в присутствии агента конденсации (карбодиимид, реакционноспособный карбонат) и активирующего агента (аминопиридины) в органическом растворителе (простые эфиры, сложные эфиры, кетоны, нитрилы, алифатические углеводороды, галогенированные алифатические углеводороды, ароматические углеводороды) при температуре от -10 С до 90 С. Предпочтительно R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл. Замену защитных групп R6 и R7 атомами водорода можно осуществлять следующим образом: когда R6 и R7 вместе образуют насыщенный пятичленный или шестичленный гетероцикл и преимущественно оксазолидиновый цикл общей формулы (VI):R8 и R9, одинаковые или разные, означают атом водорода или фенил, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, 3 то замену защитной группы, образуемойR6 и R7, на атомы водорода можно осуществлять следующим образом: когда R1 означает бензоильный радикал или радикалR2 имеет вышеуказанное значение,R8 означает фенил, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, иR7, на атомы водорода осуществляют в присутствии неорганической кислоты (соляная кислота, серная кислота) или органической кислоты(уксусная кислота, метансульфокислота, трифторметансульфокислота,п-толуолсульфокислота), которую используют индивидуально или в смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе, выбираемом среди спиртов, при температуре от -10 С до 60 С, предпочтительно при 15-30 С. Согласно изобретению, продукты общей формулы (III), то есть продукты общей формулы (I), в которой Z означает атом водорода, R4 иR5 имеют вышеуказанное значение, могут быть получены из 10-дезацетил-баккатина (III) формулы (IX): Особенно предпочтительно селективно защищать гидроксильные функции в положениях 7 и 13, например, в форме простого силилированного диэфира, который может быть получен путем воздействия силилгалогенида общей формулы (X):(X) в которой R, одинаковые или разные, означают алкильный радикал с 1-6 атомами углерода,на 10-дезацетил-баккатин (III) с получением соединения общей формулы (XI): в которой R имеет вышеуказанное значение,которое затем обрабатывают соединением общей формулы (XII):X1 означает атом галогена,для получения продукта общей формулы в которой R и R4 имеют вышеуказанное значение, затем силилированные защитные группы полученного соединения заменяют атомами водорода для получения продукта общей формулы (XIV): в которой R4 имеет вышеуказанное значение,который селективно этерифицируют в положении 7 путем воздействия соединением общей формулы (XV):R5' означает радикал, такой, что R5'-O идентичен радикалу R5, имеющему вышеуказанное значение, а Х 2 означает атом галогена для получения продукта общей формулы (III). Обычно обработку силилированным производным общей формулы (X) 10-дезацетилбаккатина (III) осуществляют в пиридине или триэтиламине, возможно, в присутствии органического растворителя, такого, как ароматический углеводород, такой как бензол, толуол и ксилолы, при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси. Обычно взаимодействие соединения общей формулы (XII) с соединением общей формулы (XI) осуществляют после образования соли металла с гидроксильной функцией в положении 10 с помощью гидрида щелочного металла, такого как гидрид натрия, амида щелочного металла, такого, как амид лития, или алкильного производного щелочного металла,такого как бутиллитий, работая в органическом растворителе, таком, как диметилформамид или тетрагидрофуран, при температуре 0-50 С. Обычно, замену силилированных защитных групп соединения общей формулы (XIII) атомами водорода осуществляют с помощью кислоты, такой, как фтороводородная кислота или трифторуксусная кислота, в присутствии основания, такого, как триэтиламин или пири 5 дин, возможно, замещенный одним или несколькими алкильными радикалами с 1-4 атомами углерода, при необходимости, в сочетании с инертным органическим растворителем, таким, как, например, ацетонитрил, или галогенированный алифатический углеводород, например, дихлорметан, при температуре 0-80 С. Обычно, взаимодействие соединения общей формулы (XV) с соединением общей формулы (XIV) осуществляют в условиях, идентичных вышеуказанным для обработки соединением общей формулы (XII) соединения общей формулы (XI). Согласно изобретению, соединения общей формулы (I), в которой Z означает радикал общей формулы (II), R4 имеет вышеуказанное значение, и R5 имеет вышеуказанное значение,можно получать из соединения общей формулы в которой R1, R3, R6 и R7 имеют вышеуказанное значение, путем силилирования в положении 7 с помощью соединения общей формулы (X) для получения соединения общей формулы (XVII): 6 общей формулы (V), защитные группы которого заменяют атомами водорода, получая продукт общей формулы (I), в которой Z означает радикал общей формулы (II). Реакции силилирования, функционализации и замены защитных групп атомами водорода осуществляют в условиях, аналогичных вышеописанным. Соединения общей формулы (XVI) можно получать в условиях, описанных в европейском патенте 0 336 841 и международных заявках 92/09589 и 94/07878, или из соединений общей формулы (XX): в которой R1 и R3 имеют вышеуказанное значение, согласно известным способам защиты гидроксильной функции в боковой цепи, не затрагивая остальную часть молекулы. Согласно изобретению соединения общей формулы (I), в которой Z означает атом водорода или радикал общей формулы (II), можно получать путем воздействия активированным никелем Ренея в присутствии алифатического спирта с 1-3 атомами углерода или простого эфира, такого как тетрагидрофуран или диоксан,на соединение общей формулы (XXI) в которой R, R1, R3, R6 и R7 имеют вышеуказанное значение, которое функционализируют в положении 10 с помощью соединения общей формулы (XII) с получением соединения общей формулы (XVIII): в которой R4 имеет вышеуказанное значение,R' и R означают атом водорода,Z1 означает атом водорода или радикал общей формулы (XXII): в которой R, R1, R3, R4, R6 и R7 имеют вышеуказанное значение,силилированную защитную группу которого заменяют атомом водорода для получения соединения общей формулы (XIX): которое после взаимодействия с соединением общей формулы (XV), приводит к соединению в которой R1, R3, R6 и R7 имеют вышеуказанное значение, получают соединение общей формулы 7 с последующей, когда Z1 означает радикал общей формулы (XXII), то есть когда соединение общей формулы (XXIII) идентично соединению общей формулы (V), заменой защитных групп,обозначаемых как R6 и R7, атомами водорода в вышеописанных условиях. Обычно, активированный никелем Ренея в присутствии алифатического спирта или простого эфира воздействуют при температуре от-10 С до 60 С. Согласно изобретению, соединение общей формулы (XXI), в которой Z1 и R4 имеют вышеуказанное значение, можно получить путем взаимодействия сульфоксида общей формулы в которой R' и R имеют вышеуказанное значение, с соединением общей формулы (XIX). Обычно реакцию сульфоксида общей формулы (ХХIV), предпочтительно диметилсульфоксида, с соединением общей формулы (XIX) проводят в присутствии смеси уксусной кислоты с уксусным ангидридом или производного уксусной кислоты, такого как галогенуксусная кислота, при температуре 0-50 С, предпочтительно около 25 С. Изобретение относится также к 4 ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-бис(метилтиометокси)-9-оксотакс-11-ен-13-ил(2R,4S,5R)3-трет.бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилату, используемому в качестве промежуточного продукта для получения диметоксипроизводного таксомера, а именно 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,10-диметокси-9-оксо-такс-11-ен 13-ил-(2R,3S)-3-трет.-бутоксикарбониламино 2-гидрокси-3-фенил-пропионата. Изобретение относится также к способу получения 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,10-диметокси-9-оксотакс-11-ен-13-ил-(2R,3S)-3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата,заключающемуся в том, что на первом этапе 4 ацетокси-2-бензоилокси-5,20-эпокси-1,7,10-тригидрокси-9-оксо-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат обрабатывают диметилсульфоксидом в присутствии уксусной кислоты, на втором этапе полученный 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-бис(метилтиометокси)-9-оксо-такс-11-eн-13-ил-(2R,4S,5R)-3 трет.-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-1,3,-оксазолидин-5-карбоксилат подвергают взаимодействию с этанольной суспензией никеля Ренея и на третьем этапе полученный 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7, 10-диметокси-9-оксо-такс-11-ен 000567 13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилат подвергают взаимодействию с этанольньм раствором соляной кислоты. Новые соединения общей формулы (I), получаемые путем осуществления способов согласно изобретению, могут быть очищены известными методами, такими как кристаллизация или хроматография. Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают замечательными биологическими свойствами. Оценка антипролиферативных свойств Концентрацию лекарственного средства,дающего 50% ингибирования роста (IС 50), определяли из двух или трех отдельных экспериментов в 96-луночном планшете для микрокультивирования. Клеточные линии, высеянные при 3104-3105 клеток/мл (0,2 мл/лунка), выращивали в течение 96-120 ч в присутствии различных концентраций лекарственного средства (каждая точка повторялась четырежды). Затем клетки инкубировали в течение 16 ч с 0,02% нейтральным красным. Клетки промывали и подвергали лизису с 1% SDS. Включение красителя, отражающего клеточный рост и жизнеспособность,оценивали путем измерения оптической плотности для каждой лунки при 540 и 346 нм, используя Titertec многолуночный спектрофотометр. В экспериментах клонирования KB клетки человеческого эпидер-моидного рака в экспоненциальном росте обрабатывали в течение 1 ч в жидкой среде, затем промывали и выливали с NobleDifco Agar в чашки Петри (4 чашки/ концентрация), как описано ранее. Число клеточных клонов (60 клеток) измеряли спустя 15 дней после инкубации при 37 С в увлажненной атмосфере с 5% СО 2. Результаты приведены в таблице I. В тесте ин витро определение биологической активности осуществляют на тубулине,извлеченном из головного мозга свиньи по методу M. L. Shelanski и сотр., Ргос. Natl. Acad.Sci. USA, 70, 765-768 (1973). Изучение деполимеризации микротрубочек до тубулина осуществляют по методу G. Chauviere и сотр., С. R.Acad. Sci., 293, серия II, 501-503 (1981). При этом исследовании продукты общей формулы(I), в которой Z означает радикал общей формулы (II), оказываются, по крайней мере, такими же активными, как таксол и таксотер. 9 В тесте ин виво продукты общей формулы(I), в которой Z означает радикал общей формулы (II), показали себя активными в тесте с мышью, которой трансплантирована меланома В 16, в дозах, составляющих от 1 до 10 мг/кг при интраперитональном введении, а также в случае других жидких или твердых опухолей. Новые продукты обладают противоопухолевыми свойствами, более конкретно, обладают активностью в отношении опухолей, которые устойчивы к таксолу или таксотеру. Такие опухоли включают опухоли ободочной кишки,которые имеют высокую экспрессию гена mdr 1(ген устойчивости к многочисленным лекарственным средствам). Термин "устойчивость к многочисленным лекарственным средствам" представляет собой общепринятый термин, означающий устойчивость опухоли к различным продуктам разных структур и разных механизмов действия. Таксоиды вообще известны тем,что они в высокой степени распознаются экспериментальными опухолями,такими какP388/DOX, линия клеток, выбираемая по ее устойчивости к доксорубицину (DOX), которая экспрессирует ген mdr 1. Следующие примеры иллюстрируют настоящее изобретение. Пример 1. К суспензии, содержащей 217,8 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-1,13 дигидрокси-7,10-диметокси-9-оксо-такс-11 ена, 200 мг (2R,4S,5R)-3-трет.-бутоксикарбонил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоновой кислоты и 50 мг молекулярного сита 4 в виде порошка в 2 см 3 этилацетата, при температуре около 20 С последовательно добавляют 126 мг дициклогексилкарбодиимида,затем 14 мг 4-N,N'-диметиламинопиридина. Полученную суспензию перемешивают при температуре около 20 С и в атмосфере аргона в течение 16 ч, затем концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 40 С. Полученный остаток очищают путем хроматографии при атмосферном давлении при использовании 50 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 2 см (градиент элюирования: смесь этилацетата с дихлорметаном в соотношении от 10:90 до 40:60 по объему), собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 271,8 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,10-диметокси-9-оксотакс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде твердого вещества белого цвета, характеристики которого следующие: Н-ЯМР-спектр (400 МГц; дейтерохлороформ с несколькими каплями дейтерированного метанола; химсдвигив м.д. (миллионные доли); константы связывания J в Гц): 1,02 (с, 9 Н: С(СН 3)3), 1,10 (с, 3 н: CH3), 1,17 (с, 3H: CH3),1,63 (с, 3 Н: СН 3), 1,65-1,85 и 2,60 (2 м, 1 Н каждый: СН 2 в положении 6), 1,78 (массив, 3 Н: СН 3), 2,02 и 2,15 (2 дд, J = 14 и 9, 1 Н каждый: СН 2 в положении 14), 2,14 (с, 3 Н: СН 3), 3,22 и 3,35 (2 с, 3 Н каждый: ОСН 3), 3,64 (д, J = 7, 1 Н: Н в положении 3), 3,73 (м, 1 Н: Н в положении 7),3,76 (с, 3 Н: АrОСН 3), 4,06 и 4,16 (2 д, J = 8,5, 1 Н каждый: СН 2 в положении 20), 4,53 (д, J = 5, 1 Н: Н в положении 2'), 4,67 (с, 1 Н: Н в положении 10), 4,85 (уш.д. J = 10, 1 Н: Н в положении 5); 5,36 (м, 1 Н: Н в положении 3'); 5,52 (д, J = 7, 1 Н: Н в положении 2), 6,07 (м, 1 Н: Н в положении 13), 6,33 (массив, 1 Н: Н в положении 5'), 6,88 (д,J = 8, 2 Н: ароматические Н в орто-положении к ОСН 3), 7,25-7,40 (м, 7 Н: ароматические Н в положении 3' и ароматические Н в мета-положении к ОСН 3), 7,43 (т, J = 7,5, 2 Н: OCOC6H5 Н в мета-положении), 7,58 (т, J = 7,5, 1 Н: ОСОС 6 Н 5 - Н в пара-положении), 7,96 (д, J = 7,5,2 Н: ОСОС 6 Н 5 - Н в орто-положении). Раствор 446,3 мг 4-ацетокси-2-бензоилокси-5, 20-эпокси-1-гидрокси-7,10-диметокси-9-оксо-текс-11-ен-13-ил-(2R,4S,5R)-3 трет.-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата в 11,6 см 3 0,1 н. раствора хлорводорода в этаноле выдерживают при перемешивании и при температуре около 0 С в течение 16 ч в атмосфере аргона. Реакционную смесь затем разбавляют с помощью 40 см 3 дихлорметана и 5 см 3 дистиллированной воды. После декантации, водную фазу экстрагируют с помощью 5 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла, затем концентрируют при пониженном давлении (0,27 кПа) при температуре около 40 С. Таким образом получают 424,2 мг твердого вещества бледно-желтого цвета, которое очищают путем препаративной тонкослойной хроматографии (12 препаративных пластин фирмы Мерк, силикагель 60F254,толщина 1 мм, нанесение в виде раствора в смеси метанола с дихлорметаном (в объемном соотношении 5:95), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95. После элюирования зоны, соответствующей основному продукту, смесью метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фильтр из фриттированного стекла, затем выпаривания растворителей при пониженном давлении (0,27 кПа) при температуре около 40 С, получают 126 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7, 10-диметокси-9-оксо-такс-11-ен 13-ил-(2R,3S)-3-трет.-бутокси-карбониламино 2-гидрокси-3-фенил-пропионата в виде воздуш 11 ной массы цвета слоновой кости, характеристики которого следующие: вращательная способность: 20D = -32,9- Н в орто-положении). 4-Ацетокси-2-бензоилокси-5,20-эпокси-1,13-дигидрокси-7,10-диметокси-9-оксо-такс-11-ен(или 7, 10-диметокси-10-дезацетокси-баккатин(III может быть получен следующим образом. К раствору 500 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1,7,13-тригидрокси-10-метокси-9-оксо-такс-11-ена в 5 см 3 иодметана и 0,5 см 3 диметилформамида, находящемуся в атмосфере аргона, при температуре около 0 С порциями добавляют 86 мг 50%-ного(по массе) гидрида натрия в вазелиновом масле. После выдерживания в течение 45 мин при температуре около 0 С, реакционную смесь разбавляют с помощью 50 см 3 этилацетата и 8 см 3 дистиллированной воды. После декантации органическую фазу промывают два раза по 8 см 3 дистиллированной водой, затем 8 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла и концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 40 С. Таким образом получают 570 мг твердого вещества бледно-желтого цвета, которое очищают путем хроматографии при атмосферном давлении при использовании 50 г диоксида кремния (0,063-0,2 мм), находящихся в колонке диаметром 2,5 см, элюируя смесью метанола с дихлорметаном (в объемном соотношении 2:98) и собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт,объединяют и концентрируют при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 380 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-1,13 000567 дигидрокси-7,10-диметокси-9-оксо-такс-11 ена в виде твердого вещества бледно-желтого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ с несколькими каплями дейтерированного метанола; химсдвигив м.д.; константы связывания J в Гц): 1.03 (с, 3 Н: СН 3), 1,11 (с, 3 Н: СН 3), 1,65 (с, 3 Н: СH3), 1,72 и 2,67 (2 м, 1 Н каждый: СН 2 в положении 6), 2,05 (с, 3 Н: СН 3), 2,21(АВ ограниченный, J = 14 и 9, 2 Н: СН 2 в положении 14), 2,25 (с, 3 Н: СОСН 3), 3,26 и 3,40 (2 с,3 Н каждый: ОСН 3), 3,85 (д, J = 7, 1 Н: Н в положении 3), 3,89 (дд, J = 11 и 6,5, 1 Н:Н в положении 7), 4,12 и 4,25 (2 д, J = 8,5, 1 Н каждый: СН 2 в положении 20), 4,78 (уш.т, J = 9, 1 Н: Н в положении 13), 4,83 (с, 1 Н: Н в положении 10),4.98 (уш.д, J = 10, 1 Н: Н в положении 5), 5,53 (д,J = 7,1H, Н в положении 2), 7,43 (т, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в мета-положении), 7,56 (т, J = 7.5,1 Н: ОСОС 6 Н 5 - Н в пара-положении), 8,05 (д, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в орто-положении). 4-Ацетокси-2-бензоилокси-5,20 эпокси-1,7,13-тригидрокси-10-метокси-9 оксо-такс-11-ен (или 10-метокси-10-дезацетокси-баккатин(III может быть получен следующим образом. К раствору 3,62 г 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-10 метокси-9-оксо-7, 13-бистриэтилсилилокситакс-11-ена в 30 см 3 дихлорметана, находящемуся в атмосфере аргона, при температуре около 0 С, медленно добавляют 50 см 3 комплекса фтороводорода с триэтиламином (3 НFЕt3N). После выдерживания в течение 48 ч при температуре около 20 С, реакционную смесь выливают в суспензию 100 см 3 водного пересыщенного раствора гидрокарбоната натрия, поддерживаемую при температуре около 0 С. После декантации водную фазу повторно экстрагируют три раза по 80 см 3 дихлорметаном, затем два раза по 80 см 3 этилацетатом. Органические фазы объединяют, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 40 С. Таким образом получают 3,45 г желтого цвета воздушной массы, которую очищают путем хроматографии при атмосферном давлении при использовании 150 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 3,5 см, элюируя смесью метанола с дихлорметаном в объемном соотношении 5:95 и собирая фракции по 35 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 1,97 г 4-ацетокси-2 бензоил-окси-5,20-эпокси-1,7,13-тригидрокси-10-метокси-9-оксо-такс-11-ена в виде твердого вещества белого цвета, характеристики которого следующие:(т, J = 7,5, 1 Н: OCOC6H5 - Н в пара-положении),8,12 (д, J = 7,5, 2 Н: OCOC6H5 - Н в ортоположении). 4-Ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-10-метокси-9-оксо-7,13-бистриэтилсилилокси-такс-11-ен (или 10-метокси-10-дезацетокси-7,13-бистриэтилсилил-баккатин (III может быть получен следующим образом. К раствору 5 г 4-ацетокси-2 бензоилокси-5, 20-эпокси-1, 10-дигидрокси 9-оксо-7, 13-бистриэтилсилилокси-такс-11 ена в 25 см 3 иодметана, поддерживаемому в атмосфере аргона, при температуре около 0 С порциями добавляют 375 мг 50%-ного (по массе) гидрида натрия в вазелиновом масле. Раствор выдерживают при перемешивании в течение 45 мин при температуре около 0 С, затем в течение 5 ч 30 мин при температуре около 20 С. Реакционную смесь снова охлаждают до температуры около 0 С и порциями добавляют 125 мг 50%-ного (по массе) гидрида натрия в вазелиновом масле. После выдерживания в течение 1 ч при 20 С, затем 18 ч при 5 С, реакционную смесь разбавляют с помощью 50 см 3 дихлорметана, выливают в 50 см 3 водного насыщенного раствора хлорида аммония и декантируют. Водную фазу экстрагируют 2 раза по 30 см 3 дихлорметаном, затем органические фазы объединяют, промывают с помощью 10 см 3 дистиллированной воды, сушат над сульфатом магния,фильтруют через фильтр из фриттированного стекла и концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 40 С. Таким образом получают 5,15 г воздушной массы желтого цвета, которую очищают путем хроматографии при атмосферном давлении при использовании 300 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 5 см (градиент элюирования: смесь этилацетата с дихлорметаном в объемном соотношении от 0:100 до 10:90), собирая фракции по 30 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 3,62 г 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-10-метокси-9-оксо-7,13 бистриэтилсилилокси-такс-11-ена в виде воздушной массы бледно-желтого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (600 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания(уш.т, J = 9, 1 Н: Н в положении 13), 5,62 (д, J = 7, 1 Н: Н в положении 2), 7,46 (т, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в мета-положении), 7,60 (т, J = 7,5,1 Н: OCOC6H5 - Н в пара-положении), 8,09 (д, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в орто-положении). 4-Ацетокси-2-бензоилокси-5, 20-эпокси-1, 10-дигидрокси-9-оксо-7, 13-бистриэтилсилилокси-такс-11-ен (или 10-дезацетил 7,13-биотриэтилсилил-баккатин(III может быть получен следующим образом. К раствору 14 г 4-ацетокси-2 бензоилокси-5,20-эпокси-1,7,10,13-тетрагидрокси-9-оксо-такс-11-ена(10-дезацетилбаккатина(III в 50 см 3 безводного пиридина,поддерживаемому в атмосфере аргона, при температуре около 20 С добавляют 10,8 см 3 триэтилсилилхлорида. После выдерживания в течение 17 ч при температуре около 20 С, реакционную смесь доводят до температуры около 115 С, затем добавляют 10,8 см 3 триэтилсилилхлорида. После выдерживания в течение трех часов 15 мин при температуре около 115 С, реакционную смесь доводят до температуры около 20 С, разбавляют с помощью 30 см 3 этилацетата и 100 см 3 дистиллированной воды. После декантации водную фазу экстрагируют 2 раза по 50 см 3 этилацетатом. Органические фазы объединяют, промывают с помощью 50 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла, затем концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 40 С. Таким образом получают 63,1 г коричневого цвета масла,которое очищают путем хроматографии при атмосферном давлении при использовании 800 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 7 см (градиент элюирования: смесь этилацетата с дихлорметаном в объемном соотношении от 0:100 до 5:95), собирая фракции по 60 см 3. Фракции, содержащие только целевой продукт, объединяют и концентри 15 руют досуха при пониженном давлении (0,27 кПа) при 40 С в течение 2 ч. Таким образом получают 9,77 г 4-ацетокси-2-бензоил-окси 5, 20-эпокси-1, 10-дигидрокси-9-оксо-7,13-бистри-этилсилилокси-такс-11-ена в виде воздушной массы кремового цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания(2 д, J = 8,5, 1 Н каждый: СН 2 в положении 20),4,27 (д, J = 1, 1 Н: ОН в положении 10), 4,40 (дд,J = 11 и 7, 1 Н: Н в положении 7), 4,95 (уш. д, J = 10, 1 Н: Н в положении 5), 4,95 (м, 1 Н: Н в положении 13), 5,16 (д, J = 1, 1 Н: Н в положении 10), 5,60 (д, J = 7, 1 Н: Н в положении 2), 7,46 (т,J = 7,5, 2 Н: OCOC6H5 - Н в мета-положении),7,60 (т, J = 7,5, 1 Н: ОСОС 6 Н 5 - Н в параположении), 8,09 (д, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в орто-положении). Пример 2. 340 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-диметокси-9 оксо-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата растворяют в 8 см 3 0,1 н. раствора хлороводорода в этаноле с 1% воды. Таким образом полученный раствор перемешивают в течение 13 ч при температуре около 20 С, затем в течение 80 ч при 4 С и добавляют 20 см 3 дихлорметана. Органическую фазу отделяют путем декантации и промывают последовательно 3 раза по 5 см 3 водным насыщенным раствором гидрокарбоната натрия, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа) при 40 С. Получают 300 мг воздушной массы белого цвета, которую очищают путем хроматографии на силикагеле, нанесенном на пластины (гель толщиной 1 мм, пластины 20 х 20 см, элюирование: смесь дихлорметана с метанолом в объемном соотношении 95:5) фракциями по 80 мг (4 пластины). После локализации с помощью УФ-лучей зоны, соответствующей адсорбированному целевому продукту, эту зону соскабливают и собранный диоксид кремния промывают на фильтре из фриттированного стекла 10 раз по 5 см 3 этилацетатом. Фильтраты объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают воздушную массу белого цвета,которую снова очищают тем же способом (3 пластины: 20 х 20 х 1 мм; элюирование: смесь дихлорметана с этилацетатом в объемном соот 000567 16 ношении 90:10). Таким образом получают 205 мг 4-ацетокси-2-бензоилокси-5,20-эпокси 1-гидрокси-7, 10-диметокси-9-оксо-такс-11 ен-13-ил-(2R,3S)-3-трет.-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: вращательная способность: [d]20D = -33 (с-Н в положении 13), 7,30-7,50 (м, 5 Н:-C6H5 в положении 3'), 7,52 [т, J = 7,5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 3 и -Н в положении 5)], 7,63 [т, J = 7,5, 1 Н: -ОСОС 6 Н 5 (-Н в положении 4)], 8,12 [д,J = 7,5, 2 Н: -ОСОС 6 Н 5 (-Н в положении 2 и -Н в положении 6)]. 4-Ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,10-диметокси-9-оксотакс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3 оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 1 г 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,10 бис(метилтиометокси)-9-оксо-такс-11-ен-13 ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в 100 см 3 безводного этанола, поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С добавляют 100 см 3 суспензии в этаноле активированного никеля Ренея (получают из 80 см 3 примерно 50%-ной водной продажной суспензии путем последовательных промывок, до рН примерно 7,15 раз по 100 см 3 дистиллированной воды и 5 раз по 100 см 3 этанола). Реакционную среду выдерживают при перемешивании в течение 24-х ч при температуре около 20 С, затем фильтруют через фильтр из фриттированного стекла, который промывают 4 раза по 80 см 3 этанолом,фильтраты объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 710 мг воздушной массы желтого цвета, которую очищают путем хроматографии на 60 г диоксида кремния (0,063-0,2 мм), 17 содержащихся в колонке диаметром 2,5 см(элюирующее средство:смесь дихлорметана с этилацетатом в объемном соотношении 90:10),собирая фракции по 6 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 350 мг 4-ацетокси-2-бензоилокси-5, 20 эпокси-1-гидрокси-7,10-диметокси-9-оксотакс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. 4-Ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-бис(метилтиометокси)9-оксо-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 3,1 г 4-ацетокси-2 бензоилокси-5,20-эпокси-1,7-10bтригидрокси-9-оксо-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в 102 см 3 диметилсульфоксида, поддерживаемому в атмосфере аргона и при перемешивании, при температуре около 20 С добавляют 2,3 см 3 уксусной кислоты и 7,55 см 3 уксусного ангидрида. Реакционную смесь выдерживают при перемешивании в течение 7 дней при температуре около 20 С, затем выливают в смесь 500 см 3 дистиллированной воды с 250 см 3 дихлорметана. После этого добавляют при интенсивном перемешивании 30 см 3 водного насыщенного раствора карбоната калия до рН около 7. После перемешивания в течение 10 мин, органическую фазу отделяют путем декантации и снова экстрагируют водную фазу 2 раза по 250 см 3 дихлорметаном. Органические фазы объединяют,промывают с помощью 250 см 3 дистиллированной воды, сушат над сульфатом магния, отфильтровывают и фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Получают 5,2 г масла бледно-желтого цвета, которое очищают путем хроматографии на 200 г диоксида кремния (0,063-0,4 мм), содержащихся в колонке диаметром 3 см (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1), собирая фракции по 50 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 1,25 г 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,10-бис(метилтиометокси)-9-оксотакс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бут-оксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. 4-Ацетокси-2-бензоилокси-5,20-эпокси-1,7,10-тригидрокси-9-оксо-такс-11-ен 000567 13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилат может быть получен следующим образом. Раствор 5,1 г 4-ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-9-оксо-7,10-бис(2,2,2-трихлорэтокси)карбонил-окси-такс-11-ен 13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в смеси 100 см 3 метанола со 100 см 3 уксусной кислоты, при перемешивании и в атмосфере аргона, нагревают до температуры около 60 С, затем добавляют 10 г цинка в порошке. Реакционную смесь после этого перемешивают в течение 15 мин при 60 С, затем охлаждают до температуры около 20 С и фильтруют через фильтр из фриттированного стекла, покрытого целитом. Фриттированное стекло промывают 2 раза по 15 см 3 метанола. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. К остатку добавляют 50 см 3 этилацетата и 25 см 3 водного насыщенного раствора гидрокарбоната натрия. Органическую фазу отделяют путем декантации и промывают последовательно с помощью 25 см 3 водного насыщенного раствора гидрокарбоната натрия и 25 см 3 дистиллированной воды, затем сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С. Таким образом получают 3,1 г 4-ацетокси-2 бензоилокси-5,20-эпокси-1,7,10-тригидрокси-9-оксо-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета. 4-Ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-9-оксо-7,10-бис(2,2,2-трихлорэтокси)карбонилокси-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилат может быть получен в условиях,описанных в международной заявке 94/07878. Пример 3. К суспензии, содержащей 135 мг 4 ацетокси-2-бензоил-окси-5, 20-эпокси-10 этокси-1, 13-дигидрокси-7-метокси-9-оксотакс-11-ена, 120 мг (2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3 оксазолидин-5-карбоновой кислоты и 50 мг молекулярного сита 4 в порошке в 1 см 3 безводного толуола, последовательно добавляют, при температуре около 20 С, 76 мг дициклогексилкарбодиимида,затем 8.5 мг 4-N,N'диметиламинопиридина. Полученную суспензию перемешивают при температуре около 20 С и в атмосфере аргона в течение 1 ч, затем очищают путем прямого внесения в хроматографическую колонку при атмосферном давлении, заполненную 30 г диоксида кремния(0,063-0,2 мм) и имеющую диаметр 2,5 см (градиент элюирования: смесь этилацетата с дихлорметаном в объемном соотношении от 2:98 до 10:90), собирая фракции по 10 см 3. Фракции,содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С в течение двух часов. Таким образом получают 320,6 г твердого вещества белого цвета, которое очищают путем препаративной тонкослойной хроматографии: 10 препаративных пластин фирмы Мерк, силикагель 60F254, толщина 0,5 мм, нанесение в виде раствора в дихлорметане, элюирование смесью метанола с дихлорметаном в объемном соотношении 3:97. После элюирования зон, соответствующих основным продуктам, смесью метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через вату, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С,получают 47,7 мг 4-ацетокси-2-бензоилокси 5, 20-эпокси-10-этокси-1, 13-дигидрокси 7-метокси-9-оксо-такс-11-ена в виде твердого вещества кремового цвета и 37 мг 4-ацет-окси 2-бензоилокси-5,20-эпокси-10-этокси-1 гидрокси-7-метокси-9-оксо-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутокси-карбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (600 МГц; дейтерохлороформ; при температуре 60 С; химсдвигив м.д.; константы связывания J в Гц): 1,09 (с, 9 Н: С(СН 3)3), 1,19 (с, 3 Н: СН 3), 1,21 (с, 3 Н: СН 3),1,27 (т, J = 7, 3 Н: СН 2 этила), 1,43 (с, 1 Н: ОН в положении 1), 1,62 (с, 3 Н: СН 3), 1,68 (с, 3 Н: СН 3), 1,77 и 2,63 (2 м, 1 Н каждый: СН 2 в положении 6), 1,86 (с, 3 Н: СОСН 3), 2,13 и 2,22 (2 дд,J = 16 и 9, 1 Н каждый: СН 2 в положении 14),3,27 (с, 3 Н: ОСН 3), 3,45 и 3,68 (2 м, 1 Н каждый: СН 2 этила), 3,76 (д, J = 7, 1 Н: Н в положении 3),3,81 (с, 3 Н: АrОСН 3), 3,85 (дд, J = 11 и 7, 1 Н: Н в положении 7), 4,13 и 4,23 (2 д, J = 8,5, 1 Н каждый: СН 2 в положении 20), 4,58 (д, J = 4,5, 1 Н: Н в положении 2'), 4,83 (с, 1 Н: Н в положении 10),4,90 (уш. д, J = 10, 1 Н: Н в положении 5), 5,46 20 карбоксилата в 0,5 см 3 этилацетата и 0,004 см 3 концентрированной 37%-ной соляной кислоты выдерживают при перемешивании и при температуре около 20 С в течение 1,5 ч в атмосфере аргона. Реакционную смесь затем очищают путем препаративной тонкослойной хроматографии: нанесение сырой реакционной смеси на 5 препаративных пластин фирмы Мерк, силикагель 60F254, толщина 0,5 мм, элюирование смесью метанола с дихлорметаном в объемном соотношении 4:96. После элюирования зоны, соответствующей основному продукту, смесью метанола с дихлорметаном в объемном соотношении 15:85, фильтрации через вату, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С,получают 28,5 мг 4-ацетокси-2-бензоилокси 5,20-эпокси-10-этокси-1-гидрокси-7 метокси-9-оксо-такс-11-ен-13-ил-(2R,3S)-3 трет.-бутоксикарбониламино-2-гидрокси-3 фенил-)пропионата в виде воздушной массы цвета слоновой кости, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания(д, J = 10, 1H: CONH), 5,64 (д, J = 7,5, 1H: H в положении 2), 6,22 (уш. т, J = 9, 1H: H в положении 13), 7,25-7,45 (м, 5 Н: ароматические Н в положении 3'), 7,50 (т, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в мета-положении), 7,62 (т, J = 7,5, 1H: ОСОС 6 Н 5 - Н в пара-положении), 8,12 (д, J = 7,5,2 Н: ОСОС 6 Н 5 - Н в орто-положении). 4-Ацетокси-2-бензоилокси-5,20-эпокси-10-этокси-1,13-дигидрокси-7-метокси 9-оксо-такс-11-ен (или 10-этокси-7-метокси 10-дезацетокси-баккатин(III может быть получен следующим образом. К раствору 235 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1,7,13 тригидрокси-10-этокси-9-оксо-такс-11-ена в 2,5 см 3 иодметана и 1 см 3 диметилформамида,поддерживаемому в атмосфере аргона, при температуре около 0 С порциями добавляют 43 мг гидрида натрия в виде 50%-ной (по массе) дисперсии в вазелиновом масле. После выдерживания в течение 30 мин при температуре около 0 С, реакционную смесь разбавляют с помощью 21 40 см 3 этилацетата, 6 см 3 дистиллированной воды и 8 см 3 водного насыщенного раствора хлорида аммония. После декантации, органическую фазу промывают 3 раза по 8 см 3 дистиллированной водой, затем 8 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 268 мг твердого вещества желтого цвета,которое очищают путем хроматографии при атмосферном давлении на 30 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см (градиент элюирования: смесь этилацетата с дихлорметаном в объемном соотношении от 0:100 до 15:85), собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 380 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-10-этокси-1,13-дигидрокси-7-метокси-9-оксо-такс-11-ена в виде белого порошка, характеристики которого следующие: 1 Н-ЯМР-спектр (300 МГц; дейтерохлороформ с добавкой нескольких капель дейтрированного метанола; химсдвигив м.д.; константы связывания J в Гц): 0,99 (с, 3 Н: СН 3), 1,09 (с,3 Н: СН 3), 1,22 (т, J = 7, 3 Н: СН 3 этила), 1,62 (с,3 Н: СН 3), 1,68 и 2,66 (2 м, 1 Н каждый: СН 2 в положении 6), 2,03 (с, 3 Н: СН 3), 2,13 и 2,22 (2 дд, J = 16 и 9, 1 Н каждый: СН 2 в положении 14),2,23 (с, 3: СОСН 3), 3,23 (с, ЗН: ОСН 3), 3,40-3,65(д, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в орто-положении). 4-Ацетокси-2-бензоилокси-5,20-эпокси-1,7,13-три-гидрокси-10-этокси-9-оксотакс-11-ен (или 10-этокси-10-дезацетоксибаккатин(III может быть получен следующим образом. К раствору 591 мг 4-ацетокси-2-бензоилокси-5, 20-эпокси-1-гидрокси-10-этокси 9-оксо-7,13 бистриэтилсилилокси-такс-11 ена в 6 см 3 дихлорметана, поддерживаемому в атмосфере аргона, при температуре около 20 С добавляют 9 см 3 комплекса фтороводорода с триэтиламином (3HFEt3N). После выдерживания в течение 21 ч при температуре около 20 С,реакционную смесь разбавляют с помощью 40 см 3 дихлорметана и выливают в суспензию 40 см 3 пересыщенного водного раствора гидрокарбоната натрия, поддерживаемую при темпера 000567 22 туре около 0 С. После разбавления с помощью 10 см 3 дистиллированной воды и декантации,водную фазу повторно экстрагируют 2 раза по 20 см 3 диэтиловым эфиром. Органические фазы объединяют, промывают с помощью 20 см 3 дистиллированной воды, 20 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 370 мг воздушной массы бледно-желтого цвета, которую очищают путем хроматографии при атмосферном давлении на 35 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см, элюируя смесью метанола с дихлорметаном в объемном соотношении 2:98 и собирая фракции по 15 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С в течение двух часов. Таким образом получают 236,2 мг 4-ацетокси 2-бензоилокси-5,20-эпокси-1,7,13-тригидрокси-10-этокси-9-оксо-такс-11-ена в виде твердого вещества белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; химсдвиги им.д.; константы связывания J в Гц): 1,08 (с, 3 Н: СН 3), 1,19 (с, 3 Н: СН 3),1,29 (т, J = 7,5, 3 Н: СН 3 этила), 1,38 (д, J = 9, 1 Н: ОН в положении 7), 1,59 (с, 1 Н: ОН в положении 1), 1,69 (с, 3 Н: СН 3), 1,82 и 2,62 (2 м, 1 Н каждый: СН 2 в положении 6), 2,02 (д, J = 5, 1 Н: ОН в положении 13), 2,08 (с, 3 Н: СН 3), 2,30 (с,3 Н: СОСН 3), 2,32 (д, J = 9, 2 Н: СН 2 в положении 14), 3,56 и 3,67 (2 м, 1 Н каждый: ОСН 2 этила), 3,98 (д, J = 7, 1 Н: Н в положении 3), 4,18 и 4,33 (2 д, J = 8,5, 1 Н каждый: СН 2 в положении 20), 4,30 (м, 1 Н: Н в положении 7), 4,90 (м, 1 Н: Н в положении 13), 4,99 (дд, J = 10 и 1,5, 1 Н: Н в положении 5), 5,05 (с, 1 Н: Н в положении 10),5,66 (д, J = 7, 1 Н: Н в положении 2), 7,49 (т, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в мета-положении), 7,63(т, J = 7,5, 1 Н: ОСОС 6 Н 5 - Н в пара-положении),8,12 (д, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в ортоположении). 4-Ацетокси-2-бензоилокси-5,20-эпокси-1)-гидрокси-10-этокси-9-оксо-7,13 бистриэтилсилилокси-такс-11-ен (или 10-этокси-10-дезацетокси-7,13-биcтриэтилсилил-баккатин(III может быть получен следующим образом. К раствору 1 г 4-ацетокси-2-бензоилокси-5,20-эпокси-1,10-дигидрокси-9-оксо 7,13-бистриэтилсилилокси-такс-11-ена в 3 см 3 иодэтана и 4 см 3 диметилформамида, поддерживаемому в атмосфере аргона, при температуре около 20 С порциями добавляют 93 мг гидрида натрия в виде 50%-ной (по массе) дисперсии в вазелиновом масле. Раствор перемешивают в течение 17 ч при температуре около 20 С, затем порциями добавляют 93 мг гидрида 23 натрия в виде 50%-ной (по массе) дисперсии в вазелиновом масле. После выдерживания в течение 50 мин при температуре около 20 С реакционную смесь разбавляют с помощью 100 см 3 этилацетата, 10 см 3 водного насыщенного раствора хлорида аммония. Декантированную органическую фазу промывают 6 раз по 10 см 3 дистиллированной водой, затем 10 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла и фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 1,2 г воздушной массы желтого цвета, которую очищают путем хроматографии при атмосферном давлении на 150 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 3,5 см, элюируя смесью этилацетата с дихлорметаном в объемном соотношении 2:98, затем 5:95, и собирая фракции по 15 см 3. Фракции, содержащие только целевые продукты, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 379,2 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1,10-ди-гидрокси-9-оксо-7,13-бистриэтилсилилокси-такс-11-ена в виде воздушной массы бледно-желтого цвета и 430 мг 4 ацет-окси-2-бензоилокси-5,20-эпокси-1-гидрокси-10-этокси-9-оксо-7b,13-бистриэтилсилилокси-такс-11-ена в виде воздушной массы белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания 24 водного толуола, последовательно добавляют,при температуре около 20 С, 65 мг дициклогексилкарбодиимида, затем 7 мг 4-N,N'диметиламино-пиридина. Полученную суспензию перемешивают при температуре около 20 С и в атмосфере аргона в течение 1 ч, затем очищают путем нанесения прямо в хроматографическую колонку при атмосферном давлении на 30 г диоксида кремния (0,063-0,2 мм), содержащиеся в колонке диаметром 2,5 см (градиент элюирования: смесь этилацетата с дихлорметаном в соотношении по объему от 2:98 до 10:90),собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С в течение двух часов. Таким образом получают 276,2 мг твердого вещества белого цвета, которое очищают путем препаративной тонкослойной хроматографии: 10 препаративных пластин фирмы Мерк, силикагель 60F254, толщина 0,5 мм, нанесение в виде раствора в дихлорметане, элюирование смесью метанола с дихлорметаном в объемном соотношении 3:97. После элюирования зон, соответствующих основным продуктам, смесью метанола с дихлорметаном в объемном соотношении 15:85, фильтрации через вату, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С,получают 84,8 мг 4-ацетокси-2-бензоилокси 5,20-эпокси-10-(1-пропил)окси-1-гидрокси 7-метокси-9-оксо-такс-11-ен-13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде воздушной массы белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (300 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания 25 ОСОС 6 Н 5 - Н в пара-положении), 8,03 (д, J = 7,5,2 Н: ОСОС 6 Н 5 - Н в орто-положении). 4-Ацетокси-2-бензоилокси-5,20 эпокси-10-(1-пропил)-окси-1-гидрокси-7 метокси-9-оксо-такс-11-ен-13-ил-(2R,3S)-3 трет.-бутоксикарбониламино-2-гидрокси-3 фенил-пропионат может быть получен следующим образом. Раствор 84 мг 4-ацетокси-2-бензоилокси-5,20-эпокси-10-(1-пропил)окси-1 гидрокси-7-метокси-9-оксо-такс-11-ен-13-ил(2R,4S,5R)-3-трет.-бутоксикарбонил-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в 0,84 см 3 этилацетата и 0,0071 см 3 концентрированной 37%-ной соляной кислоты перемешивают в течение 1 ч при температуре около 20 С и в атмосфере аргона. Реакционную смесь затем очищают путем препаративной тонкослойной хроматографии: нанесение сырой реакционной смеси на 6 препаративных пластин фирмы Мерк, силикагель 60F254, толщина 0,5 мм, элюирование смесью метанола с ацетонитрилом и дихлорметаном в объемном соотношении 3:7:90. После элюирования зоны, соответствующей основному продукту, смесью метанола с дихлорметаном в объемном соотношении 15:85, фильтрации через вату, затем выпаривания растворителей при пониженном давлении(2,7 кПа) при температуре около 40 С, получают 27 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-10-(1-пропил)окси-1-гидрокси-7 метокси-9-оксо-такс-11-ен-13-ил-(2R,3S)-3 трет.-бутоксикарбониламино-2-гидрокси-3 фенил-пропионата в виде воздушной массы белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания 4-Ацетокси-2-бензоилокси-5,20-эпокси-10-(1-пропил)-окси-1,13-дигидрокси-7 метокси-9-оксо-такс-11-ен (или 10-(1-пропил) окси-7-метокси-10-дезацетокси-баккатин(III может быть получен следующим образом. К раствору 165 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1,7,13-тригидрокси-10-(1-пропил)окси-9-оксо-такс-11-ена в 1,7 см 3 иодметана и 1 см 3 диметилформамида,поддерживаемому в атмосфере аргона, при температуре около 0 С порциями добавляют 30 мг гидрида натрия в виде 50%-ной (по массе) суспензии в вазелиновом масле. После выдерживания в течение 30 мин при температуре около 0 С, реакционную смесь разбавляют с помощью 40 см 3 этилацетата, 5 см 3 дистиллированной воды и 7 см 3 водного насыщенного раствора хлорида аммония. После декантации, органическую фазу промывают три раза по 7 см 3 дистиллированной водой, затем 7 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 224 мг твердого вещества желтого цвета,которое очищают путем хроматографии при атмосферном давлении на 20 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см (градиент элюирования: смесь этилацетата с дихлорметаном в объемном соотношении от 0:100 до 15:85), собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 117,5 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-10-(1-пропил)окси-1,13-дигидрокси 7-метокси-9-оксо-такс-11-ена в виде воздушной массы белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (300 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания 4-Ацетокси-2-бензоилокси-5,20-эпокси-1,7,13-тригидрокси-10-(1-пропил)окси 9-оксо-такс-11-ен (или 10-(1-пропил)окси-10 дезацетокси-баккатин(III может быть получен следующим образом. К раствору 585 мг 4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-10-(1 пропил)окси-9-оксо-7,13-биcтриэтилсилилокси-такс-11-ена в 6 см 3 дихлорметана, поддерживаемому в атмосфере аргона, при температуре около 20 С добавляют 8,75 см 3 комплекса фтороводорода с триэтиламином (3 НFЕt3N). После выдерживания в течение трех часов при температуре около 20 С реакционную смесь разбавляют с помощью 30 см 3 дихлорметана и выливают в суспензию 30 см 3 водного пересыщенного раствора гидрокарбоната натрия, поддерживаемую при температуре около 0 С. После разбавления с помощью 10 см 3 дистиллированной воды и декантации, водную фазу повторно экстрагируют два раза по 20 см 3 диэтиловым эфиром. Органические фазы объединяют,промывают с помощью 20 см 3 дистиллированной воды, 20 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния,отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 500 мг воздушной массы бледно-желтого цвета, которую очищают путем хроматографии при атмосферном давлении на 40 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см, элюируя смесью метанола с дихлорметаном (в соотношении 2:98 по объему) и собирая фракции по 15 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40 С в течение двух часов. Таким образом получают 373,8 мг 4-ацетокси 2-бензоилокси-5,20-эпокси-1,7,13-тригидрокси-10-(1-пропил)окси-9-оксо-такс-11-ена в виде твердого вещества белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (300 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания(или 10-(1-пропил)окси-10-дезацетокси-7,13-бистри-этилсилил-баккатин(III может быть получен следующим образом. К раствору 1 г 4-ацетокси-2 бензоилокси-5,20-эпокси-1,10-дигидрокси 9-оксо-7,13-бистриэтилсилилокси-такс-11 ена в 3 см 3 иодэтана и 4 см 3 диметилформамида,поддерживаемому в атмосфере аргона, при температуре около 20 С порциями добавляют 93 мг гидрида натрия в виде 50%-ной (по массе) суспензии в вазелиновом масле. Раствор перемешивают в течение девятнадцати часов при температуре около 20 С, затем порциями добавляют 93 мг гидрида натрия в виде 50%-ной (по массе) суспензии в вазелиновом масле. После выдерживания в течение трех часов при температуре около 20 С реакционную смесь разбавляют с помощью 100 см 3 этилацетата, 10 см 3 водного насыщенного раствора хлорида аммония. Декантированную органическую фазу промывают 6 раз по 10 см 3 дистиллированной водой, затем 10 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фильтр из фриттированного стекла и концентрируют фильтрат досуха при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 1,32 г воздушной массы бледно-желтого цвета,которую очищают путем хроматографии при атмосферном давлении на 150 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 3,5 см, элюируя смесью этилацетата с дихлорметаном (в объемном соотношении 2:98, затем 5:95) и собирая фракции по 15 см 3. Фракции, содержащие только целевые продукты, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при 40 С в течение двух часов. Таким образом получают 376,3 мг 4-ацетокси-2-бензоилокси-5,20 эпокси-1,10-дигидрокси-9-оксо-7,13-бистриэтилсилилокси-такс-11-ена в виде воздушной массы бледно-желтого цвета и 395,3 мг 4 ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-10-(1-пропил)окси-9-оксо-7,13 бистриэтилсилилокси-такс-11-ена в виде воздушной массы бледно-желтого цвета, характеристики которой следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; химсдвигив м.д.; константы связывания(т, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в мета-положении),7,60 (т, J = 7,5, 1 Н: ОСОС 6 Н 5 - Н в параположении), 8,10 (д, J = 7,5, 2 Н: ОСОС 6 Н 5 - Н в орто-положении). Новые продукты общей формулы (I), в которой Z означает радикал общей формулы (II),проявляют значительную ингибирующую активность в отношении анормальной пролиферации клеток и обладают терапевтическими свойствами, позволяющими лечить заболевания с патологическими состояниями, связанными с нарушением пролиферации клеток. К патологическим состояниям относится анормальная пролиферация злокачественных или незлокачественных клеток различных тканей и/или органов,включающих, но не ограничивающихся ими,мышечные, костные или соединительные ткани,кожу, головной мозг, легкие, половые органы,лимфатические и почечные системы, клетки грудных желез или клетки крови, печень, пищеварительный аппарат, поджелудочную железу и щитовидные железы. К этим патологическим состояниям также относится псориаз, твердые опухоли, раковые заболевания яичников, женской груди, простаты, ободочной кишки, желудка, почек или тестикул, саркому Капоши,холангиокарциному, хориокарциному, нейробластому, опухоль Вилмса, болезнь Ходжкина,меланомы, множественные меланомы, хронические лимфоцитарные лейкемии, острые или хронические гранулоцитарные лимфомы. Новые соединения согласно изобретению особенно пригодны для лечения рака яичника. Соединения согласно изобретению также можно использовать для предупреждения или замедления появления или повторного появления патологических состояний или для лечения этих патологических состояний. Соединения согласно изобретению можно вводить пациенту в различных формах, годных для выбранного пути введения, которым предпочтительно является парентеральный путь введения. Введение парентеральным путем включает внутривенное, интраперитональное, внутримышечное или подкожное введения. Наиболее предпочтительным является интраперитональное или внутривенное введение. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат, по крайней мере, один продукт общей формулы (I) в эффективном количестве, пригодном для использования в терапии человека или животного. Композиции можно получать обычными способами, используя одну или не 000567 30 сколько фармацевтически приемлемых добавок,основ или эксципиентов. Пригодными основами являются разбавители, стерильные водные среды и различные нетоксичные растворители. Предпочтительно,композиции находятся в форме водных суспензий или растворов, растворов для инъекций,которые могут содержать эмульгаторы, красители, консерванты или стабилизаторы. Однако композиции также могут находиться в форме таблеток, пилюль, порошков или гранул, вводимых перорально. Выбор добавок или эксципиентов можно определять в зависимости от растворимости и химических свойств продукта, конкретного способа введения и от сложившейся в фармацевтике практики. Для парентерального введения используют стерильные водные или неводные растворы или суспензии. Для получения неводных растворов или суспензий можно использовать природные растительные масла, такие как оливковое масло,кунжутное масло или парафиновое масло, или сложные органические эфиры для инъекций,такие как этилолеат. Стерильные водные растворы могут быть образованы водным раствором фармацевтически приемлемой соли. Водные растворы пригодны для внутривенного введения, если в них установлено необходимое рНзначение и обеспечена изотоничность, например, за счет достаточного количества хлорида натрия или глюкозы. Стерилизацию можно осуществлять путем нагревания или любым другим способом, который не ухудшает свойств композиции. Само собой разумеется, что все продукты,входящие в композицию согласно изобретению,должны быть чистыми и нетоксичными в используемых количествах. Композиции могут содержать, по крайней мере, 0,01% терапевтически активного продукта. Количество активного продукта в композиции является таким, чтобы можно было прописывать нужную дозировку. Предпочтительно,композиции получают таким образом, чтобы разовая доза содержала около 0,01-1000 мг активного продукта для введения парентеральным путем. Терапевтическое лечение можно осуществлять одновременно с другим терапевтическим лечением, включающим лечение с помощью противоопухолевых лекарственных средств,моноклональных антител, иммунологическую терапию или рентгенотерапию или лечение с помощью модификаторов биологических ответов. Модификаторы ответов включают, не исчерпывающим образом, лимфокины и цитокины, такие как интерлейкины, интерфероны (,или ) и фактор некроза опухоли. Другие химиотерапевтические агенты, пригодные для лечения нарушений, связанных с ненормальной 31 пролиферацией клеток, включают, не исчерпывающим образом, алкилирующие агенты, такие,как горчичные газы, например, мехлоретамин,циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, например, бисульфан; нитрозомочевины, например, кармустин, ломустин,семустин и стрептозоцин; триазины, например,дакарбазин; антиметаболиты, такие как аналоги фолиевой кислоты, например, метотрексат; аналоги пиримидина, такие как флуороурацил и цитарабин; аналоги пуринов, такие как меркаптопурин и тиогуанин; природные продукты,такие, как алкалоиды vinca, например, винбластин, винкристин и виндезин; эпиподофиллотоксины, такие как этопосид и тенипосид; антибиотики, такие как дактиномицин, даунорубицин, доксорубицин, блеомицин, пликамицин и митомицин; ферменты, как L-аспарагиноза; различные агенты, такие как координационные комплексы платины, такие как цисплатин; замещенные мочевины, такие как гидроксимочевина; производные метилгидразина, такие как прокарбазин; адренокортикоидные супрессоры, такие как митотан и аминоглютетимид; гормоны и антагонисты, такие как адренокортикостероиды, например, преднизолон; прогестины, такие как гидроксипрогестеронкапроат,метоксипрогестеронацетат и мегестролацетат; эстрогены, такие как диэтилстильбестрол и этинилэстрадиол; антиэстрогены, такие как тамоксифен; андрогены, такие как тестостерон-пропионат и флуоксиместерон. Дозы, используемые для введения активного начала согласно изобретению, являются такими, которые позволяют проводить профилактическое лечение или получать максимум терапевтического ответа. Дозы изменяются в зависимости от формы введения препарата, от конкретного выбранного соединения и от особенностей, присущих излечиваемому больному. Обычно дозы являются такими, которые терапевтически эффективны для лечения нарушений, вызванных ненормальной пролиферацией клеток. Продукты согласно изобретению можно также вводить настолько часто, насколько это необходимо для достижения желаемого терапевтического эффекта. У некоторых больных ответ на относительно сильные или слабые дозы возникает быстро, тогда затем достаточно вводить низкие поддерживающие дозы или вообще отменить лекарство. Обычно низкие дозы используют в начале лечения и, если необходимо,вводят все более и более сильные дозы до достижения оптимального эффекта. Другим больным может оказаться необходимым введение поддерживающих доз 1-8 раз в день, предпочтительно 1-4 раза, в зависимости от физиологических особенностей данного больного. Для некоторых больных может оказаться достаточным только 1-2 разовое введение в день. 32 Для человека дозы обычно составляют 0,01-200 мг/кг. При интраперитональном введении дозы обычно составляют 0,1-100 мг/кг,предпочтительно, 0,5-50 мг/кг и более предпочтительно 1-10 мг/кг. При внутривенном введении дозы обычно составляют 0,1-50 мг/кг, предпочтительно 0,1-5 мг/кг и более конкретно 1-2 мг/кг. Разумеется, когда выбирают наиболее подходящую дозу, то учитывают путь введения,массу больного, общее состояние его здоровья,его возраст и все факторы, которые могут влиять на эффективность лечения. Следующий пример иллюстрирует композицию согласно изобретению. Пример. 40 мг полученного в примере 1 соединения растворяют в 1 см 3 Emulphor EL 620 и 1 см 3 этанола, затем раствор разбавляют путем добавления 18 см 3 физиологической сыворотки. Композицию вводят методом перфузии в течение 1 ч с физиологическим раствором. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Таксоиды общей формулы (I) в которой Z означает радикал общей формулы в которой R1 означает бензоильный радикал или радикалR2 означает алкильный радикал с 1-8 атомами углерода,R3 означает фенил,R4 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи,R5 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи, возможно замещенный алкоксирадикалом с 1-4 атомами углерода. 2. Таксоиды по п.1, отличающиеся тем, чтоZ означает радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикалZ означает радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикалR3 означает фенил, R4 и R5, одинаковые или разные, означают, каждый, метокси-, этокси-, или пропоксирадикал. 4. Способ получения таксоидов, описанных в любом из пп.1, 2 или 3, где Z означает радикал общей формулы (II), заключающийся в том, что этерифицируют соединение общей формулы (III): в которой R4 и R5 имеют значения, указанные в любом из пп.1, 2 или 3, с помощью кислоты общей формулы (IV) в которой R1 и R3 имеют вышеуказанные значения,R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл, или с помощью производного этой кислоты для получения сложного эфира общей формулы (V) в которой R1, R3, R4, R5, R6 и R7 имеют вышеуказанные значения, защитные группы которого,обозначаемые R6 и R7, заменяют атомами водорода. 5. Способ по п.4, отличающийся тем, что этерификацию осуществляют с помощью кислоты общей формулы (IV) в присутствии агента конденсации и активирующего агента в органическом растворителе при температуре от-10 С до 90 С. 6. Способ по п.4, отличающийся тем, что если R6 и R7 вместе образуют насыщенный пятиили шестичленный гетероцикл общей формулы в котором R1 имеет вышеуказанное значение,R8 и R9, одинаковые или разные, означают атом водорода или фенил, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода,защитную группу, образуемую R6 и R7, заменяют атомами водорода следующим образом: 34 когда R1 означает бензоильный радикал или радикал R2O-CO-, в котором R2 имеет вышеуказанное значение;R8 означает фенил, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода; иR9 означает атом водорода,защитную группу, образуемую R6 и R7, заменяют атомами водорода в присутствии неорганической или органической кислоты, используемой индивидуально или в смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе, выбираемом среди спиртов, при температуре от -10 С до 60 С, предпочтительно при 15-30 С. 7. Способ получения таксоидов, описанных в любом из пп.1, 2 или 3, в котором Z означает радикал общей формулы (II), R4 и R5 имеют указанное в любом из пп.1, 2 или 3 значение,заключающийся в том, что продукт общей формулы (XVI) в которой R1, R3, R6 и R7 имеют указанное в любом из пп.1, 2, 3 или 4 значение, обрабатывают с помощью соединения общей формулы (X)(X),в которой значения радикала R, одинаковые или разные, означают алкильный радикал с 1-6 атомами углерода, с получением соединения общей формулы (XVII) в которой R, R1, R3, R6 и R7 имеют вышеуказанное значение, которое переводят в функциональные производные по положению 10 с помощью соединения общей формулы (XII)(XII),в которой R'4 означает радикал такой, что R'4-O идентичен R4, который имеет указанное в любом из пп.1, 2 или 3 значение, и X1 означает атом галогена или остаток реакционноспособного сложного эфира, с получением соединения общей формулы (XVIII) 35 группу которого заменяют атомом водорода для получения продукта общей формулы (XIX) который после взаимодействия с соединением общей формулы (XV) приводит к соединению общей формулы (V), защитные группы которого заменяют атомами водорода для получения продукта общей формулы (I), в которой Z означает радикал общей формулы (II). 8. Способ получения таксоидов, описанных в любом из пп.1, 2 или 3, заключающийся в том, что активированный никель Ренея в присутствии алифатического спирта с 1-3 атомами углерода или простого эфира вводят во взаимодействие с соединением общей формулы (XXI)Z1 означает атом водорода или радикал общей формулы (XXII)R6 и R7 имеют указанное в п. 4 значение, с получением соединения формулы (XXIII) а в случае, когда Z1 означает радикал общей формулы (XXII), заменяют защитные группы,обозначаемые как R6 и R7, на атомы водорода в условиях по п.6. 9. Способ получения по п.8, отличающийся тем, что работают при температуре от -10 С до 60 С. 10. Таксоид по п.1, отличающийся тем, что он представляет собой 4-ацетокси-2-бензо 000567 илокси-5,20-эпокси-1-гидрокси-7,10-диметокси-9-оксо-такс-11-ен-13-ил-(2R,3S)-3-трет. бутоксикарбониламино-2-гидрокси-3-фенилпропионат. 11. Таксоид по п.1, отличающийся тем, что он представляет собой 4-ацетокси-2 бензоилокси-1-гидрокси-5,20-эпокси-7 метокси-10-этокси-9-оксо-такс-11-ен-13-ил(2R,3S)-3-трет.бутоксикарбониламино-2 гидрокси-3-фенил-пропионат. 12. Таксоид по п.1, отличающийся тем, что он представляет собой 4-ацетокси-2-бензоилокси-1-гидрокси-5,20-эпокси-7-метокси 10-(1-пропил)окси-9-оксо-такс-11-ен-13 ил(2R,3S)-3-трет.бутоксикарбониламино-2 гидрокси-3-фенил-пропионат. 13. Способ получения соединения по п.10,заключающийся в том, что на первом этапе 4 ацетокси-2-бензоилокси-5,20-эпокси-1,7,10-тригидрокси-9-оксо-такс-11-ен-13-ил(2R,4S,5R)-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат обрабатывают диметилсульфоксидом в присутствии уксусной кислоты, на втором этапе полученный 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-бис(метилтиометокси)-9-оксо-такс-11-ен-13-ил-(2R,4S,5R)3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-1,З-оксазолидин-5-карбоксилат подвергают взаимодействию с этанольной суспензией никеля Ренея, и на третьем этапе полученный 4-ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7, 10-диметокси-9-оксо-такс-11-ен 13-ил-(2R,4S,5R)-3-трет.-бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилат подвергают взаимодействию с этанольным раствором соляной кислоты. 14. Таксоиды общей формулы (I), в которой Z означает атом водорода, a R4 и R5 имеют значения, указанные в п.1. 15. Способ получения таксоидов, описанных в п.14, заключающийся в том, что 10 дезацетил-баккатин III формулы (IX) обрабатывают силилгалогенидом общей формулы:(X),в которой значения радикала R, одинаковые или разные, означают алкильный радикал с 1-6 атомами углерода, с получением соединения общей формулы (XI) в которой R имеет вышеуказанное значение,которое обрабатывают соединением общей формулы (XII)(XII),в которой R'4 означает радикал такой, что R'4-O идентичен радикалу R'4, имеющему указанное в любом из пп.1, 2 или 3 значение, и X1 означает атом галогена или остатка реакционноспособного сложного эфира с получением соединения общей формулы (XIII) в которой R и R4 имеют вышеуказанное значение, в котором силилированные защитные группы заменяют атомами водорода с получением соединения общей формулы (XIV) в которой R4 имеет вышеуказанное значение,которое селективно этерифицируют в положении 7 путем обработки соединением общей формулы (XV)(XV),в которой R'5 означает радикал такой, что R'5-O идентичен R'5, имеющему указанное в любом из пп.1, 2 или 3 значение, и Х 2 означает атом гало 38 гена, с получением соединения общей формулы(I), в которой Z означает атом водорода. 16. 4-Ацетокси-2-бензоилокси-5, 20 эпокси-1-гидрокси-7,10-бис(метилтиометокси)-9-оксо-такс-11-ен-13-ил-(2R,4S,5R)-3 трет.-бутоксикарбонил-2(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилат. 17. Фармацевтическая композиция на основе таксоидного соединения, отличающаяся тем, что в качестве таксоидного соединения она содержит, по крайней мере, одно соединение по любому из пп.1, 2 или 3, в котором Z означает радикал общей формулы (II), в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и, возможно, одним или несколькими совместимыми и фармакологически активными соединениями. 18. Фармацевтическая композиция по п.17,отличающаяся тем, что она содержит, по крайней мере, одно соединение по п.10 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и,возможно, с одним или несколькими совместимыми и фармакологически активными соединениями. 19. Фармацевтическая композиция по п.17,отличающаяся тем, что она содержит, по крайней мере, одно соединение по п.11 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и,возможно, с одним или несколькими совместимыми и фармакологически активными соединениями. 20. Фармацевтическая композиция по п.17,отличающаяся тем, что она содержит, по крайней мере, одно соединение по п.12 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и,возможно, одним или несколькими совместимыми и фармакологически активными соединениями.
МПК / Метки
МПК: A61K 31/335, C07D 305/14
Метки: получения, фармацевтическая, таксоиды, композиция, основе, способы
Код ссылки
<a href="https://eas.patents.su/20-567-taksoidy-sposoby-ih-polucheniya-i-farmacevticheskaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Таксоиды, способы их получения и фармацевтическая композиция на их основе</a>
Следующий патент: Способ р.б.юна комбинированной разработки месторождений
Случайный патент: Усовершенствования, касающиеся картриджа с медикаментом












