Соединения пиримидин-4-она способ их получения и содержащие их фармацевтические композиции
Номер патента: 5402
Опубликовано: 24.02.2005
Авторы: Мюлле Оивье, Декен Анн, Миллан Марк, Брокко Морисетт, Лавие Жильбер, Дюбюффе Тьерри
Формула / Реферат
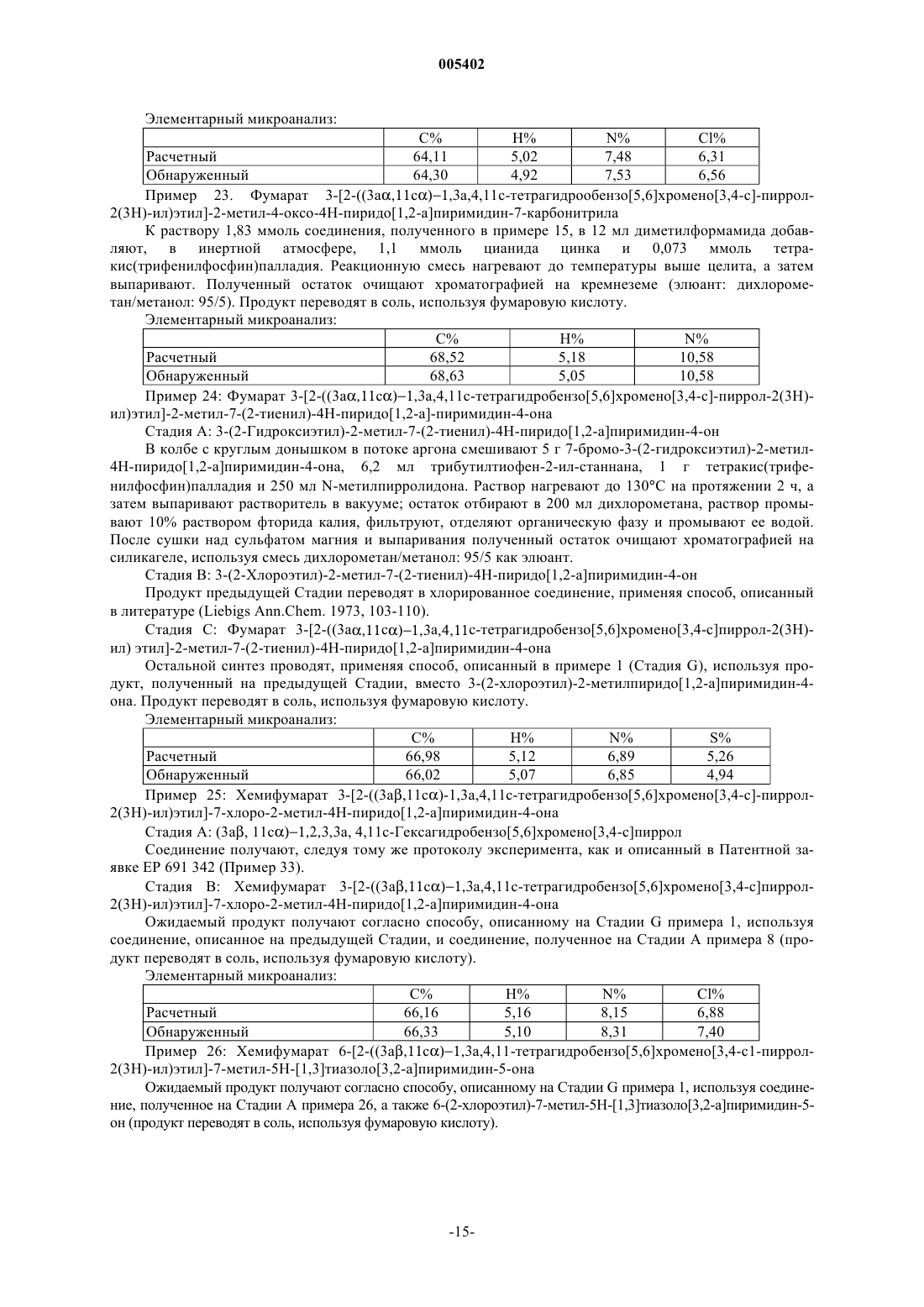
1. Соединения формулы (I)
в которой R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена или группу, выбираемую из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)полигалоалкил, гидрокси, циано, нитро и амино,
или R1 и R2, R2 и R3 или R3 и R4 совместно с атомами углерода, их несущими, образуют необязательно замещенное бензоловое кольцо или необязательно замещенное гетероароматическое кольцо,
X представляет собой атом кислорода или метиленовую группу,
A представляет собой линейную или разветвленную (C1-C6)алкиленовую цепь,
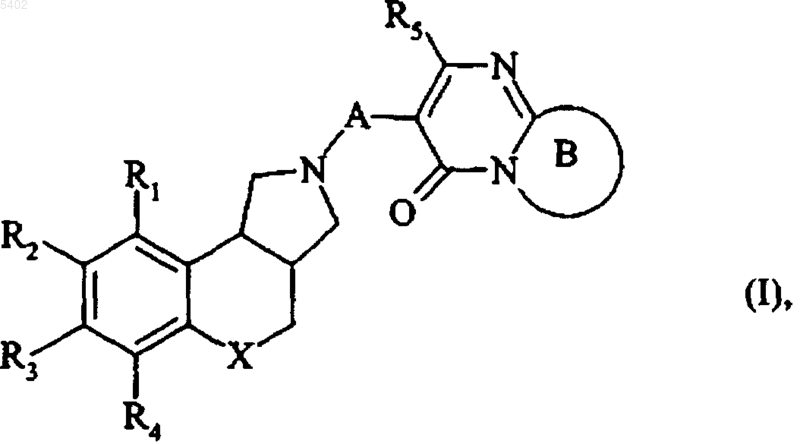
 представляет собой ненасыщенный азотсодержащий гетероцикл, необязательно замещенный одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро, амино, необязательно замещенной фенильной, необязательно замещенной тиенильной, необязательно замещенной фурильной и необязательно замещенной пирролильной групп, и
представляет собой ненасыщенный азотсодержащий гетероцикл, необязательно замещенный одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро, амино, необязательно замещенной фенильной, необязательно замещенной тиенильной, необязательно замещенной фурильной и необязательно замещенной пирролильной групп, и
R5 представляет собой линейную или разветвленную (C1-C6)алкильную группу,
к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием,
причем следует понимать, что
термин (C1-C6)алкил обозначает углеводородную цепь, содержащую от одного до шести атомов углерода,
термин (C1-C6)алкокси обозначает (C1-C6)алкилоксигруппу, содержащую от одного до шести атомов углерода,
термин (C1-C6)алкилен обозначает двухвалентную углеводородную цепь, содержащую от одного до шести атомов углерода,
термин (C1-C6)полигалоалкил обозначает углеводородную цепь, содержащую от одного до шести атомов углерода и от 1 до 9 атомов галогенов,
термин гетероароматическое кольцо обозначает 5- или 6-членное ароматическое кольцо, содержащее один, два или три гетероатома, выбираемых из кислорода, азота и серы,
термин ненасыщенный азотсодержащий гетероцикл обозначает 5-7-членное ненасыщенное кольцо, имеющее одну, две или три ненасыщенных связи и содержащее один, два или три гетероатома, один из которых представляет собой атом азота, а необязательно присутствующий(е) дополнительный(е) гетероатом(ы) выбирают из атомов кислорода, азота и серы,
термин необязательно замещенный в применении к выражениям "бензольное кольцо", "гетероароматическое кольцо", "фенил", "тиенил", "фурил" или "пирролил" показывает, что эти группы необязательно замещены одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро и аминогрупп.
2. Соединения формулы (I) по п.1, в которой R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную, линейную или разветвленную (C1-C6)алкокси или гидроксигруппу, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, в которой R1 и R2, совместно с атомами углерода их несущими, образуют бензольное кольцо, а R3 и R4, каждый, представляет собой атом водорода, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по любому из пп. с 1 по 3, в которых X представляет собой атом кислорода, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по любому из пп. с 1 по 4, в которой A представляет собой этиленовую, пропиленовую или бутиленовую цепь, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по любому из пп. с 1 по 5, в которой  представляет собой следующую группу
представляет собой следующую группу 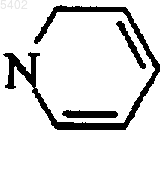 , необязательно замещенную одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогена и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро, амино и тиенильной групп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
, необязательно замещенную одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогена и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро, амино и тиенильной групп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по любому из пп. с 1 по 5, в которой  представляет собой следующую группу
представляет собой следующую группу 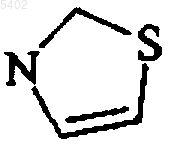 , необязательно замещенную одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогена и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро и аминогрупп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
, необязательно замещенную одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогена и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)полигалоалкильной, циано, нитро и аминогрупп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по любому из пп. с 1 по 6, в которой A представляет собой этиленовую цепочку, X представляет собой атом кислорода, R5 представляет собой метильную группу, и  представляет собой следующую группу
представляет собой следующую группу  , необязательно замещенную в положении 2 группой, выбираемой из атомов галогена и линейной или разветвленной (C1-C6)алкильной, циано и тиенильной групп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
, необязательно замещенную в положении 2 группой, выбираемой из атомов галогена и линейной или разветвленной (C1-C6)алкильной, циано и тиенильной групп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединение формулы (I) по любому из пп. 1, 2, с 4 по 6 и 8, которое представляет собой 3-[2-((3aa,9ba)-9-метокси-1,3a,4,9b-тетрагидрохромено[3,4-c]пиррол-2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-a]пиримидин-4-он, его энантиомеры и и диастереоизомеры и его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по любому из пп.1, с 3 по 6 и 8, которые представляют собой 3-[2-((3a,11ca)-1,3a,4,11c-тетрагидробензо[5,6]хромено[3,4-c]пиррол-2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-a]пиримидин-4-он и 3-[2-((3ab,11ca)-1,3a,4,11c-тетрагидробензо[5,6]хромено[3,4-c]пиррол-2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-a]пиримидин-4-он, их энантиомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II)
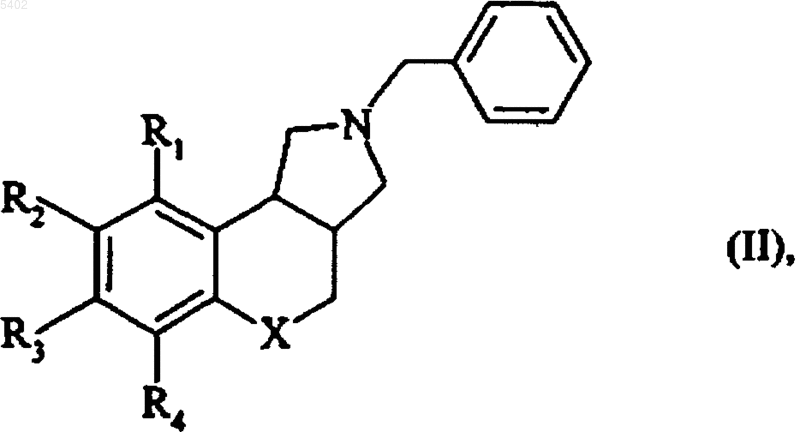
в которой R1, R2, R3, R4 и X определены для формулы (I),
подвергают каталитической гидрогенациш ё получением соединения формулы (III)
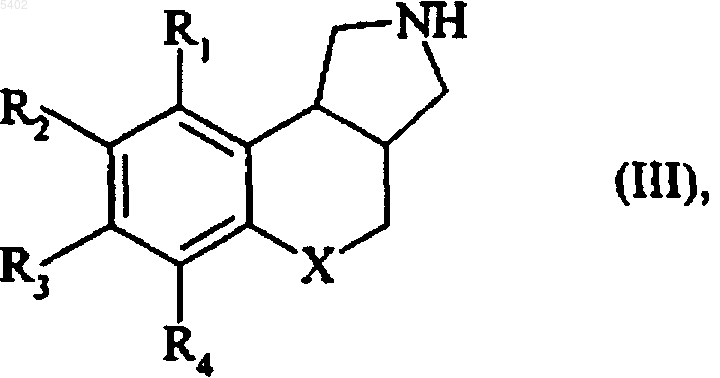
в которой R1, R2, R3, R4 и X имеют значения, указанные здесь ранее,
которое либо подвергают реакции с соединением формулы (IV)
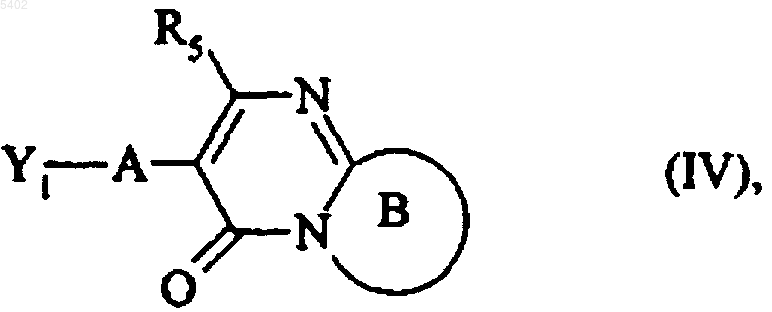
в которой A, B и R5 имеют значения, указанные для формулы (I), и Y1 представляет собой уходящую группу, такую как, например, атом галогена или тосилатная, трифлатная или месилатная группа,
либо, при условиях восстановительного аминирования с соединением формулы (V)
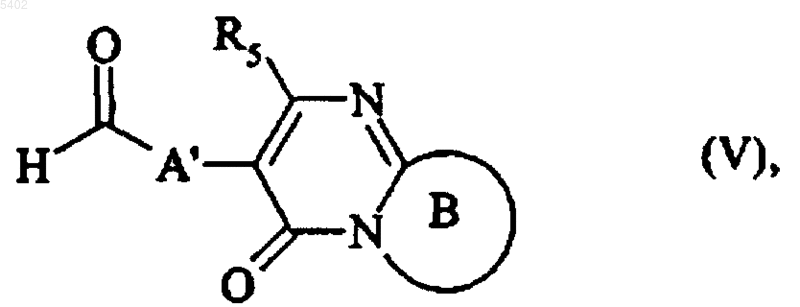
в которой B и R5 имеют значения, указанные для формулы (I) и A' представляет собой связь или линейную или разветвленную (C1-C5)алкиленовую цепь,
с получением соединения формулы (I), которое очищают, если необходимо, согласно обычной технике очистки, которое разделяют, при желании, на его стереоизомеры согласно обычной технике очистки и которое переводят, при желании, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение по любому из пп. с 1 по 10 в сочетании с одним или более инертными, нетоксичными, фармацевтически приемлемыми носителями или эксципиентами.
13. Фармацевтическая композиция по п.12 для применения в качестве двойного a2/5-HT2c антагонистического лекарственного препарата для лечения депрессии, спонтанных нарушений поведения, состояний тревоги, шизофрении, болезни Паркинсона, когнитивных расстройств, нарушений либидо, сексуальных дисфункций, нарушений аппетита и нарушений сна.
Текст
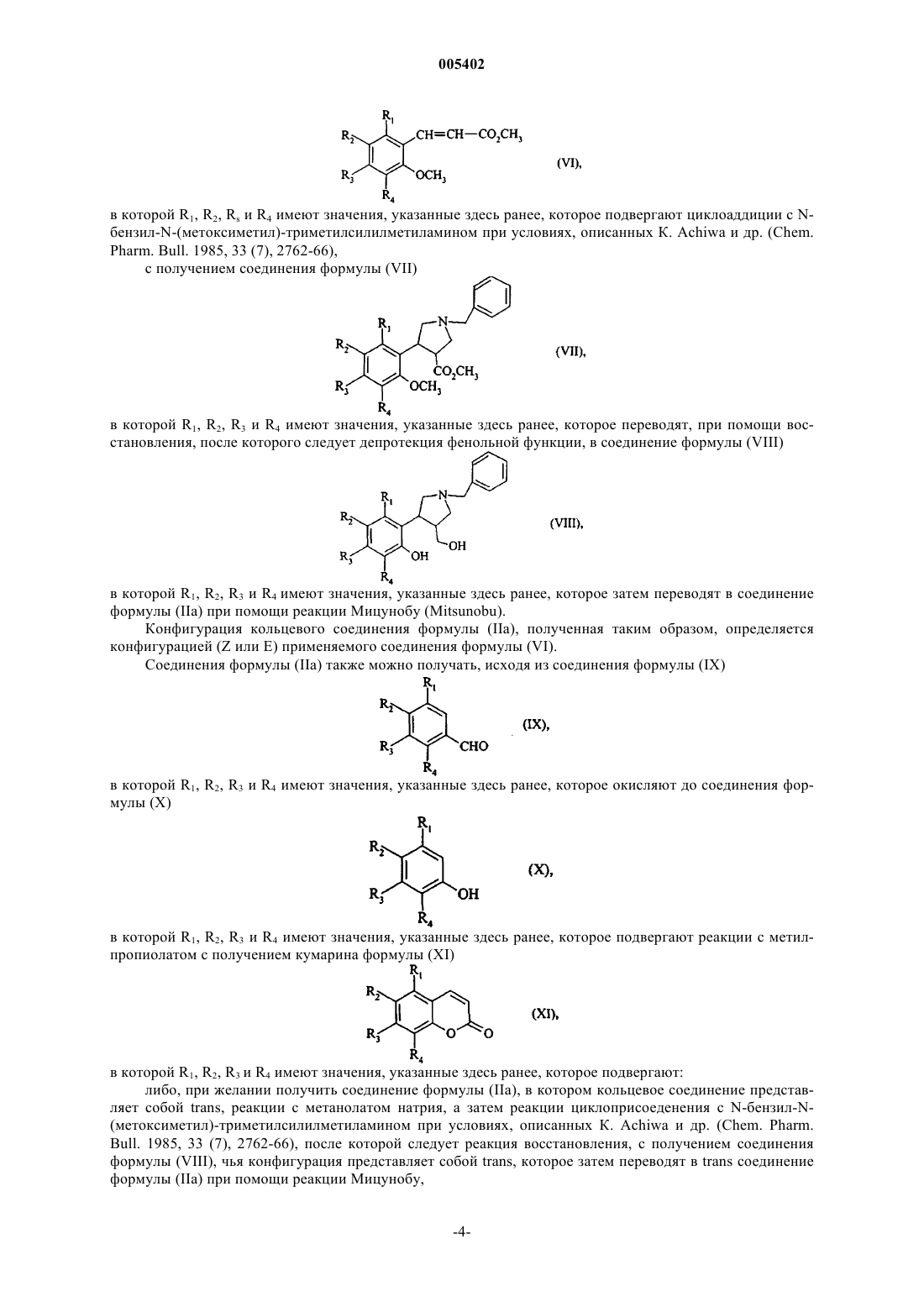
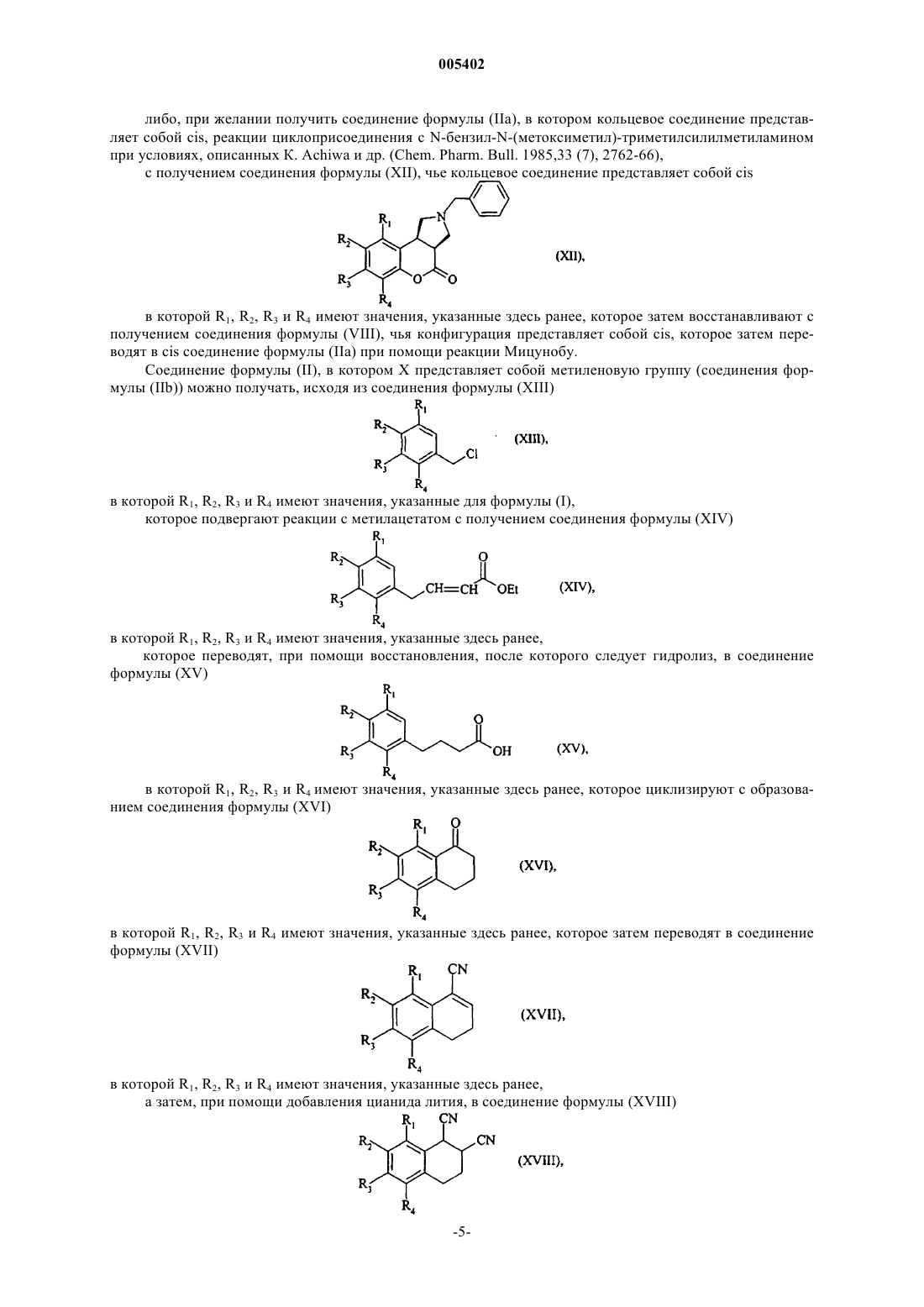
005402 Настоящее изобретение относится к новым соединениям пиримидин-4-она, способу их получения и к содержащим их фармацевтическим композициям. Изобретение также относится к их применению в сочетании с лигандами 2/5-НТ 2 с. Соединения 1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррола были описаны в Патентной заявке ЕР 691 342 в аспекте их антагонистического характера по отношению к серотонину и в Патентной заявке ЕР 887 350 в аспекте их лигандного характера по отношению к D3 допамину. Корково-периферийные структуры играют существенную роль в процессах, которые контролируют измененные функции при психиатрических нарушениях. В частности, сейчас признано, что нарушение переноса моноаминов сильно связано с этиологией этих различных нарушений. Например, в случае депрессии моноаминная активность снижена в передней части коры головного мозга и в ядерных частях полушарий морского конька. Среди различных классов авто- и гетерорецепторов моноаминов, вовлеченных в механизмы регуляции, было обнаружено, что рецепторы 2-AR (авторецептор) и 5-НТ 2 с имеют наибольшую важность. Эти два подтипа действуют в одном направлении, ингибируя допаминовый и адренергический перенос. С одной стороны, обратный контроль находится под влиянием рецепторов 2-AR (авторецептор) или норадренергических нейронов (J. Pharmacol. Exp. Then, 1994, 270,958) и, с другой стороны, рецепторы 2AR и гетерорецепторы 5-НТ 2 с влияют на ингибиторный контроль при допаминергическом и норадренергическом переносе (Neuropharmacology, 1997, 36,609, J. Psychopharmacol. 2000,14 (2), 114-138). Соединения, которые связываются с одним или другим из этих подтипов рецепторов, в прошлом проявили свой потенциал при лечении многих патологий. Например, выгодная роль соединений-антагонистов 2-AR была изучена при лечении когнитивных нарушений (J. Pharmacol., 1992, 6, 376), болезни Паркинсона (CNS Drags, 1998, 10, 189), шизофрении(Science 1999, 286, 105-107), депрессии (J. Psychopharmacol. 1996, 10, Прил. 3, 35-42), нарушений полового влечения и сексуальных дисфункций (J. Pharmacol., 1997, 11, 72). Таким образом, лиганды рецептора 5-НТ 2 с Pharmacol., там же) и болезни Паркинсона (Drag News Perspect., 1999, 12, 477), а также состояний тревоги (Br. J. Pharmacol., 1996, 117. 427), депрессии (Pharmacol. Biochem. Behav. 1988, 29, 819-820),спонтанных расстройств (Biol. Psych. 1993, 33, 3-14), нарушений аппетита (British J. Pharmacol. 1998, 123,1707-1715), нарушений сна (Neuropharmacology 1994,33 (3/4), 467-471) и шизофрении (Neurosci. Lett.,1996, 181. 65). Соединения, имеющие двойной антагонистический характер по отношению к 2-AR и 5-НТ 2 с могут быть высоко полезными для практикующих врачей тем, что дают при приеме одного соединения усиленное воздействие при улучшенной переносимости. Соединение такого типа, более того, имеет существенное преимущество над приемом двух различных соединений. Соединения по изобретению имеют новую структуру, которая обеспечивает их двойным антагонистическим характером по отношению к 2/5-НТ 2c и, таким образом, полезными при лечении депрессии,спонтанных расстройств поведения, состояний тревоги, шизофрении, болезни Паркинсона, когнитивных нарушений, расстройств полового влечения, сексуальных дисфункций, расстройств аппетита и нарушений сна. Более конкретно, изобретение относится к соединениям формулы (I)R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляют собой атом водорода, атом галогена или группу, выбираемую из линейного или разветвленного (С 1-С 6)алкила,линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (С 1-С 6)полигалоалкила,гидрокси, циано, нитро и амино,или R1 и R2, R2 и R3, или R3 и R4, совместно с атомами углерода, их несущими, образуют необязательно замещенное бензоловое кольцо или необязательно замещенное гетероароматическое кольцо,X представляет собой атом кислорода или метиленовую группу,А представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,представляет собой ненасыщенный азотсодержащий гетероцикл, необязательно замещенный одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной (C1-С 6)алкокси,линейной или разветвленной (С 1-С 6)полигалоалкильной, циано, нитро, амино, необязательно замещен-1 005402 ной фенильной, необязательно замещенной тиенильной, необязательно замещенной фурильной и необязательно замещенной пирролильной групп,и R5 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием, причем следует понимать, что термин "(С 1-С 6)алкил" обозначает углеводородную цепь, содержащую от одного до шести атомов углерода,термин "(С 1-С 6)алкокси" обозначает (С 1-С 6)алкилоксигруппу, содержащую от одного до шести атомов углерода,термин "(С 1-С 6)алкилен" обозначает двухвалентную углеводородную цепь, содержащую от одного до шести атомов углерода,термин (С 1-С 6)полигалоалкил обозначает углеводородную цепь, содержащую от одного до шести атомов углерода и от 1 до 9 атомов галогенов,термин "гетероароматическое кольцо" обозначает 5- или 6-членное ароматическое кольцо, содержащее один, два или три гетероатомов, выбираемых из кислорода, азота и серы, термин "ненасыщенный азот-содержащий гетероцикл" обозначает 5- до 7-членное ненасыщенное кольцо, имеющее одну, две или три ненасыщенных связи и содержащее один, два или три гетероатомоа, один их которых представляет собой атом азота, а необязательно присутствующие дополнительные гетероатом(ы) выбирают из атомов кислорода, азота и серы, термин "необязательно замещенный" в применении к выражениям "бензольное кольцо", "гетероароматическое кольцо", "фенил", "тиенил", "фурил" или "пирролил" показывает, что эти группы необязательно замещены одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (С 1-С 6)полигалоалкильной, циано, нитро и аминогрупп. Среди фармацевтически приемлемых солей можно упомянуть, без привнесения какого-либо ограничения, соляную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, трифтороуксусную кислоту, молочную кислоту, пирувовую кислоту, малоновую кислоту, сукциновую кислоту, глутаровую кислоту, фумаровую кислоту, малеиновую кислоту, лимонную кислоту,аскорбиновую кислоту, метансульфоновую кислоту, камфоровую кислоту, оксалиловую кислоту, др Среди фармацевтически приемлемых оснований можно упомянуть, без привнесения какого-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин, др. Среди гетероароматических колец можно упомянуть, без привнесения каких-либо ограничений,тиофен, пиридин, фуран, пиррол, имидазол, оксазол, изоксазол, тиазол, изотиазол, пиримидин. Предпочтительными ненасыщенными азотсодержащими гетероциклами являются 1,2 дигидропиридин, 2,3-дигидро-1,3-тиазол и 2,3-дигидрооксазол. Соединение (3 а,9b) или (3a,9b) понимается как обозначающее соединение, в котором относительное соединение кольца имеет cis конфигурацию. Соединение (3 а, 11 с) или (3a, 11c) понимается как обозначающее соединение, в котором относительное соединение кольца имеет cis конфигурацию. Соединение (3 а,9b) или (3a, 9b) понимается как обозначающее соединение, в котором относительное соединение кольца имеет trans конфигурацию. Соединение (3a, 11c) или (3 а, 11 с) понимается как обозначающее соединение, в котором относительное соединение кольца имеет trans конфигурацию. В предпочтительных соединениях формулы (I), R1, R2, R3 и R4, которые могут быть одинаковы или различны, каждый представляет собой атом водорода или линейную или разветвленную (С 1 С 6)алкильную, линейную или разветвленную (C1-С 6)алкокси или гидроксигруппу. Предпочтительными соединениями по изобретению являются те, в которых R1 и R2 совместно с атомами углерода, их несущими, образуют бензольное кольцо, a R3 и R4, каждый, представляет собой атом водорода.X предпочтительно представляет собой атом кислорода. Изобретение преимущественно относится к соединениям формулы (I), в которой А представляет собой этиленовую, пропиленовую или бутиленовую цепь. Изобретение более конкретно относится к соединениям формулы (I), в которых, необязательно замещенную одним или двумя одинаковыми или различсобой следующую группу ными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (C1 С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (С 1 С 6)полигалоалкильной, циано, нитро, амино и тиенильной групп. Другими предпочтительными соединениями по изобретению являются соединения формулы (I), в которой представляет собой следующую группу, необязательно замещенную одним или дву 005402 мя одинаковыми или различными заместителями, выбираемыми из атомов галогена и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (C1-С 6)полигалоалкильной, циано, нитро и аминогрупп. Настоящее изобретение более конкретно относится к соединениям формулы (I), в которой А представляет собой этиленовую цепь, X представляет собой атом кислорода, R5 представляет собой метильную группу и представляет следующую группу необязательно замещенную в 2 -положении атомом галогена или группой, выбираемой из линейной или разветвленной (С 1-С 6)алкильной, циано и тиенильной. Среди предпочтительных соединений по изобретению можно упомянуть более конкретно: 3-[2-3 а,9b)-9-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил)-этил]-2-метил-4Hпиридо[1,2-а]пиримидин-4-он, и его энантиомеры, диастереоизомеры и аддитивные соли с фармацевтически приемлемой кислотой,3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3H)-ил)-этил]-2-метил-4Hпиридо[1,2-а]пиримидин-4-он, и его энантиомеры и аддитивные соли с фармацевтически приемлемой кислотой,и 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3H-ил)этил]-2-метил-4Hпиридо[1,2-а]пиримидин-4-он, и его энантиомеры и аддитивные соли с фармацевтически приемлемой кислотой. Изобретение также относится к способу получения соединений формулы (I), отличающемуся тем,что соединение формулы (II) в которой R1, R2, R3, R4 и X определены для формулы (I),подвергают каталитической гидрогенации с получением соединения формулы (III) в которой R1, R2, R3, R4 и X имеют значения, указанные здесь ранее, которое либо подвергают реакции с соединением формулы (IV) в которой А, В и R5 имеют значения, указанные для формулы (I) и Y1 представляет собой уходящую группу, такую как, например, атом галогена или тосилатная, трифлатная или месилатная группа,либо, при условиях сниженной подвижности, с соединением формулы (V) в которой В и R5 имеют значения, указанные для формулы (I), и А' представляет собой связь или линейную или разветвленную (С 1-С 5)алкиленовую цепь,с получением соединения формулы (I), которое очищают, если необходимо, согласно обычной технике очистки, которое разделяют при желании на его стереоизомеры согласно обычной технике очистки и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формулы (II), в которой X представляет собой атом кислорода (соединения формулы(IIа можно получать, исходя из соединения формулы (VI) в которой R1, R2, Rs и R4 имеют значения, указанные здесь ранее, которое подвергают циклоаддиции с Nбензил-N-(метоксиметил)-триметилсилилметиламином при условиях, описанных К. Achiwa и др. (Chem.Pharm. Bull. 1985, 33 (7), 2762-66),с получением соединения формулы (VII) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое переводят, при помощи восстановления, после которого следует депротекция фенольной функции, в соединение формулы (VIII) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое затем переводят в соединение формулы (IIа) при помощи реакции Мицунобу (Mitsunobu). Конфигурация кольцевого соединения формулы (IIа), полученная таким образом, определяется конфигурацией (Z или Е) применяемого соединения формулы (VI). Соединения формулы (IIа) также можно получать, исходя из соединения формулы (IX) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое окисляют до соединения формулы (X) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое подвергают реакции с метилпропиолатом с получением кумарина формулы (XI) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое подвергают: либо, при желании получить соединение формулы (IIа), в котором кольцевое соединение представляет собой trans, реакции с метанолатом натрия, а затем реакции циклоприсоеденения с N-бензил-N(метоксиметил)-триметилсилилметиламином при условиях, описанных К. Achiwa и др. (Chem. Pharm.Bull. 1985, 33 (7), 2762-66), после которой следует реакция восстановления, с получением соединения формулы (VIII), чья конфигурация представляет собой trans, которое затем переводят в trans соединение формулы (IIа) при помощи реакции Мицунобу,-4 005402 либо, при желании получить соединение формулы (IIа), в котором кольцевое соединение представляет собой cis, реакции циклоприсоединения с N-бензил-N-(метоксиметил)-триметилсилилметиламином при условиях, описанных К. Achiwa и др. (Chem. Pharm. Bull. 1985,33 (7), 2762-66),с получением соединения формулы (XII), чье кольцевое соединение представляет собой cis в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое затем восстанавливают с получением соединения формулы (VIII), чья конфигурация представляет собой cis, которое затем переводят в cis соединение формулы (IIа) при помощи реакции Мицунобу. Соединение формулы (II), в котором X представляет собой метиленовую группу (соединения формулы (IIb можно получать, исходя из соединения формулы (XIII) в которой R1, R2, R3 и R4 имеют значения, указанные для формулы (I),которое подвергают реакции с метилацетатом с получением соединения формулы (XIV) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее,которое переводят, при помощи восстановления, после которого следует гидролиз, в соединение формулы (XV) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое циклизируют с образованием соединения формулы (XVI) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое затем переводят в соединение формулы (XVII) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее,а затем, при помощи добавления цианида лития, в соединение формулы (XVIII)-5 005402 в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее,цианогруппы которого переводят в карбоксигруппы перед конденсацией с получением соединения формулы (XIX) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее,которое подвергают реакции с бензиламином с получением соединения формулы (XX) в которой R1, R2, R3 и R4 имеют значения, указанные здесь ранее, которое при помощи реакции переводят в соединение формулы (IIb). Изобретение относится также к фармацевтическим композициям, включающим как активный ингредиент соединение формулы (I) совместно с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами. Среди фармацевтических композиций по изобретению следует упомянуть более конкретно те, которые пригодны для орального, парентерального (внутривенного,внутримышечного или подкожного) или назального применения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, пастилки, суппозитории, кремы, мази, кожные гели, инъекционные препараты, питьевые суспензии, др. Полезная доза может варьироваться согласно природе и сложности нарушения, графику приема, а также возрасту и весу пациента и любым связанным лечениям. Дозировка варьируется от 0,5 мг до 2 г на 24 ч за один или более приемов. Следующие примеры иллюстрируют изобретение, но никоим образом его не ограничивают. Исходные материалы являются известными продуктами или их получают согласно известным способам получения. Структуру соединений, описанных в примерах, определяли при помощи традиционных спектрометрических техник (инфракрасная, ЯМР, масс-спектрометрия). Пример 1. Дигидрохлорид 3-[2-3 а,9b)-9-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]-пиррол 2(3H)-ил)-этил]-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Стадия А: Метил (3,4)-1-бензил-4-(2,6-диметоксифенил)-3-пирролидинкарбоксилат К раствору, охлажденному до 5 С, содержащему 120 ммоль метилового эфира cis-(2,6 диметокси)коричной кислоты и 0,1 мл трифтороуксусной кислоты в 150 мл этилацетата, медленно прибавляют 100 ммоль N-бензил-N-(метоксиметил)триметилсилилметиламина. Реакционную смесь нагревают от 30 до 55 С на протяжении 75 мин. Затем добавляют 0,75 г карбоната натрия и смесь перемешивают на протяжении 15 мин. После фильтрации и выпаривания растворителей остаток отбирают в 100 мл этилацетата и раствор нагревают при 50 С. Затем добавляют 110 ммоль щавелевой кислоты, растворенной в 100 мл ацетона при энергичном перемешивании, которое продолжают на протяжении 15 ч. После фильтрации, а затем промывания эфиром, полученный оксалат обрабатывают двумя эквивалентами 1 Н раствора гидроксида калия с получением ожидаемого продукта. Стадия В: (3,4)-1-Бензил-3-гидроксиметил-4-(2,6-диметоксифенил)-пирролидин К 120 ммоль алюминиевого гидрида лития, суспендированного в 800 мл тетрагидрофурана при+5 С, добавляют 100 ммоль соединения, полученного на предыдущей Стадии, растворенного в 400 мл тетрагидрофурана. После перемешивания на протяжении 1 ч при этой температуре смесь обрабатывают,медленно добавляя 11 мл воды, 15 мл 2 Н раствора гидроксида натрия и 26 мл воды. Смесь перемешивают на протяжении 10 ч, а затем фильтруют. Растворитель выпаривают с получением ожидаемого продукта. Стадия С: (3,4)-1-Бензил-3-гидроксиметил-4-(2,6-дигидроксифенил)-пирролидин К 8,9 ммоль соединения, полученного на предыдущей Стадии, в 170 мл дихлорометана добавляют 44,5 мл 1 М раствора трибромида бора в дихлорометане. Реакционную смесь нагревают с обратным холодильником на протяжении 8 ч, а затем обрабатывают концентрированным раствором гидроксида натрия в течение 1 ч. Смесь затем нейтрализуют, используя соляную кислоту. После экстрагирования дихлорометаном, ожидаемый продукт получают после очистки остатка при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол 95/5).-6 005402 Стадия D: Гидрохлорид (3 а, 9b)-2-бензил-9-гидрокси-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррола К 80 ммоль соединения, полученного на предыдущей Стадии, в 1 л тетрагидрофурана добавляют последовательно 120 ммоль диэтилазокарбоксилата и 120 ммоль трифенилфосфина. Смесь перемешивают при температуре окружающей среды на протяжении 15 ч. Растворитель выпаривают, неочищенный продукт отбирают в 1 л изопропилового эфира и нагревают с обратным холодильником на протяжении 1 ч. Полученный осадок удаляют, а фильтрат концентрируют перед хроматографированием (элюант: циклогексан/этилацетат 70/30). Полученный продукт переводят в соль, используя соляную кислоту. Стадия Е: Гидрохлорид (3 а,9b)-2-бензил-9-метокси-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррола 11,6 ммоль соединения, полученного на предыдущей Стадии, в 50 мл диметилформамида добавляют к раствору, который содержит 14 ммоль гидрида натрия в 50 мл диметилформамида. После перемешивания на протяжении 30 мин, добавляют 11,6 ммоль метилйодида. После 1 ч при температуре окружающей среды, а затем гидролиза, растворители выпаривают. Остаток затем отбирают в воду. После экстрагирования эфиром, сушки и выпаривания, получают ожидаемый продукт после очистки остатка при помощи хроматографии на кремнеземной колонне, используя смесь циклогексана/этилацетатаN% С 1% Расчетный 68,77 6,68 4,22 10,68 Обнаруженный 68,66 4,48 4,45 10,97 Стадия F: (3 а, 9b)-9-Метокси-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол 50 ммоль соединения, полученного на предыдущей Стадии, растворяют в смеси 200 мл метанола и 50 мл воды. Добавляют 50 ммоль 5 Н раствора соляной кислоты в этаноле. После добавления 2 г дигидроксила палладия реакционную смесь помещают в атмосферу водорода. После абсорбции теоретического объема водорода катализатор отфильтровывают, а фильтрат выпаривают. Полученный остаток обрабатывают 1 Н раствором гидроксида натрия и экстрагируют дихлорометаном с получением ожидаемого продукта. Стадия G: Дигидрохлорид 3-[2-3 а,9b)9 Метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]-пиррол 2(3 Н)-ил)-этил]-2-метил-4 Н-пиридо[1, 2-а]пиримидин-4-она К 7 ммоль соединения, полученного на предыдущей Стадии, в 100 мл ацетонитрила добавляют 7 ммоль карбоната калия. Смесь нагревают до 60 С. Затем за один раз добавляют 7 ммоль 3-(2-хлороэтил)2-метилпиридо[1,2-]пиримидин-4-она (полученного согласно Liebigs Ann. Chem. 1973, 103-110). Смесь нагревают при 80 С на протяжении 18 ч. После охлаждения и добавления воды смесь экстрагируют дихлорометаном, а затем промывают и сушат. После фильтрации и выпаривания полученный остаток очищают хроматографией на кремнеземе (элюант: дихлорометан/метанол 95/5). Полученный продукт переводят в соль, используя соляную кислоту. Элементарный микроанализ: С% Н%N% Сl% Расчетный 59,49 5,86 9,05 15,27 Обнаруженный 59,57 5,89 9,09 15,41 Пример 2: Сесквифумарат 3-[2-3 а,9b)-6,8-Диметокси-7-метил-13 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил)-этил]-2-метил-4H-пиридо[1,2-а]-пиримидин-4-она Стадия А: 2,4-Диметокси-3-метилфенол К 416 ммоль 2,4-диметокси-3-метилбензальдегида, растворенного в 200 мл дихлорометана, добавляют 624 ммоль мета-хлорпербензойной кислоты. Реакционную смесь нагревают с обратным холодильником на протяжении 5 ч перед фильтрацией. Фильтрат трижды промывают, используя 200 мл насыщенного раствора NаНСО 3 каждый раз, а затем сушат над сульфатом магния. После выпаривания растворителя неочищенный продукт отбирают в 400 мл метанола. Добавляют 624 ммоль 10% раствора КОН. Смесь перемешивают на протяжении 1 ч, объем снижают до 1/3. Неочищенный продукт отбирают в 400 мл воды и экстрагируют дихлорометаном. Органические фазы собирают и сушат. После выпаривания растворителя полученный остаток очищают при помощи хроматографии на кремнеземной колонне (элюант: циклогексан/этилацетат 90/10) с получением ожидаемого продукта. Стадия В: 6,8-Диметокси-7-метилкумарин К 270 ммоль соединения, полученного на предыдущей Стадии, растворенного в 500 мл безводной метансульфоновой кислоты, добавляют 270 ммоль метилпропиолата. Реакционную смесь нагревают при 90 С на протяжении 30 мин, а затем охлаждают до 0 С. После медленного добавления воды смесь экстрагируют дихлорометаном. Органические фазы собирают, промывают 1 Н раствором гидроксида натрия,а затем сушат. После выпаривания растворителей полученный остаток растирают в порошок в этиловом эфире, а затем фильтруют с получением ожидаемого продукта. Стадия С: (3,4)-1 -Бензил-3-гидроксиметил-4-(3,5-диметокси-2-гидрокси-4-толил)-пирролидин Ожидаемый продукт получают по способам, описанным на Стадиях А и В примера 1, исходя из соединения, полученного на предыдущей Стадии. Стадия D: Гидрохлорид (3 а, 9b)-2-Бензил-6,8-диметокси-7-метил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррола Ожидаемый продукт получают согласно способу, описанному на Стадии D примера 1, исходя из соединения, полученного на предыдущей Стадии. Элементарный микроанализ: С% Н%N% Сl% Расчетный 67,10 6,97 3,73 9,43 Обнаруженный 66,90 7,00 3,92 9,57 Стадия Е: (3 а, 9b)6,8 Диметокси- 7-метил-1, 2,3,3 а, 4,9b-гексагидрохромено-[3,4-с]пиррол Ожидаемый продукт получают согласно способу, описанному на Стадии F примера 1, исходя из соединения, полученного на предыдущей Стадии. Стадия F: Сесквифумарат 3-[2-3 а, 9b)-6,8-Диметокси-7-метил-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3 Н)-ил)-этил]-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, исходя из соединения, полученного на предыдущей Стадии. Полученный продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 61,07 5,80 6,89 Обнаруженный 61,73 6,03 7,19 Пример 3: Фумарат 3-[2-(1,3 а,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3H)-ил)-этил]-2 метил-4H-пиридо[1,2-а]пиримидин-4- она Стадия А : 1,2,3,3 а,4,11 с-Гексагидробензо[5,6]хромено[3,4-с]пиррол Ожидаемый продукт получают по способам, описанным на Стадиях с С до F примера 2, исходя из бензо[f]хромен-3-она. Стадия В: Фумарат 3-[2-(1,3 а,4, 11 с-Тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)-ил)-этил]-2 метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, исходя из соединения, полученного на предыдущей Стадии. Элементарный микроанализ: С% Н%N% Расчетный 68,30 5,54 7,96 Обнаруженный 67,87 5,57 7,79 Пример 4: Фумарат 6-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)ил)-этил]-7-метил-5 Н-[1,3]тиазоло[3,2-а]пиримидин-5-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя соединение, описанное на Стадии А примера 3 и 6-(2-хлороэтил)-7-метилтиазоло[3,2-а]пиримидин-5-он в качестве исходных материалов. Полученный продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%Ann. Chem. 1973, 103-110) в 140 мл диметилсульфоксида добавляют 120 ммоль цианида калия. Реакционную смесь нагревают до 100 С на протяжении 3 ч. После выпаривания диметилсульфоксила неочищенный продукт отбирают в дихлорометан и воду и экстрагируют дихлорометаном. Органические фазы промывают и сушат. Остаток очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол 95/5) и полученный продукт затем растворяют в 100 мл дихлорометана. Смесь охлаждают до -70 С; вводят 120 ммоль гидрида диизобутилалюминия. После перемешивания на протяжении 2 ч при этой температуре смесь обрабатывают 50 мл метанола и 100 мл воды; органическую фазу затем промывают и сушат с получением ожидаемого продукта. Стадия В: Хемифумарат 3-[3-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол 2(3 Н)-ил)пропил]-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она К 10 ммоль соединения, описанного на Стадии А примера 3, растворенного в 1,2-дихлорометане,добавляют 10 ммоль соединения, полученного на предыдущей Стадии, после чего следует 14 ммоль триацетоксиборогидрида натрия. После перемешивания на протяжении 4 ч добавляют воду, реакционную смесь затем разделяют и экстрагируют дихлорометаном. Объединенные органические фазы сушат и затем фильтруют и выпаривают. Полученный таким образом остаток очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол 95/5) с получением ожидаемого продукта после перевода в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 72,03 6,04 8,69 Обнаруженный 71,68 5,95 8,59 Пример 6: Фумарат 3-2-[(3 а,11 с)1,3,3,4,5,11 с-гексагидро-2H-нафто[1,2-е]-изоиндол-2 ил]этил-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Стадия А: 2-Хлорометилнафтален К 1,26 моль нафт-2-илметанола в 1,5 л толуола медленно добавляют 3,8 моль тионилхлорида. Смесь затем нагревают с обратным холодильником на протяжении 2 ч. После охлаждения растворитель выпаривают. Неочищенный продукт отбирают дважды в толуол и выпаривают. Полученное масло отбирают в дихлорометан, промывают и сушат. После фильтрации и выпаривания полученное масло перегоняют с получением ожидаемого продукта. Точка кипения: 118 С под 0,09 мм Hg Стадия В: Этил 4-(2-нафтил)-2-бутеноат К 863 ммоль соединения, полученного на предыдущей Стадии, в 206 мл трибутиламина добавляют 1,07 моль этилакрилата и 10 ммоль ацетата палладия. Реакционную смесь нагревают с обратным холодильником на протяжении пяти часов. После охлаждения, смесь подвергают гидролизу и экстрагируют один раз дихлорометаном. Органическую фазу промывают 1 Н раствором соляной кислоты, а затем водой перед сушкой. Продукт очищают при помощи хроматографии на кремнеземе (элюант: циклогексан/этилацетат 95/5) с получением ожидаемого продукта. Стадия С: Этил 4-(2-нафтил)-2-бутаноат К 490 ммоль соединения, полученного на предыдущей Стадии, в 3 л этанола добавляют 7 г 10% палладия на углероде. Смесь затем помещают в атмосферу водорода. После абсорбции теоретического количества водорода смесь отфильтровывают, а растворитель выпаривают с получением ожидаемого продукта. Стадия D: 4-(2-Нафтил)-2-бутановая кислота К 484 ммоль соединения, полученного на предыдущей Стадии, в 1,5 л этанола добавляют 490 мл титрованного 2 Н раствора гидроксида натрия. Смесь нагревают и поддерживают при температуре флегмы на протяжении 1 ч. Этанол затем выпаривают. рН устанавливают на значение 5-6, используя 1 Н соляную кислоту. Полученный осадок отфильтровывают и промывают водой с получением ожидаемого продукта. Стадия Е: 2,3-Дигидро-4(1 Н)-фенантренон К 550 г полифосфорной кислоты добавляют 240 ммоль соединения, полученного на предыдущей Стадии. Реакционную смесь нагревают при 80 С на протяжении 3 ч, а затем выливают на лед. После перемешивания на протяжении одного часа образовавшийся осадок отфильтровывают, промывают водой и сушат с получением ожидаемого продукта. Стадия F: 1,2-Дигидро-4-фенантренкарбонитрил К 207 ммоль соединения, полученного на предыдущей Стадии, в 500 мл тетрагидрофурана добавляют,последовательно, 243 ммоль цианида триметилсилана, а затем 16 ммоль 0,5 М раствора цианида лития в диметилформамиде. Реакционную смесь перемешивают на протяжении 2 ч, а затем выливают на лед и 4 раза экстрагируют эфиром. Органические фазы промывают водой перед сушкой. После фильтрации растворители выпаривают. Остаток растворяют в 325 мл пиридина. Добавляют 42 мл РОСl3. Смесь нагревают до 100 С на протяжении 3 ч, а затем охлаждают перед тем, как вылить на 400 мл ледяной соляной кислоты После добавления дихлорометана смесь разделяют, а затем экстрагируют дихлорометаном. Объединенные органические фазы промывают, а затем сушат. После фильтрации растворители выпаривают. Полученный остаток очищают хроматографией на кремнеземе (элюант:циклогексан/дихлорометан: 70/30) с получением ожидаемого продукта. Стадия G: 1,2,3,4- Тетрагидрофенантрен-3,4-дикарбонитрил К 87 ммоль уксусной кислоты добавляют 105 ммоль 0,5 М раствора цианида лития, а затем, при 5 С,82 ммоль соединения, полученного на предыдущей Стадии, растворенного в 500 мл диметилформамида. Реакционную смесь нагревают при 100 С на протяжении 2 ч перед охлаждением, а затем сушат и выливают на лед. Полученный осадок отфильтровывают и промывают с получением ожидаемого продукта.-9 005402 Стадия Н: 1,2,3,4-Тетрагидрофенантрен-3,4-дикарбоновая кислота К 68 ммоль соединения, полученного на предыдущей Стадии, последовательно добавляют 42 мл уксусной кислоты, а затем 84 мл концентрированной соляной кислоты. Реакционную смесь нагревают с обратным холодильником на протяжении 5 дней перед тем, как охладить и вылить в один литр воды. Продукт экстрагируют этилацетатом. Органические фазы собирают и сушат. После фильтрации и выпаривания растворителя, полученный остаток очищают при помощи хроматографии (элюант: дихлорометан/метанол/уксусная кислота : 95/5/0.5) с получением ожидаемого продукта. Стадия I: (3 а,11 с)3 а,4,5,11 с-Тетрагидрофенантро[3,4-с]фуран-1,3-дион К 37 ммоль соединения, полученного на предыдущей Стадии, добавляют 1,67 моль уксусного ангидрида. Реакционную смесь нагревают с обратным холодильником на протяжении 2 ч, а затем выпаривают до сухости. Полученный остаток растирают в эфире с получением ожидаемого продукта в виде кристаллов. Стадия J: (3 а, 11 с)2 Бензил-3 а, 4,5, 11 с-тетрагидро-1 Н-нафто[1,2-е]изоиндол-1,3(2 Н)-дион К 18 ммоль соединения, полученного на предыдущей Стадии, в 400 мл толуола добавляют 18 ммоль бензиламина. Реакционную смесь нагревают с обратным холодильником на протяжении 30 ч. Добавляют 70 мл 0,1 Н раствора соляной кислоты. Смесь разделяют. Органическую фазу сушат, фильтруют,а затем выпаривают. Полученный остаток очищают хроматографией на кремнеземе (элюант: дихлорометан/циклогексан : 60/40) с получением ожидаемого продукта. Стадия K: Гидрохлорид (3 а,11 с) 2 бензил-2,3,3 а,4,5,11 с-гексагидро-1 Н-нафто[1,2-е]-изоиндола 180 мл безводного эфира выливают на 93 ммоль алюминиевого гидирда лития. После охлаждения до 10 С, добавляют 15,5 ммоль соединения, полученного на предыдущей Стадии, растворенного в 250 мл дихлорометана. Реакционную смесь перемешивают при температуре окружающей среды на протяжении 2 ч, а затем охлаждают до -10 С. Медленно добавляют 90 мл воды. Полученный гель отфильтровывают и промывают обильным количеством дихлорометана. Органические фазы и фильтрат объединяют и разделяют. Органическую фазу сушат, а затем выпаривают. Полученный остаток очищают хроматографией на кремнеземе (элюант: циклогексан/этилацетат 80/20). Полученный продукт переводят в соль, используя соляную кислоту. Элементарный микроанализ: С% Н%N% С 1% Расчетный 78,95 6,91 4,00 10,13 Обнаруженный 78,60 6,99 4,28 10,04 Стадия L: Фумарат 3-2-[(3 а,11 с)-1,3,3 а,4,5,11 с-гексагидро-2 Н-нафто[1,2-е]изоиндол-2-ил]этил 2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают по способам, описанным на Стадиях F и G примера 1, исходя из соединения, полученного на предыдущей Стадии. Полученный продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 70,49 5,88 7,85 Обнаруженный 70,84 5,94 7,99 Пример 7: Сесквифумарат 3-[2-3 а,9b)6,8 диметокси-7-метил-13 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил)-этил]-2-метил-4H-пиридо[1,2-а]-пиримидин-4-она Стадия А: Метиловый эфир trans-(3,5-Диметокси-6-гидрокси-6-метил)коричной кислоты К 70 ммоль соединения, полученного на Стадии В примера 2, в 100 мл метанола медленно добавляют 205 ммоль 30% раствора метилата натрия в метаноле. Реакционную смесь нагревают с обратным холодильником на протяжении 4 дней перед гидролизом с использованием 1 Н раствор соляной кислоты. Остаток отфильтровывают, промывают водой и сушат с получением ожидаемого продукта. Стадия В: Гидрохлорид(3 а, 9b)2 бензил-6,8-диметокси-7-метил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррола Ожидаемый продукт получают по способам, описанным на Стадиях С и D примера 2, исходя из соединения, полученного на предыдущей Стадии. Элементарный микроанализ: С% Н%N% Сl% Расчетный 67,10 6,97 3,73 9,43 Обнаруженный 67,15 7,13 3,76 9,73 Стадия С: Сесквифумарат 3-[2-3 а, 9b)6,8 диметокси-7-метил-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3 Н)-ил)-этил]-2-метил-4 Н-пиридо[1,2-а]-пиримидин-4-она Ожидаемый продукт получают по способам, описанным на Стадиях F и G примера 1, исходя из соединения, полученного на предыдущей Стадии. Полученный продукт переводят в соль, используя фумаровую кислоту.-10 005402 Пример 8: Фумарат 3-[2-(1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3H)-ил)этил]-7 хлоро-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Стадия А: 7-Хлоро-3-(2-хлороэтил)-2-метил-4 Н-пиридо[1,2-a]пиримидин-4-он Продукт получают согласно способу, описанному в литературе (Liebigs Ann. Chem. 1973,103-110),используя 2-амино-5-хлоропиридин в качестве исходного реагента. Стадия В: Фумарат 3-[2-(1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)-ил)этил]-7 хлоро-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя соединение, описанное на предыдущей Стадии, и соединение, полученное на Стадии А примера 3 (продукт переводят в соль, используя фумаровую кислоту). Элементарный микроанализ: С% Н%N% С 1% Расчетный 63,21 4,97 7,18 6,08 Обнаруженный 62,98 5,08 7,03 6,19 Пример 9: Фумарат 3-[2-3 а,9b)-6,8-диметокси-7-метил-1,3 а,4,9b-тетрагидрохромено[3,4 с]пиррол-2(3H)-ил)этил]-7-хлоро-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают по способу, описанному в примере 2, используя 7-хлоро-3-(2 хлороэтил)-2-метил-4H-пиридо[1,2-а]пиримидин-4-он, полученный на Стадии А примера 8, в качестве исходного материала вместо 3-(2-хлороэтил)-2-метил-4H-пиридо[1,2-а]-пиримидин-4-она. Полученный продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% С 1% Расчетный 59,44 5,5 7,17 6,05 Обнаруженный 58,94 5,43 6,97 6,34 Пример 10: Фумарат 6-[2-3 а,9b)-6-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]-пиррол 2(3H)этил]-7-метил-5H-[1,3]тиазоло[3,2-а]пиримидин-5-она Стадия А: (3 а,9b)-6-Метокси-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол Продукт получают как на Стадиях A-F примера 1, исходя из cis-(2,3 диметокси)коричной кислоты. Стадия В: Фумарат 6-[2-3 а,9b)-6-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3 Н)ил)этил]-7-метил-5 Н-[1,3]тиазоло[3,2-а]пиримидин-5-она Ожидаемый продукт получают, исходя из соединения, полученного на предыдущей Стадии и следуя способу, использованному на Стадии G примера 1, используя 6-(2-хлороэтил)-7-метил-5H[1,3]тиазоло[3,2-а]пиримидин-5-он. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%S% Расчетный 58,47 5,30 8,18 6,24 Обнаруженный 58,78 5,22 8,27 6,20 Пример 11: Фумарат 3-[2-3 а,9b)-6-Метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]-пиррол-2(3H)ил)этил]-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают по способу, описанному в примере 1, Стадия G, используя соединение, описанное на Стадии А примера 10 и 3-(2-хлороэтил)-2-метил-4H-пиридо[1,2-а]пиримидин-4-он в качестве исходных материалов. Полученный продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 63,90 5,76 8,28 Обнаруженный 63,03 5,77 7,91 Пример 12: Фумарат 3-[2-3 а,9b)-6-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]-пиррол-2(3H)ил)этил]-7-бромо-2-метил-4H-пиридо[1,2-а]-пиримидин-4-она Стадия А: 3-(2-Хлороэтил)-7-бромо-2-метил-4 Н-пиридо-[1,2-а]пиримидин-4-он Продукт получают по способу, описанному на стадии А примера 8, используя 2-амино-5 бромопиридин в качестве исходного реагента. Стадия В: Фумарат 3-[2-3 а,9b)-6-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3 Н)ил)этил]-7-бромо-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают по способу, описанному в примере 11, исходя из соединения примера 10 и пиримидинона, полученного на предыдущей Стадии. Продукт переводят в соль, используя фумаровую кислоту.N% Вr% Расчетный 55,30 4,81 7,17 13,63 Обнаруженный 55,02 4,75 7,12 13,81 Пример 13: Фумарат 3-[2-3 а,11 с)1,3 а,4,1 с-тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)ил)этил]-2,7-диметил-4H-пиридо[1,2-а] пиримидин-4-она Стадия А: 3-(2-Хлороэтил)-2,7-диметил-4 Н-пиридо[1,2-а]пиримидин-4-он Продукт получают по способу, описанному на стадии А примера 8, используя 2-амино-5 метилпиридин в качестве исходного реагента. Стадия В: Фумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)ил)этил]-2,7-диметил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, исходя из соединения, полученного на предыдущей Стадии и соединения Стадии А примера 3. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 68,75 5,77 7,76 Обнаруженный 67,96 5,60 7,67 Пример 14: Фумарат 3-[2-3 а,9b)-6,8-диметокси-7-метил-1,3 а,4,9b-тетрагидрохромено[3,4 с]пиррол-2(3H)-ил)этил]-2,7-диметил-4H-пиридо-[1,2-а]пиримидин-4-она Ожидаемый продукт получают по способу, описанному в примере 1, Стадия G, используя соединение, полученное на Стадии А примера 13 и продукт Стадии Е примера 2 в качестве исходных материалов. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 63,70 6,24 7,43 Обнаруженный 63,57 6,09 7,36 Пример 15: Фумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)ил)этил]-7-бромо-2-метил-4H-пиридо[1,2-а]-пиримидин-4-она Ожидаемый продукт получают по способу, описанному в примере 1, Стадия G, используя соединение, полученное на Стадии А примера 3 совместно с продуктом, полученным на Стадии А примера 12 в качестве исходных материалов. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Вr% Расчетный 59,41 4,65 6,93 13,18 Обнаруженный 59,04 4,69 6,81 12,93 Пример 16: Фумарат 3-[2-3 а,9b)-6-гидрокси-8-метокси-7-метил-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Стадия А: (3 а, 9b)-2-Бензил-8-метокси-7-метил-1,2,3,3 а,4,9b-гексагидрохромено-[3,4-с]пиррол-6-ол При 0 С добавляют 64 мл молярного раствора трибромида бора в дихлорометане к раствору 20 г соединения, описанного на Стадии D примера 2. После перемешивания на протяжении трех часов при 20 С проводят гидролиз, используя 200 мл насыщенного раствора гидрогенкарбоната натрия, и отделяют органическую фазу. Полученный остаток очищают хроматографией на силикагеле, используя смесь дихлорометан/метанол: 98/2 как элюант. Стадия В: (3 а, 9b)-8-Метокси-7-метил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]-пиррол-6-ол Продукт, полученный на предыдущей Стадии, дебензилируют, применяя способ, описанный на Стадии F примера 1. Стадия С: Фумарат 3-[2-3 а, 9b)6 гидрокси-8-метокси-7-метил-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3 Н)-ил) этил]-2-метил-4 Н-пиридо[1,2-а]-пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя соединение, описанное на предыдущей Стадии, и 3-(2-хлороэтил)-2-метил-4H-пиридо[1,2-а]пиримидин 4-он в качестве исходных реагентов. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н% Пример 17: 3-[4-(3 а,11 с)1,3 а,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3H)-ил)бутил]2-метил-4H-пиридо[1,2-а]пиримидин-4-он, фумарат Стадия А: 3-(3-Бутенил)-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-он Смесь 5,7 г метил 2-ацетил-5-гексеноата, 3,15 г 2-аминопиридина и 0,65 г полифосфорной кислоты нагревают при 160 С на протяжении 2 ч. Остаток, полученный после выпаривания растворителя, очищают при помощи хроматографии на силикагеле, используя смесь дихлорометан/метанол: 98/2 как элюант. Стадия В: 3-Бутил-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-он 55,2 мл молярного раствора борана в тетрагидрофуране добавляют к раствору 5,4 г продукта, полученного на предыдущей Стадии, в 100 мл тетрагидрофурана. Через 1 ч охлаждают до 0 С и добавляют 10 мл воды, а затем 25,4 бората натрия. Перемешивают на протяжении 1 ч, а затем смесь концентрируют; отбирают осадок в 100 мл воды и экстрагируют дихлорометаном. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, используя смесь дихлорометан/метанол: 98/2 как элюант. Стадия С: 4-(2-Метил-4-оксо-4 Н-пиридо[1,2-а]пиримидин-3-ил)бутанал Смесь 4,5 г продукта, полученного на предыдущей стадии, с 8,1 г 1-гидрокси-1 оксобензо[d][1,2]йодоксол-3-она в 200 мл тетрагидрофурана нагревают с обратным холодильником на протяжении 3 ч. Фильтруют в холодном состоянии и концентрируют фильтрат. Стадия D: 3-[4-(3 а,11 с)1,3 а,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)-ил)-бутил]2-метил-4 Н-пиридо[1,2-а]пиримидин-4-он Остальной синтез проводят, применяя способ, описанный на Стадии В примера 5, исходя из альдегида, полученного на предыдущей Стадии. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 68,06 5,89 7,26 Обнаруженный 67,25 5,85 6,82 Пример 18: 3-[2-3 а,11 с)1,3 а,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)-ил)этил]2-метил-4H-пиридо[1,2-а]пиримидин-4-он, фумарат Стадия А: (3 а,11 с) 1,2,3,3 а,4,11 с-Гексагидробензо[5,6]хромено[3,4-с]пиррол Отделение рацемата 1,2,3,3 а,4,11 с-гексагидробензо[5,6]хромено[3,4-с]пиррола: Растворяют 53,6 г продукта, полученного на Стадии А примера 3, в 450 мл этанола и смесь нагревают с обратным холодильником. Добавляют раствор 85,2 г (+)2,3-дибензоил-D-виннокаменной кислоты в 450 мл этанола. Осадок отфильтровывают через 12 ч. Трижды рекристаллизируют осадок из смеси этанол/вода: 85/15. Соединение получают в виде основания после обработки водным раствором гидроксида натрия. Стадия В: 3-[2-3 а, 11 с)1,3 а,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)-ил)этил]-2 метил-4 Н-пиридо[1,2-а]пиримидин-4-он, фумарат Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя энантиомер, полученный на предыдущей Стадии, и 3-(2-хлороэтил)-2-метил-4H-пиридо[1,2-а]пиримидин-4-он в качестве исходных материалов. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 68,30 5,54 7,96 Обнаруженный 68,24 5,41 8,12 Пример 19. 3-[2-3 а,11 с)1,3 а,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)-ил)этил]2-метметил-4H-пиридо[1,2-а]пиримидин-4-он, фумарат Стадия А: (3 а,11 с)1,2,3,3 а,4,11 с-Гексагидробензо[5,6]хромено[3,4-с]пиррол Отделение рацемата: 1,2,3,3 а,4,11 с-гексагидробензо[5,6]хромено[3,4-с]пиррола. Растворяют 10,3 г продукта, полученного на Стадии А примера 3, в 200 мл этанола и смесь нагревают с обратным холодильником. Добавляют раствор 16,4 г (-)2,3-дибензоил-L-виннокаменной кислоты в 200 мл этанола. Осадок отфильтровывают через 12 ч. Трижды рекристаллизируют осадок из смеси этанол/вода: 85/15. Соединение получают в виде основания после обработки водным раствором гидроксида натрия. Стадия В: 3-[2-3a, 11c)-1,3a,4,11 с-Тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)-ил)этил]-2 метил-4 Н-пиридо[1,2-а]пиримидин-4-он, фумарат Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя энантиомер, полученный на предыдущей Стадии, и 3-(2-хлороэтил)-2-метил-4H-пиридо[1,2-а]пиримидин-4-он в качестве исходных материалов. Продукт переводят в соль, используя фумаровую кислоту.N% Расчетный 68,30 5,54 7,96 Обнаруженный 68,85 5,45 7,81 Пример 20. Фумарат 3-[2-3 а,9b;)-6,8-диметокси-7-пропил-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-а]-пиримидин-4-она Стадия А: 2-Аллилокси-4-метоксибензалъдегид К раствору 100 г 2-гидрокси-4-метоксибензальдегида в 2 л ацетона добавляют 79,5 мл аллилбромида, а затем, постепенно, 272 г карбоната калия. Нагревают с обратным холодильником на протяжении 4 ч, а затем фильтруют; концентрируют в вакууме, отбирают остаток в 1 л дихлорометана и промывают раствор 1 Н раствором гидроксида натрия, а затем насыщенным раствором хлорида натрия. Сушат над сульфатом магния и концентрируют в вакууме. Стадия В: 3-Аллил-2-гидрокси-4-метоксибензалъдегид Нагревают раствор 125 г продукта, полученного на Стадии А, в 300 мл N,N-диметиланилина при 200 С на протяжении 15 ч. Затем в вакууме выпаривают растворитель и отбирают остаток в 1 л изопропилового эфира; раствор экстрагируют 10 раз, каждый раз используя 100 мл 1H раствора гидроксида натрия, а затем окисляют объединенные экстракты, используя 3 Н соляную кислоту. Затем экстрагируют водный раствор кислоты дихлорометаном и сушат и концентрируют органическую фазу. Стадия С: 3-Аллил-2,4-диметоксибензальдегид Смесь 108 г продукта, полученного на предыдущей Стадии, 74,4 г диметилсульфата и 233 г карбоната калия в 2 л ацетона нагревают с обратным холодильником на протяжении 5 ч. Фильтруют в холодном состоянии и концентрируют полученный раствор. Остаток отбирают в изопропиловый эфир и промывают насыщенным раствором гидрогенкарбоната натрия, а затем водой. Сушат над сульфатом магния и выпаривают растворитель в вакууме. Остаток очищают при помощи хроматографии на силикагеле,используя смесь циклогексан/этилацетат : 96/4 как элюант. Стадия D: 2,4-Диметокси-3-пропилбензальдегид 64 г продукта, полученного на Стадии С, гидрогенизируют при температуре окружающей среды и при атмосферном давлении,используя 35 г катализатора Вилкинсонаtris(трифенилфосфин)родия] в 500 мл бензола. Продукт очищают при помощи хроматографии на силикагеле, используя смесь циклогексан/этилацетат : 92/8 как элюант. Стадия Е: Фумарат 3-[2-3 а,9b)-6,8-диметокси-7-пропил-1,3 а,4,9b-тетрагидрохромено-[3,4-с]пиррол 2(3 Н)-ил)этил]-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Остальной синтез проводят, применяя способы, описанные в примере 2 (Стадии от А до F), используя альдегид, полученный на предыдущей Стадии, в качестве исходного материала. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 64,24 6,43 7,25 Обнаруженный 63,33 6,30 7,05 Пример 21. Фумарат 3-[2-3a,11c)-1,3a,4,11c-тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)ил)этил]-7-хлоро-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Стадия А: (7-Хлоро-2-метил-4-оксо-4 Н-пиридо[1,2-а]пиримидин-3-ил)ацетальдегид Продукт получают, следуя способу, описанному на Стадии С примера 18, используя 7-хлоро-3-(2 гидроксиэтил)-2-метил-4H-пиридо[1,2-а]пиримидин-4-он, который получают по способу, описанному в литературе (Liebigs Ann. Chem. 1973, 103-110), в качестве исходного субстрата. Стадия B: Фумарат 3-[2-3 а, 11 с)-1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)ил)этил]-7-хлоро-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии В примера 5, используя соединение, полученное на Стадии А примера 19 и альдегид, полученный на предыдущей Стадии. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%Cl% Расчетный 64,11 5,02 7,48 6,31 Обнаруженный 63,82 5,02 7,35 6,63 Пример 22: Фумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)ил)этил]-7-хлоро-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии В примера 5, используя соединение, полученное на Стадии А Примера 20 и альдегид, полученный на Стадии А примера 22. Продукт переводят в соль, используя фумаровую кислоту.N% Сl% Расчетный 64,11 5,02 7,48 6,31 Обнаруженный 64,30 4,92 7,53 6,56 Пример 23. Фумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидрообензо[5,6]хромено[3,4-с]-пиррол 2(3H)-ил)этил]-2-метил-4-оксо-4H-пиридо[1,2-а]пиримидин-7-карбонитрила К раствору 1,83 ммоль соединения, полученного в примере 15, в 12 мл диметилформамида добавляют, в инертной атмосфере, 1,1 ммоль цианида цинка и 0,073 ммоль тетракис(трифенилфосфин)палладия. Реакционную смесь нагревают до температуры выше целита, а затем выпаривают. Полученный остаток очищают хроматографией на кремнеземе (элюант: дихлорометан/метанол: 95/5). Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%N% Расчетный 68,52 5,18 10,58 Обнаруженный 68,63 5,05 10,58 Пример 24: Фумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]-пиррол-2(3H)ил)этил]-2-метил-7-(2-тиенил)-4H-пиридо[1,2-а]-пиримидин-4-она Стадия А: 3-(2-Гидроксиэтил)-2-метил-7-(2-тиенил)-4 Н-пиридо[1,2-a]пиримидин-4-он В колбе с круглым донышком в потоке аргона смешивают 5 г 7-бромо-3-(2-гидроксиэтил)-2-метил 4H-пиридо[1,2-а]пиримидин-4-она, 6,2 мл трибутилтиофен-2-ил-станнана, 1 г тетракис(трифенилфосфин)палладия и 250 мл N-метилпирролидона. Раствор нагревают до 130 С на протяжении 2 ч, а затем выпаривают растворитель в вакууме; остаток отбирают в 200 мл дихлорометана, раствор промывают 10% раствором фторида калия, фильтруют, отделяют органическую фазу и промывают ее водой. После сушки над сульфатом магния и выпаривания полученный остаток очищают хроматографией на силикагеле, используя смесь дихлорометан/метанол: 95/5 как элюант. Стадия В: 3-(2-Хлороэтил)-2-метил-7-(2-тиенил)-4 Н-пиридо[1,2-а]пиримидин-4-он Продукт предыдущей Стадии переводят в хлорированное соединение, применяя способ, описанный в литературе (Liebigs Ann.Chem. 1973, 103-110). Стадия С: Фумарат 3-[2-3 а,11 с)1,3a,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3 Н)ил) этил]-2-метил-7-(2-тиенил)-4 Н-пиридо[1,2-а]пиримидин-4-она Остальной синтез проводят, применяя способ, описанный в примере 1 (Стадия G), используя продукт, полученный на предыдущей Стадии, вместо 3-(2-хлороэтил)-2-метилпиридо[1,2-а]пиримидин-4 она. Продукт переводят в соль, используя фумаровую кислоту. Элементарный микроанализ: С% Н%S% Расчетный 66,98 5,12 6,89 5,26 Обнаруженный 66,02 5,07 6,85 4,94 Пример 25: Хемифумарат 3-[2-3a,11c)-1,3a,4,11c-тетрагидробензо[5,6]хромено[3,4-с]-пиррол 2(3H)-ил)этил]-7-хлоро-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Стадия А: (3a, 11 с)1,2,3,3 а, 4,11 с-Гексагидробензо[5,6]хромено[3,4-с]пиррол Соединение получают, следуя тому же протоколу эксперимента, как и описанный в Патентной заявке ЕР 691 342 (Пример 33). Стадия В: Хемифумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол 2(3 Н)-ил)этил]-7-хлоро-2-метил-4 Н-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя соединение, описанное на предыдущей Стадии, и соединение, полученное на Стадии А примера 8 (продукт переводят в соль, используя фумаровую кислоту). Элементарный микроанализ: С% Н%N% Сl% Расчетный 66,16 5,16 8,15 6,88 Обнаруженный 66,33 5,10 8,31 7,40 Пример 26: Хемифумарат 6-[2-3 а,11 с)1,3 а,4,11-тетрагидробензо[5,6]хромено[3,4-с 1-пиррол 2(3H)-ил)этил]-7-метил-5H-[1,3]тиазоло[3,2-а]пиримидин-5-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя соединение, полученное на Стадии А примера 26, а также 6-(2-хлороэтил)-7-метил-5H-[1,3]тиазоло[3,2-а]пиримидин-5 он (продукт переводят в соль, используя фумаровую кислоту).Cl% Расчетный 65,09 5,26 8,63 6,58 Обнаруженный 64,98 5,28 8,61 6,67 Пример 27: Хемифумарат 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]-пиррол 2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-а]пиримидин-4-она Ожидаемый продукт получают согласно способу, описанному на Стадии G примера 1, используя соединение, описанное на Стадии А примера 26, а также 3-(2-хлороэтил)-2-метилпиридо[1,2 а]пиримидин-4-он (продукт переводят в соль, используя фумаровую кислоту). Элементарный микроанализ: С% Н%N% Расчетный 70,90 5,74 8,73 Обнаруженный 70,99 5,70 8,77 Фармакологическое исследование Пример А: Тест на эрекцию полового члена у крыс Этот тест позволяет оценить способность фармакологических агентов ингибировать эрекции полового члена, вызванные приемом селективного агониста 5-НТ 2 с, RO 60-0175. Крыс мужского пола линии Wistar, весом 120-140 г на день эксперимента помещали по отдельности в плексиглассовые ящики для наблюдения непосредственно после введения тестируемоего соединения или носителя. Через тридцать минут животным вводили RO 60-0175 (1,25 мг/кг, подкожно) и подсчитывали количество эрекций, произошедших за следующие 30 минут. Результаты: Оказывается, что соединения по изобретению способны ингибировать эрекции полового члена, вызванные введением селективного агониста 5-НТ 2 с. Они, соответственно, имеют антагонистический характер по отношению к рецепторам 5-НТ 2 с. В качестве примера, соединение по примеру 3 имеет ингибирующую дозу 50 (ID50) в 2,6 мг/кг, подкожно. Пример В: Тест на агрессивность у мышей, вызванную изоляцией Животные представляли собой мышей CD-1 мужского пола. С момента их поступления мыши были изолированы в индивидуальных клетках со свободным доступом к еде и питью. Через один месяц изоляции выбирали пары мышей, табильных относительно агрессивности, наблюдая период латентности и количество и длительность атак, когда мышей помещали вместе. Тест проводили один раз в неделю. В день теста, каждой мыши из пары (резиденту и захватчику) давали внутриперитониально инъекцию носителя (контрольные животные) или тестируемоего соединения (обработанные животные) в объеме 10 мл/кг. Через 30 мин мышь-захватчика вводили в клетку к мыши-резиденту. В течение трех минут измеряли период латентности до первой атаки и количество и длительность атак. Соединение считается специфически противоагрессивным, если оно снижает количество и длительность аттак при неседативных дозах. Результаты: Оказывается, что соединения по изобретению существенно снижают количество и длительность аттак. В качестве примера, соединение по примеру 3 имеет ингибирующую дозу 50 (ID50) в 7 мг/кг, внутриперитониально. Пример С: Тест на прятание различных вещей мышами Этот тест позволяет оценить способность фармакологических агентов ингибировать спонтанное поведение прятания различных вещей у мышей, предвиделось ингибирование антидепрессантного и/или антиимпульсивного действия. Мышей мужского пола линии NMRI, весом от 20 до 25 г на день эксперимента помещали по отдельности в коробки из Macrolon, содержащие 5 см опилок и покрытые перфорированной плексиглассовой пластиной. Двадцать четыре стеклянных безделушки тигриный глаз в случайном порядке распределяли в опилках по периферии коробки. Через 30 мин свободного исследования животных удаляли из коробки и подсчитывали количество спрятанных безделушек. Результаты: Оказывается, что соединения по изобретению ингибируют спонтанное поведение прятания различных вещей у мышей. В качестве примера соединение по примеру 3 имеет ингибирующую дозу 50 (ID50) в 4,1 мг/кг, подкожно. Пример D: Определение аффинности к 2-адренергическим рецепторам крыс Аффинность определяли при помощи экспериментов на конкуренцию с [3H]-RX 821,002. Мембраны получали из коры головного мозга крыс и инкубировали в трех повторениях с 0,4 нМ [3H]-RX 821,002 и тестируемоего соединения в конечном объеме 1,0 мл, на протяжении 60 мин при 22 С. Инкубационный буфер содержит 50 нМ TrIS-HCl (pH 7,5), 1 мМ EDTA и 100 л GppNHp. Неспецифическое связывание определяли, используя 10 М фентоламина. Анализ данных: по окночании инкубирования инкубационную среду фильтровали через фильтрыWHATMAN GF/B, обогащенные 0,1% полиэтиленимина, и трижды промывали 5 мл охлажденного буфе-16 005402 ра. Радиоактивность, задержанную на фильтрах, измеряли при помощи жидкостной сцинтилляции. Связывающиеся изомеры анализировали при помощи нелинейной регрессии. Результаты: Соединения по изобретению взаимодействуют специфическим образом с 2 адренергическими рецепторами, например, соединение по примеру 3 имеет hKi 7,5. Пример Е: Фармацевтическая композиция Формула получения для 1000 таблеток, каждая из которых содержит 10 мг активного ингредиента Соединение по примеру 3 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза. 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена или группу, выбираемую из линейного или разветвленного (С 1 С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (С 1 С 6)полигалоалкил, гидрокси, циано, нитро и амино,или R1 и R2, R2 и R3 или R3 и R4 совместно с атомами углерода, их несущими, образуют необязательно замещенное бензоловое кольцо или необязательно замещенное гетероароматическое кольцо,X представляет собой атом кислорода или метиленовую группу,А представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,представляет собой ненасыщенный азотсодержащий гетероцикл, необязательно замещенный одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6 )алкокси,линейной или разветвленной (С 1-С 6)полигалоалкильной, циано, нитро, амино, необязательно замещенной фенильной, необязательно замещенной тиенильной, необязательно замещенной фурильной и необязательно замещенной пирролильной групп, иR5 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием,причем следует понимать, что термин (С 1-С 6)алкил обозначает углеводородную цепь, содержащую от одного до шести атомов углерода,термин (С 1-С 6)алкокси обозначает (С 1-С 6)алкилоксигруппу, содержащую от одного до шести атомов углерода,термин (С 1-С 6)алкилен обозначает двухвалентную углеводородную цепь, содержащую от одного до шести атомов углерода,термин (С 1-С 6)полигалоалкил обозначает углеводородную цепь, содержащую от одного до шести атомов углерода и от 1 до 9 атомов галогенов,термин гетероароматическое кольцо обозначает 5- или 6-членное ароматическое кольцо, содержащее один, два или три гетероатома, выбираемых из кислорода, азота и серы,термин ненасыщенный азотсодержащий гетероцикл обозначает 5-7-членное ненасыщенное кольцо,имеющее одну, две или три ненасыщенных связи и содержащее один, два или три гетероатома, один из которых представляет собой атом азота, а необязательно присутствующий(е) дополнительный(е) гетероатом(ы) выбирают из атомов кислорода, азота и серы,термин необязательно замещенный в применении к выражениям "бензольное кольцо", "гетероароматическое кольцо", "фенил", "тиенил", "фурил" или "пирролил" показывает, что эти группы необязательно замещены одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной(С 1-С 6)алкокси, линейной или разветвленной (С 1-С 6)полигалоалкильной, циано, нитро и аминогрупп.-17 005402 2. Соединения формулы (I) по п.1, в которой R1, R2, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1 С 6)алкильную, линейную или разветвленную (C1-С 6)алкокси или гидроксигруппу, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, в которой R1 и R2, совместно с атомами углерода их несущими,образуют бензольное кольцо, а R3 и R4, каждый, представляет собой атом водорода, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по любому из пп.1-3, в которых X представляет собой атом кислорода,их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по любому из пп.1-4, в которой А представляет собой этиленовую, пропиленовую или бутиленовую цепь, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по любому из пп.1-5, в которой, необязательно замещенную одним или двумя одинаковыми или различными заместителягруппу ми, выбираемыми из атомов галогена и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (C1-С 6)полигалоалкильной, циано,нитро, амино и тиенильной групп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по любому из пп.1-5, в которой, необязательно замещенную одним или двумя одинаковыми или различными заместителями,выбираемыми из атомов галогена и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (C1-С 6)полигалоалкильной, циано, нитро и аминогрупп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по любому из пп.1-6, в которой А представляет собой этиленовую цепочку, X представляет собой атом кислорода, R5 представляет собой метильную группу, и пред ставляет собой следующую группу, необязательно замещенную в положении 2 группой, выбираемой из атомов галогена и линейной или разветвленной (С 1-С 6)алкильной, циано и тиенильной групп, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Соединение формулы (I) по любому из пп.1,2,4-6 и 8, которое представляет собой 3-[2-3 а,9b)9-метокси-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-а]пиримидин-4-он, его энантиомеры и и диастереоизомеры и его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по любому из пп.1,3-6 и 8, которые представляют собой 3-[23 а,11 с)-1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол-2(3H)-ил)этил]-2-метил-4Hпиридо[1,2-а]пиримидин-4-он и 3-[2-3 а,11 с)1,3 а,4,11 с-тетрагидробензо[5,6]хромено[3,4-с]пиррол 2(3H)-ил)этил]-2-метил-4H-пиридо[1,2-а]пиримидин-4-он, их энантиомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы в которой R1, R2, R3, R4 и X определены для формулы (I),подвергают каталитической гидрогенации с получением соединения формулы (III) в которой R1, R2, R3, R4 и X имеют значения, указанные здесь ранее,-18 005402 которое либо подвергают реакции с соединением формулы (IV) в которой А, В и R5 имеют значения, указанные для формулы (I), и Y1 представляет собой уходящую группу, такую как, например, атом галогена или тосилатная, трифлатная или месилатная группа,либо, при условиях восстановительного аминирования с соединением формулы (V) в которой В и R5 имеют значения, указанные для формулы (I), и А представляет собой связь или линейную или разветвленную (С 1-С 5)алкиленовую цепь,с получением соединения формулы (I), которое очищают, если необходимо, согласно обычной технике очистки, которое разделяют, при желании, на его стереоизомеры согласно обычной технике очистки и которое переводят, при желании, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение по любому из пп.1-10 в сочетании с одним или более инертными, нетоксичными, фармацевтически приемлемыми носителями или эксципиентами. 13. Фармацевтическая композиция по п.12 для применения в качестве двойного 2/5-НТ 2 с антагонистического лекарственного препарата для лечения депрессии, спонтанных нарушений поведения, состояний тревоги, шизофрении, болезни Паркинсона, когнитивных расстройств, нарушений либидо, сексуальных дисфункций, нарушений аппетита и нарушений сна.
МПК / Метки
МПК: C07D 471/00, C07D 513/00, A61K 31/519, A61P 25/00, C07D 519/00, C07D 491/052
Метки: фармацевтические, соединения, содержащие, получения, композиции, способ, пиримидин-4-она
Код ссылки
<a href="https://eas.patents.su/20-5402-soedineniya-pirimidin-4-ona-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения пиримидин-4-она способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Антитела повышенной продуктивности к белку активации фибробластов и способы их применения
Следующий патент: Соединения бензолсульфонамида, способ их получения и фармацевтические композиции их содержащие
Случайный патент: Способ и скважинный инструмент для гравийной набивки скважины с использованием маловязких жидкостей