Производные 2-пиперазин-1-ил-4н-1,3-бензотиазин-4-она и их применение для лечения инфекций у млекопитающих
Формула / Реферат
1. Соединение формулы (1)
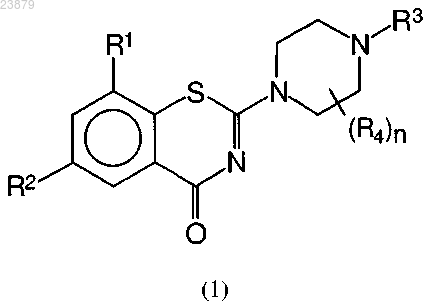
где R1 представляет собой NO2, NH2, NHOR4, COOR4, CONR5R6 или СНО;
R2 представляет собой галоген, SO2NR5R6, COOR4, CONR5R6, CHO, OCF3 или моно-, ди- или трифторметил;
R3 представляет собой насыщенный или ненасыщенный галогенированный или негалогенированный линейный, разветвленный или циклический алкил, содержащий 3-12 атомов углерода, в котором одна или две метиленовые группы, если присутствуют, возможно замещены на О, S или NR4, или
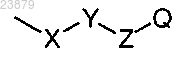
где X представляет собой насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-6 атомов углерода;
Y представляет собой О, S или NR4;
Z представляет собой прямую связь, линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода;
Q представляет собой фенил, нафтил, пиридил, хинолил, пиразинил, пиримидил, пиразолил, триазинил, имидазолил, фуранил или тиенил, где от одного до трех атомов водорода возможно замещены на группу R7;
R4 представляет собой Н или C1-3 алкил;
n=0, 1, 2, 3 или 4;
R5 и R6 независимо друг от друга выбраны из Н, C1-4 алкила, OC1-4 алкила, галогена, COOR5, CONR6R7, OCF3, CF3 или CN;
группа R7 представляет собой галоген, насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода, SO2NR5R6, COOR4, CONR5R6, CHO, OCF3, моно-, ди- или трифторметил или фенил,
и/или его фармацевтически приемлемая соль.
2. Соединение формулы (1) по п.1, отличающееся тем, что указанное соединение представляет собой 2-(4-R3-пиперазин-1-ил)-8-нитро-6-(трифторметил)-4Н-1,3-бензотиазин-4-он, a R3 имеет значение, приведенное в п.1.
3. Соединение формулы (1) по п.1, отличающееся тем, что указанное соединение представляет собой 2-(4-R3-пиперазин-1-ил)-8-нитро-6-R2-4Н-1,3-бензотиазин-4-он, R2 представляет собой галоген, a R3 имеет значение, приведенное в п.1.
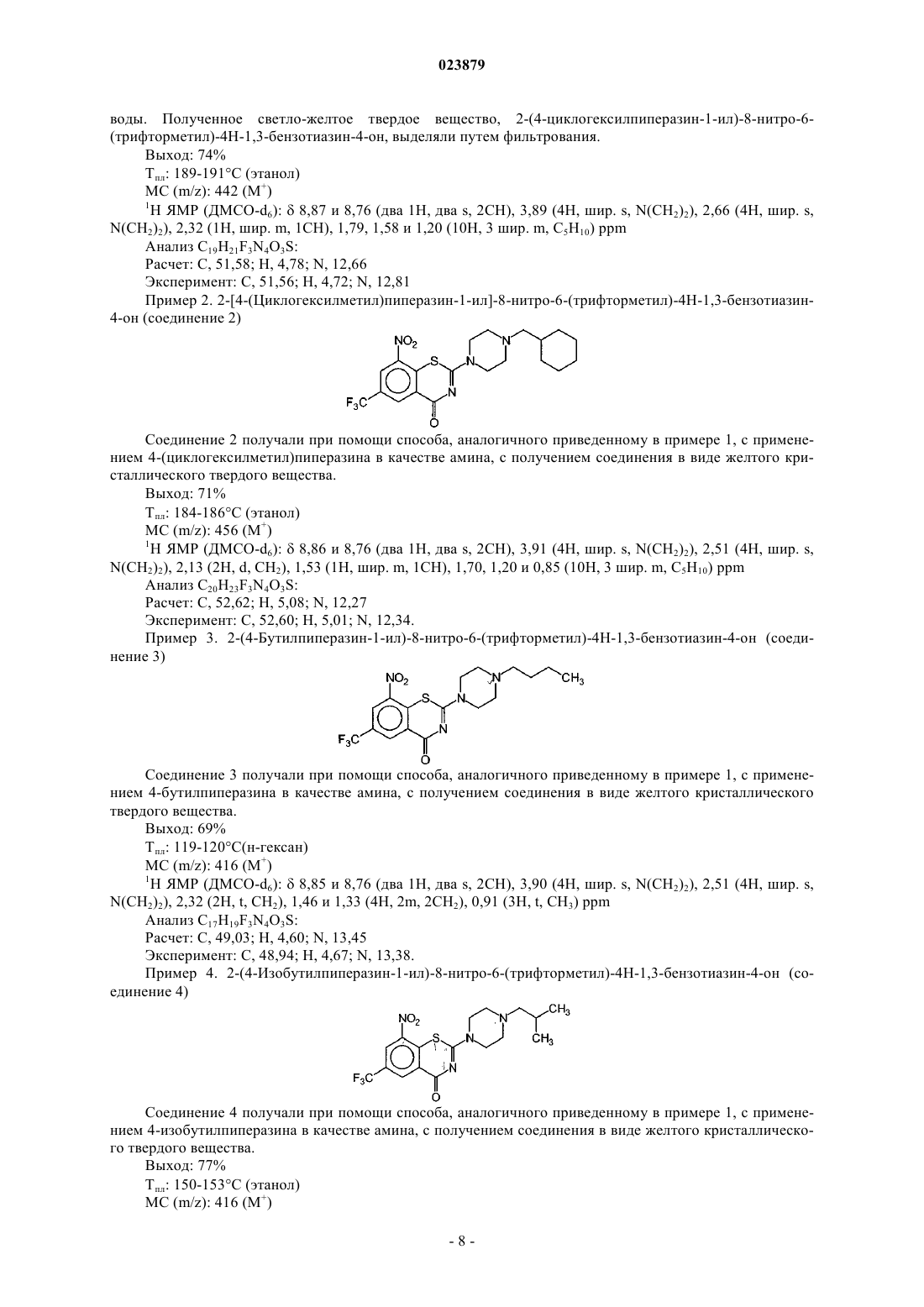
4. Соединение формулы (1) по п.2, отличающееся тем, что указанное соединение представляет собой 2-[4-(циклогексилметил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4Н-1,3-бензотиазин-4-он.
5. Соединение формулы (1) по п.1, отличающееся тем, что указанное соединение представляет собой 2-{4-[3-(4-фторфенокси)пропил]пиперазин-1-ил}-8-нитро-6-(трифторметил)-4Н-1,3-бензотиазин-4-он.
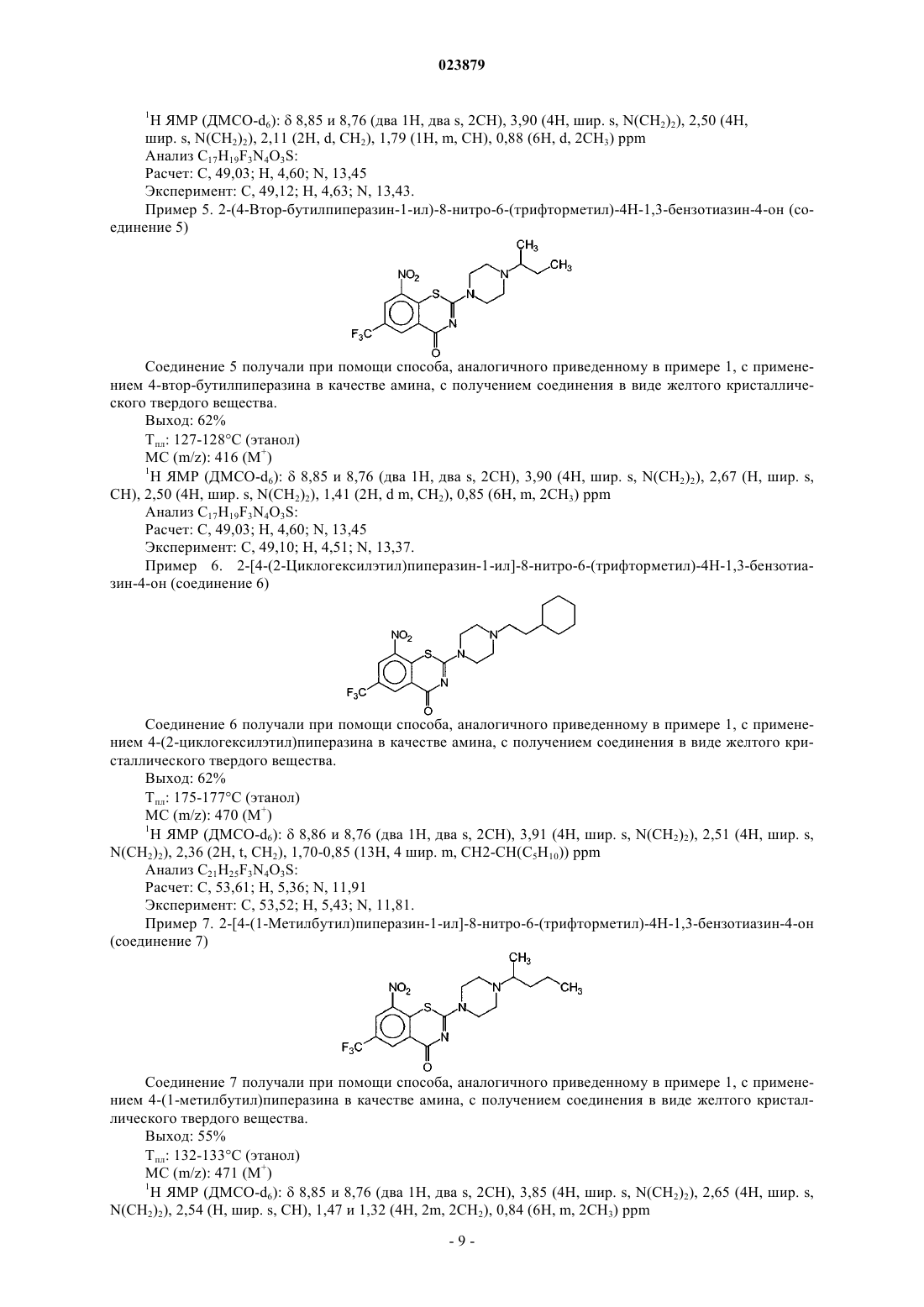
6. Соединение формулы (1) по п.2, отличающееся тем, что указанное соединение представляет собой 2-(4-гептилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4Н-1,3-бензотиазин-4-он.
7. Фармацевтическая композиция для лечения микробной инфекции, вызванной бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia, содержащая соединение формулы (1) и/или его фармацевтически приемлемую соль по любому из пп.1-6 и/или фармацевтически приемлемый носитель и/или наполнитель.
8. Применение соединения по любому из пп.1-6 для терапевтического и/или профилактического лечения заболевания, вызванного бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia.
9. Применение по п.8, отличающееся тем, что заболевание, вызванное микробной инфекцией, выбрано из группы, включающей туберкулез, проказу или язву Бурули.
10. Способ терапевтического и/или профилактического лечения заболевания, вызванного бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia, у пациента, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения по любому из пп.1-6 или фармацевтической композиции по п.7.
11. Способ подавления микробной инфекции, вызванной бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia, включающий введение терапевтически эффективного количества соединения по любому из пп.1-6 или фармацевтической композиции по п.7.
Текст
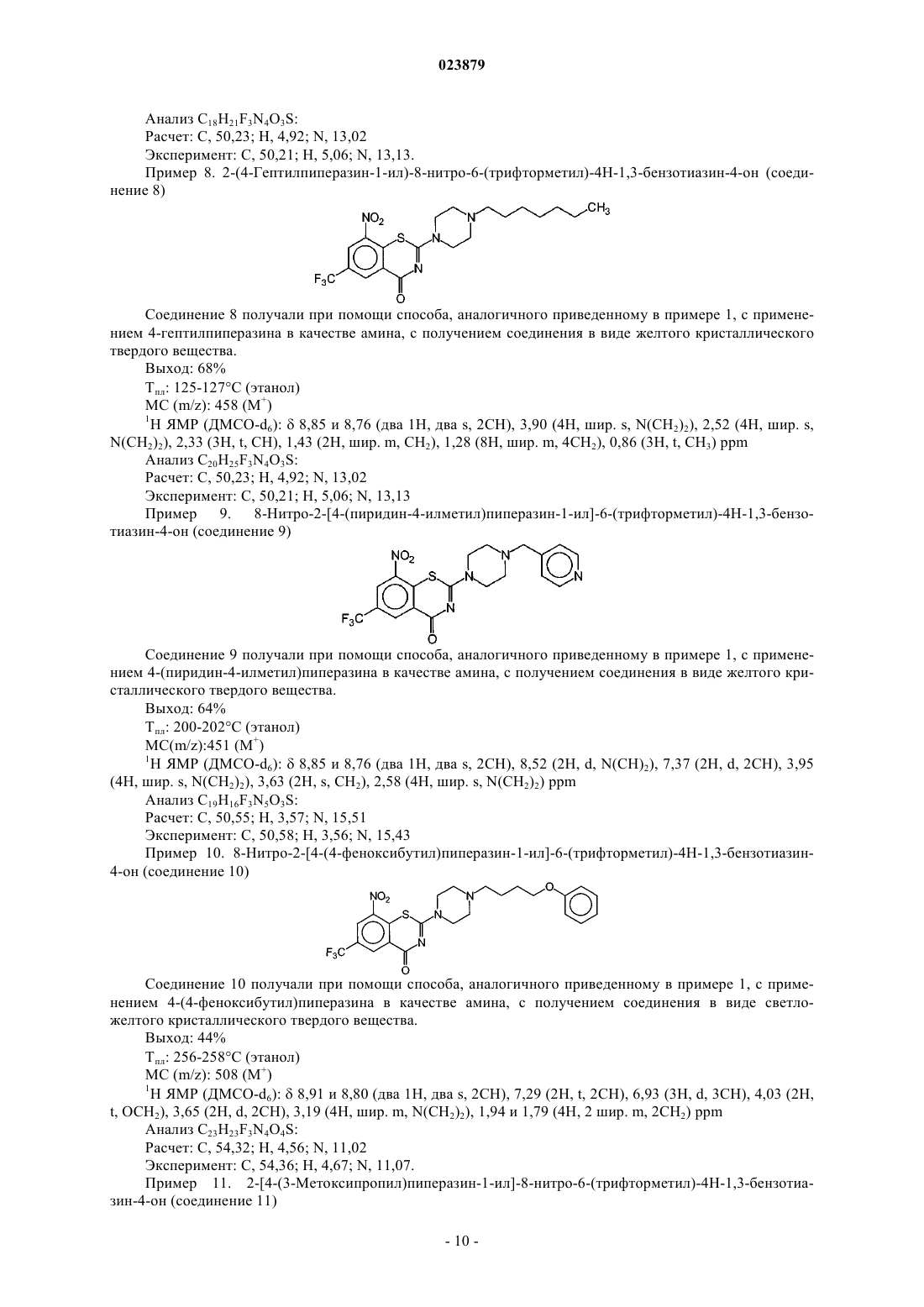
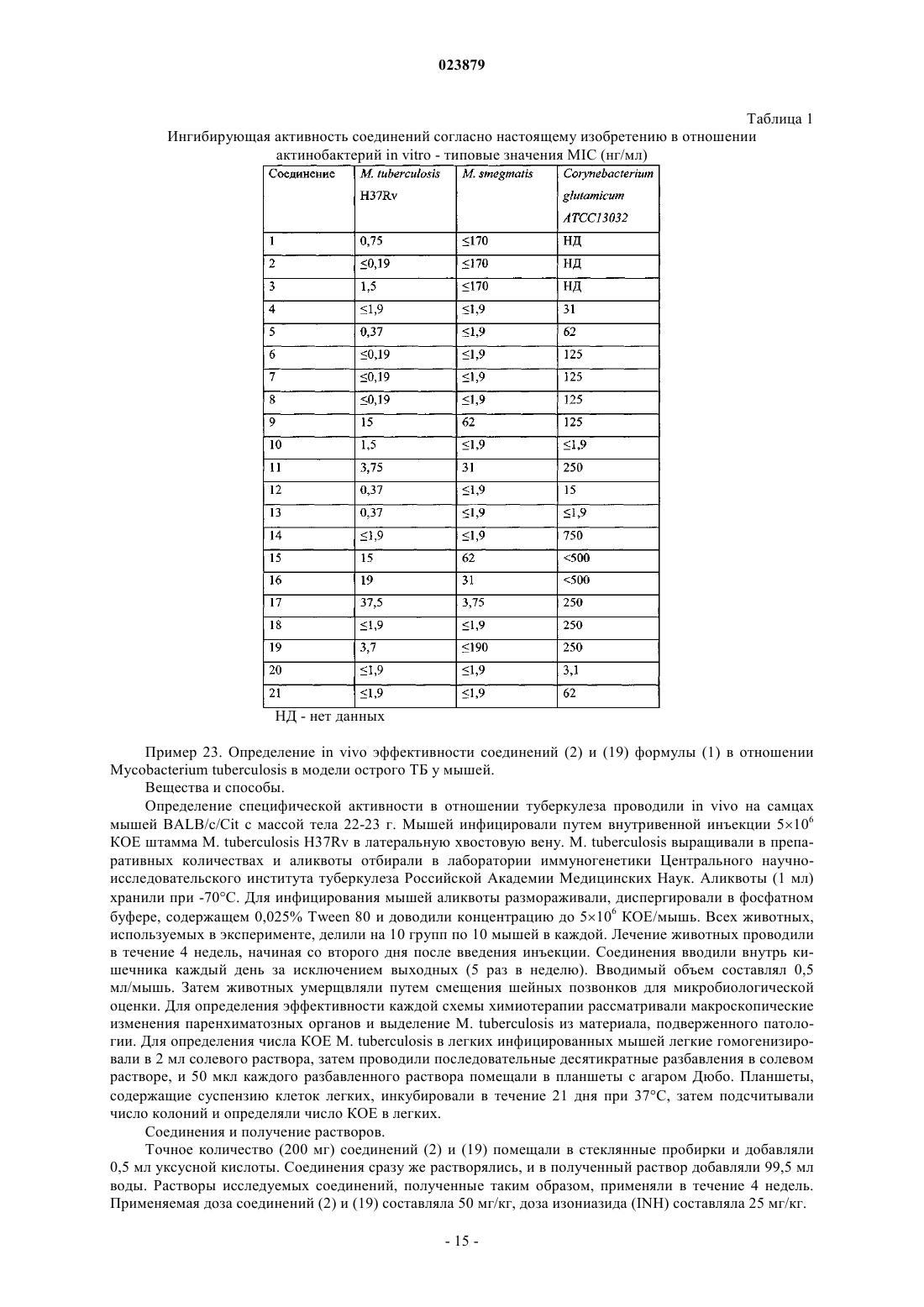
ПРОИЗВОДНЫЕ 2-ПИПЕРАЗИН-1-ИЛ-4 Н-1,3-БЕНЗОТИАЗИН-4-ОНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ У МЛЕКОПИТАЮЩИХ Настоящее изобретение относится к новым производным 2-пиперазин-1-ил-4H-1,3-бензотиазин-4 она и их применению для лечения инфекций у млекопитающих, вызванных бактериями, в частности таких заболеваний, как туберкулез (ТБ), язва Бурули и проказа, которые возникают в результате инфицирования близкородственными микобактериями.(71)(73) Заявитель и патентовладелец: ЭКОЛЬ ПОЛИТЕКНИК ФЕДЕРАЛЬ ДЕ ЛОЗАННА (ЭПФЛ) (CH) Область техники Настоящее изобретение относится к новым производным 2-пиперазин-1-ил-4H-1,3-бензотиазин-4-она и их применению для терапевтического и/или профилактического лечения инфекционных заболеваний у млекопитающих, вызванных бактериями, в частности таких заболеваний, как туберкулез (ТБ), язва Бурули и проказа, которые возникают в результате инфицирования близкородственными микобактериями. Уровень техники Микобактерии на протяжении миллионов лет наносят большой вред человечеству, вызывая опасные заболевания, такие как туберкулез (ТБ), проказа и язва Бурули. С точки зрения вреда и смертности ТБ бесспорно является наиболее существенной и опасной угрозой здоровью человека, отчасти вследствие все более распространенной первичной резистентности к существующим лекарственным средствам. Таким образом, существует растущая потребность в новых соединениях с новым способом действия(Balganesh, T.S., Alzari, P.M. and Cole, S.T. Trends Pharmacol Sci, 2008, 29(11): p. 576-81), которые также могут находить применение для лечения других заболеваний, вызываемых микобактериями. Проказа почти исчезла из числа заболеваний, представляющих угрозу для общественного здравоохранения (Britton, W.J. and Lockwood, D.N. Lancet, 2004, 363(9416): p. 1209-19) благодаря мерам, принятым Всемирной организацией здравоохранения, однако растущую озабоченность вызывает новое заболевание - язва Бурули (Demangel, С., Stinear, Т.Р., and Cole, S.T. Nat Rev Microbiol, 2009, 7(1): p. 50-60). За последние двадцать лет лекарственно-резистентный туберкулез принял пугающие новые масштабы. В 1990-х гг. предметом беспокойства являлась форма, обладающая множественной лекарственной резистентностью(МЛР), когда Mycobacterium tuberculosis приобрела резистентность к основным лекарственным средствам первой линии, изониазиду и рифампицину. По оценкам в мире насчитывается 500000 случаев заболевания МЛР-ТБ, 70000 из которых возникли в Европе (Zignol, M. et al. J. Infect Dis, 2006, 194: 479-485;Fears, R., Kaufmann, S., Ter Meulen, V.Zumla, A. Tuberculosis (Edinb) 2010, 90: 182-187). За последнее десятилетие МЛР-штаммы М. tuberculosis приобрели дополнительные резистентные мутации к лекарственным средствам второй линии и стали вызывать заболевания с широкой лекарственной устойчивостью (ШЛУ). Помимо изониазида и рифампицина ШЛУ-штаммы М. tuberculosis также являются резистентными к фторхинолонам и инъецируемым аминогликозидам (Jassal, M.Bishai, W.R.Lancet Infect Dis 2009, 9: 19-30). Более чем в 50 странах сообщается о случаях ШЛУ-ТБ, что подчеркивает необходимость и важность поиска новых лекарственных средств для лечения как чувствительного к действию лекарственных средств, так и лекарственно-резистентного ТБ. Помимо нового механизма действия другие желаемые признаки нового лекарственного средства против ТБ включают высокую активность, за счет которой можно снижать продолжительность курса лечения; высокую специфичность для предотвращения нежелательных побочных эффектов, включая нарушение флоры кишечника, и пероральное введение. 2-Аминозамещенные 1,3-бензотиазин-4-оны можно применять в качестве лекарственных средств для лечения заболеваний, вызванных микобактериями, у людей и млекопитающих. До настоящего момента наиболее активное доступное соединение представляло собой 2-[(2S)-2-метил-1,4-диокса-8 азаспиро[4.5]дец-8-ил]-8-нитро-6-(трифторметил)-4 Н-1,3-бензотиазин-4-он (BTZ043) (V. Makarov et al.WO 2009/010163. С учетом указанного уровня техники крайне желательным является получение новых 2 пиперазинзамещенных 1,3-бензотиазин-4-онов, которые не только обладают высокой активностью в отношении микобактерий, но также проявляют улучшенные свойства в качестве лекарственных препаратов по сравнению с 1,3-бензотиазин-4-онами, описанными ранее. В настоящем изобретении описано новое поколение 1,3-бензотиазин-4-онов, обладающих активностью в отношении микобактерий, в качестве новых лекарственных средств против ТБ, в которых аминозаместители в положении 2 представляют собой N-замещенные пиперазины. Настоящее изобретение относится к соединению формулы (1)R3 представляет собой насыщенный или ненасыщенный галогенированный или негалогенированный линейный, разветвленный или циклический алкил, содержащий 3-12 атомов углерода, в котором одна или две метиленовые группы, в случае, если они присутствуют, возможно замещены на О, S или где X представляет собой насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-6 атомов углерода;Z представляет собой прямую связь, линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода;Q представляет собой фенил, нафтил, пиридил, хинолил, пиразинил, пиримидин, пиразолил, триазинил, имидазолил, фуранил или тиенил, где от одного до трех атомов водорода возможно замещены на группу R7;R5 и R6 независимо друг от друга выбраны из Н, C1-4 алкила, OC1-4 алкила, галогена, COOR5,CONR6R7,OCF3, CF3 или CN; группа R7 представляет собой галоген, насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода, SO2NR5R6, низший алкокси, COOR4,CONR5R6, CHO, OCF3, моно-, ди- или трифторметил или фенил; и/или его фармацевтически приемлемой соли. Также предложена фармацевтическая композиция, содержащая соединение формулы (1) согласно настоящему изобретению и/или его фармацевтически приемлемую соль. Также предложено соединение формулы (1) и/или его фармацевтически приемлемые соли для применения для терапевтического и/или профилактического лечения заболевания. Кроме того, предложена фармацевтическая композиция, содержащая соединение формулы (1) и/или его фармацевтически приемлемые соли, для применения для терапевтического и/или профилактического лечения заболевания. В изобретении дополнительно предложен способ терапевтического и/или профилактического лечения заболевания, вызванного микробной инфекцией, у пациента, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения или фармацевтической композиции. Кроме того, предложен способ подавления микробной инфекции, включающий введение терапевтически эффективного количества соединения или фармацевтической композиции. На чертеже приведена диаграмма и статистические результаты, отражающие снижение содержания КОЕ в легких и селезенке под действием соединений 2 и 8 по сравнению со способом лечения с применением BTZ043 на модели мышей с хроническим ТБ. D0, уровень КОЕ в начале лечения; NT, животные,не подвергавшиеся лечению, на день 28; INH соответствует изониазиду; 43=BTZ043; 169=PBTZ169 соответствует соединению 2; 134=PBTZ134, соответствует соединению 8. Подробное описание изобретения Одним из недостатков описанных ранее 2-аминозамещенных производных 1,3-бензотиазин-4-она являлась их низкая растворимость в воде, которая ограничивала их всасывание в желудке и кишечнике. Предпринималось множество попыток увеличения растворимости указанных соединений в воде, например, путем добавления гидрофильного фрагмента в производные 1,3-бензотиазин-4-она, но указанные соединения имели очень низкую активность в отношении микобактерий. Таким образом, с одной стороны, преимуществами обладают соединения с более высокой растворимостью в воде, содержащие гидрофильный фрагмент, но с другой стороны, указанное соединение должно сохранять липофильность, обеспечивающую прохождение через стенки клеток микобактерий, обладающих повышенной гидрофобностью. Эти проблемы решены в настоящем изобретении за счет обеспечения соединений, в которых небольшой гидрофильный фрагмент (пиперазин) "скрыт" между двумя крупными липофильными фрагментами, один из которых представляет собой 1,3-бензотиазин-4-он. Согласно первому аспекту в настоящем изобретении предложены соединения формулы 1R3 представляет собой насыщенный или ненасыщенный галогенированный или негалогенированный линейный, разветвленный или циклический алкил, содержащий 3-12 атомов углерода, в котором одна или две метиленовые группы, в случае, если они присутствуют, возможно замещены на О, S или где X представляет собой насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-6 атомов углерода;Z представляет собой прямую связь, линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода;Q представляет собой фенил, нафтил, пиридил, хинолил, пиразинил, пиримидил, пиразолил, триазинил, имидазолил, фуранил или тиенил, где от одного до трех атомов водорода возможно замещены на группу R7;R5 и R6 независимо друг от друга выбраны из Н, C1-4 алкила, ОС 1-4 алкила, галогена, COOR5,CONR6R7,OCF3, CF3 или CN; группа R7 представляет собой галоген, насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода, SO2NR5R6, низший алкокси, COOR4,CONR5R6, CHO, OCF3, моно-, ди- или трифторметил или фенил; и/или их фармацевтически приемлемые соли. Термин "содержать" или "содержащий" в целом используются в качестве включать/включающий,т.е. допускают наличие одного или более признаков или компонентов. Кроме того, термин "содержащий" также охватывает термин "состоящий". Используемые в настоящем описании и формуле изобретения формы единственного числа включают ссылки на множество объектов, если в контексте явно не указано иное. Используемый в настоящем описании "по меньшей мере один" означает "один или более". В предпочтительном варианте реализации изобретение относится к соединениям формулы (1), выбранным из группы, состоящей из 2-(4-R3-пиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(4-R3-пиперазин-1-ил)-8-нитро-6-R2-4H-1,3-бензотиазин-4-она,2-(4-R3-пиперазин-1-ил)-8-R1-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(циклогексилметил)пиперазин-1-ил]-8-R1-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(циклогексилметил)пиперазин-1-ил]-8-нитро-6-R2-4H-1,3-бензотиазин-4-она,2-4-[2-(4-галогенфенокси)этил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4 она,2-4-[2-(3-галогенфенокси)этил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4 она,2-4-[3-(4-галогенфенокси)пропил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин 4-она,2-4-[3-(3-галогенфенокси)пропил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин 4-она,2-(4-2-[(4-галогенбензил)окси]этилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,где R1, R2 и R3 имеют приведенные выше значения. Более конкретно, настоящее изобретение относится по меньшей мере к одному соединению, выбранному из группы, состоящей из 2-(4-гексилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(4-гептилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(циклогексилметил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,-3 023879 2-[4-(2-циклогексилэтил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-(4-бутилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(3-метилбутил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(2-метилбутил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-[4-(2-этоксиэтил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-4-[2-(бензилокси)этил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-она,2-4-[3-(4-фторфенокси)пропил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4 она. Кроме того, настоящее изобретение относится к фармацевтически приемлемым солям соединений формулы (1), например к гидрохлориду, сульфату, ацетату, трифторацетату, малеату, фумарату и т.д. Соединения формулы (1) можно синтезировать при помощи любого из следующих способов, описанных в уровне техники. Указанные способы включают: 1) взаимодействие тиоцианатных солей с 2-хлорбензилхлорангидридом и последующую обработку реакционной массы соответствующим амином (см., например, Coll. Czech. Chem. Commun., 1982, 47,3268-3282; Coll. Czech. Chem. Commun., 1983, 48, 3315-3328; Coll. Czech. Chem. Commun., 1983, 48, 34273432); 2) реакцию конденсации 3,4-дизамещенных 6-меркаптобензойных кислот с подходящим цианамидом (см. патент США 3522247); 3) конверсию 2-галоген-4 Н-1,3-бензотиазин-4-она с применением соответствующего амина (см. патент США 3470168); 4) два способа получения 2-аминозамещенных 1,3-бензотиазин-4-онов, описанные в международных заявках WO 2007/134625 и WO 2009/010163, которые раскрывают следующие процессы: 6) недавно открытый эффективный способ получения производных 2-амино-1,3-бензотиазин-4-она,который включает первоначальный синтез 2-алкилмеркапто-4 Н-1,3-бензотиазин-4-она и последующую конденсацию с соответствующим производным пиперазина Все шесть способов, описанных выше, можно использовать для синтеза соединений формулы (1). Предпочтительно используют способ 6. Соединения формулы (1) можно легко превращать в водорастворимые фармацевтически приемлемые соли, например в гидрохлорид, сульфат или ацетат, путем обработки соответствующей кислотой в соответствующем растворителе, известном в данной области техники. Потенциальную мутагенность выбранных соединений формулы (1) согласно настоящему изобретению исследовали при помощи SOS-хромотеста (P. Quillardet, О. Huisman, R. D'Ari, M. Hofnung, Proc.Natl. Acad. Sci. USA, 1982, 79, 5971-5), и было показано, что соединения не вызывают мутагенез при содержании 25-50 мкг в капле и дают отрицательный результат в концентрации 5 мкг/мл в тесте Эймса с использованием штаммов ТА 98, ТА 100 и ТА 1535 Salmonella typhimurium (D.M. Maron and B.N. Ames,Mutation Res., 1983, 113, 173-215). Основной мишенью BTZ043 в микобактериях являются незаменимый фермент декапренилфосфорилD-рибозы 2'-эпимераза и резистентные к BTZ "стволы", полученные в результате миссенс-мутаций соответствующего гена dprEl. Перекрестную резистентность к выбранным соединениям формулы (1) наблюдали при исследовании чувствительности резистентных к BTZ мутантов Mycobacterium smegmatis или Mycobacterium bovis БЦЖ (Makarov, V. et al. Science 2009, 324: 801-804) к указанным соединениям,и, таким образом, подтвердили, что 2-пиперазинзамещенные 1,3-бензотиазин-4-оны имеют одну мишень с 1,3-бензотиазин-4-онами. Вторым механизмом резистентности к BTZ043, который был описан для Mycobacterium smegmatis,являлась избыточная выработка нитроредуктазы NfhB (Manina, G., et al. Mol. Microbiol. 2010, epub 2010/07/14). При исследовании чувствительности мутанта MN39 с избыточной выработкой NfnB к выбранным 2-пиперазинзамещенным 1,3-бензотиазин-4-онам было показано, что значение MIC является схожим со значением, полученным при исследовании исходного штамма дикого типа. В противоположность этому для MN39 наблюдали 6-кратное увеличение MIC BTZ043. Этот результат позволяет предположить, что пиперазинзамещенные 1,3-бензотиазин-4-оны могут быть в меньшей степени подвержены нитровосстановлению, вызванному нежелательными источниками, по сравнению с производными 1,3 бензотиазин-4-она. Для сравнения относительной цитотоксичности выбранных пиперазинзамещенных 1,3 бензотиазин-4-онов и BTZ043 определяли значения IC90 с применением двух различных клеточных линий человека. Обе серии соединений имели значение IC90 в диапазоне 12,5-100 мкг/мл в отношении клеточной линии пневмоцитов А 549, определенное при помощи исследования восстановления резазурина. Значение IC90 в отношении клеточной линии гепатомы человека Huh7, определенное при помощи этого же способа, находилось в диапазоне 6,25-12,5 мкг/мл. Согласно второму аспекту изобретения соединения формулы (1) и/или их фармацевтически приемлемые соли подходят для терапевтического и/или профилактического лечения заболевания, в частности для терапевтического и/или профилактического лечения заболевания, вызванного микробной инфекцией,более конкретно для терапевтического и/или профилактического лечения туберкулеза и других инфекций, вызванных микобактериями, или даже других инфекций, вызванных актинобактериями, таких как дифтерия, у человека и животных. Авторы настоящего изобретения неожиданно обнаружили, что отдельные соединения согласно настоящему изобретению обладают терапевтической активностью в модели хронического ТБ у мышей,определенной по снижению числа колониеобразующих единиц в легких и селезенке. Активность конкретных соединений превышала активность основного средства против ТБ, INH, которое применяли в качестве положительного контроля. Кроме того, как показано в примере 24, некоторые из новых пиперазинзамещенных производных 1,3-бензотиазин-4-онов обладали значительно более высокой активностью в этой модели по сравнению с 2-амино-1,3-бензотиазин-4-онами, как показано на примере BTZ043. Соединения согласно настоящему изобретению являются нетоксичными при пероральном введении в дозах, составляющих до 2000 мг/кг. Соединение хорошо переносилось животными в течение первых 24 ч после введения. На протяжении 7-дневного исследования соединения (2) и (18) не вызывали значительных изменений общего состояния здоровья и поведения мышей, также не влияли на двигательную и рефлекторную активность, на цикл активности и отдыха, чистку или потребление пищи. Случаи смерти животных отсутствовали. LD50 для соединений (2) и (18) составляет 2000 мг/кг. В одном из вариантов реализации соединение согласно настоящему изобретению и/или его фармацевтически приемлемые соли подходят для терапевтического и/или профилактического лечения заболевания. Предпочтительно заболевание выбрано из группы, включающей туберкулез, проказу или язву Бурули. Как правило, микробная инфекция вызвана бактериями, принадлежащими к роду Corynebacterium или Nocardia или Mycobacterium.Nocardia asteroides является видом Nocardia, наиболее часто вызывающим инфекции у человека,причем большинство случаев инфицирования протекает в виде оппортунистической инфекции у пациентов с ослабленным иммунитетом. Другими видами, важными с медицинской точки зрения, являются N.brasiliensis и N. caviae. Наиболее распространенной формой заболеваний человека, вызванных Nocardia, является медленно прогрессирующая пневмония.Mycobacterium является родом Actinobacteria и образует собственное семейство Mycobacteriaceae. Род включает известные патогены, вызывающие серьезные заболевания млекопитающих, включая туберкулез (Mycobacterium tuberculosis) и проказу (Mycobacterium leprae). Соответственно, второй аспект изобретения относится к фармацевтическим композициям, содержащим соединение формулы (1) и/или его фармацевтически приемлемые соли. В одном из вариантов реализации фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель и/или наполнитель. Фармацевтически приемлемые наполнители хорошо известны в области фармацевтики и описаны,например, в Remington's Pharmaceutical Sciences, 15th Ed., Mack Publishing Co., New Jersey (1991). Фармацевтический наполнитель можно выбирать с учетом предполагаемого способа введения и общепринятой фармацевтической практики. Наполнитель должен быть приемлемым с точки зрения безвредности для потребителя. Используемый в настоящем описании термин "фармацевтически приемлемый носитель и/или наполнитель" относится, например, к веществам-носителям, разбавителям, растворителям, таким как одноатомные спирты, такие как этанол, изопропанол, и многоатомные спирты, такие как гликоли, и пищевые масла, такие как соевое масло, кокосовое масло, оливковое масло, сафлоровое масло, хлопковое масло,сложные эфиры жирных кислот, такие как этилолеат, изопропилмиристат, к связывающим веществам,адъювантам, веществам, повышающим растворимость, загустителям, стабилизаторам, разрыхлителям,глидантам, смазывающим агентам, буферным агентам, эмульгаторам, увлажнителям, суспендирующим агентам, подсластителям, красителям, вкусоароматическим добавкам, агентам для нанесения покрытия,консервантам, антиоксидантам, агентам, улучшающим обработку, модификаторам и усилителям доставки лекарственных средств, таким как фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды,крахмал, желатин, целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза натрия, декстроза, гидроксипропилциклодекстрин, поливинилпирролидон, низкоплавкие воски и ионообменные смолы. Согласно третьему аспекту изобретение относится к способу лечения заболевания, вызванного микробной инфекцией, включающему введение терапевтически эффективного количества соединения формулы (1) и/или его фармацевтически приемлемых солей или фармацевтической композиции пациенту, нуждающемуся в этом. Используемый в настоящем описании термин "терапевтически эффективное количество" представляет собой количество, эффективное для ослабления или предотвращения симптомов. Термин "пациент, нуждающийся в этом" относится к пациенту, нуждающемуся в лечении заболевания, вызванного микробной инфекцией. Согласно одному из аспектов изобретения "пациент, нуждающийся в этом" относится к любому пациенту, который заражен или имеет риск заражения микробной инфекцией. Предпочтительно "пациент, нуждающийся в этом" относится к животному, более предпочтительно к млекопитающему, еще более предпочтительно к человеку."Введение" при использовании согласно настоящему изобретению относится к взаимодействию соединения формулы (1) и/или его фармацевтически приемлемых солей или фармацевтической композиции, как правило, присутствующих в терапевтически эффективном количестве, и пациента, нуждающегося в этом, предпочтительно животного, более предпочтительно млекопитающего, еще более предпочтительно человека. Соединения согласно настоящему изобретению готовят к применению путем получения разбавленного раствора или суспензии в фармацевтически приемлемой водной, органической или водно-органической среде для местного или парентерального введения при помощи внутривенной, подкожной или внутримышечной инъекции или для интраназального введения; или получают в форме таблетки, капсулы или водной суспензии совместно с традиционными наполнителями для перорального введения или в форме суппозиториев. Соединения согласно настоящему изобретению можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями при помощи одного или более способов, включая, но не ограничиваясь ими, пероральный (например, в виде таблетки, капсулы или раствора для приема внутрь), местный, чресслизистый (например, в виде спрея для носа или аэрозоля для ингаляции), назальный, парентеральный (например, в форме инъекции), желудочно-кишечный, интраспинальный, интраперитонеальный, внутримышечный, внутривенный, внутриматочный, внутриглазной, внутрикожный, внутричерепной, интратрахеальный, внутривагинальный, интрацеребровентрикулярный, внутримозговой, подкожный, офтальмологический (включая интравитреальный или интракамеральный), чрескожный, ректальный, трансбуккальный, эпидуральный или подъязычный. Более конкретно, новые соединения согласно настоящему изобретению можно вводить в виде большого числа различных лекарственных форм, т.е. их можно объединять с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, пастилок, формованных пастилок,леденцов, порошков, спреев, кремов, бальзамов, суппозиториев, желе, паст, лосьонов, мазей, водных суспензий, инъецируемых растворов, эликсиров, сиропов и т.д. Указанные носители включают твердые разбавители или вещества-наполнители, стерильные водные среды и различные нетоксичные органические растворители и т.д. Кроме того, в пероральные фармацевтические композиции можно вводить под-6 023879 ходящие подсластители и/или вкусоароматические добавки. Кроме того, изобретение относится к соединению формулы (1) и/или его фармацевтически приемлемым солям для применения в способе лечения или профилактики бактериальных инфекций у млекопитающих. Предпочтительными для применения в указанном способе соединениями формулы (1) и/или их фармацевтически приемлемыми солями являются конкретные соединения, перечисленные выше. Согласно дополнительному аспекту изобретение относится к способу подавления микробной инфекции,включающему введение терапевтически эффективного количества соединения формулы (1) и/или его фармацевтически приемлемых солей или фармацевтической композиции, содержащей соединение формулы (1) и/или его фармацевтически приемлемые соли. Соединения формулы (1) согласно настоящему изобретению можно применять в способе подавления микробной инфекции, так как они обладают высокой противобактериальной активностью, в частности, в отношении микобактерий, при этом минимальные ингибирующие концентрации (MIC) находятся в диапазоне 0,19-15 нг/мл в случае М. tuberculosis H37Rv. Авторы настоящего изобретения неожиданно обнаружили, что соединения согласно настоящему изобретению имеют высокую селективность к микобактериям и родственным актинобактериям, что снижает риск возникновения отрицательных побочных эффектов. Типовые результаты, полученные при помощи способа исследования восстановления резазурина (J.C. Palomino, A. Martin, М. Camacho, Н.Guerra, J. Swings, F. Portaels, Antimicrob. Agents Chemother., 2002, 46, 2720-2), приведены в примере 22. Соединения можно применять в дозировках, составляющих 0,001-1000 мг/кг массы тела. Примеры, приведенные далее в экспериментальной части, служат для иллюстрации изобретения, но не ограничивают его. Структуры соединений согласно настоящему изобретению устанавливали с учетом способа синтеза при помощи элементного анализа и спектров ядерного магнитного резонанса и масс-спектрометрии. Примеры Химические реактивы и растворители приобретали в Alfa-Aesar (GB) или в Aldrich Co. (SigmaAldrich Company, St-Louis, US). Их применяли без дополнительной очистки. Температуру плавления определяли согласно процедуре ВР, использовали нескорректированные значения (Electrothermal 9001,GB). Если результаты анализа выражены только символами элементов, то они входят в рамки 0,3% от теоретических значений (Carlo-Erba 5500, Italy). Спектры ЯМР получали при помощи Varian Unity Plus 300 (USA). Химические сдвиги 1 Н ЯМР выражены в ppm относительно ТМС . Масс-спектры получали на оборудовании Finnigan SSQ-700 (USA) с прямым вводом пробы. Прохождение реакций и чистоту соединений контролировали путем ТСХ с применением алюминиевых пластин F254 с Silicagel 60 (Merck Co, Germany). Пример 1. 2-(4-Циклогексилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4 Н-1,3-бензотиазин-4-он Гидроксид натрия (0,9 г; порошок) растворяли в 10 мл ДМСО и 2,1 мл дисульфида углерода добавляли при температуре, составляющей 10-15 С. 3,0 г 2-хлор-3-нитро-5-трифторметилбензамида добавляли в раствор небольшими частями при температуре, составляющей 10 С. Через 15 мин добавляли 0,7 млMeI при температуре, составляющей 10-20 С. Реакционную смесь оставляли на 30 мин для прохождения реакции, после чего добавляли 100 мл воды. Полученное желтое твердое вещество, 2-метилтио-8-нитро 6-трифторметил-4 Н-1,3-бензотиазин-4-он, отделяли путем фильтрования. Выход: 47% Тпл 200-203 С (этилацетат) МС (m/z): 322 (М+) 1 Н ЯМР (ДМСО-d6):8,95 и 8,81 (два 1H, два s, 2CH), 2,73 (3 Н, s, CH3) ppm Анализ C10H5F3N2O3S2: Расчет: С, 37,28; Н, 1,56; N, 8,69; S, 19,90 Эксперимент: С, 37,21; Н, 1,54; N, 8,64; S, 20,03. Суспензию 3,0 г 2-метилтио-8-нитро-6-трифторметил-4 Н-1,3-бензотиазин-4-она в 15 мл этанола обрабатывали 1,5 г 4-циклогексилпиперазина при комнатной температуре. Реакционную смесь нагревали до 50-60 С в течение 20 мин. После охлаждения добавляли 100 мл Соединение 2 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(циклогексилметил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 71% Тпл: 184-186 С (этанол) МС (m/z): 456 (М+) 1 Н ЯМР (ДМСО-d6):8,86 и 8,76 (два 1H, два s, 2 СН), 3,91 (4 Н, шир. s, N(CH2)2), 2,51 (4 Н, шир. s,N(CH2)2), 2,13 (2 Н, d, СН 2), 1,53 (1H, шир. m, 1CH), 1,70, 1,20 и 0,85 (10 Н, 3 шир. m, С 5 Н 10) ppm Анализ C20H23F3N4O3S: Расчет: С, 52,62; Н, 5,08; N, 12,27 Эксперимент: С, 52,60; Н, 5,01; N, 12,34. Пример 3. 2-(4-Бутилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 3) Соединение 3 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-бутилпиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 69% Тпл: 119-120 С(н-гексан) МС (m/z): 416 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 3,90 (4 Н, шир. s, N(CH2)2), 2,51 (4 Н, шир. s,N(CH2)2), 2,32 (2 Н, t, СН 2), 1,46 и 1,33 (4 Н, 2m, 2 СН 2), 0,91 (3 Н, t, CH3) ppm Анализ C17H19F3N4O3S: Расчет: С, 49,03; Н, 4,60; N, 13,45 Эксперимент: С, 48,94; Н, 4,67; N, 13,38. Пример 4. 2-(4-Изобутилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 4) Соединение 4 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-изобутилпиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 77% Тпл: 150-153 С (этанол) МС (m/z): 416 (М+) Соединение 5 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-втор-бутилпиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 62% Тпл: 127-128 С (этанол) МС (m/z): 416 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 3,90 (4 Н, шир. s, N(CH2)2), 2,67 (Н, шир. s,СН), 2,50 (4 Н, шир. s, N(CH2)2), 1,41 (2 Н, d m, СН 2), 0,85 (6 Н, m, 2CH3) ppm Анализ C17H19F3N4O3S: Расчет: С, 49,03; Н, 4,60; N, 13,45 Эксперимент: С, 49,10; Н, 4,51; N, 13,37. Пример 6. 2-[4-(2-Циклогексилэтил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 6) Соединение 6 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(2-циклогексилэтил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 62% Тпл: 175-177 С (этанол) МС (m/z): 470 (М+) 1 Н ЯМР (ДМСО-d6):8,86 и 8,76 (два 1H, два s, 2 СН), 3,91 (4 Н, шир. s, N(CH2)2), 2,51 (4 Н, шир. s,N(CH2)2), 2,36 (2 Н, t, СН 2), 1,70-0,85 (13 Н, 4 шир. m, СН 2-СН(С 5 Н 10 ppm Анализ C21H25F3N4O3S: Расчет: С, 53,61; Н, 5,36; N, 11,91 Эксперимент: С, 53,52; Н, 5,43; N, 11,81. Пример 7. 2-[4-(1-Метилбутил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он Соединение 7 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(1-метилбутил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 55% Тпл: 132-133 С (этанол) МС (m/z): 471 (М+) 1 Соединение 8 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-гептилпиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 68% Тпл: 125-127 С (этанол) МС (m/z): 458 (М+) 1 Соединение 9 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(пиридин-4-илметил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 64% Тпл: 200-202 С (этанол) Соединение 10 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(4-феноксибутил)пиперазина в качестве амина, с получением соединения в виде светложелтого кристаллического твердого вещества. Выход: 44% Тпл: 256-258 С (этанол) МС (m/z): 508 (М+) 1 Н ЯМР (ДМСО-d6):8,91 и 8,80 (два 1H, два s, 2CH), 7,29 (2 Н, t, 2CH), 6,93 (3 Н, d, 3CH), 4,03 (2 Н,t, ОСН 2), 3,65 (2 Н, d, 2 СН), 3,19 (4 Н, шир. m, N(CH2)2), 1,94 и 1,79 (4 Н, 2 шир. m, 2 СН 2) ppm Анализ C23H23F3N4O4S: Расчет: С, 54,32; Н, 4,56; N, 11,02 Эксперимент: С, 54,36; Н, 4,67; N, 11,07. Пример 11. 2-[4-(3-Метоксипропил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 11) Соединение 11 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(3-метоксипропил)пиперазина в качестве амина, с получением соединения в виде светложелтого кристаллического твердого вещества. Выход: 37% Тпл: 133-134 С (смесь н-гексана и этилацетата) МС (m/z): 432 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 3,85 (4 Н, шир. s, N(CH2)2), 3,41 (2 Н, d,ОСН 2), 3,20 (3 Н, s, СН 3), 2,55 (4 Н, шир. s, N(CH2)2), 2,34 (2 Н, t, NCH2), 1,68 (2 Н, m, CH2) ppm Анализ C17H19F3N4O4S: Расчет: С, 47,22; Н, 4,43; N, 12,96 Эксперимент: С, 47,19; Н, 4,54; N, 13,08. Пример 12. 8-Нитро-2-(4-пентилпиперазин-1-ил)-6-(трифторметил)-4H-1,3-бензотиазин-4-он (соединение 12) Соединение 12 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-пентилпиперазина в качестве амина, с получением соединения в виде светло-желтого кристаллического твердого вещества. Выход: 71% Тпл: 133-134 С (этанол) МС (m/z): 430 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 3,90 (4 Н, шир. s, N(CH2)2), 2,51 (4 Н, шир. s,N(CH2)2), 2,32 (2 Н, t, СН 2), 1,48 (2 Н, m, СН 2), 1,26 (4 Н, m, 2 СН 2), 0,88 (3 Н, t, CH3) ppm Анализ C18H21F3N4O3S: Расчет: С, 50,23; Н, 4,92; N, 13,02 Эксперимент: С, 50,29; Н, 4,85; N, 13,10. Пример 13. 2-[4-(1-Этилпропил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4 он (соединение 13) Соединение 13 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(1-этилпропил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 79% Тпл: 152-153 С (этанол) МС (m/z): 430 (М+) 1 Соединение 14 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(3-циклогексилпропил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 63% Тпл: 145-147 С (н-гексан) МС (m/z): 484 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 3,90 (4 Н, шир. s, N(CH2)2), 2,62 (4 Н, шир. s,N(CH2)2), 2,23 (2 Н, t, СН 2), 1,56, 1,49, 1,20 и 0,87 (15 Н, 4m, СН 2 СН 2 СН(СН 2)5) ppm Анализ C22H27F3N4O3S: Расчет: С, 54,53; Н, 5,62; N, 11,56 Эксперимент: С, 54,48; Н, 5,53; N, 11,71. Пример 15. 2-[4-(1-Адамантил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он Соединение 15 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-(1-адамантил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 77% Тпл: 236-238 С (этанол) МС (m/z): 494 (М+) 1 Соединение 16 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-[2-(бензилокси)этил]пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 64% Тпл: 117-119 С (этанол) МС (m/z): 494 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 7,33 (5 Н, m, С 6 Н 5), 4,49 (2 Н, s, ОСН 2), 3,85 Соединение 17 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-3-[2-(4-фторфенил)-1,3-диоксолан-2-ил]пропилпиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 71% Тпл: 152-154 С (этанол) МС (m/z): 568 (М+) 1 Соединение 18 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-[3-(4-фторфенокси)пропил]пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 37% Тпл: 165-167 С (этанол) Соединение 19 получали при помощи способа, аналогичного приведенному в примере 1, с применением 4-пропилпиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 69% Тпл: 130-132 С (этанол) МС (m/z): 402 (М+) 1 Н ЯМР (ДМСО-d6):8,85 и 8,76 (два 1H, два s, 2 СН), 3,90 (4 Н, шир. s, N(CH2)2), 2,51 (4 Н, шир. s,N(CH2)2), 2,32 (2 Н, t, СН 2), 1,48 (2 Н, m, СН 2), 0,90 (3 Н, t, CH3) ppm Анализ C16H13F3N4O3S: Расчет: С, 47,76; Н, 4,26; N, 13,92 Эксперимент: С, 47,81; Н, 4,20; N, 13,87. Пример 20. 6-Хлор-2-4-[3-(4-фторфенокси)пропил]пиперазин-1-ил-8-нитро-4H-1,3-бензотиазин 4-он (соединение 20) Гидроксид натрия (1,0 г; порошок) растворяли в 10 мл ДМСО и 2,4 мл дисульфида углерода добавляли при температуре, составляющей 10-15 С. В раствор добавляли 3,0 г 2,5-дихлор-3-нитробензамида небольшими частями при температуре, составляющей 10 С. Через 15 мин добавляли 0,9 мл MeI при температуре, составляющей 10-20 С. Реакционную смесь оставляли на 30 мин для прохождения реакции, а затем добавляли 100 мл воды. Полученное желтое твердое вещество, 6-хлор-2-метилтио-8-нитрометил-4H-1,3-бензотиазин-4-он, отделяли путем фильтрования. Выход: 47% Тпл: 200-203 С (этилацетат) МС (m/z): 322 (М+) 1 Н ЯМР (ДМСО-d6):8,54 и 8,40 (два 1H, два s, 2CH), 2,71 (3 Н, s, CH3) ppm Анализ (C9H5ClN2O3S2): Расчет: С, 37,44; Н, 1,75; N, 9,79 Эксперимент: С, 37,40; Н, 1,71; N, 9,874. Суспензию 1,5 г 6-хлор-2-метилтио-8-нитрометил-4 Н-1,3-бензотиазин-4-она в 10 мл этанола обрабатывали 0,8 г 4-[3-(4-фторфенокси)пропил]пиперазина при комнатной температуре. Реакционную смесь нагревали до 50-60 С в течение 20 мин. После охлаждения добавляли 100 мл воды. Полученное светложелтое твердое вещество, 6-хлор-2-4-[3-(4-фторфенокси)пропил]пиперазин-1-ил-8-нитро-4H-1,3 бензотиазин-4-он, отделяли путем фильтрования. Выход: 68% Тпл: 192-194 С (этанол) МС (m/z): 478 (М+) 1 Н ЯМР (ДМСО-d6):8,64 и 8,53 (два 1H, два s, 2CH), 7,11 и 6,94 (5 Н, 2m, C6H4F), 4,12 (2 Н, t,ОСН 2), 3,85 (4 Н, шир. s, N(CH2)2), 2,55 (4 Н, шир. s, N(CH2)2), 2,50 (2 Н, m, СН 2), 1,83 (2H, q, CH2) ppm Анализ C21H20ClFN4O4S: Расчет: С, 52,66; Н, 4,21; N, 11,70 Эксперимент: С, 52,53; Н, 4,14; N, 11,69. Пример 21. 6-Хлор-2-[4-(3-циклогексилпропил)пиперазин-1-ил]-8-нитро-4H-1,3-бензотиазин-4-он Соединение 21 получали при помощи способа, аналогичного описанному в примере 19, с применением 4-(3-циклогексилпропил)пиперазина в качестве амина, с получением соединения в виде желтого кристаллического твердого вещества. Выход: 68% Тпл: 194-195 С (этанол) МС (m/z): 450 (М+) 1H ЯМР (ДМСО-d6):8,64 и 8,53 (два 1H, два s, 2 СН), 3,90 (4 Н, шир. s, N(CH2)2), 2,52 (4 Н, шир. s,N(CH2)2), 2,26 (2 Н, t, СН 2), 1,67, 1,47, 1,19 и 0,85 (15 Н, 4m, СН 2 СН 2 СН(СН 2)5) ppm Анализ C21H27ClN4O3S: Расчет: С, 55,93; Н, 6,03; N, 12,42 Эксперимент: С, 56,02; Н, 6,14; N, 12,49. Пример 22. Определение ингибирующей активности соединений согласно настоящему изобретению в отношении микобактерий in vitro. Активность в отношении М. smegmatis и М. tuberculosis H37Rv определяли при помощи исследования восстановления резазурина (MIC99). Способ подробно описан в J.C. Palomino, A. Martin, M. Camacho,H. Guerra, J. Swings, F. Portaels, Antimicrob. Agents Chemother., 2002, 46, 2720-2. Результаты представлены в табл. 1. Таблица 1 Ингибирующая активность соединений согласно настоящему изобретению в отношении актинобактерий in vitro - типовые значения MIC (нг/мл) НД - нет данных Пример 23. Определение in vivo эффективности соединений (2) и (19) формулы (1) в отношенииMycobacterium tuberculosis в модели острого ТБ у мышей. Вещества и способы. Определение специфической активности в отношении туберкулеза проводили in vivo на самцах мышей BALB/c/Cit с массой тела 22-23 г. Мышей инфицировали путем внутривенной инъекции 5106 КОЕ штамма М. tuberculosis H37Rv в латеральную хвостовую вену. М. tuberculosis выращивали в препаративных количествах и аликвоты отбирали в лаборатории иммуногенетики Центрального научноисследовательского института туберкулеза Российской Академии Медицинских Наук. Аликвоты (1 мл) хранили при -70 С. Для инфицирования мышей аликвоты размораживали, диспергировали в фосфатном буфере, содержащем 0,025% Tween 80 и доводили концентрацию до 5106 КОЕ/мышь. Всех животных,используемых в эксперименте, делили на 10 групп по 10 мышей в каждой. Лечение животных проводили в течение 4 недель, начиная со второго дня после введения инъекции. Соединения вводили внутрь кишечника каждый день за исключением выходных (5 раз в неделю). Вводимый объем составлял 0,5 мл/мышь. Затем животных умерщвляли путем смещения шейных позвонков для микробиологической оценки. Для определения эффективности каждой схемы химиотерапии рассматривали макроскопические изменения паренхиматозных органов и выделение М. tuberculosis из материала, подверженного патологии. Для определения числа КОЕ М. tuberculosis в легких инфицированных мышей легкие гомогенизировали в 2 мл солевого раствора, затем проводили последовательные десятикратные разбавления в солевом растворе, и 50 мкл каждого разбавленного раствора помещали в планшеты с агаром Дюбо. Планшеты,содержащие суспензию клеток легких, инкубировали в течение 21 дня при 37 С, затем подсчитывали число колоний и определяли число КОЕ в легких. Соединения и получение растворов. Точное количество (200 мг) соединений (2) и (19) помещали в стеклянные пробирки и добавляли 0,5 мл уксусной кислоты. Соединения сразу же растворялись, и в полученный раствор добавляли 99,5 мл воды. Растворы исследуемых соединений, полученные таким образом, применяли в течение 4 недель. Применяемая доза соединений (2) и (19) составляла 50 мг/кг, доза изониазида (INH) составляла 25 мг/кг. Результаты исследования. У животных из отрицательной контрольной группы первые признаки заболевания проявлялись на 19-20 день после инфицирования; происходило снижение веса, мыши стали чаще собираться в группы, а не активно передвигаться по клетке, начал проявляться "кифоз", но жидкий стул отсутствовал. Смерть животных контрольной группы наступала на 26-29 день после инфицирования. Макроскопическая оценка внутренних органов мертвых мышей этой группы показала наличие множества очагов протекания туберкулеза, крупных сливающихся очагов. Селезенка была увеличена в 3 раза. Лечение соединениями(2) и (19), BTZ043 и INH в течение заданного периода времени приводило к значительным улучшениям. Состояние легких становилось близким к нормальному, т.е. восстанавливалась вентиляция, легкие становились розовыми, видимые очаги туберкулезной инфекции отсутствовали. Через 26 дней после инфицирования 3 живых мышей из контрольной группы умерщвляли для определения числа КОЕ в легких. В соответствии с программой исследования легкие удаляли у группы из 1-4 мышей для определения числа КОЕ через 4 недели после начала лечения. Результаты исследования перечислены в табл. 2. Таблица 2 Число КОЕ М. tuberculosis H37Rv в легких мышей через 4 недели лечения в модели острого ТБ у мышей ВТ 2043 - 2-[(2S)-2-метил-1,4-диокса-8-азаспиро[4.5]дец-8-ил]-8-нитро-6-(трифторметил)-4H-1,3-бензотиазин-4-он, описан в V. Makarov et al. Science, 2009, 324, 801. Приведенный пример явно показывает, что новые 2-пиперазин-1,3-бензотиазин-4-оны, которые представлены на примере соединений (2) и (19), обладают эквивалентной или более высокой активностью по сравнению с 1,3-бензотиазин-4-онами, описанными ранее. Пример 24. Определение эффективности in vivo соединений формулы (1) в отношении М. tuberculosis в модели хронического ТБ у мышей. Вещества и способы. Мышей BALB/c (Charles River Laboratories, France) возрастом от 4 до 6 недель (20-25 г) инфицировали при помощи аэрозоля штаммом H37Rv (100 КОЕ). Лечение (5 мышей в группе) начинали через четыре недели после инфицирования, соединения вводили принудительно один раз в день шесть раз в неделю в течение 4 недель. Лекарственные средства применяли в следующих концентрациях (мг/кг):BTZ043 по 50 мг/кг; INH по 25 мг/кг; соединения 2 и 8 согласно настоящему изобретению (оба по 50 мг/кг). INH растворяли в воде, в то же время BTZ043 и соединения 2 и 8 получали в 0,5% карбоксиметилцеллюлозе. Контрольных мышей и мышей, которым проводили курс лечения, умерщвляли, затем легкие и селезенку гомогенизировали и разбавленные растворы помещали в планшеты 7 Н 10 для определения числа живых палочек (в КОЕ). Статистический анализ. Число КОЕ в легких перед анализом представляли в виде log10(x+1), где х представляет собой абсолютное число КОЕ. Средние значения КОЕ/группу в контрольной группе и в группах с различными экспериментальными схемами дозирования сравнивали при помощи однофакторного анализа вариаций при помощи GraphPad v5.0. Результаты исследования. Результаты эксперимента представлены на чеотеже, на котором можно увидеть, что лечение соединениями 2 и 8 являлось значительно более эффективным по сравнению с лечением BTZ043, что определяли по снижению числа КОЕ в легких и селезенке. Лечение соединениями 2 и 8 согласно статистике значительно отличалось от лечения BTZ043, эффективность которого была незначительно ниже леченияINH. Результаты, полученные для модели хронического ТБ у мышей, показывают, что соединения согласно настоящему изобретению являются перспективными противотуберкулезными агентами. Пример 25. Ряд сравнительных экспериментов ADME/T in vitro проводили для предсказания возможности сохранения улучшенной эффективности PBTZ169 (соединение 2) по сравнению с BTZ043,- 16023879 наблюдаемой у мышей, при лечении человека. Во-первых, измеряли химическую стабильность PBTZ169 в 5 мкМ концентрации в воспроизведенном желудочном соке, через 60 мин сохранялось 67% соединения, было показано, что период полувыведения соединения в концентрации 5 мкМ из плазмы человека составляет 60 мин. Затем PBTZ169 иBTZ043 инкубировали в концентрации 1 мкг/мл с 0,1 мг микросом печени человека или мыши(Invitrogen) для измерения собственного клиренса. Относительные количества исходного соединения,сохранявшегося в течение периода времени, определяли путем ВЭЖХ. Карбамазипин и нифедипин применяли в качестве контрольных соединений с низким и высоким собственным клиренсом соответственно. Результаты показывают, что BTZ043 и PBTZ169 обладают средним собственным клиренсом (9Clint47 мкл/мин/мг белка) в микросомах печени человека и мышей, при этом PBTZ169 имело незначительно более высокий собственный клиренс (табл. 3). Для нифедипина и карбамазепина наблюдали ожидаемые высокое и низкое значения собственного клиренса. Таблица 3 Значения Clint для BTZ043, PBTZ169 и контрольных лекарственных средств Индекс селективности (SI) соединения является надежным показателем переносимости потенциального лекарственного средства. SI соответствует концентрации соединения, вызывающей 50% цитотоксический эффект (ТС 50), отнесенной к MIC соединения. Значения ТС 50 для PBTZ169 и BTZ043 определяли с применением двух клеточных линий человека, линии гепатоцитов HepG2 и линии пневмоцитов А 549 при помощи исследования восстановления резазурина путем инкубации с различными количествами соединений в течение 72 ч. Значения ТС 50 для PBTZ169 и BTZ043 в отношении клеток HepG2 составляли 66,7 и 6,3 мкг/мл соответственно. Значения ТС 50 для PBTZ169 и BTZ043 в отношении клеток А 549 составляли 73,2 и 16,3 мкг/мл соответственно. Соответствующие значения MIC составляли 1 и 2 нг/мл для PBTZ169 и BTZ043. Следовательно, так как в обоих случаях для PBTZ169 наблюдали значительно сниженную цитотоксичность, то его SI значительно превосходит значение для BTZ043 (табл. 4). Используя клинические термины, можно сказать, что PBTZ является более безопасным и лучше переносится по сравнению с BTZ043. Таблица 4 Сравнение SI на примере двух клеточных линийR3 представляет собой насыщенный или ненасыщенный галогенированный или негалогенированный линейный, разветвленный или циклический алкил, содержащий 3-12 атомов углерода, в котором одна или две метиленовые группы, если присутствуют, возможно замещены на О, S или NR4, или где X представляет собой насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-6 атомов углерода;Z представляет собой прямую связь, линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода;Q представляет собой фенил, нафтил, пиридил, хинолил, пиразинил, пиримидил, пиразолил, триазинил, имидазолил, фуранил или тиенил, где от одного до трех атомов водорода возможно замещены на группу R7;R5 и R6 независимо друг от друга выбраны из Н, C1-4 алкила, OC1-4 алкила, галогена, COOR5,CONR6R7, OCF3, CF3 или CN; группа R7 представляет собой галоген, насыщенный или ненасыщенный линейный или разветвленный алифатический радикал, содержащий 1-3 атома углерода, SO2NR5R6, COOR4, CONR5R6, CHO, OCF3,моно-, ди- или трифторметил или фенил,и/или его фармацевтически приемлемая соль. 2. Соединение формулы (1) по п.1, отличающееся тем, что указанное соединение представляет собой 2-(4-R3-пиперазин-1-ил)-8-нитро-6-(трифторметил)-4 Н-1,3-бензотиазин-4-он, a R3 имеет значение,приведенное в п.1. 3. Соединение формулы (1) по п.1, отличающееся тем, что указанное соединение представляет собой 2-(4-R3-пиперазин-1-ил)-8-нитро-6-R2-4 Н-1,3-бензотиазин-4-он, R2 представляет собой галоген, a R3 имеет значение, приведенное в п.1. 4. Соединение формулы (1) по п.2, отличающееся тем, что указанное соединение представляет собой 2-[4-(циклогексилметил)пиперазин-1-ил]-8-нитро-6-(трифторметил)-4 Н-1,3-бензотиазин-4-он. 5. Соединение формулы (1) по п.1, отличающееся тем, что указанное соединение представляет собой 2-4-[3-(4-фторфенокси)пропил]пиперазин-1-ил-8-нитро-6-(трифторметил)-4 Н-1,3-бензотиазин-4-он. 6. Соединение формулы (1) по п.2, отличающееся тем, что указанное соединение представляет собой 2-(4-гептилпиперазин-1-ил)-8-нитро-6-(трифторметил)-4 Н-1,3-бензотиазин-4-он. 7. Фармацевтическая композиция для лечения микробной инфекции, вызванной бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia, содержащая соединение формулы (1) и/или его фармацевтически приемлемую соль по любому из пп.1-6 и/или фармацевтически приемлемый носитель и/или наполнитель. 8. Применение соединения по любому из пп.1-6 для терапевтического и/или профилактического лечения заболевания, вызванного бактерией, принадлежащей к роду Mycobacterium, Corynebacterium илиNocardia. 9. Применение по п.8, отличающееся тем, что заболевание, вызванное микробной инфекцией, выбрано из группы, включающей туберкулез, проказу или язву Бурули. 10. Способ терапевтического и/или профилактического лечения заболевания, вызванного бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia, у пациента, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения по любому из пп.1-6 или фармацевтической композиции по п.7. 11. Способ подавления микробной инфекции, вызванной бактерией, принадлежащей к роду Mycobacterium, Corynebacterium или Nocardia, включающий введение терапевтически эффективного количества соединения по любому из пп.1-6 или фармацевтической композиции по п.7.
МПК / Метки
МПК: A61P 31/06, C07D 279/08, A61K 31/5415
Метки: применение, лечения, млекопитающих, инфекций, производные, 2-пиперазин-1-ил-4н-1,3-бензотиазин-4-она
Код ссылки
<a href="https://eas.patents.su/20-23879-proizvodnye-2-piperazin-1-il-4n-13-benzotiazin-4-ona-i-ih-primenenie-dlya-lecheniya-infekcijj-u-mlekopitayushhih.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-пиперазин-1-ил-4н-1,3-бензотиазин-4-она и их применение для лечения инфекций у млекопитающих</a>