Способы приготовления выпечного продукта, используемые для этого композиции и выпечной продукт
Номер патента: 11452
Опубликовано: 28.04.2009
Авторы: Коллинз Тони, Доврин Тьерри, Жори Жак, Дютрон Агнесса, Уайу Анна, Фелье Жорж, Жено Бернар
Формула / Реферат
1. Способ приготовления выпечного продукта, включающий в себя стадию добавления в тесто указанного выпечного продукта улучшающей хлеб композиции, содержащей по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз.
2. Способ по п.1, где указанным ферментом является ксиланаза, полученная из штамма
Pseudoalteromonas haloplanktis.
3. Способ по п.2, где указанным штаммом Pseudoalteromonas haloplanktis является Pseudoalteromonas haloplanktis TAH3a.
4. Способ по п.1, где указанным ферментом является ксиланаза, полученная из штамма Bacillus halodurans.
5. Способ по п.4, где указанным штаммом Bacillus halodurans является Bacillus halodurans C-125.
6. Способ по любому из пп.1-5, где указанную улучшающую хлеб композицию добавляют в ходе замешивания теста.
7. Способ по любому из пп.1-6, где указанная улучшающая хлеб композиция дополнительно содержит другой агент, улучшающий хлеб, выбранный из группы, состоящей из других ферментов, эмульгаторов, оксидантов, сухого молока, жиров, сахаров, аминокислот, солей, белков (глютена, пептидов или полипептидов, являющихся сайтами связывания целлюлозы) или их смесей.
8. Способ по п.7, где указанный другой фермент выбран из группы, состоящей из альфа-амилаз, бета-амилаз, мальтогенных амилаз, других ксиланаз, протеаз, глюкозооксидаз, оксидоредуктаз, глюканаз, целлюлаз, трансглютаминаз, изомераз, липаз, фосфолипаз, пектиназ или их смесей.
9. Способ по п.8, где указанная альфа-амилаза является альфа-амилазой, полученной из Aspergillus oryzae.
10. Способ по любому из пп.1-9, где указанный фермент с ксиланолитической активностью представлен в виде клеточного экстракта, бесклеточного экстракта или в виде очищенного белка.
11. Способ по любому из пп.1-10, где указанный фермент с ксиланолитической активностью смешан с другими ингредиентами в форме сухого порошка или гранул (в частности, непылящих гранул) или в форме жидкости, предпочтительно содержащей один или более чем один стабилизатор, такой как многоатомные спирты, сахара, органические кислоты или сахароспирты.
12. Выпечной продукт, получаемый способом по любому из пп.1-11.
13. Выпечной продукт по п.12, который представляет собой Аргентинский хлеб с увеличенной шириной разреза.
14. Способ увеличения объема выпечного продукта, включающий в себя стадию добавления в тесто выпекаемого продукта во время его замешивания достаточного количества фермента, обладающего ксиланолитической активностью, выбранного из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз.
15. Способ увеличения ширины разреза на поверхности выпечного продукта, включающий в себя стадию добавления в тесто указанного выпекаемого продукта во время его замешивания, достаточного количества фермента, обладающего ксиланолитической активностью, выбранного из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз.
16. Композиция для увеличения объема выпечного продукта, отличающаяся тем, что она содержит по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз.
17. Композиция для увеличения ширины разреза на поверхности выпеченного продукта, отличающаяся тем, что она содержит по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз.
18. Композиция по п.17, отличающаяся тем, что она дополнительно содержит по крайней мере один агент, улучшающий хлеб, выбранный из группы, состоящей из других ферментов, эмульгаторов, оксидантов, сухого молока, жиров, сахаров, аминокислот, солей, белков (глютена, пептидов или полипептидов, являющихся сайтами связывания целлюлозы) или их смесей.
19. Композиция по п.18, где указанный другой фермент выбран из группы, состоящей из альфа-амилаз, бета-амилаз, мальтогенных амилаз, других ксиланаз, протеаз, глюкозооксидаз, оксидоредуктаз, глюканаз, целлюлаз, трансглютаминаз, изомераз, липаз, фосфолипаз, пектиназ или их смесей.
20. Композиция по п.19, где указанная альфа-амилаза является альфа-амилазой, полученной из
Aspergillus oryzae.
21. Композиция для увеличения легкости механической обработки и повышения стабильности теста, отличающаяся тем, что она содержит по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз.
22. Композиция по любому из пп.16-21, где указанный фермент является ксиланазой, полученной из штамма Pseudoalteromonas haloplanktis.
23. Композиция по п.22, где указанным штаммом Pseudoalteromonas haloplanktis является
Pseudoalteromonas haloplanktis TAH3a.
24. Композиция по любому из пп.16-22, где указанный фермент является ксиланазой, полученной из штамма Bacillus halodurans.
25. Композиция по п.24, где указанным штаммом Bacillus halodurans является Bacillus halodurans
C-125.
Текст
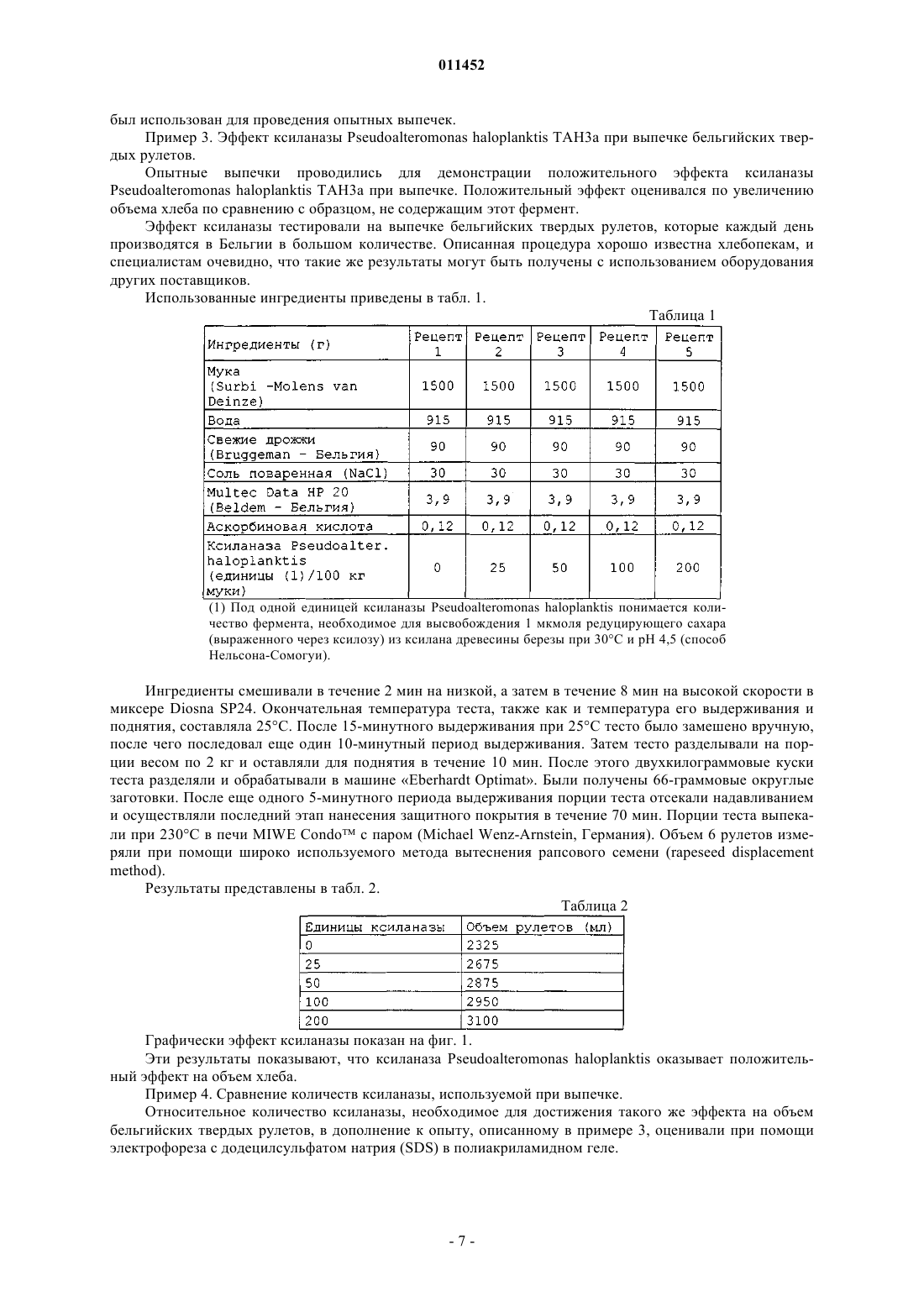
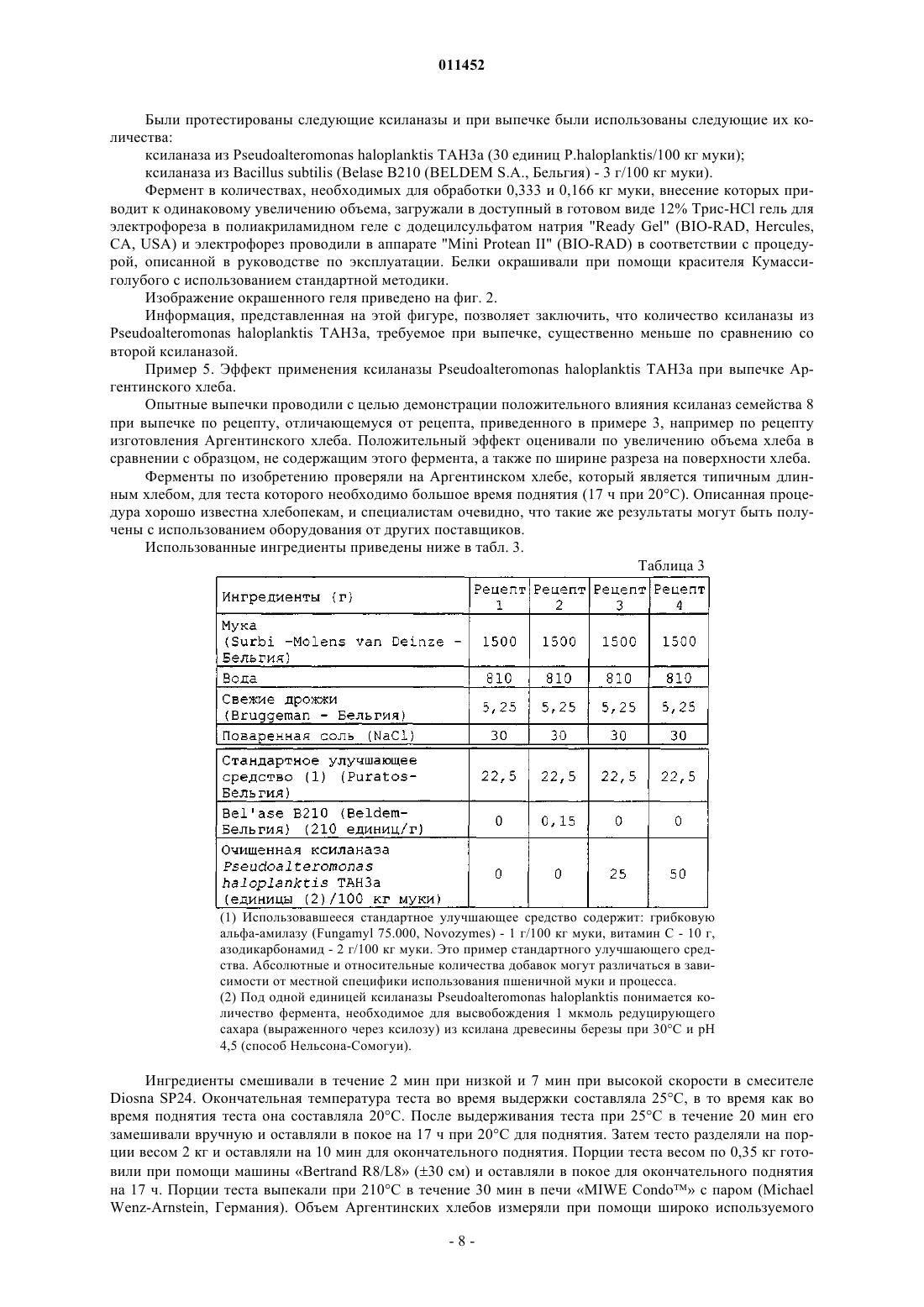
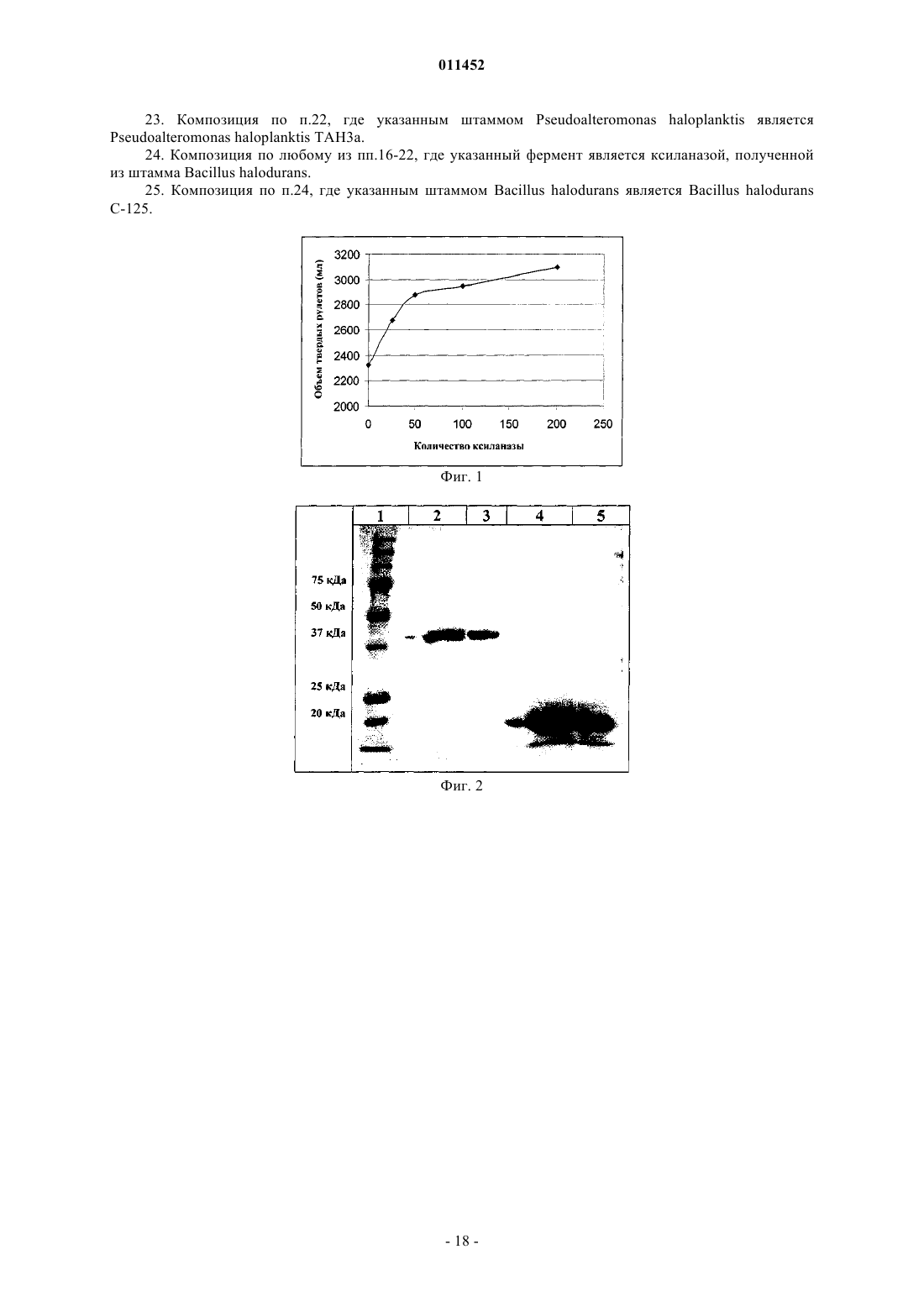
011452 Область техники Данное изобретение относится к способу и композиции для улучшения хлебопекарных продуктов,содержащей по крайней мере один фермент с ксиланолитической активностью, относящийся к семейству 8 глигозид-гидролаз. При осуществлении изобретения указанный фермент с ксиланолитической активностью дополнительно характеризуется тем, что в ходе гидролиза имеет место инверсия конфигурации. В конкретных воплощениях изобретения указанный фермент с ксиланолитической активностью является психрофильной ксиланазой, получаемой из Pseudoalteromonas haloplanktis, либо мезофильной ксиланазой, полученной из Bacillus halodurans. Предшествующий уровень техники Ксиланы - это гетерополисахариды, которые образуют основную часть гемицеллюлозы, присутствующей в биомассе растений. Каркас этих полисахаридов составляет цепь из -1-4-связанных ксилопиранозильных остатков. К этим остаткам может быть присоединено много различных боковых групп, таких как ацетил, арабинозил и глюкуронил. Кроме того, ксилановые цепи могут быть сшиты либо между цепями ксилана и лигнина могут быть образованы связи с помощью фенольных соединений типа феруловой или оксикоричной кислот посредством эфирных связей. Эндоксиланазы (или эндо 1,4-ксиланазы) специфически гидролизуют каркас гемицеллюлозы. В некоторых случаях боковые группы могут маскировать основную цепь за счет стерического барьера. Были описаны активности различных ксиланаз. У разных форм этих ферментов специфичность по отношению к их субстратам варьирует. Некоторые более активны по отношению к нерастворимым арабиноксиланам. Длина производимых олигомеров также зависит от типа ксиланазы. Гликозид-гидролазы (известные ранее как семейство D целлюлаз) разделены на 91 семейство(http://afmb.cnrs-mrs.fr/CAZY/) на основе таких признаков, как гомология последовательностей, структурные и механистические особенности. Поскольку изгиб белковых молекул более консервативен, чем их последовательность, некоторые семейства могут быть сгруппированы в кланы. (Henrissat В. 1991,Biochem. J. Vol. 280, p. 309). Эндо 1,4-ксиланазы обычно относят к семействам 10 (ранее называлось"семейство F") и 11 (ранее - "семейство G), и, как было выявлено, у них часто наблюдается обратная зависимость между pI и молекулярной массой. Ксиланазы семейства 10 (EXs10) крупнее и более сложны,а ксиланазы семейства 11 (EXs11) - меньше по размеру. Более того, существуют значительные различия в структуре и каталитических свойствах обоих семейств. У EXs10 имеется (/) 8 бочкообразный (barrel) изгиб (баррел-изгиб), около 40% -спиралей, и они относятся к клану GH-A (Dominguez et al., 1995,Nat. Struct. Biol. Vol. 2, p. 569), в то же время ферменты EXs11 характеризуются конформацией с изгибом типа -студень (jelly), имеют около 3-5% -спиралей и принадлежат к клану GH-C (Trrnen et al., 1994,EMBO J. Vol. 13, p. 2498). У EXs10 меньший по размеру сайт связывания с субстратом и меньшая субстратная специфичность, они часто показывают эндоглюконазную активность и производят меньшие по размеру олигосахариды по сравнению с производимыми EXs11, которые имеют большее сродство к незамещенному ксилану (Biely et al., 1997, J. Biotechnol. Vol. 57, p. 151). Все ксиланазы обоих семейств,охарактеризованные к настоящему времени, сохраняют аномерную конфигурацию гликозидного кислорода после гидролиза, при котором два остатка глутамата действуют как каталитические центры (Jeffries,1997, Curr. Opin. Biotechnol. Vol. 7, p. 337). Ксиланазы используются в различных отраслях промышленности, таких как целлюлозная, бумажная, пищевая и хлебопекарная. Другие области их применения - производство соков и пива. Ксиланазы могут быть также использованы в процессе расщепления пшеницы. Среди прочего, к известным технологическим эффектам относятся улучшенная способность к отбеливанию целлюлозно-бумажной пульпы,сниженная вязкость пищевых продуктов или изменения характеристик теста. Применение ксиланаз (также называемых гемицеллюлазами или пентозаназами) в хлебопекарном производстве уже много лет известно. Эти ферменты, обеспечивающие нужное качество теста, могут улучшать его механическую обработку, повышают стабильность, а также обеспечивают лучший подъем теста в печи и структуру хлебного мякиша. Другие эффекты фермента - увеличение объема (пышности) выпечки и смягчение мякиша. Механизм действия ксиланаз в процессе приготовления хлеба до сих пор полностью не выяснен. В пшеничной муке присутствует 3-4% пентозанов. Эти пентозаны могут поглощать воду в больших объемах (до 30%). Такое поглощение воды сказывается на формировании свойств теста и качестве готового продукта. Частичный гидролиз пентозанов пентозаназами до олигосахаридов с короткими молекулярными цепочками способствует увеличению поглощения воды. Кроме того, пентозаны активно взаимодействуют с глютеном в муке, образуя своеобразную сеть. Пентозаназы могут способствовать ослаблению этой прочной и жесткой сети, обеспечивая таким образом лучшее проникновение в тесто углекислого газа, выделяемого дрожжами. В качестве активных ингредиентов в пекарном производстве использовалось много различных типов препаратов с гемицеллюлазой. В настоящее время многие препараты имеются в продаже. Они производятся путем микробной ферментации с использованием различных микроорганизмов, служащих источником ферментов. Некоторые из этих ферментов также производятся генетически модифицирован-1 011452 ными микроорганизмами. Все документированные случаи успешного применения ксиланаз для увеличения удельного объема хлебопекарной продукции относятся к семействам 10 и 11 гликозид-гидролаз,описанным выше. Примерами ксиланаз, используемых для хлебопечения, являются ксиланазы, полученные из Bacillussubtilis и из Aspergillus niger. Существует множество различных способов для оценки активности ксиланаз в ферментативном препарате. Примером таких способов определения активности ксиланазы является измерение количества восстанавливающего сахара, высвобождающегося из ксилана (Miller G.L. 1959, Anal. Chem. Vol. 31,p. 426), или измерение высвобождения из модифицированных субстратов окрашенных соединений (например, АзоВАКС (AzoWAX) или Ксилазим АИкс (Xylazyme AX) из Мегазима (Megazyme. Однако нельзя установить прямую корреляционную зависимость между ксиланолитической активностью, проявляемой различными ферментативными препаратами, и действием на процесс хлебопечения. Дозозависимые эффекты могут наблюдаться, в некоторой степени, при действии одного фермента, но такая же доза для двух ксиланаз разного происхождения не оказывает такого же эффекта на тесто или хлеб. Это можно объяснить несколькими причинами: различиями в субстратной специфичности, разными оптимальными температурами и рН и т.д. Большой интерес представляет задача разработки новых ферментных препаратов, таких как композиции или агенты для улучшения хлеба, с новыми или улучшенными свойствами. Одним из таких свойств может быть то, чтобы фракция ксиланаз была как можно меньше (т.е. масса ферментов, необходимая для получения конкретного результата для хлебопекарной продукции). Недавно была описана ксиланаза, выделенная из антарктической бактерии Pseudoalteromonashaloplanktis. Acta Crystallogr D Biol Crystallogr. Vol. 58 (Pt. 9), p. 1494-6). Этот фермент является типичным психрофильным ферментом и показывает большую каталитическую активность при низкой температуре. Он негомологичен ксиланазам семейства 10 или 11, но на 20-30% идентичен членам семейства 8 гликозид-гидролаз (ранее семейство D) - семейства, которое представлено, главным образом,эндоглюканазами, а также лихеназами и хитозаназами. Кроме того, анализ FingerPRINTScan в сравнении с PRINTS с использованием поисковой программы InterPro Scan (Zdobnov and Apweiler, 2001,Bioinformatics. Vol. 17, p. 847) показал, что выделенная последовательность содержит фингерпринт гликозилгидролаз семейства 8 и остатки семейства 8, которые четко консервативные у 20 проанализированных ферментов семейства 8. В отличие от ферментов семейств EXs10 и EXs11 эта ксиланаза семейства 8 (EXs8) имеет как большую величину pI, так и большой молекулярный вес. Структурные и каталитические свойства ее отличны от таковых ферментов семейств EXs10 и EXs11. EXs8 имеет конформацию (/) 6 с бочкообразным изгибом (баррел-изгибом), с 13 -спиралями и 13 -нитями и принадлежит к клану GH-M (VanPetegem et al., 2003, The structure of a cold-adapted family 8 xylanase at 1.3 A resolution. Structural adaptations to cold and investigation of the active site. J. Biol. Chem. Vol. 278 (9), p. 7531-9). Эти ферменты не проявляют эндоглюканазной, хитозаназной или лихеназной активности и, по-видимому, функционально сходны с ферментами семейства EXs11, поскольку более активны в отношении ксилоолигосахаридов с длинной цепью. В отличие от других известных представителей семейств EXs10 и EXs11, которые сохраняют конфигурацию, гликогидролазы семейства 8 (Fierobe et al., 1993. Eur. J. Biochem. Vol. 217, p. 557;http://afmb.cnrs-mrs.fr/CAZY/) имеют тенденцию к гидролизу субстрата, сопровождающемуся инверсией аномерной конфигурации гликозидного кислорода, в ходе которого один остаток глутамата и один остаток аспартата действуют в качестве каталитических остатков. Это было показано, например, для психрофильной ксиланазы, выделенной из Pseudoalteromonas haloplanktis (Van Petegem et al., 2003, J. Biol.physico-chemical characterization. J. Biol. Chem. Vol. 277 (38), p. 35133). Другие ксиланазы, принадлежащие к гликозид-гидролазам семейства 8, уже были описаны (Yoon, K.-H., 1998, Molecular cloning of aBacillus sp. KK-1 xylanase gene and characterization of the gene product. Biochem. Mol. Biol. International. 45 (2), p. 337; Bacillus halodurans C-125 xylanase Y GenBank/GenPept код доступа ВАВ 05824). Эти ксиланазы демонстрируют гомологию последовательностей при сравнении между собой, а также с ксиланазой, полученной из Pseudoalteromonas haloplanktis, описанной Коллинсом и др. (Collins et al., 2002 - см. выше). Список ферментов, принадлежащих к семейству 8 гликозид-гидролаз, регулярно обновляется-2 011452 Задача изобретения В задачу данного изобретения входит представить новые ферментные препараты, такие как композиции для улучшения хлеба. В задачу данного изобретения также входит создание нового способа получения улучшенных хлебопекарных продуктов с использованием указанных ферментных препаратов. Краткое изложение сущности изобретения Неожиданно было обнаружено, что фермент с ксиланолитической активностью, принадлежащий к семейству гликозид-гидролаз семейства 8, оказывает при добавлении в замешиваемое тесто положительное влияние на свойства теста или хлебопекарных продуктов. Также неожиданно было обнаружено, что фермент с ксиланазной активностью, который меняет аномерную конфигурацию при гидролизе, при добавлении в замешиваемое тесто положительно влияет на свойства теста или хлебопекарных продуктов. Далее, также неожиданно было обнаружено, что такое использование ферментов увеличивает объем выпечки. Было также обнаружено, что использование некоторых таких ферментов, обладающих ксиланолитической активностью, принадлежащих к семейству 8 гликозид-гидролаз, EXs8, делает возможным применять меньшие количества фермента для оказания аналогичного действия на свойства теста или хлеба по сравнению с известными до настоящего времени ксиланазами. Конкретное применение данного изобретения имеет отношение к ферментам, обладающим ксиланолитической активностью, из семейства 8 гликозид-гидролаз и их использованию в хлебопекарной промышленности, как описано выше. Частное применение данного изобретения касается психрофильной ксиланазы семейства 8Pseudoalteromonas haloplanktis и мезофильной ксиланазы Y семейства 8 Bacillus halodurans. Эти ферменты являются ксиланазами, осуществляющими процесс гидролиза с инверсией аномерной конфигурации. Предпочтительными являются ксиланазы, полученные из штаммов Pseudoalteromonas haloplanktis ТАН 3 а и Bacillus halodurans C-125 или полученные с использованием соответствующего гена, экспрессия которого осуществляется в подходящем организме-хозяине. Предпочтительно композицию для улучшения хлеба, содержащую, как минимум, один фермент по изобретению, добавляют во время замешивания теста. Указанная композиция для улучшения хлеба может также содержать другие улучшающие свойства агенты, выбранные из группы, содержащей другие ферменты, эмульгаторы, окислители, молочный порошок, жиры, сахара, аминокислоты, соли, белки (глютен, пептиды или полипептиды, являющиеся сайтами связывания целлюлозы) или их смесь. Указанные другие ферменты могут быть выбраны из альфа-амилаз, бета-амилаз, мальтогенных амилаз, других ксиланаз, протеаз, глюкозооксидазы, оксидоредуктаз, глюканаз, целлюлаз, трансглютаминаз,изомераз, липаз, фосфолипаз, пектиназ или их смеси. Указанная альфа-амилаза предпочтительно получена из Aspergillus oryzae. Ферменты с ксиланолитической активностью в соответствии с изобретением могут быть использованы в указанной композиции для улучшения хлеба в форме клеточного или бесклеточного экстракта или в виде очищенного белка. Ферменты, составляющие предмет изобретения, могут быть смешаны с другими ингредиентами и использованы в форме сухого порошка или в виде гранул, в частности непылящих гранул, или в форме жидкости, предпочтительно с одним или более стабилизатором, таким как многоатомные спирты, сахара,органические кислоты или сахароспирты. Другой аспект изобретения касается хлебопекарной продукции, полученной или той, которую можно получить, при применении фермента по изобретению. Дальнейший аспект изобретения касается композиций для улучшения хлеба, включающих в себя хотя бы один из ферментов, составляющих предмет изобретения. Еще один аспект изобретения касается способа увеличения объема выпечного продукта, включающего стадию добавления в тесто указанного выпечного продукта в ходе его замешивания достаточного количества фермента с ксиланолитической активностью, выбранного из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз, возможно ферментов с ксиланолитической активностью, которые осуществляют гидролиз с инверсией конфигурации. Можно использовать в тесте или в хлебопекарных продуктах любую комбинацию или смесь описанных выше ферментов для любой из указанных выше целей. Краткое описание чертежей На фиг. 1 показан эффект увеличенных количеств ксиланазы ТАН 3, полученной из Pseudoalteromonas haloplanktis, на объем бельгийских твердых рулетов (Belgium hard rolls). На фиг. 2 показаны электрофореграммы (электрофорез с додецилсульфатом натрия (SDS) в полиакриламидном геле) различных образцов ксиланаз (количество внесенного фермента пропорционально количеству, используемому при выпечке; для всех ферментов принят один коэффициент пропорциональности):subtilis (4, 5), необходимые для обработки, соответственно, 0,333 (2, 4) и 0,166 кг (3, 5) пшеничной муки. Фиг. 3 А и 3 В показывают последовательности нуклеотидов гена ксиланазы Pseudoalteromonashaloplanktis (A) и соответствующей ксиланазы (В). Фиг. 4 показывает ксиланазу Y из штамма С-125 Bacillus halodurans. Изобретение будет описано более подробно на последующих примерах и воплощениях со ссылками на приложенные фигуры. Частные воплощения и примеры ни в коей мере не ограничивают объем данного изобретения в том виде, как оно заявлено. Подробное описание изобретения Данное изобретение, в частности, относится к использованию ферментов семейства 8, обладающих ксиланолитической активностью, в хлебопекарном производстве для улучшения, среди прочего, объема выпечного продукта. Указанные ферменты могут проявлять и другие типы активности, но их ксиланолитическая активность должна быть такой, чтобы фермент соответствовал задаче данного изобретения. А. Получение некоторых предпочтительных ферментов в соответствии с изобретением. Ферменты с ксиланолитической активностью из семейства 8 гликозилгидролаз могут быть получены из различных источников (для обзора см., например, http://afmb.cnrs-mrs.fr/CAZY/). Некоторые из ферментов были описаны в научной литературе и, таким образом, их можно получить с использованием способов, описанных в соответствующих публикациях. Ниже приводится более детальное описание приготовления некоторых предпочтительных ферментов, соответствующих изобретению. А.1. Ксиланаза из Pseudoalteromonas haloplanktis TAH3a. Ксиланаза из Pseudoalteromonas haloplanktis TAH3a была описана Т. Коллинсом и др. (Collins T. et(38), p. 35133). Коллинс и др. описывают получение фермента при культивировании в жидкой среде рекомбинантного штамма Escherichia coli, несущего ген ксиланазы Pseudoalteromonas haloplanktis TAH3a,клонированный в плазмиде экспрессии. Последовательность нуклеотидов гена ксиланазы Pseudoalteromonas haloplanktis доступна, так же как и соответствующая последовательность аминокислот (номерAJ427921 в EMBL, последовательность приводится путем ссылки, фиг. 3 А, 3 В, SEQ ID NO: 6 и 7). Фермент имеет молекулярную массу 46000 Да, изоэлектрическую точку, равную примерно 9,5, температурный оптимум 35 С и оптимум рН 5,3-8. Это - истинная ксиланаза, основными продуктами реакции гидролиза которой (после длительной инкубации) являются ксилотриоза и ксилотетраоза. Сырой или очищенный препарат этой ксиланазы может быть получен сначала культивированием или дикого типа, или рекомбинантного штамма в среде, подходящей для экспрессии фермента в итоге, с последующим одним или несколькими этапами очистки, такими (но не только такими) как центрифугирование, разрушение клеток (клеточных мембран), микрофильтрация, ультрафильтрация, осаждение,жидкостная хроматография, сублимационная сушка и т.п. А.2. Ксиланаза Y из Bacillus halodurans C-125. Последовательность представителя семейства 8 - ксиланазы Y из штамма С-125(АТСССВАА-125) Bacillus halodurans имеется в GenBank/GenPept под номером ВАВ 05824 (последовательность прилагается путем ссылки, фиг. 4, SEQ ID NO: 8). Соответствующая последовательность ДНК доступна как часть полной последовательности генома штамма С-125 Bacillus halodurans (коллекционный номер АР 001514, последовательность приводится путем ссылки). Ксиланаза из Bacillus halodurans С-125 может быть получена сначала культивированием штамма в/на среде, подходящей для экспрессии ксиланазы, с последующим одним или несколькими этапами очистки, такими (но не только такими) как центрифугирование, разрушение клеток (клеточных мембран), микрофильтрация, ультрафильтрация, осаждение, жидкостная хроматография, сублимационная сушка и т.п. Альтернативно, ксиланаза из Bacillus halodurans С-125 может быть получена сначала клонированием соответствующего гена с использованием хорошо известных методов, таких как ПЦР-амплификация,сшивание с вектором и трансформация в микроорганизм-хозяин. После этого этапа ксиланаза может быть преимущественно экспрессирована в подходящем хозяине путем помещения гена под контроль подходящих контрольных последовательностей, таких (но не только таких) как промоутер и терминатор,и введения этой ДНК-конструкции в клетку; обеспечила бы экспрессию гена. В конкретном воплощении данного изобретения ген ксиланазы избыточно экспрессируется в указанной клетке. Однако данное изобретение не ограничивается только указанными выше ферментами, оно распространяется и на другие ферменты с ксиланолитической активностью, принадлежащие к семейству 8 гликозид-гидролаз. Эти ферменты производятся микробными и немикробными живыми клетками, такими(но не только такими) как клетки растений и животных. Ферменты могут быть получены непосредственно из живых клеточных культур и/или образцов или они могут продуцироваться рекомбинантными штаммами или клетками-хозяевами. Ген, кодирующий рассматриваемые ферменты, может быть синтезированным.-4 011452 Под термином рекомбинантный штамм или рекомбинантная клетка-хозяин понимается штамм,в котором содержится встроенная последовательность нуклеотидов указанных ферментов с ксиланолитической активностью, принадлежащих к семейству 8 гликозидаз-гидролаз. Преимущественно рекомбинантные клетки-хозяева выбраны из группы, относящейся к микроорганизмам, предпочтительно бактериям или грибам, включая дрожжи, еще предпочтительнее Bacillus. Предпочтительно, чтобы указанный рекомбинантный штамм был способен к избыточной экспрессии указанной последовательности нуклеотидов и преимущественно обеспечивал бы большое производство указанной ксиланазы. Ферменты с ксиланолитической активностью, произведенные в соответствии с настоящим изобретением, могут быть использованы для целей указанного настоящего изобретения непосредственно и/или могут быть подвергнуты одному или более этапам очистки или (дальнейшим) этапам культивирования. При конкретном осуществлении изобретения ферменты могут быть использованы в чистом виде. Возможные способы приготовления ферментов в соответствии с изобретением включают, кроме прочего, получение или очистку от культур микроорганизмов, рекомбинантных либо нет, во встряхиваемых колбах или в ферментаторах, получение или очистку от иммобилизованных культур, экстракцию и/или очистку из живых клеток (растения и т.п.). В. Применение фермента. Фермент с ксиланолитической активностью по изобретению, очищенный или неочищенный, особенно подходит для использования в качестве агента, улучшающего хлеб. Улучшающими хлеб агентами называются продукты, которые могут улучшить или увеличить текстуру, вкусовые качества, стойкость к заплесневению, мягкость, мягкость мякиша при хранении, свежесть, легкость машинной обработки теста, объем конечного изделия. Предпочтительно данный фермент с ксиланолитической активностью улучшает обработку теста и/или увеличивает удельный объем выпечного продукта. Под определение"выпечной продукт " подпадает любой продукт, изготовленный из теста, в частности выпечное изделие,приготовленное с применением дрожжей. Тесто получают из любого типа муки или муки грубого помола (например, на основе пшеницы, ржи, ячменя, овса или кукурузы). Предпочтительно тесто приготовлено из пшеницы или из смесей, содержащих пшеницу. Одним из аспектов данного изобретения явилось намерение показать, что ферменты, обладающие ксиланолитической активностью, принадлежащие к семейству 8, могут быть с преимуществом использованы для создания композиции, улучшающей хлеб. В дальнейшей реализации данного изобретения показано, что фермент с ксиланолитической активностью, относящийся к гликозид-гидролазам семейства 8, увеличивает объем выпечного продукта. В дальнейшей реализации данного изобретения показано, что количество фермента с ксиланолитической активностью семейства 8, необходимое для получения определенного результата при выпечке,существенно меньше, чем обычно используемое количество имеющихся в продаже ферментов. Дополнительно данное изобретение касается аддитивного эффекта указанного фермента с ксиланолитической активностью при взаимном действии с другими ферментами, в частности с альфа-амилазой,предпочтительно с альфа-амилазой из Aspergillus oryzae. Указанный фермент с ксиланолитической активностью может быть использован в комбинации с другими улучшающими хлеб агентами, такими (но не только такими) как ферменты, эмульгаторы, оксиданты, сухое молоко, жиры, сахара, аминокислоты,соли, белки (глютен, пептиды или полипептиды, являющиеся сайтами связывания целлюлозы). Такие улучшающие агенты хорошо известны специалистам из уровня техники. Примерами ферментов являются, но не ограничивают их, альфа-амилазы, бета-амилазы, мальтогенные амилазы, ксиланазы, протеазы,глюкозооксидазы, оксидоредуктазы, глюканазы, целлюлазы, трансглютаминазы, изомеразы, липазы,фосфолипазы, пектиназы и т.п. Согласно данному изобретению фермент с ксиланолитической активностью может быть использован в нескольких формах. В процессе могут прямо участвовать клетки организмов, в которых проходит экспрессия фермента, таких как дрожжи, грибы, архебактерии или бактерии. Указанный фермент может быть использован в виде клеточного экстракта, бесклеточного экстракта (т.е. частей клеточного материала, прошедших одну или больше стадий разрушения мембран, центрифугирования и/или экстракции) или очищенного белка. Любая из описанных выше форм может быть использована в комбинации с другим ферментом, представленным в любой из описанных выше форм. Указанные клетки, клеточные или бесклеточные экстракты, а также ферменты могут быть смешаны с различными ингредиентами, например с образованием сухого порошка или гранул (в частности, непылящих гранул), с образованием жидкости, например, со стабилизаторами, такими как многоатомные спирты, сахара, органические кислоты,сахароспирты, по известным методам. Примеры Пример 1. Получение ксиланазы из Pseudoalteromonas haloplanktis TAH3a. Ксиланаза из Pseudoalteromonas haloplanktis была получена по описанной методике (Collins et al.,2002, см. выше) из жидкой культуры рекомбинантного штамма Escherichia coli, трансформированного векторной ДНК, содержащей соответствующий ген.-5 011452 Пример 2. Получение ксиланазы из Bacillus halodurans С-125. Штамм бактерий и условия культивирования.Bacillus halodurans С-125 (АТСС ВАА-125) культивировали в щелочной среде для Bacillus (AlkalineBacillus medium) (глюкоза 10 г/л, экстракт дрожжей (Difco) 5 г/л, бактотриптон (Bacto Tryptone) (Difco) 10 г/л, K2HPO4 1 г/л, MgSO4 0,2 г/л, Na2CO3 10 г/л), в которую было добавлено 10 г/л ксилана древесины березы (Sigma), в течение 72 ч при 37 С. После центрифугирования в течение 1 ч при 18000 g и температуре 4 С надосадочную жидкость концентрировали путем преципитации с 80% сульфатом аммония и ресуспендировали в 20 мМ MOPS при рН 8,0. Эта фракция представляет собой неочищенный экстракт,который будет использован при проведении опытных выпечек. Клонирование и избыточная экспрессия гена ксиланазы Y. Геномная ДНК была выделена и очищена из 16-часовых культур, выращенных при 37 С в модифицированной щелочной среде для Bacillus, описанной выше, с набором для очистки геномной ДНКWizard (Promega). Основываясь на опубликованной последовательности (GenBank/GenPept, коллекционный номер АР 001514), ген ксиланазы Y был целиком амплифицирован при помощи ПЦР с использованием полимеразы VENT (Biolabs Inc, Bervely, MA, USA) со смысловым праймером 5'-GGGCATATGAAGAAAACGACAGAAGG TG-3', SEQ ID NO: 1, содержащим сайт Nde I (подчеркнут),и с антисмысловым праймером 5'-GGCTCGAGCTAGTGTTCCTCTTCTTG-3', SEQ ID NO: 2, содержащим сайт Xho I (подчеркнут) и стоп-кодон (выделен курсивом). После 3 мин начальной денатурации при 95 С было проведено 25 циклов амплификации на аппарате Progene (Techne Cambridge, UK). Каждый цикл включал денатурацию при 95 С в течение 1 мин,гибридизацию при 52 С в течение 30 с и элонгацию при 72 С в течение 1,5 мин. Продукт ПЦР был клонирован в вектор PCRSript Amp SK(+) (Stratagene) с использованием процедуры, рекомендованной производителем, и трансформирован в ультракомпетентные клетки EpicurianColi XL10-Gold Kan. Использование метода бело-голубого отбора позволило отобрать белые колонии, несущие ПЦР-фрагмент. Очищенный плазмидный препарат (плазмида Nucleopsin, Macherey-Nagel) секвенировали на секвенаторе ALF (Pharmacia Biotech). Секвенирование вставленного фрагмента было выполнено при помощи универсальных праймеров Т 7 и RP, а также следующих праймеров: 5'-GTGCGGACTGAAGGAATGTC-3' (SEQ ID NO: 3); 5'-GTATGGTCCATCAACAGAGG-3' (SEQ ID NO: 4); 5'-GATGGCACTAAAAACTCCTGG-3' (SEQ ID NO: 5). Полученная последовательность была идентична опубликованной последовательности, которая может быть получена в GenBank/genPept с коллекционным номером АР 001514. Затем ген ксиланазы Y, клонированный в PCRSript Amp SK(+), был вырезан при помощи Nde I иXho I и вшит в клонирующий вектор рЕТ 22b(+) (Novagen). Получившаяся рекомбинантная плазмида была введена в клетки Е.coli BL21 (DE3) (Stratagene). Производство рекомбинантной ксиланазы Y семейства 8 с использованием Bacillus haloduransC-125. 15 мл 5-часовой предварительной культуры (37 С) клеток Е.coli BL21 (DE3), несущих ген ксиланазы, центрифугировали при 10000 g в течение 1 мин и осадок был ресуспендировали в 900 мл бульонаTerrific broth (лактотриптон (Difco) 12 г/л, экстракт дрожжей (Difco) 24 г/л, глицерин 4 мл/л, K2HPO4 12,54 г/л, KH2PO4 2,31 г/л), содержащего 200 мкг/мл ампициллина, в трехлитровой встряхиваемой колбе. Культуру инкубировали при 37 С и 250 об/мин до тех пор, пока не была достигнута оптическая плотность 3-4 при длине волны 550 нм, после чего экспрессию фермента индуцировали 1 мМ изопропил-1 тиогалактопиранозидом. После 15 ч дальнейшей инкубации при 37 С клетки были собраны центрифугированием при 18000 g в течение 30 мин при 4 С, ресуспендированы в 50 мМ BICINE, содержащем 10 мМ NaCl, разрушены в дезинтеграторе с предварительным охлаждением клеток (Constant SystemsLtd., Warwick, UK) при 1968 кг/см 2 (=8 Kpsi) и подвергнуты центрифугированию при 40000 g в течение 30 мин. Производство рекомбинантной ксиланазы семейства 8 из Bacillus halodurans C-125. Клетки 5-часовой предварительной культуры (37 С) Е.coli BL21(DE3), несущие ген ксиланазы, центрифугировали при 10000 g в течение 1 мин и использовали для иннокуляции 5 л (15 мл предварительной культуры на 1 л культуры) среды Terrific broth (бактотриптон (Difco) 12 г/л, экстракт дрожжей(Difco) 24 г/л, глицерин 4 мл/л, K2HPO4 12,54 г/л, KH2PO4 2,31 г/л), содержащей 200 мкг/мл ампициллина. Культуру инкубировали при 37 С и 250 об/мин до тех пор, пока не было достигнуто поглощение 3-4 при длине волны 550 нм, после чего экспрессию фермента индуцировали 1 мМ изопропил-1-тио-галактопиранозидом. После 4 ч дальнейшей инкубации при 37 С клетки были собраны центрифугированием при 18000 g в течение 20 мин при 4 С, ресуспендированы в 20 мМ MOPS (Sigma); предварительно охлажденные клетки были разрушены с использованием дезинтегратора (Constant Systems Ltd.) при 28Kpsi (тыс. фунтов на кв. дюйм) и подвергнуты центрифугированию при 40000 g в течение 30 мин. Хромосомную ДНК удаляли воздействием 0,2% протамин-сульфата (Calbiochem) и центрифугированием при 40000 g в течение 30 мин. Затем добавили 25 единиц бензоназы (Merck, Darmstadt, Германия) и раствор-6 011452 был использован для проведения опытных выпечек. Пример 3. Эффект ксиланазы Pseudoalteromonas haloplanktis TAH3a при выпечке бельгийских твердых рулетов. Опытные выпечки проводились для демонстрации положительного эффекта ксиланазыPseudoalteromonas haloplanktis TAH3a при выпечке. Положительный эффект оценивался по увеличению объема хлеба по сравнению с образцом, не содержащим этот фермент. Эффект ксиланазы тестировали на выпечке бельгийских твердых рулетов, которые каждый день производятся в Бельгии в большом количестве. Описанная процедура хорошо известна хлебопекам, и специалистам очевидно, что такие же результаты могут быть получены с использованием оборудования других поставщиков. Использованные ингредиенты приведены в табл. 1. Таблица 1(1) Под одной единицей ксиланазы Pseudoalteromonas haloplanktis понимается количество фермента, необходимое для высвобождения 1 мкмоля редуцирующего сахара(выраженного через ксилозу) из ксилана древесины березы при 30 С и рН 4,5 (способ Нельсона-Сомогуи). Ингредиенты смешивали в течение 2 мин на низкой, а затем в течение 8 мин на высокой скорости в миксере Diosna SP24. Окончательная температура теста, также как и температура его выдерживания и поднятия, составляла 25 С. После 15-минутного выдерживания при 25 С тесто было замешено вручную,после чего последовал еще один 10-минутный период выдерживания. Затем тесто разделывали на порции весом по 2 кг и оставляли для поднятия в течение 10 мин. После этого двухкилограммовые куски теста разделяли и обрабатывали в машине Eberhardt Optimat. Были получены 66-граммовые округлые заготовки. После еще одного 5-минутного периода выдерживания порции теста отсекали надавливанием и осуществляли последний этап нанесения защитного покрытия в течение 70 мин. Порции теста выпекали при 230 С в печи MIWE Condo с паром (Michael Wenz-Arnstein, Германия). Объем 6 рулетов измеряли при помощи широко используемого метода вытеснения рапсового семени (rapeseed displacement Графически эффект ксиланазы показан на фиг. 1. Эти результаты показывают, что ксиланаза Pseudoalteromonas haloplanktis оказывает положительный эффект на объем хлеба. Пример 4. Сравнение количеств ксиланазы, используемой при выпечке. Относительное количество ксиланазы, необходимое для достижения такого же эффекта на объем бельгийских твердых рулетов, в дополнение к опыту, описанному в примере 3, оценивали при помощи электрофореза с додецилсульфатом натрия (SDS) в полиакриламидном геле.-7 011452 Были протестированы следующие ксиланазы и при выпечке были использованы следующие их количества: ксиланаза из Pseudoalteromonas haloplanktis TAH3a (30 единиц Р.haloplanktis/100 кг муки); ксиланаза из Bacillus subtilis (Belase B210 (BELDEM S.A., Бельгия) - 3 г/100 кг муки). Фермент в количествах, необходимых для обработки 0,333 и 0,166 кг муки, внесение которых приводит к одинаковому увеличению объема, загружали в доступный в готовом виде 12% Трис-HCl гель для электрофореза в полиакриламидном геле с додецилсульфатом натрия "Ready Gel" (BIO-RAD, Hercules,CA, USA) и электрофорез проводили в аппарате "Mini Protean II" (BIO-RAD) в соответствии с процедурой, описанной в руководстве по эксплуатации. Белки окрашивали при помощи красителя Кумассиголубого с использованием стандартной методики. Изображение окрашенного геля приведено на фиг. 2. Информация, представленная на этой фигуре, позволяет заключить, что количество ксиланазы изPseudoalteromonas haloplanktis TAH3a, требуемое при выпечке, существенно меньше по сравнению со второй ксиланазой. Пример 5. Эффект применения ксиланазы Pseudoalteromonas haloplanktis TAH3a при выпечке Аргентинского хлеба. Опытные выпечки проводили с целью демонстрации положительного влияния ксиланаз семейства 8 при выпечке по рецепту, отличающемуся от рецепта, приведенного в примере 3, например по рецепту изготовления Аргентинского хлеба. Положительный эффект оценивали по увеличению объема хлеба в сравнении с образцом, не содержащим этого фермента, а также по ширине разреза на поверхности хлеба. Ферменты по изобретению проверяли на Аргентинском хлебе, который является типичным длинным хлебом, для теста которого необходимо большое время поднятия (17 ч при 20 С). Описанная процедура хорошо известна хлебопекам, и специалистам очевидно, что такие же результаты могут быть получены с использованием оборудования от других поставщиков. Использованные ингредиенты приведены ниже в табл. 3. Таблица 3(1) Использовавшееся стандартное улучшающее средство содержит: грибковую альфа-амилазу (Fungamyl 75.000, Novozymes) - 1 г/100 кг муки, витамин С - 10 г,азодикарбонамид - 2 г/100 кг муки. Это пример стандартного улучшающего средства. Абсолютные и относительные количества добавок могут различаться в зависимости от местной специфики использования пшеничной муки и процесса.(2) Под одной единицей ксиланазы Pseudoalteromonas haloplanktis понимается количество фермента, необходимое для высвобождения 1 мкмоль редуцирующего сахара (выраженного через ксилозу) из ксилана древесины березы при 30 С и рН 4,5 (способ Нельсона-Сомогуи). Ингредиенты смешивали в течение 2 мин при низкой и 7 мин при высокой скорости в смесителеDiosna SP24. Окончательная температура теста во время выдержки составляла 25 С, в то время как во время поднятия теста она составляла 20 С. После выдерживания теста при 25 С в течение 20 мин его замешивали вручную и оставляли в покое на 17 ч при 20 С для поднятия. Затем тесто разделяли на порции весом 2 кг и оставляли на 10 мин для окончательного поднятия. Порции теста весом по 0,35 кг готовили при помощи машины Bertrand R8/L8 (30 см) и оставляли в покое для окончательного поднятия на 17 ч. Порции теста выпекали при 210 С в течение 30 мин в печи MIWE Condo с паром (MichaelWenz-Arnstein, Германия). Объем Аргентинских хлебов измеряли при помощи широко используемого-8 011452 метода вытеснения рапсового семени (rapeseed displacement method). Результаты показаны в табл. 4. Таблица 4 Эти результаты показывают, что ксиланаза семейства 8 оказывает положительное эффект на изготовление хлеба, на поднятие которого требуется длительное время при более низких температурах (т.е. 20 С). Количество промышленно выпускаемого фермента (Bel'ase B210, см. выше), использованного здесь, в три раза превышает оптимальную дозу, требовавшуюся в описанном выше примере 3 при приготовлении бельгийских твердых рулетов, в то время как требуемое количество ксиланазы семейства 8 осталось неизменным. Также существует разница между концентрацией фермента, требуемой для оптимизации ширины разреза, и концентрацией фермента, требуемой для оптимального увеличения объема. Пример 6. Эффект различных ферментов по изобретению в сравнении с влиянием других ферментов, используемых при выпечке. Опытные выпечки проводили для демонстрации положительного эффекта различных ферментов при выпечке, обладающих ксиланолитической активностью, принадлежащих к гликозид-гидролазам семейства 8. Положительное влияние оценивали по увеличению объема хлеба по сравнению с образцом, не содержащим этих ферментов, а также по сравнению с хлебом, приготовленным с использованием имеющегося в продаже ферментного препарата (Bel'ase B210, см. выше). Ксиланаза из Pseudoalteromonas haloplanktis TAH3a была получена и очищена так, как это описано в примере 1. Ксиланаза Y из Bacillus subtilis C-125 была приготовлена из рекомбинантного штаммаEscherichia coli так, как это описано в примере 2. Способ, использованный для оценки действия двух ферментов, представлял собой мини-тест выпекания с приготовлением теста из 100 г муки. Описанная процедура хорошо известна специалистам, и очевидно, что такие же результаты могут быть получены с использованием оборудования других поставщиков. Список использованных ингредиентов приведен в табл. 5. Таблица 5(1) Под одной единицей ксиланазы понимается количество фермента, необходимое для высвобождения 1 мкмоль редуцирующего сахара (выраженного через ксилозу) из ксилана древесины березы при 30 С и рН 4,5-9 011452 Ингредиенты смешивали в течение 4,5 мин в миксере National. Тесто отвешивали порциями по 150 г и оставляли в покое на 20 мин в пластиковых коробках при 25 С. Затем тесто было вымешано и снова оставлено на 20 мин. Окончательное время подхода составило 50 мин при 36 С. Порции теста выпекали при 225 С в течение 20 мин. Объем выпечки измеряли при помощи широко используемого метода вытеснения рапсового семени. Результаты представлены в табл. 6. Таблица 6 Эти результаты показывают, что положительный эффект ферментов по данному изобретению не ограничивается лишь ксиланазой Pseudoalteromonas haloplanktis TAH3a. Препараты других ферментов,обладающих ксиланолитической активностью и принадлежащих к гликозид-гидролазам семейства 8,также могут улучшить свойства хлеба (здесь продемонстрированы результаты только для ксиланазы Bacillus subtilis C-125, тогда как другие результаты не показаны). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ приготовления выпечного продукта, включающий в себя стадию добавления в тесто указанного выпечного продукта улучшающей хлеб композиции, содержащей по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозидгидролаз. 2. Способ по п.1, где указанным ферментом является ксиланаза, полученная из штаммаPseudoalteromonas haloplanktis. 3. Способ по п.2, где указанным штаммом Pseudoalteromonas haloplanktis является Pseudoalteromonas haloplanktis TAH3a. 4. Способ по п.1, где указанным ферментом является ксиланаза, полученная из штамма Bacillushalodurans. 5. Способ по п.4, где указанным штаммом Bacillus halodurans является Bacillus halodurans C-125. 6. Способ по любому из пп.1-5, где указанную улучшающую хлеб композицию добавляют в ходе замешивания теста. 7. Способ по любому из пп.1-6, где указанная улучшающая хлеб композиция дополнительно содержит другой агент, улучшающий хлеб, выбранный из группы, состоящей из других ферментов, эмульгаторов, оксидантов, сухого молока, жиров, сахаров, аминокислот, солей, белков (глютена, пептидов или полипептидов, являющихся сайтами связывания целлюлозы) или их смесей. 8. Способ по п.7, где указанный другой фермент выбран из группы, состоящей из альфа-амилаз, бета-амилаз, мальтогенных амилаз, других ксиланаз, протеаз, глюкозооксидаз, оксидоредуктаз, глюканаз,целлюлаз, трансглютаминаз, изомераз, липаз, фосфолипаз, пектиназ или их смесей. 9. Способ по п.8, где указанная альфа-амилаза является альфа-амилазой, полученной из Aspergillusoryzae. 10. Способ по любому из пп.1-9, где указанный фермент с ксиланолитической активностью представлен в виде клеточного экстракта, бесклеточного экстракта или в виде очищенного белка. 11. Способ по любому из пп.1-10, где указанный фермент с ксиланолитической активностью смешан с другими ингредиентами в форме сухого порошка или гранул (в частности, непылящих гранул) или в форме жидкости, предпочтительно содержащей один или более чем один стабилизатор, такой как многоатомные спирты, сахара, органические кислоты или сахароспирты. 12. Выпечной продукт, получаемый способом по любому из пп.1-11. 13. Выпечной продукт по п.12, который представляет собой Аргентинский хлеб с увеличенной шириной разреза. 14. Способ увеличения объема выпечного продукта, включающий в себя стадию добавления в тесто выпекаемого продукта во время его замешивания достаточного количества фермента, обладающего ксиланолитической активностью, выбранного из группы, состоящей из ксиланаз семейства 8 гликозидгидролаз. 15. Способ увеличения ширины разреза на поверхности выпечного продукта, включающий в себя стадию добавления в тесто указанного выпекаемого продукта во время его замешивания, достаточного количества фермента, обладающего ксиланолитической активностью, выбранного из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз. 16. Композиция для увеличения объема выпечного продукта, отличающаяся тем, что она содержит по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз. 17. Композиция для увеличения ширины разреза на поверхности выпеченного продукта, отличающаяся тем, что она содержит по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз. 18. Композиция по п.17, отличающаяся тем, что она дополнительно содержит по крайней мере один агент, улучшающий хлеб, выбранный из группы, состоящей из других ферментов, эмульгаторов, оксидантов, сухого молока, жиров, сахаров, аминокислот, солей, белков (глютена, пептидов или полипептидов, являющихся сайтами связывания целлюлозы) или их смесей. 19. Композиция по п.18, где указанный другой фермент выбран из группы, состоящей из альфаамилаз, бета-амилаз, мальтогенных амилаз, других ксиланаз, протеаз, глюкозооксидаз, оксидоредуктаз,глюканаз, целлюлаз, трансглютаминаз, изомераз, липаз, фосфолипаз, пектиназ или их смесей. 20. Композиция по п.19, где указанная альфа-амилаза является альфа-амилазой, полученной изAspergillus oryzae. 21. Композиция для увеличения легкости механической обработки и повышения стабильности теста, отличающаяся тем, что она содержит по крайней мере один фермент с ксиланолитической активностью, выбранный из группы, состоящей из ксиланаз семейства 8 гликозид-гидролаз. 22. Композиция по любому из пп.16-21, где указанный фермент является ксиланазой, полученной из штамма Pseudoalteromonas haloplanktis.- 17011452 23. Композиция по п.22, где указанным штаммом Pseudoalteromonas haloplanktis являетсяPseudoalteromonas haloplanktis TAH3a. 24. Композиция по любому из пп.16-22, где указанный фермент является ксиланазой, полученной из штамма Bacillus halodurans. 25. Композиция по п.24, где указанным штаммом Bacillus halodurans является Bacillus halodurans
МПК / Метки
МПК: A21D 2/26, A21D 8/04, C12N 9/24
Метки: продукта, выпечной, композиции, способы, этого, продукт, используемые, приготовления, выпечного
Код ссылки
<a href="https://eas.patents.su/20-11452-sposoby-prigotovleniya-vypechnogo-produkta-ispolzuemye-dlya-etogo-kompozicii-i-vypechnojj-produkt.html" rel="bookmark" title="База патентов Евразийского Союза">Способы приготовления выпечного продукта, используемые для этого композиции и выпечной продукт</a>
Предыдущий патент: Новая соль сукцинат о-десметилвенлафаксина
Следующий патент: Защитные вещества на основе производных ароматически-алифатических карбоновых кислот
Случайный патент: Устройство регулирования давления для контейнера