Замещенный циклопропиламин в качестве ингибитора lsd1
Номер патента: 23143
Опубликовано: 29.04.2016
Авторы: Каспарек Иржи, Миллер Уилльям Генри, Суарес Доминик, Роуз Миган Б., Джонсон Нейл В., Тянь Синьжун
Формула / Реферат
1. Соединение, представляющее собой 4-((4-((((1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойную кислоту формулы
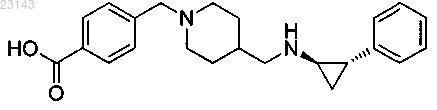
или его фармацевтически приемлемая соль.
2. Соединение, представляющее собой 4-((4-((((1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойную кислоту формулы
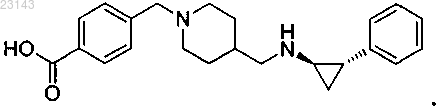
3. Фармацевтическая композиция для лечения рака, содержащая соединение или его фармацевтически приемлемую соль по п.1 и фармацевтически приемлемый эксципиент.
4. Фармацевтическая композиция для лечения рака, содержащая соединение по п.2 и фармацевтически приемлемый эксципиент.
Текст
или его фармацевтически приемлемой соли, которые применяются для модуляции, в частности,ингибирования активности Лизин-специфической деметилазы 1(LSD1), что определяет их применение для лечения рака.(71)(73) Заявитель и патентовладелец: ГЛЭКСОСМИТКЛАЙН ИНТЕЛЛЕКЧУАЛ ПРОПЕРТИ (NO.2) ЛИМИТЕД (GB) Область изобретения Изобретение относится к новому замещенному циклопропиламину и его фармацевтически приемлемой соли, которые являются ингибиторами Лизин-специфической деметилазы 1 (LSD1; также известной как ВНС 110), к содержащим их фармацевтическим композициям, и к их применению в терапии для лечения рака. Предпосылки создания изобретения Модификация хроматина играет существенную роль в регуляции транскрипции (Т. Kouzarides,2007, Cell 128: 693-705). Регуляция этих модификаций, которые включают метилирование ДНК, ацетилирование гистона и метилирование гистона, нарушается в опухоли. Эта нарушенная эпигенетическая регуляция играет важную роль в сайленсинге супрессоров опухоли и гиперэкспрессии онкогенов при раке (М. Esteller, 2008, N Engl J Med 358: 1148-59. P. Chi et al, 2010, Nat Rev Cane 10:457-469.). Ферменты,которые регулируют метилирование гистона, представляют собой гистон-метилтрансферазы и гистондеметилазы. Лизин-специфическая деметилаза 1 (LSD1; также известная как ВНС 110) представляет собой гистон-лизиндеметилазу, которая, согласно сообщениям, деметилирует H3K4me1/2 (Y. Shi et al, 2004, Cell 119: 941-953) и H3K9me1/2 (R. Schule et al.,2005, Nature 437: 436-439). LSD1 чрезмерно экспрессируется во многих типах рака человека, включая рак предстательной железы, где он ассоциируется с наиболее частыми рецидивами (P. Kahl et al, 2006, Cane. Res. 66: 11341-11347), молочной железы (J. Kirfel et al,2010, Carcinogenesis 31: 512-520), нейробластому (J. Kirfel et al, 2009, Cane. Res. 69: 2065-2071. G. Sun etal, 2010, Mol. Cell. Biol. 28: 1997-2000). LSD1 является существенным для регуляции транскрипции, опосредованной несколькими ядерными рецепторами гормонов, включая рецептор андрогена в раке предстательной железы (R. Schuele et al, 2005, Nature 437: 436-439. R. Schuele et al, 2007, Nat. Cell Biol. 9: 347353. R. Schuele et al, 2010, Nature 464: 792-796), рецептор эстрогена в карциномах молочной железыCell. Biol. 28: 3995-4003). Эти исследования показали, что "нокдаун" экспрессии LSD1 приводит к снижению пролиферации раковых клеток. Кроме того, LSD1 чрезмерно экспрессируется во многих типах рака, которые являются независимыми от ядерного рецептора гормона. Такие опухоли включают ERотрицательную опухоль молочной железы (J. Kirfel et al, 2010, Carcinogenesis 31: 512-520), мелкоклеточный рак легкого, мочевого пузыря, головы и шеи, толстой кишки, серозную опухоль яичника и почечную опухоль Вильмса. Поэтому сильные селективные малые молекулы-ингибиторы LSD1 могут быть полезны для лечения типов рака, которые являются зависимыми от ядерного рецептора гормона и/или независимыми от ядерного рецептора гормона. Композиции и способы, представленные в настоящей заявке, потенциально могут быть полезными для лечения рака, включая опухоли, такие как опухоли кожи, молочной железы, головного мозга, цервикальные карциномы, тестикулярные карциномы и т.п. Более конкретно, типы рака, которые можно лечить композициями и способами по настоящему изобретению, включают, но не ограничиваются этим,такие типы опухолей, как астроцитные, молочной железы, цервикальные, колоректальные, эндометриальные, эзофагеальные, гастральные, головы и шеи, гепатоцеллюлярные, ларингеальные, легочные,оральные, яичников, предстательной железы и щитовидной железы карциномы и саркомы. Более конкретно, эти соединения потенциально могут быть полезными для лечения опухолей: сердечных: саркома(ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома), миксома, рабдомиома, фиброма, липома и тератома; легкого: бронхиогенная карцинома (сквамозноклеточная, недифференцированная мелкоклеточная, недифференцированная крупноклеточная, аденокарцинома), альвеолярная (бронхиолярная) карцинома, бронхиальная аденома, саркома, лимфома, хондроматозная гамартома, мезотелиома; желудочнокишечных: пищевода (сквамозноклеточная карцинома, аденокарцинома, лейомиосаркома, лимфома),желудка (карцинома, лимфома, лейомиосаркома), поджелудочной железы (дуктальная аденокарцинома,инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома), тонкой кишки (аденокарцинома, лимфома, карциноидные опухоли, саркома Капоши, лейомиома, гемангиома, липома, нейрофиброма,фиброма), толстой кишки (аденокарцинома, тубулярная аденома, ворсинчатая аденома, гамартома, лейомиома); мочеполовых путей: почки (аденокарцинома, опухоль Вильмса (нефробластома), лимфома, лейкоз), мочевого пузыря и уретры (сквамозноклеточная карцинома, переходно-клеточная карцинома, аденокарцинома), предстательной железы (аденокарцинома, саркома), мужских половых желез (семинома,тератома, эмбриональная карцинома, тератокарцинома, хондриокарцинома, саркома, интерстициальноклеточная карцинома, фиброма, фиброаденома, аденоматоидные опухоли, липома); печени: гепатома(гепатоцеллюлярная карцинома), холангиокарцинома, гепатобластома, ангиосаркома, гепатоцеллюлярная аденома, гемангиома; Кости: остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброгистиоцитома, хондросаркома, саркома Эвинга, злокачественная лимфома (ретикулярно-клеточная саркома), множественная миелома, злокачественная гигантоклеточная опухоль хордома, остеохронфрома(костно-хрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксофиброма,остеоид-остеома и гигантоклеточные опухоли; нервной системы: черепа (остеома, гемангиома, гранулема, ксантома, деформирующий остоз), мягких мозговых оболочек (менингиома, менингиосаркома, глиоматоз), головного мозга (астроцитома, медуллобластома, глиома, эпендиома, герминома (пинеалома),-1 023143 мультиформная глиобластома, олигодендроглиома, шваннома, ретинобластома, врожденные опухоли),нейрофиброма, менингиома, глиома, саркома спинного мозга); гинекологических: матки (эндометриальная карцинома), шейки матки (цервикальная карцинома, предопухолевая цервикальная дисплазия), яичников (карцинома яичников (серозная цистаденокарцинома, мукоидная цистаденокарцинома, неклассифицированная карцинома), гранулезо-текалклеточные опухоли, Сертоли-Лейдига-клеточные опухоли,дисгерминома, злокачественная тератома), вульвы (сквамозноклеточная карцинома, интраэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалища (родоначально-клеточная карцинома,сквамозноклеточная карцинома, ботриоидная саркома (эмбриональная рабдомиосаркома), фаллопиевых труб (карцинома); гематологических: крови (миелогенный лейкоз (острый и хронический), острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, миелопролиферативные заболевания, множественная миелома, миелодиспластический синдром), болезнь Ходжкина, неходжкинская лимфома (злокачественная лимфома); кожи: злокачественная меланома, базальноклеточная карцинома, сквамозноклеточная карцинома, саркома Капоши, синдромы диспластического невуса, липома, ангиома, дерматофиброма, келоиды, псориаз; и надпочечников: нейробластома. Таким образом, термин "раковая клетка", используемый в настоящей заявке, включает клетку, пораженную любым из указанных выше, или родственных, состояний. Краткое описание изобретения Настоящее изобретение относится к соединению, представляющему собой 4-4-1R,2S)-2 фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойную кислоту формулы или его фармацевтически приемлемой соли. Настоящее изобретение также относится конкретно к 4-4-1R,2S)-2-фенилциклопропил)амино) метил)пиперидин-1-ил)метил)бензойной кислоте формулы Настоящее изобретение также относится к фармацевтическим композициям для лечения рака, содержащим указанное соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент. Подробное описание изобретения Настоящее изобретение относится к 4-4-1R,2S)-2-фенилциклопропил)амино)метил)пиперидин 1-ил)метил)бензойной кислоте формулы или его фармацевтически приемлемой соли. Фармацевтически приемлемые соли относятся к нетоксичным солям соединения по настоящему изобретению. Соли соединения по настоящему изобретению могут включать кислотно-аддитивные соли. Как правило, соли получают из фармацевтически приемлемых неорганических и органических кислот. Более конкретные примеры подходящих кислотных солей включают соли малеиновой, хлористоводородной, бромисто-водородной, серной, фосфорной, азотной, перхлорной, фумаровой, уксусной,пропионовой, янтарной, гликолевой, муравьиной, молочной, алеиновой, винной, лимонной, пальмовой,малоновой, гидроксималеиновой, фенилуксусной, глутаминовой, бензойной, салициловой, фумаровой,толуолсульфоновой, метансульфоновой (мезилат), нафталин-2-сульфоновой, бензолсульфоновой, гидроксинафтойная, иодисто-водородной, яблочной, тероевой, дубильной кислоты и т.п. Другие репрезентативные соли включают ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, эдетат кальция, камсилат, карбонат, клавуланат, цитрат, дигидрохлорид, эдисилат,эстолат, эсилат, фумарат, глуцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изетионат, лактат, лактобионат, лаурат, малат, малеат,манделат, мезилат, метилсульфат, монокалий малеат, муцинат, напсилат, нитрат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат, тозилат, триетиодид и валерат. Изобретение, кроме того, обеспечивает фармацевтическую композицию (также указанную как фармацевтический состав), содержащую соединение по излобретению или его фармацевтически приемлемую соль, и один или несколько эксципиентов (также называемые в фармацевтике носителями и/или разбавителями). Эксципиенты являются приемлемыми в том смысле, что они являются совместимыми сдругими ингредиентами композиции и не являются вредными для реципиента (т.е. пациента). Способ получения фармацевтической композиции включает смешивание (или объединение) соединения по настоящему изобретению или его фармацевтически приемлемой соли с по меньшей мере одним эксципиентом. Фармацевтические композиции Фармацевтические композиции могут быть в единичной дозированной форме, содержащей предварительно определенное количество активного ингредиента на единичную дозу. Такая единичная доза может содержать терапевтически эффективную дозу соединения по изобретению или его фармацевтически приемлемой соли, или часть терапевтически эффективной дозы, так чтобы множественные единичные дозированные формы можно было вводить через определенное время для достижения желаемой терапевтически эффективной дозы. Предпочтительные композиции, содержащие единичные дозы, представляют собой такие, которые содержат суточную дозу или суб-дозу, указанные в настоящей заявке выше, или их соответствующую часть, активного ингредиента. Кроме того, такие фармацевтические композиции можно получить любым способом, хорошо известным в фармацевтике. Фармацевтические композиции могут быть адаптированы для введения любым подходящим путем,например, пероральным (включая буккальный или сублингвальным), ректальным, назальным, местным(включая буккальный, сублингвальный или чрескожный), вагинальным или парентеральным (включая подкожный, внутримышечный, внутривенный или внутрикожный) путем. Такие композиции можно получить любым способом, известным в фармацевтике, например, путем приведения активного ингредиента в ассоциацию с эксципиентом(эксципиентами). Когда они адаптированы для перорального введения, фармацевтические композиции могут быть в виде дискретных единиц, таких как таблетки или капсулы; порошков или гранул; растворов или суспензий в водных или неводных жидкостях; пищевых пенообразных продуктов или взбитых масс; жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Соединение или его фармацевтически приемлемая соль по настоящему изобретению или фармацевтическая композиция по настоящему изобретению также могут быть включены в композиции леденцов, накладываемых на язык пластинок и/или полосок для введения в виде "быстрорастворимого" лекарственного средства. Например, для перорального введения в форме таблетки или капсулы, активный лекарственный компонент можно объединить с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Порошки или гранулы получают путем измельчения соединения до подходящих тонкодисперсных частиц и смешивания с подобным образом измельченным фармацевтическим носителем, таким как пищевой углевод, например, крахмал или маннит. Также могут присутствовать отдушки, консерванты, диспергирующие вещества и красители. Капсулы изготавливают путем получения порошкообразной смеси, как описано выше, и заключения ее в сформированные желатиновые или не-желатиновые оболочки. Агенты скольжения и лубриканты, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция, твердый полиэтиленгликоль, могут быть добавлены к порошкообразной смеси перед процедурой заключения ее в капсулы. Дезинтегрирующие или солюбилизирующие вещества, такие как агар-агар, карбонат кальция или карбонат натрия, также могут быть добавлены для улучшения доступности лекарственного средства при приеме капсул. Кроме того, когда это является желательным или необходимым, подходящие связующие, лубриканты, дезинтегртрующие агенты и красители также могут быть включены в смесь. Подходящие связующие включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические смолы, такие как аравийская камедь, трагакант, альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и т.п. Лубриканты, используемые в этих дозированных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтегранты включают, без ограничения, крахмал, метилцеллюлозу, агар,бентонит, ксантановую камедь и т.п. Получение таблеток включает, например, получение порошкообразной смеси, гранулирование или комкование зерен, добавление лубриканта и дезинтегранта и прессование в таблетки. Порошкообразную смесь получают путем смешивания соединения, соответственно измельченного, с разбавителем или основой, как описано выше, и необязательно со связующим, таким как карбоксиметилцеллюлоза и альгинат, желатин или поливинилпирролидон, веществом, замедляющим растворение, таким как парафин,ускорителем всасывания, таким как четвертичная соль, и/или агентом абсорбции, таким как бентонит,каолин или дикальций фосфат. Порошкообразную смесь можно гранулировать путем смачивания связующего, такого как сироп, крахмальная паста, клейкое вещество из акации или растворы целлюлозных или полимерных веществ, и пропуская через сито. В качестве альтернативы гранулированию, порошкообразную смесь можно пропустить через машину для таблетирования, и в результате неправильно сформированные комочки разбиваются на гранулы. Гранулы можно смазать для предотвращения их прилипания к таблетировочному прессу путем добавления стеариновой кислоты, стеаратной соли, талька или минерального масла. Смазанную смесь затем прессуют в таблетки. Соединение или соль по настоящему изобретению также можно объединить со свободно текущим инертным носителем и прессовать в таблетки непосредственно, без использования стадий гранулирования или комкования зерен. Может быть обеспечено светлое непрозрачное защитное покрытие, состоящее из изолирующей прослойки из шеллака, покрытия из сахара или полимерных веществ и глянцевого покрытия из воска. К этим покрытиям можно добавить красители, чтобы пометить разные дозы. Пероральные жидкости, такие как растворы, сиропы и эликсиры, можно получить в единичной дозированной форме, чтобы данное количество содержало предварительно определенное количество активного ингредиента. Сиропы можно получить путем растворения соединения или его соли по настоящему изобретению в соответствующим образом ароматизированном водном растворе, тогда как эликсиры получают путем использования нетоксичного спиртового носителя. Суспензии можно получить путем диспергирования соединения или соли по настоящему изобретению в нетоксичном носителе. Солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и эфиры полиоксиэтиленсорбита, консерванты, отдушки, такие как масло перечной мяты, природные подсластители, сахарин или другие искусственные подсластители, и подобные вещества также могут быть добавлены. Если это является подходящим, композиции единичных доз для перорального введения могут быть микроинкапсулированными. Композицию также можно получить для пролонгирования или замедления высвобождения, например, с использованием покрытия или заключения мелких частиц вещества в оболочки из полимеров, воска или т.п. В настоящем изобретении, таблетки и капсулы являются предпочтительными для доставки фармацевтической композиции. Как используется в настоящей заявке, термин "лечение" включает профилактику и относится к облегчению указанного состояния, устранению или уменьшению тяжести одного или нескольких симптомов состояния, замедлению или устранению прогрессирования состояния и профилактике или отсрочке рецидива состояния у пациента или субъекта, у которого ранее имело место или было диагностировано такое состояние. Профилактику (или предотвращение или отсрочку начала развития заболевания) типично осуществляют путем введения лекарственного средства таким же или подобным образом, как пациенту, у которого происходит развитие заболевания или состояния. Настоящее изобретение обеспечивает потенциальное лечение млекопитающего, в частности, человека, страдающего от болезненных состояний, которые являются мишенью для соединения по настоящему изобретению. Такое лечение включает стадию введения терапевтически эффективного количества соединения настоящего изобретения или его фармацевтически приемлемой соли в составе фармацевтической композиции указанному млекопитающему, в частности человеку. Как используется в настоящей заявке, термин "эффективное количество" означает такое количество лекарственного средства или фармацевтического средства, которое будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, которого добивается, например, исследователь или клиницист. Термин "терапевтически эффективное количество" означает любое количество, которое, по сравнению с соответствующим субъектом, который не принимал такое количество, приводит к улучшенному лечению, заживлению, профилактике или уменьшению интенсивности симптомов заболевания, расстройства или побочного эффекта, или снижению скорости развития заболевания или расстройства. Термин также охватывает количества, эффективные для усиления нормальной физиологической функции. Для применения в терапии, терапевтически эффективные количества соединения настоящего изобретения, а также его фармацевтически приемлемых солей можно вводить отдельно в виде химического вещества. Кроме того, активный ингредиент может быть представлен в виде фармацевтической композиции. Хотя при применении в терапии возможно отдельное введение терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли в виде химического вещества, типично оно представлено в виде активного ингредиента фармацевтической композиции или состава. Точное терапевтически эффективное количество соединения или его фармацевтически приемлемой соли по настоящему изобретению зависит от различных факторов, включая, но не ограничиваясь этим,возраст и массу тела субъекта (пациента), подлежащего лечению, конкретное расстройство, требующее лечения, и его тяжесть, природу фармацевтической композиции/состава и путь введения, и, в конечном счете, зависит от суждения лечащего врача или ветеринара. Типично, соединение по настоящему изобретению или его фармацевтически приемлемую соль применяют для лечения в пределах от около 0,01 до 100 мг/кг массы тела реципиента (пациента, млекопитающего) в день, и более типично в пределах от 0,1 до 10 мг/кг массы тела в день. Приемлемые суточные дозы могут составлять от около 1 до около 1000 мг/день, и предпочтительно от около от 1 до около 100 мг/день. Это количество можно вводить в виде разовой суточной дозы или в виде нескольких (например, двух, трех, четырех, пяти или более) дробных доз в течение дня, чтобы общая суточная доза была такой же. Эффективное количество фармацевтически приемлемой соли соединения можно определить в виде пропорции эффективного количества соединения по настоящему изобретению per se. Подобные дозы должны быть подходящими для лечения (включая профилактику) других состояний, которые описаны в настоящей заявке как подлежащие лечению. Как правило, определение подходящих для введения доз может легко определить специалист в области медицины или фармацевтики. Комбинации Когда соединение по настоящему изобртению вводят для лечения рака, термин "совместное введение" и его производные, как используется в настоящей заявке, означает либо одновременное введение,либо любой способ раздельного последовательного введения ингибирующего LSD1 соединения, описан-4 023143 ного в настоящей заявке, и дополнительного активного ингредиента или ингредиентов, известных как полезные для лечения рака, включая химиотерапию и лучевую терапию. Термин "дополнительный активный ингредиент или ингредиенты", как он используется в настоящей заявке, включает любое соединение или терапевтическое средство, известное как имеющее, или которое демонстрирует, полезные свойства при введении пациенту, нуждающемуся в лечении рака. Предпочтительно, если введение не является одновременным, соединения вводят с очень небольшим интервалом времени между введением каждого из них. Кроме того, не имеет значения в одной и той же лекарственной форме вводят соединения или нет, например, одно соединение можно вводить местным путем, а другое соединение можно вводить перорально. Типично, любое противоопухолевое средство, которое обладает активностью против чувствительной к лечению опухоли, подлежащей лечению, можно использовать в настоящем изобретении для совместного введения для лечения рака. Примеры таких средств можно найти в Cancer Principles and Practice f Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott WilliamsWilkins Publishers. Специалисту в данной области должно быть понятно, какие комбинации средств будут полезными, на основании конкретных характеристик лекарственных средств и конретного типа рака. Типичные противоопухолевые средства, полезные в настоящем изобретении, включают, но не ограничиваются этим, средства против микротрубочек, такие как дитерпеноиды и алкалоиды барвинка; платиновые координационные комплексы; алкилирующие средства, такие как азотные иприты, оксазафосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотики, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты,такие как пуриновые и пиримидиновые аналоги и антифолатные соединения; ингибиторы топоизомеразыI, такие как камптотецины; гормоны и гормональные аналоги; ингибиторы пути сигнальной трансдукции; ингибиторы связанных с ангиогенезом нерецепторных тирозинкиназ; иммунотерапевтические средства; проапоптические средства; и ингибиторы передачи сигналов клеточного цикла. Примерами дополнительного активного ингредиента или ингредиентов для применения в комбинации или для совместного введения с ингибирующим LSD1 соединением по настоящему изобретению являются химиотерапевтические средства. Средства против микротрубочек или антимитотические средства представляют собой фазаспецифические средства, активные против микротрубочек опухолевых клеток в фазе М или митоза клеточного цикла. Примеры средств против микротрубочек включают, но не ограничиваются этим, дитерпеноиды и алкалоиды барвинка. Дитерпеноиды, которые выделяют из природных источников, являются фаза-специфическими противораковыми средствами, которые действуют в G2/M фазах клеточного цикла. Считается, что дитерпеноиды стабилизируют -тубулиновую субъединицу микротрубочек путем связывания с этим белком. Затем оказывается, что разупорядочение структуры белка ингибируется, при этом митоз останавливается и следует клеточная гибель. Примеры дитерпеноидов включают, но не ограничиваются этим, паклитаксел и его аналог доцетаксел. Паклитаксел, 5,20-эпокси-1,2,4,7,10,13-гекса-гидрокситакс-11-ен-9-он 4,10-диацетат 2 бензоат 13-эфир с (2R,3S)-N-бензоил-3-фенилизосерином; представляет собой природный дитерпеновый продукт, выделенный из тихоокеанского тисового дерева Taxus brevifolia, и является коммерчески доступным в виде раствора для инъекций TAXOL. Он является членом таксанового семейства терпенов. Он был изначально выделен в 1971 году, Wani et al. J. Am. Chem, Soc, 93:2325. 1971), где его структура была охарактеризована химическими методами и методами рентгеновской кристаллографии. Один механизм его активности относится к способности паклитаксела связываться с тубулином с ингибированием,таким образом, роста раковых клеток. Schiff et al, Proc. Natl. Acad. Sci. USA, 77: 1561-1565 (1980); Schiffet al, Nature, 277:665-667 (1979); Kumar, J. Biol, Chem, 256: 10435-10441 (1981). Обзор синтеза и противораковой активности некоторых производных паклитаксела см.: D. G. I. Kingston et al., Studies in OrganicQuesne, Eds. (Elsevier, Amsterdam, 1986) pp. 219-235. Паклитаксел одобрен для клинического применения для лечения резистентного рака яичников в США (Markman et al., Yale Journal of Biology и Medicine, 64:583, 1991; McGuire et al, Ann. Intern, Med.,111:273,1989) и для лечения рака молочной железы (Holmes et al., J. Nat. Cancer Inst., 83: 1797, 1991). Он является потенциальным кандидатом для лечения опухолей в коже (Einzig et. al., Proc. Am. Soc. Clin. Oncol., 20:46) и карцином головы и шеи (Forastire et. al., Sem. Oncol., 20:56, 1990). Соединение также демонстрирует потенциал для лечения поликистозного заболевания почек (Woo et. al, Nature, 368:750. 1994),рака легкого и малярии. Лечение пациентов паклитакселом приводит к супрессии костного мозга (различные клеточные линии, Ignoff, R.J. et. al, Cancer Chemotherapy Pocket Guide, 1998), связанной с продолжительностью введения выше пороговой концентрации (50 нМ) (Kearns, CM. et. al, Seminars in Oncology, 3(6) p,16-23, 1995). Доцетаксел, (2R,3S)-N-карбокси-3-фенилизосерин,N-трет-бутиловый эфир, 13-эфир с 5-20-эпокси 1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он 4-ацетат 2-бензоат, тригидрат; является коммерчески дос-5 023143 тупным в виде раствора для инъекций как TAXOTERE. Доцетаксел показан для лечения рака молочной железы. Доцетаксел представляет собой полусинтетическое производное паклитаксела (см. выше), полученное с использованием природного предшественника, 10-деацетил-баккатина III, экстрагированное из иголок европейского тисового дерева. Дозо-ограничивающей токсичностью доцетаксела является нейтропения. Алкалоиды барвинка являются фаза-специфическими противоопухолевыми средствами, выделенными из растения барвинка. Алкалоиды барвинка действуют на М фазу (митоз) клеточного цикла путем связывания специфическим образом с тубулином. Соответственно, связанная молекула тубулина неспособна полимеризоваться в микротрубочки. Считается, что митоз останавливается в метафазе с последующей клеточной гибелью. Примеры алкалоидов барвинка включают, но не ограничиваются этим,винбластин, винкристин и винорелбин. Винбластин, винкалейкобластин сульфат, является коммерчески доступным как VELBAN в виде раствора для инъекций. Хотя он имеет возможное показание как вспомогательное лечение различных солидных опухолей, преимущественно он показан для лечения тестикулярного рака и различных лимфом, включая болезнь Ходжкина; и лимфоцитарных и гистиоцитарных лимфом. Миелосупрессия является дозо-ограничивающим побочным эффектом винбластина. Винкристин, винкалейкобластин, 22-оксо-, сульфат, является коммерчески доступным какONCOVIN в виде раствора для инъекций. Винкристин показан для лечения острых лейкозов и также нашел применение в схемах лечения ходжкинской и неходжкинской злокачественных лимфом. Алопеция и неврологические эффекты являются наиболее часто встречающимися побочными эффектами винкристина, и в меньшей степени возникают эффекты миелосупрессии и воспаления желудочно-кишечных слизистых оболочек. Винорелбин, 3',4'-дидегидро-4'-дезокси-C'-норвинкалейкобластин [R-(R,R)-2,3-дигидроксибутандиоат (1:2)(соль)], является коммерчески доступным в виде раствора для инъекций винорелбина тартрата(NAVELBINE), представляет собой полусинтетический алкалоид барвинка. Винорелбин показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами, такими как цисплатин, для лечения различных солидных опухолей, в частности, немелкоклеточного рака легкого, прогрессирующего рака молочной железы и гормон-резистентного рака предстательной железы. Миелосупрессия является наиболее часто встречающимся дозо-ограничивающим побочным эффектом винорелбина. Платиновые координационные комплексы представляют собой не-фаза-специфические противораковые средства, которые взаимодействуют с ДНК. Платиновые комплексы проникают в опухолевые клетки, подвергаются гидратированию и образуют интра- и интерцепочечные поперечные связи с ДНК,вызывая неблагоприятные биологические эффекты для опухоли. Примеры платиновых координационных комплексов включают, но не ограничиваются этим, цисплатин и карбоплатин. Цисплатин, цис-диаминдихлорплатина, является коммерчески доступным как PLATINOL в виде раствора для инъекций. Цисплатин преимущественно показан для лечения метастатического тестикулярного рака и рака яичников и прогрессирующего рака мочевого пузыря. Основными дозоограничивающими побочными эффектами цисплатина являются нефротоксичность, которую можно контролировать путем гидратации и диуреза, и ототоксичность. Карбоплатин, платина, диамин [1,1-циклобутан-дикарбоксилат(2-)-O,O'], является коммерчески доступным как PARAPLATIN в виде раствора для инъекций. Карбоплатин преимущественно показан для первоочередного и вспомогательного лечения прогрессирующей карциномы яичников. Дозоограничивающей токсичностью карбоплатина является супрессия костного мозга. Алкилирующие средства являются нефаза-специфическими противораковыми средствами и сильными электрофилами. Типично, алкилирующие средства образуют ковалентные связи, путем алкилирования, с ДНК через нуклеофильные группы молекулы ДНК, такие как фосфатные, амино, сульфгидрильные, гидроксильные, карбоксильные и имидазольные группы. Такое алкилирование разрушает функцию нуклеиновой кислоты, приводя к клеточной гибели. Примеры алкилирующих средств включают, но не ограничиваются этим, азотные иприты, такие как циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, такие как бусульфан; нитрозомочевины, такие как кармустин; и триазены, такие как дакарбазин. Циклофосфамид, 2-[бис(2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорин 2-оксид моногидрат, является коммерчески доступным в виде раствора для инъекций или таблеток как CYTOXAN. Циклофосфамид показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения злокачественных лимфом, множественной миеломы и лейкозов. Алопеция, тошнота, рвота и лейкопения являются наиболее часто встречающимися дозо-ограничивающими побочными эффектами циклофосфамида. Мелфалан, 4-[бис(2-хлорэтил)амино]-1-фенилаланин, является коммерчески доступным в виде раствора для инъекций или таблеток как ALKERAN. Мелфалан показан для паллиативного лечения множественной миеломы и неоперабельной эпителиальной карциномы яичника. Супрессия костного мозга является наиболее часто встречающимся дозо-ограничивающим побочным эффектом мелфалана. Хлорамбуцил, 4-[бис(2-хлорэтил)амино]бензолбутановая кислота, является коммерчески доступным как таблетки LEUKERAN. Хлорамбуцил показан для паллиативного лечения хронического лимфатического лейкоза и злокачественных лимфом, таких как лимфосаркома, гигантофолликулярной лимфомы и болезни Ходжкина. Супрессия костного мозга является наиболее часто встречающимся дозоограничивающим побочным эффектом хлорамбуцила. Бусульфан, 1,4-бутандиол диметансульфонат, является коммерчески доступным как MYLERAN в виде таблеток. Бусульфан показан для паллиативного лечения хронического миелогенного лейкоза. Супрессия костного мозга является наиболее часто встречающимся дозо-ограничивающим побочным эффектом бусульфана. Кармустин, 1,3-[бис(2-хлорэтил)-1-нитрозомочевина, является коммерчески доступным в виде отдельных флаконов лиофилизированного вещества как BiCNU. Кармустин показан для паллиативного лечения как отдельное средство или в комбинации с другими средствами для лечения опухолей головного мозга, множественной миеломы, болезни Ходжкина и неходжкинских лимфом. Замедленная миелосупрессия является наиболее часто встречающимся дозо-ограничивающая побочным эффектом кармустина. Дакарбазин, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид, является коммерчески доступным в виде отдельных флаконов вещества как DTIC-Dome. Дакарбазин показан для лечения метастатической злокачественной меланомы и в комбинации с другими средствами для вспомогательного лечения болезни Ходжкина. Тошнота, рвота и анорексия являются наиболее часто встречающимися дозоограничивающими побочными эффектами дакарбазина. Противоопухолевые антибиотики представляют собой нефаза-специфические средства, которые связываются или интеркалируют с ДНК. Типично, такое действие приводит к стабильным ДНК комплексам или разрыву цепей, что нарушает обычную функцию нуклеиновых кислот, приводя к клеточной гибели. Примеры противоопухолевых средств на основе антибиотиков включают, но не ограничиваются этим, актиномицины, такие как дактиномицин, антроциклины, такие как даунорубицин и доксорубицин; и блеомицины. Дактиномицин, также известный как Актиномицин D, является коммерчески доступным в форме для инъекций как COSMEGEN. Дактиномицин показан для лечения опухоли Вильмса и рабдомиосаркомы. Тошнота, рвота и анорексия являются наиболее часто встречающимися дозо-ограничивающими побочными эффектами дактиномицин. Даунорубицин, (8S-цис-)-8-ацетил-10-[(3-амино-2,3,6-тридезоксиL-ликсо-гексопиранозил)окси]7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12 нафтацендион гидрохлорид, является коммерчески доступным в липосомной форме для инъекций как DAUNOXOME в форме для инъекций как CERUBIDINE. Даунорубицин показан для индукции ремиссии для лечения острого не-лимфоцитарного лейкоза и прогрессирующей ВИЧ-ассоциированной саркомы Капоши. Миелосупрессия является наиболее часто встречающимся дозо-ограничивающим побочным эффектом даунорубицина. Доксорубицин, (8S,10S)-10-[(3-амино-2,3,6-тридезоксиL-ликсо-гексопиранозил)окси]-8-гликолоил, 7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12 нафтацендион гидрохлорид, является коммерчески доступным в форме для инъекций как RUBEX или ADRIAMYCIN RDF. Доксорубицин преимущественно показан для лечения острого лимфобластного лейкоза и острого миелобластного лейкоза,но также является полезным компонентом для лечения некоторых солидных опухолей и лимфом. Миелосупрессия является наиболее часто встречающимся дозо-ограничивающим побочным эффектом доксорубицина. Блеомицин, смесь цитотоксичных гликопептидных антибиотиков, выделенных из штамма Streptomyces verticillus, является коммерчески доступным как BLENOXANE. Блеомицин показан в качестве паллиативного лечения, как отдельное средство или в комбинации с другими средствами, сквамозноклеточной карциномы, лимфом и тестикулярных карцином. Легочные и кожные токсичности являются наиболее часто встречающимися дозо-ограничивающими побочными эффектами блеомицина. Ингибиторы топоизомеразы II включают, но не ограничиваются этим, эпиподофиллотоксины. Эпиподофиллотоксины являются фаза-специфическими противоопухолевыми средствами, выделенными из мандрагоры. Эпиподофиллотоксины типично воздействуют на клетки в S и G2 фазах клеточного цикла путем образования трехчленный комплекс с топоизомеразой II и ДНК, вызывая разрыв цепей ДНК. Разрывы цепей накапливаются и следует клеточная гибель. Примеры эпиподофиллотоксинов включают, но не ограничиваются этим, этопозид и тенипозид. Этопозид, 4'-деметил-эпиподофиллотоксин 9[4,6-O-(R)-этилиденD-глюкопиранозид], является коммерчески доступным в виде раствора для инъекций или капсул как VePESID, и широко известен как VP-16. Этопозид показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения тестикулярного рака и немелкоклеточного рака легкого. Миелосупрессия является наиболее часто встречающимся побочным эффектом этопозида. Случаи возникновения лейкопении обычно более тяжелые, чем случаи тромбоцитопении. Тенипозид, 4'-деметил-эпиподофиллотоксин 9[4,6-O-(R)-тенилиденD-глюкопиранозид], является коммерчески доступным в виде раствора для инъекций как VUMON, и широко известен как VM-26. Тенипозид показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза у детей. Миелосупрессия является наиболее часто встречающимся дозо-ограничивающим побочным эффектом тенипозида. Тенипозид может индуцировать как лейкопению, так и тромбоцитопению. Противоопухолевые средства, представляющие собой антиметаболиты, являются фаза-специфическими противоопухолевыми средствами, которые действуют на S фазу (синтез ДНК) клеточного цикла путем ингибирования синтеза ДНК или путем ингибирования синтеза пуриновых или пиримидиновых оснований, ограничивая, таким образом, синтез ДНК. Соответственно, не происходит развитие S фазы, и следует клеточная гибель. Примеры противоопухолевых средств-антиметаболитов включают, но не ограничиваются этим, фторурацил, метотрексат, цитарабин, меркаптопурин, тиогуанин и гемцитабин. 5-Фторурацил, 5-фтор-2,4-(1 Н,3 Н) пиримидиндион является коммерчески доступным как фторурацил. Введение 5-фторурацила приводит к ингибированию синтеза тимидилата, и он также внедряется как в РНК, так и в ДНК. Результатом типично является клеточная гибель. 5-Фторурацил показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения карцином молочной железы, толстой кишки, прямой кишки, желудка и поджелудочной железы. Миелосупрессия и воспаление слизистой оболочки являются дозо-ограничивающими побочными эффектами 5 фторурацила. Другие фторпиримидиновые аналоги включают 5-фтор дезоксиуридин (флоксуридин) и 5 фтордезоксиуридин монофосфат. Цитарабин, 4-амино-1D-арабинофуранозил-2(1 Н)-пиримидинон, является коммерчески доступным как CYTOSAR-U, и широко известен как Ara-С. Считается, что цитарабин проявляет клеточную фазо-специфичность в S-фазе путем ингибирования удлинения ДНК цепи путем терминального внедрения цитарабина в растущую ДНК цепь. Цитарабин показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза. Другие цитидиновые аналоги включают 5-азацитидин и 2',2'-дифтордезоксицитидин (гемцитабин). Цитарабин индуцирует лейкопению, тромбоцитопению и воспаление слизистой оболочки. Меркаптопурин, 1,7-дигидро-6 Н-пурин-6-тион моногидрат, является коммерчески доступным какPURINETHOL. Меркаптопурин проявляет клеточную фаза-специфичность в S-фазе путем ингибирования синтеза ДНК механизмом, который к настоящему времени еще не определен. Меркаптопурин показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза. Миелосупрессия и воспаление желудочно-кишечных слизистых оболочек являются ожидаемыми побочными эффектами меркаптопурина при высоких дозах. Полезным аналогом меркаптопурина является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6 Н-пурин-6-тион, является коммерчески доступным как TABLOID. Тиогуанин проявляет клеточную фаза-специфичность в S-фазе путем ингибирования синтеза ДНК механизмом, который к настоящему времени еще не определен. Тиогуанин показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения острого лейкоза. Миелосупрессия, включая лейкопению, тромбоцитопению и анемию, является наиболее часто встречающимся дозо-ограничивающим побочным эффектом введения тиогуанина. Однако возникают желудочно-кишечные побочные эффекты, и они могут быть дозо-ограничивающими. Другие пуриновые аналоги включают пентостатит, эритрогидроксинониладенин, флударабин фосфат и кладрибин. Гемцитабин, 2'-дезокси-2',2'-дифторцитидин моногидрохлорид (-изомер), является коммерчески доступным как GEMZAR. Гемцитабин проявляет клеточную фаза-специфичность в S-фазе и путем блокирования прогрессии клеток через G1/S границу. Гемцитабин показан в комбинации и цисплатином для лечения локально прогрессирующего немелкоклеточного рака легкого и отдельно для лечения локально прогрессирующего рака поджелудочной железы. Миелосупрессия, включая лейкопению, тромбоцитопению и анемию, является наиболее часто встречающимся дозо-ограничивающим побочным эффектом введения гемцитабина. Метотрексат, N-[4(2,4-диамино-6-птеридинил) метил]метиламино]бензоил]-1-глутаминовая кислота, является коммерчески доступным как метотрексат натрий. Метотрексат проявляет клеточнофазовые эффекты специфическим образом S-фазе путем ингибирования синтеза, репарации/или репликации ДНК через ингибирование дигидрофолевая кислота-редуктазы, которая необходима для синтеза пуриновых нуклеотидов и тимидилата. Метотрексат показан как отдельное средство или в комбинации с другими химиотерапевтическими средствами для лечения хондриокарциномы, менингеального лейкоза,не-ходжкинской лимфомы и карцином молочной железы, головы, шеи, яичника и мочевого пузыря. Миелосупрессия (лейкопения, тромбоцитопения и анемия) и воспаление слизистой оболочки являются ожидаемыми побочными эффектами введения метотрексата. Камптотецины, включая камптотецин и камптотециновые производные, являются доступными или находятся в процессе разработки как ингибиторы топоизомеразы I. Считают, что цитотоксичная активность камптотецинов связана с их активностью ингибирования топоизомеразы I. Примеры камптотеци-8 023143 нов включают, но не ограничиваются этим, иринотекан, топотекан и различные оптические формы 7-(4 метилпиперазино-метилен)-10,11-этилендиокси-20-камптотецина, описанные ниже. Иринотекан HCl, (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1 Нпирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14(4H,12 Н)-дион гидрохлорид, является коммерчески доступным в виде раствора для инъекций CAMPTOSAR. Иринотекан представляет собой производное камптотецина, которое связывается, наряду с его активным метаболитом SN-38, с комплексом топоизомераза I-ДНК. Считается, что цитотоксичность возникает как результат необратимых разрывов двойной цепи, вызванных взаимодействием топоизомеразаI : ДНК : иринотекан или трехчленного комплекса SN-38 с репликативными ферментами. Иринотекан показан для лечения метастатического рака толстой кишки или прямой кишки. Дозо-ограничивающими побочными эффектами иринотекана HCl являются миелосупрессия, включая нейтропению и желудочнокишечные эффекты, включая диарею. Топотекан HCl, (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-дион моногидрохлорид, является коммерчески доступным как раствор для инъекций HYCAMTIN. Топотекан представляет собой производное камптотецина, которое связывается комплексом топоизомераза I-ДНК и предотвращает повторное сшивание отдельных разрывов цепи, вызванных Топоизомеразой I в ответ на деформацию при скручивании молекулы ДНК. Топотекан показан для вспомогательного лечения метастатической карциномы яичника и мелкоклеточного рака легкого. Дозо-ограничивающим побочным эффектом топотекана HCl является миелосупрессия, преимущественно нейтропения. Также представляет интерес производное камптотецина формулы А, представленной ниже, которое в настоящее время находится в процессе разработки, включая форму рацемической смеси (R,S), а также известное под химическим названием "7-(4-метилпиперазино-метилен)-10,11-этилендиокси 20(R,S)-камптотецин (рацемическая смесь) или "7-(4-метилпиперазино-метилен)-10,11-этилендиокси 20(R)-камптотецин (R энантиомер) или "7-(4-метилпиперазино-метилен)-10,11-этилендиокси-20(S)камптотецин (S энантиомер). Такое соединение, а также родственные соединения описаны, включая способы их получения, в патентах США 6063923; 5342947; 5559235; 5491237 и в находящейся на рассмотрении патентной заявке США 08/977217, поданной 24 ноября 1997 года. Гормоны и гормональные аналоги являются полезными соединениями для лечения тех типов рака,где существует взаимосвязь между гормоном(гормонами) и ростом и/или отсутствием роста рака. Примеры гормонов и гормональных аналогов, полезных для лечения рака, включают, но не ограничиваются этим, адренокортикостероиды, такие как преднизон и преднизолон, которые являются полезными для лечения злокачественной лимфомы и острого лейкоза у детей; аминоглутетимид и другие ингибиторы ароматазы, такие как анастрозол, летразол, воразол и экземестан, полезные для лечения адренокортикальной карциномы и гормонально-зависимой карциномы молочной железы, содержащей рецепторы эстрогена; прогестрины, такие как мегестрол ацетат, полезные для лечения гормонально-зависимого рака молочной железы и эндометриальной карциномы; эстрогены, андрогены и антиандрогены, такие как флутамид, нилутамид, бикалутамид, ципротерон ацетат и 5-редуктазы, такие как финастерид и дутастерид, полезные для лечения карциномы предстательной железы и доброкачественной гипертрофии предстательной железы; антиэстрогены, такие как тамоксифен, торемифен, ралоксифен, дролоксифен, иодоксифен, а также селективные модуляторы рецепторов эстрогена (SERMS), такие, как описанные в Патентах США 5681835, 5877219 и 6207716, полезные для лечения гормонально-зависимой карциномы молочной железы и других чувствительных к лечению типов рака; и гонадотропин-высвобождающий гормон (GnRH) и его аналоги, которые стимулируют высвобождение лютеинизирующего гормона (LH) и/или фолликулостимулирующего гормона (FSH), для лечения карциномы предстательной железы, например, LHRH агонисты и антагонисты, такие как госерелин ацетат и лупролид. Ингибиторы пути сигнальной трансдукции представляют собой такие ингибиторы, которые блокируют или ингибируют химический процесс, который вызывает внутриклеточное изменение. Как используется в настоящей заявке, это изменение представляет собой клеточную пролиферацию или дифференциацию. Ингибиторы сигнальной трансдукции, полезные в настоящем изобретении, включают ингибиторы рецепторных тирозинкиназ, нерецепторных тирозинкиназ, блокаторов SH2/SH3 домена, сериновых/треониновых киназ, фосфотидилинозит-3 киназ, передачи сигналов Муо-инозита и Ras онкогенов. Некоторые тирозиновые протеинкиназы катализируют фосфорилирование специфических тирозильных остатков в различных белках, вовлеченных в регуляцию клеточного роста. Такие тирозиновые протеинкиназы могут быть широко классифицированы как рецепторные или нерецепторные киназы. Рецепторные тирозиновые киназы представляют собой трансмембранные белки, содержащие внеклеточный лиганд-связывающий домен, трансмембранный домен и тирозинкиназный домен. Рецепторные тирозиновые киназы вовлечены в регуляцию клеточного роста, и их обычно называют рецепторами фактора роста. Былопоказано, что несоответствующая или неконтролируемая активация многих из этих киназ, т.е. аберрантная активность киназы рецептора фактора роста, например, путем сверхэкспрессии или мутации, приводит к неконтролируемому клеточному росту. Соответственно, аберрантную активность таких киназ связывают с злокачественным ростом ткани. Соответственно, ингибиторы таких киназ могут обеспечить способы лечения рака. Рецепторы факторов роста включают, например, рецептор эпидермального ростового фактора (EGFr), рецептор фактора роста, полученного из тромбоцитов (PDGFr),erbB2, erbB4, рецептор фактора роста сосудистого эндотелия (VEGFr), домены гомологии тирозинкиназы с иммуноглобулин-подобным и эпидермальным ростовым фактором (TIE-2), рецептор инсулинового ростового фактора-I (IGFI), макрофагальные колоние-стимулирующий фактор (cfms), BTK, ckit, cmet,рецепторы фактора роста фибробластов (FGF), рецепторы Trk (TrkA, TrkB и TrkC), рецепторы эфрина(eph) и RET протоонкоген. Некоторые ингибиторы рецепторов факторов роста находятся в процессе разработки и включают антагонисты лигандов, антитела, ингибиторы тирозиновых киназ и антисмысловые олигонуклеотиды. Рецепторы факторов роста и средства, которые ингибируют функцию рецепторов фактора роста, описаны, например, в Kath, John С, Exp. Opin. Ther. Patents (2000) 10 (6):803-818; ShawverTargets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David, CRC press 1994, London. Тирозиновые киназы, которые не являются киназами рецепторов факторов роста, называют нерецепторными тирозинкиназами. Нерецепторные тирозинкиназы, полезные в настоящем изобретении,которые являются мишенями или потенциальными мишенями для противораковых лекарственных средств, включают cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (киназы фокальной адгезии), Brutons тирозинкиназы и Bcr-Abl. Такие не-рецепторные киназы и средства, которые ингибируют функцию нерецепторных тирозинкиназ, описаны в Sinn, S. and Corey, S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8(5): 465-80; and Bolen, J.B., Brugge, J.S., (1997) Annual review of Immunology. 15: 371-404. Блокаторы SH2/SH3 домена представляют собой средства, которые разрывают связывание SH2 илиSH3 домена в различных ферментах или адапторных белках, включая PI3-K р 85 субъединицу, киназы семейства Src, адапторные молекулы (She, Crk, Nek, Grb2) и Ras-GAP. SH2/SH3 домены в качестве мишеней для противораковых лекарственных средств обсуждаются в Smithgall, Т.Е. (1995), Journal of Pharmacological and Toxicological Methods. 34(3) 125-32. Ингибиторы Сериновых/Треониновых Киназ, включая блокаторы каскада MAP киназ, которые включают блокаторы Raf киназ (rafk), Митоген или Внеклеточную Регулируемую Киназу (MEKs) и Внеклеточные Регулируемые Киназы (ERKs); и блокаторы членов семейства протеинкиназ С, включая блокаторы PKCs (альфа, бета, гамма, эпсилон, мю, лямбда, йота, зета). Семейство IkB киназ (IKKa, IKKb),семейство PKB киназ, члены семейства AKT киназ и киназы TGF бета рецепторов. Такие Сериновые/Треониновые киназы и их ингибиторы описаны в Yamamoto, Т., Taya, S., Kaibuchi, K., (1999), Journal(1995), Cancer Threatment and Research. 78: 3-27, Lackey, K. et al Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; Патенте США 6268391; и Martinez-Iacaci, L., et al, Int. J. Cancer (2000), 88(1),44-52. Ингибиторы членов семейства Фосфотидилинозит-3 Киназ, включая блокаторы PI3-киназы, ATM,ДНК-PK и Ku, также являются полезными в настоящем изобретении. Такие киназы обсуждаются в Abraham, R.T. (1996), Current Opinion in Immubology. 8 (3) 412-8; Canman, C.E., Lim, D.S. (1998), Oncogene 17Zhong, H. et al, Cancer res, (2000) 60(6), 1541-1545. Также полезными в настоящем изобретении являются ингибиторы передачи сигналов Муо-инозита,такие как блокаторы фосфолипазы С и аналоги Муо-инозита. Такие ингибиторы сигналов описаны вDavid Kerr, CRC press 1994, London. Другая группа ингибиторов пути сигнальной трансдукции включает ингибиторы Ras Онкогена. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранил-геранилтрансферазы и СААХ протеаз, а также антисмысловые олигонуклеотиды, рибозимы и иммунотерапию. Было показано, что такие ингибиторы блокируют активацию ras в клетках, содержащих мутантный ras дикого типа, действуя,таким образом, как антипролиферативные средства. Ингибирование Ras онкогена обсуждается в Scharovsky, O.G., Rozados, V.R., Gervasoni, S.I. Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby,M.N. (1998), Current Opinion in Lipidology. 9 (2) 99-102; и BioChim. Biophys. Acta, (19899) 1423(3): 19-30. Как указано выше, антагонисты на основе антител к связыванию лиганда с киназой рецептора также могут служить в качестве ингибиторов сигнальной трансдукции. Эта группа ингибиторов пути сигнальной трансдукции включает применение гуманизированных антител к внеклеточному лиганд- 10023143 связывающему домену рецепторных тирозинкиназ. Например, Imclone C225 EGFR специфическое антитело (см. Green, M.C. et al, Monoclonal Antibody Therapy for Solid Tumors, Cancer Treat. Rev., (2000), 26(4),269-286); Herceptin erbB2 антитело (см. Tyrosine Kinase Signalling in Breast cancer:erbB Family ReceptorBrekken, R.A. et al, Selective Ingibition of VEGFR2 Activity by a monoclonal Anti-VEGF antibody blocks tumor growth in mice, Cancer Res. (2000) 60, 5117-5124). Ингибиторы связанных с ангиогенезом нерецепторных киназ также могут найти применение в настоящем изобретении. Ингибиторы связанных с ангиогенезом VEGFR и TIE2 обсуждаются выше в связи с ингибиторами сигнальной трансдукции (оба рецептора являются рецепторными тирозинкиназами). Ангиогенез, в основном, связывают с передачей сигнала erbB2/EGFR, поскольку было показано, что ингибиторы erbB2 и EGFR ингибируют ангиогенез, преимущественно VEGF экспрессию. Таким образом,комбинация ингибитора erbB2/EGFR с ингибитором ангиогенеза имеет смысл. Соответственно, ингибиторы нерецепторных тирозинкиназ можно использовать в комбинации с ингибиторами EGFR/erbB2 по настоящему изобретению. Например, анти-VEGF антитела, которые не распознают VEGFR (рецепторная тирозинкиназа), но связываются с лигандом; малые молекулы-ингибиторы интегрина (альфа v бета 3), которые будут ингибировать ангиогенез; эндостатин и ангиостатин (не-RTK) также могут быть полезными в комбинации с раскрытыми ингибиторами erb семейства. (См. Bruns CJ et al (2000), Cancer Res., 60: 2926-2935; Schreiber AB, Winkler ME and Derynck R. (1986), Science, 232: 1250-1253; Yen L et al. (2000),Oncogene 19: 3460-3469). Средства, используемые в качестве иммунотерапевтических средств, также могут быть полезными в комбинации с соединением настоящего изобретения. Существует ряд иммунологических стратегий для генерации иммунного ответа против erbB2 или EGFR. Эти стратегии, в основном, находятся в пределах вакцинации против опухолей. Эффективность иммунологических подходов может быть существенно повышена через совместное ингибирование путей передачи сигналов erbB2/EGFR с использованием малой молекулы-ингибитора. Обсуждение подхода на основе иммунологической/противоопухолевой вакцины против erbB2/EGFR можно найти в Reilly RT et al. (2000), Cancer Res. 60: 3569-3576; и Chen Y, HuD, Eling DJ, Robbins J and Kipps TJ. (1998), Cancer Res. 58: 1965-1971. Средства, используемые в качестве проапоптических (например, bcl-2 антисмысловые олигонуклеотиды), также можно использовать в комбинации по настоящему изобретению. Члены Bcl-2 семейства белков блокируют апоптоз. Активирующую регуляцию bcl-2 поэтому связывают с химиорезистентностью. Исследования показали, что эпидермальный ростовый фактор (EGF) стимулирует антиапоптические члены bcl-2 семейства (т.е. mcl-1). Поэтому стратегии, разработанные для даун-регуляции экспрессии bcl-2 в опухоли продемонстрировали клиническое преимущество и в настоящее время находятся в Фазе II/III испытаний, а именно, Genta's G3139 bcl-2 антисмысловой олигонуклеотид. Такие проапоптические стратегии с использованием стратегии антисмысловых олигонуклеотидов для bcl-2 обсуждаются в Water JS et al. (2000), J. Clin. Oncol. 18: 1812-1823; и Kitada S et al. (1994), Antisense Res. Dev. 4: 71-79. Ингибиторы сигналов клеточного цикла ингибируют молекулы, вовлеченные в контроль клеточного цикла. Семейство протеинкиназ, называемых циклин-зависимыми киназами (CDK), и их взаимодействие с семейством белков, называемых циклинами, контролируют прохождение через эукариотический клеточный цикл. Координирующая активация и инактивация различных циклин/CDK комплексов необходима для нормального прохождения через клеточный цикл. Некоторые ингибиторы сигналов клеточного цикла находятся в процессе разработки. Например, примеры циклин-зависимых киназ, включаяCDK2, CDK4 и CDK6, и ингибиторов таких киназ описаны, например, в Rosania et al, Exp. Opin. Ther.Patents (2000) 10(2):215-230. Кроме того, p21WAF1/CIP1 описан как сильный и универсальный ингибитор циклин-зависимых киназ (Cdks) (Ball et al, Progress in Cell Cycle Res., 3: 125 (1997. Соединения, которые известны как индуцирующие экспрессию p21WAF1/CIP1, вовлечены в супрессию клеточной пролиферации и обладают активностью супрессии опухоли (Richon et al, Proc. Nat Acad. Sci. U.S.A. 97(18): 10014-10019 (2000 и включены как ингибиторы сигналов клеточного цикла. Модуляторы рецептора ретиноевой кислоты используют для лечения лейкозов. Патология лейкоза ассоциируется с аномальной аккумуляцией незрелых клеток-предшественников, которые являются чувствительными к лечению ретиноевой кислотой. В большинстве случаев острого промиелоцитарного лейкоза (APL), также называемого как острый миелогенный лейкоз подтип М 3, имеет место хромосомная транслокация хромосом 15 и 17, которая вызывает генетическое слияние гена рецептора ретиноевой кислоты (RAR) с геном промиелоцитарного лейкоза (PML). Этот гибридный PML-RAR белок является ответственным за предотвращение дифференциации незрелых миелоидных клеток в более зрелые клетки. Считают, что это блокирование дифференциации и последующая аккумуляция менее дифференцированных клеток вызывают лейкоз. ATRA, Третиноин, действует на PML-RAR, снимая это блокирование, вызывая дифференциацию незрелых промиелоцитов в нормальные зрелые клетки крови, таким образом,уменьшая количество промиелоцитов и промотируя популяцию в конечном счете дифференцированных клеток с ограниченной продолжительностью жизни. Талазорол представляет собой экспериментальное лекарственное средство того же класса, что и Третиноин. Эпигенетические изменения вовлечены практически во все типы рака человека. Рак-специфические изменения часто ассоциированы с сайленсингом опухоль-супрессорных генов через модификации гистонов и модификации ДНК, включая гиперметилирование ДНК. Эпигенетические фармацевтические средства контролируют регуляторные области, ассоциированные с опухоль-супрессорными генами, вызывая конформационные изменения в гистонах и удаляя репрессивные модификации для ДНК. Эти изменения непосредственно воздействуют на образование и прогрессирование рака. Примеры эпигенетических средств включают ингибиторы гистон-деацетилазы и ингибиторы метилирования ДНК. Ингибиторы гистон-деацетилазы (ингибиторы HDAC, HDI) представляют собой класс соединений,которые препятствуют функции гистон-деацетилаз. Было показано, что ингибиторы гистон-деацетилаз могут быть полезными для лечения кожной Т-клеточной лимфомы. В настоящее время они проходят клинические исследования для других различных типов опухолей. Примеры ингибиторов HDAC, одобренных для применения, включают Вориностат и Ромидепсин. Считается, что эти соединения ингибируют активность HDAC и приводят к аккумуляции ацетилирования гистонов, промотирующих генную экспрессию. Азацитидин (INN) или 5-азацитидин, продаваемый под торговым названием Vidaza, представляет собой химический аналог цитидина, нуклеозида, присутствующего в ДНК и РНК. Азацитидин и его дезокси-производное децитабин (также известий как 5-аза-2'дезоксицитидин), применяют для лечения миелодиспластического синдрома, и в настоящее время они находятся в стадии исследования для других показаний для лечения опухолей. Азацитидин действует как ложный субстрат и сильный ингибитор ДНК-метилтрансфераз, приводя к снижению метилирования ДНК. ДНК-метилтрансферазы вводят азацитидин в ДНК в процессе репликации и в РНК в процессе транскрипции в клетке. Ингибирование метилирования ДНК происходит через образование стабильных комплексов между молекулой и ДНКметилтрансферазами, насыщая таким образом механизм клеточного метилирования. Это приводит к потере метилирования ДНК и может влиять на то, каким образом белки клеточной регуляции, такие как транскрипционный механизм, способны к ассоциации с ДНК. Примеры таких ингибиторов HDAC включают: 1. Вориностат, включая его фармацевтически приемлемые соли. Marks et al., Nature Biotechnology 25, 84 to 90 (2007); Stenger, Community Oncology 4, 384-386 (2007). Вориностат имеет следующую химическую структуру и название:N-гидрокси-N'-фенилоктандиамид. 2. Ромидепсин, включая его фармацевтически приемлемые соли.Vinodhkumar et al, BiomedicinePharmacotherapy 62 (2008) 85-93. Ромидепсин имеет следующую химическую структуру и название:(1S,4S,7Z,10S,16 Е,21R)-7-этилиден-4,21-ди(пропан-2-ил)-2-окса-12,13-дитиа-5,8,20,23-тетразабицикло[8.7.6]трикоз-16-ен-3,6,9,19,22-пентон. 3. Панобиностат, включая его фармацевтически приемлемые соли. Drugs of the Future 32(4): 315-322(2007). Панобиностат имеет следующую химическую структуру и название:(2 Е)-N-гидрокси-3-[4-([2-(2-метил-1H-индол-3-ил)этил]аминометил)фенил]акриламид. 4. Валпроевая кислота, включая ее фармацевтически приемлемые соли. Gottlicher, et al, EMBO J. 20(24): 6969-6978 (2001). Валпроевая кислота имеет следующую химическую структуру и название: 2-пропилпентановая кислота. 5. Моцетиностат (MGCD0103), включая его фармацевтически приемлемые соли. Balasubramanian etal., Cancer Letters 280: 211-221 (2009). Моцетиностат имеет следующую химическую структуру и название:N-(2-Аминофенил)-4-(4-пиридин-3-илпиримидин-2-ил)амино]метил]бензамид. Другие примеры таких ингибиторов HDAC включены в Bertrand European Journal of Medicinal Ингибиторы протеасомы представляют собой лекарственные средства, которые блокируют действие протеасом, клеточных комплексов, которые разрушают белки, такие как р 53 белок. Некоторые ингибиторы протеасом продаются на рынке или находятся в стадии исследования для лечения рака. Подходящие ингибиторы протеасомы для применения в комбинации в настоящей заявке включают: 1. Бортезомиб (Velcade), включая его фармацевтически приемлемые соли. Adams J, Kauffman M(2004), Cancer Invest 22 (2): 304-11. Бортезомиб имеет следующую химическую структуру и название: вая кислота. 2. Дисулфирам, включая его фармацевтически приемлемые соли. Bouma et al. (1998). J. Antimicrob.Chemother. 42(6): 817-20. Дисулфирам имеет следующую химическую структуру и название: 1,1',1,1-[дисульфандиилбис(карбонотиоилнитрило)]тетраэтан. 3. Эпигаллокатехин галлат (EGCG), включая его фармацевтически приемлемые соли. Williamson etal, (December 2006), The Journal of Allergy and Clinical Immunology 118 (6): 1369-74. Эпигаллокатехин галлат имеет следующую химическую структуру и название:[(2R,3R)-5,7-дигидрокси-2-(3,4,5-тригидроксифенил)хроман-3-ил]-3,4,5-тригидроксибензоат. 4. Салиноспорамид А, включая его фармацевтически приемлемые соли. Feling et at., (2003), Angew.Chem. Int. Ed. Engl. 42 (3): 355-7. Салиноспорамид А имеет следующую химическую структуру и название:(4R,5S)-4-(2-хлорэтил)-1-1S)-циклогекс-2-енил(гидрокси)метил)-5-метил-6-окса-2 азабицикло 3.2.0.гептан-3,7-дион. 5. Карфилзомиб, включая его фармацевтически приемлемые соли. Kuhn DJ, et al, Blood, 2007,110:3281-3290. Карфилзомиб имеет следующую химическую структуру и название:(S)-4-метил-N-S)-1-S)-4-метил-1-R)-2-метилоксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3 фенилпропан-2-ил)-2-S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)пентанамид. Белки теплового шока 70 кДа (Hsp70s) и белки теплового шока 90 кДа (Hsp90s) представляют собой семейства повсеместно экспрессируемых белков теплового шока. Сверхэкспрессия Hsp70s и Hsp90s имеет место в некоторых типах рака. Некоторые ингибиторы Hsp70s и Hsp90s находятся в стадии исследования для лечения рака. Подходящие ингибиторы Hsp70s и Hsp90s для применения в комбинации в настоящей заявке включают: 1. 17-AAG(Гелданамицин), включая его фармацевтически приемлемые соли. Jia W et al. Blood. 2003Sep l;102(5): 1824-32. 17-AAG(Гелданамицин) имеет следующую химическую структуру и название: 17-(Аллиламино)-17-деметоксигелданамицин. 2. Радицикол, включая его фармацевтически приемлемые соли (Lee et al., Mol Cell Endocrinol. 2002,188,47-54). Радицикол имеет следующую химическую структуру и название:(1aR,2Z,4 Е,14R,15aR)-8-хлор-9,11-дигидрокси-14-метил-15,15 а-дигидро-1 аН-бензо[с]оксирено[2,3k][1]оксациклотетрадецин-6,12(7 Н,14 Н)-дион. Ингибиторы ракового метаболизма - многие опухолевые клетки демонстрируют метаболизм, существенно отличающийся от метаболизма нормальных тканей. Например, скорость гликолиза, метаболического процесса, который преобразует глюкозу в пируват, повышается, и образующийся пируват восстанавливается до лактата вместо его дальнейшего окисления в митохондриях через цикл трикарбоновой кислоты (ТСА). Этот эффект часто наблюдают даже в аэробных условиях, и он известен как Эффект Варбурга. Лактатдегидрогеназа A (LDH-A), изоформа лактатдегидрогеназы, экспрессируемой в клетках мышц, играет центральную роль в метаболизме опухолевых клеток, осуществляя восстановление пирувата в лактат, который затем может экспортироваться из клетки. Было показано, что этот фермент активируется во многих типах опухолей. Изменение метаболизма глюкозы, описанное в Эффекте Варбурга,является критическим для роста и пролиферации раковых клеток, и было показано, что "нокаут" LDH-A с использованием PHK-i приводит к уменьшению клеточной пролиферации и роста опухоли в моделях ксенотрансплантатов.P. Leder, et. al, Cancer Cell, 2006, 9, 425. Высокие уровни синтазы жирных кислот (FAS) были обнаружены в предшествующих раку поражениях. Фармакологическое ингибирование FAS влияет на экспрессию ключевых онкогенов, вовлеченных как в развитие, так и в поддержание состояния рака.Alli et al. Oncogene (2005) 24, 39-46. doi: 10,1038. Ингибиторы ракового метаболизма, включая ингибиторы LDH-A, и ингибиторы биосинтеза жирных кислот (или ингибиторы FAS) являются подходящими для использования в комбинации с соединением по настоящему изобретению. Лечения рака включает совместное введение соединения по настоящему изобретению и/или его фармацевтически приемлемой соли и по меньшей мере одного противоопухолевого средства, такого как средство, выбранное из группы, включающей средства против микротрубочек, платиновые координационные комплексы, алкилирующие средства, антибиотики, ингибиторы топоизомеразы II, антиметаболиты, ингибиторы топоизомеразы I, гормоны и гормональные аналоги, ингибиторы пути сигнальной трансдукции, ингибиторы связанных с ангиогенезом нерецепторных тирозинкиназ, иммунотерапевтические средства, проапоптические средства, ингибиторы передачи сигналов клеточного цикла; ингибиторы протеасом; и ингибиторы ракового метаболизма. Экспериментальная часть Соединение настоящего изобретения можно получить способами, извсетными в уровне техники. Ниже представлен конкретный пример получения соединения по настоящему изобретению. РЕ Sciex API 150 одинарный квадрупольный масс-спектрометр (РЕ Sciex, Thornhill, Ontario, Canada) работал с использованием ионизации электроспреем в режиме детекции положительных ионов. Распыляющий газ генерировали из не содержащего воздух генератора (Balston Inc., Haverhill, MA;www.parker.com) и доставляли при 65 ф/дюйм 2 (4,570 кг/см 2), и используемый в качестве завесы газ представлял собой азот высокой чистоты, доставляемый из резервуара жидкого азота Dewar при 50 ф/дюйм 2 (3,515 кг/см 2). Напряжение, прилагаемое к игле электроспрея, составляло 4,8 кВ. Отверстие устанавливали при 25 В, и масс-спектрометр работал при скорости сканирования 0,5 скан/с с использованием пошагового изменения массы 0,2 amu (атомных единиц) и сбора профильных данных. Способ A, LCMS. Образцы вводили в масс-спектрометр с использованием СТС PAL автоматического пробоотборника (LEAP Technologies, Carrboro, NC), снабженного 10-мкл шприцем Hamilton, который впрыскивает пробу в Valco инжекционный клапан с 10 отверстиями. Использовали ВЭЖХ насосShimadzu LC-10ADvp (Shimadzu Scientific Instruments, Columbia, MD), работающий при 0,3 мл/мин, и линейный градиент 4,5% А до 90% В в течение 3,2 мин с удерживанием 0,4 мин. Подвижная фаза состояла из 100% (Н 2 О 0,02% TFA) в сосуде А и 100% (CH3CN 0,018% TFA) в сосуде В. Стационарная фаза представляла собой Aquasil (C18), и размеры колонки были 1 мм х 40 мм. Детекциию осуществляли при помощи УФ при 214 нм, испарительного светорассеяния (ELSD) и MS. Способ В, LCMS. Альтернативно, использовали аналитическую ВЭЖХ систему Agilent 1100 сLCMS и работу осуществляли при 1 мл/мин с линейным градиентом 5% А до 100% В в течение 2,2 мин с удерживанием 0,4 мин. Подвижная фаза состояла из 100% (Н 2 О 0,02% TFA) в сосуде А и 100% (CH3CN 0,018% TFA) в сосуде В. Стационарная фаза представляла собой Zobax (C8) с размером частиц 3,5 мкм, и размеры колонки были 2,150 мм. Детекциию осуществляли при помощи УФ при 214 нм, испарительно- 15023143 го светорассеяния (ELSD) и MS. Способ В, LCMS. Альтернативно, использовали систему MDSSCIEX API 2000, снабженную капиллярной колонкой (504,6 мм, 5 мкм). ВЭЖХ осуществляли на системе Agilent-1200 series UPLC, снабженной колонкой Zorbax SB-C18 (504,6 мм, 1,8 мкм), элюирование осуществляли с использованиемAVANCE 400 МГц, управляющей программы ACD Spect, версия 10, для дальнейшей обработки данных. Мультиплетности указывали как: с=синглет, д=дублет, т=триплет, кв.=квартет, м=мультиплет, дд = дублет дублетов, дт=дублет триплетов и т.п., и шир. указывает широкий сигнал. Аналитическая ВЭЖХ: продукты анализировали с использованием системы аналитической хроматографии Agilent 1100, с колонкой Zorbax XDB-C18 4,575 мм (3,5 мкм), при скорости потока 2 мл/мин, с 4 мин градиентом от 5% CH3CN (0,1% муравьиной кислоты) до 95% CH3CN (0,1% муравьиной кислоты) в Н 2 О (0,1% муравьиной кислоты) и удерживанием 1 мин. Препаративная ВЭЖХ: Продукты очищали с использованием системы препаративной хроматографии Gilson с колонкой YMC CorabiPrep ODS-A 7530 мм в.д. (5 мкм) (www.waters.com), при скорости потока 50 мл/мин, с 10 мин градиентом от 5% CH3CN (0,1% муравьиной кислоты) до 95% CH3CN (0,1% муравьиной кислоты) в Н 2 О (0,1% муравьиной кислоты) и удерживанием 2 мин; альтернативно, продукты очищали с использованием системы препаративной хроматографии Agilent 1100, с колонкой Gemini С 1810030 мм (5 мкм), при скорости потока 60 мл/мин, с 10 мин градиентом от 5% CH3CN (0,1% муравьиной кислоты) до 95% CH3CN (0,1% муравьиной кислоты) в H2O (0,1% муравьиной кислоты) и удерживанием 2 мин. Препаративную хроматографию с нормальной фазой осуществляли с использованием системыAnalogix IntelliFlash 280 или 310, с SuperFlash Sepra Si 50 колонками. Альтернативно, использовали систему ISCO Companion. Альтернативно, обращенно-фазовую ВЭЖХ осуществляли на системе Agilent с использованием колонки Zorbax SB-C18 (21,2250 мм, 7 мкм), элюирование осуществляли с использованием CH3CN:аммонийацетатного буфера (10 мкМ) при рН 6,8. Пример получения 4-4-1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойной кислоты: Стадия 1. трет-Бутил 4-4-(гидроксиметил)пиперидин-1-ил)метил)бензоат. трет-Бутил 4-(бромметил)бензоат (1 г, 3,13 ммоль) и пиперидин-4-илметанол (0,361 г, 3,13 ммоль) растворяли в ацетонитриле (25 мл). Добавляли K2CO3 (1,300 г, 9,40 ммоль) и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 20 мин. Реакционную смесь охлаждали до комнатной температуры, фильтровали и упаривали. Полученное твердое вещество распределяли между этилацетатом (50 мл) и 1 М HCl (50 мл). Слои разделяли и водный слой промывали этилацетатом и органические слои сливали. Водный слой подщелачивали при помощи 8 М NaOH до рН 10 и экстрагировали 2 раза при помощи 50 мл этилацетата. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и упаривали. трет-Бутил 4-4(гидроксиметил)пиперидин-1-ил)метил)бензоат (0,95 г, 2,99 ммоль, выход 95%) выделяли в виде желтого масла. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)7,95 (д, J=8,34 Гц, 2 Н), 7,39 (д, J=8,08 Гц, 2 Н), 3,56 (с, 2 Н),3,51 (д, J=6,57 Гц, 2 Н), 2,90 (д, J=11,37 Гц, 2 Н), 1,94-2,04 (м, 2 Н), 1,73 (д, J=14,15 Гц, 2 Н), 1,61 (с, 9 Н),1,40-1,56 (м, 2 Н), 1,30-1,37 (м, 2H); LC-MS Rt=0,67 мин; MS (ESI): 306,2 [М+Н]+. Стадия 2. трет-Бутил 4-4-формилпиперидин-1-ил)метил)бензоат. К раствору оксалилхлорида (0,408 мл, 4,67 ммоль) в дихлорметане (5 мл) при -60 С добавляли раствор DMSO (0,508 мл, 7,15 ммоль) в 15 мл дихлорметана в течение 30 минут. Реакционную смесь перемешивали в течение 30 мин при -60 С Добавляли раствор трет-бутил 4-4-(гидроксиметил)пиперидин-1 ил)метил)бензоата (950 мг, 3,11 ммоль) в 5 мл дихлорметана в течение 10 мин при -60 С. Реакционную смесь перемешивали в течение 3 часов при -60 С, затем добавляли триэтиламин (2,168 мл, 15,55 ммоль) и через 10 мин добавляли 10 мл воды. Реакционной смеси давали нагреться до комнатной температуры. Слои разделяли. рН Водного слоя доводили до 7 при помощи 1 М HCl и затем экстрагировали при помощи 20 мл дихлорметана. Объединенные органические слои промывали водой и насыщенным солевым раствором, затем сушили над MgSO, фильтровали и упаривали. Полученное масло очищали на колонке с диоксидом кремния с использованием для элюирования EtOAc, с получением трет-бутил 4-4 формилпиперидин-1-ил)метил)бензоата (550 мг, 1,722 ммоль, выход 55,4%) в виде желтого масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)9,67 (д, J=1,26 Гц, 1 Н), 7,96 (д, J=8,34 Гц, 2 Н), 7,38 (д, J=8,34 Гц, 2 Н),3,56 (с, 2 Н), 2,75-2,92 (м, 2 Н), 2,21-2,35 (м, 1 Н), 2,14 (т, J=10,48 Гц, 2 Н), 1,91 (дд, J=2,78, 13,14 Гц, 2 Н),1,65-1,81 (м, 2 Н), 1,58-1,64 (м, 9 Н); LC-MS Rt=0,69 мин; MS (ESI): 304,2 [М+Н]+, 322,2 [M+H2O]+, 336,6(50 мл) добавляли (1R,2S)-2-фенилциклопропанамин (3,53 г, 26,5 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 5 мин, затем охлаждали до комнатной температуры. Добавляли цианотригидроборат натрия (2,082 г, 33,1 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли воду (50 мл). Реакционную смесь концентрировали и добавляли 50 мл дихлорметана. Слои разделяли. Органические слои промывали 10% уксусной кислотой (50 мл). Слои разделяли и медленно добавляли 50 мл насыщенного солевого раствора, при этом происходило осаждение твердых частиц. Твердое вещество фильтровали и суспендировали в изопропаноле. Суспензию обрабатывали ультразвуком и фильтровали. трет-Бутил 4-4-1R,2S)-2 фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензоат (5,8 г, 13,65 ммоль, выход 61,8%) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4)8,07 (д, J=8,34 Гц, 2 Н), 7,70(м, 4 Н), 3,03 (дт, J=3,76, 7,39 Гц, 1 Н), 2,54-2,71 (м, 1 Н), 2,03-2,29 (м, 3 Н), 1,67-1,84 (м, 2 Н), 1,58-1,67 (м,10 Н), 1,40 (кв., J=6,82 Гц, 1 Н); LC-MS Rt=0,76 мин; MS (ESI): 421,4 [М+Н]+. Стадия 4. 4-4-1R,2S)-2-Фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойная кислота. Суспензию трет-бутил 4-4-1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил) бензоата (5,8 г, 13,79 ммоль) в HCL - 1 М (80 мл, 80 ммоль) нагревали до 89 С (внутренняя температура) в течение 2 ч. Раствор охлаждали до комнатной температуры и выдерживали на ледяной бане в течение 1 ч и затем фильтровали. 4-4-1R,2S)-2-Фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойную кислоту (3,8 г, 8,25 ммоль, выход 59,8%) выделяли в виде белого твердого вещества. 1H ЯМР(кв., J=6,82 Гц, 1 Н); LC-MS Rt=0,49 мин; MS (ESI): 365,3 [М+Н]+. Биохимический анализ на LSD-1 активность.LSD-1 люминесцентный анализ осуществляли в буфере, содержащем 25 мМ Tris, pH 7,5, 50 мМ хлорида калия, 0,02% термоденатурированного BSA, 2 мМ CHAPS и сверхчистую воду milliQ. Раствор фермента, содержащий 30 нМ LSD-1 (получен на месте) получали в этом буфере, а также раствор субстрата, содержащий 30 мкМ гистон Н 3K4 диметилированный пептид (H-ART[K-Ме 2]QTARKSTGGKAPRKQLAGG-OH, коммерческий источник). Два микролитра раствора фермента добавляли в каждую лунку белого 384-луночного планшета Greiner малого объема (cat 784075), содержащую 50 нл 100% DMSO разведения испытываемого соединения. Фермент и испытываемое соединение оставляли для их инкубирования вместе в течение 30 мин при комнатной температуре. Два микролитра смеси субстрата затем добавляли в каждую лунку планшета, чтобы инициировать реакцию. Планшеты покрывали крышкой, защищали от света и оставляли для их инкубирования в течение двух часов при комнатной температуре. Затем 4 мкл HyPerBlu пероксидного реагента для детекции люминесценции (Lumigen/Beckman Coulter, cat HPB-00005) добавляли в каждую лунку для гашения деметилазной реакции и генерирования пероксид-зависимого сигнала люминесценции. Планшеты затем инкубировали в течение 15-30 мин в темноте при комнатной температуре, затем их считывали для определения люминесценции с использованием Perkin Elmer Viewlux планшет-ридера. Процент ингибирования рассчитывали на основании контролей без соединения и без фермента и затем строили кривые ингибирования для определенияPIC50 значений. Биохимический анализ на МАО-В активность МАО-В FLINT анализ осуществляли в буфере, содержащем 50 мМ фосфата калия, рН 7,4, в сверхчистой воде milliQ. Раствор фермента, содержащий 0,23 МЕд./мл МАО-В (Gentest-BD Biosciences, cat 456284) и 2 МЕд./мл пероксидазы хрена типа XII (SigmaAldrich, cat P8415) получали в этом буфере, а также раствор субстрата, содержащий 200 мкМ бензиламина (Sigma Aldrich, cat B-5136) и 100 мкМ amplex красного (Molecular Probes-Invitrogen, cat A-12222). Пять микролитров раствора фермента добавляли в каждую лунку черного 384-луночного планшетаGreiner малого объема (cat 784076), содержащую 100 нл 100% DMSO разведения испытываемого соединения. Фермент и испытываемое соединение оставляли для их инкубирования вместе в течение 30 мин при комнатной температуре. Пять микролитров смеси субстрата затем добавляли в каждую лунку планшета, чтобы инициировать реакцию. Планшеты покрывали крышкой, защищали от света и оставляли для их инкубирования в течение одного часа при комнатной температуре. Через 60 мин планшеты считывали на флуоресценцию резоруфина (ЕХ:525; ЕМ:598) с использованием Perkin Elmer Viewlux планшет-ридера. Процент ингибирования рассчитывали на основании контролей без соединения и без фермента и затем строили кривые ингибирования для определения PIC50 значений. Биохимические данные Соединение по настоящему изобретению было испытано в соответствии с описанными выше анализами, и было обнаружено, что оно является ингибитором LSD1. Было обнаружено также, что соединение по настоящему изобретению является селективным ингибитором LSD1. Среднее значение PIC50 для соединения по настоящему изобретению из нескольких испытаний представлено в таблице ниже. или его фармацевтически приемлемая соль. 2. Соединение, представляющее собой 4-4-1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензойную кислоту формулы 3. Фармацевтическая композиция для лечения рака, содержащая соединение или его фармацевтически приемлемую соль по п.1 и фармацевтически приемлемый эксципиент. 4. Фармацевтическая композиция для лечения рака, содержащая соединение по п.2 и фармацевтически приемлемый эксципиент.
МПК / Метки
МПК: A61K 31/445
Метки: качестве, циклопропиламин, замещенный, ингибитора
Код ссылки
<a href="https://eas.patents.su/19-23143-zameshhennyjj-ciklopropilamin-v-kachestve-ingibitora-lsd1.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенный циклопропиламин в качестве ингибитора lsd1</a>
Предыдущий патент: Способ получения слаборастворимого соединения кальция с мышьяком
Следующий патент: Аминные и диаминные соединения и их применение для обратной пенной флотации силиката из железной руды
Случайный патент: Ингибиторы акт и p70 s6-киназы












