Производные арилпиразинона в качестве стимуляторов секреции инсулина, способы их получения и их применение для лечения диабета
Номер патента: 22345
Опубликовано: 30.12.2015
Авторы: Шарон Кристине, Эльбаваб Самер, Валё Эрик, Кергоат Мишлине, Боттон Жерар
Формула / Реферат
1. Соединение общей формулы (I)
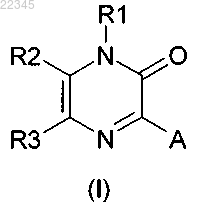
в которой R1 выбирают из этила, пропила, изопропила, бутила, втор-бутила, трет-бутила, пентила, гексила, октила, деканила, додеканила, гексадецила, октадецила, этенила, 2-пропенила, 2-бутенила, 3-бутенила, 2-пентенила, 3-пентенила, алкинила, циклоалкила, циклоалкилалкила, каждая из этих групп необязательно может быть замещена одним или несколькими заместителями, выбранными из Y;
R2 представляет собой водород;
R3 представляет собой водород;
А выбирают из арила, гетероарила, где арильные и гетероарильные группы необязательно могут быть замещены одним или несколькими заместителями, выбранными из Y;
Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси;
R2 и R3 вместе могут образовывать цикл, который соответствует общей формуле (II)
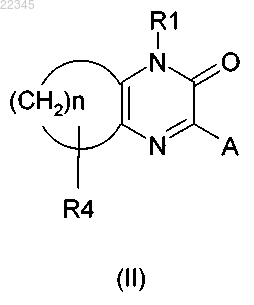
в которой R1 и А имеют значения, указанные выше;
n = 3, 4, 5;
R4 представляет собой водород;
где следующие термины определены со следующими значениями:
термин "арил" относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и по меньшей мере одно кольцо, имеющее конъюгированную пи (p) электронную систему, и включают биарильные группы;
термин "гетероарил" относится к ароматическим гетероциклам с 5-14 кольцевыми атомами, содержащими 1-3 гетероатома, в качестве кольцевых атомов в ароматическом кольце, а остальными кольцевыми атомами являются атомы углерода, где гетероатомами являются О, N;
термин "циклоалкил" обозначает насыщенные карбоциклические кольца и включает моно-, би- и трициклические соединения с 3-10 атомами углерода;
термин "алкил" относится к насыщенным алифатическим группам, включающим группы с неразветвленной цепью и группы с разветвленной цепью, содержащие от 1 до 20 атомов углерода;
термин "алкинил" относится к ненасыщенным группам, содержащим по меньшей мере одну углерод-углеродную тройную связь и включает неразветвленные, разветвленные и циклические группы, содержащие от 2 до 20 атомов углерода;
термин "алкокси" относится к группе alk-O-, где "alk" представляет собой алкильную группу;
термин "алкилсульфонил" относится к алкил-SO2- группе;
термин "циклоалкилалкил" относится к алкильной группе, замещенной циклоалкильной группой;
термин "галоген" относится к атому фтора, брома или хлора;
а также его рацемические формы, таутомеры и их фармацевтически приемлемые соли.
2. Соединение по п.1, в котором
R1 выбирают из этила, пропила, изопропила, бутила, втор-бутила, трет-бутила, пентила, гексила, октила, деканила, додеканила, гексадецила, октадецила, циклоалкила, циклоалкилалкила; каждая из этих групп необязательно может быть замещена одним или несколькими заместителями, выбранными из галогена, гидрокси;
R2 представляет собой водород;
R3 представляет собой водород;
А выбирают из арила, гетероарила; где арильные и гетероарильные группы необязательно могут быть замещены одним или несколькими заместителями, выбранными из Y;
Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси;
R2 и R3 вместе могут образовывать цикл, который соответствует общей формуле (II)
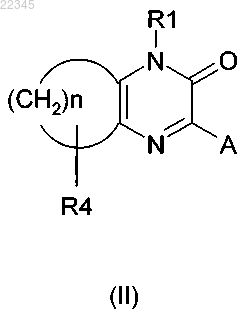
в которой R1 и А имеют значения, указанные выше;
n = 3, 4, 5;
R4 представляет собой водород;
а также его рацемические формы, таутомеры и их фармацевтически приемлемые соли.
3. Соединение по любому из пп.1 или 2, где R1 представляет собой этил, пропил, изопропил, бутил; втор-бутил, трет-бутил, циклопропил, циклопропилметил.
4. Соединение по любому из пп.1-3, где R2 и R3 представляют собой водород или образуют цикл, который соответствует тетрагидрохиноксалин-2(1Н)-ону.
5. Соединение по любому из пп.1-4, где А представляет собой фенил; который необязательно может быть замещен одной или несколькими группами, выбранными из Y, как определено в п.1.
6. Соединение по любому из пп.1-5, где Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси.
7. Соединение по любому из предыдущих пунктов, выбранное из следующих соединений:
1-циклопропил-3-фенилпиразин-2(1H)-он;
1-(циклопропилметил)-3-фенилпиразин-2(1H)-он;
1-этил-3-(4-фторфенил)пиразин-2(1Н)-он;
1-этил-3-(4-метоксифенил)пиразин-2(1H)-он;
1-этил-3-(4-метилфенил)пиразин-2(1H)-он;
1-этил-3-(5-фтор-2-метоксифенил)пиразин-2(1Н)-он;
1-этил-3-[4-(метилсульфонил)фенил]пиразин-2(1H)-он;
1-этил-3-[4-(трифторметокси)фенил]пиразин-2(1Н)-он;
1-этил-3-[4-(трифторметил)фенил]пиразин-2(1H)-он;
1-этил-3-фенилпиразин-2(1Н)-он;
1-этил-3-(1Н-индол-5-ил)пиразин-2(1H)-он;
1-этил-3-(1Н-индол-6-ил)пиразин-2(1H)-он;
1-этил-3-хинолин-6-илпиразин-2(1Н)-он;
1-изопропил-3-фенилпиразин-2(1Н)-он;
1-бутил-3-фенилпиразин-2(1H)-он;
1-изобутил-3-фенилпиразин-2(1H)-он;
3-(1,3-бензодиоксол-5-ил)-1-этилпиразин-2(1H)-он;
3-(2-этоксифенил)-1-этилпиразин-2(1H)-он;
3-(4-хлорфенил)-1-(циклопропилметил)пиразин-2(1H)-он;
3-(4-хлорфенил)-1-этил-5,6,7,8-тетрагидрохиноксалин-2(1H)-он;
3-(4-хлорфенил)-1-этилпиразин-2(1H)-он;
3-(4-хлорфенил)-1-изобутилпиразин-2(1H)-он;
3-(4-трет-бутилфенил)-1-этилпиразин-2(1H)-он;
3-фенил-1-пропилпиразин-2(1H)-он;
4-(4-этил-3-оксо-3,4-дигидропиразин-2-ил)бензойная кислота,
а также их рацемические формы, таутомеры и их фармацевтически приемлемые соли.
8. Способ получения соединений общей формулы (I) по любому из предыдущих пунктов, который включает:
а) взаимодействие соединения формулы (1)
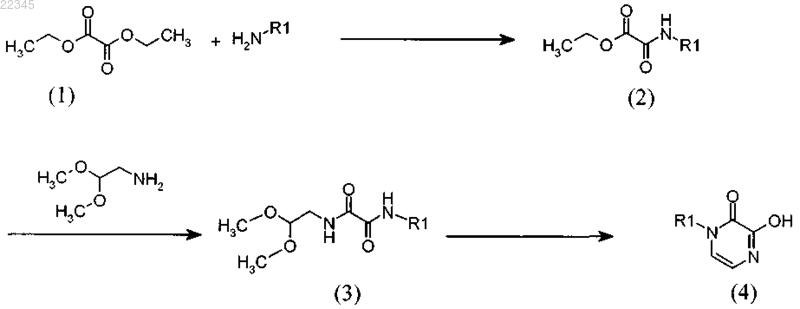
с амином R1-NH2, где R1 имеет значения, указанные в п.1, в присутствии четвертичной аммониевой соли, в инертном растворителе, с получением соединения формулы (2);
взаимодействие соединения формулы (2) с защищенным аминоацетальдегид диалкилацетатом в спирте, с получением соединения формулы (3);
циклизацию соединения формулы (3) в кислых условиях в растворителе и каталитическом количестве концентрированной соляной кислоты, с получением соединения формулы (4);
b) бромирование соединения формулы (4), где R1 имеет значения, указанные в п.1, используя бромирующее средство, в инертном растворителе, с получением соединения формулы (5)
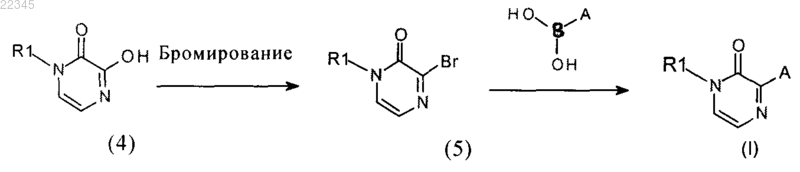
с) взаимодействие соединения формулы (5) с бороновыми кислотами или сложными эфирами бороновых кислот, где А имеет значения, указанные в п.1, в присутствии основания и катализатора, в инертном растворителе, с получением соединения формулы (I), а также их рацемических форм, таутомеров и их фармацевтически приемлемых солей.
9. Способ получения соединений общей формулы (I) по любому из предыдущих пунктов, который включает
защиту функциональной аминогруппы производных аминокислот формулы (7), где А имеет значения, указанные в п.1
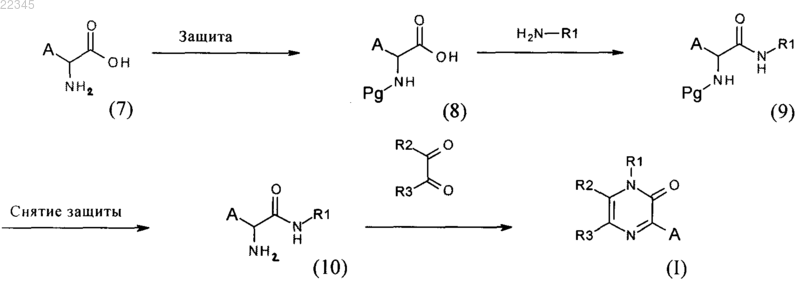
с защитной группой функциональной аминогруппы, Pg, с получением соединения формулы (8);
взаимодействие соединения формулы (8) с амином R1-NH2, где R1 имеет значения, указанные в п.1, в присутствии связующего средства или путем получения in situ смешанного ангидрида, в присутствии третичного амина, в органическом растворителе, с получением амида формулы (9);
снятие защиты с функциональной аминогруппы соединений формулы (9), с помощью органической кислоты или минеральной кислоты, или путем каталитического гидрирования, в растворителе, с получением соединения формулы (10);
циклизацию соединения формулы (10) с производными 1,2-дикарбонила или производными циклического 1,2-диона, необязательно замещенного, где R2 и R3 имеют значения, указанные в п.1, в растворителе, в присутствии минерального основания, с получением соединения формулы (I), а также их рацемических форм, таутомеров и их фармацевтически приемлемых солей.
10. Фармацевтическая композиция, обладающая активностью в качестве стимуляторов секреции инсулина, содержащая, по меньшей мере, соединение общей формулы (I) и/или его фармацевтически приемлемую соль по пп.1-7 и фармацевтически приемлемый наполнитель.
11. Применение соединения общей формулы (I), где R1, R2, R3 и А имеют значения, указанные в п.1, а также его рацемических форм, таутомеров и их фармацевтически пригодных солей, для приготовления лекарственного средства для предотвращения и/или лечения патологий, связанных с гипергликемией, для индуцирования секреции инсулина в ответ на повышение концентрации глюкозы, для лечения вызванных диабетом заболеваний, выбранных из микрососудистых и макрососудистых осложнений, для уменьшения гипергликемии, для лечения дислипидемии, ожирения или сердечно-сосудистых заболеваний.
12. Лекарственное средство, включающее по меньшей мере одно соединение общей формулы (I), где R1, R2, R3 и А имеют значения, указанные в п.1, а также его рацемические формы, таутомеры и их фармацевтически пригодные соли, для предотвращения и/или лечения патологий, связанных с гипергликемией, для индуцирования секреции инсулина в ответ на повышение концентрации глюкозы, для лечения вызванных диабетом заболеваний, выбранных из микрососудистых и макрососудистых осложнений, для уменьшения гипергликемии, для лечения дислипидемии, ожирения или сердечно-сосудистых заболеваний.
Текст
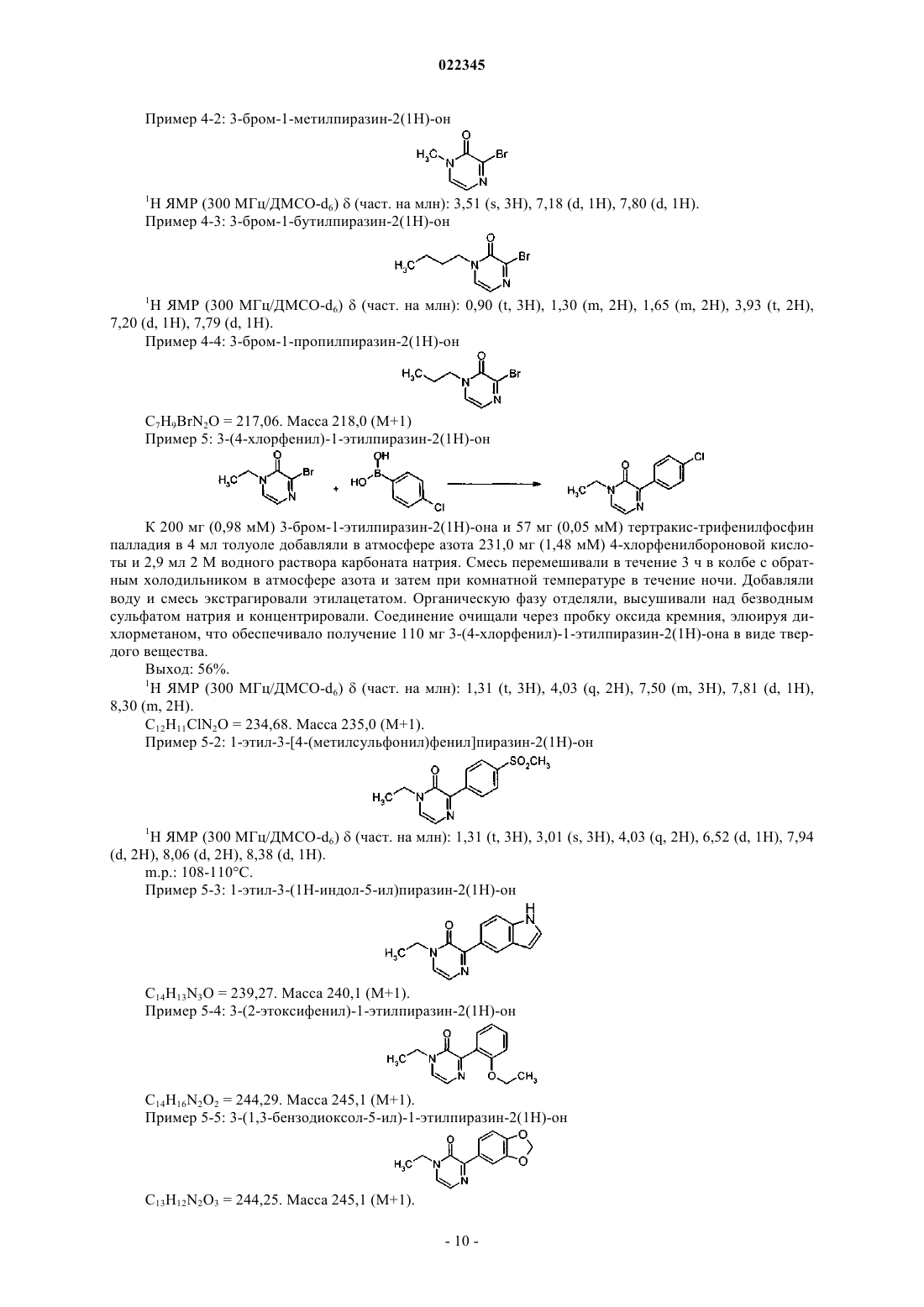
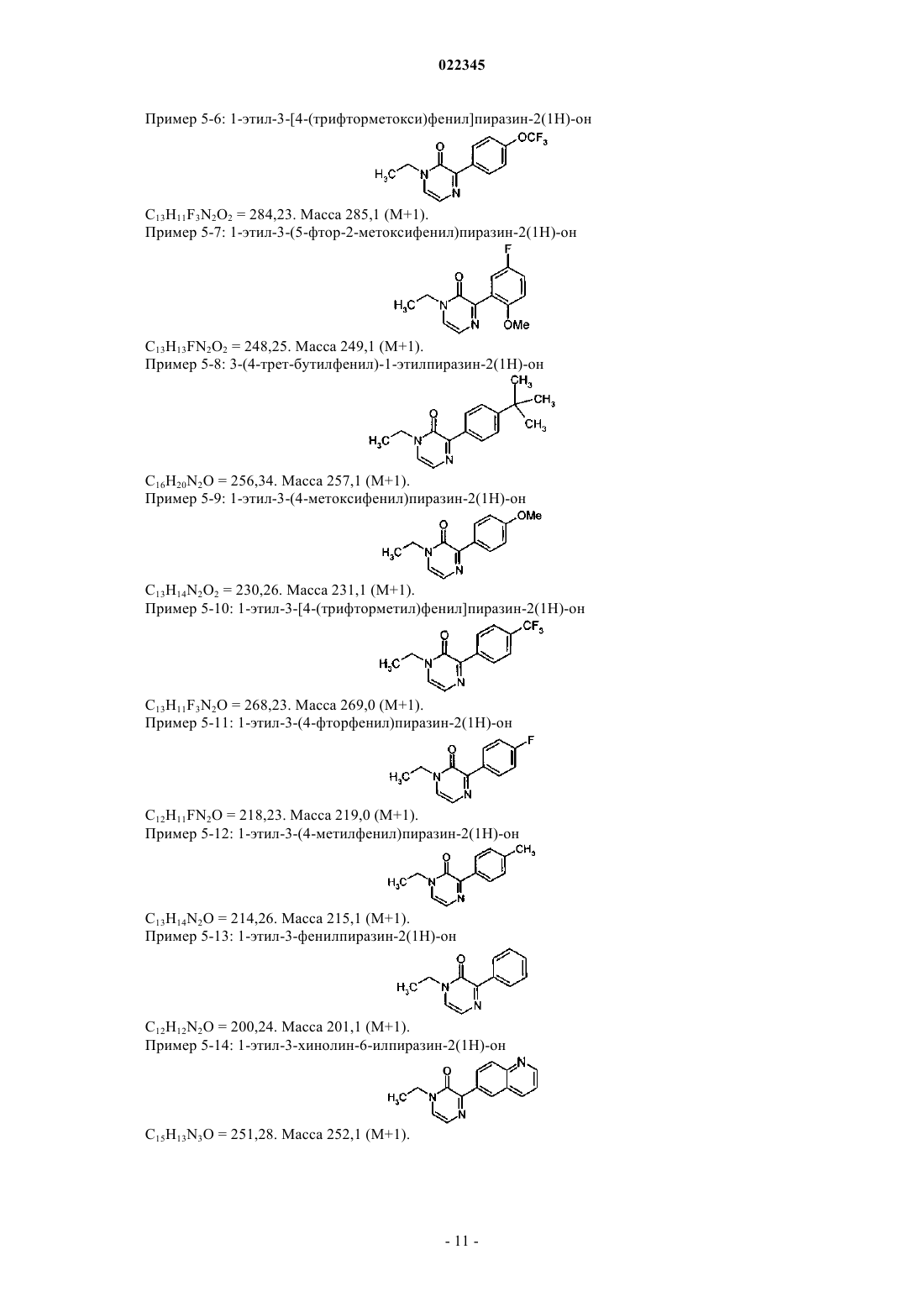
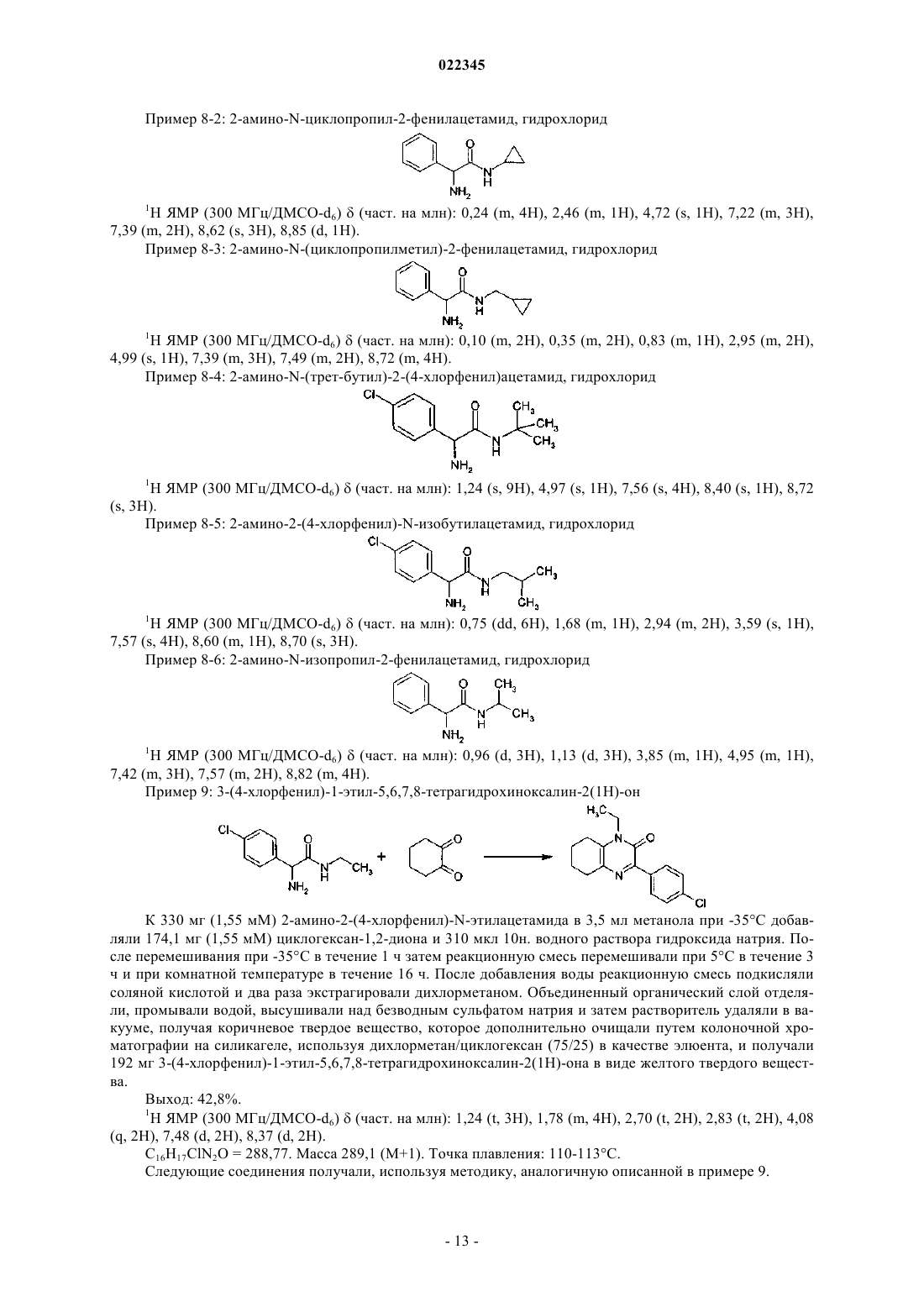
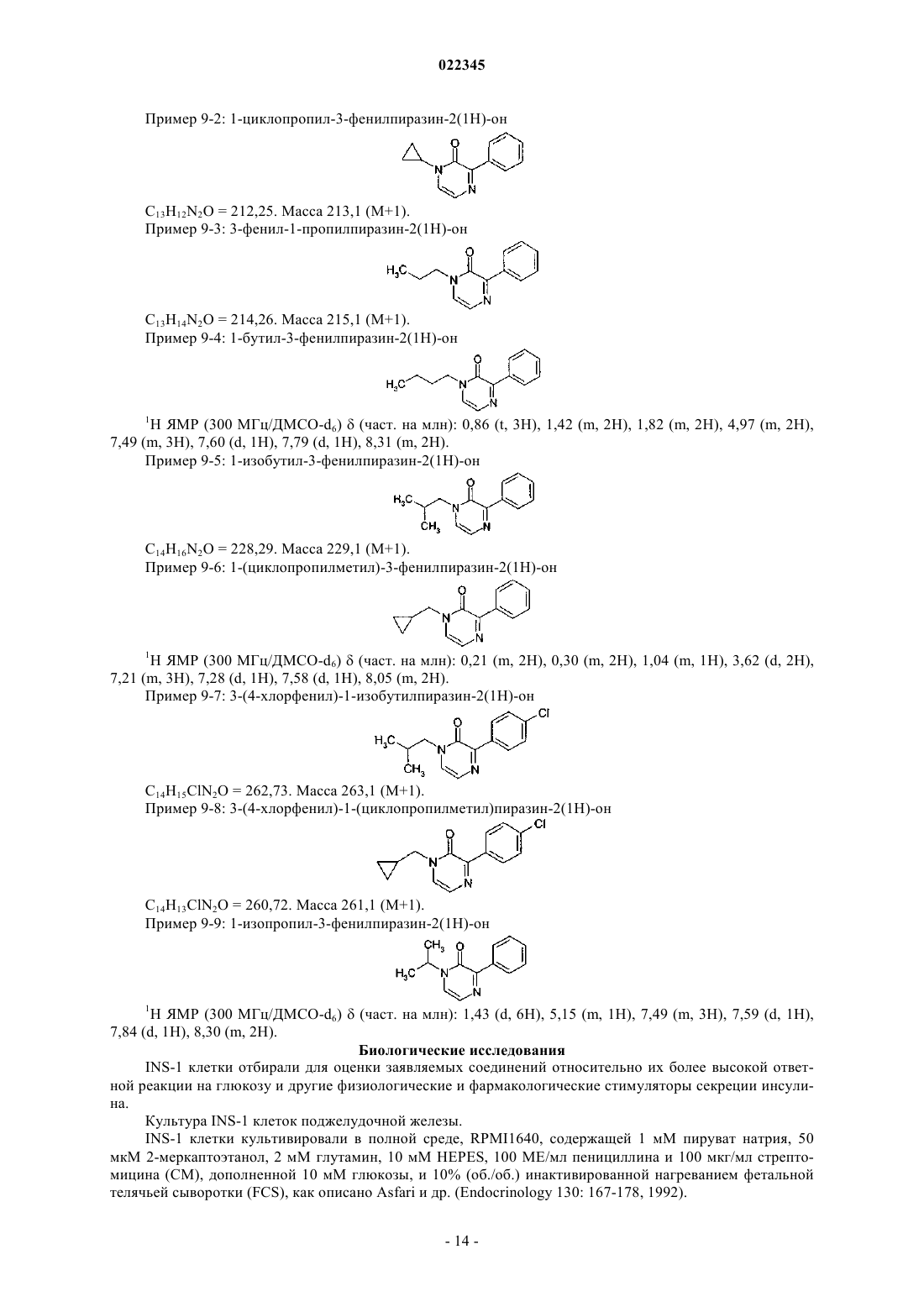
ПРОИЗВОДНЫЕ АРИЛПИРАЗИНОНА В КАЧЕСТВЕ СТИМУЛЯТОРОВ СЕКРЕЦИИ ИНСУЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА Настоящее изобретение относится к производным арилпиразинона формулы (I) где R1, R2, R3 и А имеют значения, указанные в п.1, в качестве стимуляторов секреции инсулина. Изобретение также относится к получению и применению этих производных пиразинона для профилактики и/или лечения диабета и связанных патологий.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Область техники, к которой относится изобретение Настоящее изобретение относится к производным арилпиразинона формулы (I) в качестве стимуляторов секреции инсулина. Изобретение также относится к получению и применению этих производных пиразинона для профилактики и/или лечения диабета и связанных патологий. Предпосылки создания изобретения Сахарный диабет 2 типа является одним из наиболее типичных заболеваний во всем мире. В 2007 году его распространение оценивалось на уровне 5,9% (246 млн людей) взрослого населения и оно непрерывно повышается. Это заболевание становится еще более тяжелым, поскольку оно может приводить к серьезным микро- и макроосложнениям, которые могут приводить к инвалидности или летальному исходу, так как диабет является основным фактором риска для сердечно-сосудистых заболеваний и удара. Диабет 2 типа характеризуется гипергликемией натощак и после приема пищи, в результате двух основных дефектов: резистентности к инсулину на уровни тканей-мишеней и измененной секреции инсулина бета-клетками поджелудочной железы. Эта последняя аномалия, вероятно, появляется очень рано, так как она уже присутствует на стадии нарушения толерантности к глюкозе (IGT) (Mitrakou и др., N.Engl. J. Med. 326: 22-29, 1992). Это наблюдали при осуществлении Британского перспективного исследования сахарного диабета (UKPDS) и было показано, что 50% функции бета-клеток уже нарушена при постановке диагноза диабет, что свидетельствует о том, что истощение функции бета-клеток начинается за 10-12 лет до диагностирования диабета (Holman, Diabetes Res. Clin. Pract. 40: S21, 1998 or UKPDSGroup, Diabetes 44: 1249-58, 1995). Недостаточная секреция инсулина обусловливается количественной и качественной недостаточностью бета-клеток, т.е. снижением массы бета-клеток и специфичной недостаточностью секреции инсулина в ответ на глюкозу, в особенности первой фазы секреции, так как ответ на неглюкозные стимуляторы секреции сохраняется (Pfeifer и др., Am. J. Med. 70: 579-88, 1981). Важность восстановления нормального профиля высвобождения инсулина в ответ на глюкозу для поддержания гликемического контроля в нормальном диапазоне подтверждается исследования на недиабетических добровольцах, для которых показано, что задержка первой фазы секреции инсулина в ответ на глюкозу приводит к непереносимости глюкозы (Calles-Escandon и др., Diabetes 36: 1167-72, 1987). Известно, что пероральные противодиабетические средства, доступные для лечения пациентов с диабетом 2, такие как сульфонилмочевины или глиниды, индуцируют секрецию инсулина, путем связывания рецептора сульфонимочевины на K-ATP каналах бета-клеток, что приводит к повышению внутриклеточного содержания кальция и экзоцитозу инсулина. Таким образом, такое высвобождение инсулина полностью зависит от уровня глюкозы в плазме крови и лечение этими молекулами обычно вызывает устойчивую гиперинсулинемию, которая может приводить к тяжелым побочным действия, таким как тяжелая гипогликемия, увеличение веса тела, и увеличения риска сердечно-сосудистых заболеваний. Дополнительно, пролонгированная гиперинсулинемия, наблюдаемая при лечении с помощью сульфонилмочевин, при отсутствии стабилизирующего действия на массу бета-клеток, может приводить к вторичной недостаточности вследствие истощения бета-клеток, другому вредному побочному действия этих соединений. Новое лечение диабета 2 типа должно восстанавливать нормальный профиль высвобождения инсулина, в особенности в ответ на глюкозу, при этом сохраняя или повышая массу бета-клеток. Это наблюдается с GLP-1 аналогами, такими как эксенатид или лираглутид, но эти молекулы являются пептидами и должны вводиться парентеральным путем. Такие характеристики для новой пероральной небольшой молекулы должны являться большим преимуществом по сравнению с другими противодиабетическими лекарственными средствами. В соответствии с настоящим изобретением соединения формулы (I) являются стимуляторами секреции инсулина, пригодными для лечения диабета и связанных патологий. Они снижают концентрацию глюкозы в плазме путем восстановления недостаточной индуцируемой глюкозой секреции инсулина у диабетиков 2 типа. В патентной заявке US 2007082913 описаны соединения пиперидинилпиперазина для лечения заболеваний, опосредованных хемокином, таких как воспалительные заболевания, аутоиммунные заболевания, отторжение трансплантата, инфекционные заболевания (например, туберкулоидная лепра), стойкая лекарственная эритема, кожные реакции при гиперчувствительности замедленного типа, диабет I типа,вирусный менингит и опухоли. В патентной заявке WO 2004099161 описаны пиразиноны в качестве антагонистов рецептора высвобождения кортикотропина (CRF1) для лечения ЦНС и других заболеваний, в особенности нарушений,связанных с тревожностью, и аффективных расстройств. В патенте JP 63301874 описаны хиноксалины, которые проявляются ингибирующую активность на альдоз-редуктазу и эффективны для лечения осложнений диабета, таких как дефекты заживления ран роговицы, катаракта, заболевания нервной системы, заболевание клеточных мембран или заболевания почек. Сущность изобретения Настоящее изобретение относится к производным арилпиразинона формулы (I). Указанные производные являются пригодными для лечения диабета и связанных с ним патологий. Производные арилпиразинона в соответствии с изобретением имеют следующую формулу (I): в которой R1 выбирают из этила, пропила, изопропила, бутила, втор-бутила, трет-бутила, пентила,гексила, октила, деканила, додеканила, гексадецила, октадецила, этенила, 2-пропенила, 2-бутенила, 3 бутенила, 2-пентенила, 3-пентенила, алкинила, циклоалкила, циклоалкилалкила, каждая из этих групп необязательно может быть замещена одним или несколькими заместителями, выбранными из Y;R3 представляет собой водород; А выбирают из арила, гетероарила, где арильные и гетероарильные группы необязательно могут быть замещены одним или несколькими заместителями, выбранными из Y;Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси;R2 и R3 вместе могут образовывать цикл, который соответствует общей формуле (II)R4 представляет собой водород; а также их рацемические формы, таутомеры и их фармацевтически приемлемые соли. В другом предпочтительном варианте осуществления изобретение обеспечивает производные арилпиразинона формулы (I), в которой R1 выбирают из этила, пропила, изопропила, бутила, вторбутила, трет-бутила, пентила, гексила, октила, деканила, додеканила, гексадецила, октадецила, циклоалкила, циклоалкилалкила; каждая из этих групп необязательно может быть замещена одним или несколькими заместителями, выбранными из галогена, гидрокси;R3 представляет собой водород; А выбирают из арила, гетероарила; где арильные и гетероарилыные группы необязательно могут быть замещены одним или несколькими заместителями, выбранными из Y;Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси;R2 и R3 вместе могут образовывать цикл, который соответствует общей формуле (II)R4 представляет собой водород; а также их рацемические формы, таутомеры и их фармацевтически приемлемые соли. Другими предпочтительными соединениями являются соединения общей формулы (I), где когда А представляет собой фенильную группу, то фенильная группа не замещена в пара-положении фенильной группой, необязательно замещенной. Соединения формулы (I) могут быть выбраны из следующих соединений: а также их рацемические формы, таутомеры и их фармацевтически приемлемые соли. Изобретение также относится к рацемическим формам, таутомерным формам, энантиомерам, диастереоизомерам, эпимерам и органическим или минеральным солям соединений общей формулы (I), а также к их кристаллическим формам, включая их полиморфные формы и полиморфные формы соединений формулы (I). Настоящее изобретение относится не только к рацемическим смесям этих соединений, а также к их отдельным стереоизомерам и/или диастереоизомерам, как таковым или в виде их смесей во всех соотношениях. Соединения в соответствии с изобретением формулы (I), как определено выше, содержащие достаточно кислотную функциональную группу или достаточно основную функциональную группу, или обе группы, могут включать соответствующие фармацевтически приемлемые соли органической или минеральной кислоты, или органического или минерального основания. Выражение "фармацевтически приемлемые соли" относится к относительно нетоксичным минеральным солям, солям присоединения органических кислот и солям присоединения оснований, соединений согласно настоящему изобретению. Эти соли могут быть приготовлены in situ при конечном выделении и очистке соединений. В частности, соли присоединения кислот могут быть получены путем раздельного взаимодействия очищенного соединения в его очищенной форме с органической или минеральной кислотой и выделения таким образом образованной соли. Полученные соли представляют собой, например, гидрохлориды,гидробромиды, сульфаты, гидросульфаты, дигидрофосфаты, цитраты, малеаты, фумараты, трифторацетаты, 2-нафталинсульфонаты, пара-толуолсульфонаты. Изобретение также относится к фармацевтически приемлемым солям с органическими или неорганическими основаниями. В частности, соли присоединения оснований могут быть получены путем раздельного взаимодействия очищенного соединения в его очищенной форме с органическим или неорганическим основанием и выделения таким образом полученной соли. Полученные соли представляют собой, например, соли металлов, в особенности соли щелочных металлов, соли щелочно-земельных металлов и соли переходных металлов (таких как натрий, калий, кальций, магний, алюминий), или соли,полученные с основаниями, такими как аммиак или вторичные или третичные амины (такие как диэтиламин, триэтиламин, пиперидин, пиперазин, морфолин), или с основными аминокислотами, или с осаминами (такими как меглумин), или с аминоспиртами (такими как 3-аминобутанол и 2-аминоэтанол). Изобретение также относится к солям, используемым для хирального разделения рацематов. В качестве примеров можно использовать следующие хиральные кислоты: (+)-D-ди-Обензоилвинная кислота, (-)-L-ди-О-бензоилвинная кислота, (-)-L-ди-О,О'-п-толуил-L-винная кислота, (+)D-ди-О,О'-п-толуил-L-винная кислота, (R)-(+)-яблочная кислота, (S)-(-)-яблочная кислота, (+)-камфорная кислота, (-)-камфорная кислота, R-(-)1,1'-бинафталин-2,2'-диил гидрогенофосфиновая, (+)-камфановая кислота, (-)-камфановая кислота, (S)-(+)-2-фенилпропионовая кислота, (R)-(+)-2-фенилпропионовая кислота, D-(-)-миндальная кислота, L-(+)-миндальная кислота, D-винная кислота, L-винная кислота или любая их смесь. В качестве примеров можно использовать следующие хиральные амины: хинин, бруцин,(S)-1-(бензилоксиметил)пропиламин (III), (-)-эфедрин, (4S,5R)-(+)-1,2,2,3,4-тетраметил-5-фенил-1,3 оксазолидин, (R)-1-фенил-2-п-толилэтиламин, (S)-фенилглицинол, (-)-N-метилеэфедрин, (+)-(2S,3R)-4 диметиламино-3-метил-1,2-дифенил-2-бутанол, (S)-фенилглицинол, (S)метилбензиламин или любая их смесь. Также объемом настоящего изобретения охватываются пролекарства соединений формулы (I). Термин "пролекарство", как используется в настоящем изобретении, относится к любому соединению, которое при введении в биологическую систему образует "лекарственную" субстанцию (биологически активное соединение) в результате самопроизвольной(ых) химической(их) реакции(й), и/или метаболической(их) химической(их) реакции(й). В соответствии с настоящим изобретением и как используется в настоящем изобретении, следующие термины определены со следующими значениями, если специально не указано иначе. Термин "арил" относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и по меньшей мере одно кольцо, имеющее конъюгированную пиэлектронную систему, и включают биарильные группы, все из них необязательно могут быть замещены. Подходящими арильными группами являются фенил, нафтил, бифенил, антрил, фенантрил, инденил и др. Термин "гетероарил" относится к ароматическим гетероциклам с 5-14 кольцевыми атомами, содержащими 1-4 гетероатома, в качестве кольцевых атомов в ароматическом кольце, а остальными кольцевыми атомами являются атомы углерода. Подходящими гетероатомами являются О, S, N. Подходящими гетероарильными группами являются фуранил, бензофуранил, тиенил, пиридил, пиридил-N-оксид, пиримидинил, пиразинил, оксазолил, тиазолил, изоксазолил, хинолинил, триазолил, пиридазинил, пирролил, имидазолил, индазолил, изотиазолил, индолил, оксадиазолил и др. Термин "циклоалкил" обозначает насыщенные карбоциклические кольца, необязательно замещенные, и включает моно-, би- и трициклические соединения с 3-10 атомами углерода. Подходящими циклоалкильными группами являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил,циклооктил, циклодецил, адамантил и др. Термин "гетероциклоалкил" относится к необязательно замещенным моноциклическим, бициклическим или трициклическим радикалам, содержащим один или несколько гетероатомов, предпочтительно выбранных из О, S и N, необязательно в окисленном состоянии (для S и N), и необязательно одну или несколько двойных связей. По меньшей мере одно из колец предпочтительно содержит от 1 до 4 эндоциклических колец, более предпочтительно от 1 до 3 гетероатомов. Наиболее предпочтительно гетероциклоалкильный (или просто "гетероциклический" или "гетероцикл") радикал содержит одно или несколько колец, каждое из которых имеет от 5 до 8 узловых структур. Примерами гетероциклических радикалов являются морфолинил, пиперидинил, пиперазинил, тиазолидинил, оксазолидинил, тетрагидротиенил, дигидрофуранил, тетрагидрофуранил, пиразолидинил, 1,3-диоксоланил, пирролидинил, пиранил,дигидропиранил, изоксазолидинил, имидазолил, имидазолидинил и др. Термин "алкил" относится к насыщенным алифатическим группам, включающим группы с неразветвленной цепью и группы с разветвленной цепью. Подходящими алкильными группами, содержащими от 1 до 20 атомов углерода, являются такие группы, как метил, этил, пропил, изопропил, бутил, вторбутил, трет-бутил, пентил, гексил, октил, деканоил, додеканоил, гексадецил, октадецил и др. Термин "алкенил" относится к ненасыщенными группам, содержащим по меньшей мере одну углерод-углеродную двойную связь, и включает неразветвленные, разветвленные и циклические группы. Подходящие алкенильные группы, содержащие 2-20 атомов углерода, включают этенил, 2-пропенил, 2 бутенил, 3-бутенил, 2-пентенил, 3-пентенил, 4-пентенил и др. Термин "алкинил" относится к ненасыщенным группам, содержащим по меньшей мере одну углерод-углеродную тройную связь, и включает неразветвленные, разветвленные и циклические группы; и необязательно включает по меньшей мере одну углерод-углеродную двойную связь. Подходящими алкинильными группами, содержащими от 2 до 20 атомов углерода, являются этинил, 2-пропинил, 2 бутинил, 3-бутинил, 2-пентинил, 3-пентинил, 4-пентинил и др. Термин "арилалкил" относится к алкильной группе, предпочтительно алкильной группе, содержащей от 1 до 20 атомов углерода, замещенной арильной группой. Подходящие арилалкильные группы включают бензил, пиколил и др. Термин "арилалкенил" относится к алкенильной группе, предпочтительно алкенильной группе, содержащей от 1 до 20 атомов углерода, замещенной арильной группой. Термин "арилалкинил" относится к алкинильной группе, предпочтительно алкинильной группе, содержащей от 1 до 20 атомов углерода, замещенной арильной группой. Термин "алкокси" относится к группе alk-O-, где "alk" представляет собой алкильную группу. Термин "арилокси" относится к группе арил-О-. Термин "арилоксиалкил" относится к алкильной группе, замещенной арилоксигруппой. Термин "арилалкоксиалкил" относится к алкильной группе, замещенной арилалкоксигруппой. Термин "арилалкокси" относится к группе арил-Alk-O-, где "Alk" представляет собой алкильную группу. Термин "арилтиоалкил" относится к алкильной группе, замещенной арилтиогруппой. Термин "алкилсульфинил" относится к алкил-SO- группе. Термин "алкилсульфонил" относится к алкил-SO2- группе. Термин "арилсульфонилалкил" относится к алкильной группе, замещенной арилсульфонил (арилSO2-) группой. Термин "арилалкилтиоалкил" относится к алкильной группе, замещенной арилалкилтио. Термин "гетероарилалкил" относится к алкильной группе, замещенной гетероарильной группой. Термин "гетероарилоксиалкил" относится к алкильной группе, замещенной гетероарилоксигруппой. Термин "гетероарилалкоксиалкил" относится к алкильной группе, замещенной гетероарилалкоксигруппой. Термин "гетероарилтиоалкил" относится к алкильной группе, замещенной гетероарилтиогруппой. Термин "гетероарилалкилтиоалкил" относится к алкильной группе, замещенной гетероарилалкилтиогруппой. Термин "гетероциклоалкилалкил" относится к алкильной группе, замещенной гетероциклоалкильной группой. Термин "гетероциклоалкилоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилоксигруппой. Термин "гетероциклоалкилалкоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилалкоксигруппой. Термин "гетероциклоалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилтиогруппой. Термин "гетероциклоалкилалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилалкилтиогруппой. Термин "циклоалкилалкил" относится к алкильной группе, замещенной циклоалкильной группой. Термин "циклоалкилоксиалкил" относится к алкильной группе, замещенной циклоалкилоксигруппой. Термин "циклоалкилалкоксиалкил" относится к алкильной группе, замещенной циклоалкилалкоксигруппой. Термин "алкилтио" относится к группе алкил-S-. Термин "циклоалкилтио" относится к группе циклоалкил-S-. Термин "циклоалкилтиоалкил" относится к алкильной группе, замещенной циклоалкилтиогруппой. Термин "циклоалкилалкилтиоалкил" относится к алкильной группе, замещенной циклоалкилалкилтиогруппой. Термин "галоген" относится к атому фтора, брома или хлора. Термин "амидино" относится к -C(NR5)-NR5R6, где R5R6 имеют значения, указанные выше, все, за исключением галогена, необязательно замещены. Термин "карбамоил" относится к незамещенной аминокарбонильной группе. Соединения в соответствии с изобретением согласно формуле (I) проявляют гипогликемическое действие, и пригодны для лечения патологий, связанных с синдромом резистентности к инсулину. Резистентность к инсулину характеризуется уменьшением действия инсулина (ср. "Presse Medicale",(1997), 26(14), 671-677) и она вовлечена во многие патологические состояния, такие как диабет и в особенности инсулиннезависимый диабет (диабет II или NIDDM), дислипидемия, ожирения, артериальную гипертонию, а также определенные сердечные, микросудистые и макрососудистые осложнения, например атеросклероз, ретинопатию и невропатию. В этом отношении можно привести ссылку, например, наDiabetes, 37, (1988), 1595-1607; Journal of Diabetes and its complications, 12, (1998), 110-119; Horm. Res.,38, (1992), 28-32. Изобретение также относится к фармацевтической композиции, содержащей в качестве активного компонента по меньшей мере одно соединение формулы (I), как определено выше, и/или его фармацевтически приемлемую соль, в комбинации с одним или несколькими фармацевтически приемлемыми носителями, адъювантами, разбавителями или наполнителями. Для специалиста в данной области техники известны различные типы таких носителей, адъювантов, разбавителей или наполнителей для приготовления фармацевтической композиции. Фармацевтические композиции согласно настоящему изобретению могут вводиться различными путями, включая пероральный, парентеральный, внутривенный, внутримышечный, ректальный, через слизистые или через кожу. Следовательно, они могут быть представлены в виде растворов для инъекций или суспензий или флаконов с несколькими дозами, в виде простых или покрытых оболочкой таблеток,таблеток с сахарным покрытием, облаток, гелевых капсул, пилюлей, саше, порошков, суппозиториев или ректальных капсул, растворов или суспензий, для чрескожного применения в полярном растворителе,или для применения через слизистые. Наполнители, которые пригодны для таких введений, представляют собой фармацевтически приемлемые наполнители, такие как производные целлюлозы или микрокристаллической целлюлозы, карбонаты щелочно-земельных металлов, фосфат магния, крахмалы, модифицированные крахмалы, лактоза и др. для твердых форм. Для ректального применения предпочтительными наполнителями являются масло какао или полиэтилен гликоль стеараты. Для парентерального применения наиболее подходяще в качестве наполнителей используются водные растворы, физиологический солевой раствор и изотонические растворы. Например, в случае перорального введения, например, в форме гранул, таблеток или таблеток с оболочкой, пилюль, капсул, гелевых капсул, гелей, саше или порошков, подходящая дозировка соединения находится в интервале от приблизительно 0,1 до приблизительно 100 мг/кг, предпочтительно от приблизительно 0,5 до приблизительно 50 мг/кг, более предпочтительно от приблизительно 1 до приблизительно 10 мг/кг и наиболее предпочтительно от приблизительно 2 до приблизительно 5 мг/кг веса тела в сутки. Если за типичный вес тела принимается интервал от 10 до 100 кг, то для иллюстрации суточного перорального интервала дозирования, который может использоваться и как описано выше, подходящие дозировки соединений формулы (I) будут находиться в интервале от приблизительно 1-10 и 1000-10000 мг/сутки, предпочтительно от приблизительно 5-50 и 500-5000 мг/сутки, более предпочтительно от 10100 до 100-1000 мг/сутки и наиболее предпочтительно от 20-200 до 50-500 мг/сутки. Тем не менее, подразумевается, что специфический уровень доз для любого конкретного пациента будет зависеть от различных факторов, включая активность конкретного применяемого соединения; возраст, вес тела, общее состояние здоровья, пол и питание индивидуума, подлежащего лечению; времени и пути введения; скорости выведения; других лекарственных средств, которые вводились ранее; и тяжести конкретного заболевания, подвергаемого лечению, и это является хорошо известным для квалифицированного специалиста в данной области техники. Как отмечалось выше, препараты согласно настоящему изобретению, пригодные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, саше или таблетки,каждая из которые содержит заранее установленное количество активного компонента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный компонент также может вводиться в виде болюса, электуария или пасты. При инсулиннезависимом диабете у людей гипергликемия приводит к двум основным недостаткам: изменение секреции инсулина и уменьшение эффективности инсулина на уровни трех его известных сайтов в печени, мышцах и жировой ткани. Настоящее изобретение также относится к соединению общей формулы (I), a также его рацемическим формам, таутомерам, энантиомерам, диастереомерам, эпимерам и полиморфам, и их смесям, и их фармацевтически приемлемым солям, для приготовления лекарственного средства для предотвращения и/или лечения патологий, связанных с гипергликемией; для приготовления лекарственного средства, которое индуцирует секрецию инсулина в ответ на повышение концентрации глюкозы, предпочтительно для лечения диабета, более предпочтительно для предотвращения и/или лечения диабета II типа и патологий, связанных с нарушениями метаболизма, гиперхолестеринемии, гиперлипидемии, которые повышаются посредством гиперинсулинемии и гипергликемии; для лечения диабета, выбранного из диабета,связанного с микрососудистыми и макрососудистыми осложнениями, такими как артериальная гипертония, воспалительный процесс, микроангиопатия, макроангиопатия, ретинопатия и невропатия; для уменьшения гипергликемии, для лечения дислипидемии и ожирения; или заболеваний, таких как сердечно-сосудистые заболевания, включая атеросклероз, ишемию миокарда. Настоящее изобретение также относится к применению, по меньшей мере, соединения общей формулы (I), а также его рацемических форм, таутомеров, энантиомеров, диастереомеров, эпимеров и полиморфов, и их смесей, и их фармацевтически пригодных солей, и пролекарств, для приготовления лекарственного средства для предотвращения и/или лечения патологий, связанных с гипергликемией, предпочтительно для лечения диабета, более предпочтительно для предотвращения и/или лечения диабета II типа и патологий, связанных с нарушениями метаболизма, гиперхолестеринемии, гиперлипидемии, которые повышаются посредством гиперинсулинемии и гипергликемии; для лечения диабета, выбранного из диабета, связанного с микрососудистыми и макрососудистыми осложнениями, таких как артериальная гипертония, воспалительный процесс, микроангиопатия, макроангиопатия, ретинопатия и невропатия; для уменьшения гипергликемии, для лечения дислипидемии и ожирения; или заболеваний, таких как сердечно-сосудистые заболевания, включая атеросклероз, ишемию миокарда. Изобретение также относится к способу получения соединений формулы (I), как определено выше,в соответствии со следующими типичными методами, представленными на схеме 1 (получение промежуточных соединений); схеме 2 (получение производных арилпиразинона, метод А) или схеме 3 (получение производных арилпиразинона, метод В). Следующие схемы представлены для иллюстративных целей и исключительно для целей облегче-6 022345 ния представления. Не вызывает сомнений, что, в зависимости от природы получаемых соединений формулы (I), представленные методологии могут адаптироваться квалифицированным специалистом в данной области техники путем выбора подходящих исходных веществ, где может быть модифицирована природа заместителей R1, R2 и R3, в особенности в зависимости от природы и длины желательной цепи. Соединения, пригодные в соответствии с изобретением, могут быть приготовлены, если специально не указано иначе, путем применения или адаптации известных методов, которые обозначают методы, используемые ранее или описанные в литературе, патентах или патентных заявках, в Chemical Abstracts и в интернете. Приготовление промежуточных соединений. Схема 1 где R1 имеет значения, как указано выше в формуле (I). Соединения (2) получают путем взаимодействия диэтилоксалата (1) с амином в присутствии четвертичной аммониевой соли, такой как аликват 336, в инертном растворителе, таком как хлороформ, толуол или дихлорметан, при температуре в интервале от 20 С и до температуры флегмы в течение 24-100 ч. Промежуточные соединения (3) с боковой цепью, содержащие защищенный альдегид в форме ацеталя, получают путем взаимодействия соединений формулы (2) с защищенным аминоацетальдегид диалкил-ацетатом, таким как (2,2-диметоксиэтил)амин. Реакцию осуществляют в растворителе, таком как спирт, например 2-пропанол, при температуре в интервале от 20 С до температуры флегмы в течение 124 ч. Пиразиноны (4) могут быть получены путем циклизации соединения (3) в кислых условиях, например в растворителе, таком как уксусная кислота, и каталитическом количестве концентрированной соляной кислоты, при температуре в интервале от 20 С до температуры флегмы в течение 1-24 ч. Получение производных арилпиразинона. Схема 2 Метод А где R1 и А имеют значения, указанные в формуле (I). 3-Бром пиразиноны (5) получают путем бромирования соответствующих 3-гидроксипиразинонов(4), используя бромирующее средство, такое как POBr3, в инертном растворителе, таком как 1,2 дихлорэтан, при температуре в интервале от 20 С и до температуры флегмы, более предпочтительно при температуре флегмы, в течение 1-24 ч. Арил пиразиноны (I) получают путем взаимодействия 3-бромпиразинонов (5) с подходящими бороновыми кислотами или сложными эфирами (циклическими или нет) бороновых кислот в присутствии основания, такого как карбонат натрия или карбонат калия, и катализатора, такого как хлорид бис(трифенилфосфин)палладия (II), в инертном растворителе, таком как диметилформамид или толуол, при температуре в интервале от 20 С и до температуры флегмы, более предпочтительно при температуре флегмы в течение 1-24 ч. где R1, R2, R3 и А имеют значения, как определено в формуле (I). Производное аминокислоты защищают с помощью известных методов.Pg представляют собой известные защитные группы, используемые для защиты аминов. Функциональные аминогруппы производных аминокислот (7) защищают с помощью методов, известных в данной области техники. В этих формулах Pg представляет собой защитную группу функциональной аминогруппы, такую как группы, описанные в Т.W. Greene, Protective groups in OrganicSynthesis, J. Wiley-Interscience Publication (1991), предпочтительно трет-бутоксикарбонильный радикал или бензилоксикарбонильный (Cbz) радикал. Например, аминокислота (7) может быть защищена, используя ди-трет-бутилдикарбонат, с получением соединений (8), в которых Pg представляет собой трет-бутоксикарбонильный радикал. Амиды (9) получают при реакции соединений (8) с выбранными аминами. Для активации карбоновых кислот можно использовать связующие средства, такие как 1-гидроксибензотриазол (HOBt) или бензотриазол-1-ил-окситрипирролидино фосфония гексафтор фосфат (РуВОР). Карбонилдиимидазол (CDI) или дициклогексилкарбодиимид (DCC) также можно использовать в качестве связующих средств. Амиды (9) также могут быть приготовлены непосредственно из соответствующих карбоновых кислот (8) путем получения in situ смешанного ангидрида. Реакцию сочетания обычно осуществляют в присутствии третичного амина, такого как N-метилморфолин (NMM), триэтиламин (TEA) или диизопропилэтиламин (DIPEA), в органическом растворителе, выбранном из тех растворителей, которые обычно используются для получения амида. Предпочтительными растворителями для реакции сочетания являются этилацетат (AcOEt), диметилформамид (ДМФА), N-метилпирролидон (NMP) или тетрагидрофуран(ТГФ). Смешанный альдегид получают, например, путем обработки соединений (8) с изобутил хлорформиатом в присутствии 4-метилморфолина при реакции с аминами, получая (9). Реакцию можно осуществлять в растворителе, таком как тетрагидрофуран, при температуре в интервале от -50 до 0 С, в течение 1-6 ч. Соединения (10) получают из соединения (9), используя методы снятия защиты, известные специалисту в данной области техники и в особенности методы, описанные Т.W. Greene, Protective groups inOrganic Synthesis, J. Wiley-Interscience Publication (1991). Снятие защиты с ВОС-защищенных аминов можно осуществлять с помощью органической кислоты, такой как трифторуксусная кислота (CF3COOH),или минеральной кислоты, такой как соляная кислота (HCl). Например, с функциональной аминогруппы (9) защита может быть снята с помощью соляной кислоты в диоксане, при температуре от 0 С до температуры флегмы, предпочтительно при комнатной температуре. Реакции снятия защиты также осуществляют с помощью каталитического гидрирования. Соединения (I) получают путем взаимодействия соединений (10) с производными 1,2-дикарбонила,таким как оксальальдегид, или производными циклического 1,2-диона, такими как циклогексан-1,2-дион или циклопентан-1,2-дион, необязательно замещенный. Циклизацию можно осуществлять в растворителе, таком как метанол, в присутствии минерального основания, такого как гидроксид натрия, при температуре в интервале от -50 до 0 С, в течение 1-10 ч, предпочтительно в интервале от -40 до -20 С. Последующие примеры иллюстрируют изобретение, однако никоим образом его не ограничивают. Используемые исходные вещества представляют известные продукты или продукты, полученные в соответствии с известными методиками. Проценты представлены на основе веса, если специально не указано иначе. Соединения характеризовали, в частности, с помощью следующих аналитических методик. Спектры ЯМР получали, используя спектрометр Bruker Avance DPX 300 МГц ЯМР. Массы определяли с помощью ВЭЖХ, связанной с масс-детектором Agilent серии 1100 Масса. Точки плавления (Тпл.) измеряли на блоке Stuart Scientific. К 135,8 мл (1000 мМ) диэтилоксалата и 1 г аликвата 336 в 1000 мл дихлорметана добавляли 64 мл(1000 мМ) этиламина при 70% в воде. Реакционную смесь перемешивали при комнатной температуре в течение 72 ч. Реакционную смесь высушивали над безводным сульфатом натрия и растворитель удаляли в вакууме, получая масло, которое дополнительно очищали путем колоночной хроматографии на силикагеле, используя дихлорметан/диметилкетон (95/5) в качестве элюента, получая 59,9 г этил(этиламино)(оксо)ацетата в виде масла. Выход: 41,3%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,06 (t, 3H), 1,28 (t, 3H), 3,17 (m, 2H), 4,22 (q, 2H), 8,92 59,9 г (412,6 мМ) этил(этиламино)(оксо)ацетата и 45 мл (412,6 мМ) (2,2-диметоксиэтил)амина в 480 мл 2-пропанола перемешивали при комнатной температуре в течение 16 ч. Белый осадок фильтровали,промывали 2-пропанолом и высушивали в вакууме, получая 67,8 г N-(2,2-диметоксиэтил)-N'этилэтандиамида. Выход: 80,5%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,07 (t, 3H), 3,15 (m, 2 Н), 3,27 (m, 8 Н), 4,51 (m, 1 Н),8,62 (m, 1 Н), 8,81 (m, 1 Н). Пример 3: 1-этил-3-гидроксипиразин-2(1 Н)-он 67,5 г (330 мМ) N-(2,2-диметоксиэтил)-N'-этилэтандиамида и 2 мл концентрированной соляной кислоты, в 390 мл уксусной кислоты, нагревали в колбе с обратным холодильником при перемешивании в течение 1 ч. Растворитель удаляли в вакууме, получая масло, которое дополнительно очищали путем колоночной хроматографии на силикагеле, используя дихлорметан/метанол (95/5) в качестве элюента, и получали 37 г 1-этил-3-гидрокси пиразин-2(1H)-она в виде масла. Выход: 79,5%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,20 (t, 3H), 3,73 (q, 2 Н), 6,34 (d, 1 Н), 6,56 (d, 1H),11,22 (s, 1H). Метод А. Пример 4: 3-бром-1-этилпиразин-2(1 Н)-он 10,5 г (75 мМ) 1-этил-3-гидроксипиразин-2(1 Н)-она и 23,1 г (80,5 мМ) оксибромида фосфора в 75 мл дихлорэтана нагревали в колбе с обратным холодильником при перемешивании в течение 2 ч. Затем реакционную смесь нейтрализовали до рН 7-8 с помощью насыщенного водного раствора карбоната натрия, при этом температуру поддерживали при 10 С. Затем реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и органическую фазу экстрагировали дихлорметаном. Объединенный органический слой промывали водой, высушивали над безводным сульфатом натрия и растворитель удаляли в вакууме. Соединение дополнительно очищали путем колоночной хроматографии на силикагеле, используя дихлорметан в качестве элюента, и получали 6,1 г 3-бром-1-этилпиразин-2(1 Н)она в виде твердого вещества. Выход: 40,2%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,18 (t, 3H), 3,87 (q, 2H), 7,13 (d, 1 Н), 7,75 (d, 1H). Следующие соединения получали, используя методику, аналогичную описанной в примере 4. К 200 мг (0,98 мМ) 3-бром-1-этилпиразин-2(1H)-она и 57 мг (0,05 мМ) тертракис-трифенилфосфин палладия в 4 мл толуоле добавляли в атмосфере азота 231,0 мг (1,48 мМ) 4-хлорфенилбороновой кислоты и 2,9 мл 2 М водного раствора карбоната натрия. Смесь перемешивали в течение 3 ч в колбе с обратным холодильником в атмосфере азота и затем при комнатной температуре в течение ночи. Добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу отделяли, высушивали над безводным сульфатом натрия и концентрировали. Соединение очищали через пробку оксида кремния, элюируя дихлорметаном, что обеспечивало получение 110 мг 3-(4-хлорфенил)-1-этилпиразин-2(1 Н)-она в виде твердого вещества. Выход: 56%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,31 (t, 3H), 4,03 (q, 2 Н), 7,50 (m, 3H), 7,81 (d, 1 Н),8,30 (m, 2 Н). К 25 г (134,6 мМ) амино(4-хлорфенил)уксусной в 270 мл 1 н. водного раствора гидроксида натрия добавляли 34 г (156 мМ) ди-трет-бутилдикарбоната. Смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь два раза экстрагировали этилацетатом. Объединенный органический слой промывали водой и высушивали над безводным сульфатом натрия. Растворитель удаляли в вакууме, получая 34,3 г [(трет-бутоксикарбонил)амино](4-хлорфенил)уксусной кислоты в виде желтого маслянистого соединения. Выход: 89,2%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,40 (s, 9H), 5,14 (d, 1H), 7,42 (m, 4 Н), 7,62 (d, 1H). Пример 7: трет-бутил 1-(4-хлорфенил)-2-(этиламино)-2-оксоэтилкарбамат К 1,1 г (3,85 мМ) [(трет-бутоксикарбонил)амино](4-хлорфенил)уксусной кислоты в 10 мл тетрагидрофурана добавляли при перемешивании при -25 С 0,5 мл (4,6 мМ) 4-метилморфолина и 0,52 мл (4,0 мМ) изобутил хлорформиата. Затем, через 10 мин добавляли при -25 С при перемешивании 1,9 мл (3,85 мМ) этиламина 2 М в тетрагидрофуране. Реакционную смесь перемешивали при -25 С в течение 1 ч и при комнатной температуре в течение 16 ч. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме, получая масло, которое дополнительно очищали путем колоночной хроматографии на силикагеле, используя дихлорметан/циклогексан (75/25) в качестве элюента, получая 520 мг трет-бутил 1(4-хлорфенил)-2-(этиламино)-2-оксоэтилкарбамата в виде белого твердого вещества. Выход: 43%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 0,99 (t, 3H), 1,39 (s, 9H), 3,08 (m, 2 Н), 5,14 (d, 1H),7,35 (d, 1H), 7,42 (s, 4H), 8,19 (t, 1H). Пример 8: 2-амино-2-(4-хлорфенил)-N-этилацетамид Раствор 516 мг (1,65 мМ) трет-бутил 1-(4-хлорфенил)-2-(этиламино)-2-оксоэтилкарбамата в 2 мл раствора 4 н. соляная кислота-диоксан перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь нейтрализовали с помощью водного раствора гидрокарбоната натрия и экстрагировали два раза этилацетатом. Объединенный органический слой промывали водой и высушивали над безводным сульфатом натрия. Растворитель удаляли в вакууме, получая 350 мг 2-амино-2-(4-хлорфенил)-Nэтилацетамида в виде масла. Выход: 99,8%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,01 (t, 3H), 2,27 (s, 2H), 3,08 (m, 2 Н), 4,32 (s, 1 Н), 4,32 К 330 мг (1,55 мМ) 2-амино-2-(4-хлорфенил)-N-этилацетамида в 3,5 мл метанола при -35 С добавляли 174,1 мг (1,55 мМ) циклогексан-1,2-диона и 310 мкл 10 н. водного раствора гидроксида натрия. После перемешивания при -35 С в течение 1 ч затем реакционную смесь перемешивали при 5 С в течение 3 ч и при комнатной температуре в течение 16 ч. После добавления воды реакционную смесь подкисляли соляной кислотой и два раза экстрагировали дихлорметаном. Объединенный органический слой отделяли, промывали водой, высушивали над безводным сульфатом натрия и затем растворитель удаляли в вакууме, получая коричневое твердое вещество, которое дополнительно очищали путем колоночной хроматографии на силикагеле, используя дихлорметан/циклогексан (75/25) в качестве элюента, и получали 192 мг 3-(4-хлорфенил)-1-этил-5,6,7,8-тетрагидрохиноксалин-2(1 Н)-она в виде желтого твердого вещества. Выход: 42,8%. 1 Н ЯМР (300 МГц/ДМСО-d6)(част. на млн): 1,24 (t, 3H), 1,78 (m, 4H), 2,70 (t, 2 Н), 2,83 (t, 2H), 4,08INS-1 клетки отбирали для оценки заявляемых соединений относительно их более высокой ответной реакции на глюкозу и другие физиологические и фармакологические стимуляторы секреции инсулина. Культура INS-1 клеток поджелудочной железы.INS-1 клетки культивировали в полной среде, RPMI1640, содержащей 1 мМ пируват натрия, 50 мкМ 2-меркаптоэтанол, 2 мМ глутамин, 10 мМ HEPES, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина (СМ), дополненной 10 мМ глюкозы, и 10% (об./об.) инактивированной нагреванием фетальной телячьей сыворотки (FCS), как описано Asfari и др. (Endocrinology 130: 167-178, 1992).INS-1 высевали и культивировали в планшетах на 48 лунок. После культивирования в течение 2 дней среду удаляли и клетки культивировали в течение 24 ч со средой, замененной на 5 мМ глюкозы, 1%FCS. Затем клетки промывали с Кребс-Рингер бикарбонат HEPES буфером (KRBH; 135 мМ NaCl; 3,6 мМKCl; 5 нМ NaHCO3; 0,5 нМ NaH2PO4; 0,5 мМ MgCl2; 1,5 мМ CaCl2 и 10 мМ HEPES; рН 7,4) 0,1% BSA,содержащей 2,8 мМ глюкозы и предварительно инкубировали в течение 30 мин при 37 С в том же буфере. Затем клетки промывали два раза и инкубировали в течение 1 ч в KRBH 0,1% BSA, содержащей 4,2 мМ глюкозы и различные концентрации тестируемой молекулы. Концентрации инсулина в собранных супернатантах измеряли с помощью ELISA, используя антитела к инсулину крыс (Insulin Rat Elit PLUS,ссылка каталога 10-1145-01). Результаты секреции инсулина выражали в виде % контроля (глюкоза 4,2 мМ). Секреция инсулина в INS-1 клетках (концентрация глюкозы 4,2 мМ) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) в которой R1 выбирают из этила, пропила, изопропила, бутила, втор-бутила, трет-бутила, пентила,гексила, октила, деканила, додеканила, гексадецила, октадецила, этенила, 2-пропенила, 2-бутенила, 3 бутенила, 2-пентенила, 3-пентенила, алкинила, циклоалкила, циклоалкилалкила, каждая из этих групп необязательно может быть замещена одним или несколькими заместителями, выбранными из Y;R3 представляет собой водород; А выбирают из арила, гетероарила, где арильные и гетероарильные группы необязательно могут быть замещены одним или несколькими заместителями, выбранными из Y;Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси;R2 и R3 вместе могут образовывать цикл, который соответствует общей формуле (II)R4 представляет собой водород; где следующие термины определены со следующими значениями: термин "арил" относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и по меньшей мере одно кольцо, имеющее конъюгированную пиэлектронную систему, и включают биарильные группы; термин "гетероарил" относится к ароматическим гетероциклам с 5-14 кольцевыми атомами, содержащими 1-3 гетероатома, в качестве кольцевых атомов в ароматическом кольце, а остальными кольцевыми атомами являются атомы углерода, где гетероатомами являются О, N; термин "циклоалкил" обозначает насыщенные карбоциклические кольца и включает моно-, би- и трициклические соединения с 3-10 атомами углерода; термин "алкил" относится к насыщенным алифатическим группам, включающим группы с неразветвленной цепью и группы с разветвленной цепью, содержащие от 1 до 20 атомов углерода; термин "алкинил" относится к ненасыщенным группам, содержащим по меньшей мере одну углерод-углеродную тройную связь и включает неразветвленные, разветвленные и циклические группы, содержащие от 2 до 20 атомов углерода; термин "алкокси" относится к группе alk-O-, где "alk" представляет собой алкильную группу; термин "алкилсульфонил" относится к алкил-SO2- группе; термин "циклоалкилалкил" относится к алкильной группе, замещенной циклоалкильной группой; термин "галоген" относится к атому фтора, брома или хлора; а также его рацемические формы, таутомеры и их фармацевтически приемлемые соли. 2. Соединение по п.1, в которомR1 выбирают из этила, пропила, изопропила, бутила, втор-бутила, трет-бутила, пентила, гексила,октила, деканила, додеканила, гексадецила, октадецила, циклоалкила, циклоалкилалкила; каждая из этих групп необязательно может быть замещена одним или несколькими заместителями, выбранными из галогена, гидрокси;R3 представляет собой водород; А выбирают из арила, гетероарила; где арильные и гетероарильные группы необязательно могут быть замещены одним или несколькими заместителями, выбранными из Y;Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси;R2 и R3 вместе могут образовывать цикл, который соответствует общей формуле (II)R4 представляет собой водород; а также его рацемические формы, таутомеры и их фармацевтически приемлемые соли. 3. Соединение по любому из пп.1 или 2, где R1 представляет собой этил, пропил, изопропил, бутил; втор-бутил, трет-бутил, циклопропил, циклопропилметил. 4. Соединение по любому из пп.1-3, где R2 и R3 представляют собой водород или образуют цикл,который соответствует тетрагидрохиноксалин-2(1 Н)-ону. 5. Соединение по любому из пп.1-4, где А представляет собой фенил; который необязательно может быть замещен одной или несколькими группами, выбранными из Y, как определено в п.1. 6. Соединение по любому из пп.1-5, где Y представляет собой галоген, трифторметокси, трифторметил, карбокси, алкил, алкокси, алкилсульфонил, две Y группы могут образовывать метилендиокси. 7. Соединение по любому из предыдущих пунктов, выбранное из следующих соединений: 1-циклопропил-3-фенилпиразин-2(1H)-он; 1-(циклопропилметил)-3-фенилпиразин-2(1H)-он; 1-этил-3-(4-фторфенил)пиразин-2(1 Н)-он; 1-этил-3-(4-метоксифенил)пиразин-2(1H)-он; 1-этил-3-(4-метилфенил)пиразин-2(1H)-он; 1-этил-3-(5-фтор-2-метоксифенил)пиразин-2(1 Н)-он; 1-этил-3-[4-(метилсульфонил)фенил]пиразин-2(1H)-он; 1-этил-3-[4-(трифторметокси)фенил]пиразин-2(1 Н)-он; 1-этил-3-[4-(трифторметил)фенил]пиразин-2(1H)-он; 1-этил-3-фенилпиразин-2(1 Н)-он; 1-этил-3-(1 Н-индол-5-ил)пиразин-2(1H)-он; 1-этил-3-(1 Н-индол-6-ил)пиразин-2(1H)-он; 1-этил-3-хинолин-6-илпиразин-2(1 Н)-он; 1-изопропил-3-фенилпиразин-2(1 Н)-он; 1-бутил-3-фенилпиразин-2(1H)-он; 1-изобутил-3-фенилпиразин-2(1H)-он; 3-(1,3-бензодиоксол-5-ил)-1-этилпиразин-2(1H)-он; 3-(2-этоксифенил)-1-этилпиразин-2(1H)-он; 3-(4-хлорфенил)-1-(циклопропилметил)пиразин-2(1H)-он; 3-(4-хлорфенил)-1-этил-5,6,7,8-тетрагидрохиноксалин-2(1H)-он; 3-(4-хлорфенил)-1-этилпиразин-2(1H)-он; 3-(4-хлорфенил)-1-изобутилпиразин-2(1H)-он; 3-(4-трет-бутилфенил)-1-этилпиразин-2(1H)-он; 3-фенил-1-пропилпиразин-2(1H)-он; 4-(4-этил-3-оксо-3,4-дигидропиразин-2-ил)бензойная кислота,а также их рацемические формы, таутомеры и их фармацевтически приемлемые соли. 8. Способ получения соединений общей формулы (I) по любому из предыдущих пунктов, который включает: а) взаимодействие соединения формулы (1) с амином R1-NH2, где R1 имеет значения, указанные в п.1, в присутствии четвертичной аммониевой соли, в инертном растворителе, с получением соединения формулы (2); взаимодействие соединения формулы (2) с защищенным аминоацетальдегид диалкилацетатом в спирте, с получением соединения формулы (3); циклизацию соединения формулы (3) в кислых условиях в растворителе и каталитическом количестве концентрированной соляной кислоты, с получением соединения формулы (4);b) бромирование соединения формулы (4), где R1 имеет значения, указанные в п.1, используя бромирующее средство, в инертном растворителе, с получением соединения формулы (5) с) взаимодействие соединения формулы (5) с бороновыми кислотами или сложными эфирами бороновых кислот, где А имеет значения, указанные в п.1, в присутствии основания и катализатора, в инертном растворителе, с получением соединения формулы (I), а также их рацемических форм, таутомеров и их фармацевтически приемлемых солей. 9. Способ получения соединений общей формулы (I) по любому из предыдущих пунктов, который включает защиту функциональной аминогруппы производных аминокислот формулы (7), где А имеет значения, указанные в п.1 с защитной группой функциональной аминогруппы, Pg, с получением соединения формулы (8); взаимодействие соединения формулы (8) с амином R1-NH2, где R1 имеет значения, указанные в п.1,в присутствии связующего средства или путем получения in situ смешанного ангидрида, в присутствии третичного амина, в органическом растворителе, с получением амида формулы (9); снятие защиты с функциональной аминогруппы соединений формулы (9), с помощью органической кислоты или минеральной кислоты, или путем каталитического гидрирования, в растворителе, с получением соединения формулы (10); циклизацию соединения формулы (10) с производными 1,2-дикарбонила или производными циклического 1,2-диона, необязательно замещенного, где R2 и R3 имеют значения, указанные в п.1, в растворителе, в присутствии минерального основания, с получением соединения формулы (I), а также их рацемических форм, таутомеров и их фармацевтически приемлемых солей. 10. Фармацевтическая композиция, обладающая активностью в качестве стимуляторов секреции инсулина, содержащая, по меньшей мере, соединение общей формулы (I) и/или его фармацевтически приемлемую соль по пп.1-7 и фармацевтически приемлемый наполнитель. 11. Применение соединения общей формулы (I), где R1, R2, R3 и А имеют значения, указанные в п.1, а также его рацемических форм, таутомеров и их фармацевтически пригодных солей, для приготовления лекарственного средства для предотвращения и/или лечения патологий, связанных с гипергликемией, для индуцирования секреции инсулина в ответ на повышение концентрации глюкозы, для лечения вызванных диабетом заболеваний, выбранных из микрососудистых и макрососудистых осложнений, для уменьшения гипергликемии, для лечения дислипидемии, ожирения или сердечно-сосудистых заболеваний. 12. Лекарственное средство, включающее по меньшей мере одно соединение общей формулы (I),где R1, R2, R3 и А имеют значения, указанные в п.1, а также его рацемические формы, таутомеры и их фармацевтически пригодные соли, для предотвращения и/или лечения патологий, связанных с гипергликемией, для индуцирования секреции инсулина в ответ на повышение концентрации глюкозы, для лечения вызванных диабетом заболеваний, выбранных из микрососудистых и макрососудистых осложнений,для уменьшения гипергликемии, для лечения дислипидемии, ожирения или сердечно-сосудистых заболеваний.
МПК / Метки
МПК: C07D 405/04, C07D 241/38, C07D 241/18, C07D 403/04, C07D 401/04
Метки: арилпиразинона, секреции, получения, диабета, применение, производные, инсулина, стимуляторов, лечения, качестве, способы
Код ссылки
<a href="https://eas.patents.su/19-22345-proizvodnye-arilpirazinona-v-kachestve-stimulyatorov-sekrecii-insulina-sposoby-ih-polucheniya-i-ih-primenenie-dlya-lecheniya-diabeta.html" rel="bookmark" title="База патентов Евразийского Союза">Производные арилпиразинона в качестве стимуляторов секреции инсулина, способы их получения и их применение для лечения диабета</a>
Предыдущий патент: Антибактериальные хинолиновые производные
Следующий патент: Способ получения экстракта ginkgo biloba, экстракт, полученный этим способом, и его применение
Случайный патент: Интравагинальные устройства с жесткой подложкой, способы их получения и применения