Индолсульфонильные защищенные соединения и способ их получения
Номер патента: 22476
Опубликовано: 29.01.2016
Авторы: Альварес Доминго Мерседес, Жиро Маттьё, Исидро Льобет Альберт, Альберисио Фернандо
Формула / Реферат
1. Соединение, содержащее по меньшей мере один фрагмент формулы (III), где формула (III) определена следующим образом:
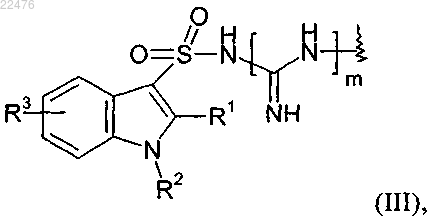
где R1 обозначает водород, С1-С6алкил, С1-С6алкоксигруппу или С1-С6алкилтиогруппу; R2 обозначает С1-С6алкил, С1-С6алкоксигруппу или С1-С6алкилтиогруппу; или R1 и R2 вместе образуют фрагмент формулы
-(CH2)n-, где n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С1-С6алкил, С1-С6алкоксигруппу, С1-С6алкилтиогруппу, фенил или бензил и m обозначает 0 или 1;
где указанное соединение представляет собой:
(а) олигопептид, содержащий от двух до пятнадцати аминокислотных остатков, или полипептид, содержащий от шестнадцати до примерно пятидесяти аминокислотных остатков;
(б) аминокислоту;
(в) олигопептид, в котором один или несколько аминокислотных остатков химически модифицированы путем ацилирования, алкилирования, образования эфира или образования амида;
(г) аминокислоту, химически модифицированную путем ацилирования, алкилирования, образования эфира или образования амида.
2. Соединение по п.1, содержащее по меньшей мере один гуанидиновый фрагмент, где этот гуанидиновый фрагмент является частью остатка аргинина, гомоаргинина или нораргинина.
3. Соединение по п.1, содержащее по меньшей мере одну аминогруппу, где по меньшей мере одна аминогруппа представляет собой N-концевую аминогруппу или часть боковой цепи аминокислотного остатка.
4. Соединение по п.3, содержащее по меньшей мере одну аминогруппу, где указанная по меньшей мере одна аминогруппа представляет собой часть остатка лизина, гомолизина или норлизина.
5. Соединение по п.3, содержащее только одну аминогруппу, которая представляет собой N-концевую аминогруппу или которая является частью боковой цепи аминокислотного остатка.
6. Соединение по п.2, содержащее только один гуанидиновый фрагмент.
7. Соединение по п.1, представляющее собой MIS-Ala-OMe.
8. Соединение по п.1, представляющее собой связанное со смолой пептидное соединение.
9. Соединение по п.1, где указанное соединение защищено на боковой цепи и/или защищено на свободном конце.
10. Соединение по п.1, где указанное соединение представляет собой N-α-бензилоксикарбонил-N-w-(1,2-диметилиндол-3-сульфонил)-L-аргинин.
11. Соединение по п.1, где указанное соединение представляет собой N-α-Fmoc-N-w-(1,2-диметилиндол-3-сульфонил)-L-аргинин.
12. Способ получения соединения по п.1, включающий стадию взаимодействия аминокислоты, определенной в п.1 подпункты (б) и (г), содержащей по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, с соединением формулы (II), где указанное соединение формулы (II) определено следующим образом:
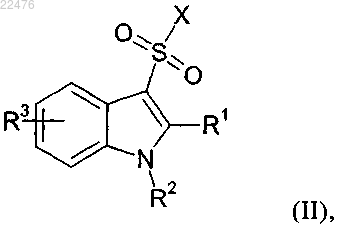
где значения R1, R2 и R3 определены в п.1 и X обозначает хлор или бром, с последующим сочетанием, в случае если соединение представляет собой олигопептид, определенный в п.1 подпункт (а), или олигопептид, определенный в п.1 подпункт (в), полученных таким образом защищенных аминокислот между собой в необходимой последовательности.
13. Способ по п.12, в котором указанное соединение, которое взаимодействует с соединением формулы (II), представляет собой Z-Arg-OH, H-Ala-ОМе или Z-Lys-OH.
14. Способ по п.12, в котором R1 и R2 независимо друг от друга обозначают С1-С4алкил, С1-С4алкоксигруппу или С1-С4алкилтиогруппу и R3 обозначает водород или галоген.
15. Способ по п.12, в котором R1 и R2 обозначают метил, R3 обозначает водород и X обозначает хлор.
16. Способ по п.12, где соединение, содержащее по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, представляет собой связанное со смолой пептидное соединение.
17. Способ по п.12, где соединение, содержащее по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, защищено на боковой цепи и/или защищено на свободном конце.
Текст
ИНДОЛСУЛЬФОНИЛЬНЫЕ ЗАЩИЩЕННЫЕ СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ Настоящее изобретение относится к способу осуществления реакции введения защитных групп в органические соединения, имеющие по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, и к полученным с помощью такой реакции защищенным соединениям. Настоящее изобретение относится к способу осуществления реакции введения защитных групп в органические соединения, имеющие по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, и к полученным с помощью такой реакции защищенным соединениям. Обеспечение соответствующей защиты гуанидинового фрагмента представляет собой еще не решенную до сих пор проблему в области химии, что обусловлено трудностью удаления известных защитных групп. Это относится прежде всего к химии пептидов, поскольку встречающаяся в естественных условиях аминокислота аргинин, несущая гуанидиновый фрагмент, имеет важное значение для получения многочисленных лекарственных субстанций. При осуществлении реакции сочетания необходимо защищать гуанидиногруппу аргинина для того,чтобы избежать ацилирования, после которого может иметь место дегуанидирование, снижая тем самым образование нежелательных продуктов в виде орнитина и -лактама. В зависимости от стратегии осуществления реакции сочетания для защиты аргинина наиболее часто применяют такие защитные группы, как паратолуолсульфонил (Tos), 2,2,5,7,8-пентаметилхроман-6 сульфонил (Pmc) и 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил (Pbf). Однако эти защитные группы обладают слишком большой устойчивостью к действию кислот, что требует более жестких условий и более продолжительного времени для удаления. Поэтому известные гуанидинозащитные группы при их удалении имеют тенденцию к образованию побочных продуктов. Наибольшие трудности вызывает их отщепление от пептидов, несущих несколько остатков аргинина, или от пептидов, содержащих триптофан.Carpino с соавторами (Tetrahedron Letters, т. 34,49, 1993, cc. 7829-7832) провели сравнение защитной группы Pbf с защитной группой Pmc при их применении для защиты боковой цепи аргинина. В WO 01/57045 описаны трициклические сульфамы, полученные с использованием бензофуран-,бензотиофен- и индолсодержащих промежуточных продуктов.Lowe с соавторами описали синтез гетероциклических сульфонилмочевин, которые, в частности,содержат индольный фрагмент (J. Heterocyclic Chem., 33, 1996, cc. 763-766). Задачей настоящего изобретения является разработка соединения, с помощью которого можно легко защищать гуанидиновый фрагмент органического соединения и которое легко можно удалять. Один из объектов настоящего изобретения относится к соединению, содержащему по меньшей мере один фрагмент формулы (III), где формула (III) определена следующим образом: где R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1 С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент формулы-(CH2)n-, где n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1 С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и где m обозначает 0 или 1; и где указанное соединение представляет собой:(а) олигопептид, содержащий от двух до пятнадцати аминокислотных остатков, или полипептид,содержащий от шестнадцати до примерно пятидесяти аминокислотных остатков;(в) олигопептид, в котором один или несколько аминокислотных остатков химически модифицированы путем ацилирования, алкилирования, образования эфира или образования амида;(г) аминокислоту, химически модифицированную путем ацилирования, алкилирования, образования эфира или образования амида. Согласно следующему объекту настоящего изобретения соединение, описанное выше, получают с помощью способа, включающего стадию взаимодействия аминокислоты, определенной выше подпунктами (б) и (г), содержащей по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, с соединением формулы (II), где указанное соединение формулы (II) определено следующим образом: где значения R1, R2 и R3 определены выше и X обозначает хлор или бром, с последующим сочетанием, в случае если соединение представляет собой олигопептид, определенный выше в подпункте (а), или оли-1 022476 гопептид, определенный выше в подпункте (в), полученных таким образом защищенных аминокислот между собой в необходимой последовательности. Следует иметь в виду, что в данном разделе и ниже понятие "С 1-Сnалкил" обозначает любую линейную или разветвленную алкильную группу, содержащую от 1 до n атомов углерода. Например, понятие "С 1-С 6 алкил" включает такие группы, как метил, этил, пропил, изопропил, бутил, изобутил, вторбутил, трет-бутил, пентил, изопентил(3-метилбутил), неопентил(2,2-диметилпропил), гексил, изогексил(4-метилпентил) и т.п. Соответственно, понятие "С 1-Сnалкоксигруппа" обозначает группу, состоящую из С 1-Сnалкильной группы, как она определена выше, и атома кислорода, связанных простой ковалентной связью. Аналогично этому понятие "С 1-С 6 алкилтиогруппа" обозначает группу, состоящую из С 1 Сnалкильной группы, как она определена выше, и атома серы, связанных простой ковалентной связью. В данном разделе и ниже понятие "галоген" обозначает фтор, хлор, бром и йод. В предпочтительном варианте осуществления изобретения R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, С 1-С 4 алкоксигруппу или C1-С 4 алкилтиогруппу; R3 обозначает водород или галоген; и X обозначает хлор или бром. В конкретном варианте осуществления изобретения, в котором и R1, и R2 обозначают метил; R3 обозначает водород; и X обозначает хлор, соединение представляет собой 1,2-диметилиндол-3 сульфонилхлорид. Для удобства это соединение сокращенно обозначают как MIS-Cl. Соединение формулы (II) получают с помощью способа, заключающегося в том, что подвергают взаимодействию соединение формулы в которой R1, R2 и R3 имеют указанные выше значения, или его соль с оксалилхлоридом или оксалилбромидом. В предпочтительном варианте осуществления изобретения R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, С 1-С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу, и R3 обозначает водород или галоген. В более предпочтительном варианте осуществления изобретения и R1, и R2 обозначают метил, и R3 обозначает водород. В способе получения соединения формулы (II) в качестве реагента можно применять соединение формулы (I) как в форме кислоты, так и в форме соли. Можно применять соединение формулы (I) в форме любой соли. Пригодными солями являются, например, натриевая соль, калиевая соль, кальциевая соль и пиридиниевая соль. В предпочтительном варианте осуществления изобретения реакцию осуществляют с использованием пиридиниевой соли соединения формулы (I). Предпочтительно при осуществлении реакции применяют оксалилхлорид. Для осуществления способа можно применять любой пригодный растворитель или смеси пригодных растворителей. К пригодным растворителям относятся растворители, которые не взаимодействуют с реактантами или с продуктом и которые растворяют реактанты в достаточной степени. Примерами пригодных растворителей являются дихлорметан, хлороформ, четыреххлористый углерод, тетрагидрофуран и 1,4-диоксан. Предпочтительно в качестве растворителя используют дихлорметан. Реакцию можно проводить также без растворителя. Целесообразно реакцию осуществлять в присутствии N,N-диметилформамида. Соединение формулы (II) в которой R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент,имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и X обозначает хлор или бром, применяют для защиты органического соединения, содержащего по меньшей мере один гуаниди-2 022476 новый фрагмент и/или по меньшей мере одну аминогруппу. В предпочтительном варианте осуществления изобретения органическое соединение представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце; R1 и R2 независимо друг от друга обозначают С 1 С 4 алкил, С 1-С 4 алкоксигруппу или C1-С 4 алкилтиогруппу, и R3 обозначает водород или галоген. В данном разделе и ниже в настоящем описании понятие "пептидное соединение" следует понимать в широком смысле, как это пояснено ниже. Так, подразумевается, что понятие "пептидное соединение" обозначает любое соединение, относящееся к любой из следующих категорий (а)-(г).(а) Пептид, т.е. соединение, которое образуется в результате формирования амидной связи между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. Амидная связь, как правило, формируется между C-1 одной аминокислоты и N-2 другой аминокислоты (эупептидная связь),но следует иметь в виду, что под понятие "пептидное соединение" подпадает также соединение, остатки которого связаны с помощью других амидных связей (изопептидные связи). Типичными пептидами, относящимися к этой категории, являются олигопептиды, содержащие от двух до пятнадцати аминокислотных остатков, и полипептиды, содержащие от шестнадцати до примерно пятидесяти аминокислотных остатков. Аминокислотные остатки могут представлять собой любые встречающиеся в естественных условиях или не встречающиеся в естественных условиях аминокислоты. Примером пептида является HArg-Val-OH.(б) Аминокислота, которая может представлять собой не только аминокислоту, обычно присутствующую в белках (встречающаяся в естественных условиях -аминокислота), но также и любую не встречающуюся в естественных условиях аминокислоту. Примерами являются Н-Ala-ОН (встречающаяся в естественных условиях аминокислота) и гомоаргинин (не встречающаяся в естественных условиях аминокислота).(в) Производное пептида, которое представляет собой пептид, в котором один или несколько аминокислотных остатков модифицированы химическим путем, например путем ацилирования, алкилирования, образования эфира или амида. Примерами являются Ac-Phe-Arg-Gly-Ala-Val-OH (SEQ ID NO: 5), HPhe-Arg-Gly-Ala-Val-NH2 (SEQ ID NO: 6) и H-Arg-Gly-Ala-Gly-Gly-Lys(N-тетрадеканоил)-Ala-Gly-GlyОН (SEQ ID NO: 7).(г) Производное аминокислоты, представляющее собой аминокислоту, модифицированную химическим путем, например путем ацилирования, алкилирования, образования эфира или амида. Примером является Н-Ala-ОМе. В другом предпочтительном варианте осуществления изобретения пептидное соединение содержит по меньшей мере один гуанидиновый фрагмент и необязательно по меньшей мере одну аминогруппу, где гуанидиновый фрагмент является частью остатка аргинина, гомоаргинина или нораргинина. Более предпочтительно указанный гуанидиновый фрагмент является частью остатка аргинина или гомоаргинина. Еще более предпочтительно пептидное соединение представляет собой Z-Arg-OH. Приставка "гомо" перед названием обычной аминокислоты (например, в названии "гомоаргинин") означает, что указанная аминокислота содержит одну дополнительную метиленовую группу в углеродной цепи. В противоположность этому приставка "нор" перед названием обычной аминокислоты (например, в названии "нораргинин") означает, что в углеродной цепи удалена одна метиленовая группа. В другом предпочтительном варианте осуществления изобретения пептидное соединение содержит по меньшей мере одну аминогруппу и необязательно по меньшей мере один гуанидиновый фрагмент, где по меньшей мере одна аминогруппа(ы) представляет(ют) собой N-концевую(ые) аминогруппу(ы) или часть боковой цепи аминокислотного остатка. Более предпочтительно аминогруппа, которая подлежит защите, представляет собой N-концевую аминогруппу указанного пептидного соединения. Наиболее предпочтительно пептидное соединение представляет собой Н-Ala-ОМе. Более предпочтительно также аминогруппа, которая подлежит защите, представляет собой часть боковой цепи аминокислотного остатка указанного пептидного соединения. Еще более предпочтительно указанная аминогруппа представляет собой часть остатка лизина, гомолизина или норлизина. Наиболее предпочтительно указанное пептидное соединение представляет собой Z-Lys-ОН. В одном из вариантов осуществления изобретения m обозначает 1, в этом случае получают соединение, которое содержит по меньшей мере один фрагмент, имеющий формулу (IV) в которой R1, R2 и R3 имеют указанные выше значения. В другом варианте осуществления изобретения m обозначает 0, в этом случае получают соединение, которое содержит по меньшей мере один фрагмент, имеющий формулу (V) в которой R1, R2 и R3 имеют указанные выше значения. В предпочтительном варианте осуществления изобретения R1 и R2 независимо друг от друга обозначают C1-С 4 алкил, С 1-С 4 алкоксигруппу или C1-С 4 алкилтиогруппу, R3 обозначает водород или галоген. В одном из вариантов осуществления изобретения m обозначает 1, а в другом варианте осуществления изобретения m обозначает 0. В более предпочтительном варианте осуществления изобретения R1 и R2 обозначают метил, R3 обозначает водород и X обозначает хлор. В одном из вариантов осуществления изобретения m обозначает 1; а в другом варианте осуществления изобретения m обозначает 0. В другом предпочтительном варианте осуществления изобретения органическое соединение представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце, в этом случае получают указанное пептидное соединение, которое содержит по меньшей мере один фрагмент, имеющий формулу (III) в которой R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент, имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; и R3 обозначает водород, галоген, С 1 С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0 или 1. Предпочтительно, R1 и R2 независимо друг от друга обозначают C1-С 4 алкил, C1-С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген. Наиболее предпочтительно R1 и R2 обозначают метил, и R3 обозначает водород. В предпочтительном варианте осуществления изобретения указанное пептидное соединение содержит по меньшей мере один гуанидиновый фрагмент, представляющий собой часть остатка аргинина,гомоаргинина или нораргинина, предпочтительно представляющий собой часть остатка аргинин или гомоаргинина, в этом случае получают указанное пептидное соединение, которое содержит по меньшей мере один фрагмент, имеющий формулу (III), в которой R1 обозначает водород, С 1-С 6 алкил, С 1 С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент, имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; и R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1 С 6 алкилтиогруппу, фенил или бензил; и m обозначает 1; предпочтительно, в которой R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, C1-С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген; и более предпочтительно, в которой R1 и R2 обозначают метил и R3 обозначает водород. Наиболее предпочтительно указанное пептидное соединение, которое требуется подвергнуть взаимодействию, содержит только один гуанидиновый фрагмент. В предпочтительном варианте осуществления изобретения указанное пептидное соединение, которое требуется подвергнуть взаимодействию, представляет собой Nбензилоксикарбонил-L-аргинин (ZArg-OH). В еще более предпочтительном варианте осуществления изобретения пептидное соединение, которое требуется подвергнуть взаимодействию, представляет собой Z-Arg-OH; R1 и R2, входящие в соединение формулы (II), обозначают метил, R3, входящий в соединение формулы (II), обозначает водород и X,входящий в соединение формулы (II), обозначает хлор, в этом случае получают N-бензилоксикарбонил-N(1,2-диметилиндол-3-сульфонил)-L-аргинин. Для удобства ниже в настоящем описании это соединение сокращенно обозначают как Z-Arg(MIS)-OH. В другом предпочтительном варианте осуществления изобретения указанное пептидное соединение содержит по меньшей мере одну аминогруппу, где указанная(ые) по меньшей мере одна аминогруппа(ы) представляет(ют) собой N-концевую(ые) аминогруппу(ы) или является(ются) частью боковой цепи аминокислотного остатка, в этом случае получают указанное пептидное соединение, которое содержит по меньшей мере один фрагмент, имеющий формулу (III), в которой R1 обозначает водород, С 1-С 6 алкил, С 1 С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1 С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент, имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; и R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1 С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0; предпочтительно, в которой R1 и R2 независимо друг от друга обозначают C1-С 4 алкил, C1-С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген; и в которой более предпочтительно R1 и R2 обозначают метил и R3 обозначает водород. Наиболее предпочтительно указанное пептидное соединение, которое требуется подвергнуть взаимодействию, содержит только одну аминогруппу, которая представляет собой N-концевую аминогруппу или которая является частью боковой цепи аминокислотного остатка. Еще более предпочтительно аминогруппа указанного пептидного соединения, которое требуется подвергнуть взаимодействию, представляет собой N-концевую аминогруппу. В предпочтительном варианте осуществления изобретения указанное пептидное соединение, которое требуется подвергнуть взаимодействию, представляет собой метиловый эфир L-аланина (Н-AlaОМе). В еще более предпочтительном варианте осуществления изобретения пептидное соединение представляет собой H-Ala-OMe; R1 и R2 соединения формулы (II) обозначают метил, R3 соединения формулы(II) обозначает водород и X соединения формулы (II) обозначает хлор, в этом случае получают метиловый эфир N(1,2-диметилиндол-3-сульфонил)-L-аланина. Для удобства ниже в настоящем описании указанное соединение сокращенно обозначают как MIS-Ala-OMe. Также еще более предпочтительно аминогруппа указанного пептидного соединения, которое требуется подвергнуть взаимодействию, представляет собой часть боковой цепи аминокислотного остатка. Наиболее предпочтительно указанная аминогруппа представляет собой часть остатка лизина, гомолизина или норлизина. В качестве растворителя при осуществлении способа защиты можно применять любой инертный жидкий растворитель, который может растворять реактанты. Пригодными растворителями являются галогенированные углеводороды, такие как дихлорметан, четыреххлористый углерод и дихлорэтан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 2-метилтетрагидрофуран; эфиры карбоновых кислот и лактоны, такие как этилацетат, метилацетат и валеролактон; и содержащие гетероатомы органические растворители, такие как ацетон, ацетонитрил, диметилформамид и диметилсульфоксид. Растворители можно применять в виде индивидуальных соединений или в виде смесей. Необязательно растворитель или смесь растворителей может содержать воду, если для растворения реактантов требуется присутствие воды. Предпочтительными растворителями являются дихлорметан и ацетон, которые применяют индивидуально или в присутствии воды. Необязательно реакционная смесь может содержать неорганические или органические основания. Примерами неорганических оснований являются гидроксид натрия, гидроксид калия, гидроксид лития и карбонат натрия. Примерами органических оснований являются диизопропилэтиламин, пиридин и триэтиламин. Предпочтительными основаниями являются гидроксид натрия и диизопропилэтиламин. Количество соединения формулы (II) варьируется в зависимости от объема реактора, и молярное соотношение указанного соединения и органического соединения, которое содержит по меньшей мере один гуанидиновый фрагмент и/или одну аминогруппу, может составлять от 0,9:1 до 4:1, предпочтительно от 1:1 до 3:1. Соединение формулы (II) можно добавлять к реакционной смеси порциями. Способ защиты можно осуществлять при низких или слегка повышенных температурах. Например,пригодная температура находится в пределах от -10 до 30C, предпочтительно от 0C до комнатной температуры. Продолжительность реакции зависит от различных факторов, таких как температура или молярное соотношение соединения формулы (II) и органического соединения, которое содержит по меньшей мере один гуанидиновый фрагмент и/или одну аминогруппу. Так, реакция может завершаться в течение нескольких минут или нескольких часов. В одном из вариантов осуществления изобретения m обозначает 1, это означает, что органическое соединение содержит по меньшей мере один фрагмент, имеющий формулу в которой R1, R2 и R3 имеют указанные выше значения. В другом варианте осуществления изобретения m обозначает 0, это означает, что органическое со-5 022476 единение содержит по меньшей мере один фрагмент, имеющий формулу (V) в которой R1, R2 и R3 имеют указанные выше значения. В предпочтительном варианте осуществления изобретения R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, С 1-С 4 алкоксигруппу или C1-С 4 алкилтиогруппу, и R3 обозначает водород или галоген. В одном из вариантов осуществления изобретения m обозначает 1, а в другом варианте осуществления изобретения m обозначает 0. В более предпочтительном варианте осуществления изобретения R1 и R2 обозначают метил, R3 обозначает водород и X обозначает хлор. В одном из вариантов осуществления изобретения m обозначает 1,а в другом варианте осуществления изобретения m обозначает 0. В другом предпочтительном варианте осуществления изобретения органическое соединение представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце и которое содержит по меньшей мере один фрагмент, имеющий формулу в которой R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент,имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0 или 1,предпочтительно m обозначает 1. Предпочтительно R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, C1-С 4 алкоксигруппу или C1-С 4 алкилтиогруппу и R3 обозначает водород или галоген. Наиболее предпочтительно R1 и R2 обозначают метил, и R3 обозначает водород. В предпочтительном варианте осуществления изобретения указанное пептидное соединение содержит по меньшей мере один гуанидиновый фрагмент, представляющий часть остатка аргинина, гомоаргинина или нораргинина, предпочтительно часть остатка аргинина или гомоаргинина, содержащий по меньшей мере один фрагмент, имеющий формулу (III), в которой R1 обозначает водород, С 1-С 6 алкил, С 1 С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1 С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент, имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; и R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1 С 6 алкилтиогруппу, фенил или бензил; и m обозначает 1; в которой предпочтительно R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, С 1 С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген и в которой более предпочтительно R1 и R2 обозначают метил и R3 обозначает водород. Наиболее предпочтительно указанное пептидное соединение содержит только один гуанидиновый фрагмент. Еще более предпочтительно указанное пептидное соединение представляет собой Z-Arg(MIS)-OH. В другом предпочтительном варианте осуществления изобретения указанное пептидное соединение содержит по меньшей мере одну аминогруппу, где указанная(ые) по меньшей мере одна аминогруппа(ы) представляет(ют) собой N-концевую(ые) аминогруппу(ы) или является(ются) частью боковой цепи аминокислотного остатка, содержащего по меньшей мере один фрагмент, имеющий формулу (III), в которойR1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1 С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент, имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; и R3 обозначает водород, галоген,С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0; предпочтительно в которой R1 и R2 независимо друг от друга обозначают C1-С 4 алкил, C1 С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген; и более предпочтительно в которой R1 и R2 обозначают метил и R3 обозначает водород. Также более предпочтительно указанное пептидное соединение содержит только одну аминогруппу, которая представляет собой N-концевую аминогруппу или которая является частью боковой цепи аминокислотного остатка. Еще более предпочтительно аминогруппа указанного пептидного соединения представляет собойN-концевую аминогруппу. Наиболее предпочтительно указанное пептидное соединение представляет собой MIS-Ala-OMe. Также еще более предпочтительно аминогруппа указанного пептидного соединения является частью боковой цепи аминокислотного остатка. Наиболее предпочтительно указанная аминогруппа является частью остатка лизина, гомолизина или норлизина. Следующим объектом изобретения является модификация и/или сочетание органического соединения, полученного согласно настоящему изобретению, которые осуществляют согласно описанной(ым) ниже стадии(ям). Поскольку органические соединения, полученные согласно настоящему изобретению, являются важными конструктивными элементами, то их можно применять для получения органических соединений, которые можно применять, например, в качестве лекарственных субстанций. Согласно настоящему изобретению органическое соединение, которое содержит по меньшей мере один фрагмент, имеющий формулу в которой R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент,имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0 или 1,подвергают химической модификации согласно описанной ниже стадии. В предпочтительном варианте осуществления изобретения органическое соединение, которое подлежит модификации согласно описанной ниже стадии, представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце и которое содержит по меньшей мере один фрагмент, имеющий формулу (III), в которой R1, R2, R3 и m имеют указанные выше значения. Предпочтительно указанное пептидное соединение содержит по меньшей мере один гуанидиновый фрагмент, представляющий собой часть остатка аргинина, гомоаргинина или нораргинина, предпочтительно часть остатка аргинина или гомоаргинина, содержащий по меньшей мере один фрагмент, имеющий формулу (III), в которой R1, R2, R3 и m имеют указанные выше значения; предпочтительно в которойR1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, С 1-С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген; и более предпочтительно в которой R1 и R2 обозначают метил и R3 обозначает водород. Наиболее предпочтительно указанное пептидное соединение содержит только один гуанидиновый фрагмент. Еще более предпочтительно указанное пептидное соединение представляет собой Z-Arg(MIS)-OH. Модификация заключается в осуществлении любой органической реакции, которая применима для защитной группы, предлагаемой в настоящем изобретении. Например, Z-Arg(MIS)-OH можно модифицировать путем удаления защитной Z-группы, что приводит к образованию H-Arg(MIS)-OH. Необязательно полученное таким путем модифицированное соединение подвергают по меньшей мере еще одной модификации. Например, соединение H-Arg(MIS)-OH, полученное в результате первой модификации, можно подвергать еще одной модификации путем введения защитной группы на его Nконец, что приводит к образованию, например, соединения Fmoc-Arg(MIS)-OH. Стадии удаления защитной группы и введения защитной группы можно осуществлять в реакционных условиях, известных в области пептидного синтеза. Также согласно настоящему изобретению органическое соединение, содержащее по меньшей мере один фрагмент, имеющий формулу в которой R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент,имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0 или 1,подвергают сочетанию с органическим соединением Q согласно описанной ниже стадии. Необязательно указанную стадию сочетания можно повторять по меньшей мере один раз и/или можно осуществлять по меньшей мере еще одно сочетание с пригодным для сочетания соединением. Полученное таким путем соединение можно химически модифицировать и в том случае, когда указанное соединение связано со смолой, можно осуществлять последующее отщепление от смолы. В предпочтительном варианте осуществления изобретения органическое соединение, подлежащее сочетанию на следующей стадии с органическим соединением Q, представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце и которое содержит по меньшей мере один фрагмент, имеющий формулу (III),в которой R1, R2, R3 и m имеют указанные выше значения. Предпочтительно указанное пептидное соединение содержит по меньшей мере один гуанидиновый фрагмент, представляющий собой часть остатка аргинина, гомоаргинина или нораргинина, предпочтительно представляет собой часть остатка аргинина или гомоаргинина, содержащий по меньшей мере один фрагмент, имеющий формулу (III), в которой R1, R2, R3 и m имеют указанные выше значения; предпочтительно в которой R1 и R2 независимо друг от друга обозначают C1-С 4 алкил, C1 С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген; и более предпочтительно в которой R1 и R2 обозначают метил и R3 обозначает водород. Наиболее предпочтительно указанное пептидное соединение содержит только один гуанидиновый фрагмент. Еще более предпочтительно указанное пептидное соединение представляет собой Fmoc-Arg(MIS)OH или Z-Arg(MIS)-OH. Органическое соединение Q предпочтительно представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце. Наиболее предпочтительно органическое соединение Q представляет собой пептидное соединение, которое необязательно защищено на боковой цепи и которое необязательно связано со смолой. В предпочтительном варианте осуществления изобретения указанное пептидное соединение представляет собой H-Val-смола или H-Trp(Boc)-Ala-Gly-смола, где смола предпочтительно получена на основе амидной смолы Зибера (9-Fmoc-аминоксантен-3-илокси-смола Меррифилда). В еще более предпочтительном варианте осуществления изобретения пептидное соединение, подлежащее сочетанию, представляет собой Fmoc-Arg(MIS)-OH, а пептидное соединение, с которым сочетают указанное пептидное соединение, представляет собой H-Val-NH-ксантен-3-илокси-смола Меррифилда, в результате чего получают соединение Fmoc-Arg(MIS)-Val-NH-ксантен-3-илокси-смола Меррифилда. Предпочтительно указанную реакцию сочетания повторяют три раза, получая в результате соединение Fmoc-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NH-ксантен-3-илокси-смола Меррифилда (SEQID NO: 8). Предпочтительно также осуществляют сочетание с Fmoc-Phe-OH после удаления N-концевой защитной группы на указанном связанном со смолой пептиде, в результате чего получают соединениеNO: 1). Более предпочтительно на N-конце осуществляют удаление защитной группы и ацетилирование,в результате чего получают соединение Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NH-ксантен 3-илокси-смола Меррифилда (SEQ ID NO: 1). Наиболее предпочтительно указанный связанный со смолой пептид отщепляют, в результате чего получают соединение Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)Arg(MIS)-Val-NH2 (SEQ ID NO: 2). В еще одном более предпочтительном варианте осуществления изобретения пептидное соединение,подлежащее сочетанию, представляет собой Z-Arg(MIS)-ОН, и пептидное соединение, с которым сочетают указанное пептидное соединение, представляет собой Н-Trp(Вос)-Ala-Gly-NH-ксантен-3-илоксисмола Меррифилда, в результате получают соединение Z-Arg(MIS)-Trp(Boc)-Ala-Gly-NH-ксантен-3 илокси-смола Меррифилда (SEQ ID NO: 3). Предпочтительно указанный связанный со смолой пептид отщепляют от смолы, в результате чего получают соединение Z-Arg(MIS)-Trp(Boc)-Ala-Gly-NH2 (SEQ IDNO: 3). Процедуру сочетания с органическим соединением Q можно осуществлять согласно любому методу проведения реакции сочетания, известному специалисту в данной области. В том случае, когда подлежащее сочетанию органическое соединение представляет собой пептидное соединение, реакцию сочетания предпочтительно проводят в твердой или жидкой фазе. Наиболее предпочтительно необязательно присутствующие предшествующие и необязательно присутствующие последующие стадии сочетания также осуществляют в твердой и/или жидкой фазе. В контексте настоящего изобретения понятие "твердая фаза" относится к твердофазному синтезу пептидов (ТФСП). При осуществлении ТФСП аминокислотную или пептидную группу, необязательно защищенную, связывают с твердой подложкой, представляющей собой смолу. Затем к связанному с подложкой пептиду последовательно присоединяют аминокислотные или пептидные группы, необязательно защищенные, до тех пор, пока не будет сформирован представляющий интерес пептидный продукт. Затем связанный с подложкой пептид, как правило, отщепляют от подложки и подвергают дополнительному процессингу и/или очистке. В некоторых случаях в результате твердофазного синтеза получают зрелый пептидный продукт; в других случаях пептид, отщепленный от подложки, т.е. "промежуточный пептидный фрагмент", применяют для получения более крупного зрелого пептидного продукта. В контексте настоящего изобретения понятие "фаза раствора" относится к синтезу пептидов в фазе раствора. При осуществлении синтеза пептидов в фазе раствора два промежуточных пептидных фрагмента, необязательно защищенных, или промежуточный пептидный фрагмент и реактивную аминокислоту, которые оба необязательно являются защищенными, подвергают сочетанию в пригодном растворителе, как правило, в присутствии дополнительных реагентов, повышающих эффективность и качество реакции сочетания. В ходе реакции промежуточные пептидные фрагменты располагаются таким образом, что N-конец одного фрагмента присоединяется к С-концу другого фрагмента или наоборот. Кроме того, защитные группы боковой цепи, которые присутствуют при твердофазном синтезе, обычно сохраняют на фрагментах при синтезе в фазе раствора для того, чтобы гарантировать определенную реактивность концевых участков фрагментов. Эти защитные группы боковых цепей, как правило, не удаляют до тех пор, пока не будет сформировано зрелое пептидное соединение. Возможно отщепление органического соединения, содержащего по меньшей мере один фрагмент,имеющий формулу в которой R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент,имеющий формулу -(CH2)n-, в которой n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил; и m обозначает 0 или 1,где указанное отщепление необязательно имеет место в присутствии по меньшей мере одного акцептора. В предпочтительном варианте осуществления изобретения процедуру отщепления осуществляют с применением кислоты, предпочтительно с применением трифторуксусной кислоты (ТФК). Кислоту применяют в чистом виде или в виде смеси с инертным растворителем. Примером пригодного инертного растворителя может служить дихлорметан (ДХМ). Предпочтительно молярное соотношение кислоты и растворителя составляет от 1:0 до 1:2, предпочтительно от 1:0 до 1:1. После отщепления образовавшееся сульфонильное производное можно улавливать с помощью любого пригодного акцептора. Примерами акцепторов являются триизопропилсилан (ТИС), вода, диметилсульфид, C1-С 4 алкоксибензолы, такие как 1,3,5-триметоксибензол (ТМБ), и C1-С 4 алкоксифенолы, такие как 3,4-диметоксифенол и 3,5-диметоксифенол. Акцептор можно применять индивидуально или в составе смеси, такой как вода/ТИС. Предпочтительно в качестве акцепторов применяют С 1-С 4 алкоксибензолы и С 1-С 4 алкоксифенолы,поскольку они являются менее полярными нуклеофилами по сравнению, например, с водой. Вследствие этого получаемые таким путем аддукты легче отделять от целевого соединения при осуществлении последующих процедур обработки. В предпочтительном варианте осуществления изобретения указанное органическое соединение,подлежащее отщеплению, представляет собой необязательно связанное со смолой пептидное соединение, которое необязательно защищено на боковой цепи и/или защищено на свободном конце. Предпочтительно R1 и R2 независимо друг от друга обозначают C1-С 4 алкил, C1-С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген, наиболее предпочтительно R1 и R2 обозначают метил и R3 обозначает водород. В более предпочтительном варианте осуществления изобретения указанное пептидное соединение,подлежащее отщеплению, представляет собой Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NHксантен-3-илокси-смола Меррифилда (SEQ ID NO: 1), в этом случае получают соединение Ac-Phe-ArgArg-Arg-Arg-Val-NH2 (SEQ ID NO: 2). Предпочтительно в качестве раствора для отщепления применяют смесь ТФК/ДХМ/ТИС/вода, наиболее предпочтительно в молярном соотношении 50:45:2,5:2,5. Также предпочтительно в качестве раствора для отщепления применяют смесь ТФК/ДХМ/3,4-диметоксифенол,наиболее предпочтительно в молярном соотношении 50:40:10. Также предпочтительно в качестве рас-9 022476 твора для отщепления применяют смесь ТФК/ДХМ/3,5-диметоксифенол, наиболее предпочтительно в молярном соотношении 50:40:10. Также предпочтительно в качестве раствора для отщепления применяют смесь ТФК/ДХМ/ТМБ, наиболее предпочтительно в молярном соотношении 50:40:10. В еще одном более предпочтительном варианте осуществления изобретения указанное пептидное соединение, подлежащее отщеплению, представляет собой Z-Arg(MIS)-Trp(Вос)-Ala-Gly-NH-ксантен-3 илокси-смола Меррифилда (SEQ ID NO: 3), в этом случае получают соединение Z-Arg-Trp-Ala-Gly-NH2(SEQ ID NO: 4). Предпочтительно в качестве раствора для отщепления применяют смесь ТФК/ДХМ/ТМБ, наиболее предпочтительно в молярном соотношении 50:40:10. В еще одном более предпочтительном варианте осуществления изобретения указанное пептидное соединение, подлежащее отщеплению, представляет собой MIS-Ala-OMe, в этом случае получают соединение Н-Ala-ОМе. Предпочтительно в качестве раствора для отщепления применяют смесь ТФК/диметилсульфид, наиболее предпочтительно в молярном соотношении 90:10. Примеры Приведенные ниже примеры служат для дополнительной иллюстрации настоящего изобретения и никоим образом не направлены на ограничение его объема. Примеры с 1 по 8 относятся к процедурам получения, а примеры с 9 по 20 относятся к методам удаления. Следует иметь в виду, что если не указано иное, то применяли L-энантиомер аминокислотного остатка и во всех случаях применяли реагенты, поступающие в продажу. Сокращения:Boc = трет-бутоксикарбонил,ДИК = диизопропилкарбодииимид,ДИПЭА = диизопропилэтиламин,MC-ESI = масс-спектрометрия с ионизацией электроспреем,Fmoc = фтор-9-илметоксикарбонил,ГОАТ = N-гидрокси-7-азабензотриазол,ГОБТ = N-гидроксибензотриазол,МСВР (ХИ) = масс-спектрометрия высокого разрешения (с химической ионизацией),MALDI-TOF = времяпролетная масс-спектрометрия с опосредуемой матрицей лазерной десорбцией/ионизацией,MIS = 1,2-диметилиндол-3-сульфонил,РуВОР = гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония,ТФК = трифторуксусная кислота,ТИС = триизопропилсилан,ТМБ = 1,3,5-триметоксибензол,Z-OSu = N-(бензилоксикарбонилокси)сукцинимид. Пример 1. Получение 1,2-диметилиндол-3-сульфоната пиридиния. 1,2-Диметилиндол (19,7 г, 135,9 ммоль) и комплекс триоксид серы-пиридин (20,4 г, 128,3 ммоль) растворяли в пиридине (100 мл) в атмосфере аргона. Реакционную смесь кипятили с обратным холодильником в течение 40 ч и затем охлаждали до комнатной температуры. После добавления воды (400 мл) образовавшийся раствор промывали четыре раза диэтиловым эфиром (используя каждый раз по 250 мл). Водную фазу упаривали досуха и сушили в вакуумном эксикаторе, получая 1,2-диметилиндол-3-сульфонат пиридиния в виде масла красного цвета(16,4 г, 53,7 ммоль), суспендировали в безводном дихлорметане (120 мл) в атмосфере азота. Раствор охлаждали в ледяной бане и медленно добавляли оксалилхлорид (14 мл, 161 ммоль). После этого медленно добавляли при перемешивании N,N-диметилформамид (0,5 мл). Реакционную смесь перемешивали еще в течение 30 мин в ледяной бане и затем при комнатной температуре. Через 6 ч раствор охлаждали в ледяной бане. Добавляли еще одну порцию оксалилхлорида (4 мл, 46 ммоль) и N,N-диметилформамида (0,4 мл) и реакционную смесь перемешивали при комнатной температуре еще в течение 15 ч. После добавления оксалилхлорида (2 мл, 23 ммоль) и перемешивания еще в течение 4 ч реакция завершалась (по данным ЖХВР; перед проведением измерений осуществляли обработку небольшой аликвоты метанолом в течение 20 мин). Реакционную смесь упаривали досуха при комнатной температуре. Добавляли N,Nдиметилформамид (200 мл), а затем воду (100 мл). Смесь перемешивали в течение 5 мин для удаления оксалилхлорида. После этого фазы разделяли и органическую фазу промывали трижды водой (используя каждый раз по 100 мл). Органическую фазу сушили над безводным сульфатом магния и упаривали досуха, в результате получали 1,2-диметилиндол-3-сульфонилхлорид (MIS-Cl) в виде твердого вещества фиолетового цвета (10,2 г, выход 78%). 1Z-Arg-OH (2 г, 6,5 ммоль) растворяли в ацетоне (65 мл) и 3 н. водном растворе гидроксида натрия(18 мл, 54 ммоль). Реакционную смесь охлаждали в ледяной бане и добавляли в течение 10 мин полученный согласно методу, который описан в примере 2, MIS-Cl (1,59 г, 6,5 ммоль), растворенный в ацетоне(50 мл). Реакционную смесь перемешивали в течение 1 ч при 0C. После этого добавляли еще одну порцию MIS-Cl (0,95 г, 3,9 ммоль) в ацетоне (20 мл) и перемешивали в течение 90 мин при 0C. В завершение добавляли последнюю порцию MIS-Cl (0,95 г, 3,9 ммоль) в ацетоне (15 мл). Реакционную смесь перемешивали еще в течение 30 мин при 0C и затем еще в течение 3 ч при комнатной температуре до достижения отсутствия обнаруживаемого количества MIS-Cl по данным ТСХ (гексан:этилацетат, 1:1). Значение рН реакционной смеси доводили до нейтрального с помощью 10%-го водного раствора лимонной кислоты. После выпаривания ацетона в вакууме добавляли воду (100 мл) и смесь подкисляли до рН 3 с помощью 10%-го водного раствора лимонной кислоты. Затем раствор трижды экстрагировали этилацетатом (используя каждый раз по 100 мл). Органические фазы объединяли, промывали трижды водой (используя каждый раз по 75 мл), сушили над сульфатом магния и, наконец, упаривали досуха. Полученный неочищенный продукт очищали дважды с помощью хроматографии на колонке (дихлорметан, метанол,уксусная кислота). Очищенные фракции объединяли и растворитель удаляли в вакууме, получая масло. Для осаждения добавляли в минимальном количестве смесь, содержащую этилацетат, дихлорметан и метанол, а затем добавляли гексан до тех пор, пока больше не происходило образования осадка. Растворитель отбрасывали и твердый продукт промывали четыре раза смесью дихлорметана и гексана и, наконец, сушили над сульфатом магния, получая Z-Arg(MIS)-OH (0,61 г, выход 18%). 1H-ЯМР (400 МГц, ДМСО):= 7,85 (d, 1H, J = 7,6 Гц), 7,52 (d, 1H, J = 8,0 Гц), 7,43 (d, 1 Н, J = 8,0 Гц), 7,30 (m, 5 Н), 7,10 (m, 2 Н), 5,01 (s, 2 Н), 3,87 (m, 1H), 3,66 (s, 3H), 3,0 (m, 2 Н), 2,60 (s, 3H), 1,64 (m,1 Н), 1,49 (m, 1 Н), 1,41 (m, 2 Н). 13 С-ЯМР (100 МГц, ДМСО):= 174,4, 157,0, 156,8, 139,4, 137,7, 135,9, 129,0, 128,5, 128,4, 125,2,122,1, 121,1, 120,1, 110,4, 66,1, 54,3, 40,0, 30,2, 28,9, 26,4, 11,4. МСВР (ХИ): m/z рассчитано для C24H30N5O6S [M+Н]+ 516,1911, обнаружено 516,1911. Пример 4. Получение Fmoc-Arg(MIS)-OH. 1. Получение H-Arg(MIS)-OH. Смесь, содержащую соединение Z-Arg(MIS)-OH, полученное согласно методу, описанному в примере 3 (486 мг, 0,94 ммоль), и 10% Pd/C (110 мг) в метаноле (60 мл), гидрировали в течение ночи при атмосферном давлении. Поскольку реакция еще не была завершена (по данным ТСХ; дихлорметан:метанол:уксусная кислота, 90:9:1), добавляли 10% Pd/C (100 мг) и реакционную смесь гидрировали еще в течение 24 ч до завершения реакции (по данным ТСХ). Реакционную смесь фильтровали через целит и упаривали досуха, получая H-Arg(MIS)-OH (выход 98%, 352 мг). 1Fmoc-Cl (84 мг, 0,32 ммоль) растворяли в 1,4-диоксане (0,5 мл). Добавляли азид натрия (25 мг, 0,39 ммоль) в воде (0,4 мл) и образовавшуюся эмульсию перемешивали в течение 2 ч при комнатной температуры. После этого эмульсию медленно добавляли к раствору H-Arg(MIS)-OH, полученного на предыдущей стадии (136 мг, 0,36 ммоль), в смеси воды и диоксана (1:1) при рН 9, значение рН контролировали путем добавления 10%-го водного раствора карбоната натрия. Реакционную смесь перемешивали, поддерживая значение рН на уровне 9. После стабилизации значения рН смесь перемешивали в течение ночи. Затем добавляли воду (30 мл) и смесь промывали трижды метил-трет-бутиловым эфиром (используя каждый раз по 20 мл). Водную фазу подкисляли с помощью 1 н. HCl до рН 2-3 и затем немедленно экстрагировали трижды этилацетатом (30 мл). Органические фазы объединяли и сушили над сульфатом магния. После упаривания досуха получали масло (115 мг), которое растворяли в минимальном количестве ацетона. После этого добавляли водный раствор карбоната натрия (20 мл) до рН 9 и водный раствор промывали трижды метил-трет-бутиловым эфиром (используя каждый раз по 30 мл). Полученный таким путем водный раствор подкисляли с помощью 1 н. HCl до рН 2-3, затем экстрагировали трижды этилацетатом (используя каждый раз по 20 мл), сушили над сульфатом магния и, наконец, упаривали досуха,- 11022476H-ЯМР (400 МГц, ДМСО):= 7,86 (m, 3H), 7,70 (d, 2H, J = 7,4 Гц), 7,59 (d, 1H, J = 7,9 Гц), 7,42 (d,1 Н, J = 8,1 Гц), 7,39 (m, 2 Н), 7,30 (m, 2 Н), 7,10 (m, 2 Н), 4,27 (m, 2 Н), 4,20 (m, 1 Н), 3,86 (m, 1 Н), 3,66 (s,3H), 3,01 (m, 2 Н), 2,61 (s, 3H), 1,65 (m, 1 Н), 1,52 (m, 1 Н), 1,38 (m, 2 Н). 13 С-ЯМР (100 МГц, ДМСО):= 174,4, 157,0, 156,8, 144,5, 141,4, 139,4, 135,9, 128,3, 127,8, 126,0,125,2, 122,1, 121,1, 120,8, 120,1, 110,4, 66,3, 55,6, 47,3, 40,0, 30,2, 28,8, 26,5, 11,4. МСВР (ХИ): m/z рассчитано для C31H34N5O6S [M+Н]+ 604,2224, обнаружено 604,2222. Пример 5. Получение Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NH2 (SEO ID NO: 2). Амидную смолу Зибера (25 мг, 0,42 ммоль/г, 9-Fmoc-аминоксантен-3-илокси-смола Меррифилда) помещали в полипропиленовый шприц вместимостью 2 мл, снабженный полиэтиленовым дисковым фильтром. Смоле давали набухать в дихлорметане. Затем осуществляли промывку с помощью дихлорметана и N,N-диметилформамида и удаляли группу Fmoc путем обработки смесью (2:8) пиперидина и N,Nдиметилформамида (один раз в течение 1 мин и дважды в течение 10 мин). Сочетание с Fmoc-Val-OH(14,3 мг, 42,1 мкмоль) осуществляли в присутствии ГОБТ (5,7 мг, 42,1 мкмоль) и ДИК (6,7 мкл, 42,1 мкмоль) в N,N-диметилформамиде в течение 1,5 ч. Группу Fmoc удаляли с помощью общепринятой процедуры и осуществляли сочетание с соединением Fmoc-Arg(MIS)-OH, полученным методом, описанным в примере 4 (15,8 мг, 26,3 мкмоль), в присутствии РуВОР (13,7 мг, 26,3 мкмоль), ГОАТ (3,6 мг, 26,3 мкмоль) и ДИПЭА (13,4 мкл, 78,9 мкмоль) в N,N-диметилформамиде в течение 90 мин. Смолу ацетилировали путем обработки уксусным ангидридом (50 экв.) и ДИПЭА (50 экв.) в ДМФ в течение 25 мин для кэпирования непрореагировавших аминов, группу Fmoc удаляли и повторяли еще три раза ту же самую процедуру, включая ацетилирование смолы перед удалением группы Fmoc. После последнего удаления группы Fmoc соединение Fmoc-Phe-OH (13,6 мг, 35 мкмоль) подвергали сочетанию в присутствии РуВОР (18,3 мг, 35 мкмоль), ГОАТ (4,8 мг, 35 мкмоль) и ДИПЭА (17,9 мкл, 105,2 мкмоль) в N,Nдиметилформамиде в течение 90 мин. Группу Fmoc удаляли и образовавшуюся в результате свободную аминогруппу ацетилировали описанным выше методом. Полученный таким путем защищенный связанный со смолой пептид Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NH-ксантен-3-илокси-смола Меррифилда промывали с помощью N,N-диметилформамида, дихлорметана и диэтилового эфира, сушили в вакууме и затем разделяли на пять аликвот. Одну аликвоту использовали для получения целевого соединения, указанного в заголовке данного примера, а другие аликвоты использовали в качестве исходного продукта в методах удаления, описанных, например, в примере 9. Таким образом, одной аликвоте давали набухать в дихлорметане и ее обрабатывали 1,5 мл смеси ТФК, дихлорметана, ТИС и воды (2:93:2,5:2,5) в течение 20 мин для отщепления защищенного пептида от смолы. Смолу фильтровали и собранный раствор разводили дихлорметаном и нейтрализовали путем добавления ДИПЭА (80 мкл, 1,2 экв. на 1 экв. ТФК). Растворитель удаляли в вакууме. После добавления воды и ацетонитрила раствор лиофилизировали, получая Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)Val-NH2(SEQ ID NO: 2). Продукт характеризовали с помощью ЖХ-МС и МСВР (ХИ): m/z рассчитано для C80H107N23O15S4[M+Na]+ 1780,7092, обнаружено 1780,7152. Пример 6. Получение Z-Arg(MIS)-Trp(Boc)-Ala-Glv-NH2 (SEO ID NO: 4). Амидную смолу Зибера (70 мг, 0,40 ммоль/г) помещали в полипропиленовый шприц вместимостью 2 мл, снабженный полиэтиленовым дисковым фильтром. Смоле давали набухать в дихлорметане, осуществляли промывки дихлорметаном и N,N-диметилформамидом и удаляли группу Fmoc. Осуществляли последовательное сочетание с Fmoc-Gly-OH (33,3 мг, 112 мкмоль), Fmoc-Ala-OH (34,9 мг, 112 мкмоль) иFmoc-Trp(Boc)-OH (59,0 мг, 112 мкмоль) в присутствии РуВОР (58,3 мг, 112 мкмоль), ГОАТ (15,2 мг, 112 мкмоль) и ДИПЭА (57,4 мкл, 336 мкмоль) в N,N-диметилформамиде в течение 1,5 ч. Смолу разделяли на две равные части. Одну часть использовали для получения целевого соединения, указанного в заголовке данного примера, а другую часть использовали для получения Z-Arg(Pbf)-Trp(Boc)-Ala-Gly-NH2 (см. пример 8.2). Так, Z-Arg(MIS)-OH (28,9 мг, 56 мкмоль) подвергали сочетанию с одной частью смолы в присутствии РуВОР (29,2 мг, 56 мкмоль), ГОАТ (7,6 мг, 56 мкмоль) и ДИПЭА (28,7 мкл, 168 мкмоль) в N,Nдиметилформамиде в течение 1,5 ч. Полученный таким путем защищенный связанный со смолой пептидZ-Arg(MIS)-Trp(Вос)-Ala-Gly-NH-ксантен-3-илокси-смола Меррифилда промывали N,N-диметилформамидом, дихлорметаном и диэтиловым эфиром, сушили в вакууме и затем разделяли на аликвоты по 4 мг. Одну аликвоту использовали для получения целевого соединения, указанного в заголовке данного примера, а другие аликвоты использовали в качестве исходного продукта в методах удаления, описанных, например, в примере 19. Таким образом, одной аликвоте давали набухать в дихлорметане и ее обрабатывали 1,5 мл смеси ТФК, дихлорметана, ТИС и воды (2:93:2,5:2,5) в течение 20 мин для отщепления защищенного пептида от смолы. Смолу фильтровали и собранный раствор разводили дихлорметаном и нейтрализовали путем добавления ДИПЭА (80 мкл, 1,2 экв. на 1 экв. ТФК). Растворитель удаляли в вакууме. После добавления воды и ацетонитрила раствор лиофилизировали, получая Z-Arg(MIS)-Trp(Boc)-Ala-Gly-NH2 с чистотой 95% (по данным анализа с помощью ЖХВР). Полученный продукт характеризовали с помощью ЖХ-МС. Пример 7. Получение MIS-Ala-OMe. Н-Ala-ОМе (95 мг, 0,68 ммоль, 1 экв.) растворяли в безводном дихлорметане и добавляли ДИПЭА(3 экв.). Добавляли раствор MIS-Cl (200 мг, 1,2 экв.), полученного согласно методу, описанному в примере 2, в безводном дихлорметане и реакционную смесь перемешивали в течение 1,5 ч при комнатной температуре. После проведения обычной обработки получали MIS-Ala-ОМе (85,4 мг, выход 40%). Пример 8. Получение защищенных группой Pbf соединений, служащих для сравнения. 8.1. Получение Ac-Phe-Arg(Pbf)-Arg(Pbf)-Arg(Pbf)-Arg(Pbf)-Val-NH2 (SEQ ID NO: 2). Применяли ту же самую процедуру, которую использовали для получения Ac-Phe-Arg(MIS)Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NH2 (см. пример 5), за исключением того, что Fmoc-Arg(MIS)-OH заменяли на Fmoc-Arg(Pbf)-OH (17,1 мг, 26,3 мкмоль). Полученный продукт характеризовали с помощью ЖХ-МС и МСВР (ХИ): m/z рассчитано для C92H136N19O19S4 [M+Н]+ 1938,9137, обнаружено 1938,9202. 8.2. Получение Z-Arg(Pbf)-Trp(Boc)-Ala-Glv-NH2 (SEQ ID NO: 4).Fmoc-Arg(Pbf)-OH (36,3 мг, 56 мкмоль) подвергали сочетанию с другой частью смолы (см. пример 6), в присутствии РуВОР (29,2 мг, 56 мкмоль), ГОАТ (7,6 мг, 56 мкмоль) и ДИПЭА (28,7 мкл, 168 мкмоль) в N,N-диметилформамиде в течение 1,5 ч. Группу Fmoc удаляли и свободную аминовую группу защищали с помощью группы Z путем обработки Z-OSu (14,0 мг, 56 мкмоль) и ДИПЭА (35,9 мкл, 210 мкмоль). Полученный таким путем защищенный связанный со смолой пептид Z-Arg(Pbf)-Trp(Boc)-AlaGly-NH-ксантен-3-илокси-смола Меррифилда промывали N,N-диметилформамидом, дихлорметаном и диэтиловым эфиром, сушили в вакууме и затем разделяли на аликвоты по 4 мг. Одну аликвоту использовали для получения целевого соединения, указанного в заголовке данного примера, а другие аликвоты использовали в качестве исходного продукта в методе анализа, который описан, например, в примере 20. Так, одну аликвоту использовали для осуществления отщепления, которое проводили таким же образом, как описано в примере 5. Получали Z-Arg(Pbf)-Trp(Boc)-Ala-Gly-NH2 с чистотой 96% (по данным анализа с помощью ЖХВР). Продукт характеризовали с помощью ЖХ-МС. 8.3. Получение Pbf-Ala-OMe. Получение осуществляли аналогично методу, описанному в примере 7, за исключением того, что применяли Pbf-Cl (1,2 экв.) вместо MIS-Cl. Выход: 209 мг (82%) Pbf-Ala-OMe. Примеры 9-12. Сравнительные анализы удаления защитных групп у защищенных с помощью MIS и защищенных с помощью Pbf связанных со смолой пептидов. Общая процедура. Защищенный связанный со смолой пептид (3 мг) обрабатывали применяемым для отщепления раствором (50 мкл). По истечении определенного промежутка времени, в течение которого проходило отщепление, раствор сливали на воду (4 мл). Затем выпаривали ТФК и дихлорметан. Полученный водный раствор промывали шесть раз дихлорметаном (используя каждый раз по 1 мл) и лиофилизировали. Образовавшийся твердый продукт анализировали с помощью ЖХВР ( = 220 нм) и MC-ESI или MALDI-TOF. Таблица 1 Результаты, полученные в примерах 9-12, при использовании в качестве раствора для отщепления смеси ТФК/ДХМ/ТИС/вода (50:45:2,5:2,5) (воду и ТИС применяли в качестве акцепторов)(сравнительный пример). ДХМ = дихлорметан. Примеры 13-15. Анализы удаления защитных групп у защищенных с помощью MIS связанных со смолой пептидов при использовании различных акцепторов. Применяли общую процедуру, описанную в примерах 9-12. В качестве защищенного связанного со смолой пептида использовали соединение Ac-Phe-Arg(MIS)-Arg(MIS)-Arg(MIS)-Arg(MIS)-Val-NHксантен-3-илокси-смола Меррифилда (SEQ ID NO: 1), полученное согласно методу, описанному в примере 5. Время отщепления составляло 60 мин. В качестве раствора для отщепления применяли смесь ТФК, дихлорметана и акцептора (50:40:10). Тестировали следующие акцепторы: 3,4-диметоксифенол (пример 13), 1,3,5-триметоксибензол(ТМБ) (пример 14) и 3,5-диметоксифенол (пример 15). Результаты показали, что количество MIS-OH снижалось более чем в 10 раз по сравнению с примером 9, в котором в качестве акцепторов применяли воду (2,5%) и ТИС (2,5%). В случае применения ТМБ было выявлено снижение более чем в 40 раз. Примеры 16 и 17. Сравнительные анализы удаления защитных групп у защищенных с помощьюMIS и защищенных с помощью Pbf связанных со смолой пептидов, которые содержат Trp. Применяли общую процедуру, описанную в примерах 9-12. Полученные неочищенные продукты характеризовали с помощью ЖХ-МС и их чистоту анализировали с помощью ЖХВР ( = 220 нм). Чистота полученного неочищенного продукта оказалась более высокой в том случае, когда применяли защищенный группой MIS исходный продукт, по сравнению с тем случаем, когда применяли защищенный группой Pbf исходный продукт. При использовании обоих вариантов защищенных пептидов в образовавшемся продукте не было выявлено ни нежелательного алкилирования, ни сульфонированияTrp. Таблица 2 Результаты, полученные в примерах 16 и 17, при использовании в качестве раствора для отщепления смеси ТФК/ДХМ/ТМБ (50:40:10) (ТМБ применяли в качестве акцептора)Z-Arg(MIS)-Trp-Ala-Gly-NH2 (SEQ ID NO: 4) не был обнаружен в полученном неочищенном продукте (по данным анализа с помощью ЖХ-МС);в полученном неочищенном продукте было обнаружено (по данным анализа с помощью ЖХВР) 20,4% Z-Arg(Pbf)-Trp-Ala-Gly-NH2 (SEQ ID NO: 4). Примеры 18-20. Сравнительные анализы удаления MIS и Pbf, применяемых в качестве Nаминозащитных групп. Защищенные аминокислоты обрабатывали раствором для отщепления при комнатной температуре,и удаление защитных групп оценивали с помощью ТСХ. Удаление MIS происходило несколько быстрее, о чем свидетельствовали положительные результаты теста Кайзера (указывающие на присутствие свободных аминов) через 5 мин, в то время как в случае защитной группы Pbf положительные результаты теста Кайзера были получены только при проведении следующего контрольного опыта (10 мин). Таблица 3 Результаты, полученные в примерах 18-20, при использовании в качестве раствора для отщепления смеси ТФК/диметилсульфид (90:10) (диметилсульфид применяли в качестве акцептора) присутствие или отсутствие Н-Ala-ОМе оценивали с помощью теста Кайзера. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, содержащее по меньшей мере один фрагмент формулы (III), где формула (III) определена следующим образом: где R1 обозначает водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; R2 обозначает С 1 С 6 алкил, С 1-С 6 алкоксигруппу или С 1-С 6 алкилтиогруппу; или R1 и R2 вместе образуют фрагмент формулы-(CH2)n-, где n обозначает целое число от 3 до 5; R3 обозначает водород, галоген, С 1-С 6 алкил, С 1- 16022476 С 6 алкоксигруппу, С 1-С 6 алкилтиогруппу, фенил или бензил, m обозначает 0 или 1; где указанное соединение представляет собой:(а) олигопептид, содержащий от двух до пятнадцати аминокислотных остатков, или полипептид,содержащий от шестнадцати до примерно пятидесяти аминокислотных остатков;(в) олигопептид, в котором один или несколько аминокислотных остатков химически модифицированы путем ацилирования, алкилирования, образования эфира или образования амида;(г) аминокислоту, химически модифицированную путем ацилирования, алкилирования, образования эфира или образования амида. 2. Соединение по п.1, содержащее по меньшей мере один гуанидиновый фрагмент, где этот гуанидиновый фрагмент является частью остатка аргинина, гомоаргинина или нораргинина. 3. Соединение по п.1, содержащее по меньшей мере одну аминогруппу, где по меньшей мере одна аминогруппа представляет собой N-концевую аминогруппу или часть боковой цепи аминокислотного остатка. 4. Соединение по п.3, содержащее по меньшей мере одну аминогруппу, где указанная по меньшей мере одна аминогруппа представляет собой часть остатка лизина, гомолизина или норлизина. 5. Соединение по п.3, содержащее только одну аминогруппу, которая представляет собой Nконцевую аминогруппу или которая является частью боковой цепи аминокислотного остатка. 6. Соединение по п.2, содержащее только один гуанидиновый фрагмент. 7. Соединение по п.1, представляющее собой MIS-Ala-OMe. 8. Соединение по п.1, представляющее собой связанное со смолой пептидное соединение. 9. Соединение по п.1, где указанное соединение защищено на боковой цепи и/или защищено на свободном конце. 10. Соединение по п.1, где указанное соединение представляет собой Nбензилоксикарбонил-N-(1,2-диметилиндол-3-сульфонил)-L-аргинин. 11. Соединение по п.1, где указанное соединение представляет собой NFmoc-N(1,2 диметилиндол-3-сульфонил)-L-аргинин. 12. Способ получения соединения по п.1, включающий стадию взаимодействия аминокислоты, определенной в п.1 подпункты (б) и (г), содержащей по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, с соединением формулы (II), где указанное соединение формулы где значения R1, R2 и R3 определены в п.1 и X обозначает хлор или бром, с последующим сочетанием, в случае если соединение представляет собой олигопептид, определенный в п.1 подпункт (а), или олигопептид, определенный в п.1 подпункт (в), полученных таким образом защищенных аминокислот между собой в необходимой последовательности. 13. Способ по п.12, в котором указанное соединение, которое взаимодействует с соединением формулы (II), представляет собой Z-Arg-OH, H-Ala-ОМе или Z-Lys-OH. 14. Способ по п.12, в котором R1 и R2 независимо друг от друга обозначают С 1-С 4 алкил, С 1 С 4 алкоксигруппу или С 1-С 4 алкилтиогруппу и R3 обозначает водород или галоген. 15. Способ по п.12, в котором R1 и R2 обозначают метил, R3 обозначает водород и X обозначает хлор. 16. Способ по п.12, где соединение, содержащее по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, представляет собой связанное со смолой пептидное соединение. 17. Способ по п.12, где соединение, содержащее по меньшей мере один гуанидиновый фрагмент и/или по меньшей мере одну аминогруппу, защищено на боковой цепи и/или защищено на свободном конце. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 209/30
Метки: защищенные, соединения, способ, получения, индолсульфонильные
Код ссылки
<a href="https://eas.patents.su/18-22476-indolsulfonilnye-zashhishhennye-soedineniya-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Индолсульфонильные защищенные соединения и способ их получения</a>
Предыдущий патент: Способ секвенирования днк
Следующий патент: Способ получения монолитной керамической массы
Случайный патент: Способ нанесения упрочняющего покрытия на металлические изделия






















