N,n-диметил-5-(2-метил-6-((5-метилпиразин-2-ил)карбамоил)бензофуран-4-илокси)пиримидин-2-карбоксамид, используемый в качестве активатора глюкокиназы, и содержащая его фармацевтическая композиция
Формула / Реферат
1. N,N-Диметил-5-(2-метил-6-((5-метилпиразин-2-ил)карбамоил)бензофуран-4-илокси)пиримидин-2-карбоксамид, имеющий следующую структуру:
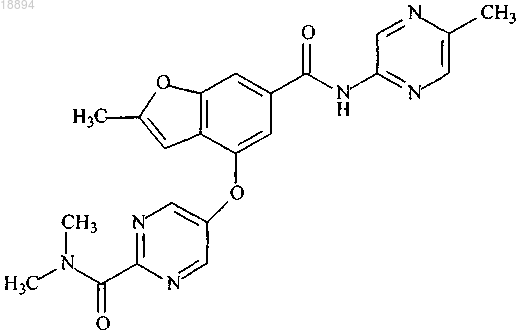
или его фармацевтически приемлемая соль.
2. Соединение по п.1, имеющее следующую структуру

3. Фармацевтическая композиция, активирующая глюкокиназу, содержащая (1) соединение по п.1 или его фармацевтически приемлемую соль; и (2) фармацевтически приемлемый эксципиент, разбавитель или носитель.
4. Композиция по п.3, где указанное соединение или его указанная фармацевтически приемлемая соль присутствуют в терапевтически эффективном количестве.
Текст
N,N-ДИМЕТИЛ-5-(2-МЕТИЛ-6-5-МЕТИЛПИРАЗИН-2-ИЛ)КАРБАМОИЛ)БЕНЗОФУРАН-4-ИЛОКСИ)ПИРИМИДИН-2-КАРБОКСАМИД, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ АКТИВАТОРА ГЛЮКОКИНАЗЫ, И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В изобретении предложено соединение формулы Линг Энтони Лэй, Пфефферкорн Джеффри Аллен (US) Поликарпов А.В. (RU) Область изобретения Настоящее изобретение относится к замещенным производным бензофуранила, а также к фармацевтическим композициям и их применению в качестве активаторов глюкокиназы. Предшествующий уровень техники Диабет представляет собой значительную проблему для здравоохранения вследствие роста его распространения и связанных с ним риском для здоровья. Заболевание характеризуется метаболическими нарушениями в продуцировании и усвоении углеводов, которые приводят к неспособности поддерживать адекватный уровень глюкозы в крови. Различают два основных типа диабета. Диабет 1 типа, или инсулинозависимый сахарный диабет (ИЗСД), является результатом абсолютного дефицита инсулина. Диабет 2 типа, или инсулиннезависимый сахарный диабет (ИНСД), часто наблюдается при нормальном или даже повышенном уровне инсулина, и по всей видимости является результатом неспособности тканей и клеток соответствующим образом реагировать на инсулин. Активный контроль ИНСД с помощью медикаментов жизненно важен, в противном случае он может развиться в ИЗСД. При увеличении уровня глюкозы в крови она транспортируется в панкреатические бета-клетки переносчиками глюкозы. Внутриклеточная глюкокиназа млекопитающих (ГК) определяет повышение глюкозы и активирует клеточный гликолиз, т. е. преобразование глюкозы в глюкозо-6-фосфат, и последующее высвобождение инсулина. Глюкокиназа в основном встречается в панкреатических бета-клетках и паренхимных клетках печени. Так как перенос глюкозы из крови в мышечные и жировые ткани зависит от инсулина, диабетики не способны адекватно усваивать глюкозу, что приводит к нежелательному накоплению глюкозы в крови (гипергликемии). Хроническая гипергликемия ведет к снижению секреции инсулина и способствует повышению резистентности к инсулину. Глюкокиназа также выступает в роли рецептора в паренхимных клетках печени, который индуцирует синтез гликогена и тем самым предотвращает высвобождение глюкозы в кровь. Таким образом, процессы с участием ГК являются критическими для поддержки гомеостаза глюкозы во всем организме. Можно ожидать, что агент, который активирует клеточную ГК будет способствовать глюкозозависимой секреции из панкреатических бета-клеток, корректировать гипергликемию, возникающую после приема пищи, усиливать утилизацию глюкозы печенью и вероятно ингибировать высвобождение глюкозы печенью. Следовательно, активатор ГК может обеспечить терапевтическое лечение ИНСД и связанных с ним осложнений, в том числе гипергликемии, дислипидемии, синдрома инсулинорезистентности,гиперинсулинемии, гипертонии и ожирения. Для лечения гипергликемии и, следовательно, ИНСД, доступен ряд лекарственных средств пяти основных категорий, отличающихся по механизму своего действия (Moller, D. E., "New drug targets for Type 2 diabetes and the metabolic syndrome" Nature 414; 821-827, (2001: (А) Средства, усиливающие секрецию инсулина, включая сульфонилмочевины (например, глипизид, глимепирид, глибурид) и меглитиниды(например, натеглинид и репаглинид), увеличивают секрецию инсулина, воздействуя на панкреатические бета-клетки. Хотя эта терапия может понизить уровень глюкозы в крови, ее эффективность и переносимость ограничена, она приводит к прибавлению в весе и часто вызывает гипогликемию. (В) Бигуаниды(например, метформин), которые, как считают, действуют в основном за счет снижения образования глюкозы в печени. Бигуаниды часто вызывают желудочно-кишечные расстройства и лактоцидоз, что ограничивает их применение. (С) Ингибиторы альфа-глюкозидазы (например, акарбоза) снижают кишечную абсорбцию глюкозы. Эти агенты часто вызывают желудочно-кишечные расстройства. (D) Тиазолидиндионы (например, пиоглитазон, розиглитазон) действуют на специфические рецепторы (гаммарецептор, активируемый пролифератором пероксисом) в печени, мышечных и жировых тканях. Они регулируют липидный метаболизм, тем самым усиливая реакцию этих тканей на воздействие инсулина. Частое применение этих лекарственных средств может приводить к увеличению массы тела и может вызывать отек и анемию. (Е) Инсулин применяют в более серьезных случаях, либо отдельно, либо в комбинации с вышеупомянутыми агентами. В идеале новое эффективное средство для лечения ИНСД должно отвечать следующим критериям:(а) оно не должно иметь существенных побочных эффектов, включая индукцию гипогликемии; (b) оно не должно вызывать увеличения массы тела; (с) оно должно по меньшей мере частично замещать инсулин, действуя за счет механизма(ов), которые независимы от действия инсулина; (d) для снижения частоты использования желательно, чтобы оно было метаболически стабильно; и (е) оно должно быть применимо в комбинации с допустимыми количествами лекарственных средств всех перечисленных выше категорий. Замещенные гетероарилы, в частности пиридоны, вовлечены в регуляцию ГК и могут сыграть существенную роль в лечении ИНСД. Например, в публикации патента США 2006/0058353 и публикациях РСТWO 2007/043638, WO 2007/043638 и WO 2007/117995 перечислены некоторые гетероциклические производные, полезные для лечения диабетов. Несмотря на непрекращающиеся исследования, все еще существует потребность в более эффективном и безопасном терапевтическом лечении диабета, в частности ИНСД. Краткое изложение сущности изобретения В настоящем изобретении предложен N,N-диметил-5-(2-метил-6-5-метилпиразин-2-ил)карбамоил) бензофуран-4-илокси)пиримидин-2-карбоксамид, имеющий следующую структуру: или его фармацевтически приемлемая соль, которые действуют как медиаторы глюкокиназы, в частности, как активаторы глюкокиназы; и следовательно могут быть использованы в лечении заболеваний, опосредованных такой активацией (например, заболеваний, относящихся к диабету 2 типа, и связанных с диабетом и ожирением сопутствующих заболеваний). В другом аспекте настоящего изобретения предложено соединение, имеющее следующую структуру: В еще одном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая (1) соединение по настоящему изобретению и (2) фармацевтически приемлемый эксципиент, разбавитель или носитель. Предпочтительно композиция содержит терапевтически эффективное количество соединения по настоящему изобретению. Определения Использованный здесь термин "алкил" относится к углеводородному радикалу общей формулыCnH2n+1. Алкановый радикал может быть линейным или разветвленным. Например, термин "(C1-C6)алкил" относится к моновалентной, линейной или разветвленной алифатической группе, содержащей от 1 до 6 атомов углерода (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, третбутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, неопентил, 3,3-диметилпропил, гексил, 2 метилпентил и тому подобное). Аналогичным образом, такое же, как указано выше, определение относится к алкильной части (т.е. алкильной группировке) групп алкокси, ацил (например, алканоил), алкиламино, диалкиламино, алкилсульфонил и алкилтио. Если указано "возможно замещенный", алкановый радикал или алкильная группировка могут быть незамещенными или замещены одним или более чем одним заместителем (обычно от одного до трех заместителей, за исключением случая галогеновых заместителей как, например, в перхлор- или перфторалкилах), независимо выбранным из группы заместителей, перечисленных ниже в определении термина "замещенный". "Галогенозамещенный алкил" относится к алкильной группе, замещенной одним или более чем одним атомом галогена (например, фторметил, дифторметил, трифторметил, перфторэтил, 1,1-дифторэтил и тому подобное). Термин "циклоалкил" относится к неароматическим кольцам, которые полностью гидрированы и могут существовать в форме одного кольца, бициклического кольца или спирального кольца. Если не указано иное, карбоциклическое кольцо обычно имеет от 3 до 8 членов. Например, циклоалкил включает такие группы, как циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, норборнил (бицикло[2.2.1]гептил), бицикло[2.2.2]октил и тому подобные группы. Термин "гетероцикл" относится к неароматическим кольцам, которые полностью гидрированы и могут существовать в форме одного кольца, бициклического кольца или спирального кольца. Если не указано иное, гетероциклическое кольцо обычно имеет от 3 до 8 членов и содержит от 1 до 3 гетероатомов (предпочтительно 1 или 2 гетероатома), независимо выбранных из серы, кислорода и/или азота. Гетероциклические кольца включают такие группы, как эпокси, азиридинил, тетрагидрофуранил, пирролидинил, N-метилпирролидинил, пиперидинил, пиперазинил, пиразолидинил, 4 Н-пиранил, морфолино,тиоморфолино, тетрагидротиенил, тетрагидротиенил-1,1-диоксид и тому подобное. Фраза "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое (1) лечит или предотвращает определенное заболевание, состояние или расстройство, (2) ослабляет, смягчает или устраняет один или более чем один симптом определенного заболевания, состояния или расстройства, или (3) предотвращает или задерживает возникновение одного или более чем одного симптома конкретного заболевания, состояния или расстройства, описанного в данном документе. Термин "животное" относится к людям (мужского или женского пола), домашним животным (например, собакам, кошкам или лошадям), животным, которые могут служить источником пищи, животным, содержащимся в неволе, морским животным, птицам и другим подобным видам животных. Термин"пригодные в пищу животные" относится к животным, которые могут служить источником пищи, таким как коровы, свиньи, овцы и домашняя птица. Фраза "фармацевтически приемлемый" указывает, что вещество или композиция должн быть совместимы химически и/или токсикологически с другими ингредиентами, составляющими лекарственный препарат, и/или с млекопитающим, лечение которого проводится с помощью этого вещества или соединения. Термины "процесс лечения", "лечение" или "лечить" охватывают как предупредительное, т.е. профилактическое, так и паллиативное лечение. Использованные здесь термины "модулируемый", "модулирование" или "модулировать", если не указано иное, относятся к активации фермента глюкокиназы соединениями по настоящему изобретению. Использованные здесь термины "опосредованный" или "опосредующий", или "опосредовать", если не указано иное, относятся к лечению или предупреждению определенного заболевания, состояния или расстройства, (2) ослаблению, смягчению или устранению одного или более чем одного симптома конкретного заболевания, состояния или расстройства, или (3) предупреждению или задержке возникновения одного или более чем одного симптома конкретного заболевания, состояния или расстройства, описанного в данном документе, путем активации фермента глюкокиназы посредством улучшения связывания глюкозы, ослабления ингибирования регуляторного белка глюкокиназы, ключевого регулятора активности глюкокиназы в печени, и/или увеличения каталитической активности фермента глюкокиназы(например, изменения Vmax). Термин "соединения по настоящему изобретению" (если специально не указано иное) относится к соединениям формулы (I) и любым фармацевтически приемлемым солям соединений, а также ко всем стереоизомерам (включая диастереомеры и энантиомеры), таутомерам, конформационным изомерам и соединениям, меченым изотопами. Гидраты и сольваты соединений по настоящему изобретению рассматриваются как композиции по настоящему изобретению, где соединение ассоциировано с водой или растворителем, соответственно. Подробное описание Соединения по настоящему изобретению могут быть синтезированы согласно схемам синтеза,включающим способы, аналогичные тем, которые хорошо известны в области химии, в частности принимая во внимание данное описание. Исходные вещества, как правило, имеются в продаже у таких коммерческих поставщиков, как Aldrich Chemicals (Milwaukee, WI) или легко могут быть получены способами, которые хорошо известны специалистам в данной области (например, получены способами, в целом описанными в Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, New York(1967-1999 ed.), или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая дополнения (также доступно через онлайновую базу данных Beilstein. В качестве иллюстрации представленные ниже схемы реакций предлагают возможные пути синтеза соединений по настоящему изобретению, а также основные промежуточные соединения. Более подробное описание отдельных стадий реакций находится ниже, в разделе примеры. Для специалистов в данной области очевидно, что для синтеза соединений по изобретению могут быть использованы другие способы. Хотя в нижеприведенных схемах и описаниях указаны конкретные исходные вещества и реагенты,они могут быть легко заменены другими исходными веществами и реагентами для получения ряда производных и/или проведения реакций в других условиях. Кроме того, многие соединения, полученные описанными ниже способами, могут быть впоследствии модифицированы, учитывая данное описание, с помощью традиционных химических процессов, общеизвестных специалистам в данной области. При получении соединений по настоящему изобретению может потребоваться защита отдельных функциональных групп (например, первичных или вторичных аминов) промежуточных соединений. Необходимость такой защиты будет зависеть от природы отдельных функциональных групп и условий способа получения. Подходящие амино-защитные группы (NH-Pg) включают ацетил, трифторацетил, третбутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-флуоренилметоксикарбонил (Fmoc). Аналогично термин "гидрокси-защитная группа" относится к заместителю гидроксильной группы, которые блокирует или защищает гидроксильную функциональную группу. Подходящие гидрокси-защитные группы(O-Pg) включают, например, аллил, ацетил, силил, бензил, пара-метоксибензил, тритил и тому подобные группы. Необходимость такой защиты легко может определить специалист в данной области. Общее описание защитных групп и их использования содержится в Т.W. Greene, Protective Groups in OrganicSynthesis, John WileySons, New York, 1991. На схеме I приведены общие способы, которые могут быть использованы для получения соединений формулы (I). Диэтилсукцинат и 5-метил-2-фуральдегид могут быть конденсированы с образованием промежуточного соединения (Ia) в стандартных условиях реакции альдольной конденсации. Например, два исходных вещества могут быть обработаны сильным основанием при нагревании (например, этоксидом натрия при кипячении с обратным холодильником в этаноле) с последующим подкислением. Бензофурановое кольцо в промежуточном соединении (Ib) может быть получено обработкой промежуточного соединения (Ia) уксусным ангидридом и ацетатом натрия примерно при комнатной температуре с последующим нагреванием до температуры дефлегмации. Затем ацетатная группа может быть удалена с получением гидроксильного промежуточного соединения (Ic), которое далее благодаря свободной гидроксильной группе позволяет добавить требуемую пиразиниламидную или пиримидиламидную группировку с образованием промежуточного соединения (Id). После этого может быть проведена реакция промежуточного соединения (Id) с требуемым амином (R3NH2) для получения соединения формулы (I) в стандартных условиях реакции амидирования, общеизвестных специалистам в данной области. Нижеприведенные примеры дают более подробное описание условий представленных выше реакций. Соединения по настоящему изобретению могут быть выделены и использованы в чистом виде или,если возможно, в виде их фармацевтически приемлемой соли. Термин "соли" относится к неорганическим и органическим солям соединения по настоящему изобретению. Эти соли могут быть получены insitu на заключительной стадии выделения и очистки соединения, или с помощью отдельной реакции соединения с подходящей органической или неорганической кислотой или основанием и выделения образовавшейся в результате этого соли. Типичные соли включают бромид, хлорид, иодид, сульфат, бисульфат, нитрат, ацетат, трифторацетат, оксалат, бесилат, пальмитат, памоат, малонат, стеарат, лаурат, манат,борат, бензоат, лактат, фосфат, гексафторфосфат, бензолсульфонат, тозилат, формиат, цитрат, малеат,фумарат, сукцинат, тартрат, нафталат, мезилат, глюкогептонат, лактобионат и лаурилсульфат, и тому подобные соли. Они могут включать катионы щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний, и тому подобных металлов, а также нетоксичные аммониевые, четвертичные аммониевые и аминные катионы, включая, но не ограничиваясь, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин и тому подобные катионы. Более подробная информация содержится, например, в Berge, et al., J. Pharm. Sci., 66, 1-19 (1977). Соединения по настоящему изобретению могут содержать асимметричные или хиральные центры,и тем самым существовать в различных стереоизомерных формах. Если не указано иное, подразумевается, что все стереоизомерные формы соединений по настоящему изобретению, а также их смеси, включая рацемические смеси, являются частью настоящего изобретения. Кроме того, настоящее изобретение охватывает все геометрические и позиционные изомеры. Например, если соединение по настоящему изобретению включает двойную связь или конденсированное кольцо, то в объем изобретения включены как цис-, так и транс- формы, а также их смеси. Диастереомерные смеси могут быть разделены на отдельные диастереоизомеры на основании их физико-химических различий способами, хорошо известными специалистам в данной области, напри-4 018894 мер, хроматографией и/или фракционной кристаллизацией. Энантиомеры могут быть разделены путем превращения энантиомерной смеси в диастереомерную смесь реакцией с подходящим оптически активным соединением (например, хиральным вспомогательным реагентом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереоизомеров и преобразованием (например, гидролизацией) индивидуальных диастереоизомеров в соответствующие чистые энантиомеры. Также некоторые соединения по настоящему изобретению могут быть атропоизомерами (например, замещенные биарилы) и рассматриваются как часть настоящего изобретения. Энантиомеры также могут быть разделены с помощью хиральной ВЭЖХ колонки. Альтернативно, конкретный стереоизомер может быть синтезирован с помощью оптически активных исходных веществ, асимметричным синтезом с применением оптически активных реагентов, субстратов, катализаторов или растворителей или преобразованием одного стереоизомера в другой путем ассиметричной трансформации. Возможно также, что промежуточные соединения и соединения по настоящему изобретению могут существовать в различных таутомерных формах, и все такие формы включены в объем изобретения. Термины "таутомер" или "таутомерная форма" относятся к структурным изомерам различной энергии,взаимное превращение которых имеет низкий энергетический барьер. Например, протонная таутомерия(также известная как прототропная таутомерия) включает взаимные превращения в результате миграции протона, таких как кето-енольная и имин-енаминная изомеризация. Конкретным примером протонного таутомера является имидазольная группировка, в которой протон может мигрировать между двумя атомами азота в кольце. Валентная таутомерия заключается во взаимных превращениях в результате перераспределения некоторых электронов в связях. Некоторые соединения по настоящему изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделимыми. Торсионная асимметрия (torsional asymmetry), обусловленная ограничением вращения вокруг ассиметричной одинарной связи вследствие, например, стерического препятствия или деформации кольца,может сделать возможным разделение различных конформеров. Настоящее изобретение также охватывает меченые изотопами соединения по настоящему изобретению, которые идентичны соединениям, перечисленным в данном документе, за исключением того, что один или более чем один атом замещены атомами, имеющими атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, йода и хлора, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 13N, 15N, 15O, 17O,18O, 31P, 32P, 35S, 18F, 123I,125I и 36Cl, соответственно. Некоторые меченые изотопами соединения по настоящему изобретению (например, соединения меченые 3 Н и 14 С) полезны для анализа распределения соединения и/или субстрата в тканях. Благодаря простоте получения и обнаружения особенно предпочтительны изотопы тритий (т.е. 3 Н) и углерод-14(т.е. 14 С). Кроме того замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2 Н), может давать определенные терапевтические преимущества вследствие повышенной метаболической стабильности(например, увеличение периода полувыведения in vivo или снижение требуемой дозировки) и поэтому в определенных обстоятельствах может быть предпочтительным. Изотопы, излучающие позитроны, такие как 15 О, 13N, 11 С и 18F, полезны для изучения с помощью позитронно-эмиссионной томографии (ПЭТ) распространения субстрата. Меченые изотопами соединения по настоящему изобретению в общем случае могут быть получены с использованием способов, аналогичных тем, которые раскрыты в данном документе в схемах и/или в нижеприведенных примерах, путем замены немеченых изотопами реагентов мечеными изотопами реагентами. Некоторые соединения по настоящему изобретению могут существовать в более чем одной кристаллической форме (обычно такие соединения называют "полиморфами"). Полиморфы могут быть получены кристаллизацией в различных условиях, например, с применением при перекристаллизации различных растворителей или различных смесей растворителей; кристаллизацией при различных температурах; и/или различными режимами охлаждения, которые могут варьировать от очень быстрого до очень медленного охлаждения в ходе кристаллизации. Полиморфы также могут быть получены нагреванием или плавлением соединения по настоящему изобретению с последующим постепенным или быстрым охлаждением. Наличие полиморфов может быть определено в твердом образце ЯМР спектроскопией, ИК спектроскопией, дифференциальной сканирующей калориметрией, дифракцией рентгеновских лучей на порошке и прочими подобными методами. Соединения по настоящему изобретению полезны для лечения заболеваний, состояний и/или расстройств, модулируемых активацией фермента глюкокиназа; соответственно, еще одно воплощение настоящего изобретения представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый эксципиент, разбавитель или носитель. Соединения по настоящему изобретению (включая композиции и способы, используемые в данном документе) могут быть также использованы в производстве лекарственного средства для терапевтических применений, описанных в данном документе. Типичный лекарственный препарат изготавливают путем смешивания соединения по настоящему изобретению и носителя, разбавителя или эксципиента. Подходящие носители, разбавители и эксципиенты хорошо известны специалистам в данной области и включают такие вещества, как углеводы, воски,растворимые и/или набухающие в воде полимеры, гидрофильные или гидрофобные вещества, желатин,масла, растворители, воду и тому подобные вещества. Использование конкретного носителя, разбавителя или эксципиента будет зависеть от способа и цели применения соединения по настоящему изобретению. Обычно растворители выбирают среди тех растворителей, которые признаны специалистами в данной области безопасными (GRAS) для введения млекопитающему. Как правило, безопасные растворители представляют собой нетоксичные водные растворители, такие как вода, и другие нетоксичные растворители, которые растворимы в воде или легко смешиваются с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоль (например, ПЭГ 400, ПЭГ 300) и т.д., и их смеси. Лекарственные препараты также могут включать один или более чем один буфер, стабилизатор,поверхностно-активное вещество, увлажнитель, смазывающее вещество, эмульгатор, суспендирующий агент, консервант, антиокислитель, замутняющий агент, глидант, технологическую добавку, краситель,подсластитель, ароматизирующую добавку, вкусовую добавку и другие известные добавки для придания лекарственному средству (т.е. соединению по настоящему изобретению или содержащей его фармацевтической композиции) привлекательного внешнего вида или для облегчения производства фармацевтического продукта (т.е. лекарственного средства). Лекарственные препараты могут быть изготовлены с использованием хорошо известных способов растворения и смешивания. Например, активное вещество лекарственного средства (т.е. соединение по настоящему изобретению или стабилизированная форма соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим агентом растворяют в подходящем растворителе в присутствии одного или более чем одного эксципиента, описанного выше. Соединение по настоящему изобретению обычно включают в состав фармацевтической лекарственной формы для того,чтобы обеспечить легко контролируемую дозировку лекарственного средства и предоставить пациенту привлекательный и простой в использовании продукт. Фармацевтические композиции также включают сольваты и гидраты соединений формулы (I). Термин "сольват" относится к молекулярному комплексу соединения, представленного формулой (I) (включая его фармацевтически приемлемые соли) с одной или более чем одной молекулой растворителя. Такие молекулы растворителя представляют собой молекулы широко применяемых в фармацевтике растворителей, которые известны как безвредные для реципиента, например, воды, этанола, этиленгликоля и тому подобных соединений. Термин "гидрат" относится к комплексу, в котором молекула растворителя является водой. Сольваты и/или гидраты предпочтительно существуют в кристаллической форме. При получении более предпочтительных сольватов в качестве промежуточных растворителей могут быть использованы другие растворители, такие как метанол, метил-трет-бутиловый эфир, этилацетат, метилацетат,(S)-пропиленгликоль, (R)-пропиленгликоль, 1,4-бутиндиол и тому подобные соединения. Фармацевтическая композиция (или лекарственный препарат) для применения может быть упакована различным образом в зависимости от способа, используемого для введения лекарственного средства. Обычно продукт для распространения включает контейнер с помещенным внутрь него фармацевтическим лекарственным препаратом в подходящей форме. Подходящие контейнеры общеизвестны специалистам в данной области и включают такие продукты, как флаконы (пластиковые и стеклянные), пакеты-саше, ампулы, пластиковые пакеты, металлические цилиндры и тому подобные контейнеры. Контейнер также может включать защиту от несанкционированного вскрытия для предотвращения случайного доступа к содержимому упаковки. Кроме того, контейнер имеет помещенную на него этикетку, которая описывает содержимое контейнера. Этикетка также может включать соответствующие предупреждения. Далее в настоящем изобретении предложен способ лечения заболеваний, состояний и/или расстройств, модулируемых активацией фермента глюкокиназы, у животных, включающий введение животному, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению или фармацевтической композиции, содержащей терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый эксципиент, разбавитель или носитель. Способ особенно полезен для лечения заболеваний, состояний и/или расстройств,при которых активация глюкокиназы является благоприятной и которые включают: пищевые расстройства (например, компульсивное переедание, анорексия, булимия, потеря или контроль массы тела и ожирение) (Otaegui, P.J., et.al., "Prevention of obesity and insulin resistance by glucokinase expression in skeletalp-cell dysfunction in type-II diabetes", Annul. Rev. Medicine, 47; 69-83, (1996. Один из аспектов настоящего изобретения представляет собой лечение ожирения и связанных с ожирением расстройств (например, избыточной массы тела, увеличения массы тела или поддержания массы тела). Ожирение и избыточную массу тела, как правило, определяют с помощью индекса массы тела(ИМТ), который коррелирует с общим количеством жира в организме и позволяет оценить относитель-6 018894 ный риск заболеваний. ИМТ рассчитывают как масса в килограммах, деленная на квадрат роста в метрах(кг/м 2). Вес обычно считают избыточным при ИМТ равном 25-29,9 кг/м 2, а наличие ожирения обычно определяют при ИМТ равном 30 кг/м 2. Более подробная информация содержится, например, в NationalServices, NIH publication no. 98-4083 (1998). Другой аспект настоящего изобретения предназначен для лечения или замедления развития или возникновения диабета или связанных с диабетом расстройств, включая диабет 1 типа (инсулинозависимый сахарный диабет, также обозначаемый как ИЗСД) и 2 типа (инсулиннезависимый сахарный диабет,также обозначаемый как ИНСД), нарушение толерантности к глюкозе, инсулинорезистентность, гипергликемию и диабетические осложнения (такие как атеросклероз, ишемическая болезнь сердца, инсульт,заболевания периферических сосудов, нефропатия, гипертония, невропатия и ретинопатия). Еще один аспект настоящего изобретения представляет собой лечение связанных с диабетом и ожирением сопутствующих заболеваний, таких как метаболический синдром. Метаболический синдром включает такие заболевания, состояния или расстройства, как дислипидемия, гипертония, инсулинорезистентность, диабет (например, диабет 2 типа), увеличение массы тела, ишемическая болезнь сердца и сердечная недостаточность. Более подробная информация о метаболическом синдроме содержится, например, в Zimmet, P.Z., et al., "The Metabolic Syndrome: Perhaps an Etiologic Mystery but Far From a Myth Where Does the International Diabetes Federation Stand", DiabetesEndocrinology, 7(2), (2005); и Alberti,K.G., et al., "The Metabolic Syndrome - A New Worldwide Definition", Lancet. 366, 1059-62 (2005). Предпочтительно введение соединений по настоящему изобретению обеспечивает статистически значимое(р 0,05) снижение по меньшей мере одного фактора риска сердечно-сосудистого заболевания, такого как снижение лептина плазмы, С-реактивного белка (СРБ) и/или холестерина, по сравнению с контролем носителем, не содержащим лекарственное средство. Введение соединений по настоящему изобретению также может давать статистически значимое (р 0,05) снижение уровня глюкозы в сыворотке. В еще одном аспекте настоящего изобретения, состояние, которое лечат, представляет собой нарушение толерантности к глюкозе, гипергликемию, диабетические осложнения, такие как катаракта, вызванная сахарным диабетом, диабетическая невропатия, диабетическая нефропатия, диабетическая ретинопатия и диабетическая кардиомиопатия, нервная анорексия, булимия, кахексия, гиперурикемия, гиперинсулинемия, гиперхолестеринемия, гиперлипидемия, дислипидемия, смешанная дислипидемия, гипертриглицеридемия, неалкогольная жировая болезнь печени, атеросклероз, артериосклероз, острая сердечная недостаточность, застойная сердечная недостаточность, ишемическая болезнь сердца, кардиомиопатия, инфаркт миокарда, стенокардия, гипертония, гипотония, инсульт, ишемия, ишемическое реперфузионное повреждение, аневризма, рестеноз, сужение сосудов, солидные опухоли, рак кожи, меланома,лимфома, рак молочной железы, рак легкого, рак ободочной и прямой кишки, рак желудка, рак пищевода, рак поджелудочной железы, рак предстательной железы, рак почки, рак печени, рак мочевого пузыря,рак шейки матки, рак матки, рак яичка и рак яичника. Настоящее изобретение также относится к терапевтическим способам лечения вышеуказанных состояний у млекопитающего, включая человека, где соединение формулы (I) по настоящему изобретению вводится как часть подходящей схемы приема лекарственного средства, разработанной для получения положительного эффекта от терапии. Подходящая схема приема, объем каждой вводимой дозы и интервалы между дозами соединения будут зависеть от используемого соединения формулы (I) по настоящему изобретению, типа используемой фармацевтической композиции, характеристик субъекта, которого лечат, и тяжести состояний. В общем, эффективная дозировка соединений по настоящему изобретению находится в пределах от 0,01 до 30 мг/кг/день, предпочтительно от 0,01 до 5 мг/кг/день активного соединения в однократной или раздельных дозах. Однако в зависимости от возраста и массы тела субъекта, которого лечат, планируемого способа введения, конкретного вводимого соединения и тому подобных факторов могут потребоваться некоторые изменения обычного диапазона доз. Определение диапазона доз и оптимальных дозировок для конкретного пациента полностью находится в компетенции обычного специалиста в данной области с учетом настоящего описания. Для практикующих врачей очевидно, что "кг" относится к массе тела пациента в килограммах. Соединения или композиции по настоящему изобретению могут быть введены в виде однократной(т.е. один раз в сутки) или многократной дозой или посредством постоянной инфузии. Соединения по настоящему изобретению могут быть также введены отдельно или в комбинации с фармацевтически приемлемыми носителями, средами и разбавителями, в виде либо однократной, либо многократной дозы. Подходящие фармацевтические носители, среды и разбавители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Соединения или композиции по настоящему изобретению могут быть введены субъекту, нуждающемуся в лечении, различными общепринятыми путями введения, включая пероральный и парентеральный (например, внутривенный, подкожный или интрамедуллярный). Кроме того, фармацевтические композиции по настоящему изобретению могут быть введены интраназально в виде суппозиториев или в виде быстрорастворимой ("flash") лекарственной формы, т. е. формы, которая обеспечивает растворение лекарственного средства во рту без использования воды. Также следует отметить, что соединения по настоящему изобретению могут быть использоваться в лекарственных формах с непрерывным высвобождением, управляемым высвобождением и замедленным высвобождением, которые также общеизвестны обычным специалистам в данной области. Соединения по настоящему изобретению также могут применяться вместе с другими фармацевтическими агентами для лечения заболеваний, состояний и расстройств, описанных в данном документе. Следовательно, также предложены способы лечения, включающие введение соединений по настоящему изобретению в комбинации с другими фармацевтическими агентами. Подходящие фармацевтические агенты, которые могут быть использованы в комбинации с соединениями по настоящему изобретению,включают агенты против ожирения (включая средства для подавления аппетита), антидиабетические агенты, антигипергликемические агенты, гиполипидемические агенты и гипотензивные агенты. Подходящие антидиабетические агенты включают ингибитор ацетил-КоА-карбоксилазы-2 (АСС-2),ингибитор диацилглицерин-О-ацилтрансферазы-1 (DGAT-1), ингибитор фосфодиэстеразы (PDE)-10,сульфонилмочевину (например, ацетогексамид, хлорпропамид, диабинез, глибенкламид, глипизид, глибурид, глимепирид, гликлазид, глипентид, гликвидон, глизоламид, толазамид и толбутамид), меглитинид, ингибитор -амилазы (например, тендамистат, трестатин и AL-3688), ингибитор а-гликозидгидролазы (например, акарбозу), ингибитор а-гликозидазы (например, адипозин, камиглибозу, эмиглитат, миглитол, воглибозу, прадимицин-Q и сальбостатин), агонист рецепторов, активирующих пролиферацию пероксисом PPAR (например, балаглитазон, циглитазон, дарглитазон, энглитазон, изаглитазон,пиоглитазон, росиглитазон и троглитазон), агонист PPAR / (например, CLX-0940, GW-1536, GW-1929,GW-2433, KRP-297, L-796449, LR-90, МК-0767 и SB-219994), бигуанид (например, метформин), агонист глюкагон-подобных белков типа 1 (GLP-1) (например, эксендин-3 и эксендин-4), ингибитор протеинтирозинфосфатазы-1 В (РТР-1 В) (например, тродусквемин, экстракт гиртиозала и соединения, раскрытые в Zhang, S., et al., Drug Discovery Today. 12(9/10), 373-381 (2007, ингибитор SIRT-1 (например, резерватрол), ингибитор дипептидилпептидазы IV (DPP-IV) (например, ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин), средство, усиливающее секрецию инсулина, ингибитор окисления жирных кислот,антагонист А 2, ингибитор c-jun N-терминальной киназы (JNK), инсулин, миметик инсулина, ингибитор гликогенфосфорилазы и агонист рецептора VPAC2. Предпочтительными антидиабетическими агентами являются метформин и ингибиторы DPP-IV (например, ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин). Подходящие агенты против ожирения включают ингибиторы 11-гидрокси-стероид-дегидрогеназы типа 1 (11-HSD типа 1), ингибитор стеароил-СоА-десатуразы-1 (SCD-1), агонисты меланокортинового рецептора MCR-4, агонисты холецистокинина-А (ССК-А), ингибиторы обратного захвата моноаминов(таких как бромокриптин), аналоги меланоцитостимулирующих гормонов, агонисты 5 НТ 2 с, антагонисты меланиноконцентрирующих гормонов, лептин (ОВ белок), аналоги лептина, агонисты лептина, антагонисты галанина, ингибиторы липазы (таких как тетрагидролипстатин, т. е. орлистат), анорексигенные агенты (такие как агонист бомбезина), антагонисты нейропептидов-Y (например, антагонистов NPY Y5),PYY3-36 (включая его аналоги), тиромиметические агенты, дегидроэпиандростерон или его аналоги, глюкокортикоидные агонисты или антагонисты, антагонисты орексина, агонисты глюкагон-подобных белков типа 1, цилиарные нейротрофические факторы (такие как Axokine производства Regeneron Pharmaceuticals, Inc., Tarrytown, NY и ProcterGamble Company, Cincinnati, ОН), ингибиторы человеческого агутиподобного белка (AGRP), антагонисты грелина, антагонисты или обратные агонисты гистамина 3,агонисты нейромедина U, ингибиторы микросомального белка, переносящего триглицериды/аполипопротеина В (МТР/АроВ) (например, селективные, действующие в кишечнике ингибиторы МТР, такие как дирлотапид), опиоидные антагонисты и тому подобные соединения. Предпочтительные агенты против ожирения для применения в комбинационных аспектах настоящего изобретения включают селективные, действующие в кишечнике ингибиторы МТР (например, дирлотапид, митратапид, имплитапид, R56918 (CAS 403987) и CAS 913541-47-6), агонисты CCKa (например,N-бензил-2-[4-(1 Н-индол-3-илметил)-5-оксо-1-фенил-4,5-дигидро-2,3,6,10b-тетраазабензо[е] азулен-6-ил]-N-изопропил ацетамид, описанный в заявке РСТWO 2005/116034 или заявке США 2005-0267100 А 1), агонисты 5 НТ 2 с (например, лоркасерин), агонисты MCR-4 (например, соединения,описанные в патенте США 6818658), ингибитор липазы (например, цетилистат), PYY3-36 (в данном документе "PYY3-36" включает аналоги, такие как пегилированный PYY3-36, описанный в заявке США 2006/0178501), опиоидные антагонисты (например, налтрексон), олеоил-эстрон (CAS 180003-17-2),обинепитид (ТМ 30338), прамлинтид (Symlin), тезофензин (NS2330), лептин, лираглутид, бромокриптин, орлистат, эксенатид (Byetta), AOD-9604 (CAS 221231-10-3) и сибутрамин. Предпочтительно соединения по настоящему изобретению и комбинационные терапии применяются вместе с физическими упражнениями и разумной диетой. Все цитированные выше патенты и заявки США включены в данный документ посредством ссыл-8 018894 ки. Воплощения настоящего изобретения иллюстрированы нижеследующими примерами. Однако следует принимать во внимание, что воплощения изобретения не ограничены конкретными подробностями этих Примеров, так как исходя из настоящего описания обычным специалистам в данной области понятны или очевидны другие варианты воплощений изобретения. Примеры Если не указано иное, исходные вещества обычно имеются в продаже у таких коммерческих поставщиков, как Aldrich Chemicals (Milwaukee, WI), Lancaster Synthesis, Inc. (Windham, NH), Acros Organics (Fairlawn, NJ), Maybridge Chemical Company, Ltd. (Cornwall, England), Tyger Scientific (Princeton, NJ) иAstraZeneca Pharmaceuticals (London, England). Следующие вещества имеются в продаже у соответствующих поставщиков: 5-метил-2-фуральдегид - Sigma-Aldrich (Milwaukee, WI); 5-метил-2-аминопиразин - Princeton Bimolecular Research, Inc (Monmouth Junction, NJ); 5-метоксипиразин-2-амин - Anichem (Monmouth Junction, NJ); 5-хлорпиразин-2-карбоновая кислота - Ark Pharma, Inc (Libertyville, IL); 1-метил-1H-пиразол-3-иламин - Matrix Scientific (Columbia, SC); 5-бромпиримидин-2-карбоновая кислота - Ark Pharma, Inc (Libertyville, IL). Общие экспериментальные методы ЯМР спектры записывали на Varian Unity 400 (производства Varian Inc., Palo Alto, CA) при комнатной температуре на частоте 400 МГц для протонов. Химические сдвиги выражали в миллионных долях (5) относительно остаточного растворителя в качестве внутреннего эталона. Формы пиков обозначали следующим образом: s - синглет; d - дублет; dd - дублет дублетов; t - триплет; q - квартет; m - мультиплет; bs -широкий синглет; 2s - два синглета. Масс-спектры с химической ионизацией при атмосферном давлении (ХИАД) получали на Fisons Platform II Spectrometer (газ-носитель: ацетонитрил; производства Micromass Ltd, Manchester, UK). Масс-спектры химической ионизации (ХИ) получали на прибореHewlett-Packard 5989 (ионизация в аммиаке, PBMS; производства Hewlett-Packard Company, Palo Alto,CA). Масс-спектры с ионизацией электрораспылением (ИЭР) получали на приборе Waters ZMD (газноситель: ацетонитрил; производства Waters Corp., Milford, MA). Масс-спектры высокого разрешения(МСВР) получали на Agilent Model 6210 по методу времени пролета. В случаях, когда указана интенсивность ионов, содержащих хлор или бром, наблюдали ожидаемое отношение их интенсивностей (приблизительно 3:1 для ионов, содержащих 35Cl/37Cl и 1:1 для ионов, содержащих 79Br/81Br) и приводили интенсивность только для иона меньшей массы. В некоторых случая приведены только характерные пики 1 Н ЯМР. Оптическое вращение определяли на поляриметре PerkinElmer 241 (производства PerkinElmer Inc., Wellesley, MA) по D-линии натрия ( = 589 нм) при указанной температуре и обозначали следующим образом: []D темп, концентрация (с = g/100 мл) и растворитель. Колоночную хроматографию проводили либо с силикагелем Baker (40 мкм; J.T. Baker, Phillipsburg, NJ), либо Silica Gel 50 (EM Sciences , Gibbstown, NJ) в стеклянных колонках или в колонках Flash 40 Biotage (ISC, Inc., Shelton, CT) или Biotage SNAP картриджах KPsil или Redisep Rf silica (Teledyne Isco) под низким давлением азота. Получение исходных веществ и ключевых промежуточных соединений Получение (Е)-3-(этоксикарбонил)-4-(5-метилфуран-2-ил)бут-3-еновой кислоты, промежуточного соединения (I-1 а) К энергично перемешиваемому раствору 5-метил-2-фуральдегида (264 мл, 2650 ммоль) и диэтилсукцината (840 мл, 5050 ммоль) в этаноле (1,820 л) при комнатной температуре добавляли этоксид натрия (0,93 л 21% по массе раствора в этаноле) одной порцией. Затем реакционную смесь нагревали до кипения в течение 13 ч. После охлаждения до комнатной температуры смесь концентрировали в вакууме(на этой стадии все порции объединяли). Полученный остаток разделяли между этилацетатом (1 л) и соляной кислотой (1 л 2 М водного раствора). После разделения водный слой экстрагировали этилацетатом(21 л). Затем объединенные органические экстракты экстрагировали гидрокарбонатом натрия (21 л насыщенного водного раствора). Эти водные экстракты объединяли и доводили рН до 2 соляной кислотой (2 М водный раствор) и затем экстрагировали этилацетатом (21 л). Эти органические экстракты объединяли и концентрировали под вакуумом с получением требуемой (Е)-3-(этоксикарбонил)-4-(5 метилфуран-2-ил)бут-3-еновой кислоты (I-1 а: 34,34 г, 5%). Исходные органические экстракты экстрагировали гидроксидом натрия (2 л 2 М водного раствора). рН этого водного экстракта доводили до 2 соляной кислотой (2 М водный раствор) и затем экстрагировали этилацетатом (2 1 л). Эти органические экстракты объединяли и концентрировали под вакуумом с получением дополнительного количества тре-9 018894 К энергично перемешиваемому раствору (Е)-3-(этоксикарбонил)-4-(5-метилфуран-2-ил)бут-3 еновой кислоты (I-1a: 326,6 г, 1,371 моль) в уксусном ангидриде (1,77 л, 18,72 моль) при комнатной температуре добавляли ацетат натрия (193 г, 2350 ммоль) одной порцией. Затем реакционную смесь грели до кипения в течение 2,5 ч. После охлаждения до комнатной температуры смесь концентрировали под вакуумом (в этот момент все порции объединяли). Полученный осадок суспендировали в дихлорметане(1,5 л) и фильтровали, промывая твердый осадок дихлорметаном (3500 мл). После этого объединенные фильтрат и промывки экстрагировали гидрокарбонатом натрия (21 л насыщенного водного раствора) и солевым раствором (2 л) и затем концентрировали под вакуумом с получением требуемого этил-4 ацетокси-2-метилбензофуран-6-карбоксилата (Mb: 549,03 г, количественный выход). 1 Н ЯМР (CDCl3, 300 МГц)млн-1 8.00-7.99 (m, 1H), 7.64 (d, 1H), 6.32-6.32 (m, 1 Н), 4.38 (q, 2H), 2.47 К перемешиваемому раствору этил-4-ацетокси-2-метилбензофуран-6-карбоксилата (I-1b: 549,03 г,1,37 моль) в этаноле (4 л) при комнатной температуре добавляли карбонат калия (266 г, 1,92 моль) одной порцией. Реакционную смесь нагревали при 60 С в течение 3 часов. После этого добавляли карбонат калия (100 г, 0,720 моль) одной порцией, и затем реакционную смесь нагревали при 60 С в течение еще 3 ч. После охлаждения до комнатной температуры смесь разбавляли дихлорметаном (2 л) и отфильтровывали суспензию, промывая твердый осадок дихлорметаном (21 л) (на этой стадии все порции объединяли). После этого объединенные фильтрат и промывки промывали лимонной кислотой (2,5 л 1 М водного раствора), затем концентрировали под вакуумом, и полученный остаток очищали безводной флэш-хроматографией (гексан, затем 2:1 гексан:этилацетат). Все фракции, содержащие целевой продукт,объединяли и концентрировали под вакуумом. Полученный остаток, который затвердевал при стоянии,суспендировали в холодном толуоле и фильтровали. Затем твердый осадок перемешивали с горячим толуолом и обесцвечивающим углем в течение 1 часа, с последующей фильтрацией горячей смеси через слой целита. Фильтрат остужали, и полученный осадок отделяли фильтрацией с получением требуемого этил-4-гидрокси-2-метилбензофуран-6-карбоксилата, (I-1 с: 360 г, 90%) в виде оранжевого порошка. 1 Н ЯМР (CDCl3, 300 МГц)млн-1 7.73-7.73 (m, 1H), 7.45 (d, 1H), 6.51-6.50 (m, 1 Н), 5.85 (s, 1H), 4.39 5-Хлорпиразин-2-карбоновую кислоту (1,00 г, 6,31 ммоль) в дихлорметане (30 мл) обрабатывали каталитическим количеством диметилформамида, а затем (COCl)2 (0,85 мл, 9,46 ммоль). Полученную смесь перемешивали в течение ночи. Реакционную смесь концентрировали под вакуумом и сушили под вакуумом с получением требуемого 5-хлорпиразин-2-карбонилхлорида в виде твердого вещества (1,05 г,100%). 5-хлорпиразин-2-карбонилхлорид (2,13 г, 12,05 ммоль) и диметиламин гидрохлорид (1,06 г, 12.7 ммоль) суспендировали в дихлорметане (50 мл) с перемешиванием. К реакционной смеси добавляли по каплям при 0 С триэтиламин (5,04 мл, 36,2 ммоль) в дихлорметане (25 мл). Объединенный раствор нагревали до температуры окружающей среды и перемешивали в течение 4 часов. Соединение разбавляли дихлорметаном, промывали 1 н. HCl, водой, рассолом, сушили (Na2SO4), фильтровали и концентрировали. Сырой продукт очищали колоночной хроматографией (силикагель, градиент от 30 до 80% этилацетат в гептане) с получением 5-хлор-N,N-диметилпиразин-2-карбоксамида (SM-1: 2,24 г, 85%). 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 8.74 (d, J=1.37 Гц, 1 Н) 8.53 (d, J=1.37 Гц, 1 Н) 3.15 (s, 3H) В колбу помещали этил-4-гидрокси-2-метилбензофуран-6-карбоксилат, (I-1 с: 6,07 г, 27,6 ммоль), 5 хлор-N,N-диметилпиразин-2-карбоксамид (SM-1: 5,06 г, 27,3 ммоль), карбонат цезия (9,78 г, 30 ммоль). Твердые вещества растворяли в диметилформамиде (60 мл). Реакционную смесь грели при 90 С в течение 3 ч. После этого реакционную смесь охлаждали до температуры окружающей среды, диметилформамид удаляли под вакуумом. Неочищенную реакционную смесь разделяли между этилацетатом (100 мл) и водой (30 мл). Водный слой экстрагировали этилацетатом (50 мл). Объединенные органические слои промывали водой, рассолом, сушили над сульфатом натрия и концентрировали. Сырой продукт очищали колоночной хроматографией (силикагель, градиент от 30 до 80% этилацетат в гептане) с получением требуемого этил-4-(5-(диметилкарбамоил)пиразин-2-илокси)-2-метилбензофуран-6-карбоксилата(50 г, 250 ммоль) в дихлорметане (821 мл) при комнатной температуре с последующим добавлением 1-2 капель диметилформамида. Реакционную смесь перемешивали в атмосфере азота в течение 2 ч. ЖХМС в метаноле показана присутствие метилового эфира и некоторого количества кислоты. К реакционной смеси добавляли диметилформамид (0,2 мл). Кислота растворилась через 30 мин. ЖХМС показала соответствующий метиловый эфир, и пик исходного вещества не наблюдали. Растворитель удаляли и сушили под вакуумом с получением неочищенного 5-бромпиримидин-2-карбонил хлорида (55 г, 100%). 5-Бромпиримидин-2-карбонил хлорид (55 г, 250 ммоль) растворяли в тетрагидрофуране (828 мл), и порциями добавляли диметиламин (2 М раствор в тетрагидрофуране) (373 мл, 745 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 часов, после чего ЖХМС показала завершение реакции. Смесь разбавляли этилацетатом (500 мл) и промывали H2O (500 мл). Водный слой далее экстрагировали CH2Cl2 (5500 мл), все органические фракции объединяли и сушили над сульфатом магния. Фильтрат концентрировали под вакуумом и затем суспендировали в метил-трет-бутиловом эфире (650 мл). После этого раствор нагревали до кипения. Горячий раствор оставляли охлаждаться в течение ночи, получая розовые кристаллы. Кристаллы отфильтровывали и промывали холодным метил-трет-бутиловым эфиром (100 мл). Твердое вещество сушили в вакуумном сушильном шкафу при 55 С в течение 12 ч с получением указанного в заголовке соединения 5-бром-N,N-диметилпиримидин-2-карбоксамида (SM-2: 44 г, 77%) в виде твердого вещества розового цвета. 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 2.94 (s, 3H) 3.13 (s, 3H) 8.85 (s, 2H). m/z (M+l) = 232. Получение этил-4-(2-(диметилкарбамоил)пиримидин-5-илокси)-2-метилбензофуран-6-карбокстата,промежуточного соединения (I-2 а) разным N2 и затем нагревали до 90 С. Гетерогенную реакционную смесь перемешивали при этой температуре с помощью механической мешалки в течение 18 ч, после чего ВЭЖХ показала практически полное завершение реакции. Реакционную смесь охлаждали до 35 С и разбавляли этилацетатом (300 мл). Для удаления карбоната цезия смесь фильтровали. Затем фильтрат разделяли между водой (500 мл) и этилацетатом (500 мл); однако разделения не наблюдали. К смеси добавляли концентрированную HCl(20 мл). Когда рН водной фазы достиг примерно 1, произошло разделение фаз. Органические фракции отделяли, и водный слой повторно экстрагировали этилацетатом (2500 мл). Все органические фракции объединяли и обратно экстрагировали водой (200 мл) и рассолом (500 мл). Органические фракции отделяли и обрабатывали активированным углем (10 г) и сульфатом магния. Смесь перемешивали в течение 10 мин и затем фильтровали через целитовую насадку с получением неочищенного желтого раствора. Фильтровальный осадок промывали этилацетатом (100 мл). Органическую фракцию концентрировали под вакуумом с получением неочищенного твердого вещества, которое сушили в глубоком вакууме в течение 4 дней. Сухое неочищенное твердое вещество растирали в метаноле (80 мл). Твердое вещество распадалось на мелкие светло-оранжевые кристаллы в красной жидкости. Твердую фазу отделяли фильтрацией и промывали метанолом (20 мл). Твердое вещество сушили в вакуумном сушильном шкафу при 55 С в течение 12 ч с получением этил-4-(2-(диметилкарбамоил)пиримидин-5-илокси)-2-метилбензофуран-6-карбоксилата в виде желтого твердого вещества (I-2 а: 18,2 г, 54%). 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 1.41 (t, J=7.12 Гц, 3H) 2.50 (d, J=0.98 Гц, 3H) 3.00 (s, 3H) 3.17 (s, 3H) 4.41 (d, J=7.22 Гц, 2 Н) 6.29 (s, 1 Н) 7.62 (d, J=1.17 Гц, 1 Н) 8.06 (s, 1H) 8.50 (s, 2H). m/z (M+1) = 370,5. Получение 5-бром-N-этил-N-метилпиримидин-2-карбоксамида, исходного вещества (SM-3) Оксалилхлорид (1,45 г, 11,1 ммоль) добавляли к суспензии 5-бромпиримидин-2-карбоновой кислоты (1,5 г, 7,4 ммоль) в дихлорметане (50 мл) при комнатной температуре с последующим добавлением 12 капель диметилформамида. Реакционную смесь перемешивали в атмосфере азота в течение 2 ч. ЖХМС в метаноле показала присутствие метилового эфира и некоторого количества кислоты. К реакционной смеси добавляли диметилформамид (0,2 мл), и вся кислота растворилась через 30 мин. ЖХМС показала соответствующий метиловый эфир, и пик исходного вещества не наблюдали. Растворитель удаляли и сушили под вакуумом с получением неочищенного 5-бромпиримидин-2-карбонил хлорида (1,6 г). 5-Бромпиримидин-2-карбонил хлорид (1600 мг, 7,225 ммоль) растворяли в дихлорметане (25 мл) и добавляли триэтиламин (4,03 мл, 28,9 ммоль), а затем этилметиламин (0,68 мл, 7,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 ч, после чего ЖХМС показала завершение реакции. Смесь разбавляли дихлорметаном (50 мл) и промывали водой (50 мл), а затем 10% лимонной кислотой (50 мл) и рассолом (50 мл). Органический слой отделяли и сушили над MgSO4, Остаток фильтровали и удаляли растворитель под вакуумом с получением указанного в заголовке соединения 5-бром-N-этил-N-метилпиримидин-2-карбоксамида (SM-3): (1,4 г, 79,4%) в виде коричневой маслянистой жидкости. 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 1.08-1.31 (m, 3H) 2.99 (d, J=79.05 Гц, 3H) 3.19 (q, J=7.22 Гц, 1 Н) 3.59 (q, J=7.22 Гц, 1H) 8.84 (d, J=3.12 Гц, 2 Н). Получение этил-4-(2-(этил(метил)карбамоил)пиримидин-5-илокси)-2-метилбензофуран-6-карбоксилата, промежуточного соединения (I-5 а) В колбу помещали 5-бром-N-этил-N-метилпиримидин-2-карбоксамид (SM-3: 615 мг, 2,5 ммоль),этил-4-гидрокси-2-метилбензофуран-6-карбоксилат, (I-1 с: 378 мг, 1,7 ммоль), Cs2CO3 (1,15 г, 3,5 ммоль),1,10-фенантролин (30,3 мг, 0,17 ммоль), иодид меди (16 мг, 0,08 ммоль) и диметилформамид (17 мл). Реакционную смесь дегазировали N2 в течение 5 мин и затем нагревали при 90 С в течение 3 ч в атмосфере N2. Реакционную смесь разбавляли этилацетатом (250 мл), промывали водой (3 100 мл), осушали(MgSO4) и концентрировали. Сырое вещество очищали в колонке Biotage 50g silica gel (20-100% EtOAc вHep) с получением указанного в заголовке соединения этил-4-(2-(этил(метил)карбамоил)пиримидин-5 илокси)-2-метилбензофуран-6-карбоксилата (I-5a: 180 мг, 28%) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 1.07-1.26 (m, 3H) 1.34 (t, J=7.12 Гц, 3H) 2.42 (d, J=0.98 Гц,- 12018894 Указанное в заголовке соединение (SM-4) получали способом, аналогичным описанному для получения SM-1, используя 5-хлорпиразин-2-карбоновую кислоту (2 г, 12,62 ммоль) и этилметиламин(0,846 г, 13,9 ммоль) и получая указанное в заголовке соединение 5-хлор-N-этил-N-метилпиразин-2 карбоксамид (SM-4: 2,05 г, 81%) в виде прозрачной маслянистой жидкости. 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 8.72 (dd, J=7.41, 1.37 Гц, 1H), 8.53 (d, J=1.56 Гц, 1 Н), 3.60 Этил-4-гидрокси-2-метилбензофуран-6-карбоксилат (1-1 с: 2,25 г, 10,22 ммоль), карбонат калия (2,1 г, 15,3 ммоль) и 5-хлор-N-этил-N-метилпиразин-2-карбоксамид (SM-4: 2,04 г, 10,2 ммоль) смешивали в ацетонитриле (30 мл). Смесь грели при 100 С в течение ночи, и после этого реакционную смесь разбавляли этилацетатом (50 мл) и фильтровали. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, элюируя этилацетатом в гептане 20-100%, с получением этил-4-(5(этил(метил)карбамоил)пиразин-2-илокси)-2-метилбензофуран-6-карбоксилата (I-7 а: 3,9 г, 99,5%) в виде смолистого вещества. 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 8.45 (dd, J=7.43, 1.17 Гц, 1 Н), 8.40 (s, 1H), 8.04 (t, J=1.07 Гц, 1H), 7.71 (d, J=0.98 Гц, 1 Н), 6.18 (d, J=0.98 Гц, 1 Н), 4.38 (q, J=7.04 Гц, 2 Н), 3.60 (q, J-7.23 Гц, 1 Н), 3.48 5-Метил-2-аминопиразин (6,8 г, 63 ммоль) разводили в 70 мл диметилового эфира и охлаждали до 0 С. Хлорид диметилалюминия (131 ммоль, 1 М в гексане) добавляли по каплям. Полученную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин. Затем добавляли этил-4(5-(диметилкарбамоил)пиразин-2-илокси)-2-метилбензофуран-6-карбоксилат (I-1d: 10,1 г, 27,3 ммоль) в диметиловом эфире (70 мл) к активированному аминному раствору через канюлю. Объединенный раствор нагревали до кипения в течение ночи. Реакционную смесь охлаждали на льду и медленно останавливали реакцию, добавляя по каплям водный раствор соли Рошеля (концентрированный, 100 мл). Смесь перемешивали в течение 20 мин. Смесь разделяли. Органический слой промывали водным раствором соли Рошеля (30 мл), 1 н. HCl (30 мл), рассолом (30 мл), сушили сульфатом натрия и концентрировали под вакуумом. Сырой продукт очищали колоночной хроматографией (силикагель, градиент этилацетата 50-100% в гептане) с получением требуемого N,N-диметил-5-(2-метил-6-5-метилпиразин-2-ил)карбамоил)бензофуран-4-илокси)пиразин-2-карбоксамида (1: 8,5 г, 72%). 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 9.57 (d, J=1.37 Гц, 1H) 8.49 (d, J=1.37 Гц, 1 Н) 8.45 (d,J=1.37 Гц, 1 Н) 8.42 (s, 1 Н) 8.14 (dd, J=1.56, 0.59 Гц, 1 Н) 7.91-7.94 (m, 1H) 7.62 (d, J=1.37 Гц, 1 Н) 6.22 (t,J=0.98 Гц, 1 Н) 3.18 (s, 3H) 3.15 (s, 3H) 2.55 (s, 3H) 2.48 (d, J=1.17 Гц, 3H). МС (М+1): 433,1. Пример 2. Получение N,N-диметил-5-(2-метил-6-5-метилпиразин-2-ил)карбамоил)бензофуран-4 илокси)пиримидин-2-карбоксамида (2) К раствору 5-метил-2-аминопиразина (38,9 г, 356 ммоль) в диметиловом эфире (3 3 5 мл) в трехгорлой колбе, оснащенной верхней мешалкой и холодильником при 0 С добавляли Me2AlCl. (1 М раствор в гексане) (715 мл). Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1,5 ч. В отдельной колбе этил-4-(2-(диметилкарбамоил)пиримидин-5-илокси)-2-метилбензофуран-6 карбоксилат (b 2 а: 52,6 г, 142,5 ммоль) растворяли в диметиловом эфире (210 мл). Затем эту смесь добавляли к комплексному амину. Смолистый осадок выпадал при потираний стенок колбы и превращался в твердое вещество. Полученную реакционную смесь кипятили с обратным холодильником в течение 3,5 ч, ВЭЖХ показала 93% завершения реакции. Приготовили пять литров раствора соли Рошеля в воде, и к смеси добавили 2 л 2-метилтетрагидрофурана. Затем реакционную смесь выливали в двухфазную систему. Смесь перемешивали верхней мешалкой в течение 14 ч, после чего выпадал желтый осадок. Осадок собирали с помощью фильтрования. Собранный осадок промывали 2-метилтетрагидрофураном. Полученное твердое вещество сушили в вакуумном сушильном шкафу в течение ночи с получением указанного в заголовке соединения N,N-диметил-5-(2-метил-6-5-метилпиразин-2-ил)карбамоил)бензофуран-4 илокси)пиримидин-2-карбоксамид (2): (49,98 г, 81%). 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 2.49 (d, J=1.17 Гц, 3H) 2.55 (s, 3H) 2.98 (s, 3H) 3.14 (s, 3H) 6.28 (t, J=0.98 Гц, 1H) 7.52 (d, J=1.37 Гц, 1 Н) 7.88 - 7.92 (m, 1H) 8.14 (d, J=0.78 Гц, 1 Н) 8.37 (s, 1 Н) 8.50 (s,2 Н) 9.54 (d, J=1.56 Гц, 1 Н). m/z (М+1) = 433,4, m/z (М-1) = 431,5. Пример 3. Получение 5-(6-5-метоксипиразин-2-ил)карбамоил)-2-метилбензофуран-4-илокси)-N,Nдиметилпиримидин-2-карбоксамида (3) Указанное в заголовке соединение (5) получали способом, аналогичным способу, который описан в примере 1, используя этил-4-(2-(этил(метил)карбамоил)пиримидин-5-илокси)-2-метилбензофуран-6 карбоксилат (I-5 а: 99 мг, 0,26 ммоль), 5-метил-2-аминопиразин (84 мг, 0,77 ммоль), хлорид диметилалюминия (1,29 ммоль, 1 М в гексане) и диметиловый эфир (4,5 мл) с получением N-этил-N-метил-5-(2 метил-6-5-метилпиразин-2-ил)карбамоил)бензофуран-4-илокси)пиримидин-2-карбоксамид (5: 70 мг,61%) в виде твердого беловатого вещества. 1 Н ЯМР (400 МГц, Хлороформ-d)млн-1 1.15-1.24 (m, 3H) 2.44 (s, 3H) 2.49 (s, 3H) 2.99 (d, J=58.94 Гц, 3H) 3.20-3.59 (m, 2 Н) 6.23 (d, J=1.17 Гц, 1 Н) 7.50 (dd, J=2.93, 1.17 Гц, 1 Н) 7.89 (d, J=1.17 Гц, 1 Н) 8.01(d, J=12.70 Гц, 3H), 2.55 (s, 3H), 2.47 (s, 3H), 1.22-1.28 (m, 3H). МС (М+1): 447,3 (М-1) 445,4. Фармакологическое тестирование Практическое воплощение настоящего изобретения для лечения заболеваний, модулируемых активацией фермента глюкокиназы, может быть подтверждено выполнением по меньшей мере одного из протоколов, представленных ниже. В приведенных ниже испытаниях использованы следующие сокращенные наименования, которые имеют указанные значения. В скобках указаны поставщики. Испытания in vitro Полноразмерную глюкокиназу (бета-клеточную изоформу) маркировали His с N-конца и очищали на колонке Ni с последующей эксклюзионной хроматографией. Колонку 320 мл самостоятельно наполняли смолой для препаративного разделения Superdex75 (Amersham Pharmacia, Carlsbad, CA). Глюкозу приобретали в Calbiochem (San Diego, CA), а другие реагенты приобретали в Sigma-Aldrich (St. Louis,MO). Все тесты проводили в 384-луночном планшете Corning с использованием спектрофотометра Spectramax PLUS (Molecular Devices, Sunnyvale, CA) при комнатной температуре. Конечный объем теста составлял 40 мкл. Состав буфера, используемого в этом тесте, был следующим: 50 мМ HEPES, 5 мМ глюкозы, 2,5 мМ АТФ, 3,5 мМ MgCl2, 0,7 мМ НАДН, 2 мМ дитиотреитола, 1 ед/мл пируваткиназы/лактатдегидрогеназы (PK/LDH), 0,2 мМ фосфоенолпирувата и 25 мМ KCl. Значение рН буфера составляло 7,1. Раствор испытываемого соединения в диметилсульфоксиде добавляли в буфер и перемешивали в планшетном шейкере в течение 7,5 мин. Конечная концентрация введенного диметилсульфоксида в тесте составляла 0,25%. Глюкокиназу добавляли в буферную смесь для инициирования реакции в присутствии и в отсутствии соединения. Реакцию отслеживали по поглощению при 340 нм вследствие уменьшения количества НАДН. Начальную скорость реакции измеряли по наклону линейного участка кривой от 0 до 300 с. Процент максимальной активации рассчитывали по следующему уравнению:% максимальной активации = (Va/Vo - 1)100; где Va и Vo определены как начальная скорость реакции в присутствии и в отсутствии испытываемого соединения, соответственно. Для определения ЕС 50 (50% максимальной эффективной концентрации) и % максимальной активации, соединения последовательно разбавляли в три раза диметилсульфоксидом. Для вычисления ЕС 50 и% максимальной активации данные подставляли в следующее уравнение:Va/Vo = 1 + (% максимальной активации/100)/(1 + EC50/концентрация соединения). Очистка бета-клеточной His-маркированной глюкокиназы Условия выращивания и инициирования. Клетки BL21(DE3) (Invitrogen Corporation, Carlsbad, СА), содержащие вектор pBCGK (С или N His),выращивали при 37 С (в 2XYT), пока оптическая плотность OD600 не достигала 0,6-1,0. Экспрессию индуцировали добавлением изопропилтиогалактозида конечной концентрацией 0,1-0,2 мМ к клеткам,которые затем инкубировали в течение ночи при 23 С. На следующий день клетки собирали центрифугированием при 5000 об/мин в течение 15 мин при 4 С. Клеточную массу хранили при -80 С для последующей очистки. Очистка. Для разделения использовали колонку Ni-NTA (Quigan, Germantown, MD) (15-50 мл). Приготавливали два буфера, 1) лизисный уравновешивающий и промывочный буфер для никелевого носителя и 2) элюирующий буфер для никелевого носителя. Лизисный уравновешивающий и промывочный буфер приготавливали следующим образом: 25 мМ HEPES буфер (рН 7.5), 250 мМ NaCl, 20 мМ имидазол и 14 мМ -меркаптоэтанол (концентрации конечные). Элюирующий буфер приготавливали следующим образом: 25 мМ HEPES буфер (рН 7.5), 250 мМ NaCl, 400 мМ имидазол и 14 мМ -меркаптоэтанол (концентрации конечные). Перед использованием каждый буфер фильтровали через 0,22 мкм фильтр. Клеточную массу (1 л культуры) ресуспендировали в 300 мл лизисного уравновешивающего буфера. Затем клетки лизировали (3 раза) с помощью микрофлюидайзера Microfluidics Model 110Y (Microfluidics Corporation, Newton, MA). Суспензию центрифугировали на ультрацентрифуге Beckman Coulter Model LE-80K(Beckman Coulter, Fullerton, CA) на 40000 об/мин в течение 45 мин при 4 С. Надосадочную жидкость переносили в охлажденную колбу. Объем 20 мкл сохраняли для анализа в геле. Для разделения использовали систему очистки Pharmacia АКТА (GMI, Inc., Ramsey, MN). Основные линии очищали с помощью лизисного уравновешивающего буфера. Колонку Ni-NTA уравновешивали 200 мл лизисного уравновешивающего буфера при скорости потока 5 мл/мин. Надосадочную жидкость вводили в колонку со скоростью 4 мл/мин и после прохождения колонки собирали в колбу. Свободные белки промывали лизисным уравновешивающим буфером при скорости потока 5 мл/мин, пока УФ не достиг исходных показателей. Затем белок элюировали с колонки с помощью 320 мл имидазольного элюирующего буфера при градиенте имидазола от 20 мМ до 400 мМ. Затем колонку очищали от всех дополнительных белков с помощью 80 мл элюирующего буфера. Каждая элюированная фракция имела объем 8 мл, общее количество составило 50 проб. Фракции анализировали с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ) и фракции, содержащие исследуемый белок, объединяли и концентрировали до 10 мл на ультрафильтрационной ячейке с мембраной Millipore с отсечением по молекулярной массе 10000 (Sigma-Aldrich, St. Louis, МО) в атмосфере азота (60 ф.сила/кв.дюйм, 413,7103 Па). Далее белок очищали эксклюзионной хроматографией (SEC) с использованием испарительного детектора светорассеяния Sedex 75 (320 мл) (Amersham Pharmacia, Uppsala, Sweden). SEC уравновешивали 450 мл разделительного буфера, содержащего 25 мМ HEPES (рН 7,0), 50 мМ NaCl и 5 мМ дитиотреито- 16018894 ла. Концентрированный белок вводили в SEC и проводили элюирование 400 мл разделительного буфера в течение ночи при скорости 0,5 мл/мин. Фракции анализировали с помощью ДСН-ПААГ, и фракции,содержащие белок, объединяли. Концентрацию измеряли методом Брэдфорд с использованием в качестве стандарта БСА. Очищенный белок хранили маленькими аликвотами при -80 С. ЕС 50 (мкМ) и % максимальной активации (%) приведены ниже в табл. 1. Таблица 1 или его фармацевтически приемлемая соль. 2. Соединение по п.1, имеющее следующую структуру 3. Фармацевтическая композиция, активирующая глюкокиназу, содержащая (1) соединение по п.1 или его фармацевтически приемлемую соль; и (2) фармацевтически приемлемый эксципиент, разбавитель или носитель. 4. Композиция по п.3, где указанное соединение или его указанная фармацевтически приемлемая соль присутствуют в терапевтически эффективном количестве.
МПК / Метки
МПК: A61P 3/10, A61K 31/506, C07D 405/14, A61P 3/04, A61K 31/497
Метки: качестве, содержащая, активатора, n,n-диметил-5-(2-метил-6-((5-метилпиразин-2-ил)карбамоил)бензофуран-4-илокси)пиримидин-2-карбоксамид, используемый, фармацевтическая, глюкокиназы, композиция
Код ссылки
<a href="https://eas.patents.su/18-18894-nn-dimetil-5-2-metil-6-5-metilpirazin-2-ilkarbamoilbenzofuran-4-iloksipirimidin-2-karboksamid-ispolzuemyjj-v-kachestve-aktivatora-glyukokinazy-i-soderzhashhaya-ego-farmacevticheska.html" rel="bookmark" title="База патентов Евразийского Союза">N,n-диметил-5-(2-метил-6-((5-метилпиразин-2-ил)карбамоил)бензофуран-4-илокси)пиримидин-2-карбоксамид, используемый в качестве активатора глюкокиназы, и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Бытовой прибор для обработки белья с парогенератором
Следующий патент: Способ изготовления пучкового перехода, пучковый преобразователь электромагнитного излучения
Случайный патент: Полиметаллический катализатор для гидропереработки и способ его получения












