Твердая фармацевтическая композиция, включающая производное бензимидазол-7-карбоксилата и ph регулирующий агент
Формула / Реферат
1. Твердая фармацевтическая композиция, включающая (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2-этокси-1-{[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил}-1Н-бензимидазол-7-карбоксилат или его соль и рН регулирующий агент, имеющий рН от 2 до 5 в воде, в концентрации 1% мас./об. при 25°С.
2. Твердая фармацевтическая композиция, включающая калиевую соль (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2-этокси-1-{[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил}-1Н-бензимидазол-7-карбоксилата и рН регулирующий агент, имеющий рН от 2 до 5 в воде, в концентрации 1% мас./об. при 25°С.
3. Фармацевтическая композиция по п.1 или 2, в которой рН регулирующий агент представляет собой однозамещенный фумарат натрия или комбинацию фумаровой кислоты и гидроксида натрия.
4. Способ стабилизации соединения в твердой фармацевтической композиции по п.1 или 2, который включает добавление рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25°С, к твердой фармацевтической композиции.
5. Способ улучшения растворимости соединения из твердой фармацевтической композиции по п.1 или 2, который включает добавление рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25°С, к твердой фармацевтической композиции по п.1 или 2.
6. Применение рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25°С, для стабилизации соединения в твердой фармацевтической композиции по п.1 или 2.
7. Применение рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25°С, для улучшения растворимости соединения в твердой фармацевтической композиции по п.1 или 2.
Текст
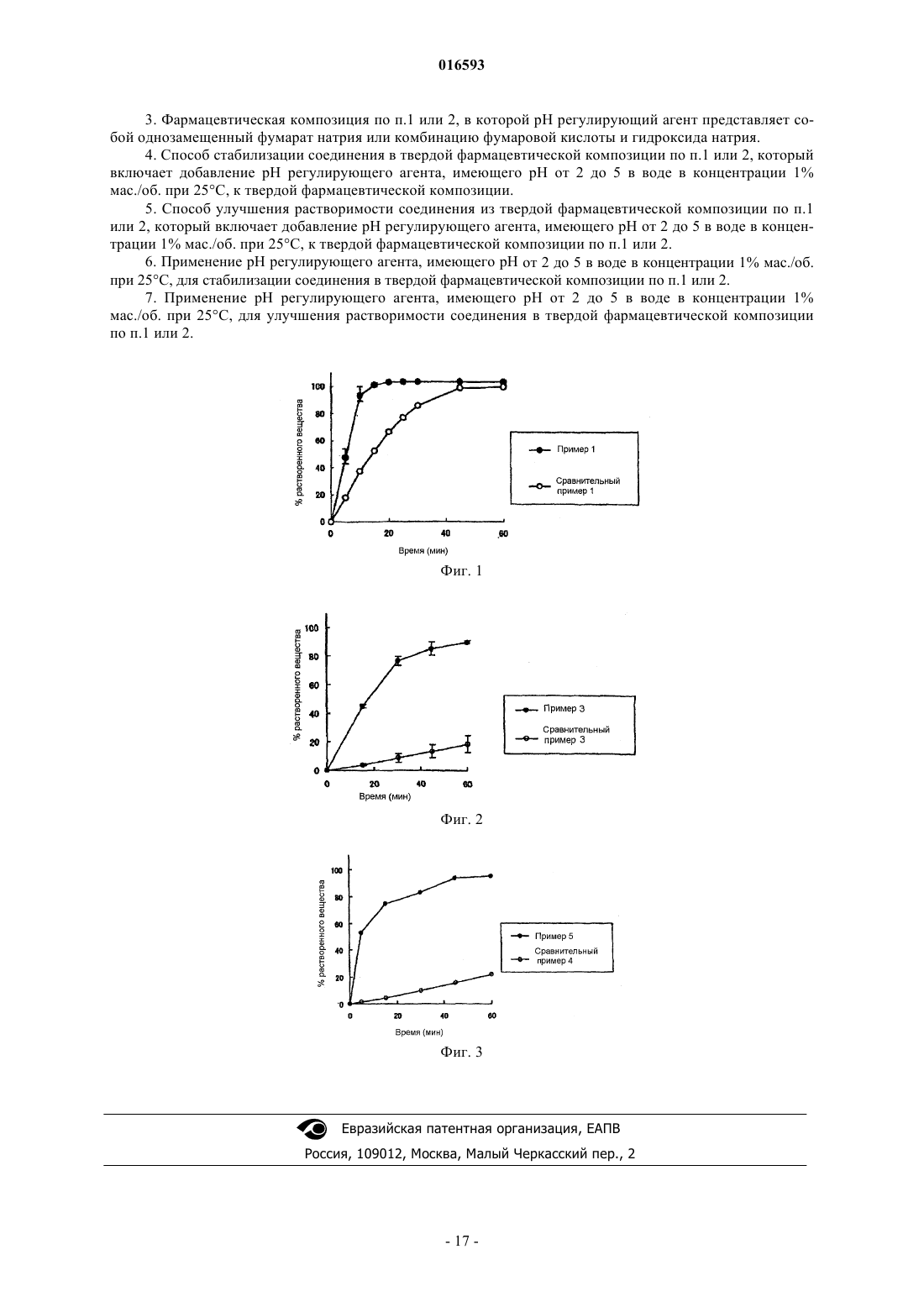
Настоящее изобретение предоставляет твердую фармацевтическую композицию,содержащую (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2-этокси-1-[2'-(5-оксо-4,5-дигидро-1,2,4 оксадиазол-3-ил)бифенил-4-ил]метил-1 Н-бензимидазол-7-карбоксилат (соединение (I или его соль, обладающее антагонистическим действием по отношению к рецептору ангиотензина II и охарактеризованное в описании, и рН регулирующий агент, состав которой является наилучшим для стабильности и растворимости соединения (I).(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) 016593 Настоящее изобретение относится к твердой фармацевтической композиции, включающей соединение (I) и рН регулирующий агент, которая превосходит соединение (I) как по стабильности, так и по растворимости. Кроме того, настоящее изобретение относится к способу стабилизации соединения (I) и к способу улучшения растворимости соединения (I). Уровень техники изобретения Важно, чтобы фармацевтические продукты были эффективными и безопасными. Даже если фармацевтический продукт эффективен и безопасен непосредственно после получения, в том случае, если лекарственное средство легко разлагается или денатурирует во время распределения, оно не эффективно и не безопасно в качестве фармацевтического продукта. Поэтому стабильность лекарственного средства очень важна для фармацевтических продуктов. Кроме того, для поддержания эффективности и безопасности фармацевтического продукта не только эффективность и безопасность активного ингредиента, но также и свойства фармацевтического препарата, такие как растворимость лекарственного средства в организме и ему подобные, очень важны. Например, когда растворимость лекарственного средства из фармацевтического препарата слишком медленная, концентрация лекарственного средства в крови не достигает эффективного уровня и ожидаемая эффективность действия не может быть проявлена в достаточной мере. С другой стороны, когда растворимость лекарственного средства из фармацевтического препарата слишком быстрая, концентрация лекарственного средства в крови возрастает быстро и риск побочных эффектов возрастает. Другими словами, для фармацевтического продукта необходимо гарантировать стабильность и постоянное значение растворимости лекарственного средства в дополнение к эффективности и безопасности. При этом свойство растворимости лекарственного средства, как известно, коррелируется с растворяемостью лекарственного средства. Как известно, обычно это означает, что низкая растворяемость лекарственного средства связана со свойством медленной растворимости лекарственного средства. В данном случае производное бензимидазола (I), обладающее сильной антагонистической активностью к рецептору ангиотензина II где R1 представляет собой моноциклическую азотсодержащую гетероциклическую группу, содержащую атом водорода, который может быть депротонирован, R2 представляет собой этерифицированную карбоксильную группу и R3 представляет собой необязательно замещенный низший алкил или его соль (в дальнейшем в этом документе иногда именуемые как соединение (I, в частности соль карбоновой кислоты, (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2-этокси-1-[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3 ил)бифенил-4-ил]метил-1 Н-бензимидазол-7-карбоксилат (WO 2005/080384), представляет собой перспективное терапевтическое лекарственное средство при гипертензии и ей подобных. Однако свойства фармацевтического препарата необходимо усовершенствовать для стабилизации соединения (I), потому что соединение (I) нестабильно при нейтральном рН, при котором фармацевтические препараты обычно производятся. Тем не менее, растворяемость соединения (I) является низкой в диапазоне рН, в котором соединение (I) является стабильным. И поэтому очень сложно одновременно обеспечить стабильность и растворимость соединения (I), и желательно одновременное их достижение. Раскрытие изобретения Целью настоящего изобретения является предоставление получения твердой фармацевтической композиции, превосходящей соединение (I) как по стабильности, так и по растворимости. Другой целью настоящего изобретения является создание способа стабилизации соединения (I) и,кроме того, способа улучшения его растворимости. Авторы настоящего изобретения провели тщательные исследования для одновременного достижения стабильности соединения (I) в препарате и растворимости его из препарата и установили, что цели могут быть неожиданно достигнуты посредством одновременного присутствия рН регулирующего агента и соединения (I) и, кроме того, посредством регулирования с помощью рН регулирующего агента диапазона рН твердого препарата до такого диапазона рН, при котором растворяемость соединения (I) становится низкой, что в результате привело к созданию настоящего изобретения. Настоящее изобретение предоставляет нижеследующее.(1) Твердая фармацевтическая композиция, включающая соединение формулы (I) где R1 представляет собой моноциклическую азотсодержащую гетероциклическую группу, содержащую атом водорода, который может быть депротонирован, R2 представляет собой этерифицированную карбоксильную группу и R3 представляет собой необязательно замещенный низший алкил, или его соль и рН регулирующий агент.(2) Фармацевтическая композиция вышеуказанного (1), в которой соль соединения формулы (I) представляет собой калиевую соль (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2-этокси-1-[2'-5-оксо-4,5 дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил-1 Н-бензимидазол-7-карбоксилата (в дальнейшем в этом документе иногда именуемую как соединение А).(3) Фармацевтическая композиция вышеуказанных (1) или (2), в которой рН регулирующий агент имеет рН 2-5.(4) Фармацевтическая композиция вышеуказанного (3), в которой рН регулирующий агент представляет собой однозамещенный фумарат натрия или комбинацию фумаровой кислоты и гидроксида натрия.(5) Способ стабилизации соединения формулы (I) или его соли в твердой фармацевтической композиции, который включает добавление рН регулирующего агента к твердой фармацевтической композиции, включающей соединение формулы (I) или его соль.(6) Способ улучшения растворимости соединения формулы (I) или его соли из твердой фармацевтической композиции, который включает добавление рН регулирующего агента к твердой фармацевтической композиции, включающей соединение формулы (I) или его соль.(7) Применение рН регулирующего агента для стабилизации соединения формулы (I) или его соли в твердой фармацевтической композиции, включающей соединение формулы (I) или его соль.(8) Применение рН регулирующего агента для улучшения свойства растворимости соединения формулы (I) или его соли из твердой фармацевтической композиции, включающей соединение формулы(I) или его соль. Твердая фармацевтическая композиция настоящего изобретения превосходит по стабильности соединение (I), а также и по свойству растворимости соединения. В соответствии со способом стабилизации соединения (I) настоящего изобретения соединение (I) в твердой фармацевтической композиции существенно стабилизировано. Кроме того, в соответствии со способом улучшения растворимости соединения (I) свойство растворимости соединения (I) из твердой фармацевтической композиции может быть существенно улучшено. Краткое описание чертежей Фиг. 1 демонстрирует свойство растворимости лекарственного средства высушенных обычных таблеток, полученных в примере 1 и сравнительном примере 1; фиг. 2 демонстрирует свойство растворимости лекарственного средства высушенных обычных таблеток, полученных в примере 3 и сравнительном примере 3; фиг. 3 демонстрирует свойство растворимости лекарственного средства высушенных обычных таблеток, полученных в примере 5 и сравнительном примере 4. Подробное описание изобретения В вышеуказанной формуле (I) R1 представляет собой моноциклическую азотсодержащую, гетероциклическую группу, содержащую атом водорода, который может быть депротонирован, такую как тетразолильная группа или группа, представленная формулой где i представляет собой -О- или -S-, j представляет собой С=O, C=S или S(O)m, где m представляет собой 0, 1 или 2 (например, группа 4,5-дигидро-5-оксо-1,2,4-оксадиазол-32-ил и т.п.), и им подобные являются предпочтительными. Группа 4,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил включает три таутомера (а', b' и с'), представленные формулами и группа 4,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил включает все вышеуказанные а', b' и с'.-2 016593 В вышеуказанной формуле (I) R2 представляет собой этерифицированную карбоксильную группу и,например, предпочтительно карбоксильную группу, этерифицированную низшим (C1-4)алкилом, необязательно замещенным заместителем, выбранным из гидроксильной группы, аминогруппы, атома галогена, низшего (С 2-6)алканоилокси (например, ацетилокси, пивалоилокси и т.п.), низшего (С 4-7) циклоалканоилокси, (низшего (C1-6)алкокси)карбонилокси (например, метоксикарбонилокси, этоксикарбонилокси и т.п.), (низшего (С 3-7)циклоалкокси)карбонилокси (например, циклогексилоксикарбонилокси и т.п.), низшего (С 1-4)алкокси и 5-метил-2-оксо-1,3-диоксолен-4-ил (например, группа (5-метил-2-оксо 1,3-диоксолен-4-ил)метоксикарбонил, группа 1-(циклогексилоксикарбонилокси)этоксикарбонил) и им подобных. В вышеуказанной формуле (I) R3 представляет собой необязательно замещенный низший алкил и предпочтительно низший (С 1-5)алкил, необязательно замещенный заместителем, выбранным из гидроксильной группы, аминогруппы, атома галогена и низшей (С 1-4)алкоксигруппы (предпочтительно низшего (С 2-3)алкила; в частности предпочтительно этила). В качестве соли соединения формулы (I) может быть представлена фармацевтически приемлемая соль и могут быть указаны, например, соль соединения формулы (I) с неорганическим основанием, его соль с органическим основанием и им подобные. Предпочтительные примеры соли с неорганическим основанием включают соль щелочного металла, такую как натриевая соль, калиевая соль и им подобные; соль щелочно-земельного металла, такую как кальциевая соль, магниевая соль и им подобные; алюминиевая соль, аммонийная соль и им подобные. Предпочтительные примеры соли с органическим основанием включают соли триметиламина, триэтиламина, пиридина, пиколина, этаноламина, диэтаноламина, триэтаноламина, дициклогексиламина,N,N'-дибензилэтилендиамина и им подобные. В качестве соли соединения формулы (I) является предпочтительной соль щелочного металла соединения формулы (I). В частности, является предпочтительной калиевая соль соединения формулы (I). В качестве соединения формулы (I) или его соли является предпочтительной соль (5-метил-2-оксо 1,3-диоксол-4-ил)метил-2-этокси-1-[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил 1 Н-бензимидазол-7-карбоксилата и, в частности, является предпочтительной калиевая соль (5-метил-2 оксо-1,3-диоксол-4-ил)метил-2-этокси-1-[2'-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4 ил]метил-1 Н-бензимидазол-7-карбоксилата. Соль соединения формулы (I) может быть гидратом или не гидратом. Поскольку рН регулирующий агент следует применять в настоящем изобретении, любой рН регулирующий агент может применяться при условии, что можно одновременно достичь стабильности соединения (I) в лекарственном продукте и его растворимости из лекарственного продукта, и что подходит для фармацевтических продуктов. Многочисленные рН регулирующие агенты могут применяться в комбинации. Поскольку рН регулирующий агент следует применять в настоящем изобретении, рН регулирующий агент, проявляющий рН от около 2 до около 5, предпочтительно от около 3 до около 5, более предпочтительно от около 3 до около 4, является предпочтительным для использования. Например, применяются кислотное вещество, такое как виноградная кислота, лимонная кислота, молочная кислота,фумаровая кислота, яблочная кислота, аскорбиновая кислота, уксусная кислота, дикарбоновая аминокислота (например, глутаминовая кислота, аспарагиновая кислота) и им подобные, неорганические соли этих кислотных веществ (например, соль щелочного металла, соль щелочно-земельного металла, аммонийная соль и т.п.), соли этих кислотных веществ с органическим основанием (например, диаминокислота, такая как лизин, аргинин и т.п., меглумин и т.п.) и их гидраты, их сольваты и им подобные. В данном случае значение рН для рН регулирующего агента измеряют при нижеприведенных условиях. Следует уточнить, что это рН раствора или суспензии, полученной посредством растворения или суспендирования рН регулирующего агента в воде при концентрации 1% мас./об. при 25 С. Поскольку рН регулирующий агент следует применять в настоящем изобретении, кислотное вещество и основное вещество комбинируют, и полученный рН регулирующий агент может быть скорректирован таким образом, что рН раствора или суспензии составляет от около 2 до около 5, предпочтительно до около 3 до около 5, более предпочтительно от около 3 до около 4, в случае, когда комбинированный рН регулирующий агент растворяют или суспендируют в воде при 25 С, при концентрации 1% мас./об. Примеры кислотных веществ, которые следует применять в комбинации, включают в дополнение к кислотным веществам, имеющим значение рН от около 2 до около 5, приведенным выше, и их солям, сильные кислоты, такие как хлористо-водородная кислота, серная кислота, фосфорная кислота и им подобные. Примеры основных веществ, которые следует применять в комбинации, включают неорганические основания (например, гидроксид натрия, гидроксид калия, карбонат натрия, гидрокарбонат натрия, карбонат магния, карбонат кальция, оксид магния, амииак, синтетический гидротальцит), органические основания (например, диаминокислоту, такую как лизин, аргинин и т.п., меглумин и им подобные) и им подобные. Кроме того, предпочтительные примеры рН регулирующего агента, который следует применять в настоящем изобретении, включают такие, растворы которых обладают буферными свойствами при указанных значениях рН, такие как дигидрофосфат натрия, однозамещенный фумарат натрия и им подобные.-3 016593 Поскольку рН регулирующий агент следует применять в настоящем изобретении, однозамещенный фумарат натрия является, в частности, предпочтительным, и фумаровая кислота и гидроксид натрия могут применяться в комбинации. Твердая фармацевтическая композиция настоящего изобретения содержит рН регулирующий агент в количественном соотношении, равном 0,01-20 мас.%, предпочтительно 0,05-10 мас.%, более предпочтительно 0,1-5 мас.%. Кроме того, активный ингредиент, т.е. соединение (I), содержится в твердой фармацевтической композиции в количественном соотношении, равном 0,1-60 мас.%, предпочтительно 1-40 мас.%, более предпочтительно 10-30 мас.%. Твердая фармацевтическая композиция настоящего изобретения может применяться в форме твердого лекарственного продукта, пригодного для перорального введения, такого как таблетка, гранула,мелкая гранула, капсула, пилюля и им подобные. Твердый препарат может быть произведен в соответствии со способом, известным per se (например,способ, описанный в General Rules for Preparations, The Japanese Pharmacopoeia 14th Edition). Например, в случае, когда получают таблетки, соединение (I), рН регулирующий агент, эксципиент (например, лактоза, сахароза, глюкоза, крахмал, кукурузный крахмал, тростниковый сахар, микрокристаллическая целлюлоза, порошкообразный корень солодки, маннит, сорбит, гидрокарбонат натрия, фосфат кальция, сульфат кальция, силикат кальция и т.п.), дезинтегратор (например, аминокислота, крахмал, кукурузный крахмал,карбонат кальция, натрий-кармелоза, кальций-кармелоза, натрий-кроскармелоза, низкозамещенная гидроксипропилцеллюлоза, кросповидон, натрий-карбоксиметилкрахмал и т.п.) и им подобные комбинируют; связующее вещество (например, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, желатин, крахмал, аравийская камедь, трагакантовая камедь, карбоксиметилцеллюлоза, альгинат натрия, пуллулан, глицерин и т.п.) добавляют для получения гранул; скользящее вещество(например, стеарат магния, стеариновая кислота, стеарат кальция, очищенный тальк и т.п.) и им подобные добавляют в дополнение к этому; и смесь прессуют с образованием таблеток. Кроме того, гранулы и мелкие гранулы производят путем грануляции таким же способом, как и таблетки, или производят, покрывая оболочкой Nonpareil (торговое наименование, сферические гранулы, содержащие сахарозу 75%(мас./мас.) и кукурузный крахмал 25% (мас./мас., помимо этого с распыленной водой или раствором связующего вещества, такого как сахароза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и им подобные (концентрация около 0,5-70% (мас./об., с мелким порошком, содержащим соединение(I), рН регулирующий агент и вспомогательное вещество (например, сахароза, кукурузный крахмал,микрокристаллическая целлюлоза, гидроксипропилцеллюлоза, метилцеллюлоза, поливинилпирролидон и т.п.). Капсулы получают заполнением капсул, изготовленных из желатина, гидроксипропилметилцеллюлозы и им подобных, вышеуказанными гранулами или мелкими гранулами, или заполнением капсул,изготовленных из желатина, гидроксипропилметилцеллюлозы и им подобных, активным ингредиентом вместе с эксципиентом (например, лактоза, сахароза, глюкоза, крахмал, тростниковый сахар, микрокристаллическая целлюлоза, порошкообразный корень солодки, маннит, гидрокарбонат натрия, фосфат кальция, сульфат кальция и т.п.). Твердый препарат может быть покрыт оболочкой из покрывающего вещества для маскировки вкуса, для кишечного растворения или замедленного высвобождения, или им подобных. Примеры покрывающего вещества включают гидроксипропилметилцеллюлозу, этилцеллюлозу, гидроксиметилцеллюлозу, гидроксипропилцеллюлозу, полиоксиэтиленгликоль, Tween 80, pluronic F68, фталат ацетата целлюлозы, фталат гидроксипропилметилцеллюлозы, сукцинат ацетата гидроксиметилцеллюлозы, Eudragit (сополимер метакриловой кислоты-акриловой кислоты, производства Rohm, West Germany) и им подобные,и там, где это необходимо, также может применяться светозащитное вещество, такое как оксид титана,красный железооксидный пигмент и им подобные. Твердая фармацевтическая композиция настоящего изобретения может безопасно применяться в качестве фармацевтического агента для млекопитающих (например, для человека, собаки, кролика, крысы, мыши и т.п.). В то же время дозу соединения (I) для пациентов определяют, принимая во внимание возраст, массу тела, общее состояние здоровья, пол, питание, время введения, скорость выведения из организма, комбинирование лекарственных средств и тому подобное, а также и тяжесть заболевания, от которого пациент проходит лечение, дневная доза от около 0,05-500 мг до около 0,1-100 мг. Примеры В то время как нижеприведенные примеры подробно объясняют настоящее изобретение, их не следует истолковывать как ограничивающие настоящее изобретение. В примерах и в сравнительных примерах в качестве лактозы, маннита, гидроксипропилцеллюлозы,микрокристаллической целлюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона, очищенной сахарозы, кукурузного крахмала и стеарата магния применяли продукты, согласующиеся с Japanese Pharmacopoeia 14th Edition, и в качестве натриевой соли кроскармеллозы, сахарозокрахмальных сферических гранул и силиката кальция применяли продукты, согласующиеся с JapanesePharmaceutical Excipients 2003. Пример 1. Соединение А (1200 г) и маннит (2673 г) смешивали до однородного состояния в грану-4 016593 ляторе с псевдоожиженным слоем (FD-5S, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (151,2 г), фумаровой кислоты (56,00 г) и гидроксида натрия (19,32 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы превращали в порошок, используя электродробильную размалывающую машину (Р-3, Showa Chemical Machinery) и 1,5 ммпробивное сито. К полученным размолотым гранулам (3660 г) добавляли натрийкроскармелозу (345,0 г), микрокристаллическую целлюлозу (450,0 г) и стеарат магния (45,00 г), их смешивали в барабанной мешалке (ТМ-15, Showa Chemical Machinery). Полученную смесь таблетировали с помощью роторной таблетирующей машины (AQUARIUS, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 6,5 KN/пуансон, масса таблетки: 360 мг), получая плоскую таблетку,имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 2. Соединение А (42,68 г), лактозу (217,32 г), микрокристаллическую целлюлозу (32 г) и однозамещенный фумарат натрия (10 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (12 г) и однозамещенного фумарата натрия (10 г) и сушили в грануляторе с псевдоожиженным слоем, получая гранулы. Пример 3. Соединение А (42,68 г), лактозу (217,32 г), микрокристаллическую целлюлозу (32 г) и однозамещенный фумарат натрия (10 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (12 г) и однозамещенного фумарата натрия (10 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш(размер отверстия 1,0 мм), получая просеянные гранулы. Полученные просеянные гранулы (16,2 г) добавляли к низкозамещенной гидроксипропилцеллюлозе (0,8 г) и смесь перемешивали в стеклянной колбе. Полученную смесь таблетировали в Autograph (производства Shimadzu Corporation, AG-5000B), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 398,3 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч.-5 016593 Пример 4. Соединение А (71,13 г), кукурузный крахмал (18 г), очищенную сахарозу (68,87 г), низкозамещенную гидроксипропилцеллюлозу (40 г) и однозамещенный фумарат натрия (28,33 г) смешивали до однородного состояния, получая мелкий порошок для слоя, содержащего лекарственное средство. Сахарозо-крахмальные сферические гранулы (100 г) загружали в центробежный барабанный гранулятор(CF-mini, Freund Corporation) и мелкий порошок слоя, содержащего лекарственное средство, распыляли при разбрызгивании водного раствора гидроксипропилцеллюлозы (2 г) и однозамещенного фумарата натрия (5 г), получая сферические гранулы. Полученные сферические гранулы сушили при пониженном давлении при 40 С в течение 16 ч и просеивали через сетчатый фильтр, получая 710-1180 мкм гранулы. Пример 5. Соединение А (42,68 г), маннит (217,32 г), микрокристаллическую целлюлозу (32 г) и однозамещенный фумарат натрия (10 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (12 г) и однозамещенного фумарата натрия (10 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш(размер отверстия 1,0 мм), получая просеянные гранулы. Полученные просеянные гранулы (16,2 г) добавляли к низкозамещенной гидроксипропилцеллюлозе (0,8 г) и смесь перемешивали в стеклянной колбе. Полученную смесь таблетировали в Autograph (производства Shimadzu Corporation, AG-5000B), используя 6 ммпуансон (давление таблетирования: 3 KN/пуансон, масса таблетки: 170 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 6. Соединение А (85,36 г), маннит (155,64 г) и микрокристаллическую целлюлозу (30 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г) и дигидрофосфата натрия (20 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250 г) добавляли натрий-кроскармелозу (12,5 г) и стеарат магния (2,5 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 318 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 7. Соединение А (85,36 г), маннит (155,64 г), микрокристаллическую целлюлозу (30 г) и однозамещенный фумарат натрия (20 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250 г) добавляли натрий-кроскармелозу (12,5 г) и стеарат магния (2,5 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5KN/пуасон, масса таблетки: 318 мг), получая плоскую таблетку,имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 8. Соединение А (85,36 г), маннит (155,64 г) и микрокристаллическую целлюлозу (30 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г) и однозамещенного фумарата натрия (20 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250 г) добавляли натрий-кроскармелозу (12,5 г) и стеарат магния (2,5 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 318 мг), получая плоскую таблетку,имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 9. Соединение А (85,36 г), маннит (166,64 г), микрокристаллическую целлюлозу (30 г) и однозамещенный фумарат натрия (15 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании вод-7 016593 ного раствора гидроксипропилцеллюлозы (9 г) и однозамещенного фумарата натрия (5 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш(размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (155,5 г) добавляли микрокристаллическую целлюлозу (18,3 г), натрий-кроскармелозу (9,15 г) и стеарат магния(1,65 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 369,2 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 10. Соединение А (85,36 г), маннит (166,64 г), микрокристаллическую целлюлозу (30 г) и однозамещенный фумарат натрия (15 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г) и однозамещенного фумарата натрия (5 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш(размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (155,5 г) добавляли силикат кальция (18,3 г), натрий-кроскармелозу (9,15 г) и стеарат магния (1,65 г) и смешивали их в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5KN/пуансон, масса таблетки: 369,2 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 11. Соединение А (85,36 г), маннит (161,64 г) и микрокристаллическую целлюлозу (30 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора поливинилпирролидона (18 г) и однозамещенного фумарата натрия (5 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250 г) добавляли натрий-кроскармелозу (12,5 г) и стеарат магния (2,5 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон(давление таблетирования: 7,5 KN/пуансон, масса таблетки: 318 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 12. Соединение А (85,36 г) и маннит (199,99 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г); фумаровой кислоты (4,2 г) и гидроксида натрия (1,45 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250 г) добавляли микрокристаллическую целлюлозу (25 г), натрий-кроскармелозу(12,5 г) и стеарат магния (2,9 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 348,5 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 13. Соединение А (85,36 г) и маннит (199,99 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г), фумаровой кислоты (4,2 г) и гидроксида натрия (2,04 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250,3 г) добавляли микрокристаллическую целлюлозу (25 г), натрийкроскармелозу (12,5 г) и стеарат магния (2,9 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 349,1 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 14. Соединение А (85,36 г) и маннит (199,99 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9 г), фумаровой кислоты (4,2 г) и гидроксида натрия (2,55 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250,9 г) добавляли микрокристаллическую целлюлозу (25 г), натрийкроскармелозу (12,5 г) и стеарат магния (2,9 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 349,6 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 15. Маннит (190,99 г) перемешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и после этого добавляли распылением водный раствор фумаровой кислоты (4,2 г) и гидроксида натрия (1,45 г). Добавляли соединение А (85,36 г) и смесь гранулировали при разбрызгивании водного раствора поливинилпирролидона (18 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш(размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (250 г) добавляли микрокристаллическую целлюлозу (25 г), натрий-кроскармелозу (12,5 г) и стеарат магния (2,9 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 7,5 KN/пуансон, масса таблетки: 348,5 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч.- 10016593 Пример 16. Соединение А (106,7 г) и маннит (242,4 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (13,5 г), фумаровой кислоты (2,5 г) и гидроксида натрия (0,863 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (183 г) добавляли микрокристаллическую целлюлозу (22,5 г), натрийкроскармелозу (17,25 г) и стеарат магния (2,25 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, Kikusui Seisakusho,Ltd.), используя 6,0 ммпуансон (давление таблетирования: 2,5 KN/пуансон, масса таблетки: 90,0 мг),получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 17. Маннит (349,1 г) перемешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (13,5 г), фумаровой кислоты (2,5 г) и гидроксида натрия (0,863 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (91,5 г) и просеянным гранулам (91,5 г) примера 16 добавляли микрокристаллическую целлюлозу(22,5 г), натрий-кроскармелозу (17,25 г) и стеарат магния (2,25 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Correct 19K, KikusuiSeisakusho, Ltd.), используя 6,0 ммпуансон (давление таблетирования: 2,5 KN/пуансон, масса таблетки: 90,0 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Пример 18. Соединение А (5999 г) и маннит (13360 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (FD-S2, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (756,0 г), фумаровой кислоты (280,0 г) и гидроксида натрия (9 6,60 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы превращали в порошок, используя электродробильную размалывающую машину (Р-3, Showa ChemicalMachinery) и 1,5 ммпробивное сито. К полученным измельченным гранулам (36980 г) добавляли натрий-кроскармелозу (3478 г), микрокристаллическую целлюлозу (4536 г) и стеарат магния (453,6 г) и их смешивали в барабанном смесителе (ТМ 20-0-0 type, Suehiro Kakouki). Полученную смесь таблетировали с помощью роторной таблетирующей машины (AQUARIUS 36K, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 6,8 KN/пуансон, масса таблетки: 360 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давле- 11016593 нии при 40 С в течение 16 ч. Сравнительный пример 1. Соединение А (71,1 г) и маннит (163,9 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1, POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (9,0 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. К полученным просеянным гранулам (230,0 г) добавляли натрий-кроскармелозу (17,6 г), микрокристаллическую целлюлозу (23,0 г) и стеарат магния (2,3 г) и их смешивали в пластиковом пакете. Полученную смесь таблетировали с помощью роторной таблетирующей машины (Mini Rotary tableting machine, Kikusui Seisakusho, Ltd.), используя 9,5 ммпуансон (давление таблетирования: 6,5 KN/пуансон, масса таблетки: 360 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Сравнительный пример 2. Соединение А (42,68 г), лактозу (217,32 г) и микрокристаллическую целлюлозу (32 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1,POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (12 г) и сушили в грануляторе с псевдоожиженным слоем, получая гранулы. Сравнительный пример 3. Соединение А (42,68 г), лактозу (217,32 г) и микрокристаллическую целлюлозу (32 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1,POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (12 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. Полученные просеянные гранулы (15,2 г) добавляли к низкозамещенной гидроксипропилцеллюлозе (0,8 г) и смесь перемешивали в стеклянной колбе. Полученную смесь таблетировали в Autograph (производстваKN/пуансон, масса таблетки: 374,9 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Сравнительный пример 4. Соединение А (42,68 г), маннит (217,32 г) и микрокристаллическую целлюлозу (32 г) смешивали до однородного состояния в грануляторе с псевдоожиженным слоем (Lab-1,POWREX CORPORATION) и смесь гранулировали при разбрызгивании водного раствора гидроксипропилцеллюлозы (12 г) и сушили в грануляторе с псевдоожиженным слоем. Полученные гранулы просеивали через сетчатый фильтр 16 меш (размер отверстия 1,0 мм), получая просеянные гранулы. Полученные просеянные гранулы (15,2 г) добавляли к низкозамещенной гидроксипропилцеллюлозе (0,8 г) и смесь перемешивали в стеклянной колбе. Полученную смесь таблетировали в Autograph (производстваShimadzu Corporation, AG-5000B), используя 6 ммпуансон (давление таблетирования: 3 KN/пуансон,масса таблетки: 160 мг), получая плоскую таблетку, имеющую нижеприведенный состав. Затем плоскую таблетку сушили при пониженном давлении при 40 С в течение 16 ч. Экспериментальный пример 1. Свойство растворимости лекарственного средства для высушенных плоских таблеток, полученных в примере 1 и сравнительном примере 1, определяли с помощью теста растворимости (2,0% мас./мас. фосфатный буфер, содержащий додецилсульфат натрия (рН 6,8), 900 мл, способ с лопастной мешалкой,50 об./мин, 37 С). Тест растворимости осуществляли в соответствии с Japanese Pharmacopoeia 14th Edition Dissolution Test Method 2 (Paddle Method). Скорость растворимости измеряли посредством использования тестового раствора в УФ измеряющих приборах (Agilent8453, Agilent) в каждый момент времени,определяя количество соединения А и основного продукта разложения, используя устройства многокомпонентного анализа и рассчитывая скорость растворимости исходя из общего их количества. Результаты представлены на фиг. 1, где показывает результаты для высушенной плоской таблетки примера 1 и-о- показывает результаты для высушенной плоской таблетки сравнительного примера 1. Как представлено на фиг. 1, добавление рН регулирующего агента улучшает свойство растворимости. Экспериментальный пример 2. Сухие плоские таблетки, полученные в примере 1 и сравнительном примере 1, помещали в стеклянную колбу с влагопоглотителем в указанном порядке и хранили при 40 С в течение одного месяца. Увеличение количества продукта разложения определяли нижеприведенным способом. Соединение А извлекали в виде экстракта в концентрации приблизительно 1 мкг/мл и раствор фильтровали, используя безводный фильтр (0,45 мкм), и проводили количественное определение с помощью высокоэффективной жидкостной колоночной хроматографии (ВЭЖХ) при нижеприведенных условиях. Условия ВЭЖХ: детектор: фотометр поглощения в ультрафиолетовой области,измеряемая длина волны: 240 нм,колонка: YMC-Pack ProC18, 5 мкм, внутренний диаметр: 4,6 мм, длина: 150 мм,температура колонки: 25 С,подвижная фаза (А): 0,05 моль/л фосфатный буфер (рН 3,0)/ацетонитрил, смешанный раствор в соотношении (9:1),подвижная фаза (В): 0,05 моль/л фосфатный буфер (рН 3,0)/ацетонитрил, смешанный раствор в соотношении (3:7),скорость потока: 1 мл/мин,программа градиента (линейная) Результаты представлены в табл. 1. Как показано в табл. 1, добавление рН регулирующего агента сдерживает разложение соединения А. Таблица 1 Экспериментальный пример 3. Гранулы, полученные в примере 2 и сравнительном примере 2, помещали в стеклянную колбу с влагопоглотителем в указанном порядке и хранили при 40 С в течение одного месяца. Увеличение количества продукта разложения определяли так же, как в экспериментальном примере 2. Результаты представлены в табл. 2. Как показано в табл. 2, добавление рН регулирующего агента сдерживает разложение соединения А. Таблица 2 Экспериментальный пример 4. Свойство растворимости лекарственного средства для сухих плоских таблеток, полученных в примере 3 и сравнительном примере 3, определяли с помощью теста растворимости (0,5% мас./мас. фосфатный буфер, содержащий додецилсульфат натрия (рН 6,8), 900 мл,способ с лопастной мешалкой, 50 об./мин, 37 С). Тест растворимости осуществляли в соответствии сJapanese Pharmacopoeia 14th Edition Dissolution Test Method 2 (Paddle Method). Количество растворенного лекарственного средства получали посредством фильтрования тестируемого раствора через мембранный фильтр (размер пор 0,45 мкм) в каждый момент времени и определяли количественно с помощью высокоэффективной жидкостной колоночной хроматографии (ВЭЖХ) при нижеприведенных условиях. Скорость растворимости рассчитывали исходя из общего количества соединения А (время удерживания приблизительно 10 мин) и основного продукта разложения (время удерживания приблизительно 4 мин). Условия ВЭЖХ: детектор: фотометр поглощения в ультрафиолетовой области,измеряемая длина волны: 260 нм,колонка: YMC-Pack ProC18, 5 мкм, внутренний диаметр: 4,6 мм, длина: 150 мм,температура колонки: 25 С,подвижная фаза: 0,05 моль/л фосфатный буфер (рН 3,0)/ацетонитрил, смешанный раствор в соотношении (1:1),скорость потока: приблизительно 1 мл/мин,Результаты представлены на фиг. 2, где показывает результаты для высушенной плоской таблетки примера 3 и -о- показывает результаты для высушенной плоской таблетки сравнительного примера 3. Как представлено на фиг. 2, добавление рН регулирующего агента улучшает свойство растворимости. Экспериментальный пример 5. Сухие плоские таблетки, полученные в примере 3 и сравнительном примере 3, помещали в стеклянную колбу с влагопоглотителем в указанном порядке и хранили при 40 С в течение одного месяца. Увеличение количества продукта разложения определяли таким же образом,как в экспериментальном примере 2. Результаты представлены в табл. 3. Как показано в табл. 3, добавление рН регулирующего агента сдерживает разложение соединения А. Экспериментальный пример 6. Свойство растворимости лекарственного средства для сухих плоских таблеток, полученных в примере 5 и сравнительном примере 4, осуществляли в соответствии с экспоказывает результаты для периментальным примером 3. Результаты представлены на фиг. 3, где высушенной плоской таблетки примера 5 и -о- показывает результаты для высушенной плоской таблетки сравнительного примера 4. Как представлено на фиг. 3, добавление рН регулирующего агента улучшает свойство растворимости. Экспериментальный пример 7. Сухие плоские таблетки, полученные в примере 6 и сравнительном примере 1, помещали в стеклянную колбу с влагопоглотителем в указанном порядке и хранили при 40 С в течение одного месяца. Увеличение количества продукта разложения определяли таким же образом,как в экспериментальном примере 2. Результаты представлены в табл. 4. Как показано в табл. 4, добавление рН регулирующего агента,представляющего оптимальный рН, сдерживает разложение соединения А. Таблица 4 Экспериментальный пример 8. Сухие плоские таблетки, полученные в примерах 12, 13 и 14, помещали в стеклянную колбу с влагопоглотителем в указанном порядке и хранили при 40 С в течение двух недель. Увеличение количества продукта разложения определяли таким же образом, как в экспериментальном примере 2. Результаты представлены в табл. 5. Как показано в табл. 5, добавление рН регулирующего агента сдерживает разложение соединения А и доведение до оптимального рН увеличивает стабильность соединения А. Таблица 5 Экспериментальный пример 9. Сухие плоские таблетки, полученные в примерах 16 и 17 и в сравнительном примере 1, помещали в стеклянную колбу с влагопоглотителем в указанном порядке и хранили при 40 С в течение одного месяца. Увеличение количества продукта разложения определяли таким же образом, как в экспериментальном примере 2. Результаты представлены в табл. 6. Как показано в табл. 6, таблетки примера 16 и примера 17 показывали стабилизирующий эффект. Таблица 6 Экспериментальный пример 10. рН регулирующий агент растворяли или суспендировали в воде при концентрации 1% мас./об. при 25 С и для полученного в результате раствора или суспензии измеряли рН. Результаты представлены в табл. 7. Экспериментальный пример 11. К трем таблеткам сравнительного примера 1 добавляли воду (1080 мл) и смесь перемешивали до полной распадаемости таблеток. Для полученной в результате суспензии измеряли рН при 25 С. В результате получали значение рН, равное 8,02. Экспериментальный пример 12. Растворяемость соединения А в водных растворах с различными значениями рН измеряли, как показано ниже. Избыточное количество соединения А и водного раствора помещали в пробирку и смесь встряхивали при 25 С в течение 30 с каждые 5 мин. Спустя 30 мин раствор фильтровали через мембранный фильтр 0,45 мкм, получая образец. Используя образец, концентрацию соединения А определяли при нижеприведенных условиях ВЭЖХ. Условия ВЭЖХ: детектор: фотометр поглощения в ультрафиолетовой области,измеряемая длина волны: 260 нм,колонка: YMC-Pack ProC18, 3 мкм, внутренний диаметр: 6 мм, длина: 5 см,температура колонки: 25 С,подвижная фаза: 0,05 моль/л фосфатный буфер (рН 3,0)/ацетонитрил, смешанный раствор в соотношении (1:1),скорость потока: приблизительно 1 мл/мин. Таблица 8Britton Robinson буферный раствор. Промышленная применимость Твердая фармацевтическая композиция настоящего изобретения демонстрирует как лучшую стабильность соединения (I) в препарате, так и лучшую растворимость активного ингредиента из препарата. Кроме того что некоторые примеры осуществления настоящего изобретения выше описаны подробно, специалист в этой области техники может внести различные модификации и изменения в отдельные примеры осуществления изобретения, по существу, не выходя за пределы новых указаний и преимуществ настоящего изобретения. Такие модификации и изменения охватываются сущностью и объемом настоящего изобретения, как изложено ниже в прилагаемых пунктах формулы изобретения. Эта заявка основывается на предварительной заявке США 60/908515, содержание которой включено в этот документ посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Твердая фармацевтическая композиция, включающая (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2 этокси-1-[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил-1 Н-бензимидазол-7 карбоксилат или его соль и рН регулирующий агент, имеющий рН от 2 до 5 в воде, в концентрации 1% мас./об. при 25 С. 2. Твердая фармацевтическая композиция, включающая калиевую соль (5-метил-2-оксо-1,3 диоксол-4-ил)метил-2-этокси-1-[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил-1 Нбензимидазол-7-карбоксилата и рН регулирующий агент, имеющий рН от 2 до 5 в воде, в концентрации 1% мас./об. при 25 С.- 16016593 3. Фармацевтическая композиция по п.1 или 2, в которой рН регулирующий агент представляет собой однозамещенный фумарат натрия или комбинацию фумаровой кислоты и гидроксида натрия. 4. Способ стабилизации соединения в твердой фармацевтической композиции по п.1 или 2, который включает добавление рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25 С, к твердой фармацевтической композиции. 5. Способ улучшения растворимости соединения из твердой фармацевтической композиции по п.1 или 2, который включает добавление рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25 С, к твердой фармацевтической композиции по п.1 или 2. 6. Применение рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25 С, для стабилизации соединения в твердой фармацевтической композиции по п.1 или 2. 7. Применение рН регулирующего агента, имеющего рН от 2 до 5 в воде в концентрации 1% мас./об. при 25 С, для улучшения растворимости соединения в твердой фармацевтической композиции по п.1 или 2.
МПК / Метки
МПК: A61K 9/16, A61K 9/20, A61K 31/00
Метки: производное, агент, композиция, регулирующий, бензимидазол-7-карбоксилата, фармацевтическая, твердая, включающая
Код ссылки
<a href="https://eas.patents.su/18-16593-tverdaya-farmacevticheskaya-kompoziciya-vklyuchayushhaya-proizvodnoe-benzimidazol-7-karboksilata-i-ph-reguliruyushhijj-agent.html" rel="bookmark" title="База патентов Евразийского Союза">Твердая фармацевтическая композиция, включающая производное бензимидазол-7-карбоксилата и ph регулирующий агент</a>
Предыдущий патент: Трициклические производные изохинолина для лечения ожирения
Следующий патент: Производные 1-(аминоалкоксиарилсульфонил)индола в качестве 5-нт6 лигандов
Случайный патент: 3, 4, 5-тризамещенные арилнитроны и содержащие их фармацевтические композиции