Олигосахаридные производные рибоза-рибит-фосфата и содержащие их вакцины
Формула / Реферат
1. Смесь олигосахаридов, содержащая повторяющиеся звенья формулы (фосфат-рибоза-рибит)n или (рибоза-рибит-фосфат)n, где указанная смесь получена синтетическим способом и содержит по меньшей мере 5 соединений формулы A или B, причем значения n составляют от 4 до 25, и где R1 или R2 означает H или спейсер для конъюгации с носителем, при условии, что R1=спейсер, если R2=H, или R2=спейсер, если R1=H.
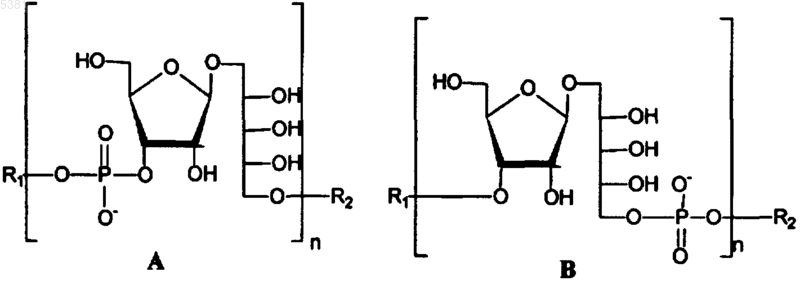
2. Смесь олигосахаридов по п.1, где указанные соединения формулы (фосфат-рибоза-рибит)n или (рибоза-рибит-фосфат)n формулы A или B отличаются друг от друга только значением n, причем значения n составляют от 4 до 25.
3. Смесь олигосахаридов по п.1, где спейсер означает любую алифатическую углеводородную цепь, содержащую гетероатомы, число которых колеблется от 0 до 5, и/или ароматическую цепь, всегда имеющую на другом конце спейсера функциональную группу NH2, COOH, CHO, SH или их предшественников, способных к образованию химической связи с молекулой, выполняющей роль носителя.
4. Способ синтеза смеси олигосахаридов по пп.1-3, содержащих повторяющиеся звенья формулы (фосфат-рибоза-рибит)n или (рибоза-рибит-фосфат)n, где в одну стадию проводят реакцию поликонденсации, используя дисахаридное производное 2,3,4-три-O-бензил-1-O-(b-D-2',5'-ди-O-бензил-3'-O-триэтиламмонийфосфонатрибофуранозил)-D-рибитол (19) или его аналоги, содержащие фосфонат в положении 5 и свободную гидроксильную группу в положении 3 (23), в присутствии промотора, который представляет собой активное производное стерически затрудненной кислоты, в основном растворителе и со спейсером, который участвует в реакции в качестве акцептора, обрывающего рост олигомерной цепи.
5. Способ по п.4, где промежуточный дисахарид 19 или 23 и промотор находятся в мольном соотношении 1/1-3.
6. Способ по п.4 или 5, где промотор является активным производным стерически затрудненной кислоты.
7. Способ по любому из пп.4-6, где промотор предпочтительно представляет собой пивалоилхлорид, адамантантоилхлорид, дифенилхлорфосфат или 2,4,6-триизопропилбензолсульфонилхлорид.
8. Способ по п.4, где промежуточный дисахарид 19 или 23 и спейсер находятся в мольном соотношении 5-10/1.
9. Способ по любому из пп.4-8, где дисахаридом является 19, спейсером является 23, промотором является пивалоилхлорид, а растворителем является пиридин.
10. Способ синтеза смеси олигосахаридов по любому из пп.1-3, где соединения, полученные в соответствии со способом по любому из пп.4-9, дополнительно подвергают окислению фосфоната до фосфата с последующим гидрированием для удаления бензильных защитных групп, снятию защиты или активации спейсера и удалению фракций из менее чем 4 и более 25 повторяющихся звеньев путем одного или нескольких молекулярных рассевов.
11. Иммуноген, содержащий смесь олигосахаридов по любому из пп.1-3, где указанная смесь олигосахаридов связана с молекулой носителя, выбранной из группы, состоящей из белков, пептидов или липидов.
12. Вакцина для профилактики инфекционных заболеваний, вызываемых Haemophilus influenzae типа b, содержащая иммуноген по п.11, приготовленная с адъювантом или с другими добавками или без них.
13. Вакцина по п.12, используемая в сочетании с другими вакцинами, такими как вакцины против гепатита B, против менингококка A, B и/или C, DPT, против вируса полиомиелита, против пневмококка 1, 5, 6B, 6A, 14, 19F, 19a и/или 23F, или в сочетании с соответствующими им иммуногенами.
14. Способ синтеза промежуточного дисахарида 2,3,4-три-O-бензил-5-O-аллил-(b-D-рибофуранозил)-D-рибита 4 в чистой форме путем рибозилирования 2,3,4-три-O-бензил-5-O-аллил-D-рибита 14 перацетатом рибофуранозы с последующим дезацетилированием с получением соединения 4, которое подвергают абсорбции-десорбции на силикагеле с целью очистки.
15. Дисахарид 5-O-пропенил-2,3,4-три-O-бензил-1-O-(2',5'-ди-O-бензил-b-D-рибофуранозил)-D-рибита 17 в качестве промежуточного соединения в синтезе производных 19 и 23.
16. Способ синтеза промежуточного дисахарида 17, предусматривающий процедуру дибензилирования дисахарида 4 оксидом дибутилолова, йодидом тетрабутиламмония, гидридом натрия и бензилхлоридом в соотношении 1:0,5-2:0,001-1:0,5-10:1-5 в растворителе, таком как толуол, бензол, тетрагидрофуран или ксилол, с получением соединения формулы 5-O-аллил-2,3,4-три-O-бензил-1-O-(b-D-2',5'-ди-O-бензилрибофуранозил)-D-рибитол (5) с последующей изомеризацией аллила до пропенила.
17. Дисахаридное производное 2,3,4-три-O-бензил-1-O-(2',5'-ди-O-бензил-b-D-рибофуранозил)-D-рибит-5-O-триэтиламмонийфосфонат (23) или 2,3,4-три-O-бензил-1-O-(2',5'-ди-O-бензил-b-O-рибофуранозил)-D-рибит-3'-O-триэтиламмонийфосфонат (19) в качестве промежуточных соединений в способе олигомеризации по любому из пп.4-9.
18. Способ получения дисахарида 19, исходя из дисахарида 17, предусматривающий фосфонилирование трихлоридом фосфора-имидазолом с последующим гидролизом пропенильной группы или ацетилирование, гидролиз пропенильной группы и фосфонилирование трихлоридом фосфора-имидазолом с последующим дезацетилированием.
19. Способ получения дисахарида 23, исходя из дисахарида 17, предусматривающий фосфонилирование трихлоридом фосфора-имидазолом с последующим гидролизом пропенильной группы или ацетилирование, гидролиз пропенильной группы и фосфонилирование трихлоридом фосфора-имидазолом с последующим дезацетилированием.
20. Применение дисахаридов 19 или 23 для синтеза смесей олигосахаридов по любому из пп.1-3.
21. Макромолекула, содержащая смесь олигосахаридов по любому из пп.1-3, в которых олигосахаридная смесь связана с иммунологически инертным полимерным материалом.
22. Применение макромолекулы по п.21 для обнаружения и количественного анализа антител против капсульного полисахарида Haemophilus influenzae типа b.
Текст
005381 Область техники Настоящее изобретение относится к области медицины, в частности к химическим синтезам смесей олигосахаридов, полученных из рибоза-рибит-фосфата, используемых в качестве активной основы в вакцинах для профилактики инфекций, вызываемых Haemophilus influenzae типа b (Hib), а также касается вакцин, содержащих указанные смеси олигосахаридов. Известный уровень техникиHaemophilus Influenzae типа b является во всем мире серьезной проблемой, связанной со здоровьем человека. Бактерия вызывает, в основном, у детей в возрасте 5 лет менингит, пневмонию, эпиглоттит и другие заболевания дыхательных путей. Наблюдаемые исходы от нарушений слуха до тяжелой олигофрении составляют во многих странах более 30% выживших после болезни. Последние оценки Всемирной Организации Здравоохранения показывают, что более 550000 детей в мире умирает ежегодно от болезней,вызываемых Haemophilus influenzae типа b. Очищенный капсульный полисахарид Haemophilus influenzae способен вызывать защитный иммунитет у взрослых, однако, иммунная реакция у детей очень слаба и практически отсутствует у детей в возрасте до 2 лет. Капсульный полисахарид имеет следующую структуру: Показано, что основная проблема заключается в самой природе антигена, являясь полисахаридом,он представляет собой Т-независимый антиген, не способный стимулировать незрелую иммунную систему ребенка. Показано, что решение данной проблемы может быть достигнуто за счет ковалентного связывания (конъюгирования) полисахарида с белком, известным в качестве носителя. Полученный таким образом продукт, известный как конъюгированная вакцина, индуцирует защитный уровень антител с двухмесячного возраста.Chu и др. (Infection Immunity 1983, 40, 245-256) получили конъюгат из нативного капсульного полисахарида и столбнячного анатоксина после активации цианогенбромидом.Gordon (патент США 4496538) активировал природный полисахарид цианогенбромидом и затем конъюгировал его с дифтерийным анатоксином через дигидразид адипиновой кислоты.Hilman и др. (патент США 4459286) конъюгировали природный полисахарид через 6 аминокапроновую кислоту с белком наружной мембраны менингококка после их первоначального активирования. Во всех предшествующих способах конъюгирования имеет место ковалентная связь между несколькими группами капсульного полисахарида и белка-носителя. Способность вызывать защитный иммунитет у детей зависит от структуры конъюгата. Когда конъюгирование выполняют с нативным полисахаридом, группы, участвующие в образовании связи, случайно распределены по цепи полисахарида, делая характеристику каждой партии весьма сложной. Все эти вакцины очень трудны для анализа физико-химическими методами; поэтому стало обычной практикой оценивать каждую партию путем изучения иммуногенности на экспериментальных животных. Однако поведение конъюгата в организме ребенка отличается от поведения в организме экспериментальных животных. Согласно критериям Всемирной Организации Здравоохранения (ВОЗ) стабильного качества (M.R.Holliday, C. Jones, Biologicals, 1999, 27, 51-53) контроль конъюгированных вакцин должен основываться на физико-химических методах, демонстрирующих сходство одной партии с другой. Для облегчения указанной задачи конъюгированные вакцины следует более точно характеризовать на молекулярном уровне. Одним из альтернативных решений данной проблемы является синтез фрагменов капсульного полисахарида. Способ синтетического конструирования антигена Haemophilus influenzae типа b имеет две основные стадии, синтез промежуточного дисахарида и его олигомеризацию. Было разработано несколько подходов к указанному синтезу.Beuvery и др. (заявка на выдачу европейского патента ЕРО 0276516; патент США 5034519; Tetrahedron Lett., 28, 1553, 1987) и Hoogerhout и др. (J. Carbohydr. Chem, 7, 1988, 399-416) получили синтетическим способом фрагмент капсульного полисахарида, который был заявлен как содержащий от 3 до 20 повторяющихся звеньев. Для достижения указанной цели был сначала получен промежуточный дисахарид 2, а затем методами твердофазной химии или синтеза в растворе был получен олигомер, содержащий 6 повторяющихся звеньев (Elie et al., Rec. Trav. Chim. Pays-Bas, 108, 1989, 219). Олигомеры конъюгировали с белками или пептидами через спейсер. Тримерный конъюгат является столь же иммуногенным у мышей, как и коммерчески доступная вакцина, полученная из капсульного полисахарида. 1 005381 В предпочтительном варианте осуществления, иллюстрирующем избранный синтетический путь,использовали следующий последовательный подход: 1 - синтез рибита, 2 - связывание с рибозой, 3 - селективное введение заместителей в звено рибозы и 4 - введение фосфор-активирующей группы. Используя указанный путь, получали ключевое производное дисахарида 2 лишь за 15 реакционных стадий. Общий выход составляет 7% (Hermans et al., Reel. Trav. Chim. Pays-Bas, 1987, 106, 498-504). Кроме того, данный способ имеет два основных недостатка: способ включает 11 хроматографических стадий, а защита групп ключевого промежуточного соединения не способствует процессу олигомеризации. При олигомеризации, или второй стадии синтеза, используемым способом является синтез в растворе через активацию с помощью сложного фосфотриэфира, позволяющий выходы в пределах 70-90% на цикл, в расчете на дисахарид. Основной недостаток указанного способа состоит в невозможности получения фрагментов, содержащих более 4 повторяющихся звеньев, поскольку выходы резко снижаются. Промежуточный дисахарид 2 имеет 3 различные защитные группы, что очень затрудняет снятие защиты с конечного продукта. Таким образом, указанный дисахарид неудобен для олигомеризации методами твердофазной химии. Ввиду этого сообщалось о синтезе гексамера. В иммунологических исследованиях (Peters CCAM, et al., Infect. Immunity, 1991, 59, 3504-10) сообщается только о конъюгации тримера со столбнячным анатоксином и его иммуногенности для мышей и обезьян.G. Just, J. Upeslacis (European patent application EP 0 320 942, L. Chan; G. Just, Tetrahedron, 46, 1990, 151162) синтезировали также фрагмент капсульного полисахарида через промежуточный дисахрид и синтез в растворе. С целью получения оптимального промежуточного соединения для синтеза антигена выбран другой путь: 1 - синтез рибита, 2 - синтез звена рибозы с адекватной защитной группой, 3 - сочетание рибозы и рибита и 4 - введение фосфор-активной функциональной группы. Получение промежуточного соединения 3 в форме фосфорамидита использованием указанной методики выделяет лучший выбор защитных групп для способа олигомеризации. Для достижения указанной цели требуется большее число стадий. Ключевое производное получают за 19 стадий и с использованием 8 хроматографических стадий очистки. Дисахарид 3 олигомеризуют в растворе, получая фрагменты капсульного полисахарида, содержащего 3 повторяющихся звена, с выходом в расчете на дисахарид в пределах 70-90% на цикл.Kandil и др. (Syn. Lett., 1992, 555-7), Chon и др. (РСТ патентная заявка WO 93/15205 и патент США 5679352) синтезировали фрагмент капсульного полисахарида, используя то же самое промежуточное производное дисахарида 3 и через химическое превращение в твердой фазе, использованием в качестве носителя монометоксиполиэтиленгликоля получены фрагменты, содержащие до 6 повторяющихся звеньев, выход на цикл составляет 95%.Krivan и др. (РСТ патентная заявка WO 94/00149) и Nilsson и др. (J. Carbohydr. Chem., 10, 1991, 122) получили фрагмент из 10 повторяющихся звеньев при том же промежуточном производном дисахарида 3 и химическом превращении в твердой фазе. Указанный фрагмент конъюгировали через спейсер сHib-адгезином. Промежуточное фосфонатное соединение получают за 21 стадию с общим выходом 5%. Требуется также по меньшей мере 7 хроматографических стадий. Способ олигомеризации осуществляют, используя Н-фосфонаты и химическое превращение в твердой фазе, применяя аминированную смолуChiu Machado и др. (J. Carbohydr. Chem., 13 1994, 465-474) и кубинский патент 22424 описывают эффективный способ синтеза подходящего защищенного производного рибозы из глюкозы. Используя указанное производное, авторы получают ключевой дисахарид за 20 реакционных стадий. Одним из аспектов, затрудняющих приложение синтеза к получению Hib-фрагментов и их использования в вакцинах, является синтез промежуточного дисахарида. 2 005381 Все перечисленные выше способы отражают состояние уровня техники современной химии углеводов, однако, они имеют два очень серьезных технических недостатка. Использование нескольких хроматографических стадий на протяжении синтеза делает синтез нецелесообразным в промышленном масштабе, и число синтетических стадий обычно очень высоко. Основная сложность синтеза дисахарида в несколько реакционных стадий состоит во введении бензильных групп в звено рибозы. Способ олигомеризации дисахарида может осуществляться и в растворе, при серьезном неудобстве,состоящем в том, что максимальный размер, который может быть достигнут, ограничивается 3-4 повторяющимися звеньями. Способ может также быть осуществлен с применением химических превращений в твердой фазе. Химическое превращение в твердой фазе позволяет получение олигосахаридов в интервале от 6 до 10 повторяющихся звеньев с высокими выходами на цикл. Однако обычно существуют две серьезные проблемы, состоящие в том, что реальный выход составляет только 10-15% из-за достижения высокого включения промежуточного дисахарида на цикл и обычно требуется большой избыток дисахарида, между 3-10 мольными эквивалентами. Излишек дисахарида теряется при технологическом процессе. Другая проблема состоит в том, что обычно требуются два различных производных, одно для сочетания с твердым носителем и второе для удлинения цепи. Синтез единичного чистого фрагмента олигосахарида, лишенного какого-либо отличия не только по структуре, но также и по длине цепи, является общим аспектом всех предшествующих сообщений о синтезе Hib-антигенов и, в то же самое время, является одной из их главных задач. Все основано на допущении, что антиген, состоящий из отдельной молекулы, необходим для получения анти-Hib конъюгированной вакцины с более стабильной характеристикой благодаря более легкому регулированию. Разработаны новые способы получения фрагментов олигосахаридов путем фрагментации природных полисахаридов, а также активации смеси олигосахаридов по одной из концевых позиций. Согласно патентам США 4808700; США 4761283, а также в Glycoconjugate J., 1989, 6, 489-498 (R.C.Seid, et al.) природный полисахарид окисляют периодатом и очищают полученные фрагменты. Смесь фрагментов олигосахаридов становится активированной по двум концевым позициям, как показано на последующей схеме. Указанные олигосахариды конъюгируют по реакции восстановительного аминирования до CRM 197. Как видно из схемы, оба участка конъюгирования различны. Тотчас же после осуществления конъюгирования существует по меньшей мере два семейства конъюгированных олигосахаридов с различными структурами. С другой стороны, процент олигосахарида не очень хорошо устанавливает, происходит ли связывание одного и того же олигосахарида с двумя различными участками одного и того же белка, или с двумя молекулами белка. Все эти явления создают неоднородность и затрудняют контроль. С другой стороны, патент США 5153312, а также Vaccine, 1999, 17, 1251-63 (P. Constantino et al.) сообщают о гидролизе природного полисахарида уксусной кислотой и очистке образующейся смеси фрагментов олигосахаридов. Продукт активируют через последовательность реакций, где спейсер вводят путем восстановительного аминирования этилендиамином при высоких рН и температуре, что может влиять на целостность смеси олигосахаридов. С другой стороны, часть антигена является, вероятно,инактивированной после восстановления карбонилгемиацеталя, как показано на следующей схеме. Далее, аминопроизводное олигосахарида селективно замещают активным сложным эфиром адипиновой кислоты по одной из концевых сложноэфирных функциональных групп. Другая сложноэфирная функциональная группа остается активной для сочетания с белком. Две вакцины, полученные из продуктов фрагментации природного полисахарида, использованы в практике иммунизации множества детей. Показано, что возможно использование олигосахаридов, не имеющих не только одного размера, а даже размеров в пределах интервала, для промышленного получения конъюгированной вакцины против Hib и, в то же самое время, адекватное контролирование воспро 3 005381 изводимости и качества продукта. Даже если конъюгат, полученный указанным способом, легче характеризовать, чем продукт, полученный прямым активированием полисахарида, практически невозможно выполнить фрагментацию природного полисахарида с последующим введением функциональной активной группы и достигнуть того же уровня молекулярного построения и чистоты в антигене, какой может быть достигнут путем химического синтеза. Не существует видимых преимуществ в регулировании конъюгированных вакцин путем использования олигосахарида определенного размера или смеси олигосахаридов по размеру, но однородной по остаточной структуре. Это было продемонстрировано предварительно проведенными экспериментами с применением аналитических способов, известных из уровня техники, позволяющих легко определять составCarbohydrate Symposium, Galway, July 1999, PBO14). С другой стороны, не существует отличий в иммунологическом поведении между вакциной, состоящей из смеси Hib-олигосахаридов по размерам или из олигосахарида одного размера, когда фрагмент содержит более 3 повторяющихся звеньев (S. Pillai, et al., Infection and Immunity, 1991, 59, 4371-6; A.A Kandil, et al., Glycoconjugate J., 1997, 14, 13-7 и Peters CCAM, et al., Infect. Immunity, 1991, 59, 3504-10). Дополнительные обстоятельства, затрудняющие выбор одного, оптимального со всех точек зрения,размера. Олигосахариды из 4-6 повторяющихся звеньев синтезировать легче и их размера обычно достаточно для того, чтобы вызывать адекватную иммунную реакцию. Однако количество белка-носителя,необходимое для указанной вакцины, очень велико и стабильность олигосахарида в вакцине понижена из-за процесса разложения путем гидролиза сложного фосфодиэфира, что приводит к очень быстрому возникновению очень короткого фрагмента, соединенного с белком, с числом повторяющихся звеньев менее 4, и поэтому неактивного. Фрагменты с размером в пределах 8-20 повторяющихся звеньев являются в принципе более стабильными, поскольку после разложения до половины их размера оставшийся фрагмент, соединенный с белком-носителем, будет больше, чем из 4 повторяющихся звеньев. Количество белка-носителя, необходимое для вакцины, также меньше. Однако согласно известному из уровня техники в отношении олигосахаридов для Hib синтез фрагментов с размером в пределах 10-20 невозможен по способам в растворах и все еще сомнительна возможность использования твердофазных способов. Фактически, в приведенных ранее примерах олигосахариды указанного размера полностью отсутствуют. Другим недостатком является Т-зависимость иммунной реакции, очень важный аспект для достижения хорошей иммунной реакции у детей. Тзависимость полисахарида снижается с повышением размера (С. Fernandez, E. Sverremark, Cell Immunol.,1994, 153, 67-78). Вывод: любой способ синтеза Hib-антигенов, чтобы быть конкурентоспособным, должен снижать число стадий ключевого дисахарида, снижать число хроматографических стадий и, в особенности, должен существенно повышать выходы в процессе олигомеризации. Смеси олигосахаридов, полученных гидролизом природных полисахаридов, содержат фракции интервалов обоих размеров, что обеспечивает преимущество каждого и снижает их недостатки. Если подобные смеси можно будет получать синтетическим путем, они получат преимущество содержания интервалов обоих размеров. Созданная синтетическим путем указанная смесь будет более определенной и чистой и будет содержать спейсер в точно определенных пропорциях и положении. Описание изобретения Настоящее изобретение, в частности, касается химического синтеза смесей олигосахаридов, полученных из рибоза-рибит-фосфата, которые полезны в качестве активной основы в вакцинах для профилактики инфекций, вызываемых Haemophilus Influenzae типа b (Hib), а также вакцин, содержащих указанные смеси олигосахаридов. Смеси олигосахаридов, полученные химическим синтезом по настоящему изобретению, включают повторяющиеся звенья формулы (фосфат-рибоза-рибит)n или (рибоза-рибит-фосфат)n по меньшей мере из 5 соединений структур А или В, представляющих повторяющееся звено капсульного полисахаридаHaemophilus influenzae типа b и отличающихся только величиной n, при этом n принимает значения в интервале от 4 до 25 (4n25), и где R1 или R2 означает спейсер для конъюгации с носителем, при условии, что R1=спейсер, если R2=Н, или R2=спейсер, если R1=Н. Изобретение касается также иммуногенов, содержащих указанные смеси олигосахаридов, вакцин,содержащих указанные иммуногены, и способов получения указанных олигосахаридов в виде смесей. Кроме того, настоящее изобретение включает использование вакцин отдельно либо в сочетании с другими вакцинами для профилактики инфекций, вызываемых Haemophilus influenzae типа b. 4 005381 С помощью настоящего изобретения можно получать путем химического синтеза регулярную смесь олигосахаридов четко определенного размера и более эффективным способом. Указанная смесь имеет большую чистоту и ее получают использованием более простого технологического процесса. Найдено также, что конъюгированные вакцины, полученные из смеси по изобретению, лучше по промышленному получению и проще для регулирования. Другой объект настоящего изобретения представляет собой синтетический способ получения вышеуказанной смеси олигосахаридов, определяемый как одностадийный способ, состоящий в контролируемой реакции поликонденсации между ключевым промежуточным дисахаридом, спейсером и промотором и характеризующийся также тем фактом, что средний размер антигена можно регулировать через долю каждого из участвующих реагентов, порядок их добавления и время реакции. Еще один объект настоящего изобретения представляет собой применение вышеуказанных иммуногенов в получении вакцин против болезней, вызываемых Haemophilus influenzae типа b, с использованием или в отсутствие адъювантов и других добавок. Еще один объект настоящего изобретения представляет собой применение вышеуказанных смесей для получения комбинированных вакцин с другими вакцинами, конъюгированными или нет, как, например, с вакциной против вируса гепатита В, DPT, против менингококка А, В, С, против пневмококка 1, 5 6 В, 6 А, 14, 19F, 19 А, 23F и против вируса полиомиелита. Другой объект настоящего изобретения представляет собой оптимизированный способ синтеза ключевого дисахарида, требуемого для синтеза Hib-олигосахаридов. Оптимизация состоит в открытии новой реакции селективного бензилирования, которая, применительно к дисахариду 4, позволяет превратить его в дисахарид 5, с введением бензильных защитных групп в звено рибозы на отдельной стадии,что делает весь способ значительно короче и проще. Объектом настоящего изобретения является также оптимальный способ синтеза промежуточного соединения 4, позволяющий получать указанное соединение с высокой чистотой всего за 11 реакционных стадий и без использования хроматографических способов. Другой объект настоящего изобретения представляет собой применение вышеуказанных олигосахаридов для обнаружения и количественного определения антител к Hib через их конъюгаты с иммунологически инертными веществами, такими как полиакриламид, полистирол, латекс. Новизну настоящего изобретения составляет композиция из полученной смеси олигосахаридов, которая реагирует на повторяющееся звено капсульного полисахарида Haemophilus influenzae типа b со спейсером, приводя к конъюгации только по одной из трех концевых позиций, по положению, заранее рассчитанному в синтезе. Указанная композиция отзывается на одну и ту же регулярную и гомогенную структуру. Смесь олигосахаридов содержит фрагменты из двух различных интервалов по размеру, в основном, между 4-8 и 8-20 звеньями, приобретая преимущества каждого интервала и снижая недостатки,которые может иметь каждая группа в отдельности. Кроме того, новизну настоящего изобретения составляет сам способ получения указанной смеси путем химического синтеза, позволяющего получать продукт с высокой воспроизводимостью и эффективностью. Точно так же, в данном изобретении показано, что только одна реакция позволяет вводить бензильные защитные группы в звено рибозы на отдельной стадии, что повышает эффективность получения ключевого дисахаридного производного для синтеза указанных олигосахаридов. Синтез промежуточного дисахарида начинают с получения производного 5-O-аллил-2,3,4-три-Oбензил-D-рибита 14 с помощью 9 химических реакций, представленных следующей схемой. D-Рибозу превращают в производное изопропилидена 6 по методике, известной из предшествующего уровня техники (Leonart et al., J. Het. Chem., 1966, 3, 485). Положение 5 аллилируют аллилбромидом в условиях переноса фаз с последующим гидролизом изопропилиденовой группы серной кислотой в метаноле, получая производное 8, которое подвергают бензилированию бензилхлоридом и гидридом натрия в диметилформамиде. Метильную группу гидролизуют смесью уксусной кислоты и соляной кислоты с последующим восстановлением боргидридом натрия. Производное 5-O-аллил-2,3-ди-О-бензил-D-рибита 11 абсорбируют силикагелем и селективно экстрагируют путем перколяции сначала циклогексаном, а затем хлороформом. Указанный способ позволяет очистку в больших масштабах без использования общепринятых хроматографических способов. Далее производное 11 тритилируют в пиридине, бензилируют бензилхлоридом и гидридом натрия в диметилформамиде и, наконец, гидролизуют уксусной кислотой, получая конечное производное рибита,которое очищают перегонкой. Производное рибита 14 рибозилируют перацетатом рибофуранозы 15, как показано на следующей схеме. Дальнейшее дезацетилирование и последующее новое приложение адсорбционно-десорбционных способов позволяет получать триол 4 в больших масштабах без использования общепринятых хроматографических стадий. Затем в рамках настоящего изобретения, применительно к триолу 4, используют открытую реакцию дибензилирования. Указанное взаимодействие позволяет получать производное 5 после способа очистки с применением хроматографии на колонке. Аллильную группу промежуточного соединения 5 изомеризуют до пропенила с последующим введением фосфоната в свободное положение 3 звена рибозы. Удаление пропенильной группы дает ключевое промежуточное производное 19. Подобным образом, ацетилирование гидрокси-функциональности в положении 3 производного 17 с последующим гидролизом пропенила, введение фосфоната в положение 5 и дезацетилирование продукта дают ключевой дисахарид 23, содержащий фосфонат в положении 5 и свободную гидроксильную функциональную группу в положении 3. 005381 Структуру полученных продуктов подтверждают во всех случаях ядерным магнитным резонансомH и 13 С и путем экспериментов по Н-Н и Н-Х корреляции. Чистоту контролируют тонкослойной хроматографией или ВЭЖХ. 1 Исходя из производных 18 или 22, могут быть получены производные 24 и 25, используемые также как акцепторы в реакции поликонденсации, как будет показано ниже. Реакция олигомеризации изучена в различных условиях, всегда на основе только трех компонентов,ключевого дисахарида (19 или его аналога 23), промотора реакции, которым может быть пивалоилхлорид, адамантан-1-карбонилхлорид или другой стерически затрудненный хлорангидрид, и третьего компонента, который гасит реакцию и одновременно вводит спейсер. Указанный компонент содержит функциональную активную группу или ее предшественника в концевой позиции, как, например, 24, 25 или 26. В качестве спейсера, которым в случае 24, 25 или 26 является 5-азидо-3-оксапентанол, могут быть использованы любые другие соединения с общей формулой R1-Y-OH, где Y означает цепь спейсера, которая может быть алифатической цепью. Алифатическая цепь может включать введенную в нее ароматическую цепь или ряд гетероатомов, число которых колеблется между 0-5. R1 означает функциональную группу в концевой позиции спейсера и может являться NH2, COOR, CHO, SH или любым из их предшественников. Оптимальные условия способа поликонденсации, разработанные для ряда случаев, например для дисахарида 19, спейсера 5-азидо-3-оксапентанола 26 и пивалоилхлорида в дихлорметане-пиридине, позволяют получать продукт. Фракция, содержащая олигомеры 27, может быть получена с выходом 7085% по отношению к дисахариду после окисления и LH-20-гель-хроматографии на LH-20 в метаноле. Смесь олигосахаридов 27 гидрируют в смеси метанол-этилацетат-вода-уксусная кислота в присутствии палладия на угле, получая сырую смесь олигосахаридов 28. Если спейсерную группу требуется активировать, способ лучше осуществлять в несколько стадий. Например, к смеси олигомеров 28 добавляют N-гидроксисукцинимидиловый эфир -малеимидопропионовой кислоты в диметилформамиде. После окончания взаимодействия полученный раствор разбавляют дистиллированной водой и подвергают диализной фильтрации под давлением азота через мембрану с диафрагмой 1000. Полученный таким образом продукт 30 является смесью активированных олигосахаридов, готовой к применению в способе конъюгации. Структуру полученных продуктов подтверждают во всех случаях ядерным магнитным резонансомH и 13 С и путем экспериментов по Н-Н и Н-Х корреляции. Производные белков получают с помощью тиопропионовой кислоты путем введения тиола, маскированного под бисульфид. Для указанной дериватизации могут быть использованы такие реагенты, как 1SPDP или DSP с последующим взаимодействием с дитиотреитолом в атмосфере азота. Избыточные реагенты могут быть устранены для Neisseria meningitidis OMP или столбнячного анатоксина путем осаждения водным этанолом (20-95%) с последующим центрифугированием. Для Neisseria meningitidis OMP выполняемый способ иллюстрируется следующей схемой. Тиолированный белок смешивают в инертной атмосфере с активным олигосахаридом, предварительно пропущенным через фильтр 0,2 мкм и лиофилизованным. Реакцию гасят осаждением этанолом с последующим центрифугированием или диафильтрацией. Либо иначе, избыток активирующих реагентов может быть удален из конъюгата диафильтрацией. Оба способа разделения устраняют почти весь неконъюгированный олигосахарид из белка, обеспечивая очень стабильное качество конечного продукта. Смесь олигосахаридов 30 может быть конъюгирована с другим носителем, например липидами. Так, например, взаимодействие с 2,3-диоктадецилоксипропилсукцинимидилбутандиоатом 33 в присутствии карбодиимида позволяет получать конъюгат 34. Конъюгат синтетической олигосахаридной смеси и белков может быть разбавлен или реструктурирован в подходящем физиологическом буфере и может быть смешан с добавками или адъювантами, консервантами и другими веществами с целью получения конечного состава вакцины. Подобным образом вакцина может быть смешана до или во время процесса формулирования с другими вакцинами из числа используемых в настоящее время вакцин для плановой иммунизации детей в возрасте до 1 года. Например, смешиванием с белками наружной мембраны из Neisseria meningitidis типа В (ОМР) может быть получена комбинированная вакцина против Hib и против менингита типа В. После смешивания с DTP может быть получена комбинированная тетравалентная вакцина против Hib и против дифтерии, коклюша и столбняка. Иммуногенность конъюгированной вакцины между олигосахаридами 30 и менингококковыми белками наружной мембраны продемонстрирована с использование некоторых моделей на животных. Наличие антител к Hib-капсульному полисахариду, индуцируемых вакциной, определяют, используя ELISAметод (D.C. Phipps et al., J. Immunolog. Methods, 1990, 135, 121-8). Результаты приведены на фиг. 2-5. У кроликов вакцина, приготовленная без оксида алюминия, вызывает более сильный ответ на начальные дозы, однако, оба препарата становятся равноценными после повторных доз. В обоих случаях наблюдается высокий титр антител. На примере Sprague-Dawley крыс вакцина, полученная из двух конъюгатов, отличающихся по соотношению углевод-белок, также индуцирует высокие титры антител к Hib. У BaIb C мышей вакцина, полученная из подобного конъюгата, вызывает высокие титры антител к капсульным полисахаридам. Смесь олигосахаридов 30 может быть соединена с такими матрицами, как, например, полиакриламид. Продукт может быть использован для определения антител к Hib у иммунизированных людей или лабораторных животных. Смесь может быть связана с латексом и использоваться для определения антител у больных или вакцинированных людей. Полиакриламид, активированный по N. Bovin (Glycoconjugate J., 1998, 15, 431-446), взаимодействует со смесью олигосахаридов 30. Сравнительная активностьHbO-HSA, рекомендованного вещества для определения антител к Hib и полиакриламидного конъюгата смеси олигосахаридов 30 приведенa на фиг. 6. Лучшее соотношение ответ-шум достигается с продуктом,содержащим синтетические олигосахариды. 8 005381 Практические примеры Пример 1. Синтез 5-O-аллил-2,3-ди-О-бензил-D-рибита 11. Аллилирование. 100 г метил-2,3-О-изопропилиден-D-рибо-фуранозида растворяют в 70 мл аллилбромида и перемешивают в присутствии 75 мл 50% водного гидроксида натрия и 2,6 г йодида тетрабутиламмония в течение 12 ч. По прошествии указанного времени перемешивание останавливают и разделяют фазы. Водную фазу экстрагируют дихлорметаном (70 мл) и объединенную органическую фазу сушат и упаривают. Гидролиз. Полученный сироп растворяют в 1,5 л метанола. К указанному раствору добавляют 3,6 мл водной серной кислоты (0,4 н) и смесь нагревают до температуры кипения с обратным холодильником 3 ч. После окончания реакции реакционную смесь нейтрализуют бикарбонатом натрия, образующиеся соли фильтруют и раствор упаривают. Остаток экстрагируют этилацетатом, сушат и упаривают. Продукт сушат в вакууме по меньшей мере 2 ч. Бензилирование. Полученный продукт растворяют в 450 мл диметилформамида. Образовавшийся раствор охлаждают до 0 С и медленно добавляют 50 г гидрида натрия. Смесь перемешивают 30 мин и затем добавляют по каплям бензилхлорид (150 мл). После 2 ч перемешивания к реакционной смеси добавляют по каплям 20 мл метанола. Образующуюся суспензию упаривают в вакууме, повторно растворяют в дихлорметане и промывают водой. Органическую фазу сушат сульфатом натрия и упаривают. Гидролиз. Полученный по предыдущей реакции сироп растворяют в 1,5 л диоксана. Добавляют НСl (2 н, 1,5 л) и систему нагревают до 75-80 С. Через 2 ч реакцию прерывают и фазы разделяют. Водную фазу дважды экстрагируют 200 мл дихлорметана и объединенные органические фазы упаривают. Концентрированный продукт растворяют в дихлорметане (1 л) и промывают последовательно водой (400 мл), насыщенным раствором бикарбоната натрия (300 мл) и водой (400 мл) и, наконец, сушат сульфатом натрия и упаривают. Восстановление. Полученный сироп растворяют в этаноле (800 мл) и систему охлаждают до 20 С. Затем добавляют 24 г NaBH4. Смесь перемешивают 1,5 ч при комнатной температуре и затем реакцию обрывают, избыток боргидрида разлагают добавлением уксусной кислоты до рН 7-8. Раствор фильтруют и упаривают. Остаток растворяют в 500 мл дихлорметана, органический раствор промывают водой, сушат сульфатом натрия и используют в следующем примере. Пример 2. Очистка 5-O-аллил-2,3-ди-O-бензил-D-рибита 11. К дихлорметановому раствору сырого 5-O-аллил-2,3-ди-O-бензил-D-рибита 11 из предшествующего примера добавляют 300 г силикагеля и смесь перемешивают вручную, пока не произойдет адсорбция продукта твердой фазой. Суспензию упаривают в вакууме для удаления дихлорметана. Силикагель, содержащий продукт, помещают в перколятор. Примеси удаляют экстракцией циклогексаном в течение 48 ч. Заменяют растворитель для экстракции на дихлорметан для экстракции продукта, получая хроматографически чистый светло-желтый сироп. Выход 75-95%. 13 С-ЯМР 60,7 (С-1), 70,2 (С-4), 71,0, 71,7, 72,0, 73,6 (PhCH2C-5, ОСН 2 СН=), 79,2, 79,3 (С-2,3),117,1 (СН 2=), 127,5-128,2 (Ph), 134,3 (СН=), 138,0, 138,1 (Cipso). Пример 3. Синтез 5-O-аллил-2,3,4-три-O-бензил-D-рибита 14. Тритилирование. 100 г 5-O-аллил-2,3-ди-О-бензил-D-рибита 11 из предшествующего примера сушат в вакууме и растворяют в 600 мл пиридина. К указанному раствору добавляют 75 г хлортрифенилметана и 0,5 г диметиламинопиридина и смесь перемешивают при 50 С в течение 6 ч. Сразу по окончанию реакции растворитель упаривают и остаток растворяют в 500 мл дихлорметана, раствор промывают водой (1 л), сушат и упаривают. Остаток сушат в вакууме 3 ч. Бензилирование. Сироп из предшествующей реакции растворяют в 300 мл диметилформамида и раствор охлаждают до 5 С. Медленно добавляют гидрид натрия (25 г) и затем перемешивание продолжают в течение 30 мин. Потом медленно добавляют бензилхлорид (40 мл) и перемешивание продолжают еще 1 ч. После окончания взаимодействия реакционную смесь охлаждают снова и медленно добавляют 10 мл метанола для разложения избытка реагентов. Растворители упаривают и остаток растворяют в 500 мл дихлорметана,промывают 1 л воды. Органическую фазу сушат сульфатом натрия и упаривают. Гидролиз. Остаток растворяют в уксусной кислоте (1 л) и 110 мл воды и реакционную смесь перемешивают при 80 С в течение 1,5 ч. Растворитель удаляют упариванием и остаток растворяют в 500 мл циклогексана. Органическую фазу охлаждают до 0-5 С в течение 4 ч и затем фильтруют, промывают водой, сушат сульфатом натрия и упаривают. Чистый продукт получают перегонкой при 200-220 С и давлении 0,1 мм. Выход 80-90 г в расчете на 100 г рибозы. 9 С-ЯМР 61,2 (С-1), 69,6, 71,8, 72,1, 72,3, 73,9 (PhCH2C-5, ОСН 2 СН=), 78,0, 78,8, 78,9 (С-2,3,4),116,8(СН 2=), 127,5-128,2 (Ph), 134,7 (CH=), 138,0, 138,1, 138,2 (Cipso). Пример 4. Синтез 5-O-аллил-2,3,4-три-O-бензил-1-O-(-D-рибофуранозил)-D-рибита 4. Гликозилирование. Продукт из предшествующего примера (370 г) растворяют в 2,7 л сухого дихлорэтана и переносят в реактор. Раствор охлаждают до 0-25 С, добавляют порошкообразные молекулярные сита 4 (207 г) и спустя 15 мин медленно добавляют эфират трифторида бора (407 мл) со скоростью 15 мл/мин. Наконец,перацетат D-рибофуранозы 15 (370 г), растворенный в сухом дихлорэтане (1 л), медленно добавляют в течение 20 мин. Реакционную смесь перемешивают 3 ч и исследуют путем ТСХ, гексан/этилацетат (2/1). Пластины проявляют обработкой 5% H2SO4 (конц.) в этаноле. Сразу после окончания взаимодействия реакционную смесь нейтрализуют триэтиламином (222 мл) до рН 7 и затем добавляют насыщенный раствор бикарбоната натрия (800 мл) и перемешивание продолжают в течение 30 мин. рН реакционной смеси следует поддерживать нейтральной. Содержимое реактора фильтруют в вакууме. Твердый продукт дважды промывают дихлорэтаном (200 мл) для экстракции любого остаточного продукта из твердого вещества. Твердую фазу отбрасывают, а органическую фазу дважды экстрагируют водой 600 мл, сушат сульфатом натрия и упаривают в вакууме. Дезацетилирование. К полученному в предшествующей реакции сиропу, растворенному в метаноле (2 л), добавляют раствор метилата натрия (1%) в метаноле до достижения рН 9. Реакцию продолжают почти 2 ч. Сразу после окончания взаимодействия реакционную смесь нейтрализуют кислой смолой до достижения рН 67. Смолу удаляют фильтрованием в вакууме. Сироп (427 г) содержит требуемый продукт вместе с 5-Оаллил-2,3,4-три-О-бензил-D-рибитом, D-рибозой и другими неопределенными примесями. Пример 5. Очистка 5-О-аллил-2,3,4-три-О-бензил-1-О-(-D-рибофуранозил)-D-рибита 4. Сироп из предшествующего примера растворяют в дихлорметане (1 л). К раствору добавляют силикагель (1 кг) и смесь перемешивают вручную, пока не произойдет адсорбция продукта твердой фазой. Суспензию упаривают в вакууме для удаления дихлорметана. Полученный твердый продукт сушат в вакууме в течение 2 ч для удаления следов дихлорметана. Силикагель, содержащий продукт, помещают в перколятор. Примеси удаляют экстракцией циклогексаном в течение 48 ч. Заменяют растворитель для экстракции на хлороформ для экстракции продукта,получая светло-желтый сироп. Выход 238 г. 1H-ЯМР 5,85 (м, 1 Н, СН=), 5,20 (м, 2 Н, CH2=), 4,85 (с, 1 Н, Н-1'). 13 С-ЯМР 62,8 (С-5'), 77,7, 77,9, 78,2 (С-2,3,4), 84,0 (С-4'), 107,2 (С-1'). Пример 6. Синтез 5-О-аллил-2,3,4-три-О-бензил-1-О-(-D-2',5'-ди-О-бензилрибофуранозил)-Dрибита 5. Бензилирование. Соединения (200 г), полученные по предшествующему примеру, растворяют в толуоле (2 л). К указанному раствору добавляют Bu2SnO (80 г) и смесь нагревают до температуры кипения с обратным холодильником в течение 4 ч. NaH 50% (56 г) добавляют небольшими порциями при комнатной температуре и смесь перемешивают при 80 С в течение 30 мин. Добавляют йодид тетрабутиламмония (62 г) и смесь перемешивают еще 1 ч. Затем добавляют бензилхлорид (148 мл) и реакционную смесь продолжают перемешивать при 80 С еще несколько часов. Подобные добавления бензилхлорида повторяют с интервалом 30 мин, пока ТСХ (гексан/этилацетат - 2/1) не подтвердит, что основной продукт состоит из дибензилированного дисахарида. Реакционную смесь охлаждают и нейтрализуют метанольным раствором 1% НСl. Затем реакционную смесь фильтруют через целит и упаривают при пониженном давлении. Полученный продукт, содержащий некоторое количество солей, растворяют в этилацетате, фильтруют при пониженном давлении и концентрируют. Сырой сироп очищают хроматографией на колонке в системе растворителей толуол-ацетон 60/1. Очищенный продукт 5 получают в виде сиропа (100 г). 1H-ЯМР 5,96 (м, 1 Н, -СН=), 5,18 (м, 2 Н, СН 2=), 5,02 (с, 1 Н, Н-1). Пример 7. Синтез 2,3,4-три-О-бензил-1-О-(-D-2',5'-ди-О-бензил-3'-О-триэтиламмонийфосфонатрибофуранозил)-D-рибита 19. Изомеризация аллильной группы. 20 г полученного по предшествующему примеру сиропа сушат в вакууме в течение 2 ч. Сироп растворяют в сухом диметилсульфоксиде (100 мл) и добавляют трет-бутилат натрия (6,4 г). Реакционную смесь перемешивают при 100 С в течение 1 ч и затем добавляют к 250 мл смеси лед-вода. Добавляют по каплям концентрированную соляную кислоту до достижения рН 7. Смесь экстрагируют 3 раза 80 мл простого диэтилового эфира. Органические фазы объединяют, сушат сульфатом натрия и упаривают. Фосфонилирование. Раствор имидазола (1,5 г) в сухом ацетонитриле (34 мл) охлаждают до 0 С. Добавляют трихлорид фосфора (0,56 мл) и триэтиламин (3,1 мл). Полученный раствор перемешивают 15 мин. К указанной смеси добавляют дисахарид из предшествующей реакции, растворенный в сухом ацетонитриле (3 мл). Образующуюся смесь перемешивают 15 мин при комнатной температуре и реакцию обрывают добавлением 10 005381 1 М раствора триэтиламмонийбромида. Перемешивание продолжают 10 мин, добавляют дихлорметан и разделяют фазы. Органическую фазу промывают охлажденным раствором триэтиламмонийбикарбоната,сушат и упаривают. Гидролиз пропенильной группы. Продукт растворяют в уксусной кислоте 60% и перемешивают при 70 С 30 мин. Растворитель удаляют упариванием и продукт растворяют в дихлорметане, промывают бикарбонатом триэтиламмония,сушат и упаривают. Колоночная хроматография полученного продукта дает чистое соединение с выходом в пределах 70-85%. 1H-ЯМР 6,85 (д, Н-Р), 4,95 (с, Н-1), 4,60 (м, Н-3), 2,93 (кв, NСН 2 СН 3), 1,20 (т, NСН 2 СН 3). 13 С-ЯМР 105,9 (С-1). Пример 8. Реакция поликонденсации между 19 и 26 (соотношение 10-1). К раствору соединения 19 (1 г) в смеси пиридин-триэтиламин (10-1, 1 мл) добавляют триметилацетилхлорид (0,14 мл) и реакционную смесь перемешивают в течение 20 мин. Добавляют спейсер 26 (29,2 мг) и новое количество триметилацетилхлорида (0,9 мл) и реакционную смесь перемешивают в течение 1 ч. Добавляют раствор I2 (1,1 г) в смеси пиридин-вода (7,3 мл; 20-1) и реакционную смесь перемешивают в течение 30 мин. Смесь разбавляют дихлорметаном, промывают раствором тиосульфата натрия (1 М) и охлажденным раствором триэтиламмонийбромида (0,5 М), затем сушат сульфатом натрия и упаривают. Полученный продукт растворяют в метаноле и хроматографируют на колонке с Sephadex LH-20 с тем же растворителем. Фракции, содержащие олигомеры, объединяют и упаривают. Выход 80%. Пример 9. Реакция поликонденсации между 19 и 26 (соотношение 10-1). К раствору соединения 19 (1 г) и спейсера 26 (14,6 мг) в смеси пиридин-триэтиламин (10-1, 1 мл) добавляют триметилацетилхлорид (0,23 мл) и реакционную смесь перемешивают в течение 2 ч. Добавляют раствор I2 (1,1 г) в смеси пиридин-вода (7,3 мл; 20-1) и продукт обрабатывают способом, подобным указанному в примере 8. Пример 10. Реакция поликонденсации между 19 и 26 (соотношение 5-1). К раствору соединения 19 (1 г) и спейсера 24 (29,2 мг) в смеси пиридин-триэтиламин (10-1, 1 мл) добавляют триметил-ацетилхлорид (0,23 мл) и реакционную смесь перемешивают в течение 2 ч. Добавляют раствор I2 (1,1 г) в смеси пиридин-вода (7,3 мл; 20-1) и продукт обрабатывают способом, подобным указанному в примере 8. Пример 11. Реакция поликонденсации между 23 и 26 (соотношение 5-1, растворитель пиридин). К раствору соединения 23 (1 г) и спейсера 26 (29,2 мг) в пиридине (1 мл) добавляют триметилацетилхлорид (0,23 мл) и реакционную смесь перемешивают в течение 2 ч. Добавляют раствор I2 (1,1 г) в смеси пиридин-вода (7,3 мл; 20-1) и продукт обрабатывают способом, подобным указанному в примере 8. Пример 12. Реакция поликонденсации между 19 и 24 (соотношение 5-1, растворитель пиридин). К раствору соединения 19 (1 г) и спейсера 24 (29,2 мг) в пиридине (1 мл) добавляют триметилацетилхлорид (0,23 мл) и реакционную смесь перемешивают в течение 2 ч. Добавляют раствор I2 (1,1 г) в смеси пиридин-вода (7,3 мл; 20-1) и продукт обрабатывают способом, подобным указанному в примере 8. Пример 13. Реакция гидрирования продуктов по примерам 8-12. Сырой продукт по предшествующим примерам 8-12 гидрируют в смеси этилацетат-этанол-водауксусная кислота (1-2-2-0,1) с палладием на угле 10%. Окончательно продукт очищают ионообменной хроматографией на сефадексе С-25 Na. Лиофилизованный продукт, характеризованный ЯМР, показывает наличие основного повторяющегося звена Rib-Rib-фосфат и спейсера. Активные фракции получают после диализной фильтрации и ультрафильтрации, сначала через мембрану с диафрагмой 1000 и ретентат через мембрану с диафрагмой 10000. Раствор, проходящий через мембрану 10000, объединяют и лиофилизуют, получая конечный продукт 28 с общим выходом, зависящим от условий реакции и находящимся в пределах 20-80%, в расчете на покидающий систему дисахарид. 1H-ЯМР 5,12 (Н-1), 4,60 (Н-3), 3,29 (CH2NH2). 31 Р 2,14 (spac-P-Риб), 0,74 (Рибит-Р-Риб). Пример 14. Синтез производного 5-(3-малеимидопропионамидо)-3-оксапентилолиго-рибозилрибит-фосфата 30. К раствору по предшествующему примеру (3,34 мг, 1,73 мкмоль) в бидистиллированной воде (0,1 мл), добавляют 0,7 мг (2,62 мкмоль) N-гидроксисукцинимидилмалеимидопропионата 27, растворенного в N,N-диметилформамиде (0,4 мл). После 4 ч взаимодействия раствор упаривают в вакууме, ресуспендируют в дистиллированной воде (0,5 мл) и центрифугируют (10 мин, 3500 об./мин). Супернатант разбавляют водой и ультрафильтруют на Amicon оборудовании на отсекающей мембране 1000. Ретентат лиофилизуют. Выходы находятся в пределах между 85 и 95%. 1H-ЯМР 6,95 (с, 2 Н, СН=СН), 5,01 (с, Н-1), 3,41 (т, 2 Н, CH2NH), 2,56 (т, 2 Н, СН 2 а). Пример 15. Анализ полученных по примеру 13 продуктов путем ионообменной хроматографии. Продукты по примеру 8-12, гидрированные и в виде натриевых солей, анализируют ионообменной хроматографией на HR5/5 mono Q колонке при линейном градиенте хлорида натрия (Р. Constantino, et al.,Vaccine, 1999, 17, 1251-1263). Профиль хроматографического элюирования продукта по примеру 8 пред 11 005381 ставлен на фиг. 1 В и показывает фрагменты различных размеров. Сравнивая указанные результаты с результатами, приведенными в литературе, и фиг. 1 А, представляющей хроматограмму пентамера, можно сделать вывод, что в смеси представлены фрагменты от 4-5 повторяющихся звеньев до более чем 20. Пример 16. Конъюгирование с белком наружной мембраны Neisseria meningitidis. Комплекс белков наружной мембраны Neisseria meningitidis (OMPC) 400 мг растворяют в 80 мл PBS буфера рН 8, предварительно барботированного N2 (г). Раствор барботируют азотом в течение 5 мин при перемешивании и использовании бани лед-вода. Добавляют 1,6 мл раствора DSP в диметилформамиде и смесь осторожно перемешивают при 4 С в течение 2 ч. Добавляют 1,6 мл раствора DTT в PBS и перемешивание при 4 С продолжают еще 1 ч. Полученную суспензию переносят в центрифужную колбу, содержащую 20-400 мл охлажденного этанола. Колбу центрифугируют при 1800 об./мин и 4 С в течение 30 мин и супернатант отбрасывают. Добавляют новую порцию этанола к твердому веществу и центрифугирование повторяют потом снова, используя 200-400 мл этанола. Осадок ресуспендируют в 80 мл PBS буфера рН=7-9. К полученному раствору добавляют синтетический олигосахарид 30 и перемешивание продолжают 1-48 ч. По окончании взаимодействия операции по осаждению этаноломцентрифугированию повторяют с последующим использованием диализной фильтрации с применением 30000 отсекающей мембраны. Остаток восстанавливают в PBS буфере при концентрации Hib 40-80 мкг на мл. Пример 17. Конъюгирование со столбнячным анатоксином. Раствор столбнячного анатоксина при концентрации 5 мг/мл в PBS рН 8 барботируют N2 (г) в течение 5 мин. Поддерживая перемешивание при охлаждении на бане лед-вода, добавляют 1,6 мл раствораDSP в диметилформамиде и смесь осторожно перемешивают при 4 С в течение 2 ч. Добавляют 1,6 мл раствора DTT в PBS и перемешивание при 4 С продолжают еще 1 ч. Полученный раствор переносят в оборудование для ультрафильтрации с 10000 отсекающей мембраной. Раствор несколько раз подвергают диализной фильтрации, добавляя свежий буфер, предварительно продутый N2 (г), пока раствор, проходящий через мембрану, не даст отрицательной реакции на тест Елмана. К полученному раствору добавляют синтетический олигосахарид 30 и перемешивание продолжают 1-48 ч. По окончанию взаимодействия раствор снова подвергают диализной фильтрации, пока раствор, проходящий через мембрану, не даст отрицательную реакцию на фенол-серный тест на сахара. Наконец, раствор восстанавливают в PBS буфере при концентрации Hib 40-80 мкг на мл. Пример 18. Конъюгирование с диоктадецилглицеролгемисукцинатом. Продукт по примеру 8 (10 мг) растворяют в 1 мл диметилформамида и добавляют к раствору диоктадецилглицеролгемисукцината в качестве сложного эфира N-гидроксисукцинимида 31. К раствору добавляют этилдиаминопропилкарбодиимид (5 мг) и реакционную смесь перемешивают 6 ч. Добавляют новую порцию карбодиимида и перемешивание продолжают 6 ч. Растворитель упаривают и смесь переносят на колонку С 18-силикагель (1 г). Элюирование водой удаляет олигосахарид. Продукт элюируют при градиентной концентрации смеси метанол-вода. Выход 85%. 1H-ЯМР 5,12 (Н-1), 4,60 (Н-3), 3,40 (СН 2NН), 1,30 (СН 2), 0,90 (СН 3). Пример 19. Получение вакцины без адъюванта. Иммуноген по примеру 16, растворенный в фосфатном буфере при концентрации 40 мкг на мл, разбавляют в асептических условиях при 4-8 С бидистиллированной водой. Суспензию перемешивают в течение 10 мин. Конечную концентрацию Hib антигена определяют, оценивая содержание рибозы и общего белка, и можно осуществлять доведение концентрации до требуемой величины добавлением большего количества буферного раствора, пока конечная концентрация Hib антигена не станет 20 мг на мл. Тиомерсал добавляют до конечной концентрации 0,1-0,001%. Полученная суспензия представляет собой конечную массу анти-Hib конъюгированной вакцины без адъюванта. Пример 20. Получение анти-Hib вакцины в оксиде алюминия в качестве адъюванта. Иммуноген по примеру 16, растворенный в фосфатном буфере при концентрации 40 мкг на мл, перемешивают в антисептических условиях с равным объемом оксида алюминия 1-0,01 мг на мл в дистиллированной воде. Перемешивание продолжают в течение 20 мин при 4-8 С. Конечную концентрациюHib определяют, оценивая содержание рибозы и общего белка, и можно осуществлять доведение концентрации до требуемой величины добавлением большего количества буферного раствора, пока конечная концентрация Hib антигена не станет 20 мг на мл. Тиомерсал добавляют до конечной концентрации 0,10,001%. Полученная суспензия представляет собой конечную массу анти-Hib конъюгированной вакцины в оксиде алюминия. Пример 21. Получение комбинированной анти-Hib и антименингококковой В вакцины. Иммуноген по примеру 16, растворенный в фосфатном буфере при концентрации 80 мкг на мл, перемешивают в антисептических условиях при 4-6 С с основной массой раствора комплекса белков наружной мембраны (OMPC) Neisseria meningitidis типа В, используемого в настоящее время в VAMEMGOC ВС, при концентрации в PBS 100-200 мг на мл. После 20 мин гомогенизации путем слабого перемешивания магнитной мешалкой содержимое реакционной смеси перемешивают с равным объемом оксида алюминия 1-0,01 мг на мл в дистиллированной воде. Перемешивание продолжают в течение 20 мин при 4-6 С. Конечную концентрацию Hib антигена определяют, оценивая содержание рибозы и общего 12 005381 белка, и можно осуществлять доведение концентрации до требуемой величины добавлением большего количества буферного раствора, пока конечная концентрация Hib антигена не станет 20 мг на мл. Тиомерсал добавляют до конечной концентрации 0,1-0,001%. Полученная суспензия представляет собой конечную массу комбинированной анти-Hib и антименингококковой В (вакцины) в оксиде алюминия. Пример 22. Получение комбинированной анти-Hib и анти-DTP вакцины. Иммуноген по примеру 16, растворенный в фосфатном буфере при концентрации 80 мкг на мл, перемешивают в антисептических условиях при 4-6 С с основной массой раствора DTP при 4 х концентрациях. После 20 мин гомогенизации путем слабого перемешивания магнитной мешалкой содержимое реакционной смеси перемешивают с равным объемом оксида алюминия 1-0,01 мг на мл в бидистиллированной воде. Перемешивание продолжают в течение 20 мин при 4-6 С. Конечную концентрацию Hib определяют, оценивая содержание рибозы и общее содержание белка по Лоури, и можно осуществлять доведение концентрации до требуемой величины добавлением большего количества буферного раствора,пока конечная концентрация Hib антигена не станет 20 мг на мл. Тиомерсал добавляют до конечной концентрации 0,1-0,001%. Полученная суспензия представляет собой конечную массу комбинированной анти-Hib и анти-DTP (вакцины) в оксиде алюминия. Пример 23. Иммунологические испытания вакцин, полученных из синтетической смеси олигосахаридов и ОМР. Вакциной по примеру 19 и 20 иммунизируют (животных) при дозе антигенов 1 и 2 мкг. Используемыми в указанных экспериментах животными служат кролики, крысы и мыши. Выполняют 2 иммунизации с 4-недельным интервалом при заборе крови на 0, 28 и 42 дни. Кровь забирают и центрифугируют при 3500 об./мин в течение 20 мин. Сыворотку десятикратно разбавляют и хранят при -40 С. Реакцию на антитела измеряют путем прямого ELISA, используя Hib-HSA в качестве покрывающего антигена. Результаты приведены на фиг. 2-5. Пример 24. Конъюгат между смесью синтетических олигосахаридов и п-нитрофенилакрилатом. Смесь олигосахаридов по примеру 13 (10 мг) растворяют в диметилформамиде и добавляют к раствору нитрофенилакрилата (10-30 мг) в диметилформамиде (1 мл). Добавляют 0,1-0,5 мл триэтиламина и взаимодействие поддерживают путем перемешивания в течение 16 ч. Добавляют аммиак 0,1-0,5 мл и перемешивание продолжают в течение 24 ч. Раствор переносят на колонку с сефадексом LH-20 в ацетонитриле. Элюирование осуществляют смесью ацетонитрил-вода. Фракции, дающие положительную реакцию в орсинол-тесте на рибозу, объединяют и лиофилизуют. Выход составляет обычно выше 80%. Пример 25. Способность конъюгата из синтетических олигосахаридов обнаруживать анти-Hib антитела. Раствор продукта по предшествующему синтезу в карбонат-бикарбонатном буфере наносят при концентрации 1-100 мкг на мл на половину 96-луночного планшета. На другую половину планшета наносят антиген HbO-HSA при рекомендованной концентрации. Испытание ELISA проводят, используя сыворотку мышей, иммунизированных вакциной, содержащей природный капсульный полисахарид, соединенный со столбнячным анатоксином. Результаты приведены на фиг. 6. Краткое описание чертежей Фиг. 1. Типичная хроматограмма олигомерных фракций, полученных по примеру 15 путем ионообменной хроматографии на Mono Q HR 5/5 при линейном градиенте NaCl 0-500 мМ, где А - пентамер; В олигомер по примеру 10. Фиг. 2. Реакция на антитела у кроликов, вакцинированных вакциной по примеру 16. Фиг. 3. Реакция на антитела у кроликов, вакцинированных вакциной по примеру 15. Фиг. 4. Реакция на антитела у крыс, вакцинированных вакциной по примеру 15. Фиг. 5. Реакция на антитела у BaIb С мышей, вакцинированных вакциной по примеру 15. Фиг. 6. Способность конъюгата 26-РАА к определению антител к Hib. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Смесь олигосахаридов, содержащая повторяющиеся звенья формулы (фосфат-рибоза-рибит)n или(рибоза-рибит-фосфат)n, где указанная смесь получена синтетическим способом и содержит, по меньшей мере, 5 соединений формулы А или В, причем значения n составляют от 4 до 25, и где R1 или R2 означает Н или спейсер для конъюгации с носителем, при условии, что R1=спейсер, если R2=H, или R2=спейсер,если R1=H. 005381 2. Смесь олигосахаридов по п.1, где указанные соединения формулы (фосфат-рибоза-рибит)n или(рибоза-рибит-фосфат)n формулы А или В отличаются друг от друга только значением n, причем значения n составляют от 4 до 25. 3. Смесь олигосахаридов по п.1, где спейсер означает любую алифатическую углеводородную цепь,содержащую гетероатомы, число которых колеблется от 0 до 5, и/или ароматическую цепь, всегда имеющую на другом конце спейсера функциональную группу NН 2, СООН, СНО, SH или их предшественников, способных к образованию химической связи с молекулой, выполняющей роль носителя. 4. Способ синтеза смеси олигосахаридов по пп.1-3, содержащих повторяющиеся звенья формулы(фосфат-рибоза-рибит)n или (рибоза-рибит-фосфат)n, где в одну стадию проводят реакцию поликонденсации, используя дисахаридное производное 2,3,4-три-О-бензил-1-O-(-D-2',5'-ди-О-бензил-3'-Oтриэтиламмонийфосфонатрибофуранозил)-D-рибитол (19) или его аналоги, содержащие фосфонат в положении 5 и свободную гидроксильную группу в положении 3 (23), в присутствии промотора, который представляет собой активное производное стерически затрудненной кислоты, в основном растворителе и со спейсером, который участвует в реакции в качестве акцептора, обрывающего рост олигомерной цепи. 5. Способ по п.4, где промежуточный дисахарид 19 или 23 и промотор находятся в мольном соотношении 1/1-3. 6. Способ по п.4 или 5, где промотор является активным производным стерически затрудненной кислоты. 7. Способ по любому из пп.4-6, где промотор предпочтительно представляет собой пивалоилхлорид, адамантантоилхлорид, дифенилхлорфосфат или 2,4,6-триизопропилбензолсульфонилхлорид. 8. Способ по п.4, где промежуточный дисахарид 19 или 23 и спейсер находятся в мольном соотношении 5-10/1. 9. Способ по любому из пп.4-8, где дисахаридом является 19, спейсером является 23, промотором является пивалоилхлорид, а растворителем является пиридин. 10. Способ синтеза смеси олигосахаридов по любому из пп.1-3, где соединения, полученные в соответствии со способом по любому из пп.4-9, дополнительно подвергают окислению фосфоната до фосфата с последующим гидрированием для удаления бензильных защитных групп, снятию защиты или активации спейсера и удалению фракций из менее чем 4 и более 25 повторяющихся звеньев путем одного или нескольких молекулярных рассевов. 11. Иммуноген, содержащий смесь олигосахаридов по любому из пп.1-3, где указанная смесь олигосахаридов связана с молекулой носителя, выбранной из группы, состоящей из белков, пептидов или липидов. 12. Вакцина для профилактики инфекционных заболеваний, вызываемых Haemophilus influenzae типа b, содержащая иммуноген по п.11, приготовленная с адъювантом или с другими добавками или без них. 13. Вакцина по п.12, используемая в сочетании с другими вакцинами, такими как вакцины против гепатита В, против менингококка А, В и/или С, DPT, против вируса полиомиелита, против пневмококка 1, 5, 6 В, 6 А, 14, 19F, 19a и/или 23F, или в сочетании с соответствующими им иммуногенами. 14. Способ синтеза промежуточного дисахарида 2,3,4-три-О-бензил-5-О-аллил-(-D-рибофуранозил)-D-рибита 4 в чистой форме путем рибозилирования 2,3,4-три-O-бензил-5-O-аллил-D-рибита 14 перацетатом рибофуранозы с последующим дезацетилированием с получением соединения 4, которое подвергают абсорбции-десорбции на силикагеле с целью очистки. 15. Дисахарид 5-O-пропенил-2,3,4-три-O-бензил-1-O-(2',5'-ди-О-бензилD-рибофуранозил)-Dрибита 17 в качестве промежуточного соединения в синтезе производных 19 и 23. 16. Способ синтеза промежуточного дисахарида 17, предусматривающий процедуру дибензилирования дисахарида 4 оксидом дибутилолова, йодидом тетрабутиламмония, гидридом натрия и бензилхлоридом в соотношении 1:0,5-2:0,001-1:0,5-10:1-5 в растворителе, таком как толуол, бензол, тетрагидрофуран или ксилол, с получением соединения формулы 5-О-аллил-2,3,4-три-O-бензил-1-O-(-D-2',5'-ди-Oбензилрибофуранозил)-D-рибитол (5) с последующей изомеризацией аллила до пропенила. 17. Дисахаридное производное 2,3,4-три-O-бензил-1-O-(2',5'-ди-О-бензилD-рибофуранозил)-Dрибит-5-O-триэтиламмонийфосфонат (23) или 2,3,4-три-O-бензил-1-O-(2',5'-ди-О-бензилО-рибофуранозил)-D-рибит-3'-O-триэтиламмонийфосфонат (19) в качестве промежуточных соединений в способе олигомеризации по любому из пп.4-9. 18. Способ получения дисахарида 19, исходя из дисахарида 17, предусматривающий фосфонилирование трихлоридом фосфора-имидазолом с последующим гидролизом пропенильной группы или ацетилирование, гидролиз пропенильной группы и фосфонилирование трихлоридом фосфора-имидазолом с последующим дезацетилированием. 19. Способ получения дисахарида 23, исходя из дисахарида 17, предусматривающий фосфонилирование трихлоридом фосфора-имидазолом с последующим гидролизом пропенильной группы или ацетилирование, гидролиз пропенильной группы и фосфонилирование трихлоридом фосфора-имидазолом с последующим дезацетилированием. 14 005381 20. Применение дисахаридов 19 или 23 для синтеза смесей олигосахаридов по любому из пп.1-3. 21. Макромолекула, содержащая смесь олигосахаридов по любому из пп.1-3, в которых олигосахаридная смесь связана с иммунологически инертным полимерным материалом. 22. Применение макромолекулы по п.21 для обнаружения и количественного анализа антител против капсульного полисахарида Haemophilus influenzae типа b.
МПК / Метки
МПК: C07H 15/04, A61K 39/102
Метки: рибоза-рибит-фосфата, содержащие, олигосахаридные, вакцины, производные
Код ссылки
<a href="https://eas.patents.su/17-5381-oligosaharidnye-proizvodnye-riboza-ribit-fosfata-i-soderzhashhie-ih-vakciny.html" rel="bookmark" title="База патентов Евразийского Союза">Олигосахаридные производные рибоза-рибит-фосфата и содержащие их вакцины</a>
Предыдущий патент: Иммунологический анализ неоникотинильных инсектицидов
Следующий патент: Производные тропана, полезные для терапии
Случайный патент: Соединения актагардина и их применение для лечения или профилактики инфекции clostridium difficile












