Индазоламиды с аналгетической активностью
Номер патента: 9077
Опубликовано: 26.10.2007
Авторы: Ализи Мария Алессандра, Каццолла Никола, Луна Джузеппе, Поленцани Лоренцо, Фурлотти Гвидо, Гульельмотти Анджело
Формула / Реферат
1. Индазоламид формулы (I)
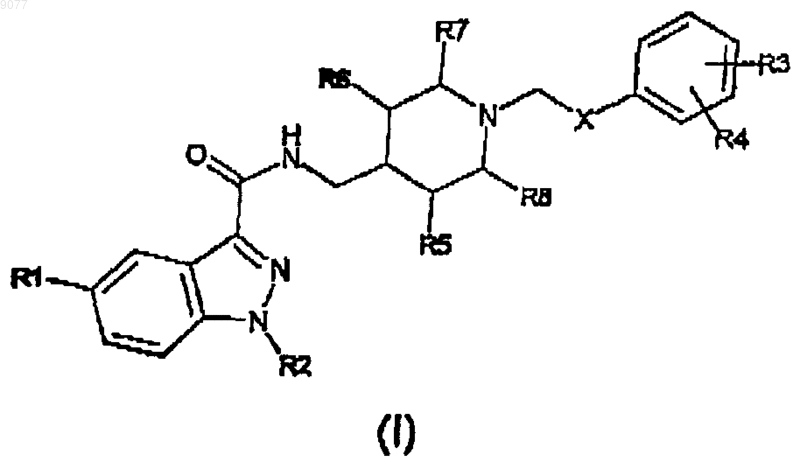
где X представляет собой C(O)NH группу;
R1 представляет собой водород или C1-3алкильную группу с линейной или разветвленной цепью;
R2 представляет собой атом водорода, или C1-6алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или амино, нитро, гидроксил, C1-3алкильную группу с линейной или разветвленной цепью, ди(С1-3)алкиламино или О-(C1-3)алкилфенильную группу;
R5, R6, R7 и R8, которые могут быть одинаковыми или различными, представляют собой Н,
и его кислотно-аддитивные соли с фармацевтически приемлемыми органическими и минеральными кислотами.
2. Индазоламид по п.1, отличающийся тем, что R1 представляет собой Н или метил.
3. Индазоламид по п.1 или 2, отличающийся тем, что R2 представляет собой Н, метил или изопропил.
4. Индазоламид по любому из пп.1-3, отличающийся тем, что R3 представляет собой Н, метил, гидроксил, амино или диметиламино.
5. Индазоламид по любому из пп.1-4, отличающийся тем, что R4 представляет собой Н, метил или гидроксил.
6. Индазоламид по любому из пп.1-5, отличающийся тем, что R5, R6, R7 и R8 представляют собой Н.
7. Индазоламид по любому из пп.1-6, отличающийся тем, что он представляет собой фармацевтически приемлемую кислотно-аддитивную соль кислоты, выбранной из группы, включающей щавелевую кислоту, малеиновую кислоту, янтарную кислоту, лимонную кислоту, винную кислоту, молочную кислоту, метансульфоновую кислоту, паратолуолсульфоновую кислоту, соляную кислоту, фосфорную кислоту и серную кислоту.
8. Индазоламид, выбранный из
N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
гидрохлорида N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1Н-индазол-3-карбоксамида,
тозилата N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-бензил-1Н-индазол-3-карбоксамида,
гидрохлорида N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-бензил-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-((4-((фенилметил)окси)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-((4-гидроксифенил)амино)-2-оксоэтил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
гидрохлорида N3-((1-(2-((4-гидроксифенил)амино)-2-оксоэтил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-((4-нитрофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-((4-аминофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
дигидрохлорида N3-((1-(2-оксо-2-((4-аминофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
5-метил-N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1Н-индазол-3-карбоксамида,
гидрохлорида 5-метил-N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1Н-индазол-3-карбоксамида,
5-метил-N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
гидрохлорида 5-мeтил-N3-((1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-((4-(диметиламино)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
дигидрохлорида N3-((1-(2-оксо-2-((4-(диметиламино)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
N3-((1-(2-оксо-2-((2,6-диметилфенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
щавелево-кислой соли N3-((1-(2-оксо-2-((2,6-диметилфенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1Н-индазол-3-карбоксамида,
и их фармацевтически приемлемых кислотно-аддитивных солей.
9. Способ получения индазоламида формулы (I)
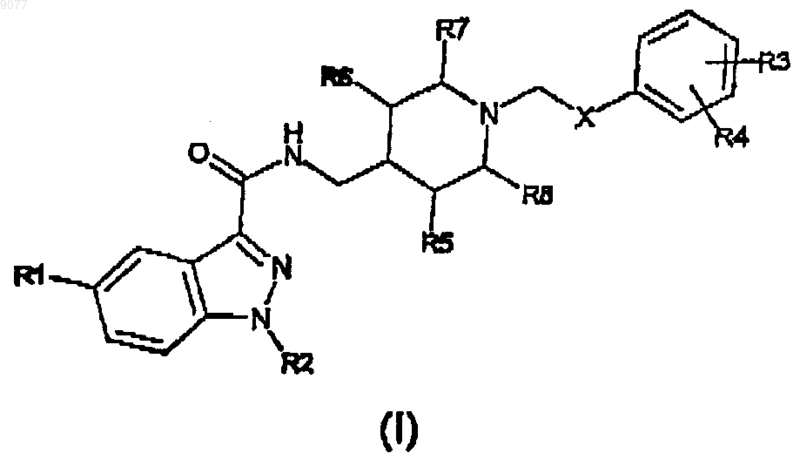
где X представляет собой C(O)NH группу;
R1 представляет собой водород или C1-3алкильную группу с линейной или разветвленной цепью;
R2 представляет собой атом водорода, или C1-6алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или амино, нитро, гидроксил, C1-3алкильную группу с линейной или разветвленной цепью, ди(С1-3)алкиламино или О-(C1-3)алкилфенильную группу;
R5, R6, R7 и R8 представляют собой Н,
и его кислотно-аддитивные соли с фармацевтически приемлемыми органическими и минеральными кислотами,
отличающийся тем, что включает следующие стадии:
а) конденсация амина формулы (II)
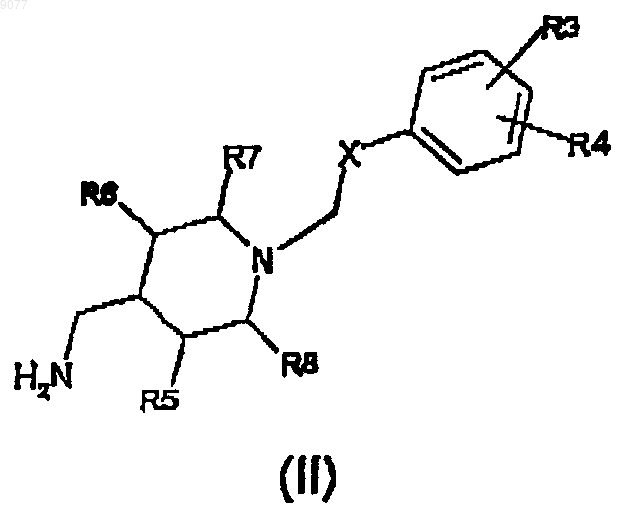
в которой X, R3, R4, R5, R6, R7 и R8 имеют те же значения, как и представлено выше,
с производным индазолкарбоновой кислоты формулы (IIIa)
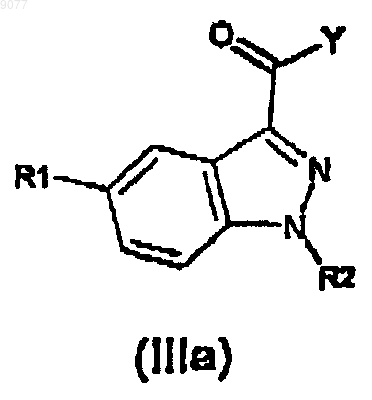
в которой R1 и R2 имеют те же значения, что и представлено выше, и
Y представляет собой атом хлора, или брома, или OR, или OC(O)R группу, в которой R представляет собой (C1-6)алкильную группу с линейной или разветвленной цепью,
или формулы (IIIb)
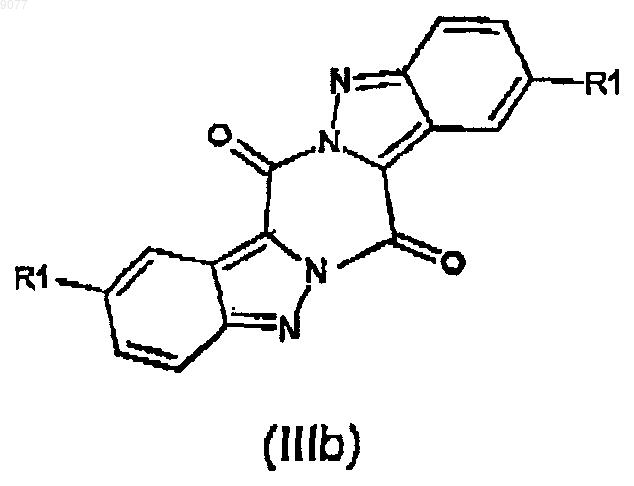
в которой R1 имеет то же значение, что и представлено выше,
с получением индазоламида формулы (I) и
b) необязательно, образование кислотно-аддитивной соли индазоламида формулы (I) с фармацевтически приемлемой органической или минеральной кислотой.
10. Способ по п.9, отличающийся тем, что стадию а) осуществляют путем взаимодействия соединения формулы (II) с соединением формулы (IIIa), в которой Y представляет собой хлор, или с соединением формулы (IIIb) в присутствие подходящего разбавителя при температуре в диапазоне от 0 до 140шС в течение времени в диапазоне от 0,5 до 20 ч.
11. Способ по п.10, отличающийся тем, что температура реакции находится в диапазоне от 15 до 40шС.
12. Способ по п.10, отличающийся тем, что время реакции находится в диапазоне от 1 до 14 ч.
13. Способ по любому из пп.9-12, отличающийся тем, что разбавитель является апротонным.
14. Способ по п.13, отличающийся тем, что разбавитель представляет собой апротонный неполярный разбавитель.
15. Способ по любому из пп.9-14, отличающийся тем, что если Y представляет собой хлор или бром, вышеупомянутую стадию а) проводят в присутствии акцептора органической или минеральной кислоты.
16. Фармацевтическая композиция, включающая эффективное количество соединения формулы (I)
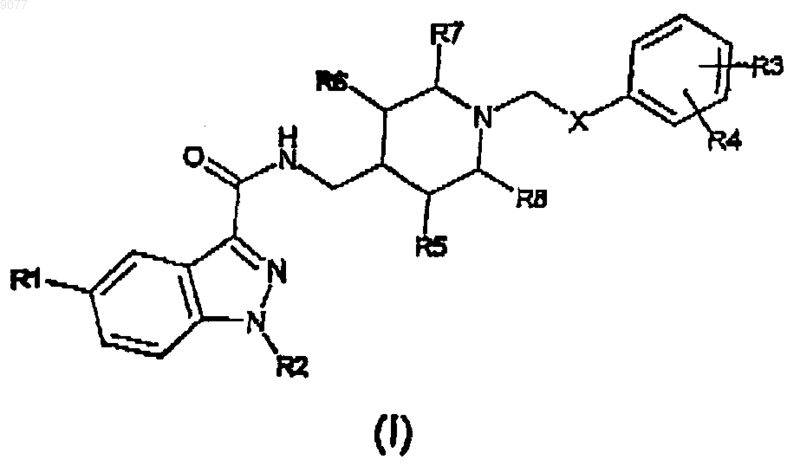
где X представляет собой C(O)NH группу;
R1 представляет собой водород или C1-3алкильную группу с линейной или разветвленной цепью;
R2 представляет собой атом водорода, или C1-6алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород, или атом галогена, или амино, нитро, гидроксил, C1-3алкильную группу с линейной или разветвленной цепью, ди(C1-3)алкиламино или О-(C1-3)алкилфенильную группу;
R5, R6, R7 и R8 представляют собой Н,
или его кислотно-аддитивные соли с фармацевтически приемлемыми кислотами и по крайней мере один фармацевтически приемлемый инертный ингредиент.
17. Амин формулы (II)
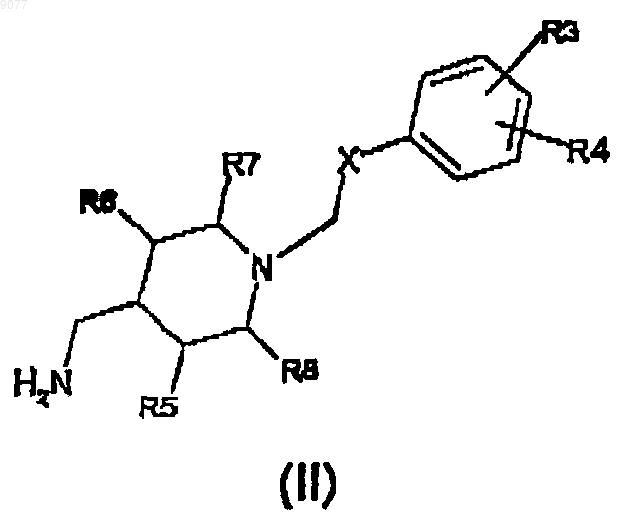
в которой X представляет собой C(O)NH группу;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или нитро, гидроксил, C1-3алкильную группу с линейной или разветвленной цепью, ди(C1-3)алкиламино или О-(C1-3)алкилфенильную группу;
R5, R6, R7 и R8 представляют собой Н.
18. Амин по п.17, отличающийся тем, что R3 представляет собой Н, метил, гидроксил, нитро или диметиламино.
19. Амин по п.17, отличающийся тем, что R4 представляет собой Н или метил.
20. Амин по п.17, отличающийся тем, что R5, R6, R7 и R8 представляют собой Н.
Текст
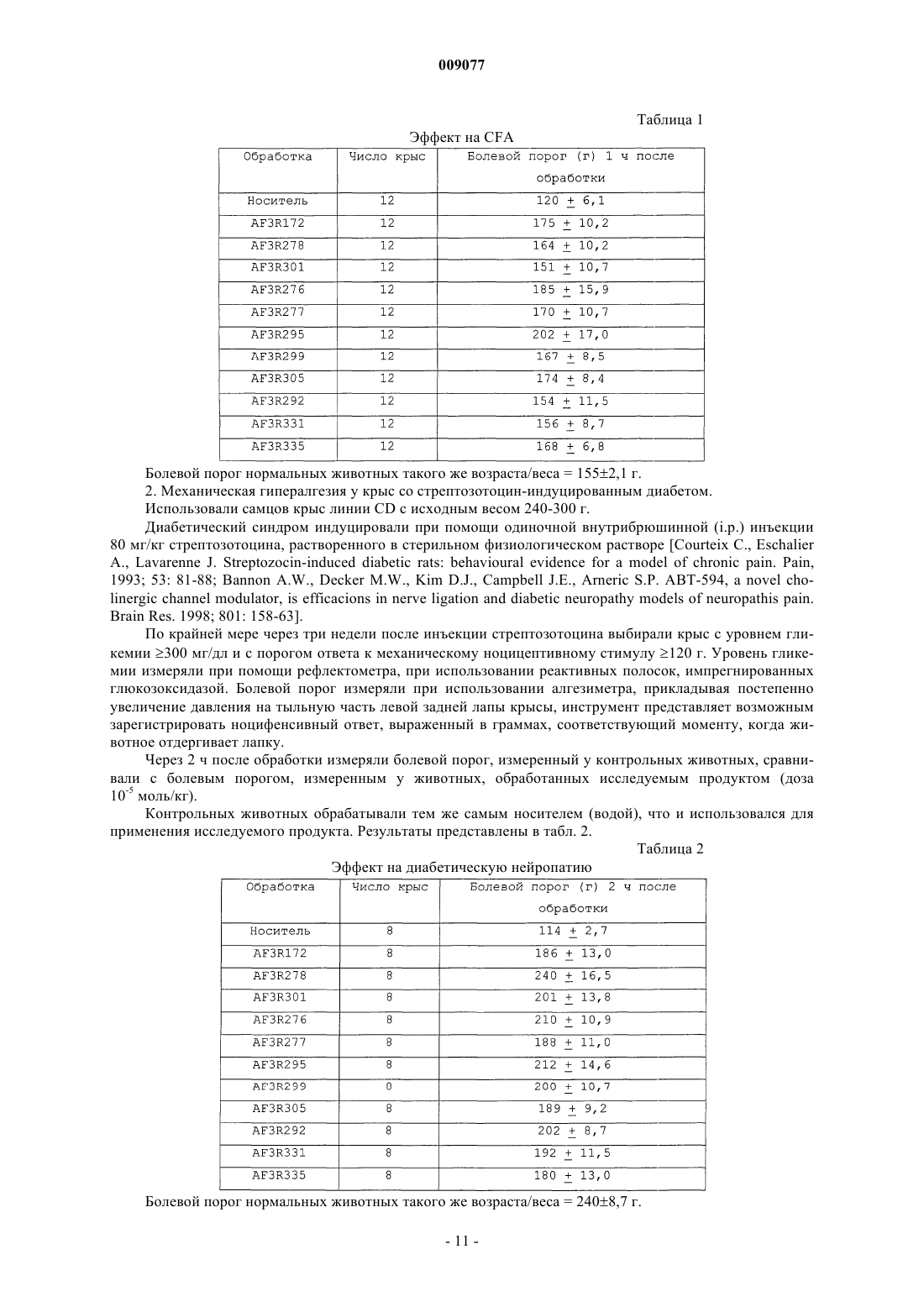
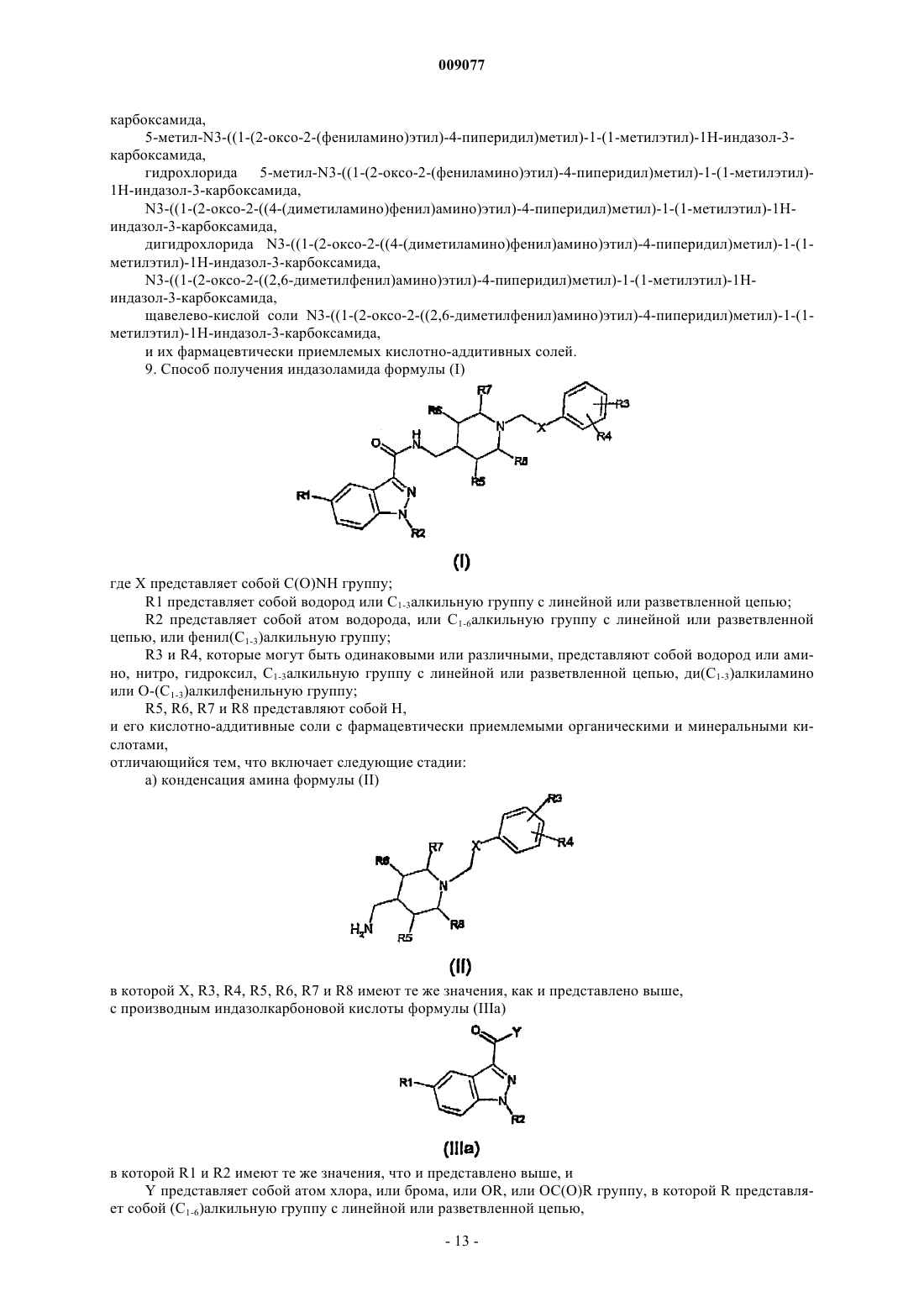
009077 Настоящее изобретение относится к индазоламидам, обладающим аналгетической активностью, к способу их получения и фармацевтической композиции, включающей указанные индазоламиды. Хроническая боль является широко распространенной. В среднем, от нее страдает около 20% взрослого населения. Этот тип боли обычно ассоциируют с хроническими поражениями и/или дегенеративными процессами. Типичными примерами патологий, характеризуемых хронической болью, являются ревматоидный артрит, остеоартрит, фибромиалгия, нейропатия и т.д. [Ashburn M.A., Staats P.S., Management of chronic pain. Lancet 1999; 353:1865-69]. Лекарственные препараты-анальгетики, используемые в настоящее время, по существу, относятся к двум классам: нестероидные противовоспалительные (NSAID), которые сочетают аналгетическую активность с противовоспалительной активностью, и опиоидные анальгетики. Эти классы составляют основы трехуровневой аналгетической шкалы, предложенной Всемирной Организацией Здравоохранения для фармакологического лечения боли [Textbook of pain. Fourth edition. P.D. Wall and R. Melzack Eds.Churchill Livingstone, 1999]. Хроническая боль часто ослабляет силы организма и является причиной потери работоспособности и низкого уровня жизни. Таким образом, она имеет последствия как экономического, так и социального характера. Дополнительно, существует значительное число пациентов, болевые состояния которых до сих пор не имеют подходящего лечения [Scholz J., Woolf C.J. Can we conquer pain Nat. Neurosci. 2002Nov; 5 Suppl; 1062-7]. Интенсивные исследовательские усилия, направленные на установление пригодного аналгетического соединения, до сих пор не привели к существенным результатам. В настоящее время неожиданно было обнаружено, что теми же свойствами обладает новый класс индазоламидов. Таким образом, в первом аспекте настоящее изобретение относится к индазоламиду формулы (I)R1 представляет собой водород или C1-3 алкильную группу с линейной или разветвленной цепью;R2 представляет собой атом водорода, или C1-6 алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или амино, нитро, гидроксил, C1-3 алкильную группу с линейной или разветвленной цепью, ди(С 1-3)алкиламино или О-(C1-3)алкилфенильную группу;R5, R6, R7 и R8, которые могут быть одинаковыми или различными, представляют собой Н,и его кислотно-аддитивным солям с фармацевтически приемлемыми органическими и минеральными кислотами. Предпочтительными значениями R1 являются Н, метил и метокси. Предпочтительными значениями R2 являются Н, метил и изопропил. Предпочтительными значениями R3 являются Н, метил, гидроксил, амино и диметиламино. Предпочтительными значениями R4 являются Н, метил и гидроксил. Предпочтительным значением R5, R6, R6, R7 и R8 является Н. Аналгетическая активность соединений формулы (I) была продемонстрирована при помощи двух экспериментальных моделей на крысах: механической гипералгезии, индуцированной полным адьювантом Фрейнда (CFA), и механической гипералгезии при диабетической нейропатии, индуцированной стрептозотоцином. Как известно из известного уровня техники, вышеупомянутые экспериментальные модели могут рассматриваться как прогнозирующие действие у человека. Индуцированная CFA гипералгезия представляет собой синдром, характеризующийся активацией комплекса механизмов, предназначенных для контроля воспалительного ответа и связанных с возникновением условий, которые мешают восприятию боли. В частности, инъекции CFA способны вызывать периферическое выделение воспалительного супа (медиаторы воспалительного ответа и альгогенные агенты), отвечающего за местную травму, и центрально, в спинном мозге, за биохимические изменения,которые способствуют усилению ощущения боли. Как хорошо известно, эта модель представляет эффективный механизм для исследования лекарственных средств для использования при лечении воспалительной боли человека и, в особенности, для контроля таких состояний, как гиперальгезия и аллодиния.-1 009077 Типичными примерами человеческих патологий, характеризуемых этим типом боли, ассоциированными с дегенеративными воспалительными процессами, являются ревматоидный артрит и остеоартрит. Со своей стороны, диабетическая нейропатия, индуцированная стрептозотоцином у крыс, представляет собой инсулинзависимый синдром, характеризующийся сопутствующим сокращением скорости проводимости двигательных и чувствительных нервов и появлением серии отклонений в болевом восприятии. Как хорошо известно, эта экспериментальная модель представляет собой эффективный механизм для исследования лекарственных средств для использования при лечении невропатической боли у человека. В частности, модель представляет собой действительный пример большой группы типов невропатической боли, характеризуемой такими явлениями, как гипералгезия и аллодиния, являющимися следствием первичных повреждений или дисфункций нервной системы. Типичными примерами патологий у человека, характеризуемых дисфункциями подобного типа и присутствием невропатической боли,являются диабеты, рак, иммунная недостаточность, травмы, ишемия, рассеянный склероз, ишиас, невралгия тройничного нерва и постгерпетические синдромы. Во втором аспекте настоящее изобретение относится к способу получения соединений формулы (I) и его кислотно-аддитивных солей с фармацевтически приемлемыми органическими и минеральными кислотами, характеризующемуся тем, что он включает следующие стадии: а) конденсация амина формулы (II) в которой X, R3, R4, R5, R6, R7 и R8 имеют те же значения, как и представлено выше,с производным индазолкарбоновой кислоты формулы (IIIa) в которой R1 и R2 имеют те же значения, что и представлено выше, иY представляет собой атом Cl, или Br, или OR, или OC(O)R группу, в которой R представляет собой(C1-6)алкильную группу с линейной или разветвленной цепью,или формулы (IIIb) в которой R1 имеет то же значение, что и представлено выше,с получением индазоламида формулы (I) иb) необязательно, образование кислотно-аддитивной соли индазоламида формулы (I) с фармацевтически приемлемой органической или минеральной кислотой. Амин формулы (II) может быть получен общеизвестными способами, например алкилированием изонипекотамида соответствующим галогенидом, с последующим восстановлением амида до первичного амина (WO 98/07728) или защитой аминометилпиперидина бензальдегидом (Synthetic Communications 22(16), 2357-2360, 1992), алкилированием соответствующим галогенидом и снятием защитной группы. Промежуточные продукты формулы (II), в которых X, R3, R4, R5, R6, R7 и R8 имеют те же значения, как и представлено выше, являются новыми.-2 009077 В третьем аспекте настоящее изобретение относится к промежуточным продуктам формулы (II), в которых X, R3, R4, R5, R6, R7 и R8 имеют те же значения, как и представлено выше. Индазолы формул (IIIа) и (IIIb) могут быть также получены общеизвестными способами. Например,соединения формулы (IIIa), в которых Y представляет собой хлор, могут быть получены при использовании тионилхлорида из соответствующей кислоты (J. Med. Chem. 1976, Vol. 19(6), pp. 778-783), в то время как соединения формулы (IIIa), в которых Y представляет собой OR или OC(O)R, могут быть получены известными реакциями этерификации или известными реакциями для получения смешанных ангидридов(R.C. Larock, Comprehensive Organic Transformations, VCH, pp. 965-966). В свою очередь, соединения формулы (IIIb) могут быть получены согласно J.O.C. 1958, Vol. 23, р.621. В одном из вариантов осуществления способа по настоящему изобретению стадию (а) проводят реакцией соединения формулы (II) с соединением формулы (IIIa), в котором Y представляет собой хлор, с соединением формулы (IIIb) в присутствие пригодного разбавителя и при температуре в диапазоне от 0 до 140 С в течение времени в диапазоне от 0,5 до 20 ч. Предпочтительно температура реакции находится в диапазоне от 15 до 40 С. Благоприятно время реакции находится в диапазоне от 1 до 14 ч. Предпочтительно разбавитель является апротонным, полярным или неполярным. Более предпочтительно он представляет собой апротонный разбавитель. Примерами пригодных апротонных неполярных разбавителей являются ароматические углеводороды, например толуол. Примерами пригодных апротонных полярных разбавителей являются диметилформамид и дихлорметан. В варианте осуществления изобретения, в котором используют соединение формулы (IIIa), в котором Y представляет собой Cl или Br, вышеупомянутая стадия (а) может проводиться в присутствии акцептора органической или минеральной кислоты. Примерами пригодных акцепторов органических кислот являются пиридин, триэтиламин и т.п. Примерами пригодных акцепторов минеральных кислот являются карбонаты щелочных металлов и бикарбонаты. Согласно способу по настоящему изобретению на стадии (b) добавлению фармацевтически приемлемой органической или минеральной кислоты к индазоламиду формулы (I), полученному на стадии а),предпочтительно предшествует стадия изолирования указанного индазоламида. Типичными примерами фармацевтически приемлемых кислот являются щавелевая кислота, малеиновая кислота, метансульфоновая кислота, паратолуолсульфоновая кислота, янтарная кислота, лимонная кислота, винная кислота, молочная кислота, соляная кислота, фосфорная кислота, серная кислота. В четвертом аспекте настоящее изобретение относится к фармацевтической композиции, включающей эффективное количество соединения формулы (I) или его аддитивной соли с фармацевтически приемлемой кислотой и по крайней мере один фармацевтически приемлемый инертный ингредиент. Хроническая боль представляет собой типичный пример патологического состояния, которое можно эффективно лечить фармацевтической композицией по настоящему изобретению. Обычно эту хроническую боль можно отнести к хроническим поражениям или дегенеративным процессам, например ревматоидному артриту, остеоартриту, фибромиалгии, онкологической боли, невропатической боли и т.п. Предпочтительно фармацевтические композиции по настоящему изобретению получают в форме пригодных лекарственных форм. Примерами пригодных лекарственных форм являются таблетки, капсулы, таблетки, покрытые оболочкой, гранулы, растворы и сиропы для перорального применения; кремы, мази и медицинские пластыри для местного применения; суппозитории для ректального применения и стерильные растворы для инъекций, аэрозольного или офтальмологического применения. Выгодно, чтобы эти лекарственные формы были составлены таким образом, чтобы гарантировать контролируемое высвобождение соединения формулы (I) или его соли с фармацевтически приемлемой кислотой с течением времени. В частности, в зависимости от способа лечения, требуемое время высвобождения может быть очень коротким, нормальным или замедленным. Формы дозировки могут также содержать другие традиционные ингредиенты, такие как консерванты, стабилизаторы, поверхностно-активные вещества, буферы, соли для регулирования осмотического давления, эмульгаторы, подсластители, красители, ароматизаторы и т.д. Дополнительно, если это необходимо для конкретного лечения, фармацевтическая композиция по настоящему изобретению может содержать другие фармацевтически активные ингредиенты, одновременное применение которых является полезным. Количество соединения формулы (I) или его соли с фармацевтически приемлемой кислотой в фармацевтической композиции по настоящему изобретению может изменяться в широком диапазоне, в зависимости от известных факторов, например типа заболевания, которое подвергают лечению, тяжести заболевания, веса тела пациента, лекарственной формы, выбранного способа введения, числа приемов в день и эффективности выбранного соединения формулы (I). Однако оптимальное количество может быть в обычном порядке и легко определено специалистом в данной области техники. Обычно количество соединения формулы (I) или его соли с фармацевтически приемлемой кислотой-3 009077 в фармацевтической композиции будет таким, чтобы гарантировать уровень приема в диапазоне от 0,001 до 100 мг/кг/день. Еще более предпочтительно количество будет составлять от 0,1 до 10 мг/кг/день. Лекарственные формы фармацевтической композиции по настоящему изобретению могут быть получены в соответствии с технологическими способами, которые хорошо известны специалистам в области фармакологической химии, включающими смешивание, грануляцию, таблетирование, растворение,стерилизацию и т.п. Последующие примеры служат в целях иллюстрации изобретения, при этом не ограничивая его. В последующих примерах заместители при ароматическом цикле (R3 и R4) определены нумерацией полужирным шрифтом. Пример 1. 2-(4-(Аминометил)-1-пиперидил)-N-фенилацетамида дигидрохлорид (AF3R279).(Соединение II: R3=R4=R5=R6=R7=R8=H, X=C(O)NH) а) N-Гексагидро-4-пиридилметил-N-фенилметилиденамин. Бензальдегид (12,7 г; 0,12 моль) добавляли по каплям к раствору 4-аминометилпиперидина (13,7 г; 0,12 моль) в толуоле (50 мл). Таким образом, полученный раствор перемешивали при комнатной температуре. Через 3 ч растворитель удаляли выпариванием при пониженном давлении и осадок дважды поглощали толуолом (250 мл). Таким образом, получали N-гексагидро-4-пиридилметил-N-фенилметилиденамин (25 г) и использовали для дальнейшей очистки.b) 2-(4-(Аминометил)-1-пиперидил)-N-фенилацетамид. Продукт, полученный как описано в стадии а) выше, (26,3 г; 0,13 моль) растворяли в абсолютном этаноле (100 мл) и добавляли к суспензии, содержащей N-2-хлорацетиланилин (22,4 г; 0,13 моль), полученный как описано в Beilstein (I) Syst. No 1607, p. 243, и безводный карбонат калия (33 г; 0,24 моль) в абсолютном этаноле (250 мл). Таким образом, полученную суспензию нагревали с обратным холодильником в течение 16 ч. Реакционную смесь оставляли охлаждаться при комнатной температуре и фильтровали. Фильтрат выпаривали при пониженном давлении и таким образом полученный осадок суспендировали в 3 н. НCl (90 мл) и перемешивали при комнатной температуре в течение 2 ч. Раствор переносили в делительную воронку и кислую водную фазу промывали 4 раза этилацетатом(450 мл). Водную фазу подщелачивали до рН 13 6 н. NaOH и экстрагировали дихлорметаном (80 мл). Органическую фазу сушили над Na2SO4 и растворитель удаляли испарением при пониженном давлении с получением 2-(4-(аминометил)-1-пиперидил)-N-фенилацетамида (10 г).c) 2-(4-(Аминометил)-1-пиперидил)-N-фенилацетамида дигидрохлорид. Продукт, полученый как описано в стадии b) выше, (4 г) превращали в соответствующий дигидрохлорид растворением в этаноле (60 мл), добавлением хлористого этанола (5 мл) и кристаллизацией из 95 этанола. Таким образом, получали 2-(4-(аминометил)-1-пиперидил)-N-фенилацетамида дигидрохлорид(3,5 г). т. пл.: 288 С (разложение) Элементный анализ Для C14H21N3O2HClH2O(Соединение I: R1=R3=R4=R5=R6=R7=R8=H, R2=i-C3H7, X=C(O)NH) 1-(1-Метилэтил)-1 Н-индазол-3-карбоксил хлорид (17,5 г; 0,079 моль), полученный как описано в ЕР-А-0975623, добавляли по частям к суспензии продукта, полученного как описано в примере 1b) (19,5 г; 0,079 моль) в толуоле (300 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем растворитель удаляли испарением при пониженном давлении. Осадок поглощали 1 н. NaOH (100 мл) и дихлорметаном(100 мл) и переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Затем растворитель удаляли испарением при пониженном давлении и таким образом полученный осадок (20 г) очищали флэш-хроматографией,элюируя смесью 7/3 гексан/этилацетат. Полученный продукт превращали в соответствующий гидрохлорид растворением в этилацетате,-4 009077 добавлением хлористого этанола и кристаллизацией из смеси 9/1 этилацетат/абсолютный этанол. Таким образом, получали искомый продукт (12,8 г). т. пл.: 201-202 С (разложение) Элементный анализ Для C25H31N5O2HCl(Соединение I: R1=R2=R3=R4=R5=R6=R7=R8=H, X=C(O)NH) Раствор продукта, полученного как описано в примере 1b), (5,7 г; 0,026 моль) в дихлорметане(30 мл) добавляли через капельную воронку к суспензии 7 Н,14 Н-индазоло[2',3':4,5]пиразино[1,2b]индазол-7,14-диона (3,7 г; 0,013 моль), полученного как описано в J.O.C. 1958, Vol. 23, р. 621 в толуоле(30 мл). После перемешивания при комнатной температуре в течение 18 ч реакционную смесь переносили в делительную воронку. Добавляли дихлорметан (30 мл) и органическую фазу промывали 1 н. NaOH. Органическую фазу отделяли и сушили над Na2SO4. Затем растворитель удаляли испарением при пониженном давлении и таким образом полученный продукт переводили в соответствующий тозилат растворением в этилацетате, добавлением стехиометрического количества п-толуолсульфоновой кислоты и перекристаллизовывали из 95 этанола. Таким образом, получали искомый продукт (4,3 г). т. пл.: 215,5-217,5 С (разложение) Элементный анализ для C22H25N5O2C7H8O3S1/2H2Oa) 1-Бензил-1 Н-индазол-3-карбоксил хлорид. Тионилхлорид (5,6 мл; 0,077 моль) добавляли к суспензии 1-бензил-1 Н-индазол-3-карбоновой кислоты (6,5 г; 0,026 моль), полученной как описано в J. Med. Chem., 1976, Vol. 19(6), pp. 778-783, в толуоле (65 мл) и реакционную смесь перегоняли с обратным холодильником в течение 2 ч. Растворитель удаляли испарением при пониженном давлении и остаток дважды поглощали толуолом (250 мл) с получением заданного продукта (7 г), который использовали без дальнейшей очистки.b) N3-1-(2-Оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-бензил-1 Н-индазол-3-карбоксамида гидрохлорид. При использовании того же способа, что и описанного в примере 2, продукт, полученный как описано в примере 4 а), (8,2 г; 0,030 моль) вводили в реакцию с продуктом, как описано в примере 1b), (7,5 г; 0,030 моль) и продукт реакции переводили в соответствующий гидрохлорид. Таким образом, получали искомый продукт (4,5 г). т. пл.: 196-198 С Элементный анализ Для C29H31N5O2HCl1/2H2Oa) N1-(4-Фенилметил)окси)фенил)-2-(4-(аминометил)-1-пиперидил)этанамида гидрохлорид. Продукт, полученный как описано в примере 1 а), (68 г; 0,34 моль) вводили в реакцию с N1-(4 фенилметил)окси)фенил)-2-хлорэтанамидом (93,7 г; 0,34 моль), полученным как описано в Indian J.Appl. Chem. 1967, vol. 30(3-4), pp. 91-95, при использовании способа, сходного с описанным в примере 1b). Таким образом, полученный маслянистый остаток (120 г) очищали при использовании флэшхроматографии, при элюировании смесью 10/4/1 хлороформ/метанол/нашатырный спирт. Таким образом, получали N1-(4-фенилметил)окси)фенил)-2-(4-(аминометил)-1-пиперидил)этанамидное основание (70 г), которое переводили в соответствующий дигидрохлорид растворением в этаноле, добавлением хлористого этанола и перекристаллизацией из абсолютного этанола с получением 65 г целевого продукта. Элементный анализ Для C21H27N3O22HClN3-1-(2-Оксо-2-4-фенилметил)окси)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол-3-карбоксамид. 1-(1-Метилэтил)-1 Н-индазол-3-карбоксилхлорид (31,1 г; 0,14 моль), полученный как описано в ЕРА-0975623, добавляли по частям к суспензии N1-(4-фенилметил)окси)фенил)-2-(4-(аминометил)-1 пиперидил)этанамида, полученного как описано в примере 5 а) (49,5 г; 0,14 моль) в толуоле (500 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч и затем фильтровали. Таким образом, полученное твердое вещество поглощали 2 н. NaOH и дихлорметаном. Смесь переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Растворитель удаляли испарением при пониженном давлении и таким образом полученный остаток (75 г) дважды кристаллизовали из изопропанола с получением 56 г целевого продукта. т. пл.: 113-115 С Элементный анализ Для C32H37N5O3(Соединение I: R1=R4=R5=R6=R7=R8=H, R2=i-C3H7, R3=4-OH, X=C(O)NH) Раствор продукта, полученного как описано в примере 5, (36,5 г; 0,068 моль) в 95 этаноле(1000 мл) гидрировали над 10% Pd-C (3,65 г) при 40 фунт/кв.дюйм в течение 5 ч. Затем реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Таким образом, полученный продукт переводили в соответствующий гидрохлорид растворением в абсолютном этаноле, добавлением хлористого этанола и перекристаллизацией из абсолютного этанола с получением 20 г целевого продукта. т. пл.: 277 С (разложение) Элементный анализ Для C25H31N5O3HCla) 2-(4-(Аминометил)-1-пиперидил)-N-(4-нитрофенил)ацетамид. Продукт, полученный как описано в примере 1 а), (28 г; 0,14 моль) вводили в реакцию с N1-(4 нитрофенил)-2-хлорэтанамидом (30 г; 0,14 моль), при использовании способа, сходного с описанным в примере 1b). Таким образом, полученный маслянистый остаток (20 г) очищали при использовании флэшхроматографии, элюируя смесью 10/4/1 хлороформ/метанол/нашатырный спирт с получением 15 г целевого продукта. Элементный анализ Для C14H20N4O3b) N3-1-(2-Оксо-2-4-нитрофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол 3-карбоксамид. 1-(1-Метилэтил)-1 Н-индазол-3-карбоксилхлорид (3,1 г; 0,013 моль), полученный как описано в ЕРА-0975623, добавляли по частям к суспензии продукта, полученного согласно примеру 7 а), (4,07 г; 0,014 моль) в толуоле (300 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Растворитель удаляли испарением при пониженном давлении. Остаток поглощали 1 н. NaOH и дихлорметаном. Смесь переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Растворитель удаляли испарением при пониженном давлении. Таким образом, полученный остаток очищали при использовании флэш-хроматографии, элюируя этилацетатом с получением 2,8 г целевого продукта. Элементный анализ Для C25H30N6O4(Соединение I: R1=CH3; R2=R3=R4=R5=R6=R7=R8=H, X=C(O)NH) а) 2,9-Диметил-7 Н,14 Н-индазоло[2',3':4,5]пиразино[1,2-b]индазол-7,14-дион. Тионилхлорид (11 мл; 0,151 моль) добавляли к суспензии 5-метил-1 Н-индазол-3-карбоновой кислоты (12,2 г; 0,056 моль), полученной как описано в J. Heterocyclic Chem., 1964, Vol. 1(5), pp. 239-241, в толуоле (130 мл) и реакционную смесь перегоняли с обратным холодильником в течение 4 ч. Растворитель удаляли испарением при пониженном давлении и остаток дважды поглощали толуолом с получением 12 г заданного продукта. 1 Н-ЯМР (, CDCl3): 2,54 (д, J=1 Гц, 6 Н), 7,35 (дд, J=9, 2 Гц, 2 Н), 7,85 (д, J=9 Гц, 2 Н), 8,01 (м, 1 Н).b) 5-Метил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1 Н-индазол-3-карбоксамида гидрохлорид. Продукт, полученный согласно примеру 1b), (4,5 г; 0,018 моль) и продукт, полученный согласно примеру 8 а), (2,8 г; 0,009 моль) вводили в реакцию способом, сходным с описанным в примере 3. Получали 3,8 г 5-метил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1 Н-индазол-3 карбоксамида и превращали его в соответствующий гидрохлорид растворением в этилацетате, добавлением хлористого этанола и перекристаллизацией из смеси 95/5 этилацетат/этанол с получением 2,7 г целевого продукта. т. пл.: 252 С (разложение) Элементный анализa) Изопропил-1-(1-метилэтил)-5-метил-1 Н-индазол-3-карбоксилат. 60% суспензию гидрида натрия в минеральном масле (17,1 г; 0,43 моль) добавляли к суспензии 5 метил-1 Н-индазол-3-карбоновой кислоты (30 г; 0,17 моль), полученной как описано в J. HeterocyclicChem., 1964, Vol. 1(5), pp. 239-241, в диметилформамиде (450 мл) и реакционную смесь нагревали до 70 С. Через 30 мин добавляли изопропилбромид (48 мл; 0,51 моль). Реакционную смесь перемешивали в течение 6 ч при 70 С. После охлаждения добавляли воду. Реакционную смесь переносили в делительную воронку и экстрагировали диэтиловым простым эфиром. Органическую фазу промывали насыщенным раствором бикарбоната натрия и в конце растворитель удаляли испарением при пониженном давлении. Таким образом, было получено и очищено при помощи флэш-хроматографии 20 г масла, при элюировании смесью 7/3 гексан/этилацетат, с получением 12 г целевого продукта. 1 Н-ЯМР (, CDCl3): 1,47 (д, J=6 Гц, 6 Н), 1,64 (д, J=7 Гц, 6 Н), 2,50 (д, J=1 Гц, 3H), 4,92 (септет, J=7 Гц, 1 Н), 5,39 (септет, J=6 Гц, 1 Н), 7,23 (дд, J=9, 1 Гц, 1 Н), 7,40 (д, J=9 Гц, 1 Н), 7,95 (квинт, J=1 Гц, 1 Н).b) 1-(1-Метилэтил)-5-метил-1 Н-индазол-3-карбоновая кислота. Суспензию продукта, полученного согласно примеру 9a), (8 г, 0,03 моль) в 1 М NaOH (42 мл) перегоняли с обратным холодильником в течение 3 ч. Затем ее добавляли в воду, подкисленную 2 М НCl, и экстрагировали дихлорметаном. После испарения растворителя при пониженном давлении было получено 7 г целевого продукта. 1 Н-ЯМР (, CDCl3): 1,61 (д, J=7 Гц, 6 Н), 2,44 (с, 3H), 4,88 (септет, J=7 Гц, 1 Н), 7,19 (д, J=9 Гц, 1 Н),7,34 (д, J=9 Гц, 1 Н), 7,97 (с, 1 Н), 9,32 (уш.с, 1 Н).c) 1-(1-Метилэтил)-5-метил-1 Н-индазол-3-карбоксилхлорид. Продукт, полученный согласно примеру 9 а), (12,2 г; 0,056 моль) хлорировали способом, сходным с описанным в примере 4 а). Было получено 13,3 г целевого продукта и использовано без дополнительной очистки.d) 5-Метил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол 3-карбоксамида гидрохлорид. Продукт, полученный согласно примеру 1b), (3 г; 0,012 моль) добавляли к суспензии продукта, полученного согласно примеру 9 с), (2,9 г; 0,012 моль) в толуоле (60 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч и растворитель удаляли при пониженном давлении. Остаток поглощали 2 н. NaOH и дихлорметаном. Смесь переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Растворитель удаляли испарением при пониженном давлении. Таким образом, полученный остаток (4 г) очищали при использовании флэш-хроматографии, при элюировании смесью 97/3 хлороформ/метанол. Полученный продукт превращали в соответствующий гидрохлорид растворением в этилацетате, добавлением хлористого этанола и кристаллизацией из абсолютного этанола, с получением 2,3 г целевого продукта. Точка плавления: 241 С Элементный анализ Для С 26 Н 33N5O2 НCla) 2-(4-(Аминометил)-1-пиперидил)-N-(4-(диметиламино)фенил)ацетамид. Продукт, полученный согласно примеру 1 а) выше, (25 г; 0,12 моль) вводили в реакцию с N1-(4-8 009077(диметиламино)фенил)-2-хлорэтанамидом (25,5 г; 0,12 моль) способом, сходным с описанным в примере 1b). Получали 36 г маслянистого остатка, очищали его флэш-хроматографией, при элюировании смесью 10/4/1 хлороформ/метанол/нашатырный спирт с получением 25 г целевого продукта. Элементный анализ Для C16H26N4ON3-1-(2-Оксо-2-4-(диметиламино)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)1 Н-индазол-3-карбоксамида гидрохлорид. При использовании способа, сходного с описанным в примере 2, продукт, полученный согласно примеру 10 а), (6,4 г; 0,022 моль) вводили в реакцию с 1-(1-метилэтил)-1 Н-индазол-3-карбоксилхлоридом(4,9 г; 0,022 моль) и продукт реакции переводили в соответствующий гидрохлорид. Таким образом, получали 4,2 г целевого продукта. т. пл.: 203 С (разложение) Элементный анализ Для С 26 Н 36N6O22 НClН 2Oa) 2-(4-(Аминометил)-1-пиперидил)-N-(2,6-диметилфенил)ацетамида дигидрохлорид. Продукт, полученный согласно примеру 1 а) выше, (32 г; 0,16 моль) вводили в реакцию с N1-(2,6 диметилфенил)-2-хлорэтанамидом (31,6 г; 0,16 моль) способом, сходным с описанным в примере 1b). Получали 54 г маслянистого остатка и кристаллизовали его из этилацетата с получением 45 г целевого продукта, который переводили в соответствующий гидрохлорид растворением в этилацетате, добавлением хлористого этанола и перекристаллизацией из 95 этанола с получением 40 г целевого продукта. Элементный анализ Для C16H25N3O2HClN3-1-(2-Оксо-2-2,6-диметилфенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Ниндазол-3-карбоксамида оксалат. Полученный как описано в ЕР-А-0975623 1-(1-метилэтил)-1 Н-индазол-3-карбоксилхлорид (11,3 г; 0,051 моль) добавляли по частям к суспензии продукта, полученного как описано в примере 11 а), в виде основания (14,1 г; 0,051 моль) в толуоле (200 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. После удаления растворителя испарением при пониженном давлении остаток поглощали 1 н. NaOH и дихлорметаном. Смесь переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Растворитель удаляли испарением при пониженном давлении. Таким образом, полученный остаток (20 г) очищали флэш-хроматографией, при элюировании этилацетатом. Полученный продукт превращали в соответствующий оксалат растворением в этилацетате, добавлением стехиометрического количества щавелевой кислоты и кристаллизацией из 95 этанола, с получением 7,8 г целевого продукта. т. пл.: 214 С (разрушение) Элементный анализ(Соединение I: R1=R4=R5=R6=R7=R8=H, R2=i-C3H7, R3=4-NH2, X=C(O)NH) Раствор продукта, полученного согласно примеру 7b), (1,4 г; 0,003 моль) в абсолютном этаноле(50 мл) гидрировали над 10% Pd-C (90 мг) при 40 фунт/кв.дюйм в течение 3 ч. Смесь затем фильтровали и фильтрат концентрировали при пониженном давлении. Таким образом, полученный продукт переводили в соответствующий дигидрохлорид растворением в этилацетате, добавлением хлористого этанола и кристаллизацией из смеси 95/5 этилацетат/этанол с получением 0,7 г целевого продукта. т. пл.: 252 С (разложение) Элементный анализ Для С 25 Н 32N6O22 НClН 2O(септет, J=7 Гц, 1 Н), 7,20-7,38 (м, 3H), 7,30-7,48 (м, 1 Н), 7,70 (д, J=9 Гц, 2 Н), 7,79 (д, J=9 Гц, 2 Н), 8,17 (д,J=8 Гц, 1 Н), 8,37 (т, J=6 Гц, 1 Н), 10,03 (уш.с, 4 Н), 11,17 (с, 1 Н). Испытания 1. CFA-индуцируемая механическая гипералгезия у крыс. Использовали самцов крыс линии CD с исходным весом 150-200 г. При помощи алгезиметра выбирали крыс с порогом ответа к механическому ноцицептивному стимулу в диапазоне от 150 до 180 г. Прикладывая постепенно увеличение давления на тыльную часть левой задней лапки крысы, инструмент предоставляет возможность зарегистрировать ноцифенсивный ответ,выраженный в граммах, соответствующий моменту, когда животное отдергивает лапку [Randall L.O. andTher. 1957; 111: 409-419]. Гипералгезию индуцировали односторонней инъекцией 150 мкл полного адьюванта Фрейнда(CFA) в поверхность левой задней лапки животного [Andrew D., Greenspan J.D., Mechanical and heat sensitization of cutaneous nociceptors after peripheral inflammation in the rat. J. Neurophysiol. 1999; 82(5): 26492656; Hargreaves K., Dubner R., Brown R., Flores C., Joris J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain 1988; 32: 77-88]. Испытываемые соединения испытывали (доза 10-5 моль/кг) проведением исследования через 23 ч после инъекции CFA. Через час после обработки болевой порог, измеренный у контрольных животных, сравнивали с болевым порогом, измеренным у животных, обработанных исследуемым продуктом. Контрольных животных обрабатывали тем же самым носителем (водой), что и использовалось для применения исследуемого продукта. Результаты представлены в табл. 1. Болевой порог нормальных животных такого же возраста/веса = 1552,1 г. 2. Механическая гипералгезия у крыс со стрептозотоцин-индуцированным диабетом. Использовали самцов крыс линии CD с исходным весом 240-300 г. Диабетический синдром индуцировали при помощи одиночной внутрибрюшинной (i.p.) инъекции 80 мг/кг стрептозотоцина, растворенного в стерильном физиологическом растворе [Courteix С., EschalierBrain Res. 1998; 801: 158-63]. По крайней мере через три недели после инъекции стрептозотоцина выбирали крыс с уровнем гликемии 300 мг/дл и с порогом ответа к механическому ноцицептивному стимулу 120 г. Уровень гликемии измеряли при помощи рефлектометра, при использовании реактивных полосок, импрегнированных глюкозоксидазой. Болевой порог измеряли при использовании алгезиметра, прикладывая постепенно увеличение давления на тыльную часть левой задней лапы крысы, инструмент представляет возможным зарегистрировать ноцифенсивный ответ, выраженный в граммах, соответствующий моменту, когда животное отдергивает лапку. Через 2 ч после обработки измеряли болевой порог, измеренный у контрольных животных, сравнивали с болевым порогом, измеренным у животных, обработанных исследуемым продуктом (доза 10-5 моль/кг). Контрольных животных обрабатывали тем же самым носителем (водой), что и использовался для применения исследуемого продукта. Результаты представлены в табл. 2. Таблица 2 Эффект на диабетическую нейропатию Болевой порог нормальных животных такого же возраста/веса = 2408,7 г.R1 представляет собой водород или C1-3 алкильную группу с линейной или разветвленной цепью;R2 представляет собой атом водорода, или C1-6 алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или амино, нитро, гидроксил, C1-3 алкильную группу с линейной или разветвленной цепью, ди(С 1-3)алкиламино или О-(C1-3)алкилфенильную группу;R5, R6, R7 и R8, которые могут быть одинаковыми или различными, представляют собой Н,и его кислотно-аддитивные соли с фармацевтически приемлемыми органическими и минеральными кислотами. 2. Индазоламид по п.1, отличающийся тем, что R1 представляет собой Н или метил. 3. Индазоламид по п.1 или 2, отличающийся тем, что R2 представляет собой Н, метил или изопропил. 4. Индазоламид по любому из пп.1-3, отличающийся тем, что R3 представляет собой Н, метил, гидроксил, амино или диметиламино. 5. Индазоламид по любому из пп.1-4, отличающийся тем, что R4 представляет собой Н, метил или гидроксил. 6. Индазоламид по любому из пп.1-5, отличающийся тем, что R5, R6, R7 и R8 представляют собой Н. 7. Индазоламид по любому из пп.1-6, отличающийся тем, что он представляет собой фармацевтически приемлемую кислотно-аддитивную соль кислоты, выбранной из группы, включающей щавелевую кислоту, малеиновую кислоту, янтарную кислоту, лимонную кислоту, винную кислоту, молочную кислоту, метансульфоновую кислоту, паратолуолсульфоновую кислоту, соляную кислоту, фосфорную кислоту и серную кислоту. 8. Индазоламид, выбранный изN3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-бензил-1 Н-индазол-3 карбоксамида,N3-1-(2-оксо-2-4-фенилметил)окси)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)1 Н-индазол-3-карбоксамида,N3-1-(2-4-гидроксифенил)амино)-2-оксоэтил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол 3-карбоксамида,гидрохлорида N3-1-(2-4-гидроксифенил)амино)-2-оксоэтил)-4-пиперидил)метил)-1-(1-метилэтил)1 Н-индазол-3-карбоксамида,N3-1-(2-оксо-2-4-нитрофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол-3 карбоксамида,N3-1-(2-оксо-2-4-аминофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол-3 карбоксамида,дигидрохлорида N3-1-(2-оксо-2-4-аминофенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)1 Н-индазол-3-карбоксамида,5-метил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1 Н-индазол-3-карбоксамида,гидрохлорида 5-метил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1 Н-индазол-3- 12009077 карбоксамида,5-метил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Н-индазол-3 карбоксамида,гидрохлорида 5-мeтил-N3-1-(2-оксо-2-(фениламино)этил)-4-пиперидил)метил)-1-(1-метилэтил)1 Н-индазол-3-карбоксамида,N3-1-(2-оксо-2-4-(диметиламино)фенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Ниндазол-3-карбоксамида,дигидрохлорида N3-1-(2-оксо-2-4-(диметиламино)фенил)амино)этил)-4-пиперидил)метил)-1-(1 метилэтил)-1 Н-индазол-3-карбоксамида,N3-1-(2-оксо-2-2,6-диметилфенил)амино)этил)-4-пиперидил)метил)-1-(1-метилэтил)-1 Ниндазол-3-карбоксамида,щавелево-кислой соли N3-1-(2-оксо-2-2,6-диметилфенил)амино)этил)-4-пиперидил)метил)-1-(1 метилэтил)-1 Н-индазол-3-карбоксамида,и их фармацевтически приемлемых кислотно-аддитивных солей. 9. Способ получения индазоламида формулы (I)R1 представляет собой водород или C1-3 алкильную группу с линейной или разветвленной цепью;R2 представляет собой атом водорода, или C1-6 алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или амино, нитро, гидроксил, C1-3 алкильную группу с линейной или разветвленной цепью, ди(С 1-3)алкиламино или О-(C1-3)алкилфенильную группу;R5, R6, R7 и R8 представляют собой Н,и его кислотно-аддитивные соли с фармацевтически приемлемыми органическими и минеральными кислотами,отличающийся тем, что включает следующие стадии: а) конденсация амина формулы (II) в которой X, R3, R4, R5, R6, R7 и R8 имеют те же значения, как и представлено выше,с производным индазолкарбоновой кислоты формулы (IIIa) в которой R1 и R2 имеют те же значения, что и представлено выше, иY представляет собой атом хлора, или брома, или OR, или OC(O)R группу, в которой R представляет собой (C1-6)алкильную группу с линейной или разветвленной цепью,- 13009077 или формулы (IIIb) в которой R1 имеет то же значение, что и представлено выше,с получением индазоламида формулы (I) иb) необязательно, образование кислотно-аддитивной соли индазоламида формулы (I) с фармацевтически приемлемой органической или минеральной кислотой. 10. Способ по п.9, отличающийся тем, что стадию а) осуществляют путем взаимодействия соединения формулы (II) с соединением формулы (IIIa), в которой Y представляет собой хлор, или с соединением формулы (IIIb) в присутствие подходящего разбавителя при температуре в диапазоне от 0 до 140 С в течение времени в диапазоне от 0,5 до 20 ч. 11. Способ по п.10, отличающийся тем, что температура реакции находится в диапазоне от 15 до 40 С. 12. Способ по п.10, отличающийся тем, что время реакции находится в диапазоне от 1 до 14 ч. 13. Способ по любому из пп.9-12, отличающийся тем, что разбавитель является апротонным. 14. Способ по п.13, отличающийся тем, что разбавитель представляет собой апротонный неполярный разбавитель. 15. Способ по любому из пп.9-14, отличающийся тем, что если Y представляет собой хлор или бром, вышеупомянутую стадию а) проводят в присутствии акцептора органической или минеральной кислоты. 16. Фармацевтическая композиция, включающая эффективное количество соединения формулы (I)R1 представляет собой водород или C1-3 алкильную группу с линейной или разветвленной цепью;R2 представляет собой атом водорода, или C1-6 алкильную группу с линейной или разветвленной цепью, или фенил(C1-3)алкильную группу;R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород, или атом галогена, или амино, нитро, гидроксил, C1-3 алкильную группу с линейной или разветвленной цепью, ди(C1-3)алкиламино или О-(C1-3)алкилфенильную группу;R5, R6, R7 и R8 представляют собой Н,или его кислотно-аддитивные соли с фармацевтически приемлемыми кислотами и по крайней мере один фармацевтически приемлемый инертный ингредиент. 17. Амин формулы (II)R3 и R4, которые могут быть одинаковыми или различными, представляют собой водород или нитро, гидроксил, C1-3 алкильную группу с линейной или разветвленной цепью, ди(C1-3)алкиламино или О(C1-3)алкилфенильную группу;
МПК / Метки
МПК: C07D 401/12, C07D 211/26, A61P 23/00, A61K 31/4523
Метки: активностью, индазоламиды, анальгетической
Код ссылки
<a href="https://eas.patents.su/16-9077-indazolamidy-s-analgeticheskojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Индазоламиды с аналгетической активностью</a>
Предыдущий патент: Пенообразующий ингредиент и продукты, содержащие такой ингредиент
Следующий патент: Замещенные производные 1-пиперидин-4-ил-4-пирролидин-3-илпиперазина и их применение в качестве антагонистов нейрокининов
Случайный патент: Противокоррозийная композиция для покрытия