Применение вторичных производных 8-оксихинолин-7-карбоксамида в качестве противогрибковых агентов
Номер патента: 24115
Опубликовано: 31.08.2016
Авторы: Майлланд Федерико, Гальярди Стефаниа, Дель Сордо Симоне, Легора Михела
Формула / Реферат
1. Применение соединения общей формулы (I) или его фармацевтически приемлемой соли
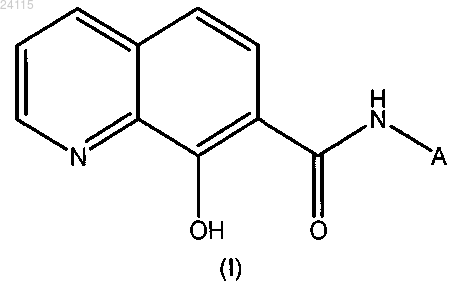
в качестве противогрибкового агента, в котором А:
-(CH2)m-X1, причем X1:
-арил, с факультативным замещением одним, двумя или тремя R4,
-гетероцикл с факультативным замещением одним R5,
-С3-С8-циклоалкил, причем арил представляет собой
фенил;
причем гетероцикл представляет собой 5-, 6-членное насыщенное или ненасыщенное кольцо, содержащее от одного до трех гетероатомов, выбираемых из группы, состоящей из азота, кислорода и серы, и включающее любую бициклическую группу, в которой любое из вышеперечисленных гетероциклических колец слито с бензольным или другим гетероциклическим кольцом;
причем циклоалкил представляет собой насыщенное или ненасыщенное углеводородное кольцо, содержащее от 3 до 8 атомов углерода и включающее любую бициклическую группу, в которой вышеперечисленное кольцо соединено с бензольным, гетероциклическим или другим углеводородном кольцом; причем R4:
-Cl,
-Br,
-CF3,
-W-R10 или
-(CH2)m-NR14R15,
причем R5:
-C1-C6 алкил;
причем W:
-О;
причем R10:
-Н,
-C1-С6 алкил;
причем R14 и R15 независимо друг от друга, выбирают из
-C1-C6 алкила;
где m - целое число от 0 до 1.
2. Применение по п.1, в котором гетероцикл является 2,3-дигидробензо[b][1,4]диоксином, пиридином, тиофеном, триазолом, тиазолом, изоксазолом, бензотиазолом, пиразином, имидазолом или фураном.
3. Применение по п.1, выбираемое из группы, состоящей из
8-гидрокси-N-(тиофен-2-илметил)хинолин-7-карбоксамид,
8-гидрокси-N-(циклогексилметил)хинолин-7-карбоксамид,
8-гидрокси-N-бензилхинолин-7-карбоксамид,
8-гидрокси-N-(4-хлорбензил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-метоксифенил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-(трифторметил)бензил)хинолин-7-карбоксамид,
8-гидрокси-N-фенилхинолин-7-карбоксамид,
8-гидрокси-N-(2-гидроксибензил)хинолин-7-карбоксамид,
8-гидрокси-N-(фуран-2-илметил)хинолин-7-карбоксамид,
8-гидрокси-N-(пиридин-3-илметил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-метоксибензил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-бромбензил)хинолин-7-карбоксамид,
8-гидрокси-N-(1,1-диоксидотетрагидротиен-3-ил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-(диметиламино)бензил)хинолин-7-карбоксамид,
8-гидрокси-N-(тетрагидро-2Н-пиран-4-ил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-морфолинофенил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-(1Н-1,2,4-триазол-1-ил)фенил)хинолин-7-карбоксамид,
8-гидрокси-N-(тиазол-2-ил)хинолин-7-карбоксамид,
8-гидрокси-N-(2,3-дигидробензо[b][1,4]диоксин-6-ил)хинолин-7-карбоксамид,
8-гидрокси-N-(4-морфолинобензил)хинолин-7-карбоксамид,
8-гидрокси-N-((5-метилизоксазол-3-ил)метил)хинолин-7-карбоксамид,
8-гидрокси-N-((4-метилтиазол-2-ил)метил)хинолин-7-карбоксамид,
8-гидрокси-N-(изоксазол-3-ил)хинолин-7-карбоксамид,
8-гидрокси-N-(бензо[d]тиазол-2-илметил)хинолин-7-карбоксамид,
8-гидрокси-N-((5-метилпиразин-2-ил)метил)хинолин-7-карбоксамид,
8-гидрокси-N-((1-метил-1Н-имидазол-2-ил)метил)хинолин-7-карбоксамид,
8-гидрокси-N-((4-фенилтиазол-2-ил)метил)хинолин-7-карбоксамид,
8-гидрокси-N-(пиридин-4-илметил)хинолин-7-карбоксамид,
8-гидрокси-N-(пиридин-2-илметил)хинолин-7-карбоксамид.
4. Применение соединения формулы
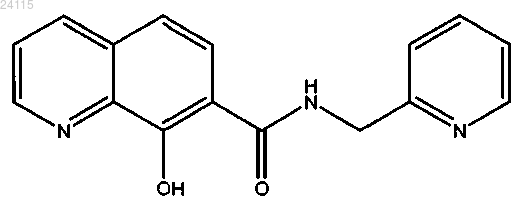
в качестве противогрибкового агента.
5. Применение по любому из пп.1-4 для лечения и/или профилактики грибковых инфекций.
6. Применение по п.5, в котором упомянутая грибковая инфекция представляет собой инфекцию, вызываемую Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger, Scopulariopsis Brevicaulis или Candida, как, например, Candida Albicans или Candida Glabrata.
7. Применение по п.5, в котором упомянутая грибковая инфекция представляет собой инфекцию, вызываемую дерматофитами и/или плесневыми грибками.
8. Применение по п.7, в котором упомянутые плесневые грибки представляют собой Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger и/или Scopulariopsis Brevicaulis.
9. Применение по п.5, в котором упомянутая грибковая инфекция не является инфекцией, вызываемой дрожжевыми грибками.
10. Применение по п.9, в котором упомянутые дрожжевые грибки являются Candida.
11. Применение по любому из пп.6-10, в котором реципиент данного лечения или профилактики представляет собой млекопитающее.
12. Применение по п.11, в котором реципиент данного лечения или профилактики - млекопитающее - представляет собой человека.
Текст
ПРИМЕНЕНИЕ ВТОРИЧНЫХ ПРОИЗВОДНЫХ 8-ОКСИХИНОЛИН-7 КАРБОКСАМИДА В КАЧЕСТВЕ ПРОТИВОГРИБКОВЫХ АГЕНТОВ Гальярди Стефаниа, Дель Сордо Симоне (IT), Майлланд ФедерикоLETTERS, PERGAMON, ELSEVIER SCIENCE, Заявленное изобретение относится к применению соединения общей формулы (I) и его фармацевтически приемлемой соли в качестве противогрибковых агентов. В частности, данные соединения прошли испытания в отношении Tricophyton Rubrum, Tricophyton Mentagrophytes,Aspergillus Niger и Scopulariopsis Brevicaulis. Данные соединения активны в отношении грибков рода Candida, как, например, Candida Albicans и Candida Glabrata. Заявленное изобретение относится к вторичным производным 8-оксихинолин-7-карбоксамида и их фармацевтически приемлемым солям, предназначенным для применения в качестве противогрибковых агентов. В частности, данные соединения прошли испытания в отношении Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger и Scopulariopsis Brevicaulis. Данные соединения активны в отношении грибков рода Candida, как например Candida Albicans и Candida Glabrata. Уровень техники изобретения Патогенные грибы можно разделить на две категории: грибы, которые могут вызывать заболевания у здоровых организмов, и менее болезнетворные грибы, которые могут вызвать заболевания только у критически ослабленных организмов. В последние два десятилетия наблюдался значительный рост частоты возникновения агрессивно-патогенных грибковых инфекций и связанных с ними заболеваемости и смертности. Данное явление объясняется прежде всего стремительным прогрессом в современной медицине, благодаря которому удалось повысить выживаемость пациентов в критическом состоянии, например, находящихся в блоках интенсивной терапии (ICU, БИТ) с сосудистым и мочевым катетерами, с полным парентеральным питанием и гемодиализом или подключенных к аппарату искусственного дыхания. Грибки рода Candida обычно являются возбудителями внутрибольничных инфекций кровообращения среди пациентов БИТ. Частота возникновения внутрибольничной кандидемии в стационарах Великобритании составляет примерно 3% на 100,000 койко-дней, и от 40 до 52% всех случаев происходят в БИТ (Schelenz S., J. Antimicrob. Chemother. 2008; 61, Suppl 1, 31-34). Данный тип микозов часто ассоциируют с высокими показателями заболеваемости и смертности. Приписываемый уровень смертности составляет примерно 38%, хотя он может варьироваться в пределах между 5 и 71%. В последние годы наблюдался растущий показатель частоты возникновения патогенного легочного аспергиллеза у пациентов БИТ. Частота возникновения заболевания варьируется в пределах от 0,3 до 5,8%, с общим уровнем смертности, превышающим 80% (Trof R. J. et al, Intensive Care Med., 2007; 33, 1694-1703). Пациенты в критическом состоянии подвержены риску возникновения нарушений иммунорегуляции во время пребывания в БИТ, с высокой подверженностью грибковым инфекциям. Факторы риска включают, например, хроническую обструктивную болезнь легких, длительный прием стероидных препаратов, запущенные формы заболеваний печени (печеночной недостаточности), дисфункции, связанные с заместительной почечной терапией, высокий риск аспирации и сахарный диабет. Наблюдался очень высокий рост также в числе иммунокомпрометированных пациентов, в особенности в отделениях трансплантации паренхиматозных органов и костного мозга, аутоиммунного синдрома, синдрома приобретенного иммунодефицита (AIDS, СПИД) и онкологии. Примерно у 40% пациентов после трансплантации костного мозга развиваются патогенные грибковые инфекции (Khan S. A., Wingard J. R., Natl. Cancer Inst. Monogr. 2001; 29, 31-36). Грибки родов Candida и Aspergillus являются наиболее частыми патогенными агентами - возбудителями внутрибольничных микозов легкой и тяжелой форм у пациентов с гемобластозами и после трансплантации костного мозга. У данных пациентов смертность, связанная с системным кандидозом, очень высока (50-90%). Что касается пациентов после трансплантации паренхиматозных органов, осложнения инфекционного генеза чаще встречаются у пациентов с пересаженными легкими. Помимо режима иммуносупрессии, повышенная предрасположенность (к грибковым инфекциям), главным образом, объясняется постоянным контактом с окружающей средой. Параллельно с интенсивностью иммуносупрессивной терапии,агрессивная грибковая инфекция может возникнуть в течение первых дней после хирургического вмешательства, причем частота возникновения наиболее высока в первые 2 месяца при снижении после 6 месяцев, но с сохраняющейся вероятностью проявления в течение нескольких лет после трансплантации(Hamacher J. et al, Eur. Respir. J., 1999; 13, 180-186). Агрессивные грибковые инфекции также часто встречаются у пациентов после трансплантации других паренхиматозных органов, а именно почек и печени; по статистическим данным частота возникновения грибковых инфекций у данных пациентов составляет от 5 до 50% (Dictar М. О. et al., MedMycol., 2000; 38 Suppl. 1,251-258). Микозы являются одной из главных причин смертности у пациентов со СПИД, причем частота возникновения и тяжесть протекания данных инфекций возрастает по мере прогрессирования основного заболевания и последующим развитием Т-лимфоцитарной иммунной недостаточности. Частота возникновения различных микозов тесно связана с присутствием в сфере обитания эндемически оппортунистических грибков. Обобщая, можно утверждать, что наиболее часто встречающимися УК пациентов с СПИД микозами являются гистоплазмоз, бластомикоз, кокцидиоидомикоз и паракокцидиомикоз (SarosiG. A., Davies S. F., West J. Med., 1996; 164, 335-340). Грибковые инфекции, вызванные родом Candida, также широко распространены. У обычных пациентов все эти грибковые инфекции самокупирующиеся, а у иммунодепрессированных пациентов приобретают высокоинвазивную форму, с последующим распространением и размножением. Кроме того, в последние годы стал очевиден рост уровня заболеваемости грибковыми инфекциями,устойчивыми в отношении современных препаратов. Данное явление в особенности распространено в случае применения флуконазола и других азолов в лечении грибковых инфекций, вызванных Candida albicans (Bastert J. et al., Int. J. Antimicrob. Agents,2001; 17, 81-91). Предлагаемые в настоящее время противогрибковые лекарственные препараты не удовлетворяют полностью требованиям вследствие ограниченного спектра активности и наличием осложняющих побочных эффектов. Полиеновый препарат Амфотерицин В, например, так или иначе активен в отношении Aspergillus,Zygomycete и других плесневых грибков, но вследствие токсичности разрешенная к применению дозировка для лечения инвазивного микоза составляет 3-5 мг/кг веса пациента в день. У высокоиммунокомпрометированных пациентов с инвазивным аспергиллезом суточная доза 3 мг/кг веса пациента липосомального капсулированного Амфотерицина В вызвала положительный ответ у 50% пациентов и показатель выживаемости 12 недель 72% (Comely О. A. et al., Clin. Infect. Dis., 2007; 44, 1289-1297). Препарат вызвал нефротоксичность и гипокалиемию у 14-16% пациентов. При суточной дозе 10 мг/кг Амфотерицин В не обеспечил дополнительный терапевтический эффект и вызвал высокую нефротоксичность(31%). Азолы, появившиеся на рынке во второй половине 1970-х гг., представляют собой ингибиторы синтеза эргостерола. Применение лекарственных препаратов данной группы ограничено узким спектром активности. Вориконазол, например, более активен, чем Амфотерицин В, при лечении инвазивного аспергиллеза, но не обладает активностью в отношении зигомицетов (Johnson L. В., Kauffman С. А., Clin.Infect. Dis., 2003, 36, 630-637). Применение азолов также ограничено некоторыми побочными эффектами. Азолы взаимодействуют с энзимами млекопитающих р 450, что приводит к конфликту с метаболизмом других лекарственных препаратов и, дополнительно, некоторые азолы, как, например, кетоконазол, могут ингибировать кардиокалиевый канал Kv1.5, вызывая удлинение Q-T интервала и двунаправленную желудочковую тахикардию (Dumaine R., Roy M. L, Brown A. M., J. Pharmacol. Exp. Then, 1998; 286, 727735). Аллиламины, как, например, тербинафин, связываются с и ингибируют сквален-эпоксидазу, вызывая блокирование синтеза эргостерола. Данные препараты очень активны в отношении Dermatophytes, в то время как их активность в отношении грибков рода Candida очень низкая. В некоторых случаях лечение аллиламинами вызывает тяжелые кожные нежелательные реакции. Результаты проведенного недавно в нескольких странах исследования методом случай-контроль (euroSCAR) (Sidoroff A. et al., Br. J.Dermatol., 2007; 15, 989-996) показали, что системная терапия тербинафином напрямую связана с развитием острого генерализованного экзантематозного пустулеза (AGEP, ОГЭП). Данное заболевание характеризуется внезапным появлением множества стерильных, нефолликулярных пустул, обычно сопровождающимся лейкоцитозом и лихорадкой. ОГЭП обычно связывают с проводимой у пациента терапией некоторыми препаратами, как правило, вызывающей измененную активность Т-клеток. Терапия тербинафином также может вызвать дерматомиозит, острое аутоиммунное заболевание соединительной ткани,характеризующееся эритемой, мышечной слабостью и интерстициальным пневмофиброзом (Magro С. М.et al., J. Cutan. Pathol., 2008; 35, 74-81). Помимо этого аналогично другим противогрибковым медпрепаратам Тербинафин может вызвать тяжелую дисфункцию печени (Perveze Z. et al., Liver Transpl., 2007; 13,162-164). Гризеофульвин представляет собой бензофуран, одобренный к применению в 1960 г. для лечения дерматофитовых инфекций. Препарат проявляет фунгистатическую активность путем нарушения процесса производства микротрубочек. Гризеофульвин проявляет минимальную активность в лечении онихомикозов и зачастую провоцирует тяжелые побочные эффекты, как, например, тошноту, диарею,головные боли, спутанность сознания и утомляемость (Korting Н. С. et al., Antimicrob. Agents Chemother,1993; 37, 2064-2068), которые могут послужить основанием для прекращения лечения. Основное действие обоих N-гидроксипиридонов, циклопироксоламина и октопирокса, заключается в образовании хелатных (комплексных) соединений с многовалентными катионами, в результате чего происходит ингибирование металл-зависимых энзимов. Они используются против различных грибковых инфекций, но их использование ограничено местным лечением. Эхинокандины (каспофунгин, микафунгин, анидулафунгин) предсталяют собой полусинтетические липопептиды, совсем недавно представленные на рынке противогрибковых препаратов. Они действуют путем неконкурентного ингибирования -(1-3)-Dглюкансинтазы (энзима, незаменимого для целостности клеточной мембраны) и главным образом используются для внутривенного введения при лечении инвазивных форм кандидоза и аспергиллеза. Они проявляют фунгицидные свойства в отношении дрожжевых грибков, а в отношении гифомицетов (мицелиальных грибков) - только фунгистатические свойства; помимо этого, они достаточно неактивны в отношении диморфных грибов, как, например, Blastomyces и Histoplasma. Эхинокандины имеют, как правило, хорошую переносимость, но испытания на размножение, проведенные на животных, показали неблагоприятное воздействие на зародыш. По этой причине Комиссия по контролю за лекарствами и питательными веществами (FDA) включила эхинокандины в группу риска для применения беременными(http://www.fda.gov/medwatch/SAFETY/2004/marPI/CancidasPl.pdf; http://www.fda.gov/medwatch/safety/2007/AugPI/MycaminePl.pdf). Заявка WO98/11073 (US6310211) раскрывает 8-гидрокси-7-замещенные хинолины в качетве антивирусных агентов. Заявка US2003/0055071 раскрывает класс дженериковых соединений с ингибирующей активностью в отношении интегразы ВИЧ. Собственно, большинство специфических соединений, раскрытых в данном источнике, имеют остаток нафтидринила. Заявка ЕР 1375486 раскрывает азотсодержащие гетероарильные соединения с ингибирующей активностью в отношении интегразы ВИЧ.N-бензил-8-оксихинолин-7-карбоксамид. Заявка WO2008/14602 раскрывает производные хинолина с активностью в качестве ингибиторовCLK-1. Патент ЕР 1669348 раскрывает противогрибковые агенты, определенные всеобъемлющей формулой, которая включает некоторые вторичные амиды. Из описанного выше очевидно, что в последние несколько лет наметилась явная тенденция в насущной необходимости проведения клинических испытаний противогрибковых лекарственных препаратов. К сожалению, присутствующие на рынке лекарственные препараты несовершенны вследствие узкого спектра действия, фармакокинетических характеристик и тяжелых побочных эффектов. Описание изобретения Заявляется применение вторичных производных 8-оксихинолин-7-карбоксамида в соответствии с соединением общей формулы (I) или его фармацевтически приемлемой солиm - целое число от 0 до 1; где X1:- арил, с факультативным замещением одним, двумя или тремя R4,- гетероцикл, с факультативным замещением одним или двумя R5, или- С 3-С 8-циклоалкил,причем арил представляет собой фенил; причем гетероцикл представляет собой 5-,6-членное насыщенное или ненасыщенное кольцо, содержащее от одного до трех гетероатомов, выбираемых из группы, состоящей из азота, кислорода и серы, и включающее любую бициклическую группу, в которой любое из вышеперечисленных гетероциклических колец слито с бензольным или другим гетероциклическим кольцом; причем циклоалкил представляет собой насыщенное или ненасыщенное углеводородное кольцо,содержащее от 3 до 8 атомов углерода и включающее любую бициклическую группу, в которой вышеперечисленное кольцо соединено с бензольным, гетероциклическим или другим углеводородном кольцом; причем R4:m - целое число от 0 до 1,причем R5:-Н,-С 1-С 6 алкил; причем R14 и R15 независимо друг от друга, выбирают из-C1-С 6 алкила; и/или гетероцикл предпочтительно является 2,3-дигидробензо[b][1,4]диоксином, пиридином, тиофеном, триазолом, тиазолом, изоксазолом, бензотиазолом, пиразином, имидазолом или фураном. Заявленное изобретение в общем случае относится к применению соединений формулы (I) или их фармацевтически приемлемым солям, обладающим ярко выраженной противогрибковой активностью"Фармацевтически приемлемые соли" или производные относятся к таким солям или производным,-3 024115 которые обладают биологической эффективностью и свойствами исходного препарата, и являются приемлемыми по параметрам биологической и прочей совместимости. Такие соли включают соли с неорганическими или органическими кислотами, как, например, соль гидробромида, гидрохлорида, сульфата,фосфата, натрия, магния; такие производные включают сложные и простые эфиры и оксиды азота. Соединения в соответствии с заявленным изобретением и их фармацевтически приемлемые соли или производные могут иметь ассиметричные центры и могут представлять собой, если иначе не указано, смеси стереоизомеров, или отдельные диастереоизомеры, или энантиомеры, любых изомерических форм в соответствии с заявленным изобретением. Фраза "фармацевтически приемлемые", в том смысле, в котором она используется в связи с композициями, содержащими соединения в соответствии с заявленным изобретением, относится к молекулярным субстанциям и прочим ингредиентам таких субстанций, которые физиологически приемлемы и не вызывают нежелательных реакций при введении животному - млекопитающему (а также, человеку). В предпочтительном использовании в данном описании, термин "фармацевтически приемлемые" означает допущенные к применению органом контроля, например Комиссией по контролю за лекарствами и питательными веществами (FDA) или Европейским агентством по аттестации лекарственных препаратов(ЕМЕА), или включенными в сборник Фармакопеи США или Европейской Фармакопеи (другой всемирно признанной фармакопеи) для применения у млекопитающих, а также у человека. Предпочтительные соединения согласно заявленному изобретению включают, но не ограничены,соединениями, выбираемыми из группы, состоящей из Заявленное изобретение также относится к применению соединения формулы в качестве противогрибкового агента. Вышеуказанные соединения согласно заявленным изобретениям предназначены к применению для лечения и/или профилактики грибковых инфекций, относящихся к млекопитающим и особенно человеку. К упомянутым грибковым инфекциям, которые являются объектом лечения и/или профилактики для заявленных применений вышеуказанных соединений, относятся инфекции такие как Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger, Scopulariopsis Brevicaulis или Candida, как, например,Candida Albicans или Candida Glabrata. К упомянутым грибковым инфекциям, которые являются объектом лечения и/или профилактики для заявленных применений вышеуказанных соединений, в частности, возможно отнести инфекцию, вызываемую дерматофитами и/или плесневыми грибками, представляющими собой Tricophyton Rubrum,Tricophyton Mentagrophytes, Aspergillus Niger и/или Scopulariopsis Brevicaulis. Соединения в соответствии с заявленным изобретением можно приготовить путем связывания приемлемых 8-гидроксихинолин-7-карбоновых кислот 1-1 (или производных кислот, как например галоидангидридов или сложных эфиров) с соответствующими аминами 1-2 по примеру того, как представлено на обобщнной схеме 1. Схема 1. Альтернативно, гидроксильную группу карбоновой кислоты можно защитить (как описано в Bioorg.Med. Chem., 14, 2006, 5742-5755 или Synthesis, 12, 1997,1425-1428 или DE 540842) до реакции связывания с амином и снять защиту в последнем этапе. Способы связывания карбоновых кислот с аминами для получения карбоксамидов хорошо известны из уровня техники. Приемлемые способы описаны, например, в Jerry March, Advanced Organic Chemistry, 4-е издание, John WileySons, 1992, стр. 417-425. Способы защиты и снятия защиты ароматических гидроксильных групп хорошо известны из уровня техники. Защиту групп осуществляют в соответствии со стандартными методами органического синтеза(Green T.W. and Wuts P.G.M. (1991) Protecting Groups in Organic Synthesis, John Wiley et Sons). Специалисту в данной области техники совершенно понятно, что описанные синтетические реакции носят репрезентативный характер, при этом даже рядовым специалистам в области органической химии известны альтернативные процессы синтеза. Следующие примеры носят иллюстративный характер для объяснения сути и вариантов практического воплощения заявленного изобретения. Примеры не носят ограничительного характера касательно сути или объема заявленных претензий по описанному изобретению. Эксперименты 1. Химический синтез Если не указано иначе, все исходные реагенты присутствовали на рынке в коммерческих объемах и использованы без какого-либо предварительного очищения. Соединения согласно заявленному изобретению можно полностью получить, применяя традиционный способ синтеза. В данных реакциях также возможно использование вариантов, которые сами по себе известны специалистам с начальными познаниями в данной области техники, но не упоминаются в подробностях. Помимо этого, в контексте описанных схем химических реакций и примеров практического воплощения, специалистам с начальными познаниями в данной области техники могут также быть известны прочие методы получения соединений согласно заявленному изобретению. Если не указано иначе, все показатели определены выше. При ссылке на использование "аналогичной" методики, в особенности с точки зрения восприятия специалистами в данной области техники, такая методика может включать небольшие вариации параметров, например температуры реакции, объемов реагента/растворителя, времени реакции, условия выделения продуктов реакции или параметры хроматографической очистки. Аббревиатуры, используемые в данной заявке, в частности в таблицах и в примерах, приведены в табл. 1. Если не указано иначе в тексте, все температуры указаны в С (градусах Цельсия) или K (градусах Кельвина). Спектры, полученные при помощи протонного ядерного магнитного резонанса (1H-NMR), зарегистрировали на установке Brucker 300 МГц. Химические сдвиги выражены в миллионных долях (ppm,units). Структуры расщепления описывают явственную мультиплетность и обозначают как s (синглет), d(дуплет), t (триплет), q (квартет), quint (квинтет), sxt (секстет), m (мультиплет), br. s (широкий синглет). Данные LC-MS записали при следующих условиях:UPLC при помощи устройства Sample Manager и с 2996 детектором фотодиодной матрицы PDA Detector (Waters), связанным с помощью интерфейса с масс-спектрометром с одной квадрупольной линзойZQ (Waters). Интерфейс ZQ: ESI позитивный режим. Полное сканирование от 102 до 900 атомных массовых единиц. Капиллярная сила 3.2V, конус 25V, центрифуга 3V, коэффициент удерживания 0.3V, температура источника 115 С, температура десольватации 350 С, расход газа 800 л/ч, конуса 100 л/ч. Способ А: Колонка Aquity UPLC-BEH C18 (502.1 мм, 1.7 мкм). Расход газа 0,6 мл/мин, колонка при 40 С, впрыскивание 2 мкл. Подвижные фазы: А фаза = вода/CH3CN 95/5 + 0.1% TFA, В фаза = вода/CH3CN = 5/95 + 0.1% TFA. Градиент: 0-0.25 мин (А: 95%, В: 5%), 3.30 мин (А: 0%, В: 100%), 3.30-4.00 8-Гидрокси-N-(тиофен-2-илметил)хинолин-7-карбоксамид. Смесь 8-гидроксихинолин-7-карбоновой кислоты (100 мг, 0,53 ммоль) и ди(1 Н-имидазол-1 ил)метанона (86 мг, 0,53 ммоль) в THF (8 мл) нагрели до 45 С в течение ночного времени суток, в азоте. Реакционную смесь оставили для охлаждения до комнатной температуры и добавили тиофен-2 илметанамин (30 мг, 0,26 ммоль). Полученную смесь перемешали при комнатной температуре в течение 24 ч. Добавили добавочный тиофен-2-илметанамин (15 мг, 0,13 ммоль) и реакционную смесь перемешали при комнатной температуре в течение 60 ч. Реакционную смесь остудили с применением Н 2 О и THF выпарили до высушенного состояния. Насыщенный раствор бикарбоната натрия добавили к водной фазе и дважды экстрагировали с применением DCM. Сепарированные органические вещества высушили надNa2SO4, отфильтровали и подвергли концентрированию при пониженном давлении. Остаток подвергли очистке при помощи картриджа SPE-SI (2 г, соотношение DCM к DCM:MeOH 99:1), получая титульное соединение (40 мг, 0,14 ммоль) в виде желтого твердого вещества. LC-MS m/z (отношение массы к заряду) (EST): 285.1 (МН+), Rt= 1.41 мин (способ А). 1H-NMR (DMSO-d6) : 9.43 (br. s, 1H); 8.91 (dd, 1H); 8.35 (dd, 1H); 8.00 (d, 1H); 7.65 (dd, 1H); 7.317.48 (m, 2H); 7.09 (dd, 1H); 6.99 (dd, 1H); 4.40-4.92 (m, 2H) Согласно методике, аналогичной описанной выше, получили дополнительные соединения согласно заявленному изобретению (табл. 2). 2. Определение активности Методы и результаты Микроорганизмы, используемые для определения противогрибковой активности Trichophyton Rubrum (ATCC 28188, PBI International); Trichophyton Mentagrophytes (АТСС 9533, PBI International); Aspergillus Niger (ATCC 16404, PBI International); Scopulariopsis Brevicaulis (ATCC 36840, DSMZ); Candida Albicans (ATCC 90028, PBI International); Candida Glabrata (ATCC 90030, DSMZ). Приготовление и консервация Штаммы приготовили из лиофилизированного препарата в ампулах или капсулах. Изолирование суспензий провели на картофельном агаре с декстрозой (PDA) для определения чистоты штаммов. Затем осуществили массивный рост штаммов путем посева штрихом на чашках с PDA. Инкубацию провели при 30 С в течение 48-72 ч (грибки Кандида) и в течение 7-10 дней (гифомицеты). Дрожжегрибковые колонии и гифомицетные конидии собрали с 3-5 мл RPMI-раствора 1640 + 50% глицерола и аликвоты заморозили при -80 С. Определение противогрибковой чувствительности Минимальную подавляющую концентрацию (МПК) соединений определили посредством теста на противогрибковую чувствительность микровпитываемости питательной среды, с использованием метода, разработанного в рамках работ по соглашению с Национальным комитетом по клиническим и лабораторным стандартам (NCCLS) (National Committee for Clinical Laboratory Standards.M38-A. 2002; vol. 22, No. 16). Опыты провели на RPMI-растворе 1640 с L-глутаминовой средой, разбавленной буфером до рН 7 с 0,165 М 3-(N-морфолин)пропансульфоновой кислоты (MOPS) и 10 М NaOH, с добавлением 18 г глюкозы на 1 л. Опыты провели с использованием 96 луночного стерильного планшета (размер инокулята 1105 КОЕ/мл). Стоковые растворы соединений приготовили при 12,8 мг/мл в 100% DMSO. Приготовили серию разбавленных в 2 раза составов на планшете с использованием RPMI-раствора 1640. Конечные концентрации варьировались в пределах от 0,125 до 128 мкг/мл при 1% DMSO. МПК трактуют как самую низкую концентрацию противогрибкового агента, которая предотвращает любой заметный рост, и определили после 48 ч инкубации в случае дрожжевых клеток (35 С) и после пяти дней инкубации в случае гифомицетов (35 С). Результаты В табл.3 представлены значения МПК для наиболее предпочтительных соединений рассчитали как средние геометрические значения от значений, полученных в ходе проведения двух единичных экспериментов. Помимо этого соединение с кодовым обозначением Е 8 в ЕР 1669348 А 1 синтезировали вместе с новым соединением (с кодовым обозначением NiK-29298), не включенным в число тех соединений, которые раскрыты в ЕР 1669348 А 1, а также в заявленном изобретении, которое может служить в качестве связующего между классом соединений, описанным в заявленном изобретении и соединениями, раскрытыми в ЕР 1669348 А 1 (табл. 4). Таблица 4 В табл. 5 приведены значения МПК для данных соединений, тестированных на одних и тех же микроорганизмах, использовали для оценки эффективности производных, описанных в заявленном изобретении. Можно отметить, что все соединения, перечисленные в табл. 3, активны в отношении всех 6 тестированных штаммов, включая дрожжи, дерматофиты и плесневые грибки. Такой широкий спектр действия соединений в соответствии с заявленным изобретением позволяет эффективно подавлять все типы грибковых инфекций у человека или животных, включая кожные инфекции, инфекции кожи головы и ногтей, в большинстве случаев вызываемые дерматофитами; вагинальные, инфекции полости рта и ЖКТ,в большинстве случаев вызываемые дрожжевыми грибками; инфекции ушей, легких, глаз, и прочие системные инфекции, в большинстве случаев вызываемые плесневыми грибками. С другой стороны, соединение Е 8, раскрытое в ЕР 1669348 А 1, и соединение NiK-29298, характеризующееся наличием одинакового звена с хинолином, описанным в ЕР 1669348 А 1, активны только в отношении дрожжевых клеток и не показывают сколь-нибудь значительной активности в отношении других штаммов, включая дерматофиты и плесневые грибки. Механизм действия Из уровня техники известно, что циклопирокс, один из наиболее эффективных противогрибковых агентов широкого спектра действия, убивает грибковые клетки путем хелатировании Fe3+, т.е. путем вычленения (удаления) ионов железа из грибковых клеток, и его действие in vitro подавляется только путем добавления достаточного количества ионов Fe3+ в среду. Циклопирокс также известен из уровня техники как единственный противогрибковый агент, который вследствие своего особенного механизма действия не вызывает развития сопротивляемости грибковых штаммов. Метод определения механизма действия Для подтверждения факта того, что механизм действия соединений основан на хелатировании ионов железа, определение МПК в отношении штамма Candida glabrata (ATCC 90030) осуществили путем аддиции избыточных ионов железа (100 мкм FeCl3) в контрольную идентификационную среду. Жизнеспособность клеток, подвергнутых воздействию лекарственных препаратов, с или без ион-металла Fe3+,измерили при помощи определения значения оптической плотности на длине волны 540 нм. Соединения, описанные в примере 2, Е 8 и NiK-29298, испытали в присутствии и отсутствие 100 мкм (100 микромолей) Fe3+. Результаты приведены на фиг. 1, 2 и 3. На всех фигурах линии и пунктиры представляют данные ингибирования в процентах грибкового роста (по оси ординат) путем добавления различных концентраций противогрибковых агентов (по оси абсцисс). Голубые линии и пунктиры представляют данные экспериментов, проведенных без добавления железа, а красные - данные экспериментов, проведенных с добавлением 100 мкМ Fe3+. Как известно из уровня техники, действие циклопирокса полностью подавляется в присутствии Fe3+ и Candida glabrata вновь беспрепятственно размножается (фиг. 1). С другой стороны, Fe3+ не оказывает влияния на амфотерицин - противогрибковый агент, известный из уровня техники, с механизмом действия, отличным от механизма действия циклопирокса. Все соединения согласно заявленному изобретению оказывают эффект, сходный с действием циклопирокса, т.е. их противогрибковая активность полностью подавляется в присутствии Fe3+ (фиг. 2). В свою очередь, действие соединения Е 8, раскрытого в ЕР 1669348 А 1, и соединения NiK-29298, с хинолиновым звеном, раскрытого в ЕР 1669348 А 1, в отличие от циклопирокса и соединений согласно заявленному изобретению не было подавлено в присутствии ионов Fe3+ в среде. В заключение, соединения, раскрытые в ЕР 1669348 А 1, имеют узкий спектр действия, ограниченный активностью в отношении дрожжевых грибков, при отсутствии противогрибковой активности в отношении дерматофитов или плесневых грибков. Тем не менее, механизм их действия не зависит от хелатирования железа. С другой стороны, соединения согласно заявленному изобретению превосходят по характеристикам соединения, раскрытые в ЕР 1669348 А 1, а именно, в том, что их потенциальная противогрибковая активность имеет широкий спектр действия, в т.ч. в отношении дрожжевых грибков, дерматофитов и плесневых грибков. Данное свойство позволяет рассчитывать их эффективность при лечении целого ряда грибковых инфекций, включая инфекции кожного покрова (в т.ч. головы), ногтей, вагинальных инфекций, инфекций ротовой полости и ЖКТ, а также ушей, легких, глаз и прочих систематических инфекционных заболеваний. Помимо этого, соединения согласно заявленному изобретению превосходят по свойствам соединения, раскрытые в ЕР 1669348 А 1, в том, что механизм их действия заключается в хелатировании железа, т.е. механизм, известный из уровня техники, наличие которого позволяет избежать развития устойчивости грибковых клеток. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения общей формулы (I) или его фармацевтически приемлемой соли-арил, с факультативным замещением одним, двумя или тремя R4,-гетероцикл с факультативным замещением одним R5,-С 3-С 8-циклоалкил, причем арил представляет собой фенил; причем гетероцикл представляет собой 5-, 6-членное насыщенное или ненасыщенное кольцо, содержащее от одного до трех гетероатомов, выбираемых из группы, состоящей из азота, кислорода и серы, и включающее любую бициклическую группу, в которой любое из вышеперечисленных гетероциклических колец слито с бензольным или другим гетероциклическим кольцом; причем циклоалкил представляет собой насыщенное или ненасыщенное углеводородное кольцо,содержащее от 3 до 8 атомов углерода и включающее любую бициклическую группу, в которой вышеперечисленное кольцо соединено с бензольным, гетероциклическим или другим углеводородном кольцом; причем R4:-Н,-C1-С 6 алкил; причем R14 и R15 независимо друг от друга, выбирают из-C1-C6 алкила; где m - целое число от 0 до 1. 2. Применение по п.1, в котором гетероцикл является 2,3-дигидробензо[b][1,4]диоксином, пиридином, тиофеном, триазолом, тиазолом, изоксазолом, бензотиазолом, пиразином, имидазолом или фураном. 3. Применение по п.1, выбираемое из группы, состоящей из 8-гидрокси-N-(тиофен-2-илметил)хинолин-7-карбоксамид,8-гидрокси-N-(циклогексилметил)хинолин-7-карбоксамид,8-гидрокси-N-бензилхинолин-7-карбоксамид,8-гидрокси-N-(4-хлорбензил)хинолин-7-карбоксамид,8-гидрокси-N-(4-метоксифенил)хинолин-7-карбоксамид,8-гидрокси-N-(4-(трифторметил)бензил)хинолин-7-карбоксамид,8-гидрокси-N-фенилхинолин-7-карбоксамид,8-гидрокси-N-(2-гидроксибензил)хинолин-7-карбоксамид,8-гидрокси-N-(фуран-2-илметил)хинолин-7-карбоксамид,8-гидрокси-N-(пиридин-3-илметил)хинолин-7-карбоксамид,8-гидрокси-N-(4-метоксибензил)хинолин-7-карбоксамид,8-гидрокси-N-(4-бромбензил)хинолин-7-карбоксамид,8-гидрокси-N-(1,1-диоксидотетрагидротиен-3-ил)хинолин-7-карбоксамид,8-гидрокси-N-(4-(диметиламино)бензил)хинолин-7-карбоксамид,8-гидрокси-N-(тетрагидро-2 Н-пиран-4-ил)хинолин-7-карбоксамид,8-гидрокси-N-(4-морфолинофенил)хинолин-7-карбоксамид,8-гидрокси-N-(4-(1 Н-1,2,4-триазол-1-ил)фенил)хинолин-7-карбоксамид,8-гидрокси-N-(тиазол-2-ил)хинолин-7-карбоксамид,8-гидрокси-N-(2,3-дигидробензо[b][1,4]диоксин-6-ил)хинолин-7-карбоксамид,8-гидрокси-N-(4-морфолинобензил)хинолин-7-карбоксамид,8-гидрокси-N-5-метилизоксазол-3-ил)метил)хинолин-7-карбоксамид,- 13024115 в качестве противогрибкового агента. 5. Применение по любому из пп.1-4 для лечения и/или профилактики грибковых инфекций. 6. Применение по п.5, в котором упомянутая грибковая инфекция представляет собой инфекцию,вызываемую Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger, Scopulariopsis Brevicaulis или Candida, как, например, Candida Albicans или Candida Glabrata. 7. Применение по п.5, в котором упомянутая грибковая инфекция представляет собой инфекцию,вызываемую дерматофитами и/или плесневыми грибками. 8. Применение по п.7, в котором упомянутые плесневые грибки представляют собой TricophytonRubrum, Tricophyton Mentagrophytes, Aspergillus Niger и/или Scopulariopsis Brevicaulis. 9. Применение по п.5, в котором упомянутая грибковая инфекция не является инфекцией, вызываемой дрожжевыми грибками. 10. Применение по п.9, в котором упомянутые дрожжевые грибки являются Candida. 11. Применение по любому из пп.6-10, в котором реципиент данного лечения или профилактики представляет собой млекопитающее. 12. Применение по п.11, в котором реципиент данного лечения или профилактики - млекопитающее представляет собой человека.
МПК / Метки
МПК: C07D 407/12, C07D 215/48, C07D 413/12, A61P 31/10, C07D 401/12, C07D 409/12, C07D 417/12, A61K 31/4709
Метки: противогрибковых, 8-оксихинолин-7-карбоксамида, вторичных, производных, агентов, применение, качестве
Код ссылки
<a href="https://eas.patents.su/16-24115-primenenie-vtorichnyh-proizvodnyh-8-oksihinolin-7-karboksamida-v-kachestve-protivogribkovyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Применение вторичных производных 8-оксихинолин-7-карбоксамида в качестве противогрибковых агентов</a>
Предыдущий патент: Футеровка мельницы
Следующий патент: Полистирольные смеси
Случайный патент: Способ получения биологически активной добавки












