Использование антагонистов н4-гистаминовых рецепторов для лечения послеоперационных спаек
Формула / Реферат
1. Способ подавления формирования послеоперационных спаек между тканевыми поверхностями в полостях тела, в которых выполнялось хирургическое вмешательство, включающий введение эффективного количества по меньшей мере одного антагониста Н4-гистаминовых рецепторов в тканевые поверхности полостей тела, где указанный антагонист Н4-гистаминовых рецепторов выбран из группы, включающей (5-хлор-1Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил-1Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н4-гистаминовых рецепторов.
2. Способ по п.1, в котором по меньшей мере один антагонист Н4-гистаминовых рецепторов вводится с помощью носителя для доставки, пригодного для локального, несистемного введения терапевтического средства в поверхности тканей.
3. Способ по п.2, в котором носителем для доставки является по меньшей мере один из следующих: наночастицы, микрокапсулы, микросферы, барьеры, липосомы, липидные пены, растворы, композиции, осмотические насосы, волокна, нити, гели и пленки.
4. Способ по п.3, в котором барьер является рассасывающимся.
5. Способ по п.1, в котором по меньшей мере один антагонист Н4-гистаминовых рецепторов вводится однократной дозой.
6. Способ по п.1, в котором по меньшей мере один антагонист Н4-гистаминовых рецепторов вводится путем замедленного высвобождения.
7. Способ по п.1, в котором по меньшей мере один антагонист Н4-гистаминовых рецепторов вводится способом выброса/замедленного высвобождения.
8. Способ по п.1, в котором по меньшей мере один антагонист Н4-гистаминовых рецепторов вводится в количестве от приблизительно 0,001 мг на килограмм массы тела до приблизительно 200 мг на килограмм массы тела.
9. Способ по п.1, дополнительно включающий системное введение по меньшей мере одного антагониста Н4-гистаминовых рецепторов до хирургического вмешательства.
10. Композиция, пригодная для локального, несистемного введения лекарственного средства непосредственно в ткани полостей тела, в которых выполнялось хирургическое вмешательство, содержащая эффективное количество по меньшей мере одного антагониста Н4-гистаминовых рецепторов, выбранного из группы, включающей (5-хлор-1Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил-1Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н4-гистаминовых рецепторов, и носитель для доставки, пригодный для локального, несистемного введения по меньшей мере одного антагониста Н4-гистаминовых рецепторов.
11. Композиция по п.10, в которой носитель для доставки представляет собой по меньшей мере один из следующих: наночастицы, микрокапсулы, микросферы, барьеры, липосомы, липидные пены, растворы, композиции, осмотические насосы, волокна, нити, гели и пленки.
12. Композиция по п.10, в которой носитель для доставки содержит по меньшей мере один полимер из группы полоксамеров, полиортоэфиров, поливинилового спирта, полиангидридов, полиметакрилатов, полиметакриламидов, анионных углеводородных полимеров, полигидроксимасляной кислоты, полиацеталей, поли-l-лактида, поли-dl-лактида, поли-dl-лактид-когликолидов, поли-l-лактид-когликолидов, поли-е-капролактона, полигликолида, поли-п-диоксанонов, политриметиленкарбоната, полиалкилендигликолятов, полиоксиэфиров, полиоксамидов или глицеридных полимеров.
13. Композиция по п.10, в которой указанная композиция предназначена для введения однократной дозы по меньшей мере одного антагониста Н4-гистаминовых рецепторов.
14. Композиция по п.10, обеспечивающая замедленное высвобождение по меньшей мере одного антагониста Н4-гистаминовых рецепторов.
15. Композиция по п.10, обеспечивающая выброс/замедленное высвобождение по меньшей мере одного антагониста Н4-гистаминовых рецепторов.
16. Композиция по п.10, содержащая от приблизительно 0,001 мг по меньшей мере одного антагониста Н4-гистаминовых рецепторов на килограмм массы тела до приблизительно 200 мг по меньшей мере одного антагониста Н4-гистаминовых рецепторов на килограмм массы тела.
17. Композиция по п.11, в которой липосомы получены из L-альфа-дистеароилфосфатидилхолина, фосфатидилхолина, дипальмитоилфосфатидилхолина или дистеароилфосфатидилхолина.
18. Композиция по п.11, в которой раствор содержит кристаллоидный инстиллят, и указанный кристаллоидный инстиллят включает по меньшей мере или солевой фосфатный буфер, или физиологический раствор, или лактированный раствор Рингера.
19. Композиция по п.11, в которой раствор содержит вязкий инстиллят, при этом указанный вязкий инстиллят содержит по меньшей мере один носитель из группы, включающей декстраны, циклодекстраны, гидрогели, карбоксиметилцеллюлозу, полисахариды, гиалуроновую кислоту, поперечно-сшитую гиалуроновую кислоту, а также хондроитинсульфаты.
20. Композиция по п.11, в которой барьер является рассасывающимся.
21. Композиция по п.20, в которой рассасывающийся барьер содержит по меньшей мере одно вещество из группы, включающей гиалуроновую кислоту, производные целлюлозы, коллагены, полиэтиленгликоли, плуроники, хитин, хитозаны, декстраны, полимеры глюкозы, полимеры углеводородов, желатин, гликозаминогликаны, полиакриламиды, поливинилпирролидоны, поливиниловый спирт, полиметакрилаты, альгинаты, крахмал и полипептиды.
22. Способ подавления формирования послеоперационных спаек между тканевыми поверхностями в полостях тела, в которых выполнялось хирургическое вмешательство, включающий системное введение эффективного количества по меньшей мере одного антагониста Н4-гистаминовых рецепторов, выбранного из группы, включающей (5-хлор-1Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил-1Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н4-гистаминовых рецепторов.
23. Способ по п.22, в котором введение выполняется перед хирургическим вмешательством.
24. Способ по п.22, в котором введение выполняется после хирургического вмешательства.
Текст
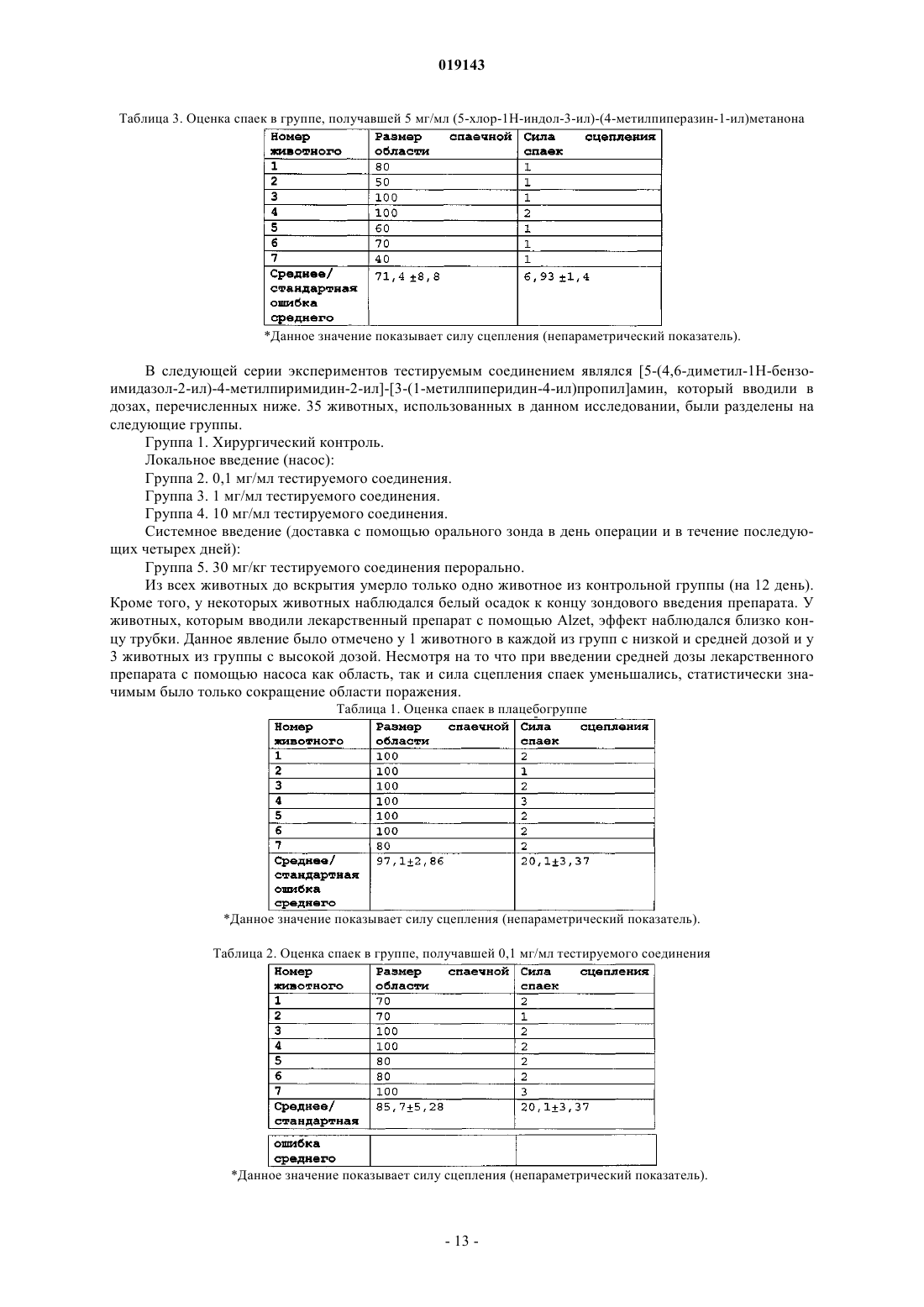
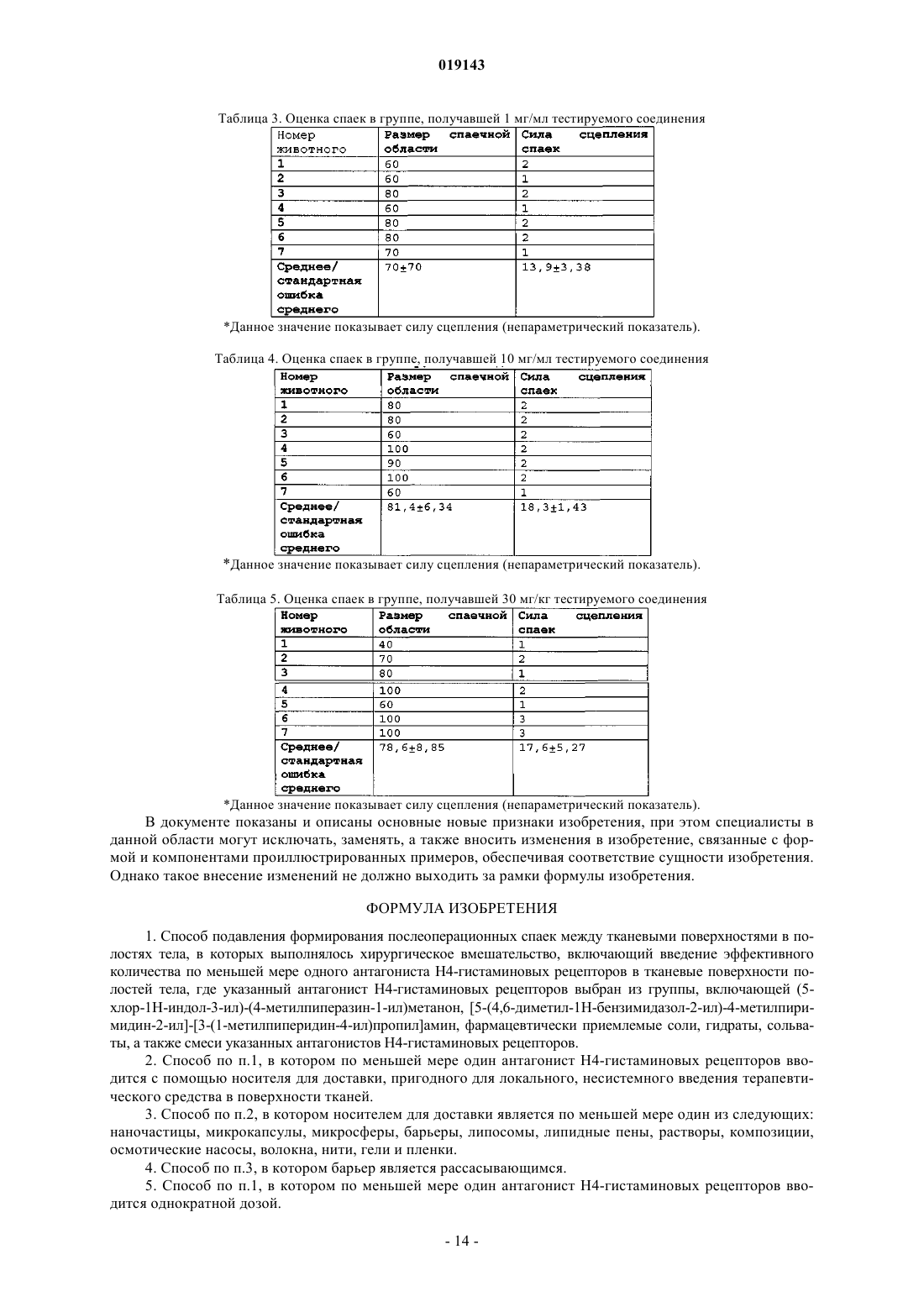
ИСПОЛЬЗОВАНИЕ АНТАГОНИСТОВ Н 4-ГИСТАМИНОВЫХ РЕЦЕПТОРОВ ДЛЯ ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННЫХ СПАЕК Изобретение включает способы подавления формирования послеоперационных спаек между поверхностями тканей в полостях тела, в которых выполнялось хирургическое вмешательство,к которым относится введение антагонистов Н 4-гистаминовых рецепторов системно,непосредственно на поверхности тканей полостей тела или обоими способами, а также системы доставки и композиции, пригодные для локального, несистемного введения лекарственного средства в организм и непосредственно в ткани полостей тела, в которых выполнялось хирургическое вмешательство.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область применения изобретения Изобретение связано с использованием антагонистов Н 4-гистаминовых рецепторов для подавления или предупреждения послеоперационных спаек между тканевыми поверхностями в полостях тела, а также с композициями, содержащими антагонист Н 4-гистаминовых рецепторов, для введения в тело для подавления или предупреждения послеоперационных спаек. Предпосылки создания изобретения Спайки, образующиеся в особенности после перитонеальных, торакальных и спинальных операций,являются основной причиной послеоперационных осложнений и смертности. Аппендэктомия и гинекологические операции, например, наиболее часто способствуют образованию клинически значимых спаек. Наиболее серьезным осложнением интраперитонеальных спаек является кишечная непроходимость. Кроме того, спайки ассоциированы с хроническими или рецидивирующими тазовыми болями и бесплодием у женщин, компрессией нервов и болями в позвоночнике, послеоперационными осложнениями торакальных вмешательств, а также потерей подвижности кисти после реконструктивных операций. Патогенез образования спаек является многофакторным и не до конца изученным процессом. Первый этап, предположительно, связан с избыточным отложением фибрина, что ведет к формированию фиброзных образований. Затем следует оформление фиброзных образований с участием различных клеточных элементов, в том числе фибробластов. Были подробно изучены различные подходы к предупреждению формирования спаек (diZerega, G.S.Rodgers, K. Е., "Prevention of Postoperative Adhesions" в The Peritoneum, diZerega, G. S.Rodgers, K. Е., eds., Springer-Verlag, New York, c. 307- 369 (1992. В целом, лечение осуществляется одним из нескольких возможных способов: ограничение аппозиции тканей; уменьшение местного воспаления в тканях; предотвращение отложения фибрина и устранение отложений фибрина; снижение пролиферации клеток (таких как фибробласты); угнетение выработки коллагена. Например, были попытки использования физических барьеров для предупреждения формирования спаек ограничением аппозиции тканей во время критического периода восстановления, минимизируя таким образом образование фибриновой матрицы между тканевыми поверхностями. В качестве ограждающих средств использовались как механические барьеры, так и вязкие растворы. Комбинированная эффективность была достигнута использованием пленочных барьеров, например, политетрафторэтилена. Подобные мембраны также не идеальны, так как они должны быть сшиты с поверхностью и не способны рассасываться. Рассасывающиеся барьеры являются предпочтительными, однако некоторые исследования показали, что эффективность таких барьеров в предупреждении спаек невысока. Также была изучена возможность использования жидких барьеров для предупреждения спаек; например, испытания хондроитинсульфата и карбоксиметилцеллюлозы на животных моделях дали интересные результаты. Другим изученным подходом является устранение отложений фибрина. Протеолитические ферменты (то есть пепсин, трипсин и папаин) теоретически должны усиливать местную фибринолитическую систему и ограничивать формирование спаек, однако данные ферменты быстро нейтрализуются перитонеальным экссудатом, что делает их практически бесполезными для профилактики спаек. Несмотря на то что оправдано применение различных фибринолитиков, например фибринолизина, стрептокиназы и урокиназы, потенциальная сложность клинического использования данных ферментов в послеоперационной терапии заключается в усилении кровотечений в результате их введения. Также была оценена возможность применения ингибиторов коллагена. Биосинтез коллагена включает в себя уникальные посттрансляционные модификации про-альфа-цепей. Гидроксилирование пролил- и лизилостатков - ключевой этап в образовании коллагена, критически важный для нормального формирования тройной спирали и межмолекулярных сшивок. Когда посттрансляционные процессы ингибируются, формируется неспиральный проколлаген, который затем разлагается внутриклеточными протеазами и, как нефункциональный белок, медленно выводится во внеклеточный матрикс. Включение пролиновых аналогов, например, цис-4-гидрокси-1-пролина (сНур, cis-4hydroxy-L-proline) в формирующиеся про-альфа-цепи способствует снижению внеклеточного накопления коллагена. Полагают, что такие средства оказывают в большей степени общее действие, ингибируя синтез коллагена и тем самым предотвращая некоторые патофизиологические последствия фиброза, такие как атеросклероз и гипертензия. Деформируя углы связи и формируя стерические препятствия в полипептидных цепях, сНур ингибирует сворачивание про-альфа-цепей в стабильные тройные спирали. Прочие пролиновые аналоги, например цис-4-фторпролин, цис-4-бромпролин и 3,4-дегидропролин, оказывают аналогичное действие и могут ингибировать другие посттрансляционные этапы. Соединение 3,4 дегидропролин является пролиновым аналогом, который также может ингибировать другие посттрансляционные этапы. Например, 3,4-дегидропролин подавляет активность пролилгидроксилазы. Однако признан тот факт, что сНур может быть потенциально токсичным при неправильном и особенно при длительном использовании, что ограничивает его клиническое применение. В качестве средства, предупреждающего спайки, на крысах было изучено соединение N-(3,4 диметоксициннамоил)антраниловой кислоты, широко известное как траниласт (Shinya, A., et.al. (1999),"The Prevention of Postoperative Intraperitoneal Adhesions by Tranilast: N-(3,4-dimethoxycinnamoyl) Anthranilic Acid", Jpn J Surg. 29:51-54). В данном исследовании Shinya и др. использовали соединение сис-1 019143 темно, орально как в пред-, так и в постоперационном периоде на интраперитонеальной модели спаек у крыс. Однако необходимо отметить, что в модели, использованной в указанном исследовании, травматическая ишемия в месте операции не выполнялась. Таким образом считается, что клиническая ситуация при данном типе травмы у человека, при которой кровоток отсутствует, была смоделирована не точно. Отсутствие кровотока в значительной степени способствует снижению активности плазминогена в тканях, отложению фибрина и формированию спаек. Соответственно, считается, что несмотря на признание эффективности систематического введения траниласта, ценность и обоснованность данного исследования в отношении подавления или предупреждения спаек сомнительна. Была оценена эффективность противовоспалительных лекарственных средств для предупреждения послеоперационных спаек, т.к. они могут снижать высвобождение фибринозного экссудата при воспалении в месте операции. Были протестированы два класса данных лекарственных средств - кортикостероиды и нестероидные противовоспалительные средства. Применение кортикостероидов в исследованиях на животных не показало в целом обнадеживающих результатов. Клиническое применение кортикостероидов ограничено их иными фармакологическими свойствами. Нестероидные противовоспалительные лекарственные средства перспективны для подавления формирования послеоперационных спаек (Rodgers,K. Е., "Nonsteroidal anti-inflammatory drugs (NSAIDs) in the treatment of Postsurgical adhesion" в Treatmentof Post-Surgical Adhesions, diZerega, G. S. et al., eds., Wiley-Liss, New York, с 119-129 (1990. Однако, как было указано в настоящем документе, отдельный класс противовоспалительных препаратов - блокаторов Н 4-гистаминовых рецепторов - показал эффективность в подавлении и предупреждении послеоперационных спаек в моделях in vivo. Модуляция Н 4-рецепторов контролирует высвобождение медиаторов воспаления и подавляет мобилизацию лейкоцитов, обеспечивая тем самым возможность предупреждать и (или) лечить Н 4 опосредованные заболевания и состояния, в том числе разрушительные последствия воспалений. Вследствие их преимущественной экспрессии на иммунокомпетентных клетках, Н 4-рецепторы тесно связаны с регулирующими функциями гистамина в иммунном ответе. Биологическая активность гистамина в контексте иммунологии и аутоиммунных заболеваний тесно связана с аллергическими реакциями и их разрушительными последствиями, например, воспалением. Воспалительную реакцию может вызывать физическое воздействие (в т.ч. травма), химическое воздействие, инфекция, а также попадание инородного тела. Воспалительная реакция характеризуется болью,повышением температуры, покраснением, отеком, снижением функций, либо сочетанием указанных симптомов. При дегрануляции тучных клеток (экзоцитозе) высвобождается гистамин, что приводит к воспалительной реакции, которая первоначально может проявляться гистаминобусловленными волдырями и воспалительной гиперемией. К активации, мобилизации и дегрануляции тучных клеток может приводить широкий спектр иммунологических (например, аллергены и антитела) и неиммунологических(например, химических) стимулов. Активация тучных клеток запускает аллергические воспалительные реакции, которые в свою очередь являются причиной мобилизации других эффекторных клеток, участвующих в дальнейшем воспалительном процессе. Было доказано, что гистамин вызывает хемотаксис тучных клеток у мышей (Hofstra, et al., 2003). Хемотаксис не происходит у мыши с выключенными Н 4 рецепторами. Более того, реакция блокируется Н 4-специфическими антагонистами, но не антагонистами(1), 404-413). Реакция хемотаксиса тучных клеток на гистамин опосредуется Н 4 -гистаминовыми рецепторами (Thurmond, et al., 2004). Было доказано, что гистамин является фактором хемотаксиса эозинофилов (O'Reilly, М., et al., J.Recept. Signal Transduction 2002, 22(1-4), 431-448; Buckland, K.F., et al., Br. J. Pharmacol. 2003, 140(6),1117-1127; Ling et al., 2004). С использованием H4-селективных лигандов было доказано, что гистамининдуцированный хемотаксис эозинофилов опосредуется через Н 4-рецепторы (Buckland, et al., 2003; Linget al., 2004). Экспрессия молекул адгезии клеточной поверхности CD11b/CD18 (LFA-1) и CD54 (ICAM-1) на эозинофилах увеличивается после лечения гистамином (Ling, et al., 2004). Такое увеличение блокируют антагонисты Н 4-рецепторов, в отличие от антагонистов H1-, H2- или Н 3-рецепторов. Н 4-гистаминовые рецепторы (H4R) также функционируют в дендритных и Т-клетках. У человека в дендритных клетках (производных моноцитов) стимуляция H4R угнетает продукцию IL-12 р 70 и запускает гистаминопосредованный хемотаксис (Gutzmer, R., et al., J. Immunol. 2005, 174 (9), 5224-5232). Сообщалось также о роли Н 4-рецепторов в CD8+ Т-клеток. Gantner, et al., (2002) показали, что как Н 4, так и Н 2 рецепторы контролируют гистамининдуцированное высвобождение IL-16 из CD8+ Т-клеток человека. IL16 обнаружен в бронхоальвеолярной жидкости больных аллергической или гистамин-обусловленной астмой (Mashikian, V.M., et al., J. Allergy Clin. Immunol. 1998, 101 (6, Part 1), 786-792; Krug, N., et al., Am.J. Resp. Crit. Care Med. 2000, 162(1), 105-111), и считается, что он играет важную роль в миграции CD4+клеток. Активность рецепторов в этих типах клеток играет большую роль в адаптивных иммунных реакциях, в том числе при аутоиммунных заболеваниях.In vivo антагонисты Н 4-рецепторов блокировали нейтрофилию при зимозаниндуцированном перитоните и смоделированном плеврите (Takeshita, K., et al., J. Pharmacol. Exp. Ther. 2003, 307(3), 1072-1078;Thurmond, et al., 2004). Кроме того, антагонисты Н 4-рецепторов показали активность в широко приме-2 019143 няемой и имеющей хорошие характеристики модели колита (Varga, С, et al., Eur. J. Pharmacol. 2005, 522(1-3), 130-138). Эти результаты подтверждают вывод о том, что антагонисты Н 4-рецепторов способны оказывать противовоспалительное действие in vivo. Настоящее изобретение основано на использовании антагонистов Н 4-гистаминовых рецепторов для подавления или предупреждения образования послеоперационных спаек. Данные соединения и их композиции могут быть доставлены непосредственно к месту операции либо могут применяться системно для подавления или предупреждения образования послеоперационных спаек. Краткое описание изобретения Целью настоящего изобретения является преодоление или смягчение по меньшей мере одного из недостатков стандартных методик и (или) известных способов, либо предоставление пригодных альтернатив для последних. Настоящее изобретение относится к способу подавления формирования послеоперационных спаек между тканевыми поверхностями в полостях тела, в которых выполнялось хирургическое вмешательство, включающему введение эффективного количества по меньшей мере одного антагониста Н 4 гистаминовых рецепторов в тканевые поверхности полостей тела, где указанный антагонист Н 4 гистаминовых рецепторов выбран из группы, включающей (5-хлор-1 Н-индол-3-ил)-(4-метилпиперазин 1-ил)метанон, [5-(4,6-диметил-1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин 4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н 4-гистаминовых рецепторов. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится с помощью носителя для доставки, пригодного для локального, несистемного введения терапевтического средства в поверхности тканей. В предпочтительном варианте осуществления настоящего изобретения носителем для доставки является по меньшей мере один из следующих: наночастицы, микрокапсулы, микросферы, барьеры, липосомы, липидные пены, растворы, композиции, осмотические насосы, волокна, нити, гели и пленки. В предпочтительном варианте осуществления настоящего изобретения барьер является рассасывающимся. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится однократной дозой. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится путем замедленного высвобождения. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится способом выброса/замедленного высвобождения. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится в количестве от приблизительно 0,001 мг на килограмм массы тела до приблизительно 200 мг на килограмм массы тела. В предпочтительном варианте осуществления настоящего изобретения способ дополнительно включает системное введение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов до хирургического вмешательства. В другом аспекте настоящее изобретения относится к композиции, пригодной для локального, несистемного введения лекарственного средства непосредственно в ткани полостей тела, в которых выполнялось хирургическое вмешательство, содержащей эффективное количество по меньшей мере одного антагониста Н 4-гистаминовых рецепторов, выбранного из группы, включающей (5-хлор-1 Н-индол-3-ил)(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил-1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н 4-гистаминовых рецепторов, и носитель для доставки, пригодный для локального, несистемного введения по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. В предпочтительном варианте осуществления настоящего изобретения носитель для доставки представляет собой по меньшей мере один из следующих: наночастицы, микрокапсулы, микросферы, барьеры, липосомы, липидные пены, растворы, композиции, осмотические насосы, волокна, нити, гели и пленки. В предпочтительном варианте осуществления настоящего изобретения носитель для доставки содержит по меньшей мере один полимер из группы полоксамеров, полиортоэфиров, поливинилового спирта, полиангидридов, полиметакрилатов, полиметакриламидов, анионных углеводородных полимеров, полигидроксимасляной кислоты, полиацеталей, поли-l-лактида, поли-dl-лактида, поли-dl-лактидкогликолидов, поли-l-лактид-когликолидов, поли-е-капролактона, полигликолида, поли-п-диоксанонов,политриметиленкарбоната, полиалкилендигликолятов, полиоксиэфиров, полиоксамидов или глицеридных полимеров. В предпочтительном варианте осуществления настоящего изобретения композиция предназначена для введения однократной дозы по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. В предпочтительном варианте осуществления настоящего изобретения композиция обеспечивает замедленное высвобождение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов.-3 019143 В предпочтительном варианте осуществления настоящего изобретения композиция обеспечивает выброс/замедленное высвобождение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. В предпочтительном варианте осуществления настоящего изобретения композиция содержит от приблизительно 0,001 мг по меньшей мере одного антагониста Н 4-гистаминовых рецепторов на килограмм массы тела до приблизительно 200 мг по меньшей мере одного антагониста Н 4-гистаминовых рецепторов на килограмм массы тела. В предпочтительном варианте осуществления настоящего изобретения предлагается композиция, в которой липосомы получены из L-альфа-дистеароилфосфатидилхолина, фосфатидилхолина, дипальмитоилфосфатидилхолина или дистеароилфосфатидилхолина. В предпочтительном варианте осуществления настоящего изобретения раствор содержит кристаллоидный инстиллят, и указанный кристаллоидный инстиллят включает по меньшей мере или солевой фосфатный буфер, или физиологический раствор, или лактированный раствор Рингера. В предпочтительном варианте осуществления настоящего изобретения раствор содержит вязкий инстиллят, при этом указанный вязкий инстиллят содержит по меньшей мере один носитель из группы,включающей декстраны, циклодекстраны, гидрогели, карбоксиметилцеллюлозу, полисахариды, гиалуроновую кислоту, поперечносшитую гиалуроновую кислоту, а также хондроитинсульфаты. В предпочтительном варианте осуществления настоящего изобретения барьер является рассасывающимся. В предпочтительном варианте осуществления настоящего изобретения рассасывающийся барьер содержит по меньшей мере одно вещество из группы, включающей гиалуроновую кислоту, производные целлюлозы, коллагены, полиэтиленгликоли, плуроники, хитин, хитозаны, декстраны, полимеры глюкозы, полимеры углеводородов, желатин, гликозаминогликаны, полиакриламиды, поливинилпирролидоны,поливиниловый спирт, полиметакрилаты, альгинаты, крахмал и полипептиды. В ещ одном аспекте настоящее изобретение относится к способу подавления формирования послеоперационных спаек между тканевыми поверхностями в полостях тела, в которых выполнялось хирургическое вмешательство, включающий системное введение эффективного количества по меньшей мере одного антагониста Н 4-гистаминовых рецепторов, выбранного из группы, включающей (5-хлор-1 Ниндол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил-1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н 4-гистаминовых рецепторов. В предпочтительном варианте осуществления настоящего изобретения введение выполняется перед хирургическим вмешательством. В предпочтительном варианте осуществления настоящего изобретения введение выполняется после хирургического вмешательства. Описанные выше варианты осуществления, особенности и достоинства изобретения будут очевидны из следующего подробного описания и практического осуществления изобретения. Подробное описание изобретения В соответствии с настоящим изобретением методы, использующие введение определенных антагонистов Н 4-гистаминовых рецепторов и фармацевтических композиций, пригодных для системного или локального введения таких соединений в ткани тела, способствуют подавлению или предупреждению образования спаек между поверхностями тканей и (или) органов, наиболее частой причиной которых является предшествующее хирургическое вмешательство. Предупреждение образования спаек после хирургического вмешательства предпочтительно, однако достаточно такого подавления формирования спаек, при котором степень развития или размер спаечного образования будут достаточно низкими, чтобы не приводить к серьезным осложнениям, ассоциированным со спайками, в соответствии с описанным в настоящем документе. Способы и композиции, относящиеся к изобретению, показали высокую эффективность в подавлении послеоперационного формирования спаек, формирующихся после перитонеальных операций. Настоящее изобретение также находит применение и в других ситуациях, например, в сердечнососудистой, ортопедической, торакальной, офтальмологической, реконструктивной хирургии (например,кисти), при операциях на ЦНС и т.д., где образование спаек является серьезным осложнением. Кроме того, также желательно подавление формирования спаек либо локуляции, спровоцированной лекарственными средствами при внутрибрюшинном введении химиотерапевтических препаратов либо при назначении обезболивающих препаратов, например морфина. К настоящему изобретению относится возможность комбинации антагонистов Н 4-гистаминовых рецепторов с фармацевтическими композициями,содержащими химиотерапевтические или иные терапевтические средства с целью получения не только терапевтического эффекта от данных средств, но также для подавления образования спаек, которые могут формироваться при введении таких фармацевтических композиций. Настоящее изобретение основано на открытии, связанном с тем, что соединения антагонистов Н 4 рецепторов, например, (5-хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)-метанон и [5-(4,6-диметил-1 Нбензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, известные своей активностью в отношении Н 4-рецепторов, которые вовлечены в такие процессы как воспаление, аллер-4 019143 гия и астма, эффективно ослабляют или предупреждают формирование спаек между тканевыми поверхностями в полостях тела после хирургических вмешательств при введении непосредственно в ткани и полости тела в количестве и при условиях, необходимых для подавления формирования послеоперационных спаек. Кроме того, данные соединения эффективны при системном введении до и (или) после хирургического вмешательства. В формировании спаек участвуют, помимо прочего, такие процессы, как воспалительные реакции,рост и дифференциация клеток, ангиогенез, обновление внеклеточного матрикса, ремоделирование тканей и апоптоз (Chegini, N. (2002), "Peritoneal Molecular Environment, Adhesion Formation and Clinical Implication", Frontiers in Bioscience 7, e91-115, 1 апреля 2002 г.). Однако ни один из указанных возможных механизмов действия сам по себе не дает достаточного основания, чтобы предположить эффективность соединений антагонистов Н 4-гистаминовых рецепторов в подавлении формирования спаек. В настоящем документе описаны соединения, эффективные в отношении подавления или предупреждения формирования послеоперационных спаек: описаны (5-хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)-метанон и[5-(4,6-диметил-1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, а также фармацевтически приемлемые соли, гидраты, сольваты и смеси таких соединений. Термин "фармацевтически приемлемая соль" означает соль свободной кислоты или основание антагониста Н 4-гистаминовых рецепторов, биологически толерантная или иным образом биологически приемлемая для введения в организм человека. Общая информация представлена в работе S.M. Berge, et al.,"Pharmaceutical Salts", J. Pharm. Sci., 1977, 66:1-19, и "Handbook of Pharmaceutical Salts, Properties, Selection, and Use", Stahl and Wermuth, Eds., Wiley-VCH and VHCA, Zurich, 2002. Предпочтительными являются фармацевтически приемлемые соли, которые обладают фармакологической эффективностью, не обладают чрезмерной токсичностью и при контакте с тканями пациента не вызывают раздражения или аллергических реакций. Антагонисты Н 4-гистаминовых рецепторов могут иметь в своем составе группы с кислотными свойствами, группы с основными свойствами, или оба типа функциональных групп и, соответственно, могут реагировать с рядом неорганических и органических оснований, а также неорганических и органических кислот с образованием фармацевтически приемлемых солей. Примеры фармацевтически приемлемых солей включают: сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты,моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты,пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксиленсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты,цитраты, лактаты, -гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты,нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты. Если антагонист Н 4-гистаминовых рецепторов содержит основной атом азота, то необходимая фармацевтически приемлемая соль может быть изготовлена по любой известной методике, например обработкой свободного основания неорганической кислотой, в том числе хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, сульфаминовой кислотой, азотной кислотой, борной кислотой, фосфорной кислотой и им подобными или органической кислотой, в том числе уксусной кислотой, фенилуксусной кислотой, пропионовой кислотой, стеариновой кислотой, молочной кислотой,аскорбиновой кислотой, малеиновой кислотой, гидроксималеиновой кислотой, изэтионовой кислотой,янтарной кислотой, валериановой кислотой, фумаровой кислотой, малоновой кислотой, пировиноградной кислотой, щавелевой кислотой, гликолевой кислотой, салициловой кислотой, олеиновой кислотой,пальмитиновой кислотой, лауриновой кислотой, пиранозидильной кислотой, такой как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислотой, такой как миндальная кислота, лимонная кислота или винная кислота, аминокислотой, такой как аспарагиновая кислота или глутаминовая кислота, ароматической кислотой, такой как бензойная кислота, 2-ацетоксибензойная кислота, нафтойная кислота или коричная кислота, сульфоновой кислотой, такой как лаурилсульфоновая кислота, ртолуолсульфоновая кислота, метансульфоновая кислота, этансульфоновая кислота, а также любой совместимой смесью кислот, как приведенных в настоящем документе, так и любыми иными кислотами или смесью кислот, которые рассматриваются как эквивалентные или приемлемые заменители с учетом обычного уровня владения данной технологией. Если антагонист Н 4-гистаминовых рецепторов является кислотой, например, карбоновой кислотой или сульфоновой кислотой, необходимая фармацевтически приемлемая соль может быть приготовлена по любой допустимой методике, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла, гидроксид щелочно-земельного металла, любой совместимой смесью оснований, как приведенных в настоящем документе, так и любых иных оснований, и их смесями, которые рассматриваются как эквивалентные или приемлемые заменители с учетом обычного уровня владения данной технологией. Типовые примеры соответствующих солей включают органические соли - производные аминокислот, таких как глицин и аргинин, аммониевые соли, карбонаты, бикарбонаты, первичные, вторичные и третичные-5 019143 амины, циклические амины, такие как бензиламины, пирролидины, пиперидин, морфолин и пиперазин, и неорганические соли - производные натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Предпочтительными являются антагонисты Н 4-гистаминовых рецепторов, в том числе их фармацевтически приемлемые соли, гидраты, сольваты, а также смеси, обладающие невысокой токсичностью или не обладающие токсичностью как на локальном, так и на системном уровне, пригодные для использования в организме животного, а также в организме человека. Специалист в данной области способен определить такие соединения. В способах в рамках настоящего изобретения антагонисты Н 4-гистаминовых рецепторов используются для подавления формирования послеоперационных спаек. Термин "подавлять" или "подавление",используемый в настоящем документе, относится к введению активного средства или соединения из настоящего изобретения в полости тела с целью получения терапевтического или профилактического эффекта посредством модуляции активности Н 4-гистаминовых рецепторов. Подавление подразумевает обратное развитие, амелиорацию, смягчение, замедление формирования, уменьшение выраженности либо предупреждение послеоперационных спаек. В соответствии с настоящим изобретением пригодные антагонисты Н 4-гистаминовых рецепторов вводятся и поддерживаются в эффективной концентрации в месте потенциального формирования спаек в течение времени, достаточного для предупреждения их образования. Антагонисты Н 4-гистаминовых рецепторов вводятся системно либо локально (например, непосредственно в полость тела), а также обоими способами в послеоперационном периоде до полного заживления раны. В некоторых вариантах осуществления антагонист Н 4-гистаминовых рецепторов доставляется в ткани полости тела однократной дозой и удерживается в контакте с ними, как описано в настоящем документе. В других вариантах осуществления антагонист Н 4-гистаминовых рецепторов доставляется продолжительно несколькими дозами в течение времени, достаточного для подавления формирования спаек, т.е. высвобождается замедленно."Эффективное количество" означает количество антагониста Н 4-гистаминовых рецепторов, способное, при введении в ткани, эффективно подавлять формирование послеоперационных спаек в полости тела. Терапевтически эффективными концентрациями антагониста Н 4-гистаминовых рецепторов являются его концентрации в тканях полостей тела, подавляющие или предупреждающие формирование послеоперационных спаек между тканевыми поверхностями в полостях тела после перенесенного хирургического вмешательства. Минимальное количество антагониста Н 4-гистаминовых рецепторов, которое может быть введено, должно эффективно подавлять формирование послеоперационных спаек, как описано в настоящем документе. Максимальное количество антагониста Н 4-гистаминовых рецепторов, которое может быть введено, ограничивается токсичностью соединения. Эффективные количества или дозировки активных средств настоящего изобретения могут быть определены стандартными способами,например, моделированием, исследованиями с увеличением дозы или клиническими испытаниями с учетом стандартных факторов, таких как способ или путь введения или доставки лекарственного средства,фармакокинетика средства, степень тяжести и характер течения болезни, заболевания или состояние,предшествующая или текущая терапия пациента, состояние здоровья и реакция пациента на лекарственные средства, а также мнение лечащего врача. Приблизительная доза находится в интервале от приблизительно 0,001 до приблизительно 200 мг антагониста Н 4-рецепторов гистамина на 1 кг массы тела пациента в сутки. Предпочтительная доза составляет приблизительно от 0,05 до 100 мг/кг/сут., от 1 до 35 мг/кг/сут. или от 0,1 до 10 мг/кг в сутки однократной дозой или дробно (например, два раза в день, три раза в день, четыре раза в день). Для человека весом 70 кг иллюстративной приемлемой дозировкой является количество приблизительно от 1 до 200 мг/сут. или от 5 до 50 мг/сут. После достижения улучшения доза может быть скорректирована для профилактического приема или поддерживающего лечения. Например, дозировка, частота введения или и то и другое могут быть снижены в зависимости от симптомов до уровня, при котором поддерживается желательный терапевтический или профилактический эффект от приема препарата. Разумеется, если симптомы облегчены до приемлемого уровня, лечение можно прекратить. Однако при наличии рецидивов симптомов пациенту может потребоваться долговременное периодическое лечение. Как описано выше, настоящее изобретение относится к фармацевтическим композициям, содержащим антагонист Н 4-гистаминовых рецепторов. В некоторых вариантах осуществления фармацевтической композиции дополнительно содержат фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления антагонист Н 4-гистаминовых рецепторов вводится локально, например непосредственно в полость тела, в которой выполнялось хирургическое вмешательство. В других вариантах осуществления антагонист Н 4-гистаминовых рецепторов вводится системно соответствующим способом, например орально, парентерально, ректально, топикально, окулярно или с помощью ингаляции. Кроме того, антагонист Н 4-гистаминовых рецепторов может быть введен системно в сочетании с локальным, несистемным введением. В одном из вариантов осуществления изобретения антагонист Н 4-гистаминовых рецепторов после хирургического вмешательства доставляется непосредственно к месту выполнения операции системой доставки, пригодной для локального, несистемного введения терапевтического средства в тканевые по-6 019143 верхности, например в водном геле полиэтиленгликоля или натрия карбоксиметилцеллюлозы, с целью ослабления, подавления либо предупреждения формирования спаек в месте операции после ее выполнения. Предпочтительно введение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов однократной дозой до сшивания краев раны после выполнения операции с использованием системы доставки, позволяющей поддерживать эффективную концентрацию соединения в течение времени, необходимого для предупреждения формирования спаек во время заживления раны. Подходящей считается такая система доставки, которая не провоцирует воспаление, является неиммуногенной и позволяет высвобождаться антагонисту Н 4-гистаминовых рецепторов таким образом, чтобы поддерживать его эффективную концентрацию в течение требуемого периода времени. В рамках настоящего изобретения рассматривается также большое количество альтернативных систем доставки, позволяющих обеспечивать длительное высвобождение антагониста Н 4-гистаминовых рецепторов при содержании терапевтически эффективного количества действующего вещества. Подходящими системами доставки могут являться наночастицы, микрокапсулы или микросферы, липосомы или другие липидные системы высвобождения; рассасывающиеся и (или) биодеградируемые механические барьеры; полимерные носители, в том числе блок-сополимеры полиэтиленоксида или полипропиленоксида (например, полоксамеры), полиортоэфиры, поливиниловый спирт, полиангидриды, полиметакрилаты, полиметакриламиды, анионные углеводородные полимеры, полигидроксимасляная кислота и полиацетали, при этом список подходящих систем доставки не ограничивается приведенными примерами. Наиболее предпочтительными подходящими составами для достижения наилучшего профиля высвобождения антагониста Н 4-гистаминовых рецепторов, близкого к псевдонулевому порядку, являются составы для инъекционного введения, содержащие микрокапсулы или микросферы, приготовленные из биодеградируемых полимеров, таких как (помимо прочего) поли-l-лактид, поли-dl-лактид, поли-dlлактидкогликолиды, поли-l-лактидкогликолиды, поли-е-капролактон, полигликолид, поли-п-диоксаноны, политриметиленкарбонат, полиалкилендигликоляты, полиоксиэфиры, полиоксамиды, а также их сополимеры и смеси. Другие желаемые профили высвобождения, как, например, состоящий из начального выброса антагониста Н 4-гистаминовых рецепторов, за которым следует нулевой порядок замедленного высвобождения (выброс/замедленное высвобождение), могут быть созданы смешиванием инкапсулированных и неинкапсулированных лекарственных средств в одном составе. К глицеридам с необходимой длиной цепи эфиров карбоновых кислот относятся (помимо прочего) следующие: глицерилмоностеараты, глицерилмонопальмитаты, смеси глицерилмоностеарата и глицерилмонопальмитата (Myvaplex 600; поставляется компанией Eastman Fine Chemical Company, Рочестер,Нью-Йорк), глицерилмонолинолеат, глицерилмоноолеат, смеси глицерилмонопальмитата, глицерилмоностеарата, моноолеата и глицерилмонолинолеата (Myverol, поставляется Eastman Fine Chemical Company), глицерилмонолинолеат, глицерилмоногадолеат, смеси глицерилмонопальмитата, глицерилмоностеарата, глицерилмоноолеата, глицерилмонолинолеата, глицерилмонолинолената и глицерилмоногадолеата (Myverol 18-99, поставляется Eastman Fine Chemical Company), ацетилированные глицериды, такие как дистилированный ацетилированный моноглицерид (Myvacet 5-07, 7-07 и 9-45, поставляется EastmanFine Chemical Company), смеси моноэфиров пропиленгликоля, дистиллированного моноглицерида, стеароил-лактилата натрия и диоксида силикона (Myvatex TL, поставляется Eastman Fine Chemical Company),смеси моноэфиров пропиленгликоля, дистиллированных моноглицеридов, стеароил-лактилата натрия и диоксида силикона (Myvatex TL, поставляется Eastman Fine Chemical Company), d-альфатокоферолполиэтиленгликоль 1000 сукцинат (витамин Е TPGS, поставляется Eastman Fine Chemical Company), смеси эфиров моно- и диглицеридов, кальция стеароил-лактилат, этоксилированные моно- и диглицериды,лактированные моно- и диглицериды, лактилаты эфиров карбоновых кислот глицерина и пропиленгликоля, лактиловые эфиры длинноцепочечных карбоновых кислот, полиглицериновые эфиры длинноцепочечных карбоновых кислот, пропиленгликолевые моно- и диэфиры длинноцепочечных карбоновых кислот, стеароил-лактилат натрия, сорбитанмоностеарат, сорбитанмоноолеат, прочие сорбитановые эфиры длинноцепочечных карбоновых кислот, сукцинилированные моноглицериды, стеарилмоноглицерилцитрат, стеарилгептаноат, воски цетиловых эфиров, стеарилоктаноат, С 10-С 30 холестерол-авостероловые эфиры, а также эфиры сахарозы длинноцепочечных карбоновых кислот. К глицеридам относятся (помимо прочего) следующие: триглицериловые эфиры, такие как глицерилдистеарат, глицерилтристеарат,глицерилмоностеарат, глицерилдипальмитат, глицерилтрипальмитат, глицерилмонолаурат, глицерилдидокозаноат, глицерилтридокозаноат, глицерилмонодокозаноат, глицерилмонокапрат, глицерилдикапрат,глицерилтрикапрат, глицералмономиристат, глицерилдимиристат, глицерилтримиристат, глицерилмонодеценоат, глицерилдидеценоат, а также глицерилтридеценоат. Глицериды могут применяться отдельно или в сочетании с иными аналогичными веществами. Системы для инъекционного введения, содержащие наночастицы, микрокапсулы или микросферы диаметром от 0,001 до 1000 мкм, имеют преимущество перед другими системами доставки, так как они дают возможность гибко подбирать длительность и скорость высвобождения лекарственного средства,изменяя размеры микрокапсул, лекарственную нагрузку, а также дозировку при введении. Кроме того,такие микрокапсулы могут быть эффективно простерилизованы гамма-излучением или окисью этилена. Микросферы и микрокапсулы являются носителями либо системами, состоящими из жидкого или-7 019143 твердого ядра, окруженного полимерной пленкой. Пленка микросферы, как правило, не вступает в реакцию с веществами ядра; она достаточно прочная, чтобы исключить разрывы, но в тоже время достаточно тонкая, чтобы обеспечить высокое значение отношения объема ядра к объему пленки. Содержимое сферы (капсулы) остается внутри до тех пор, пока оно не высвободится путем диффузии или иными способами, например, растворением, расплавлением, нарушением целостности, разрывом, а также извлечением вещества, заключенного внутри сферы (капсулы). Предпочтительны сферы (капсулы) с пленками,которые в соответствующих средах разрушаются и разлагаются, тем самым способствуя диффузии содержимого ядра через пленку, что обеспечивает его медленную непрерывную доставку. Механизмом высвобождения в биодеградируемых микросферах является комбинация лекарственной диффузии и биодеградации полимера. Таким образом, скорость и длительность высвобождения определяются размерами микросфер, количественным содержанием и качественными характеристиками лекарственного вещества, а также параметрами полимера, такими как кристалличность, молекулярный вес и состав. Регулировка высвобождения лекарственного средства достигается изменением толщины пленки, диаметра сферы, или обоими способами сразу. Кроме того, альтернативные системы доставки, основанные на биодеградируемых полимерах, пригодных для использования в соответствии с настоящим изобретением, например, волокна или нити, содержащие в качестве активных средств эффективные количества антагониста Н 4-гистаминовых рецепторов, также рассматриваются в рамках настоящего изобретения. Альтернативный подход к доставке однократной дозы антагониста Н 4-гистаминовых рецепторов предполагает использование какого-либо из описанных в настоящем документе биодеградируемых полимеров в виде пленки. Такие пленки могут быть получены путем распыления или выбросом дисперсных жидких капель, содержащих биополимер и антагонист Н 4-гистаминовых рецепторов на пригодном носителе, из герметичного контейнера в место назначения. Пленки, волокна и частицы могут быть получены различными способами, известными специалистам в данной области. Такими способами могут быть (помимо прочего): получение во вращающемся барабане, растворение или осаждение, а также сверхкритические флюидные способы. Еще одним подходом к доставке однократной дозы антагониста Н 4-гистаминовых рецепторов в соответствии с настоящим изобретением является использование липосом и иных липидных систем доставки для инкапсулирования активного средства в мультиламеллярные везикулы (т.е. липосомы). Обычным способом получения липосомальной суспензии является добавление порошкообразной смеси липидов к необходимому количеству активного вещества в водном растворе, например в солевом фосфатном буферном растворе. После соответствующего периода гидратации гидратированная суспензия автоклавируется с получением липосомального препарата активного средства. Липосомальные композиции в большинстве случаев являются комбинацией фосфолипидов, в частности фосфолипидов с высокой температурой фазового перехода, со стероидами, главным образом холестерином. Также могут быть использованы иные фосфолипиды или липиды. Физические характеристики липосом зависят от рН, ионной силы, а также присутствия двухвалентных катионов. Примером липидов,пригодных для получения липосом, являются соединения фосфатидила, такие как фосфатидилглицерин,фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, сфинголипиды, цереброзиды, а также ганглиозиды. Наилучшим образом подходят диацилфосфатидилглицерины с насыщенным липидным компонентом, содержащим от 14 до 18 атомов углерода, в особенности 16-18 атомов углерода. Примерами могут служить яичный фосфатидилхолин, дипальмитоилфосфатидилхолин, а также дистеароилфосфатидилхолин. Липидная смесь, пригодная для получения липосом, может быть получена растворением L-альфадистеароилфосфатидилхолина и холестерина в хлороформе, к которому добавлен альфатокоферол. Специалистами, имеющими опыт в данной области, могут быть использованы иные композиции, а также способы получения липосом в рамках настоящего изобретения. В настоящем изобретении могут быть использованы иные липидные системы доставки. Одной из подходящих систем является липидная пена DEPOFOAM (торговое наименование; производитель SkyPharama, Inc., Сан-Диего, Калифорния) - система длительного высвобождения, содержащая сферические частицы, ограниченные одной двухслойной липидной мембраной, каждая из которых содержит неконцентрические водные камеры с инкапсулированным активным ингредиентом. Подобные липидные частицы получены из нетоксичных липидов, идентичных таковым в клеточных мембранах. Также приемлемым подходом к доставке однократной дозы антагониста Н 4-гистаминовых рецепторов в соответствии с настоящим изобретением является использование кристаллоидов, а также так называемых "вязких инстиллятов". Кристаллоидами являются водорастворимые кристаллические субстанции (например, натрия хлорид), способные диффундировать через полупроницаемые мембраны. Растворы кристаллоидов (например, физиологический раствор), известны как кристаллоиды, кристаллоидные растворы, а также кристаллоидные инстилляты. К кристаллоидным инстиллятам относятся (помимо прочего) лактированный раствор Рингера, физиологический раствор, а также солевой фосфатный буфер. В случае вязких инстиллятов к носителям с высокой молекулярной массой, применяющимся в смеси с активными средствами, относятся (помимо прочего) декстраны и циклодекстраны, гидрогели, вязкие мате-8 019143 риалы с поперечными связями, в том числе вискоэластики и когезивные вискоэластики, карбоксиметилцеллюлоза, полисахариды, гиалуроновая кислота, поперечносшитая гиалуроновая кислота, а также соединения гиалуроновой кислоты с ортоэфирами. Кроме того, допускается совместное введение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов с дополнительным терапевтическим средством, применяющимся для лечения послеоперационных спаек или для лечения сопутствующих заболеваний (например, совместно с химиотерапевтическими препаратами) в количестве, эффективном для достижения терапевтического эффекта,ожидаемого от введения второго терапевтического средства. Дополнительное терапевтическое средство может вводиться в одно время, но раздельно по меньшей мере от одного антагониста Н 4-гистаминовых рецепторов, или совместно в одной фармацевтической композиции, согласно настоящему изобретению. Дополнительными терапевтическими средствами могут являться вещества, известные или обнаруженные как эффективные в лечении послеоперационных спаек либо воспаления, такие как прочие модуляторы Н 4-гистаминовых рецепторов или соединения, активные в отношении иных отклонений, ассоциированных с данным состоянием. Данное сочетание компонентов может иметь целью повышение эффективности (например, путем включения в состав данной комбинации соединения, повышающего эффективность или активность антагониста Н 4-гистаминовых рецепторов), ослабление одного или нескольких побочных эффектов или снижение требуемой дозировки активного средства в соответствии с настоящим изобретением. Дополнительными терапевтическими средствами, использующимися в комбинации с антагонистом Н 4-гистаминовых рецепторов, могут быть антитромбоцитарные, антифиброзные, противовоспалительные, антипролиферативные средства и (или) ингибиторы синтеза коллагена. К ним относится (помимо прочего) урокиназа - негликозилированный активатор плазминогена для удаления измененного белка из ткани, выпускающийся под торговым названием RETAVASE (поставщик Boehringer Manheim, Индианаполис, Индиана), фармацевтический препарат, содержащий абциксимаб для предупреждения и лечения заболеваний системы кровообращения, выпускающийся под торговым названием REOPRO (поставщикEli Lilly and Company, Индианаполис, Индиана), клопидогреля бисульфат, выпускающийся под торговым названием PLAVIX (поставщик Sanofi-Synthelabo, Париж, Франция), фармацевтические препараты для лечения онкологических заболеваний, содержащие иматиниба месилат, выпускающиеся под торговым названием GLEEVEC (поставщик Novartis AG, Базель, Швейцария), триамцинолона ацетонид, тепоксалин, пирфенидон, коллагеназа, анти-CTGF (фактор роста соединительной ткани), ингибиторы тирозинкиназы, ингибиторы пролилгидроксилазы, ингибиторы лизилоксидазы, ингибиторы С-протеиназы, ингибиторы N-протеиназы, ингибиторы TGF (трансформирующий фактор роста), такие как тамоксифен,ингибиторы HMG-CoA-редуктазы (гидроксиметилглутарил-коэнзим А), такие как ловастатин, ингибиторы ЦОГ-1 и (или) ЦОГ-2 (циклооксигеназа), такие как ибупрофен, нимесулид, фармацевтические препараты, содержащие рофекоксиб, использующийся для лечения артрита, выпускающиеся под торговым названием VIOXX (поставщик MerckCo., Inc., Уайтхаус-Стэйшн, Нью-Джерси), фармацевтические препараты, являющиеся противовоспалительными анальгетиками, содержащими целекоксиб, выпускающиеся под торговым названием CELEBREX (поставщик G.D. SearleСо., Скоки, Иллинойс), фармацевтический препарат, содержащий валдекоксиб, выпускающийся под торговым названием BEXTRA(Поставщик PharmaciaUpjohn Co., Северный Пипэк, Нью-Джерси), антагонисты кальция, такие как амлодипин, нифедипин, верапамил, применяющиеся для лечения гипертонии, хелаторы железа, такие как дефероксамин, выпускающийся под торговым названием DESFERAL (поставщик Novartis AG, Базель, Швейцария), антибиотики, такие как кларитромицин и ципрофлоксин, ретиноиды, такие как третиноин и ретиноевая кислота, ингибиторы химазы, а также 9-метил-3-(1 Н-тетразол-5-ил)-4 Н-пиридо[1,2]пиримидин-4-он калия, известный как пемироласт. При использовании в сочетании с антагонистами Н 4-гистаминовых рецепторов, терапевтические средства (лекарственные средства) присутствуют в количестве, необходимом для обеспечения предполагаемого от таких средств терапевтического эффекта. Использование во время операции или перед операцией системы доставки в виде барьера и антагониста Н 4-гистаминовых рецепторов может иметь большую эффективность в сочетании с другими лекарственными средствами. Например, во время выполнения хирургического вмешательства в место операции может быть доставлен антифиброзный препарат - рекомбинантный активатор плазминогена, выпускающийся под торговым названием RETAVASE (поставщик Boehringer Manheim Corp., Индианаполис,Индиана), после чего в этом же месте может быть установлен барьер, содержащий ингибитор синтеза коллагена (антагонист Н 4-гистаминовых рецепторов). Совокупный эффект, обеспеченный активатором плазминогена, ограничивающим свертывание крови в месте операции, барьером, ограничивающим аппозицию тканевых поверхностей, и антагонистом Н 4-гистаминовых рецепторов, ингибирующим синтез коллагена, дает возможность в значительной степени подавить образование спаек. Локальное несистемное введение дополнительных терапевтических средств может сочетаться с различными способами системного введения до, во время и после хирургического вмешательства. В одном из вариантов осуществления изобретения антагонист Н 4-гистаминовых рецепторов сочетается с физическим барьером. Считается, что при сочетании надлежащего физического барьера с анта-9 019143 гонистом Н 4-гистаминовых рецепторов возможно достижение синергетического эффекта, что дает лучшие результаты, чем использование только антагониста Н 4-гистаминовых рецепторов или только барьера. Так, поверхность барьера из полиэтиленгликоля обладает антитромбогенными свойствами, что позволяет предотвратить агрегацию тромбоцитов и предупредить свертывание фибрина. Однако антагонист Н 4-гистаминовых рецепторов, который действует на более поздних стадиях формирования спаек,например, на этапе синтеза коллагена, может доставляться к месту назначения в течение более длительного периода времени. Таким образом, действуя более чем на одном этапе образования спаек, эффективность комбинации барьера с антагонистом Н 4-гистаминовых рецепторов выше суммарной эффективности антагониста Н 4-гистаминовых рецепторов и барьера по отдельности. Прочие барьеры также могут проявлять аналогичные эффекты в сочетании с антагонистом Н 4-гистаминовых рецепторов. Другим примером является гиалуроновая кислота, использование которой предлагается для подавления пролиферации клеток (антипролиферативный эффект) и которая также является превосходным покрытием, обеспечивающим скольжение между соприкасающимися тканевыми поверхностями. Гиалуроновая кислота вырабатывается в организме и выполняет аналогичные функции, обеспечивая скольжение между поверхностями суставов. Таким барьером может являться гидрогель карбоксиметилцеллюлозы, так как он удерживается тканями и имеет отличную биосовместимость, вследствие чего не вызывает воспалительных реакций, провоцирующих синтез коллагена. Сочетание барьера из гиалуроновой кислоты с антагонистом Н 4-гистаминовых рецепторов может быть более эффективным, чем использование только антагонист Н 4-гистаминовых рецепторов. Также барьерами могут являться (помимо прочего) различные производные гиалуроновой кислоты(в том числе соли железа, натрия; эфиры, в том числе бензиловый), производные целлюлозы (окисленная регенерированная, метил-, этил-, гидроксипропилцеллюлоза), коллагены, полиэтиленгликоли (в том числе поперечносшитые in situ), плуроники, хитин, хитозаны, декстраны, полимеры глюкозы, полимеры углеводородов, желатин, гликозаминогликаны, полиакриламиды, поливинилпирролидоны, поливиниловый спирт, полиметакрилаты, альгинаты, крахмал, полипептиды, а также прочие водорастворимые полимеры и их смеси. Указанные полимеры могут также быть сополимеризованы или смешаны с гидролизуемыми или разлагаемыми под действием ферментов полимерами, такими как полилактоны, полиоксиэфиры,полиалкилендигликоляты, глицеридсодержащие полимеры, а также с их смесями. Барьеры могут также быть нерассасывающимися, например, политетрафторэтиленовые. Антагонист Н 4-гистаминовых рецепторов и (или) другие терапевтические средства в настоящем изобретении могут быть ковалентно или нековалентно (например, ионно) связаны с барьером, или они могут быть диспергированы в нем. Следует также отметить, что для локальной доставки лекарственного средства (средств) могут использоваться не только описанные в настоящем документе гелевые барьеры, но и другие способы локального введения, например осмотический насос. Термин "фармацевтически приемлемый наполнитель" означает нетоксичное, биологически переносимое и по остальным параметрам биологически допустимое для введения пациенту вещество, такое как инертное вещество, добавляемое в фармакологическую композицию или иным образом используемое в качестве средства доставки, носителя или разбавителя для облегчения введения средства и совместимое с последним. Примеры наполнителей включают карбонат кальция, фосфат кальция, различные сахара и типы крахмалов, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Формы доставки фармацевтических композиций, содержащих одну или несколько единиц дозирования активных средств, могут быть приготовлены с использованием соответствующих фармацевтических наполнителей и способов приготовления, известных сегодня или доступных в будущем специалистам. Описываемые композиции могут в соответствии с целями настоящего изобретения вводиться любым соответствующим путем, например перорально, парентерально, ректально, местно, в глаза либо через ингалятор. Препарат может быть в форме таблеток, капсул, саше, драже, порошков, гранул, пастилок, порошков для восстановления, жидких препаратов или суппозиториев. Предпочтительно композиции сформулированы для внутривенного вливания, местного применения или перорального введения. Для перорального введения активные средства в соответствии с настоящим изобретением могут быть приготовлены в форме таблеток или капсул, а также в форме раствора, эмульсии или суспензии. Для приготовления композиций для перорального введения активные средства могут вводиться в композиции в количествах, обеспечивающих дозировки, например, приблизительно от 0,05 до 50 мг/кг/сут.,приблизительно от 0,05 до 20 мг/кг/сут. или приблизительно от 0,1 до 10 мг/кг/сут. Таблетки для перорального введения могут включать активные компоненты, смешанные с совместимыми фармацевтически приемлемыми наполнителями, такими как разбавители, вещества для улучшения распадаемости таблеток, связывающие средства, смазывающие вещества, подсластители, вкусовые добавки, красители и консерванты. Соответствующие инертные наполнители включают карбонаты натрия и кальция, фосфаты натрия и кальция, лактозу, крахмал, сахар, глюкозу, метилцеллюлозу, стеарат магния, маннитол, сорбитол и т.п. Примеры жидких наполнителей для орального введения включают этанол, глицерин, воду и т.п. Типовые вещества для улучшения распадаемости таблеток включают крахмал, поливинилпирролидон (PVP), крахмала натрия гликолят, микрокристаллическую целлюлозу и аль- 10019143 гиновую кислоту. Связывающие средства могут включать крахмал и желатин. Смазывающим средства,при его наличии, может быть стеарат магния, стеариновая кислота или тальк. При необходимости таблетки могут быть покрыты таким материалом, как глицерилмоностеарат или глицерилдистеарат, для замедления всасывания в желудочно-кишечном тракте, или могут иметь энтеросолюбельную оболочку. Капсулы для орального применения могут быть твердыми и мягкими желатиновыми капсулами. Для приготовления твердых желатиновых капсул активные компоненты могут быть смешаны с твердым,полужидким или жидким разбавителем. Мягкие желатиновые капсулы могут быть приготовлены путем смешивания активного компонента с водой, маслом, таким как арахисовое или оливковое масло, вазелиновым маслом, смесью моно- и диглицеридов короткоцепочечных жирных кислот, полиэтиленгликолем 400 или пропиленгликолем. Возможные жидкости для перорального применения включают суспензии, растворы, эмульсии или сиропы, либо могут быть лиофилизованы и поставляться в сухом виде для восстановления водой или иным соответствующим носителем перед использованием. В состав подобных жидких композиций могут входить следующие компоненты: фармацевтически приемлемые наполнители, такие как суспендирующие средства (например, сорбитол, метилцеллюлоза, альгинат натрия, желатин, гидроксиэтилцеллюлоза,карбоксиметилцеллюлоза, гелеобразный стеарат алюминия и т.д.); неводные носители, например масла(например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, этиловый спирт или вода; консерванты (например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота); смачивающие средства, такие как лецитин; а также, при необходимости, ароматизаторы или красители. Активные средства, относящиеся к настоящему изобретению, могут также вводиться системно непероральными путями. Например, композиции могут быть приготовлены в виде суппозиториев для ректального применения. В случае композиций для парентерального введения, включая внутривенное,внутримышечное, внутрибрюшинное или подкожное введение, средства в соответствии с настоящим изобретением могут быть приготовлены в форме стерильных водных растворов или суспензий, с добавлением соответствующих растворов до получения требуемых значений рН и изотоничности, либо в виде парентерально приемлемого масла. Соответствующие жидкие носители включают раствор Рингера и изотонический раствор хлорида натрия. Подобные лекарственные формы могут быть приготовлены в виде однодозовой формы, такой как ампула или одноразовое приспособление для инъекций, в виде многодозовой формы, такой как флаконы, из которых может быть отобрано требуемое количество препарата, или в твердой форме или в форме первичного концентрата, который может быть использован для приготовления составов для инъекций. Типовые дозы для инъекций находятся в диапазоне приблизительно от 1 до 1000 мкг/кг/мин средства в виде смеси с фармацевтическим носителем в течение промежутка времени от нескольких минут до нескольких дней. Для местного применения средства могут быть смешаны с фармацевтическим носителем в концентрации от приблизительно 0,1 до приблизительно 10% лекарственного средства в носителе. Другой способ введения средств, составляющих предмет настоящего изобретения, может использовать пластыри для трансдермальной доставки препарата. Альтернативно в целях настоящего изобретения активные средства могут вводиться путем ингаляции, через нос или рот, например, в виде спрея, содержащего также соответствующий носитель. Примеры приведены для лучшего понимания изобретения. Они лишь поясняют, но не ограничивают сферу действия изобретения, которая определена ниже в формуле изобретения. Примеры Для подтверждения эффективности антагонистов Н 4-гистаминовых рецепторов в снижении интенсивности или подавлении формирования спаек после перитонеальных операций были выполнены многочисленные исследования с использованием модели спаек на боковой стенке. Перитонеальная модель спаек на боковой стенке Животные: двадцать восемь самок новозеландского белого кролика весом 2,4-2,7 кг были закуплены на ирландских фермах и до использования выдержаны в карантине по меньшей мере 2 сут. Кролики содержались в условиях цикла "свет:отсутствие света" в режиме 12:12 без ограничений в доступе к корму и воде. Анестезию произвели смесью 55 мг/кг кетамина гидрохлорида и 5 мг/кг Rompum внутримышечно. После манипуляций по обеспечению стерильности выполняли срединную лапаротомию. Полиэтиленовый катетер (полиэтиленовая трубка производства Clay Adams PE-60 вн. диам. 0,76 мм (0,030 дюйма),внеш. диам. 1,22 мм (0,048 дюйма был введен в брюшную полость и пришит к боковой стенке 5-0 этилоном. Для местного введения миниосмотический насос Alzet (10 мкл/ч, 2 мл, модель 2ML1 Durect), наполненный однократной дозой препарата или плацебо (вода для инъекций) в количестве 10 мкл/ч, был размещен в подкожном пространстве в течение 7 дней, включая день операции. Затем катетер прикрепляли к насосу, мышцы рядом с катетером, затронутые срединным разрезом, сшивали. Слепую кишку и кишечник выводили на поверхность и сдавливали пальцами для получения субсерозных кровоизлияний по всей поверхности. После этого поврежденный кишечник слегка истирали четырехслойной стерильной марлевой салфеткой размером 10,2 см (4 дюйма)10,2 см (4 дюйма) до появления точечных кровотечений. Затем слепую кишку и кишечник возвращали в нормальное анатомическое положение. На правой- 11019143 боковой брюшной стенке была удалена область брюшины и поперечной мышцы живота размером 53 см. Разрез был сшит в два слоя 3-0 викрилом (поставщик Ethicon, Сомервилль, Нью-Джерси). Насос был удален на седьмой день. Через двадцать один день после операции кроликов умертвили внутривенным введением препаратаEuthaSol. Формирование спаек в месте повреждения боковой стенки оценивалось путем определения размера участка (в процентах) поврежденной области боковой стенки, вовлеченного в образование спаек. Соответствие доли поверхности боковой стенки, вовлеченной в образование спаек с различными органами, общей количественной оценке спаечного процесса приведено в таблице ниже. Кроме того, сила сцепления сформировавшихся спаек оценивалась по следующей схеме: 0 = отсутствие спаек; 1 = мягкие, легко отсекаемые спайки; 2 = умеренные спайки, не отсекаемые, без повреждения органа; 3 = плотные спайки, не отсекаемые, при удалении орган повреждается. Разница в формировании спаек между контрольной и исследуемой группой была проанализирована с помощью t-критерия Стьюдента. Сокращение пораженной области и силы сцепления спаек может рассматриваться как благотворное и эффективное. С целью оценки фармакокинетики у каждого животного был взят анализ крови объемом 1 мл в 0(до операции) и 7 день после установки насоса. Кровь была собрана в гепаринизированные пробирки и центрифугирована для осаждения клеток; надосадочную жидкость (плазму) хранили при -80 С. За каждым животным были проведены общие наблюдения (внешний вид, поведение, клинические проявления, симптомы, предсмертные проявления, смертность, физические показатели) до начала исследования и в день вскрытия. В день вскрытия особенно внимательно фиксировались данные о воспалении,гранулематозном материале и формировании спаек в месте лечения. Полностью была описана биосовместимость, а также отмечена выраженность реакции (отсутствие, легкая, умеренная, тяжелая). Локальное введение (5-хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанона 28 кроликов, использованных в данном исследовании, были разделены на следующие группы. Группа 1. Отсутствие лечения. Группа 2. Система доставки (контроль). Группа 3. 5 мг/мл (5-хлор-1 Н-индол-3-ил)-(4- метилпиперазин-1-ил)метанона. Одно животное из контрольной группы умерло на 10 день от перитонита. Каких-либо клинических проявлений не наблюдалось ни у одного из оставшихся животных. Не было отмечено ни одной воспалительной или гранулематозной реакции в брюшной полости. Плацебо (табл. 2) существенно не влияло на размер области либо силу сцепления при формировании спаек в сравнении с контролем (табл. 1). (5 хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон значительно снижал как размер области, так и силу сцепления спаек (табл. 3). Таблица 1. Оценка спаек в контрольной группе прооперированных животных Данное значение показывает силу сцепления (непараметрический показатель). Таблица 2. Оценка спаек в плацебогруппе животных Данное значение показывает силу сцепления (непараметрический показатель). Данное значение показывает силу сцепления (непараметрический показатель). В следующей серии экспериментов тестируемым соединением являлся [5-(4,6-диметил-1 Н-бензоимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, который вводили в дозах, перечисленных ниже. 35 животных, использованных в данном исследовании, были разделены на следующие группы. Группа 1. Хирургический контроль. Локальное введение (насос): Группа 2. 0,1 мг/мл тестируемого соединения. Группа 3. 1 мг/мл тестируемого соединения. Группа 4. 10 мг/мл тестируемого соединения. Системное введение (доставка с помощью орального зонда в день операции и в течение последующих четырех дней): Группа 5. 30 мг/кг тестируемого соединения перорально. Из всех животных до вскрытия умерло только одно животное из контрольной группы (на 12 день). Кроме того, у некоторых животных наблюдался белый осадок к концу зондового введения препарата. У животных, которым вводили лекарственный препарат с помощью Alzet, эффект наблюдался близко концу трубки. Данное явление было отмечено у 1 животного в каждой из групп с низкой и средней дозой и у 3 животных из группы с высокой дозой. Несмотря на то что при введении средней дозы лекарственного препарата с помощью насоса как область, так и сила сцепления спаек уменьшались, статистически значимым было только сокращение области поражения. Таблица 1. Оценка спаек в плацебогруппе Данное значение показывает силу сцепления (непараметрический показатель). Таблица 2. Оценка спаек в группе, получавшей 0,1 мг/мл тестируемого соединения Данное значение показывает силу сцепления (непараметрический показатель). Данное значение показывает силу сцепления (непараметрический показатель). Таблица 4. Оценка спаек в группе, получавшей 10 мг/мл тестируемого соединения Данное значение показывает силу сцепления (непараметрический показатель). Таблица 5. Оценка спаек в группе, получавшей 30 мг/кг тестируемого соединения Данное значение показывает силу сцепления (непараметрический показатель). В документе показаны и описаны основные новые признаки изобретения, при этом специалисты в данной области могут исключать, заменять, а также вносить изменения в изобретение, связанные с формой и компонентами проиллюстрированных примеров, обеспечивая соответствие сущности изобретения. Однако такое внесение изменений не должно выходить за рамки формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ подавления формирования послеоперационных спаек между тканевыми поверхностями в полостях тела, в которых выполнялось хирургическое вмешательство, включающий введение эффективного количества по меньшей мере одного антагониста Н 4-гистаминовых рецепторов в тканевые поверхности полостей тела, где указанный антагонист Н 4-гистаминовых рецепторов выбран из группы, включающей (5 хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил-1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н 4-гистаминовых рецепторов. 2. Способ по п.1, в котором по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится с помощью носителя для доставки, пригодного для локального, несистемного введения терапевтического средства в поверхности тканей. 3. Способ по п.2, в котором носителем для доставки является по меньшей мере один из следующих: наночастицы, микрокапсулы, микросферы, барьеры, липосомы, липидные пены, растворы, композиции,осмотические насосы, волокна, нити, гели и пленки. 4. Способ по п.3, в котором барьер является рассасывающимся. 5. Способ по п.1, в котором по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится однократной дозой.- 14019143 6. Способ по п.1, в котором по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится путем замедленного высвобождения. 7. Способ по п.1, в котором по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится способом выброса/замедленного высвобождения. 8. Способ по п.1, в котором по меньшей мере один антагонист Н 4-гистаминовых рецепторов вводится в количестве от приблизительно 0,001 мг на килограмм массы тела до приблизительно 200 мг на килограмм массы тела. 9. Способ по п.1, дополнительно включающий системное введение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов до хирургического вмешательства. 10. Композиция, пригодная для локального, несистемного введения лекарственного средства непосредственно в ткани полостей тела, в которых выполнялось хирургическое вмешательство, содержащая эффективное количество по меньшей мере одного антагониста Н 4-гистаминовых рецепторов, выбранного из группы, включающей (5-хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6-диметил 1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин, фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н 4-гистаминовых рецепторов, и носитель для доставки, пригодный для локального, несистемного введения по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. 11. Композиция по п.10, в которой носитель для доставки представляет собой по меньшей мере один из следующих: наночастицы, микрокапсулы, микросферы, барьеры, липосомы, липидные пены,растворы, композиции, осмотические насосы, волокна, нити, гели и пленки. 12. Композиция по п.10, в которой носитель для доставки содержит по меньшей мере один полимер из группы полоксамеров, полиортоэфиров, поливинилового спирта, полиангидридов, полиметакрилатов,полиметакриламидов, анионных углеводородных полимеров, полигидроксимасляной кислоты, полиацеталей, поли-l-лактида, поли-dl-лактида, поли-dl-лактид-когликолидов, поли-l-лактид-когликолидов, поли-е-капролактона, полигликолида, поли-п-диоксанонов, политриметиленкарбоната, полиалкилендигликолятов, полиоксиэфиров, полиоксамидов или глицеридных полимеров. 13. Композиция по п.10, в которой указанная композиция предназначена для введения однократной дозы по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. 14. Композиция по п.10, обеспечивающая замедленное высвобождение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. 15. Композиция по п.10, обеспечивающая выброс/замедленное высвобождение по меньшей мере одного антагониста Н 4-гистаминовых рецепторов. 16. Композиция по п.10, содержащая от приблизительно 0,001 мг по меньшей мере одного антагониста Н 4-гистаминовых рецепторов на килограмм массы тела до приблизительно 200 мг по меньшей мере одного антагониста Н 4-гистаминовых рецепторов на килограмм массы тела. 17. Композиция по п.11, в которой липосомы получены из L-альфа-дистеароилфосфатидилхолина,фосфатидилхолина, дипальмитоилфосфатидилхолина или дистеароилфосфатидилхолина. 18. Композиция по п.11, в которой раствор содержит кристаллоидный инстиллят, и указанный кристаллоидный инстиллят включает по меньшей мере или солевой фосфатный буфер, или физиологический раствор, или лактированный раствор Рингера. 19. Композиция по п.11, в которой раствор содержит вязкий инстиллят, при этом указанный вязкий инстиллят содержит по меньшей мере один носитель из группы, включающей декстраны, циклодекстраны, гидрогели, карбоксиметилцеллюлозу, полисахариды, гиалуроновую кислоту, поперечно-сшитую гиалуроновую кислоту, а также хондроитинсульфаты. 20. Композиция по п.11, в которой барьер является рассасывающимся. 21. Композиция по п.20, в которой рассасывающийся барьер содержит по меньшей мере одно вещество из группы, включающей гиалуроновую кислоту, производные целлюлозы, коллагены, полиэтиленгликоли, плуроники, хитин, хитозаны, декстраны, полимеры глюкозы, полимеры углеводородов, желатин,гликозаминогликаны, полиакриламиды, поливинилпирролидоны, поливиниловый спирт, полиметакрилаты, альгинаты, крахмал и полипептиды. 22. Способ подавления формирования послеоперационных спаек между тканевыми поверхностями в полостях тела, в которых выполнялось хирургическое вмешательство, включающий системное введение эффективного количества по меньшей мере одного антагониста Н 4-гистаминовых рецепторов, выбранного из группы, включающей (5-хлор-1 Н-индол-3-ил)-(4-метилпиперазин-1-ил)метанон, [5-(4,6 диметил-1 Н-бензимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин,фармацевтически приемлемые соли, гидраты, сольваты, а также смеси указанных антагонистов Н 4 гистаминовых рецепторов. 23. Способ по п.22, в котором введение выполняется перед хирургическим вмешательством. 24. Способ по п.22, в котором введение выполняется после хирургического вмешательства. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 39/395, A61P 41/00, C07K 16/28
Метки: спаек, лечения, послеоперационных, рецепторов, н4-гистаминовых, использование, антагонистов
Код ссылки
<a href="https://eas.patents.su/16-19143-ispolzovanie-antagonistov-n4-gistaminovyh-receptorov-dlya-lecheniya-posleoperacionnyh-spaek.html" rel="bookmark" title="База патентов Евразийского Союза">Использование антагонистов н4-гистаминовых рецепторов для лечения послеоперационных спаек</a>
Предыдущий патент: Способ разделения платины (ii, iv) и родия (iii) в солянокислых водных растворах
Следующий патент: Дверной замок
Случайный патент: Способ получения кристаллической фруктозы из топинамбура