Способ применения антагонистов il-6 с ингибиторами протеасом
Формула / Реферат
1. Способ лечения раковых заболеваний у млекопитающего, который включает совместное введение ингибитора протеасом в комбинации с антагонистом IL-6.
2. Способ по п.1, в котором антагонистом IL-6 является антитело или его фрагмент.
3. Способ по п.2, в котором антитело является моноклональным антителом.
4. Способ по п.2, в котором антитело или фрагмент связывается с IL-6.
5. Способ по п.2, в котором антитело или фрагмент связывается с рецептором IL-6.
6. Способ по п.3 или 4, в котором фрагментом антитела является Fab, Fab' или F(ab')2-фрагмент или его производное.
7. Способ по п.3, в котором моноклональное антитело конкурирует с моноклональным антителом cCLB8 за связывание с IL-6 человека.
8. Способ по п.3, в котором моноклональное антитело вводят внутривенно.
9. Способ по п.3, в котором моноклональное антитело вводят в количестве 0,01-12 мг/кг массы тела.
10. Способ по п.3, в котором моноклональное антитело вводят в болюсной дозе с последующей инфузией указанного антитела.
11. Способ по п.1, в котором млекопитающим является человек.
12. Способ по п.1, в котором ингибитор протеасом выбран из группы, состоящей из содержащего борную кислоту дипептидного ингибитора протеасом бортезомиба, PS-519 (1R-[1S,4R,5S]-1-(1-гидрокси-2-метилпропил)-4-пропил-6-окса-2-азабицикло[3.2.1.]гептан-3,7-диона); класто-лактацистин-бета-лактона; лактацистина, эпоксомицина, CVT634 (5-метокси-1-инданон-3-ацетиллейцил-D-лейцил-1-инданиламида), ТМС96 ((3-метилбутаноил-L-треонин-N-(1-(2-(гидроксиметил)оксиран-2-илкарбонил)-3-метилбут-3-енил)амида, MG-115, CEP1612 и MG132.
13. Способ по п.1, в котором ингибитор протеасом является содержащим борную кислоту дипептидным ингибитором протеасом бортезомибом.
14. Способ по п.1, в котором раковым заболеванием является, по меньшей мере, раковое заболевание, выбранное из лейкоза, острого лейкоза, острого лимфобластного лейкоза (ALL), В-клеточного, Т-клеточного или FAB ALL, острого миелоидного лейкоза (AML), острого миелогенного лейкоза, хронического миелоцитарного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), ретикулоэндотелиоза, миелодиспластического синдрома (MDS), лимфомы, болезни Ходжкина, злокачественной лимфомы, неходжкинской лимфомы, лимфомы Беркитта, множественной миеломы, саркомы Капоши, колоректальной карциномы, карциномы поджелудочной железы, почечноклеточной карциномы, карциномы клеток простаты, назофарингеальной карциномы, злокачественного гистиоцитоза, паранеопластического синдрома/гиперкальциемии злокачественности, солидных опухолей, аденокарцином, сарком и злокачественной меланомы.
15. Способ по п.1, в котором анти-IL-6-антагонист вводят последовательно, периодически или одновременно с ингибитором протеасом.
16. Способ ингибирования роста опухоли у млекопитающего, включающий введение этому млекопитающему вместе с ингибитором протеасом моноклонального антитела или его фрагмента, которые предотвращают IL-6-активацию передачи сигнала через мембраносвязанные рецепторы в количестве, эффективном для ингибирования роста указанной опухоли.
17. Способ профилактики метастазов у млекопитающих, включающий введение этому млекопитающему вместе с ингибитором протеасом моноклонального антитела или его фрагмента, которые предотвращают IL-6-активацию передачи сигнала через мембраносвязанные рецепторы в количестве, эффективном для предотвращения метастазов в указанном млекопитающем.
18. Способ по любому из пп.3, 16 или 17, где антителом является cCLB8 или его фрагмент.
Текст
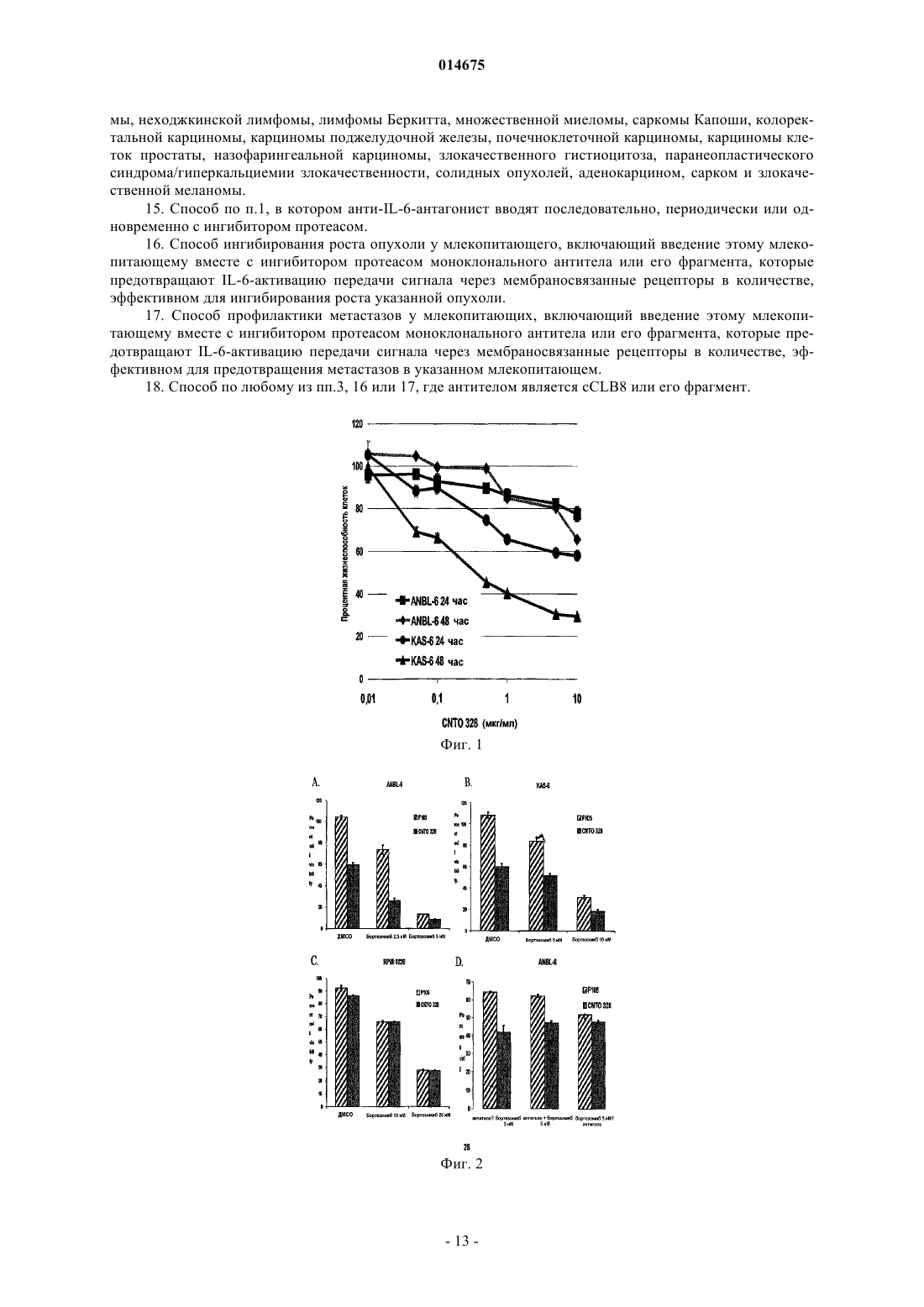
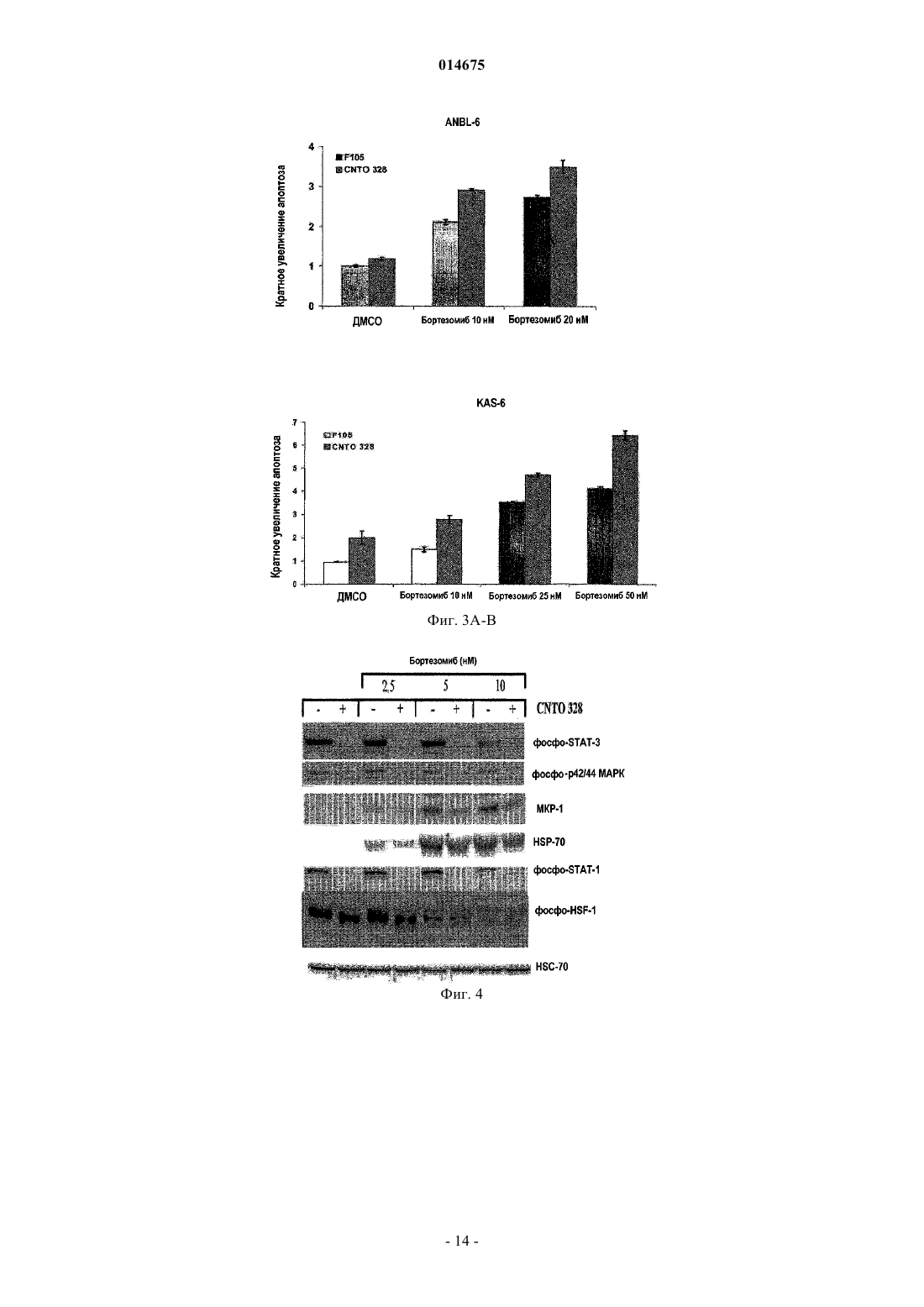
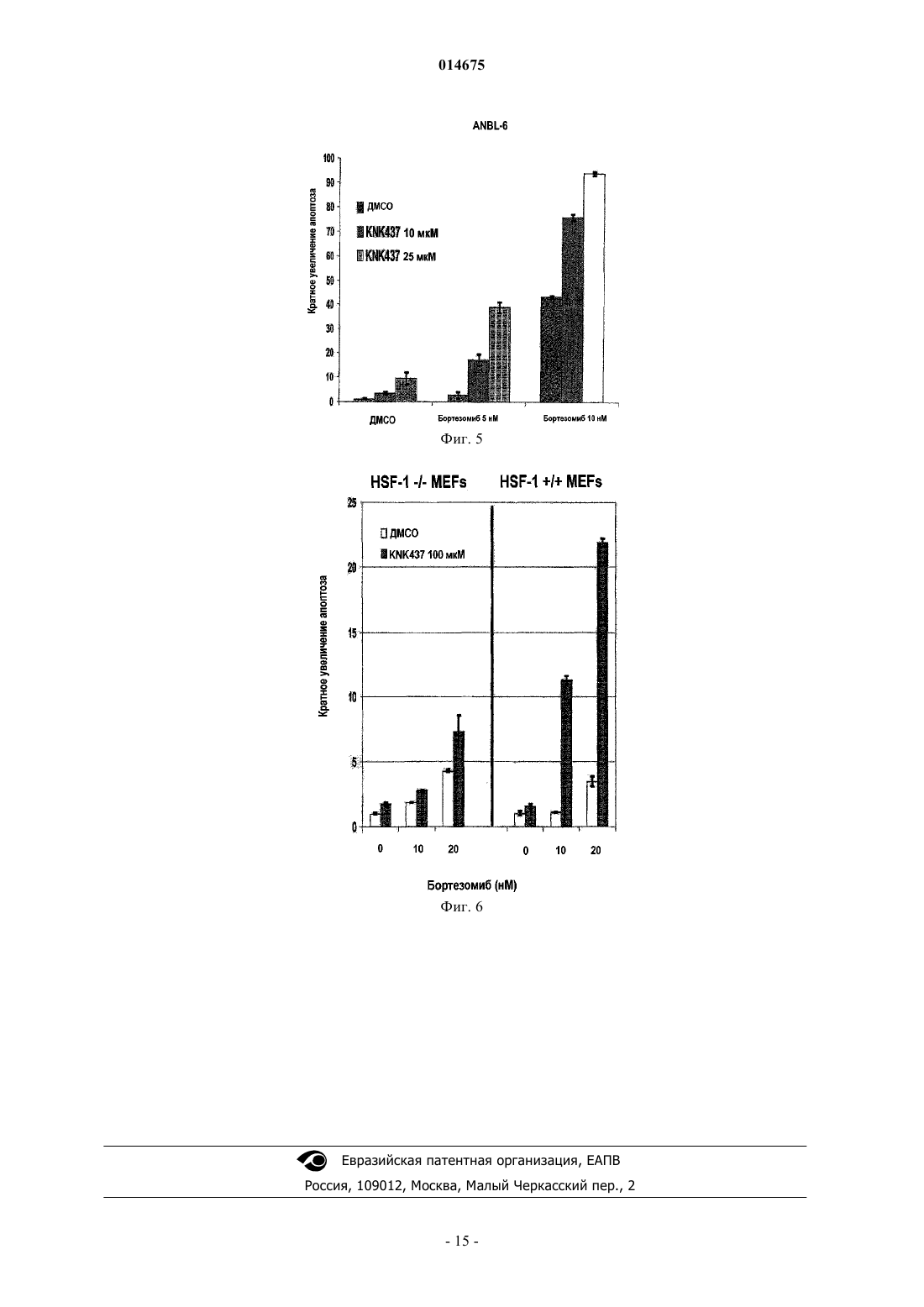
СПОСОБ ПРИМЕНЕНИЯ АНТАГОНИСТОВ IL-6 С ИНГИБИТОРАМИ ПРОТЕАСОМ Настоящее изобретение относится к способу лечения ракового заболевания или связанного с IL-6 нарушения или состояния у млекопитающего, включающего совместное введение ингибитора протеасом с антагонистом IL-6. 014675 Область техники, к которой относится изобретение Настоящее изобретение относится к применению ингибитора протеасом в комбинации с антагонистом интерлейкина-6 для усиления ответа на лечение у индивида, получающего лечение в отношении таких заболеваний, как рак. Настоящее изобретение также относится к способам лечения рака у индивида путем введения индивиду эффективного количества ингибитора протеасом и эффективного количества антагониста интерлейкина-6. Настоящее изобретение относится, в частности, к антителам, в том числе к определенным частям или вариантам, специфичным в отношении белка интерлейкина-6 (IL-6 известен также как интерферон 2. Уровень техники Цитокин IL-6IL-6 (интерлейкин-6) является секретируемым гликопротеином с массой 22-27 кДа, ранее известным как моноцитарный фактор роста В-клеток человека, стимулирующий В-клетки фактор 2, BSF-2, интерферон бета-2 и гибридомный фактор роста, который обладает как стимулирующей рост активностью,так и провоспалительной активностью (Hirano et al. Nature 324: 73-76, 1986).IL-6 принадлежит семейству гранулоцитарного колониестимулирующего фактора (G-CSF) и миеломоноцитарного фактора роста (MGF), которое включает ингибирующий лейкоз фактор (LIF) , онкостатин М (OSM), цилиарный нейротрофический фактор (CNTF), кардиотропин-1 (CT-I), IL-1 и IL-11. IL-6 продуцируется рядом типов клеток, наиболее значительно антигенпрезентирующими клетками, Тклетками и В-клетками. Все цитокины типа IL-6 действуют посредством рецепторных комплексов, содержащих обычный трансдуцирующий сигнал белок, gр 130 (ранее известный как IL-6R-бета). Однако,если IL-6, IL-11, СТ-1 и CNTF связываются сначала со специфичными рецепторными белками, которые затем связываются с gp130, то LIF и OSM непосредственно связываются с комплексом LIF-R и gp130. Специфичный IL-6-рецептор (IL-6R или IL-6-альфа, gp80 или CD126) существует либо в мембраносвязанной, либо в растворимой форме (SIL-6R, форме с массой 55 кДа), каждая из которых способна активировать gр 130. Известно несколько агентов, индуцирующих экспрессию IL-6, например IL-1, IL-2, TNF, IL-4,IFN, онкостатин и LPS. IL-6 принимает участие в разнообразных функциях, таких как активация В- и Тклеток, гематопоэз, активность остеокластов, рост кератиноцитов, синтез белка острой фазы, рост нейронов и активация гепатоцитов (Hirano et al. Int. Rev. Immunol; 16(3-4) :249-84, 1998). Хотя IL-6 вовлечен во многие пути, мыши с нокаутом IL-6 имеют нормальный фенотип, они являются жизнеспособными и фертильными и обнаруживают слегка повышенное количество Т-клеток и пониженную реакцию белка острой фазы на повреждение ткани (Kopf M., et al. Nature: 368:339-42, 1994). Напротив, у трансгенных мышей, которые сверхэкспрессируют церебральный IL-6, развивается неврологическое заболевание, такое как нейродегенерация, астроцитоз, церебральный ангиогенез, и эти мыши не имеют гематоэнцефалического барьера (Campbell et al. PNAS 90: 10061-10065, 1993). Роль IL-6 при раке Предполагается, что IL-6 участвует в патофизиологии нескольких злокачественных заболеваний посредством различных механизмов. Существует гипотеза, что IL-6 является причинным фактором связанного с раком осложнения, такого как астения/кахексия и резорбция кости. Было обнаружено, что индуцированная опухолью кахексия (Cahlin et al. (2000) Cancer Res; 60 (19):5488-9), резорбция костей и ассоциированная гиперкальциемия уменьшаются у мышей с нокаутом IL-6 (Sandhu et al., 1999). Связанная с раком депрессия и отек мозга, являющиеся вторичными нарушениями при опухолях мозга, также связаны с высоким уровнем IL-6 (Musselman et al. Am J Psychiatry.; 158 (8) :1252-7, 2001). Результаты экспериментов на ряде моделей in vitro и in vivo различных типов рака человека показали, что IL-6 является терапевтической мишенью ингибирования. IL-6 может индуцировать пролиферацию, дифференцировку и выживание опухолевых клеток, стимулирует апоптоз (Jee et al. Oncogene 20: 198-208, 2001) и индуцирует устойчивость к химиотерапии (Conze et al. Cancer Res 61: 8851-8858, 2001). Множественная миелома является злокачественной опухолью, относящейся к плазматическим клеткам. Известно, что IL-6 усиливает пролиферацию, дифференцировку и выживание злокачественных плазматических клеток при множественной миеломе (ММ) за счет аутокринного или паракринного механизма, который включает ингибирование апоптоза злокачественных клеток. Таким образом, было сделано предположение, что блокирование IL-6 может быть эффективной терапией (Anderson et al. Hematology: 147-165, 2000) . Выполнялись эксперименты как in vitro (Tassone, P. et al. Int. J. Oncol. 21(4): 867-873,2002), так и клинические исследования (Bataille et al. (1995) Blood; 86(2): 685-91 и Van Zaanen, et al.(1996) J Clin. Invest. 98: 1441-1448), и результаты показали, что блокада IL-6 оказывает воздействие на рост раковых клеток. Протеасомный путь в качестве терапевтической мишени Данные недавних экспериментов явно указывают, что ингибиторы протеасом могут, действительно,быть эффективными при некоторых патологиях, таких как рак, астма, инфаркт головного мозга и аутоиммунный энцефаломиелит. При раке действие таких лекарственных средств заключается в ингибировании деградации различных ингибиторов клеточного цикла или ингибировании антиапоптотического ре-1 014675 гулятора NF-В, тогда как при нейропротекции их воздействие связано с ингибированием активации NFВ, который в данном случае индуцирует воспалительную реакцию. При аутоиммунных заболеваниях ингибиторы протеасом могут воздействовать путем ингибирования презентации "собственных" пептидов, а также влияя на передачу сигнала по клеточному иммунному каскаду. Содержащий борную кислоту дипептидный ингибитор протеасом PS-341, бортезомиб(VELCADE), является первым одобренным терапевтическим средством, известным как сильнодействующий и специфичный ингибитор протеасом. Хотя бортезомиб важен для улучшения лечения миеломы, лишь 27% пациентов, с резистентностью к лечению или с рецидивом заболевания, имели частичный ответ или улучшение результатов в клинических испытаниях начальной фазы II, что привело к одобрению их FDA (Richardson P.G. et al., N Engl. J Med. 2003, 348: 2609-17). В преклинических испытаниях были идентифицированы важные медиаторы индуцируемой химиорезистентности, в том числе антиапоптотические пути, активируемые под воздействием ингибиторов протеасом, ослабляя тем самым их противоопухолевую активность (обзор в Saleh A et al., Nat Cell Biol. 2000, 2: 476-83). Одним из механизмов химиорезистентности ингибиторов протеасом является индукция экспрессииHSP-70, важного ингибитора апоптоза. Ингибирование протеасомы приводит к накоплению неправильно уложенных белков и чрезмерной активации членов семейства белков теплового шока, особенно HSP-70,посредством активации фактора транскрипции HSF-1.5-8. Была выдвинута гипотеза, что терапевтические средства, которые подавляют индукцию HSP-70, могут стимулировать активность ингибиторов протеасом. В других исследованиях ингибирование экспрессии HSP-70 с помощью siPHK или способов с использованием антисмысловых последовательностей вызывала проапоптотическую активность ингибиторов протеасом на других преклинических моделях рака (Robertson J.D. et al., Biochem J 1999, 344: 477-85;Gabai V.L. et al., Oncogene 2005, 24: 3328-38). Вторым примером агента индуцируемой химиорезистентности является фосфатаза МКР-1, которая транскрипционно активируется ингибиторами протеасом (Orlowski R.Z. et al, J Biol. Chem. 2002, 277: 27864-71). Фосфатаза МКР-1 является белком стрессовой реакции, который также является антиапоптотическим, действующим посредством инактивации c-Jun-N-концевой киназы. Было показано, что ингибирование МКР-1 усиливает противоопухолевую эффективность ингибиторов протеасом (Small G.W. etIL-6 играет центральную роль в патогенезе миеломы, на что указывает ее способность функционировать в качестве фактора роста и выживания миеломных клеток в микроокружении костного мозга, и активировать антиапоптотическую программу, которая снижает чувствительность к различным химиотерапевтическим средствам. Было показано, что IL-6 активирует экспрессию HSP-70 в нескольких модельных системах. Во-вторых, STAT-1, важный фактор транскрипции конечных этапов сигнального пути,активируемый сигналом IL-6, взаимодействует с HSF-1, стимулируя транскрипцию членов семейства белков теплового шока. Таким образом, при поиске более эффективных, менее токсичных и более длительных клинических ответов важно показать комбинацию агентов, эффективных в лечении определенных типов рака и связанных или не связанных с резким истощением мышц, а также с определенными аутоиммунными нарушениями нейронального или ненейронального происхождения. До сих пор не были показаны эффективные комбинации ингибиторов цитокина IL-6 и ингибиторов протеасом. Сущность изобретения Настоящее изобретение относится к способам лечения заболевания у индивида путем введения индивиду эффективного количества ингибитора протеасом и эффективного количества антагониста IL-6. Способ по изобретению включает введение антагониста IL-6 последовательно, периодически или одновременно с бортезомибом или соответствующими ингибиторами протеасом. В одном из вариантов осуществления антагонист IL-6 является высокоаффинным анти-IL-6-антителом. В другом варианте осуществления антагонист IL-6 является анти-IL6R-антителом. Заболевание, подлежащее лечению способом по изобретению, включает рак, астму, воспалительное заболевание и неврологическое заболевание. В одном из вариантов осуществления заболевание представляет собой рак. Настоящее изобретение также относится к способу прогнозирования применимости комбинации по меньшей мере одного антагониста IL-6 и по меньшей мере одного ингибитора протеасом. Краткое описание чертежей На фиг. 1 показан график, демонстрирующий эффект действия увеличивающейся концентрацииCNTO328 на клетки множественной миеломы, обработанные указанное число раз. На фиг. 2 А-D показаны столбчатые диаграммы, представляющие относительную процентную жизнеспособность указанных клеток, инкубированных антителом, F105, и иррелевантным контрольным Mab или CNTO328 и указанной концентрацией бортезомиба: А) клетки множественной миеломы ANBL-6,прединкубированные с антителом, а затем обработанные бортезомибом при указанной концентрации, В) клетки множественной миеломы KAS-6, прединкубированные с антителом и затем обработанные бортезомибом при указанной концентрации, С) IL-6-независимые миеломные клетки RPMI8226 и D) клетки-2 014675 множественной миеломы ANBL-6, обработанные одновременно CNTO328 и бортезомибом. На фиг. 3 А-В показаны столбчатые диаграммы, представляющие относительное кратное увеличение апоптоза, измеренного в IL-6-зависимых клеточных линиях ANBL-6 (А) и КАХ-6 (В), обработанных комбинациями антитела и бортезомиба, где F105 является контрольным Mab. На фиг. 4 показан Вестерн-блот геля с белками клеточных образцов ANBL-6 после обработкиCNTO328 или контрольным Mab и увеличивающимися концентрациями бортезомиба, с меткой на HSC70 и МКР-1. На фиг. 5 показана столбчатая диаграмма, представляющая относительное кратное увеличение апоптоза, измеренного в клетках ANBL-6, инкубированных с контролем-носителем (ДМСО) или двумя концентрациями бортезомида и увеличивающимися концентрациями аттенуатора белков теплового шокаKNK.437. На фиг. 6 показана столбчатая диаграмма, показывающая относительное кратное увеличение апоптоза, измеренного в клетках MEF, которые являются дефицитными (-/-) или нормальными (+/+) по HSF,инкубированных с контролем-носителем (ДМСО) или двумя концентрациями бортезомиба и увеличивающимися концентрациями аттенуатора белков теплового шока KNK437. Подробное описание изобретения АббревиатурыIg - иммуноглобулин; IgG - иммуноглобулин G; IL - интерлейкин; IL-6 - интерлейкин-6; IL-6R - рецептор интерлейкина-6; SIL-6R - растворимый рецептор интерлейкина-6; HSF-1 - фактор транскрипции белка теплового шока; HSP - белок теплового шока; MAPK - активируемая митогеном протеинкиназа;MPK-1, MAPK - фосфатаза; Mab, моноклональное антитело; STAT - фактор активации трансдукции сигнала. Определения Термин "антитело" используется в данном контексте в самом широком смысле и конкретно включает моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифичные антитела, (например, биспецифичные антитела) и фрагменты антител, с длиной, позволяющей проявлять желаемую биологическую активность. "Фрагменты антител" содержат часть полноразмерного антитела, обычно антигенсвязывающий или вариабельный домен антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; димерные антитела; линейные антитела; одноцепочечные молекулы антител и мультиспецифичные антитела, образованные из фрагментов антител."Химерные антитела" являются антителами, которые сохраняют различные домены, обычно вариабельный домен, одного вида и остальную часть другого вида; например химеры мышь-человек. Термин "антитело человека" включает в этом контексте антитела с вариабельной и константной областями, полученные из последовательностей зародышевой линии человека или близкородственных последовательностей иммуноглобулина зародышевой линии человека. Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные случайным или сайт-специфичным мутагенезом in vitro или соматической мутацией in vivo, например, во время рекомбинации сегментов V, D и J тяжелой цепи иммуноглобулина человека). Таким образом, в контексте настоящего изобретения, термин"антитело человека" относится к антителу, в котором, по существу, каждая часть этого белка (например,CDR, каркасная область, CL-, CH-домены (например, CH1, CH2, CH3), шарнирная область, (VL, VH является, по существу, аналогичной частям, кодируемым генами антитела зародышевой линии человека. Антитела человека были классифицированы в группы на основании сходства их аминокислотной последовательности, см., например, http://people.cryst.bbk.ас.uk/ubcg07s/. Таким образом, при использовании поиска на сходство последовательностей антитело со сходной линейной последовательностью может быть выбрано в качестве шаблона для отбора или создания антител человека или гуманизированных антител. В данном контексте термин "высокая аффинность" в применении к антителу обозначает антитело,имеющее KD 10-8 M или менее, более предпочтительно 10-9 М или менее и даже более предпочтительно 10-10 М или менее. Термин "Kdis" или "KD" или "Kd", в данном контексте, относится к скорости диссоциации конкретного взаимодействия антитело-антиген. KD" является отношением скорости диссоциации(k2) , также обозначаемой (koff), к скорости ассоциации (k1) или также обозначаемой (kon). Таким образом,KD равна k2/k1 или koff/kon и выражается в виде молярной концентрации (М). Отсюда следует, что чем меньше KD, тем сильнее связывание. Так, 10-6 М (или 1 мМ) свидетельствует о слабом связывании по сравнению с 10-9 М (или 1 нМ). В этом контексте "система убиквитин-протеасома" является мультикомпонентной системой, которая идентифицирует и деградирует нежелательные белки. Эта система включает ферменты, необходимые для распознавания нежелательных белков в результате их повреждения, неправильной укладки или короткоживущих в клетке белков, которые представляют собой ферменты, связанные с убиквитинилированием нежелательных белков, а также ферменты, которые содержат протеасомную структуру, которая является мультисубъединичным комплексом, обнаруживаемым как в ядре, так и в цитозоле.-3 014675 В данном контексте термин "ингибитор протеасом" включает ингибиторы пептидаз протеасомы. Более конкретно, эти ингибиторы пептидаз протеасомы включают ингибиторы химотрипсинподобных и трипсинподобных протеаз наряду с тиоловыми и сериновыми протеазами. В данном контексте термин "резистентный" в отношении терапевтического средства при ссылке на раковые клетки обозначает, что эта клетка приобрела резистентность к воздействию этого средства,обычно вызываемую действием средства с определенным уровнем или концентрацией в окружающей среде этого средства, что нарушает или ингибирует пролиферацию, или клетка ингибируется до очень низкой степени при взаимодействии с таким уровнем терапевтического средства по сравнению с ситуацией, когда нормальные или нерезистентные клетки приводят в контакт с тем же самым уровнем или с той же самой концентрацией такого терапевтического средства. Свойство быть резистентным к терапевтическому средству является в высокой степени изменчивым свойством, причем разные типы раковых клеток проявляют различные уровни "резистентности" к конкретному терапевтическому средству при различных условиях. Ингибитор протеасом бортезомиб позволяет достичь значительного прогресса в лечении множественной миеломы, но его эффективность ограничивается рядом механизмов резистентности. Одним из наиболее важных является путь белков теплового шока (HSP) и путь стрессовых реакций, которые посредством таких членов, как HSP-70 и фосфатаза (МКР)-1 активируемой митогеном протеинкиназы(МАРК), противостоят проапоптотической активности бортезомиба. Поскольку передача сигнала интерлейкина (IL)-6 повышает реакцию теплового шока через трансдуктор сигнала и активатор транскрипции(STAT)-1 и фактор транскрипции теплового шока (HSF)-l, авторы настоящей заявки высказали гипотезу,что отрицательная регуляция передачи сигнала IL-6 могла бы ослаблять индукцию HSP бортезомибом,усиливая посредством этого его антимиеломную активность. Обработка IL-6-зависимых линий клеток множественной миеломы KAS-6 и ANBL-6 комбинацией бортезомиба и CNTO 328, химерным моноклональным нейтрализующим IL-6 антителом, приводила к более значительному уменьшению жизнеспособности клеток, чем любым из этих средств по отдельности, зависимым от времени и концентрации образом. Это было связано с повышенной индукцией апоптоза, которая, при некоторых условиях, была более высокой, чем сумма действий этих двух индивидуальных агентов по отдельности, что предполагает синергическое взаимодействие. Подобные результаты не наблюдали при использовании изотипически сходных контрольных антител и при исследованиях IL6-независимой линии клеток миеломы RPMI 8226. Повышенную активность наблюдали при обработке клеток антителом CNTO 328 последующей обработкой бортезомибом или при их обработке обоими агентами одновременно по сравнению с обработкой бортезомибом с последующей обработкой CNTO 328. Обработка антителом CNTO 328 значительно ингибировала IL-6-опосредованные последующие пути передачи сигнала, как показано заметной блокадой фосфорилирования STAT-3 и р 44/42 МАРК. Антитело CNTO 328 уменьшало опосредованную бортезомибом индукцию экспрессии HSP-70 и МКР-1 на 45% и 90%, соответственно. Примечательно, что антитело CNTO 328 заметно уменьшало уровни транскрипционно активного фосфо-STAT-1 и уменьшало гиперфосфорилирование HSF-1. Другие стратегии подавления реакции теплового шока, в том числе применение фармакологического ингибитора KNK437,также доказывают синергическое антимиеломное действие комбинации с бортезомибом. Синергическая активность KNK437 и бортезомиба воспроизводилась в фибробластах нормальных эмбрионов мышей(MEF), но уменьшалась в MEF с нокаутом HSF-1. В целом, авторы заявки продемонстрировали, что ингибирование передачи сигнала IL-6 усиливает антимиеломную активность бортезомиба. Это также подтверждает гипотезу, что это происходит, по меньшей мере частично, посредством ослабления опосредованной ингибитором протеасом индукции реакции теплового шока через отрицательную регуляцию транскрипционно активных STAT-1 и HSF-1. Описание настоящего изобретения дает логическое обоснование способа лечения пациентов анти-IL-6-антителами последовательно, периодически или одновременно с бортезомибом или соответствующими ингибиторами протеаз. Антагонисты IL-6 по изобретению Антагонист IL-6, используемый в настоящем изобретении, может быть антагонистом IL-6 любого происхождения при условии, что он блокирует передачу сигнала IL-6 и ингибирует биологическую активность IL-6. Примеры антагонистов IL-6 включают IL-6-антитело, IL-6R-антитело, gp130-антитело,мутант IL-6, антисмысловой нуклеотид IL-6R и частичные пептиды IL-6 или IL-6R. Пример мутанта IL6, используемого в настоящем изобретении, описан в Brakenhoff, et al., J. Biol. Chem., 269, 86-93, 1994 или Savino, et al. , EMBO J., 13, 1357-1367, 1994. Этот мутантный полипептид или его фрагмент IL-6 не обладает эффектом на передачу сигнала IL-6, но сохраняет связывающую активность с IL-6R, и его получают за счет введения мутации в форме замены, делеции или инсерции в аминокислотную последовательность IL-6. Хотя нет ограничений в отношении используемых видов животных, предпочтительно использовать IL-6 человека. Подобным образом, любые частичные пептиды IL-6 или частичные пептидыIL-6R могут быть использованы в настоящем изобретении, при условии, что они предотвращают действие IL-6 или IL-6R (gp80) или gp130 на трансдукцию сигнала и посредством этого предотвращают связанную с IL-6 биологическую активность (см. патент США 5210075; ЕР 617126 в отношении деталей,касающихся частичных пептидов IL-6 и частичных пептидов IL-6R). Еще в одном варианте осуществле-4 014675 ния, в способе по изобретению могут быть использованы олигонуклеотиды, способные осуществлять сайленсинг РНК IL-6 или IL-6R или антисмысловые механизмы (см. JP5-300338 в отношении деталей,касающихся антисмыслового олигонуклеотида IL-6R). Антитела по изобретению Антитела, применимые по настоящему изобретению, включают выделенные химерные, гуманизированные и/или CDR-трансплантированные антитела или антитела человека, имеющие по меньшей мере одну антигенсвязывающую область, которые способны ингибировать биологические функции IL-6. Примеры антител по изобретению включают IL-6-связывающее антитело, IL-6R (gp80)-связывающее антитело, gp130-связывающее антитело. Примеры IL-6R-антител с подходящими антигенсвязывающими областями включают антитело РМ-1 (Hirata, et al., J. Immunol., 143, 2900-2906, 1989) и антитело AUK1220, AUK64-7 или AUK146-15 (WO 92-19759). В другом варианте осуществления анти-IL-6R-антитело является реконструированным антителом, известным как MRA, описанным в патентах США с номерами 5888510 и 6121423. В одном из вариантов осуществления антигенсвязывающую область получают из высокоаффинного анти-IL-6-антитела CLB-8. Примером антитела по изобретению, полученным из CLB-6, является антитело CNTO328, описанное заявителями в ожидающей одновременного рассмотрения заявке на патент США с порядковым номером 10/280716, содержание которой включено в настоящее изобретение в качестве ссылки. В другом варианте осуществления это антитело является антителом человека, которое связывает IL-6 с высокой аффинностью, например, описанное заявителями в ожидающей одновременного рассмотрения предварительной заявке на патент США с порядковым номером 60/677319. Антитело по изобретению специфично нейтрализует IL-6 человека с высокой аффинностью. Анти-IL-6-антитело, которое может быть использовано в способе по настоящему изобретению,включает любую молекулу белка или пептида, которая содержит по меньшей мере один определяющий комплементарность район (CDR) тяжелой цепи или легкой цепи или его лигандсвязывающую часть,произведенный из моноклонального антитела CLB-8 мыши, в комбинации с константной областью тяжелой цепи или легкой цепи, каркасной областью или любой их частью, которая может быть включена в антитело настоящего изобретения. В одном варианте осуществления настоящее изобретение относится к химерному анти-IL-6-антителу, содержащему две легкие цепи и две тяжелые цепи, причем каждая из этих цепей содержит по меньшей мере часть константной области человека и по меньшей мере часть вариабельной области (v), полученной из моноклонального антитела C-CLB8 мыши, имеющего специфичность в отношении IL-6 человека, причем указанное антитело связывается с высокой аффинностью с ингибирующим и/или нейтрализующим эпитопом IL-6 человека, такое как антитело cCLB-8. Изобретение включает также фрагменты или производное такого антитела, например, одну или несколько частей цепи антитела, например, константной области, J-области или вариабельной области тяжелой цепи или константной области, J-области или вариабельной области легкой цепи. Предпочтительные антитела по изобретению включают химерные, гуманизированные и/или CDRтрансплантированные антитела или антитела человека, которые будут конкурентно ингибировать связывание in vivo с IL-6 человека анти-IL-6-антитела мыши CLB-8, химерного анти-IL-6-антитела CLB-8, или антитела, имеющего, по существу, те же самые характеристики связывания, а также их фрагменты и области. Антитело по изобретению, предпочтительно, связывает анти-IL-6 или анти-IL-6R с аффинностью(Kd) по меньшей мере 10-9 М, предпочтительно по меньшей мере 10-10 М и/или, по существу, нейтрализует по меньшей мере одну активность по меньшей мере одного белка IL-6. В предпочтительном варианте осуществления, это антитело связывает IL-6 с аффинностью (Kd) по меньшей мере 110-11 М, предпочтительно 510-11 M, и нейтрализует IL-6 человека. Предпочтительно это антитело не связывает другие члены суперсемейства IL-6 и блокирует передачу сигнала gp130. Ингибиторы протеасом Протеасома представляет собой внутриклеточную структуру, которая является мультикаталитической протеиназой, которая является высококонсервативной. Протеасомы ответственны за АТФзависимый протеолиз многих белков, участвующих в важных регуляторных клеточных процессах. Так,протеасома является регуляторным элементом роста и дифференцировки клеток. Средняя клетка человека содержит приблизительно 30000 протеасом, каждая из которых содержит несколько расщепляющих белки протеаз. Эти комплексы находятся в огромном множестве клеточных функций, включающих транскрипцию, контроль клеточного цикла, стрессовую реакцию, биогенез рибосом и отклоняющийся от нормы катаболизм белков. Таким образом, они играют роль в таких процессах, как иммунные и воспалительные реакции (WO 95/25533), вирусная инфекция, онкогенез, нервная и мышечная дегенерация (патент США 5340736), процессинг антигенов (WO 94/17816), репарация ДНК и дифференцировка клеток. Активность протеасомы утонченным образом регулируется для поддержания строгого управления скоростью деградации и специфичными типами деградируемых белков. Несколько стадий участвуют в деградации белка через протеасомный или "убиквитинпротеасомный" путь. Сначала белок метят для деструкции цепью малых полипептидов, известных как-5 014675 убиквитин. Убиквитинилирование направляет этот белок в заключенную в протеасоме протеолитическую камеру. Для убиквитинилирования необходимы три ферментативные активности, Е 1, Е 2 и Е 3. АТФ-зависимый фермент Е 1 активирует убиквитин и связывает его с убиквитинконъюгирующим ферментом, Е 2. Затем фермент Е 3, убиквитинлигаза, связывает молекулу убиквитина с этим белком. Этот процесс повторяется до тех пор, пока у указанного белка не образуется позади длинная цепь убиквитиновых частей молекулы, и протеасома, наконец, деградирует этот белок на малые фрагменты. Убиквитин-протеасомный путь ответственен за деградацию 90% всех патологических, неправильно уложенных белков и всех короткоживущих, регуляторных белков в клетке. Эти короткоживущие белки, полупериоды существования которых составляют менее трех часов, ответственны за 10-20% всех клеточных белков. Этот путь разрушает также большое количество относительно долгоживущих клеточных белков. Таким образом, убиквитин-протеасомный путь является ответственным за деградацию 80-90% всех внутриклеточных белков. Описанные ранее ингибиторы протеасом включают пептидилальдегиды. Их предварительная оптимизация показала предпочтение по лейцину в положении Р 1 и большого гидрофобного остатка, такого как нафтилаланин, в положениях Р 2 или Р 3. Поскольку, как было показано, пептидилальдегиды обладают также сильным ингибированием тиоловых пептидаз (например, кальпаинов, катепсинов) и не являются конфигурационно стабильными вследствие кислотности протона в альфа-положении, исследовали замены для альдегидной группы. Кроме антибиотических ингибиторов, первоначально выделенных из актиномицетов, синтезировали различные пептид-альдегиды, такие как ингибиторы химотрипсин-подобных протеаз, описанные Siman et al. (WO 91/13904). Сообщались различные ингибиторы протеасомного комплекса, например, Dick,et al., Biochem. 30: 2725 (1991); Goldberg, et al. , Nature 357: 375 (1992); Goldberg, Eur. J. Biochem. 203: 9al., J. Biol. Chem. 264: 12, 215 (1989); Tanaka, et al. , New Biol. 4: 1 (1992). Ингибиторы протеасом обсуждаются также в патенте США 5693617, описание которого включено здесь в качестве ссылки. Предпочтительным ингибитором протеасом является "PS-341", который называют содержащим боровую кислоту дипептидным ингибитором протеасом бортезомибом (MLN-341, LDP-341 и PS-341; N(морфолино)карбонил)-бета-(1-нафтил)-L-аланин-L-лейцин-борная кислота), продаваемым под торговым названием VELCADE, WO 96/013266). PS-341 ингибирует активацию фактора транскрипции NF-В.PS-341 отрицательно регулирует также экспрессию нескольких ингибиторов апоптоза, индуцирует каспаза-зависимый апоптоз устойчивых к лекарственным средствам линий клеток множественной миеломы(ММ) и клеток пациента, ингибирует связывание клеток ММ со стромальными клетками костного мозга(BMSC) и ингибирует продуцирование факторов роста и выживания ММ в среде костного мозга. В противоположность пептидальдегидам, которые ингибируют активности как протеасомы, так и цистеиновых протеаз, бортезомиб является гораздо более сильным и селективным ингибитором протеасомы. Он имеет очень высокую селективность в отношении протеасомы (более чем 500-кратную) по сравнению с другими сериновыми протеазами, включающими эластазу лейкоцитов человека, катепсинG, хемотрипсин и тромбин. Бортезомиб был недавно одобрен для применения при лечении рецидивирующей и трудно поддающейся лечению множественной миеломы. Ингибирование активности протеасом опухолевых клеток бортезомибом в различных моделях опухолевых культур связано с индукцией апоптоза. Специфичные ингибиторы протеасом подразделены на пять классов, различающихся фармакофором, который взаимодействует с треонином активного сайта в протеасоме: пептидальдегиды, такие как СЕР 1612 и MG132, пептид-боронаты, такие как бортезомиб, пептидвинилсульфоны, пептидэпоксикетоны и -лактоновые ингибиторы, такие как лактоцистин. Следующие соединения или их аналоги также обсуждаются как применимые в качестве ингибиторов протеасом по изобретению: PS-519 (1R[1S,4R,5S-1-(1-гидрокси-2-метилпропил)-4-пропил-6-окса-2-азабицикло[3.2.1]гептан-3,7-дион); кластолактацистин-бета-лактон; лактацистин, эпоксомицин, CVT634 (5-метокси-1-инданон-S-ацетиллейцил-Dлейцил-1-инданиламид), TMC96 3-метилбутаноил-L-треонин-N-(1-(2-(гидроксиметил)оксиран-2-илкарбонил)-3-метилбут-3-енил)амид), MG-115, CEP1612 и MG132. Кроме ингибиторов протеаз протеасомы, убиквитинпротеасомный путь может быть блокирован ингибиторами вспомогательных ферментов убиквитинактивирующего фермента (Е 1), убиквитинконъюгирующего фермента (Е 2) и убиквитинлигаз (ферментов Е 3). Были идентифицированы ингибиторы Е 1,такие как химеиновая кислота A (Tsukamoto, et al. 2005, Bioorgan Med. Chem. Lett. 15(1):191-194. Другие способы, известные в данной области, такие как сайленсинг РНК, могут быть также использованы для уменьшения или элиминации активностей специфичных связанных с убиквитинилированием ферментов. Мониторинг ингибирующей протеосомы активности Способ мониторинга фармакодинамического лекарственного действия ингибитора протеасом в млекопитающем описан в патенте США 6613541, причем авторы неожиданно обнаружили, что анализex vivo активности протеасом, а не концентрация лекарственного средства, в биологических пробах обеспечивает полезный способ мониторинга фармакодинамического лекарственного действия ингибито-6 014675 ров протеасом и что эти данные обеспечивают руководство для отбора последующего дозового количества и частоты доз ингибитора протеасом, который должен вводиться в будущем. Этот способ предусматривает введение ингибитора протеасом млекопитающему; получение одной или нескольких биологических тест-проб из этого млекопитающего после введения ингибитора протеасом; измерение активности протеасом в биологической тест-пробе или в биологических тест-пробах; определение величины активности протеасом в биологической тест-пробе или в биологических тест-пробах и сравнение величины активности протеасом в биологической тест-пробе с величиной активности протеасом в ссылочной биологической пробе, полученной из млекопитающего, которому не был введен ингибитор протеасом. Патент США 6613541 дополнительно относится к способу определения схемы введения доз для ингибитора протеасом, способу определения фоновой активности протеасом у млекопитающего, в том числе у человека, и к набору для измерения активности протеасом в биологической пробе из млекопитающего. Способы патента США 6613541 могут использоваться для биологических проб, выбранных из проб крови, мочи, тканевой биопсии. Измерение IL-6IL-6 может быть детектирован в биоанализах, использующих чувствительные к IL-6 клеточные линии (см.: 7TD1; В 9; CESS, KPMM2; КТ-3; Ml, MH60-BSF-2, MO7 Е; Mono Mac 6; NFS-60; PIL-6; SKW6C14; T1165; XG-1). IL-6 может также анализироваться по его активности в качестве фактора роста гибридом (см.: HGF). Доступны также чувствительные иммуноанализы и колориметрические тесты. Альтернативным способом детектирования является ОТ-ПЦР-определение количества цитокинов. АнализELISA используют для детектирования связанного с рецептором белка gp130 (такие реагенты доступны,например, из (RD Systems). Для детектирования IL-6, связанного с CNTO328, анти-ID-(антитела против вариабельной области,описанные заявителями в ожидающей одновременного рассмотрения заявке на патент США с порядковым номером 10/280716), могут быть использованы для детектирования в любом стандартном формате иммуноанализа, таком как анализ типа ELISA. Заболевания, поддающиеся лечению с использованием способа настоящего изобретения Экспрессия IL-6 с нарушенной регуляцией является, возможно, одним из основных факторов, участвующих в патогенезе ряда заболеваний. Избыточная сверхпродукция IL-6 (и других факторов дифференцировки В-клеток) была отмечена при различных патологических состояниях, таких как ревматоидный артрит, множественная миелома, синдром Леннерта (гистиоцитарная лимфома), болезнь Кастлмана(лимфаденопатия с массивной инфильтрацией плазматических клеток, гамма-глобулинемией, анемией и повышенными концентрациями белков острой фазы), сердечные миксомы и цирроз печени. Также был отмечен конститутивный синтез IL-6 глиобластомами и секрецию IL-6 в цереброспинальную жидкость. Что касается иммуноопосредованных воспалительных заболеваний (IMID), предполагается, что IL6 участвует в патогенезе хронического полиартрита (вместе с IL-1 и IL-8), так как избыточные концентрации IL-6 обнаруживаются в синовиальной жидкости. В воспалительных кишечных заболеваниях повышенные уровни IL-6 в плазме могут быть показателем патологического состояния. У пациентов с мезангиальным пролиферативным гломерулонефритом повышенные уровни IL-6 в моче являются также показателем патологического состояния. IL-6 может играть роль в иммуноопосредованном патогенезе сахарного диабета как типа I, так и типа II. Таким образом, настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного IL-6-связанного заболевания в клетке, ткани, органе, животном или пациенте, известного в данной области или описанного здесь, с использованием по меньшей мере одного IL-6 антитела настоящего изобретения, например, введением или контактированием этих клетки, ткани, органа, животного или пациента с терапевтически эффективным количеством IL-6-антитела вместе с введением ингибитора протеасом. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного IL-6-связанного заболевания, в клетке, ткани, органе, животном или пациенте, в том числе, но не только, по меньшей мере одного заболевания, выбранного из ожирения, связанного с иммунной системой заболевания, сердечно-сосудистого заболевания, инфекционного заболевания, злокачественного заболевания или неврологического заболевания. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного IL-6-связанного заболевания, связанного с иммунной системой, в клетке, ткани, органе, животном или пациенте, в том числе, но не только, по меньшей мере одного заболевания, выбранного из ревматоидного артрита, ювенильного ревматоидного артрита, системного возникновения ювенильного ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, язвы желудка, серонегативных артропатий, остеоартрита, остеолиза, асептического расшатывания ортопедических имплантатов, воспалительного заболевания кишечника, язвенного колита, системной красной волчанки, антифосфолипидного синдрома, иридоциклита/увеита/ретробульбарного неврита, идиопатического фиброза легких, системного васкулита/гранулематоза Вегенера, саркоидоза, орхита/процедур реверсирования вазектомии, аллергических/атопических заболеваний, астмы, аллергического ринита, экземы, аллергического контактного дерматита, аллергического конъюнктивита, аллергического пневмонита, трансплантатов, отторжения трансплантатов органов, реакции трансплантат против хозяина, системного синдрома воспалительной-7 014675 реакции, синдрома сепсиса, грамположительного сепсиса, грамотрицательного сепсиса, культураотрицательного сепсиса, грибкового сепсиса, нейтропенической лихорадки, уросепсиса, менингококкемии, травмы/кровотечения, ожогов, воздействия ионизирующего облучения, острого панкреатита, респираторного дистресс-синдрома взрослых, ревматоидного артрита, индуцированного алкоголем гепатита, хронических воспалительных патологий, саркоидоза, болезни Крона, серповидно-клеточной анемии,диабета, нефроза, атопических заболеваний, аллергических реакций, аллергического ринита, сенной лихорадки, хронического аллергического ринита, конъюнктивита, эндометриоза, астмы, крапивницы, системной анафилаксии, дерматита, пернициозной (злокачественной) анемии (болезни Аддисона-Бирмера),гемолитического заболевания, тромбоцитопении, отторжения трансплантата любого органа или любой ткани, отторжения трансплантата почки, отторжения трансплантата сердца, отторжения трансплантата печени, отторжения трансплантата поджелудочной железы, отторжения трансплантата легкого, отторжения трансплантата костного мозга (ВМТ), отторжения аллотрансплантата кожи, отторжения трансплантата хряща, отторжения трансплантата кости, отторжения трансплантата тонкой кишки, отторжения трансплантата фетальной вилочковой железы, отторжения трансплантата паращитовидной железы, отторжения ксенотрансплантата любого органа или любой ткани, отторжения аллотрансплантата, реакций гиперчувствительности к антителу против рецептора, болезни Грейвса, болезни Рейно, инсулинзависимого диабета типа В, астмы, тяжелой псевдопаралитической миастении, опосредованной антителами цитотоксичности, реакций гиперчувствительности типа III, синдрома POEMS (полиневропатии, спланхиомегалии, эндокринопатии, моноклональной гаммапатии и синдрома кожных изменений), полиневропатии, спланхиомегалии, эндокринопатии, моноклональной гаммапатии, синдрома кожных изменений,антифосфолипидного синдрома, пузырчатки, склеродермии, заболевания смешанных соединительных тканей, идиопатической болезни Аддисона, сахарного диабета, хронического активного гепатита, первичного билиарного цирроза, витилиго, васкулита, синдрома пост-MI-кардиотомии, гиперчувствительности типа IV, контактного дерматита, аллергического пневмонита, отторжения аллотрансплантата, гранулем, вызванных внутриклеточными организмами, чувствительности к лекарственным средствам метаболических/идиопатических заболеваний, болезни Вильсона, гемохроматоза, недостаточности альфа-1 антитрипсина, диабетической ретинопатии, тиреоидита Хашимото, остеопороза, диагноза системы гипоталамус-гипофиз-надпочечники, первичного билиарного цирроза, тироидита, энцефаломиелита, кахексии, муковисцидоза, хронической болезни легких новорожденных, хронической обструктивной болезни легких (ХОБЛ), семейного гематофагоцитарного лимфогистиоцитоза, дерматологических состояний,псориаза, алопеции, нефротического синдрома, нефрита, гломерулярного нефрита, острой почечной недостаточности, гемодиализа, уремии, токсичности, преэклампсии, okt3-терапии, анти-cd3-терапии, терапии цитокинами, химиотерапии, лучевой терапии (например, включающей, но не ограничивающейся ими, астению, анемию, кахексию и т.п.), хронической интоксикации салицилатом и т.п. См., например,Merck Manual, 12th-17th Editions, MerckCompany, Rahway, NJ (1972, 1977, 1982, 1987, 1992, 1999),Pharmacotherapy Handbook, Wells et al., eds., Second Edition, Appleton and Lange, Stamford, Conn. (1998,2000), оба включенные в качестве ссылки в полном виде. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного сердечно-сосудистого заболевания в клетке, ткани, органе, животном или пациенте, включающего, но не ограничивающегося ими, по меньшей мере одно заболевание, выбранное из сердечного синдрома временной потери сознания, инфаркта миокарда, застойной сердечной недостаточности, геморрагического инсульта, ишемического кровоизлияния, кровотечения, артериосклероза, атеросклероза, рестеноза,диабетического атеросклеротического заболевания, гипертензии, артериальной гипертензии, реноваскулярной гипертензии, синкопы, шока, сифилиса сердечно-сосудистой системы, сердечной недостаточности, легочного сердца, первичной легочной гипертензии, сердечных аритмий, предсердных эктопических сокращений, трепетания предсердий, предсердной фибрилляции (постоянной или пароксизмальной),постперфузионного синдрома, воспалительной реакции на искусственное кровообращение, хаотической или многоочаговой предсердной тахикардии, регулярной тахикардии с узкими QRS, специфичных аритмий, желудочковой фибрилляции, аритмий пучка Гиса, атриовентрикулярной блокады сердца, блокады пучка Гиса (межжелудочковой блокады), ишемических нарушений миокарда, заболевания коронарной артерии, стенокардии, инфаркта миокарда, кардиомиопатии, расширенной застойной кардиомиопатии,облитерирующей кардиомиопатии (болезни Беккера), пороков клапанов сердца, эндокардита, перикардиального заболевания, опухолей сердца, аневризм аорты и периферических аневризм, расслоения аорты,воспаления аорты, окклюзии брюшной аорты и ее ветвей, нарушений периферических сосудов, окклюзивных артериальных нарушений, периферического атеросклеротического заболевания, облитерирующего тромбангиита, функциональных нарушений периферических артерий, феномена и болезни Рейно, акроцианоза, эритромелалгии (болезни Митчелла), венозных нарушений, тромбоза вен, варикозных вен,артериовенозного свища, лимфедемы, липедемы, нестабильной стенокардии реперфузионного повреждения, постгемодиализного синдрома, ишемического-реперфузионного повреждения и т.п. Такой способ может необязательно предусматривать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, в клетку, ткань, орган, животное или пациента, нуждающегося в такой модуляции, таком лечении или такой терапии.-8 014675 Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного IL-6-связанного инфекционного заболевания в клетке, ткани, органе, животном или пациенте, включающего, но не ограничивающегося ими, по меньшей мере одно заболевание, выбранное из острой или хронической бактериальной инфекции, острого или хронического паразитарного или инфекционного процесса, включающего бактериальные, вирусные и грибковые инфекции, ВИЧ-инфекцию/ВИЧнефропатию, менингит, гепатит (например, А, В или С или т.п.), септический артрит, перитонит, пневмонию, эпиглоссит, Е. coli 0157:h7, гемолитический уремический синдром/тромболитическую тромбоцитопеническую пурпуру, малярию, геморрагическую лихорадку денге, лейшманиоз, проказу, синдром токсического шока, стрептококковый миозит, газовую гангрену, Mycobacterium tuberculosis, Mycobacterium avium intracellulare, пневмонию Pneumocystis carinii, воспаление тазовых органов, орхит/эпидидимит, инфекцию легионеллы, болезнь Лайма, грипп А, вирус Эпштейна-Барра, вирусассоциированный гемафагоцитарный синдром, вирусный энцефалит/асептический менингит и т.п. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного IL-6-связанного злокачественного заболевания в клетке, ткани, органе, животном или пациенте, включающего, но не ограничивающегося ими, по меньшей мере одно заболевание, выбранное из лейкоза, острого лейкоза, острого лимфобластного лейкоза (ALL), острого лимфоцитарного лейкоза, В-клеточного,Т-клеточного или FAB ALL, острого миелоидного лейкоза (AML), острого миелогенного лейкоза, хронического миелоцитарного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), ретикулоэндотелиоза, миелодиспластического синдрома (MDS), лимфомы, болезни Ходжкина, злокачественной лимфомы, не-ходжкинской лимфомы, лимфомы Беркитта, множественной миеломы, саркомы Капоши, колоректальной карциномы, карциномы поджелудочной железы, назофарингеальной карциномы, злокачественного гистиоцитоза, паранеопластического синдрома/гиперкальциемии злокачественной опухоли, солидных опухолей, рака мочевого пузыря, рака молочной железы, колоректального рака, рака эндометрия,рака головы, рака шеи, наследственного неполипозного рака, лимфомы Ходжкина, рака печени, рака легкого, немелкоклеточного рака легкого, рака яичника, рака поджелудочной железы, рака предстательной железы, почечноклеточной карциномы, тестикулярного рака, аденокарцином, сарком, злокачественной меланомы, гемангиомы, метастатического заболевания, связанной с раком резорбции костей, связанной с раком боли костей и т.п. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного IL-6-связанного неврологического заболевания в клетке, ткани, органе, животном или пациенте,включающего, но не ограничивающегося ими, по меньшей мере одно заболевание, выбранное из нейродегенеративных заболеваний, рассеянного склероза, головной боли (мигрени), комплекса СПИДдеменция, демиелинизирующих заболеваний, таких как рассеянный склероз и острый поперечный миелит; экстрапирамидных и мозжечковых нарушений, например, повреждений, кортикоспинальной системы; нарушений базальных ядер; гиперкинетических нарушений движения, таких как хорея Гентингтона и сенильная хорея; индуцированных лекарственными средствами нарушений движения, таких как нарушения движения, индуцированные лекарственными средствами, которые блокируют рецепторы допамина ЦНС; гипокинетических нарушения движения, таких как болезнь Паркинсона; прогрессирующего супрануклеарного паралича; структурных повреждений мозжечка; относящихся к спинному мозгу и мозжечку дегенераций, таких как спинномозговая атаксия, атаксия Фридрейха, мозжечковых кортикальных дегенераций, дегенераций множественных систем (Mencel, Dejerine-Thomas, Shi-Drager и MachadoJoseph); системных нарушений (болезни Рефсума, абеталипопротеинемии, атаксии, телеангиэктазии и нарушения митохондриальной мультисистемы; демиелинизирующих центральных нарушений, таких как рассеянный склероз, острый поперечный миелит; и нарушений мотонейронов, таких как нейрогенные мышечные атрофии (дегенерация клеток переднего рога, такая как амиотрофический боковой склероз,детская спинальная мышечная атрофия и ювенильная спинальная мышечная атрофия); болезни Альцгеймера; синдрома Дауна в среднем возрасте; диффузного заболевания с тельцами Леви; сенильной деменции типа телец Леви; синдрома Вернике-Корсакова; хронического алкоголизма; болезни Кройтцфельдта-Якоба; подострого склерозирующего панэнцефалита; болезни Галлервордена-Шпатца; Dementiapugilistica; нейротравматического повреждения (например, повреждения спинного мозга, повреждения головного мозга, сотрясения головного мозга, повторяемого сотрясения); боли; боли при воспалении; аутизма; депрессии; инсульта; когнитивных нарушений; эпилепсии и т.п. Такой способ может необязательно предусматривать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно TNF-антитело или указанные часть или вариант в клетку,ткань, орган, животное или пациента, нуждающегося в такой модуляции, таком лечении или такой терапии. См., например, Merck Manual, 16th Edition, MerckCompany, Rahway, NJ (1992). Способы введения Способ по изобретению включает введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, в клетку, ткань, орган, животное или пациента, нуждающегося в такой модуляции, таком лечении или такой терапии, вместе с лечением, предусматривающим введение ингибитора протеасом. Способ по изобретению включает лечение таких заболеваний или нарушений, при которых показано введение указанного по меньшей мере-9 014675 одного антагониста IL-6. Способ по изобретению дополнительно предусматривает совместное введение с антагонистом IL-16 до, одновременно и/или после по меньшей мере одного ингибитора протеасом. В конкретном варианте осуществления антагонист IL-6 является антителом, которое предотвращает или ингибирует биологические функции IL-6, таким как нейтрализующее IL-6-антитело или анти-IL-6Rантитело, а ингибитор протеасом выбран из группы, состоящей из PS-314 (бортезомиба), PS-519; кластолактацистина-бета-лактона; лактацистина, эпоксомицина, CVT634, ТМС 96, MG-115, CEP1612 и MG132. Обычно лечение патологических состояний осуществляют введением эффективного количества или дозы композиции анти-IL-6-антитела, которые составляют в среднем диапазон от по меньшей мере приблизительно 0,01 до 500 миллиграммов по меньшей мере одного анти-IL-6-антитела на килограмм пациента на дозу и предпочтительно от по меньшей мере приблизительно 0,1 до 100 мг антитела/кг пациента на единственное или на множественные введения, в зависимости от конкретной активности активного агента, содержащегося в этой композиции. Альтернативно, эффективная концентрация в сыворотке может содержать 0,1-5000 мкг/мл сыворотки на единственное или множественные введения. Подходящие дозы известны врачам-практикам и будут, конечно, зависеть от конкретного пациента, подвергающегося лечению. В некоторых случаях для достижения желаемого терапевтического количества может быть необходимым обеспечение повторяемого введения, т.е. повторяемых отдельных введений конкретно наблюдаемой или отмеренной дозы,причем эти отдельные введения повторяют, пока не достигается желаемая суточная доза или желаемое действие. Для парентерального введения это антитело или ингибитор протеасом могут быть приготовлены в виде раствора, суспензии, эмульсии, частицы, порошка или лиофилизированного порошка, вместе с фармацевтически приемлемым парентеральным носителем или с отдельно обеспеченным фармацевтически приемлемым парентеральным носителем. Примерами таких носителей являются вода, солевой раствор,раствор Рингера, раствор декстрозы и 1-10% сывороточный альбумин человека. Могут быть также использованы липосомы и неводные носители, такие как нелетучие масла. Носитель или лиофилизированный порошок может содержать добавки, которые поддерживают изотоничность (например, хлорид натрия, маннит) и химическую стабильность (например, буферы и консерванты). Готовую форму стерилизуют известными или подходящими способами. Подходящие фармацевтические носители описаны в самом недавнем издании Remington's Pharmaceutical Sciences, A. Osol, стандартном ссылочном руководстве в этой области. Введение Многие известные и разработанные способы могут быть использованы в соответствии с изобретением для введения фармацевтически эффективных количеств антагониста IL-6 и ингибитора протеасом в соответствии с настоящим изобретением. Хотя обычным является парентеральное введение, могут быть использованы другие способы введения в соответствии с настоящим изобретением с подходящими результатами. Композиция по изобретению может доставляться в носителе, в виде раствора, эмульсии,коллоида или суспензии, или в виде сухого порошка, с использованием любого из различных устройств и способов, подходящих для введения ингаляцией или другими способами, описанными здесь или известными в данной области. Альтернативные способы введения включают подкожный, внутримышечный, внутривенный, внутрисуставный, внутрибронхиальный, внутрибрюшной, внутрикапсульный, внутрихрящевой, внутриполостной, интрацелиальный, внутримозжечковый, интрацеребровентрикулярный, внутрикишечный (внутрь толстой кишки), интрацервикальный, внутрижелудочный, внутрипеченочный, интрамиокардиальный,внутрикостный, внутритазовый, интраперикардиальный, внутрибрюшинный, внутриплевральный, внутрипростатный, внутрилегочный, интраректальный, внутрипочечный, интраретинальный, интраспинальный, внутрисуставный, внутригрудной, внутриматочный, внутрипузырный, внутрираневой, болюсный,вагинальный, ректальный, буккальный, сублингвальный, интраназальный или трансдермальный способы. Пример 1. Активность анти-IL-6-антитела в комбинации с ингибитором протеасом. На основе гипотезы, что ингибирование IL-6 химерным, моноклональным IL-6-нейтрализующим антителом, CNTO 328, могло бы усиливать антимиеломную активность ингибитора протеасом, бортезомиба, ослаблением опосредованной бортезомибом повышающей регуляции HSP-70, были задуманы и выполнены следующие исследования. А. Ингибирование передачи сигнала IL-6 моноклональным антителом, CNTO 328, уменьшает жизнеспособность клеток IL-6-зависимых линий клеток множественной миеломы, ANBL-6 и KAS-6. Клетки ANBL-6 и KAS-6 (Dr. Diane Jelinek, Mayo Clinic, Rochester, MN) инкубировали с увеличивающимися концентрациями CNTO 328 или изотипически сходного контрольного антитела, F105, в течение 24 и 48 ч. В течение последних 4 ч эти клетки инкубировали в присутствии WST-1 (Roche AppliedScience, Indianapolis, IN). Восстановление WST-1 в водорастворимую соль формазана жизнеспособными клетками измеряли по оптической плотности при 450 нм с использованием планшет-ридера ELISA. Жизнеспособность измеряли в виде процентной жизнеспособности относительно необработанных клеток. Все клетки обрабатывали в среде RPMI 1640, содержащей 10% ФТС и 1 нг/мл IL-16.- 10014675 Результаты показаны графически на фиг. 1 (величины являются средней величиной четырех повторностей культур; столбики ошибок, SEM) . Обработка клеток ANBL-6 и KAS-6 антителом CNTO 328 приводит к зависимому от дозы и от времени уменьшению жизнеспособности клеток. Клетки KAS-6 были значимо более чувствительными к действиям ингибирования IL-6, чем клетки ANBL-6. В. CNTO 328 усиливает антимиеломную активность бортезомиба в IL-6-зависимых миеломных клетках. Линии клеток миеломы ANBL-6, KAS-6 или IL-6-независимые линии клеток миеломы RPMI 8226 прединкубировали с 0,1 мкг/мл (KAS-6) или 10 мкг/мл (ANBL-6 и RPMI 8226) контрольного антитела,F105, или CNTO 328 в течение 24 ч, с последующим коинкубированием либо с контролем ДМСО, либо с увеличивающимися концентрациями бортезомиба при непрерывном присутствии антител F105 илиCNTO 328 в течение 24 ч. Для экспериментов по секвенированию, клетки ANBL-6 обрабатывали: 1) антителами F105 или CNTO 328 в течение 24 ч и затем антителами F105 или CNTO 328 и 5 нМ бортезомибом в течение еще 24 ч (антителобортезомиб) ; 2) антителами F105 или CNTO 328 и 5 нМ бортезомибом одновременно в течение 24 ч (антитело + бортезомиб) или 5 нМ бортезомибом в течение 12 ч, затем антителами F105 или CNTO 328 в течение 24 ч (бортезомибантитело). Жизнеспособность клеток анализировали, как описано выше, и измеряли в виде процентной жизнеспособности относительно необработанных клеток. Все клетки обрабатывали в среде RPMI 1640, содержащей 10% ФТС и 1 нг/мл IL-6. Столбцы, средние величины четырех повторностей культур; столбики ошибок, SEM. Прединкубация клеток ANBL-6 и KAS-6 с CNTO 328 усиливала цитотоксичность бортезомиба, как показано значимым уменьшением жизнеспособности клеток относительно клеток, предобработанных контрольным антителом F105 (фиг. 2 А и В) . Антитело CNTO 328 не усиливало активность бортезомиба в IL-6-независимой линии клеток миеломы, RPMI 8226 (панель С). Антитело CNTO 328 усиливало цитотоксичность бортезомиба больше всего, когда клетки ANBL-6 предобрабатывали CNTO 328 и затем бортезомибом или обрабатывали одновременно CNTO 328 и бортезомибом. В противоположность этому,антитело CNTO 328 имело небольшое дополнительное действие, когда клетки предобрабатывали бортезомибом (панель D).C. Ингибирование передачи сигнала IL-6 антителом CNTO 328 усиливает опосредованный бортезомибом апоптоз IL-6-зависимых линий клеток множественной миеломы, ANBL-6 и KAS-6. Клетки ANBL-6 и KAS-6 инкубировали с 10 мкг/мл (ANBL-6) или 1 мкг/мл (KAS-6) CNTO 328 или контрольного антитела, F105, в течение 8 (ANBL-6) - 12 (KAS-6) часов. Апоптоз определяли с использованием анализа на основе ELISA, который измеряет присутствие моно- и олигонуклеосом (Roche AppliedScience, Indianapolis, IN), и выражали в виде кратного увеличения апоптоза относительно ДМСО и F105 обработанных контролей. Клетки обрабатывали в среде RPMI 1640, содержащей 10% ФТС и 1 нг/мл IL-6(фиг. 3 А и В, высота столбцов представляет среднее трех повторностей культур; столбики ошибок,SEM). Обработка клеток ANBL-6 и KAS-6 антителом CNTO 328 и бортезомибом приводила к усиленной индукции апоптоза в сравнении с клетками, обработанными любым лекарственным средством по отдельности. Антитело CNTO 328 не было способно усиливать апоптоз в IL-6-независимой линии клеток миеломы RPMI 8226 (данные не показаны).D. CNTO 328 понижающим образом регулирует передачу сигнала интерлейкина-6 и ослабляет опосредованную бортезомибом индукцию антиапоптотических МКР-1 и HSP-70 в клетках ANBL-6. Клетки ANBL-6 инкубировали с 10 мкг/мл CNTO 328 или контрольного антитела, F105, с увеличивающимися концентрациями или без увеличивающихся концентраций бортезомиба в течение 8 ч. Готовили лизаты клеток и подвергали их анализу иммуноблоттинга. Блоты получали и зондировали на HSC70 для гарантии равной нагрузки белка на дорожку. Денситометрию выполняли на иммуноблотах HSP-70 и МКР-1. Обработка клеток ANBL-6 CNTO 328 приводила к разительному уменьшению последующих медиаторов передачи сигнала IL-6, как показано уменьшением уровней фосфо-р 42/44 МАРК и фосфоSTAT-3 (фиг. 4). Примечательно, что увеличение доз бортезомиба также уменьшало уровни фосфоSTAT-3 и фосфо-р 42/44 МАРК. Эти данные свидетельствуют о том, что бортезомиб препятствует передаче сигнала IL-6 (что также сообщалось Hideshima T et al, Oncogene 2003, 22: 8386-93). Кроме того,CNTO 328 препятствовал опосредованной бортезомибом индукции HSP-70 и МКР-1 на 45 и 90%, соответственно, что коррелировало с уменьшенными уровнями транскрипционно активного фосфо-STAT-1 и гиперфосфорилированного HSF-1. Е. KNK437 усиливает опосредованный бортезомибом апопотоз клеток ANBL-6 и HSF-1+/+ клетокMEF. Клетки ANBL-6 или MEF (контрольные и HSF-1-/-) инкубировали либо с контролем ДМСО, либо с увеличивающимися концентрациями бортезомиба и KNK437 в течение 12 (ANBL-6) - 24 ч (MEF). Апопотоз определяли, как описано выше, и выражали в виде кратного увеличения апоптоза относительноDMSO-обработанных контролей. Клетки ANBL-6 обрабатывали в среде RPMI 1640, содержащей 10% ФТС и 1 нг/мл IL-6 (фиг. 5, столбцы, средняя величина трех повторностей культур; столбики ошибок,- 11014675SEM). Обработка клеток ANBL-6 KNK437 приводила к значимому увеличению опосредованного бортезомибом апоптоза в сравнении с обработанными контролем клетками. Усиление опосредованного бортезомибом апоптоза снижалось в HSF-1-/-MEF относительно контрольных MEF (фиг. 6), что позволяет предположить, что повышенная активность этой комбинации обусловлена понижающей регуляцией реакции белков теплового шока. Суммирование результатов комбинации CNTO 328 с бортезомибом. Нейтрализующее IL-6 антитело CNTO 328 уменьшало жизнеспособность клеточных линий множественной миеломы ANBL-6 и KAS-6 зависимым от дозы и зависимым от времени образом. Обработка клеток ANBL-6 и KAS-6 антителом CNTO 328 усиливала антимиеломную активность бортезомиба, как показано уменьшением жизнеспособности клеток и усилением апоптоза этой комбинацией в сравнении с контрольным антителом и бортезомибом. Это антимиеломное действие CNTO 328 уменьшалось, когда клетки обрабатывали последовательно бортезомибом и затем CNTO 328, скорее в этом, а не в обратном порядке, возможно, вследствие способности бортезомиба понижающим образом регулировать важные последующие медиаторы передачи сигнала IL-6 или более ранней повышающей регуляции членов реакции белков теплового шока. Обработка клеток ANBL-6 и KAS-6 антителом CNTO 328 приводила к понижающей регуляции передачи сигнала IL-6, как показано заметным уменьшением уровней фосфо-STAT-3 и фосфо-р 42/44 МАРК. Бортезомиб также понижающим образом регулировал уровни фосфо-STAT-3 и фосфо-р 42/44 МАРК зависимым от концентрации образом. Повышенная активность комбинации CNTO 328 и бортезомиба ассоциировалась с уменьшенным опосредованным бортезомибом накапливанием антиапоптотических HSP-70 и МКР-1. Уменьшенная индукция HSP-70 коррелировала с уменьшенными уровнями фосфо-STAT-1 и гиперфосфорилированногоHSF-1. Обработка клеток ANBL-6 и KAS-6 KNK437 усиливала апоптотическую активность бортезомиба,что отчасти было следствием его способности препятствовать индукции реакции белков теплового шока,как показано тем фактом, что увеличенное апоптотическое действие заметно уменьшалось в HSF-1 негативных эмбриональных фибробластах мыши. Взятые вместе, эти данные обеспечивают логическое обоснование для перенесения комбинации бортезомиба/CNTO 328 в клинические исследования и разработки других новых стратегий, нацеленных на понижающую регуляцию устойчивости к бортезомибу (например, ингибиторов HSP-70, МКР-1). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения раковых заболеваний у млекопитающего, который включает совместное введение ингибитора протеасом в комбинации с антагонистом IL-6. 2. Способ по п.1, в котором антагонистом IL-6 является антитело или его фрагмент. 3. Способ по п.2, в котором антитело является моноклональным антителом. 4. Способ по п.2, в котором антитело или фрагмент связывается с IL-6. 5. Способ по п.2, в котором антитело или фрагмент связывается с рецептором IL-6. 6. Способ по п.3 или 4, в котором фрагментом антитела является Fab, Fab' или F(ab')2-фрагмент или его производное. 7. Способ по п.3, в котором моноклональное антитело конкурирует с моноклональным антителомcCLB8 за связывание с IL-6 человека. 8. Способ по п.3, в котором моноклональное антитело вводят внутривенно. 9. Способ по п.3, в котором моноклональное антитело вводят в количестве 0,01-12 мг/кг массы тела. 10. Способ по п.3, в котором моноклональное антитело вводят в болюсной дозе с последующей инфузией указанного антитела. 11. Способ по п.1, в котором млекопитающим является человек. 12. Способ по п.1, в котором ингибитор протеасом выбран из группы, состоящей из содержащего борную кислоту дипептидного ингибитора протеасом бортезомиба, PS-519 (1R-[1S,4R,5S]-1-(1-гидрокси 2-метилпропил)-4-пропил-6-окса-2-азабицикло[3.2.1.]гептан-3,7-диона); класто-лактацистин-беталактона; лактацистина, эпоксомицина, CVT634 (5-метокси-1-инданон-3-ацетиллейцил-D-лейцил-1 инданиламида), ТМС 96 3-метилбутаноил-L-треонин-N-(1-(2-(гидроксиметил)оксиран-2-илкарбонил)-3 метилбут-3-енил)амида, MG-115, CEP1612 и MG132. 13. Способ по п.1, в котором ингибитор протеасом является содержащим борную кислоту дипептидным ингибитором протеасом бортезомибом. 14. Способ по п.1, в котором раковым заболеванием является, по меньшей мере, раковое заболевание, выбранное из лейкоза, острого лейкоза, острого лимфобластного лейкоза (ALL), В-клеточного, Тклеточного или FAB ALL, острого миелоидного лейкоза (AML), острого миелогенного лейкоза, хронического миелоцитарного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), ретикулоэндотелиоза, миелодиспластического синдрома (MDS), лимфомы, болезни Ходжкина, злокачественной лимфо- 12014675 мы, неходжкинской лимфомы, лимфомы Беркитта, множественной миеломы, саркомы Капоши, колоректальной карциномы, карциномы поджелудочной железы, почечноклеточной карциномы, карциномы клеток простаты, назофарингеальной карциномы, злокачественного гистиоцитоза, паранеопластического синдрома/гиперкальциемии злокачественности, солидных опухолей, аденокарцином, сарком и злокачественной меланомы. 15. Способ по п.1, в котором анти-IL-6-антагонист вводят последовательно, периодически или одновременно с ингибитором протеасом. 16. Способ ингибирования роста опухоли у млекопитающего, включающий введение этому млекопитающему вместе с ингибитором протеасом моноклонального антитела или его фрагмента, которые предотвращают IL-6-активацию передачи сигнала через мембраносвязанные рецепторы в количестве,эффективном для ингибирования роста указанной опухоли. 17. Способ профилактики метастазов у млекопитающих, включающий введение этому млекопитающему вместе с ингибитором протеасом моноклонального антитела или его фрагмента, которые предотвращают IL-6-активацию передачи сигнала через мембраносвязанные рецепторы в количестве, эффективном для предотвращения метастазов в указанном млекопитающем. 18. Способ по любому из пп.3, 16 или 17, где антителом является cCLB8 или его фрагмент.
МПК / Метки
МПК: A61K 39/395, A61K 38/00
Метки: способ, протеасом, применения, антагонистов, ингибиторами
Код ссылки
<a href="https://eas.patents.su/16-14675-sposob-primeneniya-antagonistov-il-6-s-ingibitorami-proteasom.html" rel="bookmark" title="База патентов Евразийского Союза">Способ применения антагонистов il-6 с ингибиторами протеасом</a>
Предыдущий патент: Применение трибенурона, его сельскохозяйственно приемлемого производного или его сельскохозяйственно приемлемой соли, как сафенера для 3-фенилурацилов
Следующий патент: Изокинетический способ и система отбора проб для мультифазного потока из подземных скважин
Случайный патент: Система и способ управления регулируемыми трансмиссиями