Липосомная композиция для индукции иммунитета
Формула / Реферат
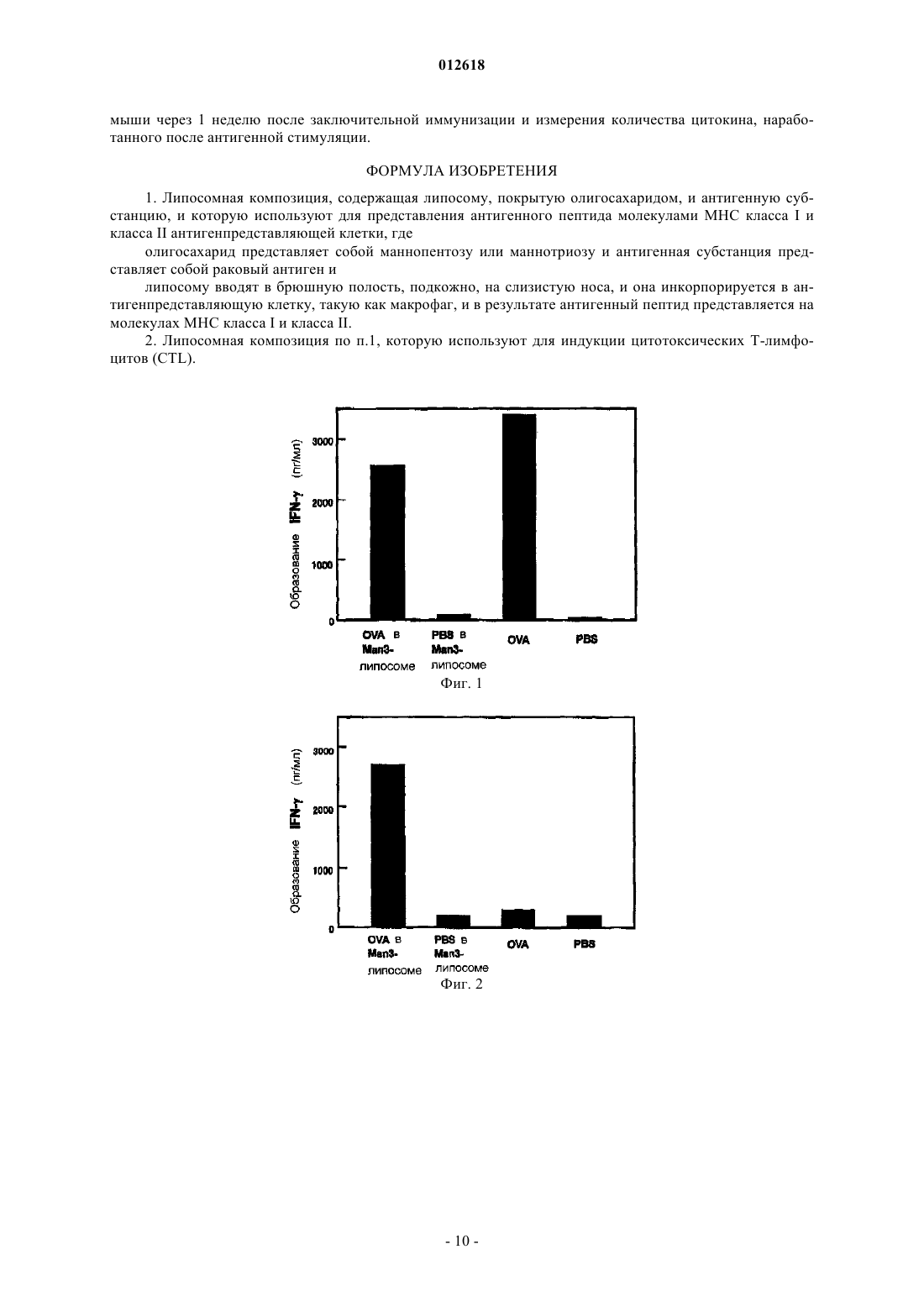
1. Липосомная композиция, содержащая липосому, покрытую олигосахаридом, и антигенную субстанцию, и которую используют для представления антигенного пептида молекулами МНС класса I и класса II антигенпредставляющей клетки, где
олигосахарид представляет собой маннопентозу или маннотриозу и антигенная субстанция представляет собой раковый антиген и
липосому вводят в брюшную полость, подкожно, на слизистую носа, и она инкорпорируется в антигенпредставляющую клетку, такую как макрофаг, и в результате антигенный пептид представляется на молекулах МНС класса I и класса II.
2. Липосомная композиция по п.1, которую используют для индукции цитотоксических Т-лимфоцитов (CTL).
Текст
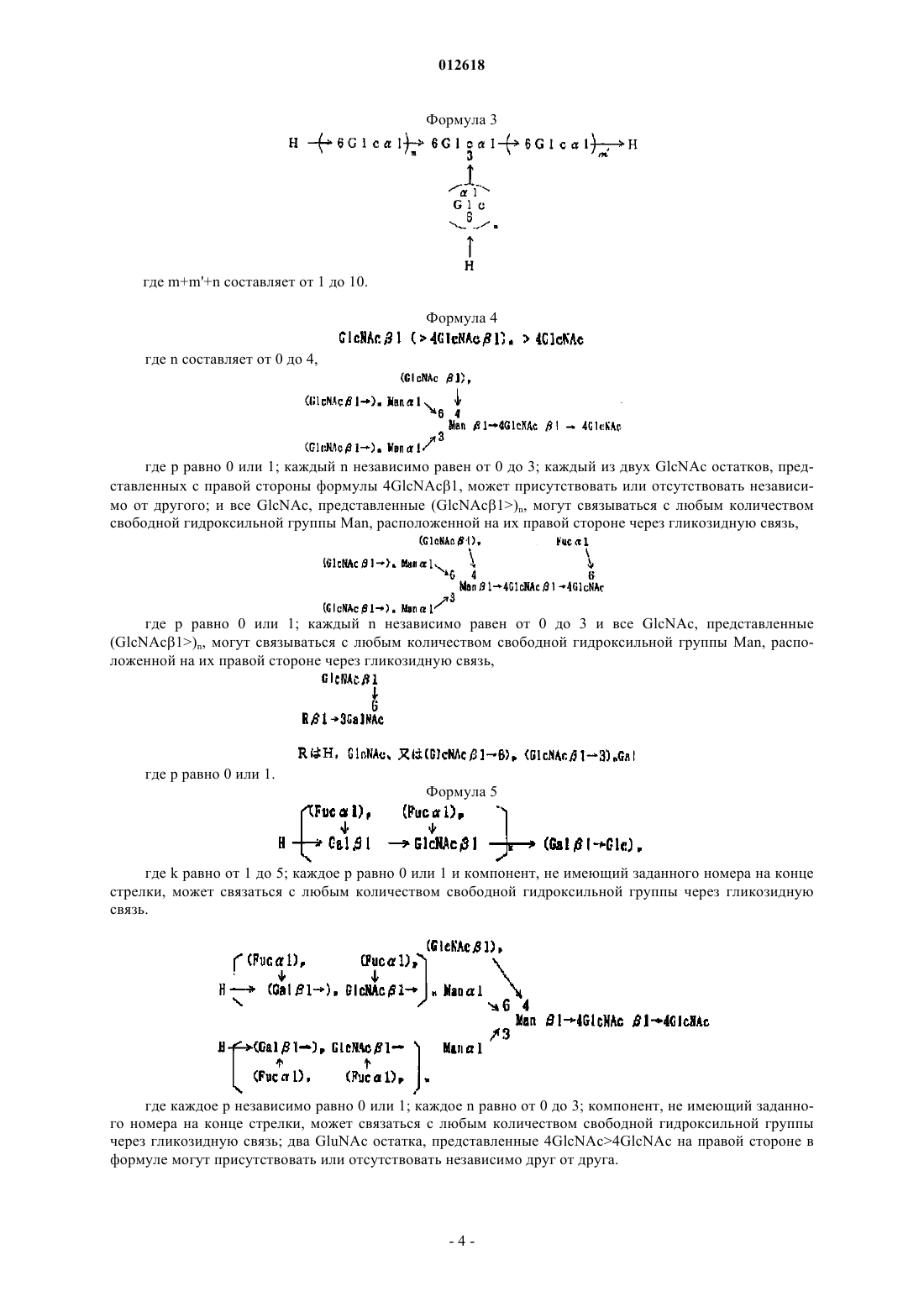
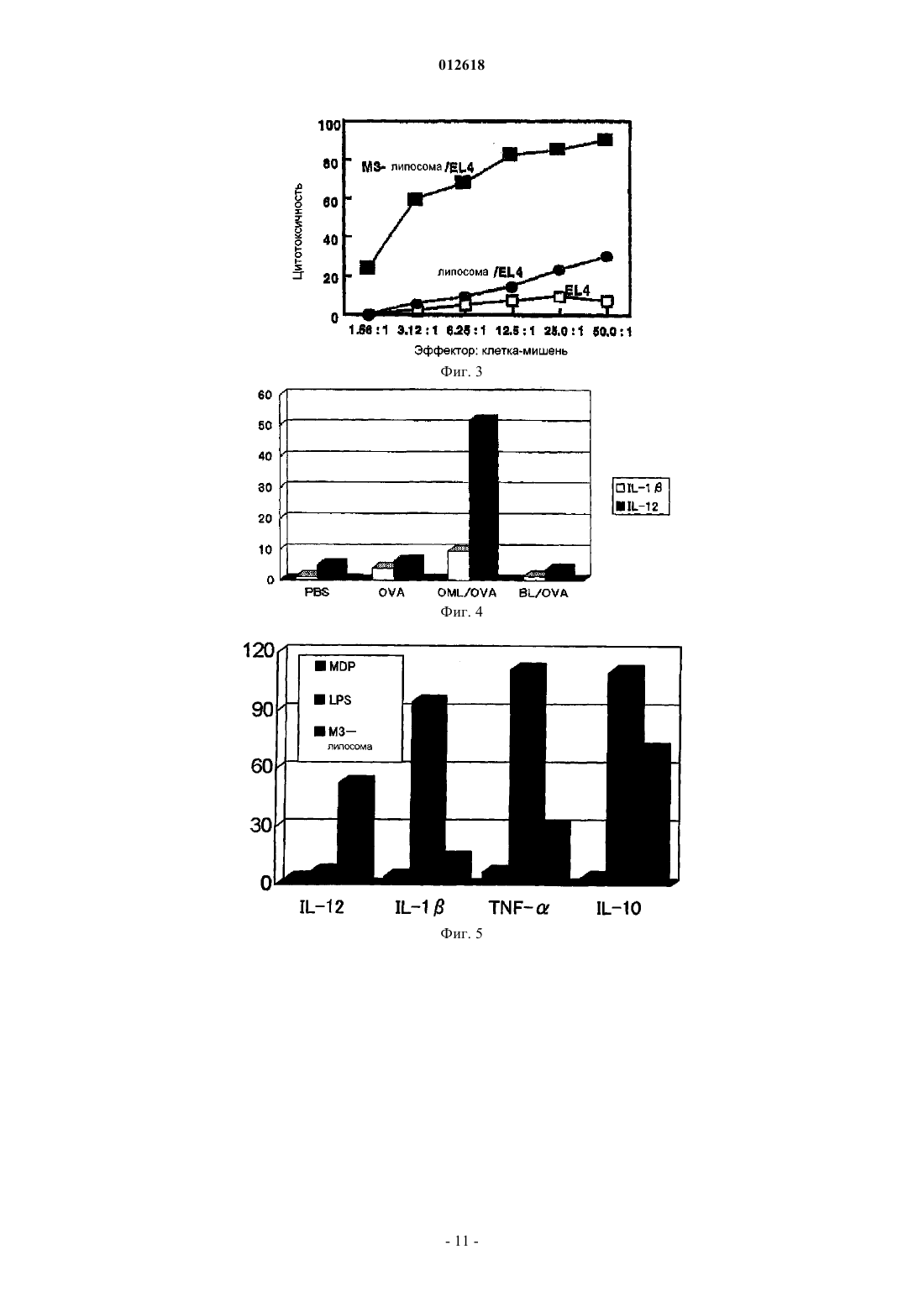
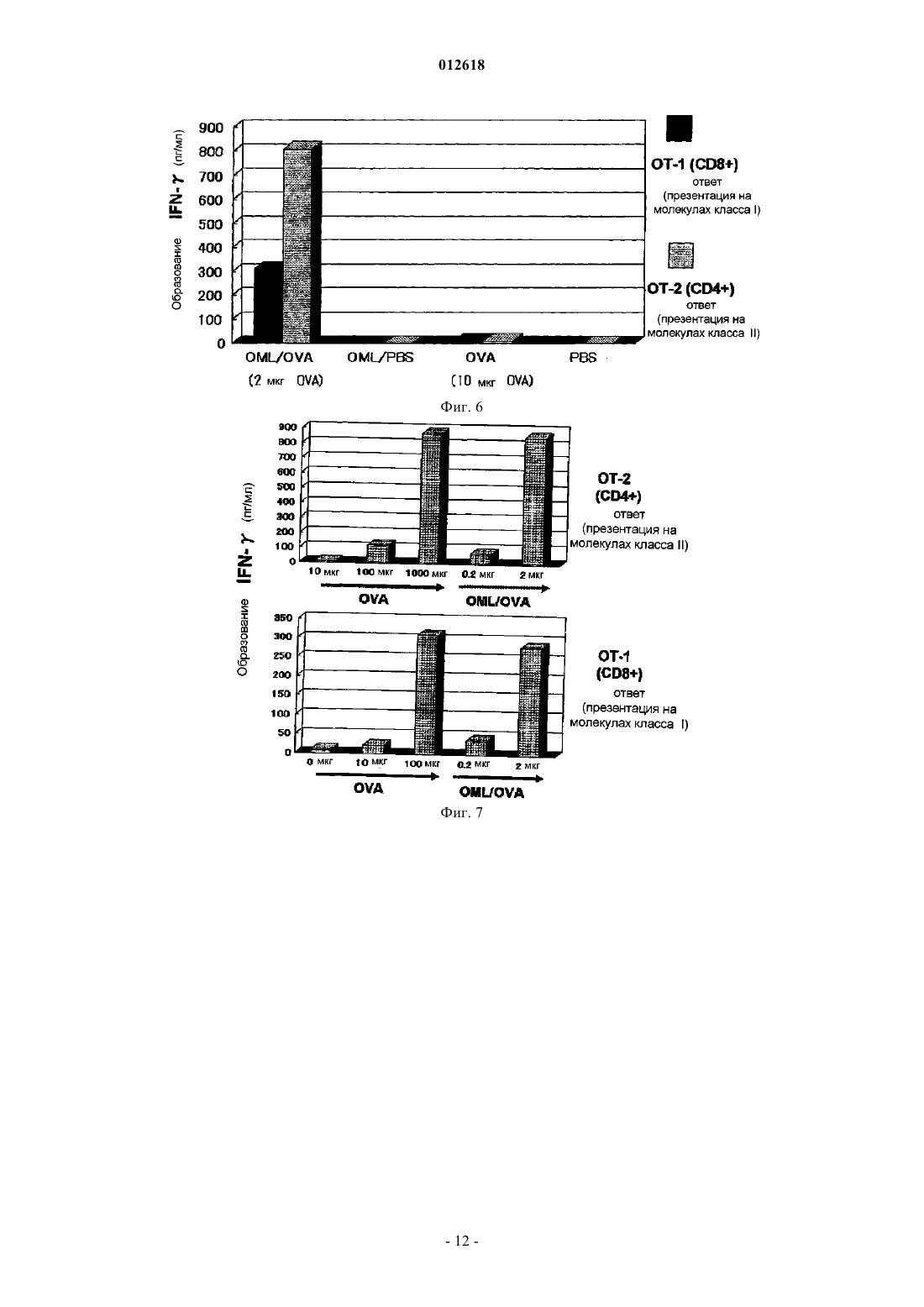
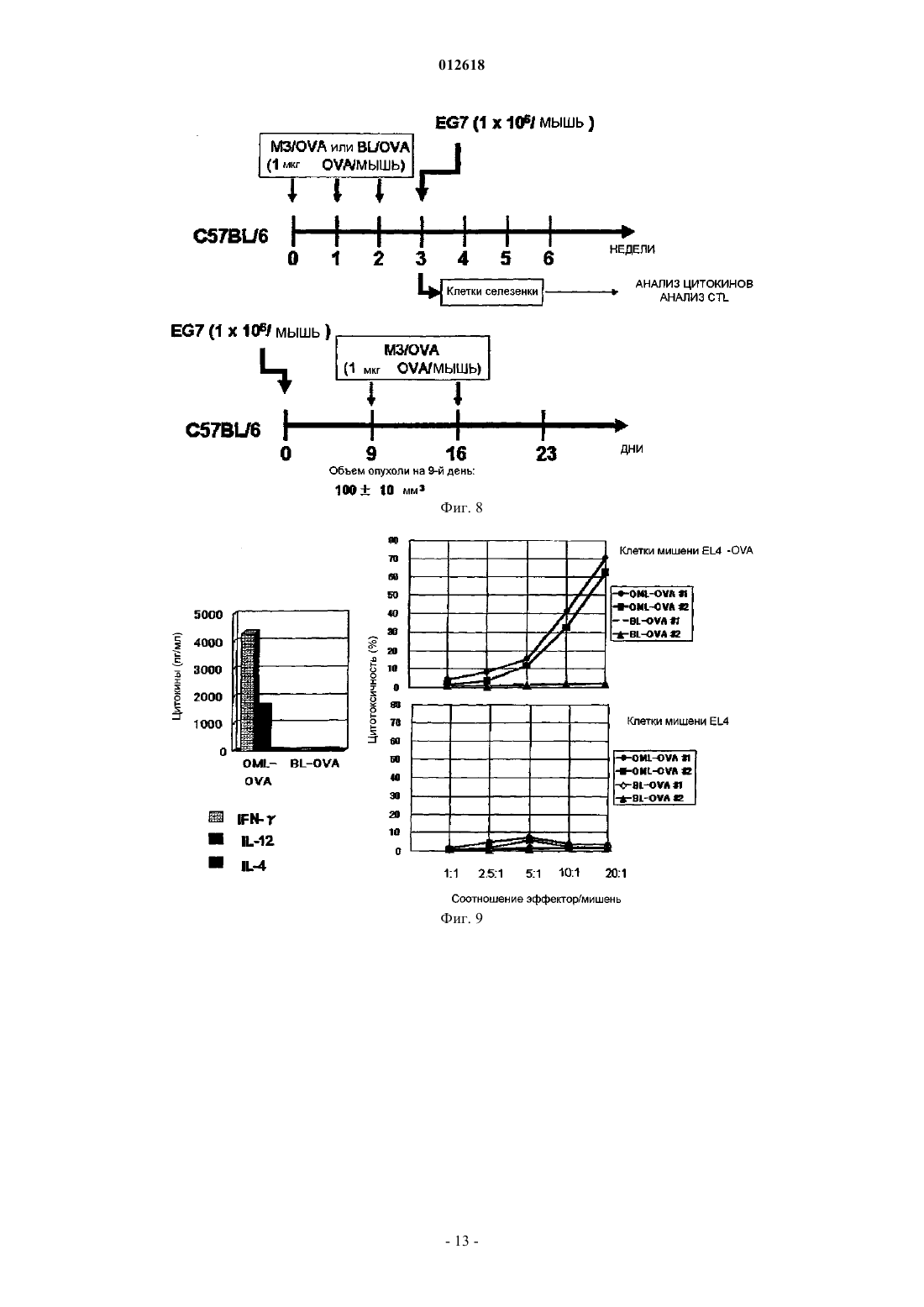
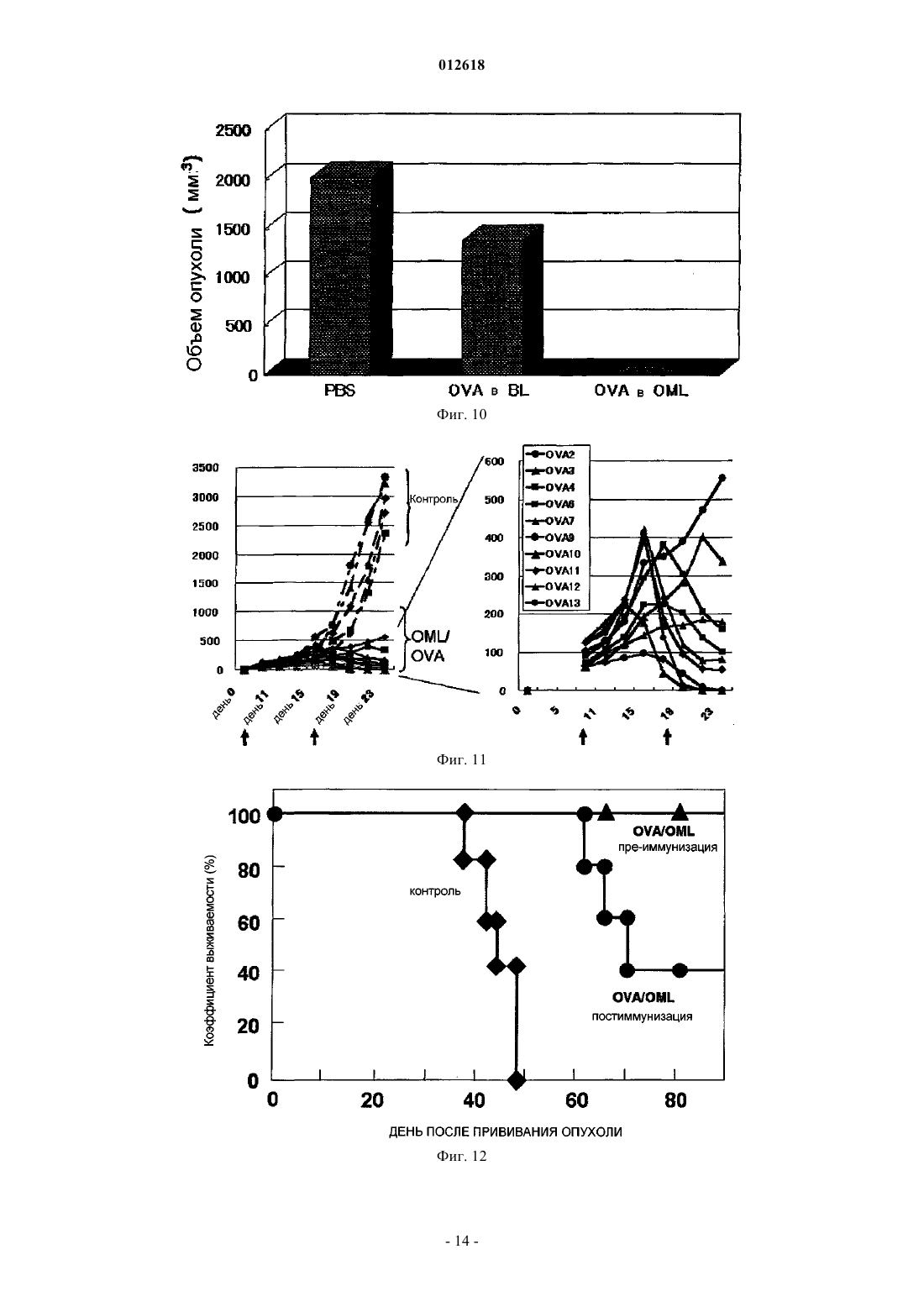
012618 Область техники, к которой относится изобретение Настоящее изобретение относится к липосомной композиции для индукции иммунитета, в которой используют покрытую олигосахаридами липосому. Более конкретно, настоящее изобретение относится к липосомной композиции, в которой используют покрытую олигосахаридами липосому, которая отличается тем, что она заключена в макрофаг, существующий в брюшной полости, после того, как его вводят в брюшную полость, и она представляется на молекулах МНС класса I и II. Уровень техники Количество смертей, вызванных раком желудка, в общем количестве смертей от всех видов рака,занимает второе место после рака легких. Главным фактором является диссеминированное метастазирование в органы брюшной полости. Поэтому для выздоровления от рака желудка является очень важным развитие иммунотерапии, которая способна контролировать метастазирование в брюшной полости и его распространение. Цитотоксические Т-лимфоциты (CTL) являются главными эффекторными клетками иммунной системы, которые устраняют рак. Хелперные Т-клетки (Th) играют важную роль в проявлении функций указанных клеток. Таким образом, для создания эффективной иммунной реакции считают важным, чтобы эти две группы клеток были активированы совместно. Изучена иммунотерапия рака, в которой используют в качестве антигенов как эпитоп хелперов (Th), так и эпитоп цитотоксических Т-лимфоцитов (CTL). Как указано ранее, для получения эффективной иммунной реакции необходимо одновременно активировать хелперные Т-клетки (Th) и цитотоксические Т-лимфоциты (CTL). Для такой одновременной активации идеальна иммунизация антигеном, включающим в себя как Th эпитоп (МНС класс II), так иCTL эпитоп (МНС класс I). При этом известно, что сложно эффективно активировать CTL иммунизацией интактным белком. В общем, известно, что эндогенный антиген представлен на МНС класса I, в то время как экзогенный антиген представлен на МНС класса II. Тем не менее указывается, что экзогенный антиген, поглощенный антигенпредставляющей клеткой, такой как макрофаг, представляется на МНС классаII намного легче, чем на МНС класса I. Это происходит, когда в качестве вакцины используют антиген и отдельно вводят его пациенту для иммунизации, при этом CTL, которые зависят от представления антигена молекулами МНС класса I, не активируются эффективно. Поскольку CTL являются главными эффекторными клетками иммунной системы, которые устраняют рак, было предпринято несколько попыток сделать возможным представление экзогенного антигена молекулами класса I. Такие попытки, предпринятые в виде иммунотерапии, охватывают: (1) способ,который включает забор антигенпредставляющих клеток пациента, их культивирование, добавление пептида антигена в культуру и возвращение результирующей культуры обратно в организм пациента, и(2) способ, который включает в себя представление гена антигена антигенпредставляющим клеткам. Два указанных метода являются проблематичными в техническом, этическом и экономическом аспектах. Кроме того, необходимо установить раковый антиген, который подходит для иммунизации. Далее, для одновременной активации нескольких рядов Th/CTL вышеупомянутым способом (1) также необходимо установить Th и CTL эпитопы. При этом, что касается полисахарид-конъюгированной липосомы, было показано, что пуллулан и маннан инкорпорируются макрофагами и так, что они представлены на молекулах МНС класса I. В иммунотерапии был испытан способ конъюгирования антигена с такими полисахаридами и введение его пациенту. Однако поскольку указанная полисахаридная структура заключает в себе антигенность или токсичность, нельзя заведомо сказать, что применение данного способа является безопасным для человека. Далее еще не доказано, что молекулы МНС класса II способны представлять такой антиген. Сущность изобретения Задача, решаемая изобретением. Целью настоящего изобретения является решение вышеупомянутых проблем предшествующего уровня техники. Другими словами, целью настоящего изобретения является создание липосомной композиции, которая способна позволить молекулам МНС класса I и II антигенпредставляющих клеток эффективно представлять антигенную субстанцию. Способ решения задачи В результате интенсивных исследований, направленных на достижение вышеупомянутой цели, авторы изобретения обнаружили, что антиген может быть доставлен к макрофагу путем инкапсулирования указанного антигена в липосому, покрытую олигоманнозой (MCL), и введения ее пациенту. Это происходит благодаря реакции, которая опосредована рецептором к маннозе, который экспрессируется макрофагом. Такой макрофаг специфически и активно поглощает липосому, которая была введена в брюшную полость, и становится активированным. В последующей иммунной реакции макрофаг представляет инкапсулированный антиген на своих молекулах МНС класса I и II и он мигрирует к экстанодальным лимфатическим тканям большого сальника или брыжейке тонкой кишки так, чтобы активировать клеточный иммунитет. В то же время макрофаг способен представлять пептид, полученный из инкапсулированного антигена, на молекулах МНС класса I и II, и он также мигрирует к региональному лимфатическому узлу. В эксперименте на мышах макрофаг инкорпорирует MLC, которую ввели в брюшную полость, становится активированным и достигает большого сальника, работающего как региональный лимфатический-1 012618 узел. В то же время макрофаг представляет пептид, полученный из инкапсулированного антигена, на молекулах МНС класса I и II, и он активирует две клеточные группы Th и CTL, что позволяет им производить -интерферон (IFN-). Настоящее изобретение дополнено на основании указанных результатов. Таким образом, настоящее изобретение относится к липосомной композиции, которая включает в себя покрытую олигосахаридами липосому и субстанцию антигена и которая используется для того, чтобы побудить молекулы МНС класса I и II антигенпредставляющей клетки представить антигенный пептид. Олигосахарид предпочтительно является олигоманнозой. Олигосахарид предпочтительно является маннопентозой или маннотриозой. Субстанция антигена предпочтительно является раковым антигеном. Предпочтительно липосомную композицию согласно настоящему изобретению вводят в брюшную полость подкожно или через слизистую оболочку носа, и она поглощается антигенпредставляющей клеткой, такой как макрофаг, и в результате антигенный пептид представляется на молекулах МНС класса I иII. Липосомную композицию согласно настоящему изобретению предпочтительно используют для стимулирования цитотоксических Т лимфоцитов (CTL). Наилучший способ осуществления изобретения Варианты осуществления настоящего изобретения конкретно описаны ниже. Авторы изобретения установили, что при использовании яичного альбумина (OVA) в качестве модели антигена, когда такой экзогенный антигенный белок инкапсулируют в покрытую олигоманнозой липосому (MCL) и затем вводят пациенту, антиген может быть представлен не только на МНС класса I,но и на МНС класса II. После того как яичный альбумин (OVA) или пептид OVA был инкапсулирован в покрытую олигоманнозой липосому и такая липосома затем была введена в брюшную полость, она быстро инкорпорируется в макрофаг. Затем макрофаг извлекали из брюшной полости и культивировали 24 ч. Далее полученную культуру помещали в смешанную культуру вместе с селезеночными CD8 позитивными Т-лимфоцитами от трансгенных (Tg) мышей ТО-1, в которые введен ген Т-клеточного рецептора, специфичного к OVA пептиду, представленному на молекулах класса I. В результате, когда растворенный в PBS OVA ввели в брюшную полость мыши и затем извлекли макрофаги, то INF- практически не вырабатывался. При этом в случае, если OVA был помещен в покрытую олигоманнозой липосому, тоINF- вырабатывался. Полученный результат ясно показывает, что после того, как MCL с инкапсулированным OVA инкорпорировалась в макрофаги, OVA пептид представлялся на молекулах МНС класса I. С другой стороны, даже в случае прямого введения OVA, такой OVA также был инкорпорирован в макрофаги. Однако INF- не вырабатывался. Таким образом, считали, что OVA пептид не был представлен на молекулах МНС класса I. Следовательно, было показано, что он может быть эффективно представлен на молекулах МНС класса I антигенпредставляющих клеток путем инкапсулирования белка антигена или пептида антигена в MCL и последующего введения MCL пациенту. С другой стороны, если вышеупомянутую культуру смешивали с селезеночными CD8 позитивными Т-лимфоцитами от трансгенных (Tg) мышей ТО-1, в которые введен ген Т-клеточного рецептора, специфичного к OVA пептиду, представленному на молекулах класса II, то стимулировалось образованиеINF-, специфичного к OVA пептиду, представленному на молекулах МНС класса II. Таким образом,было показано, что антиген был эффективно представлен на вышеупомянутых молекулах в обоих случаях, когда антиген был инкапсулирован в липосому, покрытую олигоманнозой, и когда антиген был привит непосредственно. Кроме того, когда растворимый белок лимфомы мышей EL4, который инкапсулировали в MCL,вводили подкожно сингенной мыши, то наблюдалась высокая активность CTL к EL4, которая была едва заметной при непосредственном введении растворимого продукта. Этот результат показывает, что даже если антиген вводили подкожно, то он инкорпорировался антигенпредставляющими клетками, и что антигенный пептид эффективно представлен на молекулах МНС класса I. Этот результат также показывает,что даже если антигенный белок неизвестен или не очищен, пептид, способный индуцировать CTL, может быть представлен на молекулах МНС класса I путем инкапсулирования экстракта раковых клеток в липосому, покрытую маннозой, и последующего введения этой липосомы. Таким образом, было показано, что применение такой липосомы эффективно в качестве средства для получения вакцины против рака. Липосомная композиция согласно настоящему изобретению также может быть использована как система доставки лекарственных средств. Термин "система доставки лекарственных средств" используют в настоящем документе для обозначения системы для доставления лекарственных средств. В общем случае, когда вводят лекарственное средство, оно распространяется по всему телу. Система доставки лекарственного средства представляет собой технику, которая предотвращает данное распространение лекарственного средства и доставляет его к тканям-мишеням или клеткам-мишеням. Эта система доставки лекарственных средств имеет эффект снижения побочных эффектов или улучшения лекарственного эффекта.-2 012618 Термин "липосома" используют в настоящем документе для обозначения искусственной частицы,сделанной из двойной мембраны, образованной фосфолипидами. Гидрофильная часть ориентирована вовнутрь мембраны и гидрофобная часть - вовне. Гидрофильное соединение может быть инкапсулировано в полость. Липосомная композиция согласно настоящему изобретению может быть использована в системе доставки лекарственных средств для противораковых агентов и тому подобного. Липосомная композиция согласно настоящему изобретению отличается тем, что включает в себя липосому, покрытую олигосахаридами, и антигенную субстанцию. Липосомную композицию используют, чтобы заставить молекулы МНС класса I и класса II антигенпредставляющих клеток представлять антигенный пептид из антигенной субстанции. Более подробно, когда липосомная композиция согласно настоящему изобретению вводится в брюшную полость, она инкорпорируется в антигенпредставляющую клетку, такую как макрофаг, и антигенный пептид представляется на молекулах МНС класса I и класса II указанной клетки. Макрофаг представляет собой фагоцитирующую клетку. Эта клетка распознает чужеродные субстанции, которые не представлены в организме, умирающие (апоптозные) клетки, которые больше не формируют живой организм, раковые клетки и т.д. После этого макрофаг детально представляет пептидный фрагмент переваренного белка, который будет являться целью атаки иммунной системы, на клеточной поверхности и работает как контрольно-диспетчерский пункт для информирования иммунной сети о цели атаки. В качестве покрытой олигосахаридами липосомы, использованной в настоящем изобретении, может быть использована липосома, описанная в японском патенте 2828391. Тип сахарного компонента,формирующего такой олигосахарид, не является лимитированным. Примеры сахарного компонента включают в себя D-маннозу (D-man), L-фукозу (L-Fuc), D-ацетилглюкозамин (D-GlcNAc), D-глюкозу (DGlc), D-галактозу (D-Gal), D-ацетилгалактозамин (D-GalNAc), D-рамнозу (D-Rha). В олигосахариде индивидуальные составляющие сахара связаны друг с другом через 12 связь,13 связь, 14 связь, 16 связь, 14 связь или их комбинацию. Например, манноза может составлять единичную нить через указанную связь или может принимать ветвистую структуру посредством комбинации связей 13 и 16. Количество моносахаридов, содержащихся в олигосахариде, составляет предпочтительно от 2 до 11. Индивидуальные примеры этих олигосахаридов включают маннобиозу (Man2), маннотриозу (Man3), маннотетраозу (Man4), маннопентозу (Man5), манногексозу (Man6),манногептозу (Man7) и различные типы смешанных олигосахаридов, таких как М 5 (формула 1) и RN где каждая Man, которая связана с другой 12 связью, может быть представлена или не представлена независимо. Олигосахарид, имеющий структуру, представленную формулой 3, является примером олигосахарида, содержащего глюкозу. Олигосахарид, имеющий структуру, представленную формулой 4, является примером олигосахарида, содержащего N-ацетилглюкозамин. Олигосахарид, имеющий структуру, представленную формулой 3, является примером олигосахарида, содержащего фукозу. где m+m'+n составляет от 1 до 10. Формула 4 где n составляет от 0 до 4, где р равно 0 или 1; каждый n независимо равен от 0 до 3; каждый из двух GlcNAc остатков, представленных с правой стороны формулы 4GlcNAc1, может присутствовать или отсутствовать независимо от другого; и все GlcNAc, представленные (GlcNAc1)n, могут связываться с любым количеством свободной гидроксильной группы Man, расположенной на их правой стороне через гликозидную связь, где р равно 0 или 1; каждый n независимо равен от 0 до 3 и все GlcNAc, представленные(GlcNAc1)n, могут связываться с любым количеством свободной гидроксильной группы Man, расположенной на их правой стороне через гликозидную связь, где р равно 0 или 1. Формула 5 где k равно от 1 до 5; каждое р равно 0 или 1 и компонент, не имеющий заданного номера на конце стрелки, может связаться с любым количеством свободной гидроксильной группы через гликозидную связь. где каждое p независимо равно 0 или 1; каждое n равно от 0 до 3; компонент, не имеющий заданного номера на конце стрелки, может связаться с любым количеством свободной гидроксильной группы через гликозидную связь; два GluNAc остатка, представленные 4GlcNAc4GlcNAc на правой стороне в формуле могут присутствовать или отсутствовать независимо друг от друга. где каждое р независимо равно 0 или 1; каждое n независимо равно от 0 до 3; компонент, не имеющий заданного номера на конце стрелки, может связаться с любым количеством свободной гидроксильной группы через гликозидную связь; два GluNAc остатка, представленные 4GlcNAc4GlcNAc на правой стороне в формуле, могут присутствовать или отсутствовать независимо друг от друга. Олигосахарид, используемый в настоящем изобретении, предпочтительно представляет собой олигоманнозу и особенно предпочтительно маннопентозу или маннотриозу. Все указанные сахариды имеют восстановленную концевую альдегидную группу. Таким образом,указанная альдегидная группа может быть использована в качестве способа представления олигосахарида на поверхности липосомы. А именно указанный альдегид может реагировать с липидом, имеющим аминогруппу, с образованием Шиффова основания. Следовательно, согласно общему способу, такое Шиффово основание восстанавливают и предпочтительно восстанавливают химически, напримерNaBH3CN, так чтобы связать олигосахарид с липидом (Tsuguo Mizuochi, Toshitsu-kodaku (CarbohydrateEngineering), стр. 224-232, Биотехнологический информационный центр, Индустриальный исследовательский центр Японии, 1992). Указанный липид, имеющий аминогруппу, предпочтительно является фосфолипидом, имеющим аминогруппу. Например, может быть использован фосфатидиламин, такой как дипальмитоилфосфа тидилэтаноламин (DPPE) или дистеароилфосфатидилэтаноламин (DSPE). Полученная, таким образом,связанная субстанция также может быть отнесена к искусственным гликолипидам в настоящем изобретении. В качестве липидов, которые формируют липосому, обычно используют любые указанные липиды,которые известны как компоненты липосомы и могут быть использованы отдельно или в виде смеси нескольких липидов. Например, могут быть использованы натуральные липиды, такие как липиды желтка яйца, соевых бобов, или липиды, полученные из других растений и животных, модифицированные липиды, полученные модификацией вышеуказанных липидов, такие как липиды, чья степень ненасыщенности увеличена гидрированием, или химически синтезированные липиды. Характерные примеры этих липидов включают в себя стеролы, такие как холестерин (Chol); фосфатидилэтаноламины, такие как дипалмитоилфосфатидилэтаноламин (DPPE) или дистеароилфосфатидилэтаноламин (DSPE); фосфотидилхолины, такие как дипалмитоилфосфатидилхолин (DPPC) или дистеароилфосфатидилхолин (DSPC); фосфатидилсерины, такие как дипалмитоилфосфатидилсерин (DPPS) или дистеароилфосфатидилсерин(DSPS), и фосфатидные кислоты, такие как дипалмитоилфосфатидная кислота (DPPA) или дистеароилфосфатидная кислота (DSPA). Липосома может быть изготовлена по известному способу [D.W. Deeamer, P.S. Uster, "Liposome" ed.by M.J. Ostro, Marcel Dekker Inc., N.Y. Basel, 1983, p.27]. Общепринятыми являются вихревой способ и ультразвуковой способ. Также могут быть применены другие, кроме вышеупомянутых, способы: способ этаноловой инъекции, эфирный способ, способ напыления обратной фазы. Такие способы также могут быть использованы в комбинации. Например, в случае вихревого способа и ультразвукового способа определенный липид растворяют в органическом растворителе, таком как метанол, этанол, хлороформ или их смесь, включая смесь метанола и хлороформа. После этого органический растворитель удаляют выпариванием, так чтобы получить тонкий слой липида. Затем к тонкому слою липида добавляют водный переносчик с последующей вихревой обработкой или обработкой ультразвуком для формирования липосом. Во время этой операции субстанцию для введения, такую как лекарственное средство, маркер или контрастное вещество, вводят в указанный водный переносчик. Например, такую субстанцию растворяют или ресуспендируют в указанном водном переносчике, так чтобы субстанция для введения была инкапсулирована в липосому. Для того чтобы ввести олигосахарид в поверхность липосомы, можно, например, использовать один из следующих двух способов. В случае, если указанный искусственный гликолипид является водорастворимым и совершенно не растворимым в органическом растворителе, например когда используют связанную субстанцию вышеупомянутых М 5 и DPPE (M5-DPPE) или связанную субстанцию RN DPPE(RN-DPPE), то готовят водный раствор, который содержит такую связанную субстанцию, и затем водный раствор смешивают с формируемой липосомой. После этого полученная смесь может быть инкубирована при температуре от +4 С до комнатной температуры от 24 до 120 ч, например примерно 72 ч. С другой стороны, в случае если вышеупомянутый искусственный гликолипид растворим в органи-5 012618 ческом растворителе, то искусственный гликолипид вместе с липидом, который используют для формирования липосомы, растворяют в указанном органическом растворителе в процессе производства липосомы. После этого липосома может быть создана по общепринятому способу. Количество олигосахарида, используемого для производства липосомы, отличается в зависимости от типа олигосахарида, типа антигена для инкапсулирования, комбинационной структуры липосомы и т.д. В общем, используют от 5 до 500 мкг олигосахарида с учетом 1 мг липида, который составляет липосому. Липосома, используемая в настоящем изобретении, может быть либо многослойного типа (многослойный переносчик), либо однослойного типа (однослойный переносчик). Такая липосома может быть изготовлена общеизвестным способом. Кроме того, также возможно преобразовать один тип в другой общепринятым способом. Например, липосома многослойного типа может быть преобразована в липосому однослойного типа. Размер частицы липосомы, используемой в настоящем изобретении, не является особенно лимитированным. При необходимости размер частицы липосомы может быть изменен согласно общепринятому способу, например фильтрацией через фильтр, имеющий желаемый размер пор. В настоящем изобретении предпочтительно используют липосому, покрытую олигоманнозой. Такую липосому, покрытую олигоманнозой, получают присоединением липидов к нескольким цепям сахара маннозы (олигоманнозы), которые формируют структуру сахарной цепи, которая является высококонсервативной в организмах, от дрожжей до человека, ее очисткой и затем конъюгированием с липосомой. Такая покрытая олигоманнозой липосома не является токсичной, потому что используют структуру, исходно представленную в человеческом организме. Когда рецептор, который имеется на макрофаге, специфически узнает олигоманнозу, липосома, покрытая олигоманнозой, немедленно инкорпорируется в клетку в результате фагоцитоза. Тип антигенной субстанции, используемой в настоящем изобретении, не является особенно лимитированным. Примеры данной антигенной субстанции включают в себя сурвивин, ливин, рикаварин,gp110, MART-1, NY-ESO-1, SSX, PBF, HER2 SYT-SSX, CEA и MUC-1. Указанная антигенная субстанция предпочтительно является раковым антигеном. Количество антигенной субстанции, содержащейся в липосоме, не является особенно лимитированным, при условии, что может быть получен эффект настоящего изобретения, такой, что введенная липосомная композиция инкорпорируется в макрофаг, находящийся в брюшной полости, и затем антигенный пептид представляется на молекулах МНС класса I и класса II антигенпредставляющей клетки. Количество такой антигенной субстанции может быть определено приблизительно, в зависимости от типа субстанции для введения, композиции липосомы, ее структуры и т.д. В общем, вводят от 1 до 100 мкг антигенной субстанции с учетом 1 мг липида, который составляет липосому. Композиция липосомы согласно настоящему изобретению может включать в себя фармацевтически приемлемый носитель по желанию. Примеры используемого носителя включают в себя стерильную воду, буферный раствор и физиологический раствор. Кроме того, композиция липосомы согласно настоящему изобретению может также включать в себя соли, сахара, белки, крахмал, желатин, растительное масло, полиэтиленгликоль и т.д. Путь введения липосомальной композиции согласно настоящему изобретению не является особенно лимитированным. Указанная липосомная композиция предпочтительно может быть введена в брюшную полость, подкожно или через слизистую носа. Доза липосомальной композиции согласно настоящему изобретению изменяется в зависимости от типа субстанции для введения, пути введения, тяжести симптомов, возраста и состояния пациента, степени побочных эффектов и т.д. В общем, указаную липосомальную композицию вводят в дозе от 1 до 100 мг/кг в день. Настоящее изобретение может быть описано более детально в следующих примерах. Однако эти примеры не ограничивают рамки настоящего изобретения. Примеры. Пример 1. Способ производства липосомы, покрытой олигосахаридами, и способ инкапсулирования в нее антигена. Согласно следующему способу маннотриозу (М 3) (маннотриоза (Man3), имеющую структуруMan16 (Man13) Man), химически связывают с дипальмитоилфосфатидилэтаноламином в реакции восстановительного аминирования так, чтобы синтезировать М 3-DPPE. Во-первых, добавляют 600 мкл дистиллированной воды к 2,5 мг маннотриозы (М 3) и перемешивают реакционный раствор так, чтобы указанная субстанция растворилась в дистиллированной воде, и таким образом получают раствор олигосахарида. Затем растворяют DPPE в концентрации 5 мг/мл в смешанном растворе хлороформ/этанол (1:1; объемное отношение) и таким образом получают DPPE раствор. Кроме того, растворяют NaBH3CN в концентрации 10 мг/мл в метаноле и таким образом получаютNaBH3CN раствор. 9,4 мл вышеупомянутого раствора DPPE и 1 мл вышеупомянутого раствора NaBH3CN добавляют к 600 мкл каждого из вышеупомянутых олигосахаридных растворов, и три типа растворов перемешивают взбалтыванием, реакционную смесь инкубируют при 60 С 16 ч для получения искусственного гликолипида. Синтезированный искусственный гликолипид очищают высокоэффективной жидкостной хроматографией, ВЭЖХ, так чтобы получить высоко очищенный гликолипид.-6 012618 Липосома, в которую помещен белок-антиген (яичный альбумин (OVA) или антиген EL4), получена следующим образом. Во-первых, раствор хлороформ/метанол или раствор этанола, который содержит дипальмитоилфосфатидилхолин (DPPC), холестерин и искусственный гликолипод (M3-DPPE) в соотношении 1:1:0,1,помещают в грушевидную колбу. Смесь высушивают, используя роторный испаритель, при пониженном давлении так, чтобы получить липидную пленку. Затем 0,3 мл основного фосфатного буфера (PBS), который содержит белок-антиген (5 мг/мл), добавляют к липидной пленке и полученную смесь затем перемешивают, используя вортекс миксер, так, чтобы получить M3-DPPE-покрытую липосому (OML). Затем липосому несколько раз отмывают PBS и водорастворимые субстанции, которые не были инкапсулированы в липосому, удаляют центрифугированием. Кроме того, размер частиц липосом устанавливают, используя 1 мкм фильтр. Количество инкапсулированного белка устанавливают, измеряя количество белка. Кроме того, композиционное соотношение липида в липосоме и количества лекарственного средства определяют количественно ВЭЖХ. Пример 2. Подтверждение представления антигена молекулами МНС класса I и класса II. Яичный белок (OVA) или OVA пептид инкапсулируют в липосому, покрытую маннозой, и затем вводят липосому непосредственно в брюшную полость мыши C57BL/6 или мыши BALB/c. Липосома быстро инкорпорируется в CD11b-положительную клетку, которая экспрессирует оба МНС класса I и МНС класса I и класса II. Известно, что данная CD11b-положительная клетка функционирует как антиген-представляющая клетка. Таким образом, чтобы продемонстрировать, что OVA может быть представлен на обеих молекулах МНС класса I и класса II, после того, как покрытая олигоманнозой (M3) липосома с инкапсулированным OVA была инкорпорирована в CD11b-положительную клетку, проводят следующий эксперимент.(1) Экспериментальные группы. В группе А 50 мкг OVA, растворенного в PBS, инкапсулируют в М 3 покрытые липосомы (OML). Добавляют PBS к липосоме до конечного объема 200 мкл. Полученный раствор вводят в брюшную полость каждой мыши. В группе В OVA растворяют в PBS в концентрации 5 мг/мл. К 10 мкл раствора OVA добавляютPBS до конечного объема 200 мкл. Полученный раствор вводят в брюшную полость каждой мыши. В группе В мышам также вводят по 50 мкг OVA, как и в случае группы А. В группе С PBS добавляют к 38 мкл липосом, покрытых М 3 и содержащих только PBS, до конечного объема 200 мкл. Полученный раствор вводят в брюшную полость каждой мыши. В группе D 200 мкл PBS вводят в брюшную полость каждой мыши.(2) Предварительная обработка CD11b-положительных клеток, полученных из брюшной полости. Используют восьминедельных мышей линии C57BL/6 или BALB/c. Брюшную часть каждой мыши дезинфицируют гигроскопической ватой, смоченной в 70% этаноле. После этого каждый из вышеуказанных растворов вводят каждой группе мышей, используя шприц для туберкулинизации. Через час после введения мышей подвергали эвтаназии введением нембутала в качестве анестезирующего агента. После этого брюшную полость мыши быстро промывают 5 мл сбалансированного раствора Хенкса и собирают указанный раствор для выделения свободных клеток, имеющихся в брюшной полости. Клетки, полученные с помощью сбалансированного раствора Хенкса от 3 мышей каждой группы,собирают отдельно для каждой группы и центрифугируют при 1000 об/мин 5 мин. Осажденные клетки ресуспендируют в 10 мл раствора RPMI (раствор RPMI-A), который содержит 10% фетальной телячьей сыворотки, и затем их вновь центрифугируют при 1000 об/мин 5 мин. Данную процедуру повторяют дважды и полученные клетки ресуспендируют в растворе RPMI (раствор RPMI-B), который содержит 1 мкМ 2-меркаптоэтанола и 10% фетальной телячьей сыворотки. Суспензию наносят по 100 мкл в 96 луночный планшет. Клетки культивируют в СО 2 инкубаторе при 37 С, 5% СО 2 в течение 2 ч для адгезииCD11b-положительных клеток. Неадгезированные клетки смывают, и оставшиеся клетки культивируют в 100 мкл раствора RPMI-B в течение 24 ч.(3) Определение антигена, представленного на молекулах MHC класса I и класса II. Наличие или отсутствие OVA пептида, представляемого на молекулах MHC класса I и класса II мышей C57BL/6, определяют, используя мышей линии C57BL/6, а именно мышей ОТ-1 (которые различают OVA257-264, представленных на Н-2Kb в качестве молекулы MHC класса I) и мышей ОТ-2 (которые различают OVA323-339, представленных на Н-2Ab в качестве молекулы MHC класса II) соответственно. Из каждой из указанных мышей выделяют селезенку, погружают в 5 мл сбалансированного раствора Хенкса и растирают между двух предметных стекол. Размельченную таким образом селезенку переносят в центрифужную пробирку объемом 15 мл и оставляют на 5 мин для осаждения фиброзной ткани, которая формирует ткань селезенки. Осажденную фиброзную ткань удаляют. После этого для получения лимфоцитов осадок центрифугируют в среде для выделения лимфоцитов M-SMF (JIMRO Co., Ltd.). Дополнительно проводят эксперимент для проверки эффективности представления антигена молекулами класса II у мышей DO11.10 (которые распознают OVA пептид, представленный Н-2Ad/OVA323-339), которые являются мышами линии BALB/c. Лимфоциты 1107 ресуспендируют в 1 мл раствора RPMI-B и добавляют по 100 мкл каждой суспензии в каждую лунку, содержащую CD11b-положительные клетки (2-d), с по-7 012618 следующим культивированием. Через 48 ч собирают супернатант и определяют количество INF-, содержащегося в супернатанте. Результаты представлены на фиг. 1 и 2. Как показывают результаты на фиг. 1 и 2, если объекту вводят яичный альбумин (OVA), заключенный в липосому, покрытую маннозой, то антиген представлен обеими молекулами МНС класса I и класса II, и эффективно вырабатывается INF-. Пример 3. Индукция CTL на клетках лимфомы мышей EL4. Клетки EL4 вводят подкожно сингенной мыши линии C57BL/6 для получения большого количества клеток EL4. Данную клеточную массу гомогенизируют в PBS и 100000 г полученного супернатанта используют в качестве EL4 антигена.EL4 антиген помещают в липосому, покрытую олигоманнозой, и вводят 1 мкг белка подкожно мыши линии C57BL/6 для иммунизации (всего 3 раза с интервалами в 1 неделю). Через 3 недели после первой иммунизации выделяют селезенку, погружают в 5 мл сбалансированного раствора Хенкса и растирают между двух предметных стекол. Размельченную таким образом селезенку переносят в центрифужную пробирку объемом 15 мл и оставляют на 5 мин для осаждения фиброзной ткани, которая формирует ткань селезенки. Осажденную фиброзную ткань удаляют. После этого для получения лимфоцитов осадок центрифугируют в среде для выделения лимфоцитов M-SMF (JIMRO Co.,Ltd.). Выделенные таким образом лимфоциты используют в качестве эффекторных клеток. После этого эффекторные клетки стимулируют растворенным белковым антигеном (100 мкг EL4/107 клеток) в течение 3 дней. Эффекторные клетки смешивают с клетками-мишенями (EL4 клетки: 104 клеток/лунку) в следующих соотношениях (Е/Т соотношения =50:1; 25:1; 12,5:1; 6,25:1; 3,125:1 и 1:1). Через восемь часов культивирования измеряют цитотоксичность, используя набор CytoTox96 assay kit (Promega). Результаты измерения представлены на фиг. 3. Как следует из результатов, показанных на фиг. 3,если субъекту вводят EL4 антиген, помещенный в липосому, то CTL могут быть эффективно индуцированы. Пример 4.OVA, помещенный в OML (покрытая олигоманнозой липосома, OML/OVA), OVA, помещенный в непокрытую олигоманнозой липосому (BL/OVA), или только OVA вводят в брюшную полость мыши(5 мкг OVA). Через 1 ч выделяют интраперитониальные клетки и помещают их на чашку Петри для последующего культивирования в течение 1 ч. После этого взвешенные клетки удаляют и к адгезированным клеткам добавляют свежую среду RPMI1640. Через 24 ч собирают среду и определяют в ней цитокины с помощью ИФА. Результаты представлены на фиг. 4. IL12 вырабатывают только OML/OVA. Пример 5.OML/OVA или LPS (10 нг) вводят в брюшную полость мыши, как в примере 4. Через 1 ч собирают интраперитониальные клетки и затем определяют количество цитокинов, произведенных макрофагами. Результаты представлены на фиг. 5. В результате LPS стимуляции преимущественно образуются IL1 иCD8-положительные Т-клетки и CD4-положительные Т-клетки получают из трансгенных мышей ОТ-1 и ОТ-2, которым вводили TCR, которые распознают OVA257-264 на H-2Kb (MHC класс I) и TCR, которые распознают OVA323-339 на H-2Ab (MHC класс II) соответственно. В то же время OVA, содержащиеOML, вводят в брюшную полость мыши C57/BL6 и через 1 ч собирают интраперитониальные клетки. Полученные клетки культивируют и затем используют адгезированные клетки как макрофаги. Указанные Т-клетки и макрофаги используют в смешанной культуре. Через 24 ч собирают культуральный раствор и определяют количество цитокинов, содержащихся в среде. Результаты представлены на фиг. 6. Пример 7. Сравнивают отдельное введение OVA с введением OVA, помещенного в OML, в показателях эффективности представления антигена. Применяют способ, описанный в примере 6. Результаты представлены на фиг. 7. При введении 2 мкг OVA, инкапсулированного в OML, количество выделенных цитокинов почти равно количеству, полученному при отдельном введении OVA (1000 мкг). Таким образом, полагают, что представление антигена МНС класса II при использовании OML примерно в 500 раз выше,чем при отдельном введении OVA. To есть представление антигена может быть проведено очень эффективно путем инкапсулирования антигена в OML. Пример 8. Мышей линии C57BL/6 иммунизируют OVA/OML (примерно 1 мкг OVA) (подкожное введение дважды с интервалом в одну неделю). Схема иммунизации для активации кишечного иммунитета показана на фиг. 8. Через неделю после заключительной иммунизации получают клетки селезенки мыши,стимулированные антигеном. После этого измеряют содержание цитокинов в среде (фиг. 9). В то же время оценивают цитотоксичность на клетках линии EG7 (клетки, которые вносят OVA гены в клеткиEL4 и представляют OVA пептиды на своих собственных молекулах МНС класса I) в качестве клетокмишеней (фиг. 9). У мышей, иммунизированных OVA, инкапсулированным в OML, наблюдают значительное образование цитокина Th1 и выраженную цитотоксичность. С другой стороны, когда в качестве-8 012618 мишени используют родительскую линию EL4, то ни в одном случае не наблюдают цитотоксичности. Соответственно, можно сказать, что индуцирована антигенспецифическая CTL. Пример 9. Через неделю после заключительной иммунизации, как описано в примере 8, 1106 EG-7 трансплантируют в область спины иммунизированной мыши. Через 3 недели измеряют объем опухоли. Результаты представлены на фиг. 10. В случае, если мышь иммунизирована OVA/OML, развитие опухоли полностью ингибировано. Пример 10. Трансплантируют 1106 EG-7 в область спины каждой иммунизированной мыши. На 9-й день после трансплантации (объем опухоли примерно 100 мм 3) мышь прививают OML/OVA (1 мкл OVA). После этого измеряют объем опухоли. Результаты представлены на фиг. 11. В группе, которой вводилиOML/OVA, наблюдают инволюцию опухоли практически у всех мышей, и в трех случаях опухоль полностью исчезла. Коэффициент выживаемости мышей с привитой опухолью представлен на фиг. 12. В группе, которой вводили OML/OVA, данный коэффициент выживаемости заметно увеличен. Пример 11. Вводят OML/OVA (5 мкл OVA) в назальную полость каждой мыши, всего 3 раза с интервалом в 1 неделю. Через 1 неделю после финальной иммунизации из мыши выделяют назально-ассоциированные лимфатические ткани (NALT) и селезенку и измеряют количество выработанных цитокинов после стимуляции антигеном. Результаты представлены на фиг. 13. В группе, которой вводили OML/OVA, наблюдается значительное образование цитокина Th1 в NALT. Промышленное применение Согласно настоящему изобретению стало возможным предоставить липосомную композицию, которая стимулирует молекулы МНС класса I и класса II антигенпредставляющей клетки, эффективно представлять антигенный пептид, такой как раковый антиген. Согласно настоящему изобретению создан простой способ иммунизации, в котором не нужна операция получения клеток из тела пациента и последующего их возвращения обратно. В частности, липосомная композиция согласно настоящему изобретению делает возможным инкапсулирование белка, действующего как раковый антиген, и прямое введение белка пациенту. Таким образом, липосомная композиция согласно настоящему изобретению является удобной для вакцинальной терапии. Краткое описание фигур На фиг. 1 показано количество INF-, образованного клетками селезенки трансгенной TCRспецифичной к OVA пептиду ограниченной по МНС класса I мыши. На фиг. 2 показан ответ клеток селезенки трансгенной TCR-специфичной к OVA пептиду ограниченной по МНС класса II мыши на макрофаг из брюшной полости, в который был заключен OVA. На фиг. 3 показана индукция цитотоксических Т-клеток иммунизацией Man3-липосомой. На фиг. 4 показано количество цитокина, образованного интраперитониальными клетками после введения в брюшную полость липосомы, покрытой олигоманнозой (OML/OVA), или подобного ей соединения. На фиг. 5 показано количество цитокина, образованного интраперитониальными клетками после введения в брюшную полость OML/OVA или LPS. На фиг. 6 показано количество цитокина, образованного в случае, когда CD8-положительные Тклетки и CD4-положительные Т-клетки получают из TCR трансгенных мышей ОТ-1, которые распознают OVA257-264 (МНС класс I), и TCR трансгенных мышей ОТ-2, которые распознают OVA323-339 (МНС класс II), соответственно, и когда CD8-положительные Т-клетки, CD4-положительные Т-клетки и макрофаги используют для смешанной культуры. На фиг. 7 показаны результаты, полученные при сравнении случая отдельного введения OVA и случая инкапсулирования OVA в OML и последующего введения OML, в показателях эффективности представления антигена. На фиг. 8 показана схема иммунизации для активации кишечного иммунитета. На фиг. 9 показаны результаты, полученные выделением клеток селезенки через 1 неделю после заключительной иммунизации для активации кишечного иммунитета, стимулированием клеток антигеном и измерением количества цитокина, содержащегося в среде, и результаты оценки цитотоксичности, полученные на клетках-мишенях линии EG7. На фиг. 10 показаны результаты, полученные трансплантацией EG-7 в область спины каждой мыши, подвергнутой кишечной иммунизации, через 1 неделю после заключительной иммунизации и измерения объема опухоли через 3 недели. На фиг. 11 показаны результаты измерения объема опухоли после прививки OML/OVA на 9-й день после трансплантации EG-7 в область спины каждой мыши. На фиг. 12 показан коэффициент выживаемости мышей с привитой опухолью. На фиг. 13 показаны результаты, полученные при введении OML/OVA в назальную полость каждой мыши, выделении лимфатической ткани, ассоциированной с назальной полостью (NALT), и селезенки-9 012618 мыши через 1 неделю после заключительной иммунизации и измерения количества цитокина, наработанного после антигенной стимуляции. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Липосомная композиция, содержащая липосому, покрытую олигосахаридом, и антигенную субстанцию, и которую используют для представления антигенного пептида молекулами МНС класса I и класса II антигенпредставляющей клетки, где олигосахарид представляет собой маннопентозу или маннотриозу и антигенная субстанция представляет собой раковый антиген и липосому вводят в брюшную полость, подкожно, на слизистую носа, и она инкорпорируется в антигенпредставляющую клетку, такую как макрофаг, и в результате антигенный пептид представляется на молекулах МНС класса I и класса II. 2. Липосомная композиция по п.1, которую используют для индукции цитотоксических Т-лимфоцитов (CTL).
МПК / Метки
МПК: A61P 35/00, A61K 39/00, A61K 47/26, A61P 37/04, A61K 9/127, A61K 47/36
Метки: иммунитета, липосомная, индукции, композиция
Код ссылки
<a href="https://eas.patents.su/16-12618-liposomnaya-kompoziciya-dlya-indukcii-immuniteta.html" rel="bookmark" title="База патентов Евразийского Союза">Липосомная композиция для индукции иммунитета</a>
Предыдущий патент: Способ микробиального производства ценного соединения
Следующий патент: Способ переработки окисленных никелевых руд
Случайный патент: Автоматизированный комплекс для видеонаблюдения