Композиция (варианты) и способ для лечения гиперпролиферативных процессов, способ лечения рака (варианты) и способ получения твёрдой дисперсии вещества
Формула / Реферат
1. Композиция для лечения гиперпролиферативных процессов, содержащая метиламид 4-[4-[3-(4-хлор-3-трифторметилфенил)уреидо]-3-фторфенокси}пиридин-2-карбоновой кислоты и/или его соли, гидраты, сольваты в форме твердой дисперсии.
2. Композиция для лечения гиперпролиферативных процессов, содержащая твердую дисперсию, включающую, по меньшей мере, соединение формулы I, и фармацевтически приемлемый матричный образователь
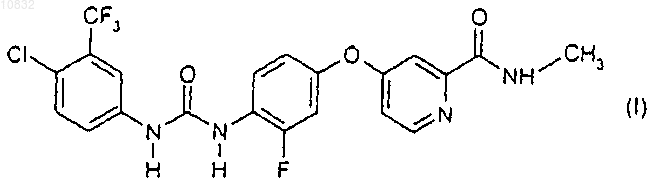
3. Композиция по п.2, в которой матричный образователь включает полимерные наполнители или неполимерные наполнители, способные к растворению или диспергированию соединения формулы I.
4. Композиция по п.2, в которой матричный образователь включает комбинацию полимерных наполнителей и неполимерных наполнителей, способных к растворению или диспергированию соединения формулы I.
5. Композиция по п.2, в которой матричный образователь включает водорастворимый полимер.
6. Композиция по п.5, в которой матричный образователь включает по меньшей мере один полимер, выбранный из группы, включающей поливинилпирролидон, соповидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, полиэтиленгликоль и полиэтиленоксид.
7. Композиция по п.6, в которой агентом матричного образователя является поливинилпирролидон.
8. Композиция по п.7, в которой соотношение масс соединения формулы I, рассчитанного как основание, не содержащее растворитель, и поливинилпирролидона составляет от 1:0,5 до 1:20.
9. Композиция по п.6, в которой агентом матричного образователя является гидроксипропилцеллюлоза.
10. Композиция по п.9, в которой соотношение масс соединения формулы I, рассчитанного как основание, не содержащее растворитель, и гидроксипропилцеллюлозы составляет от 1:0,5 до 1:20.
11. Композиция по любому из пп.1-10, в которой твердая дисперсия включает натрийкроскармеллозу, натрийкрахмалгликолят, кросповидон, гидроксипропилцеллюлозу с низким уровнем замещения, крахмал, микрокристаллическую целлюлозу или их комбинацию.
12. Композиция по п.8, в которой твердая дисперсия включает поливинилпирролидон и натрийкроскармеллозу.
13. Композиция по п.8, в которой твердая дисперсия включает поливинилпирролидон и натрий-крахмалгликолят.
14. Композиция по п.8, в которой твердая дисперсия включает поливинилпирролидон, натрийкроскармеллозу и микрокристаллическую целлюлозу.
15. Композиция по п.10, в которой твердая дисперсия включает гидроксипропилцеллюлозу и натрийкроскармеллозу.
16. Композиция по п.10, в которой твердая дисперсия включает гидроксипропилцеллюлозу и по меньшей мере один наполнитель, который представляет собой сахар, сахароспирт или циклодекстрин.
17. Композиция по любому из пп.1-16, в которой твердая дисперсия является, по существу, однородной.
18. Композиция по любому из пп.1-17, которая содержит соединение формулы I, по существу, в аморфной форме.
19. Композиция по любому из пп.1-18, которая представляет собой фармацевтическую композицию для перорального применения.
20. Композиция по любому из пп.1-19, которая представляет собой фармацевтическую композицию в форме таблетки.
21. Композиция по любому из пп.1-19, которая представляет собой фармацевтическую композицию в форме капсулы.
22. Композиция по любому из пп.1-19, которая представляет собой фармацевтическую композицию в форме порошка, гранулы или саше.
23. Способ получения твердой дисперсии соединения формулы I
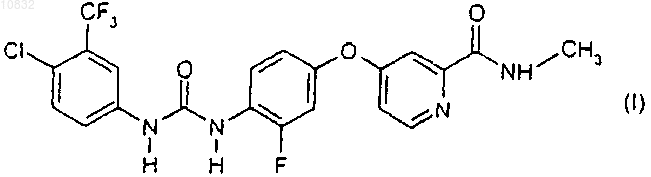
в котором одновременно обрабатывают соединение формулы I и по меньшей мере один агент матричного образователя методом экструзии горячего расплава, методом покрытия горячим расплавом, методом приллирования, методом замораживания, методом выпаривания растворителя или их комбинациями.
24. Способ по п.23, в котором твердую дисперсию получают обработкой соединения формулы I и по меньшей мере одного агента матричного образователя экструзией горячего расплава.
25. Способ по п.23, в котором твердую дисперсию получают обработкой соединения формулы I и по меньшей мере одного агента матричного образователя методами выпаривания растворителя.
26. Способ по п.25, в котором по меньшей мере один растворитель выбран из группы, включающей метанол, этанол, н-пропанол, изопропанол и ацетон.
27. Способ по п.26, в котором в качестве растворителя используют смесь этанола и ацетона.
28. Способ по любому из пп.23-27, в котором твердую дисперсию далее подвергают по меньшей мере одной дополнительной стадии обработки, которая представляет собой помол, просеивание, уплотнение роликом, измельчение, отсеивание, смешивание или их комбинацию.
29. Способ по любому из пп.23-28, который включает дополнительную стадию получения состава твердой дисперсии по меньшей мере с одним фармацевтически приемлемым носителем с образованием смеси и формования указанной смеси в виде таблеток, наполненных капсул или саше.
30. Фармацевтическая композиция, полученная способом по любому из пп.23-29.
31. Способ лечения гиперпролиферативных процессов, отличающийся тем, что млекопитающему, в том числе человеку, вводят фармацевтическую композицию по любому из пп.1-22 и 30 в виде монотерапии или в комбинации с другими методами лечения.
32. Способ лечения рака, отличающийся тем, что млекопитающему, в том числе человеку, вводят фармацевтическую композицию по любому из пп.1-22 и 30 в виде монотерапии или в комбинации с другими методами лечения.
33. Способ лечения рака, отличающийся тем, что млекопитающему, в том числе человеку, вводят фармацевтическую композицию по любому из пп.1-22 и 30 в виде монотерапии или в комбинации с радиотерапией.
34. Способ лечения рака, отличающийся тем, что человеку вводят фармацевтическую композицию по любому из пп.1-22 и 30 в комбинации с цитотоксической терапией.
35. Способ лечения рака, отличающийся тем, что человеку вводят фармацевтическую композицию по любому из пп.1-22 и 30 в комбинации с другой противораковой терапией, направленной на VEGFR, PDGFR, src, abl flt-3, EGFR, HER-2, aurora, raf, MEK, ERK, киназу PI-3, AKT, mTOR или HDAC.
Текст
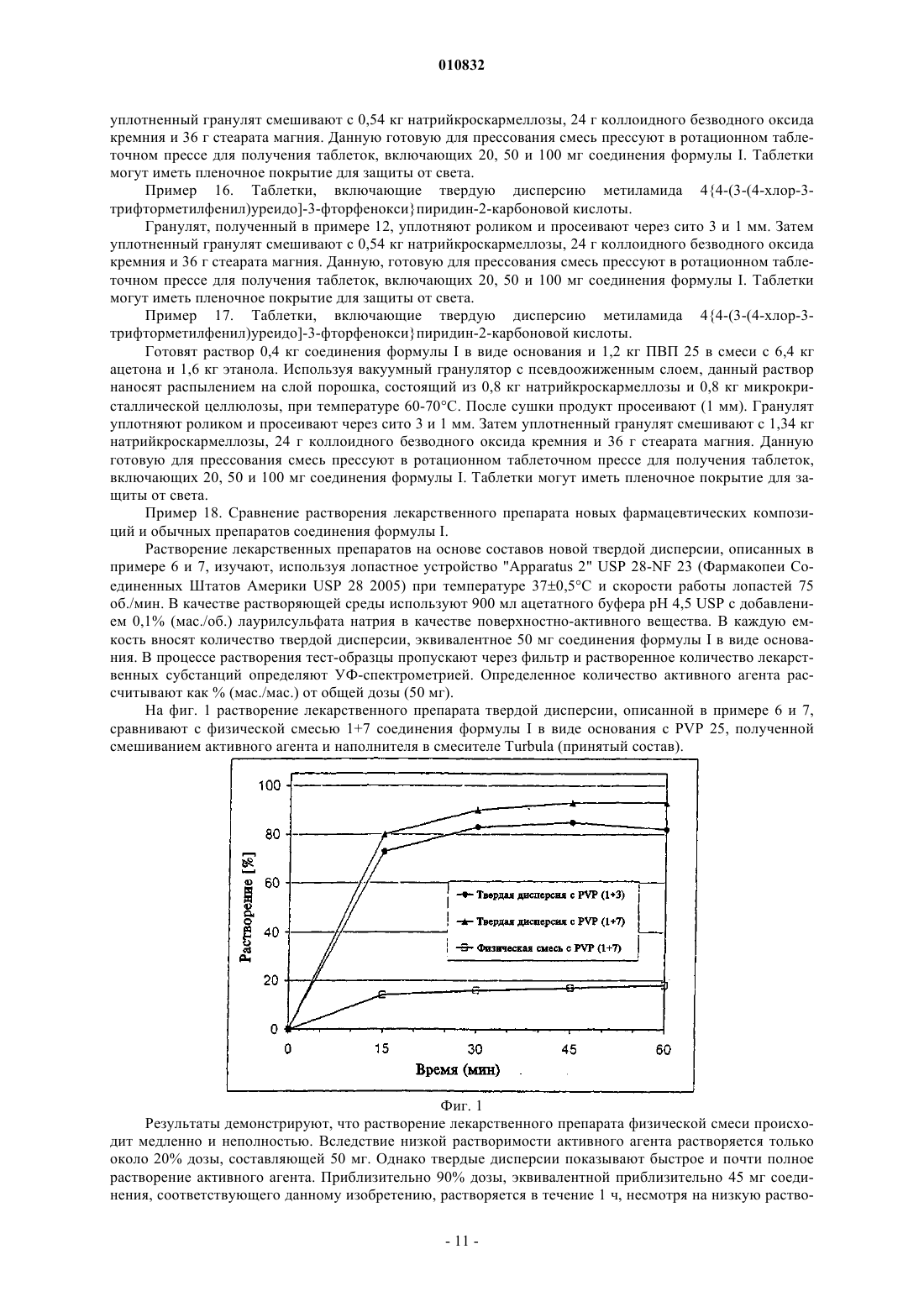
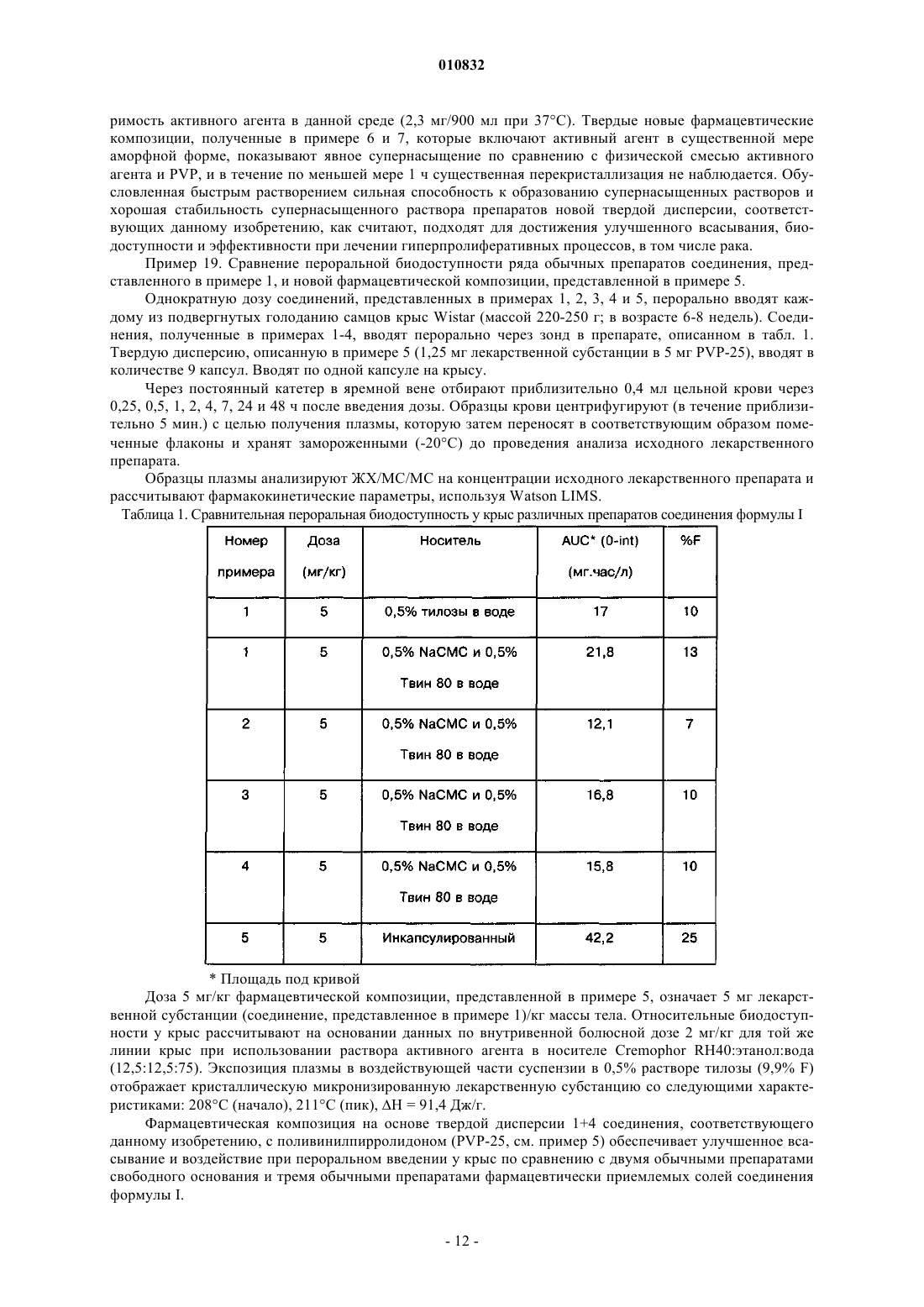
010832 Область техники, к которой относится изобретение Данное изобретение относится к новым фармацевтическим композициям, способам получения данных новых фармацевтических композиций и их применению для лечения гиперпролиферативных процессов, таких как рак, либо в виде монотерапевтического агента, либо в комбинации с другими терапевтическими методами. Уровень техники Диарилмочевины представляют собой класс ингибиторов серинтреонинкиназы, а также ингибиторов тирозинкиназы, известных в области техники. Следующие публикации иллюстрируют их эффективность в качестве активного ингредиента в фармацевтических композициях для лечения гиперпролиферативных заболеваний, таких как рак:-карбоксиарилдифенилмочевины описаны в заявке WO 00/42012 (опубликована 20 июля 2000 г.),WO 00/41698 (опубликована 20 июля 2000 г.) и в следующих опубликованных заявках США:US2002-013774-A1, опубликована 26 сентября 2002 г.; и одновременно находящихся на рассмотрении заявках США: 09/758547, поданной 12 января 2001 г.,09/889227, поданной 12 июля 2001 г.,09/993647, поданной 27 ноября 2001 г.,10/042203, поданной 11 января 2002 г., и 10/071248, поданной 11 февраля 2002 г. В частности, обнаружено, что дифенилмочевина формулы I, обозначаемая также как метиламид 44-[3-(4-хлор-3-трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты представляет собой сильный ингибитор киназ raf, VEGFR-2, р 38 и PDGFR. Все эти ферменты являются молекулярными мишенями, представляющими интерес в плане лечения гиперпролиферативных заболеваний, в том числе рака. Вследствие этого соединение формулы I будут использовать в качестве лекарственного средства для лечения вышеупомянутых заболеваний. Предпочтительным путем введения лекарственного препарата является введение через ротовую полость. Данный путь обеспечивает максимальный комфорт и удобство дозирования. Биодоступность, достигаемая после перорального применения, является мерой потенциальной эффективности пероральной дозированной формы лекарственного препарата. Биодоступность после перорального применения зависит от ряда факторов, таких как растворимость активного начала в водной среде, концентрация дозы,растворение дозированной формы, всасывание через желудочно-кишечный тракт и эффект первого прохождения. Вследствие этого требуются твердые фармацевтические композиции для перорального применения,включающие соединение формулы I, которые в результате дают улучшенное растворение, всасывание и воздействие на млекопитающих, улучшенную вариабельность среди пациентов и общую повышенную эффективность в клинических условиях. В настоящее время обнаружено, что цель в виде улучшенной растворимости, повышенного уровня всасывания и повышенной биодоступности, а также других требований, которая станет очевидной компетентному специалисту в данной области, достигается настоящим изобретением, которое подробно описано ниже. Описание изобретения Применение новой фармацевтической композиции, включающей твердую дисперсию соединения формулы I, обеспечит существенные преимущества в клинической практике. Формула I представляет собой следующую: Термин "соединение формулы I" или "соединение, соответствующее данному изобретению", относится не только к метиламиду 4-4-[3-(4-хлор-3-трифторметилфенил)уреидо]-3-фторфеноксипиридин-2 карбоновой кислоты, как показано в формуле I, но также относится к его сольватам, гидратам, фармацевтически приемлемым солям или их комбинациям. Настоящее изобретение относится к:(i) новым фармацевтическим композициям, включающим соединение формулы I в форме твердой дисперсии, которая включает твердые растворы, стеклянные растворы, стеклянные суспензии, аморфные осадки в кристаллическом носителе, эвтектические смеси или монотектические смеси, соединение или комплексное образование и их комбинации;(ii) способам получения данных новых фармацевтических композиций;(iii) применению данных композиций для лечения гиперпролиферативных заболеваний, таких как рак, либо в виде монотерапевтического агента, либо в комбинации с другими терапевтическими препаратами. Далее различные типы твердых дисперсий (твердые растворы, стеклянные растворы, стеклянные суспензии, аморфные осадки в кристаллическом носителе, эвтектические смеси или монотектические смеси, соединение или комплексное образование и их комбинации) совместно называют твердой дисперсией. Фармацевтическая композиция, соответствующая данному изобретению, состоит из твердой дисперсии, включающей по меньшей мере одно соединение формулы I и фармацевтически приемлемый матричный образователь. Термин "матричный образователь" или "агенты матричного образователя", как используют в данном контексте, относится к обоим полимерным наполнителям, неполимерным наполнителям и их комбинациям, способным растворять или диспергировать соединение формулы I. Аспектом изобретения, представляющим особенный интерес, является фармацевтическая композиция, включающая твердую дисперсию, в которой матричный образователь включает фармацевтически приемлемый полимер, такой как, например, поливинилпирролидон, сополимер винилпирролидона/винилацетата, кросповидон, полиалкиленгликоль (например, полиэтиленгликоль), полиэтиленоксид,полоксамер, гидроксиалкилцеллюлоза (например, гидроксипропилцеллюлоза), гидроксиалкилметилцеллюлоза (например гидроксипропилметилцеллюлоза), карбоксиметилцеллюлоза, натрий карбоксиметилцеллюлоза, этил целлюлоза, сукцинаты целлюлозы (например, ацетатсукцинатцеллюлозы и ацетатсукцинат гидроксипропилметилцеллюлозы), фталаты целлюлозы (например ацетатфталат целлюлозы и фталатгидроксипропилметилцеллюлозы), полиметакрилаты (например типа Eudragit), полигидроксиалкилакрилаты, полигидроксиалкилметакрилаты, полиакрилаты, поливиниловый спирт, поливинилацетат,сополимер винилового спирта/винилацетата, ксантановая камедь, галактоманнаны, каррагинан, хитозан,хитин, альгиновая кислота и ее соли, полилактиды, декстрины, крахмал и производные крахмала, белки и их комбинации. Другой аспект изобретения представляет собой фармацевтическую композицию, включающую твердую дисперсию, в которой матричный образователь включает сахар и/или сахароспирт и/или циклодекстрин, такой как, например, сахароза, лактоза, фруктоза, мальтоза, раффиноза, сорбит, лактитол, маннит, мальтитол, эритритол, трейтол, адонитол, арабитол, ксилит, дульцитол, инозит, трегалоза, изомальт,инулин, матольдекстрин, -циклодекстрин, гидроксипропилциклодекстрин, сульфобутиловый эфир циклодекстрина или их комбинации. Дополнительные подходящие наполнители, которые используют для получения матричного образователя твердой дисперсии, включают, но без ограничения перечисленным, спирты, органические кислоты, органические основания, соли, аминокислоты, пептиды, фосфолипиды, липиды (например моно-,ди- и триглицериды), жирные кислоты, жирные спирты, воски, сложные эфиры жирных кислот, сложные эфиры полиоксиэтиленсорбита и жирных кислот, полигликолизированные глицериды, сложные эфиры сахарозы, мочевину и их комбинации. Твердая дисперсия соединения формулы I в матричном образователе может включать ряд дополнительных фармацевтически приемлемых ингредиентов, таких как носители, поверхностно-активные вещества, наполнители, разрыхляющие агенты, адсорбенты, ингибиторы перекристаллизации, пластификаторы, разжижающие агенты, пеногасители, антиоксиданты, агенты для снижения клейкости, модификаторы рН, скользящие агенты и смазывающие вещества. Носитель, соответствующий данному изобретению, представляет собой наполнитель, который нагружается смесью, включающей, по меньшей мере, агент матричного образователя и соединение, соответствующее данному изобретению, в процессе изготовления твердой дисперсии, например, посредством-2 010832 процессов экструзии горячего расплава, покрытия горячим расплавом, приллирования, замораживания,выпаривания растворителя (например, наслаивания, покрытия, грануляции), и, таким образом, становится составной частью твердой дисперсии. В предпочтительном варианте осуществления данного изобретения матричный образователь включает водорастворимый полимер. В другом предпочтительном варианте осуществления в качестве агента матричного образователя в твердой суспензии используют по меньшей мере один из представителей группы, включающей поливинилпирролидон, соповидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, полиэтиленгликоль и полиэтиленоксил. В другом предпочтительном варианте осуществления в качестве агента матричного образователя используют поливинилпирролидон. Вариант осуществления, представляющий особенный интерес, включает соединение формулы I(рассчитано как основание, не содержащее растворитель) и поливинилпирролидон в массовом соотношении от 1:0,5 до 1:20. Другой предпочтительный вариант осуществления включает гидроксипропилцеллюлозу в качестве агента матричного образователя. Вариант осуществления, представляющий особенный интерес, включает соединение формулы I(рассчитано как основание, не содержащее растворитель) и гидроксипропилцелюлозу в массовом соотношении от 1:0,5 до 1:20. Другой аспект изобретения, представляющий особенный интерес, представлен твердыми дисперсиями, включающими в качестве носителя или разрыхлителя натрий кроскармеллозу, натрий крахмалгликолят, кросповидон, гидроксипропилцеллюлозу с низким уровнем замещения (L-HPC), крахмал, микрокристаллическую целлюлозу или их комбинацию. В предпочтительном варианте осуществления твердая дисперсия включает поливинилпирролидон и натрийкроскармеллозу. В другом предпочтительном варианте осуществления твердая дисперсия включает поливинилпирролидон и натрийкрахмалгликолят. В другом предпочтительном варианте осуществления твердая дисперсия включает поливинилпирролидон, натрийкроскрамеллозу и микрокристаллическую целлюлозу. В другом предпочтительном варианте осуществления твердая дисперсия включает гидроксипропилцеллюлозу и натрийкроскармеллозу. В еще одном предпочтительном варианте осуществления твердая дисперсия включает гидроксипропилцеллюлозу и по меньшей мере один наполнитель, который представляет собой сахар, сахароспирт, циклодекстрин. Твердую дисперсию, соответствующую изобретению, получают согласно способам, известным в области изготовления твердых дисперсий, таким как технология размягчения/плавления, экструзия горячего расплава, покрытие горячим расплавом, приллирование, замораживание, выпаривание растворителя(например, сублимационная сушка, распылительная сушка, вакуумная сушка, наслаивание порошков,гранул или пеллет и грануляция в псевдоожиженном слое), соосаждение, метод суперкритических жидкостей и метод электростатического формования. Методы экструзии горячего расплава или выпаривания растворителя являются предпочтительными процессами в плане получения составов твердых дисперсий, соответствующих данному изобретению. Растворителем, подходящим для изготовления твердых дисперсий с помощью процессов выпаривания растворителя, таких как распылительная сушка, наслаивание и грануляция в псевдоожиженном слое,может быть любое соединение, в котором можно растворить соединение формулы I. Предпочтительные растворители включают спирты (например, метанол, этанол, н-пропанол, изопропанол и бутанол), кетоны (например, ацетон, метилэтилкетон и метилизобутилкетон), сложные эфиры (например, этилацетат и пропилацетат) и различные другие растворители, такие как ацетонитрил, метиленхлорид, хлороформ,гексан, толуол, тетрагидрофуран, циклические эфиры и 1,1,1-трихлорэтан. Можно также использовать растворители с более низкой летучестью, такие как диметилацетамид или диметилсульфоксид. Кроме того, могут быть использованы смеси растворителей, такие как 20% этанола и 80% ацетона, а также смеси с водой, пока лекарственный препарат и (при необходимости) агент матричного образователя достаточно растворимы, чтобы сделать процесс практически осуществимым. В предпочтительном варианте осуществления растворитель, использованный для изготовления твердой дисперсии, включает метанол, этанол, н-пропанол, изопопанол или ацетон. В предпочтительном варианте осуществления смесь этанола и ацетона используют в качестве растворителя для получения твердой дисперсии. Аспектом изобретения, представляющим особый интерес, является композиция, в которой твердая дисперсия в значительной степени однородна. Аспектом изобретения, представляющим особый интерес, является фармацевтическая композиция,в которой соединение формулы I в значительной мере аморфно. Данная фармацевтическая композиция будет использована для достижения желательного фармако-3 010832 логического эффекта при пероральном введении нуждающемуся в этом пациенту и будет иметь преимущества относительно обычного препарата в плане высвобождения лекарственного препарата, биодоступности, вариабельности среди пациентов и/или эффективности у млекопитающих. Пациент для целей данного изобретения является млекопитающим, включая человека, нуждающегося в лечении определенного состояния или заболевания, в том числе в профилактическом лечении. Для перорального применения твердая дисперсия, описанная в данном контексте, может быть получена в виде твердых или жидких препаратов, таких как порошок, гранулы, пеллеты, таблетки, капсулы,драже, жевательные таблетки, шипучие таблетки, распадающиеся таблетки, пастилки, лепешки, леденцы,растворы, суспензии или эмульсии, и может быть приготовлена согласно методам, известным в области изготовления фармацевтических композиций. Для данной цели твердая дисперсия может быть смешана с принятыми наполнителями, например связующими агентами, инертными наполнителями, смазывающими веществами, разрыхлителями, растворителями, поверхностно-активными веществами, эмульгаторами, сгустителями и стабилизаторами, скользящими агентами, покрывающими материалами, а также подсластителями, вкусовыми добавками и красителями. Считают, что компетентный специалист в данной области, используя предшествующую информацию, может применить настоящее изобретение в самой полной мере. Пероральный препарат соединения формулы I приемлем для широкого интервала доз, таких как суточная доза 1, 10, 100 мг или даже 1 г и выше. Это можно было бы осуществить, например, путем модификации состава и размера таблетки или капсулы и/или посредством введения нуждающемуся в этом пациенту множества таблеток или капсул в день. Альтернативно препарат в виде твердой дисперсии можно дозировать также в таких формах, как порошки, гранулы, жевательные, шипучие или распадающиеся таблетки, или путем диспергирования любого адекватного твердого препарата в подходящей жидкости перед приемом, например, если оптимальная схема дозирования более не согласуется с возможным размером таблетки или капсулы. Способ лечения гиперпролиферативных процессов Настоящее изобретение относится также к способу применения новой пероральной фармацевтической композиции соединения формулы I для лечения гиперпролиферативных заболеваний, в том числе рака, у млекопитающих. Данный способ заключается во введении фармацевтической композиции в форме твердой дисперсии нуждающемуся в этом млекопитающему, включая человека, в количестве, которое эффективно для лечения процесса. Термин "гиперпролиферативные процессы" и/или "рак" относятся не только к солидным опухолям, таким как рак молочной железы, дыхательных путей, головного мозга,половых органов, пищеварительного тракта, мочевых путей, глаза, печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы и их отдаленным метастазам, но включают также лимфомы,саркомы и лейкозы. Примеры рака молочной железы включают, но без ограничения перечисленным, инвазивную карциному протоков, инвазивную лобулярную карциному, карциному протоков in situ и лобулярную карциному in situ. Примеры рака дыхательных путей включают, но без ограничения перечисленным, мелкоклеточную и немелкоклеточную карциному легкого, а также бронхиальную аденому и плевропульмонарную бластому. Примеры рака головного мозга включают, но без ограничения перечисленным, глиому ствола головного мозга и гипоталамуса, мозжечковую и церебральную астроцитому, медуллобластому, эпендимому, а также нейроэктодермальную и пинеальную опухоль. Опухоли мужских половых органов включают, но без ограничения перечисленным, рак простаты и яичка. Опухоли женских половых органов включают, но без ограничения перечисленным, рак эндометрия, шейки матки, яичника, вагины и вульвы, а также саркому матки. Опухоли пищеварительного тракта включают, но без ограничения перечисленным, рак ануса, толстой кишки, колоректальный рак, рак пищевода, желчного пузыря, желудка, поджелудочной железы,прямой кишки, тонкой кишки и слюнных желез. Опухоли мочевых путей включают, но без ограничения перечисленным, рак мочевого пузыря, полового члена, почки, почечной лоханки, мочеточника и мочеиспускательного канала. Рак глаза включает, но без ограничения перечисленным, внутриглазную меланому и ретинобластому. Примеры рака печени включают, но без ограничения перечисленным, гепатоцеллюларную карциному (карциномы клеток печени с или без фиброламелларного варианта), холангиокарциному (карциному внутрипеченочных желчных протоков) и смешанную гепатоцеллюларную холангиокарциному. Рак кожи включает, но без ограничения перечисленным, карциному сквамозных клеток, саркому Капоши, злокачественную меланому, рак кожных клеток Меркеля и рак кожи, отличный от меланомы. Рак головы и шеи включают, но без ограничения перечисленным, рак гортани, гортанной части глотки, носоглотки, ротовой части глотки и рак губы и полости рта. Лимфомы включают, но без ограничения перечисленным, лимфому, связанную со СПИДом, лимфому не-Ходжкина, лимфому кожных Т-клеток, болезнь Ходжкина и лимфому центральной нервной системы.-4 010832 Саркомы включают, но без ограничения перечисленным, саркому мягких тканей, фибросаркому,остеосаркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому. Лейкозы включают, но без ограничения перечисленным, острый миелоидный лейкоз, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз и лейкоз ворсистых клеток. Данные процессы хорошо охарактеризованы у человека, но встречаются также с близкой этиологией у других млекопитающих, таких как животные из семейств псовых и кошачьих, и их можно лечить введением фармацевтических композиций, соответствующих настоящему изобретению. Общее количество активного ингредиента (соединения формулы I), предназначенное для перорального введения при использовании фармацевтической композиции, соответствующей настоящему изобретению, будет, как правило, находиться в интервале от приблизительно 0,01 до приблизительно 50 мг/кг массы тела/сутки. Основываясь на обычных лабораторных методиках, принятых для оценки соединений,используемых для лечения гиперпролиферативных процессов, с помощью тестов на токсичность и обычных фармакологических анализов для определения лечения определенных выше состояний у млекопитающих и путем сравнения данных результатов с результатами, полученными для известных лекарственных средств, которые используют для лечения данных состояний, компетентные специалисты в данной области могут легко установить эффективную дозу фармацевтических композиций, соответствующих данному изобретению. Количество введенного активного ингредиента может широко варьировать в соответствии с такими факторами, как конкретное соединение и используемая унифицированная доза, способ и время введения, период лечения, пол, возраст и общее состояние проходящего лечение пациента, природа и степень развития состояния, которое лечат, скорость метаболизма и выведения лекарственного препарата, возможные комбинации лекарственных препаратов и взаимодействия между лекарственными препаратами и т.п. Фармацевтические композиции, соответствующие данному изобретению, можно вводить как монотерапевтический агент или в комбинации с одним или более других терапевтических препаратов, когда комбинация не вызывает неприемлемых вредных эффектов. Например, их можно комбинировать с цитотоксическими агентами, ингибиторами сигнальной трансдукции или другими противораковыми агентами или терапевтическими препаратами, а также их смесями и комбинациями. В одном варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, могут быть скомбинированы с цитотоксическими противораковыми агентами. Примеры данных агентов можно найти в 11th Edition of the Merck Index (Каталог Merck, 11 изд.) (1996) Данные агенты включают, без ограничения, перечисленным, аспарагиназу, блеомицин, карбоплатин, кармустин,хлорамбуцил, цисплатин, каласпаз, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, доксорубицин (адриамицин), эпирубицин, этопозид, 5-фторурацил, гексаметилмеламин, гидроксимочевину, ифосфамид, иринотекан, лейковорин, ломустин, мехлорэтамин, 6-меркаптопурин, месну, метотрексат, митомицин С, митоксантрон, преднизолон, преднизон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тиогуанин, топотекан, винбластин, винкристин и виндезин. Другие цитотоксические лекарственные препараты, пригодные для применения с фармацевтическими композициями, соответствующими изобретению, включают, но без ограничения перечисленным,те соединения, которые признаны как предназначенные для применения при лечении опухолевых заболеваний в справочнике Goodman и Gilman The Pharmacological Basis of Therapeutics (Фармакологическая основа терапевтических препаратов) (9 изд., 1996, McGraw-Hill). Данные агенты включают, но без ограничения перечисленным, аминоглютетимид, L-аспарагиназу, азатиоприн, 5-азацитидин, кладрибин, бусульфан, диэтилстилбестрол, 2'2'-дифтордезоксицитидин, доцетаксел, эритрогидроксинониладенин, этинилэстрадиол, 5-фтордезоксиуридинмонофосфат, флударабинфосфат, флуоксиместрон, флутамид, гидроксипрогестеронкапроат, идарубицин, интерферон, медроксипрогестеронацетат, мегестролацетат, мелфалан, митотан, паклитаксел, пентостатин, N-фосфоноацетил-L-аспартат (PALA), пликамицин, семустин,тенипозид, тестостеронпропионат, тиотепа, триметилмеланин, уридин и винорелбин. Другие цитотоксические противораковые агенты, пригодные для применения в комбинации с композициями, соответствующими изобретению, также включают недавно разработанные цитотоксические агенты, такие как оксалиплатин, гемцитабин, капецитабин, эпотилон и его природные и синтетические производные, темозоломид (см. статью Quinn et al., J Clin Oncology 2003, 21 (4), 646-651), тоситумомаб(Bexxar), трабедектин (см. статью Vidal et al., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3181) и ингибиторы кинезина веретенообразного белка Еg5 (см. статью Wood et al.,Curr Opin Pharmacol 2001, 1, 370-377). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с другими ингибиторами сигнальной трансдукции. Особый интерес представляют ингибиторы сигнальной трансдукции, которые направлены на семейство EGFR (рецепторов эпидермального фактора роста), например EGFR, HER-2 и HER-4 (см. статьи Raymond et al., Drugs 2000, 60 (Suppl. 1), 15-23, Harari et al., Oncogene 2000, 19 (53), 6102-6114) и их соответствующие лиганды. Примеры данных агентов включают, но без ограничения перечисленным, терапевтические препараты на основе антител, такие как Герцептин (трастуцумаб), Эрбитакс (цетуксимаб) и пертуцумаб. Примеры дан-5 010832 ных терапевтических препаратов также включают, но без ограничения перечисленным, маленькие молекулы-ингибиторы киназы, такие как ZD-1839/Iressa (см. статью Baselga et al., Drugs 2000, 60(Suppl. 1), 3340), OSI-774Tarceva (см. статью Pollack et al. J. Pharm. Exp. Ther. 1999, 291(2), 739-748), Cl-1033 (см. статью Bridges, Curr. Med. Chem. 1999, 6, 825-843), GW-2016 (см. статью Lackey et al, 92nd AACR Meeting,New Orleans, 24-28 марта, 2001, реферат 4582), CP-724714 (см. статью Jani et al., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3122), AEE-78S (см. статью Baselga et al., Proceedingsof the American Society for Clinical Oncology 2005, 24, реферат 3028), HKI-272 (см. статью Rabindran et al.,Cancer Res. 2004, 64, 3958-3965) и ЕКВ-569 (см. статью Greenberger et al., 11th NCl -EORTC-AACR Symposium on New Drugs in Cancer Therapy, Amsterdam, 7-10 ноября, 2000, реферат 388). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с другими ингибиторами сигнальной трансдукции, направленными на рецепторные киназы семейств расщепляющего домена киназ (VEGFR, FGFR, PDGFR, flt-3, c-kit, c-fms и т.п.) и их соответствующие лиганды. Данные агенты включают, но без ограничения перечисленным,антитела, такие как Авастин (бевасицумаб). Данные агенты включают также, но без ограничения перечисленным, маленькие молекулы-ингибиторы, такие как STI-571/Gleevec (см. статью Zvelebil, Curr. Opin.American Association of Cancer Research 2005, 46, реферат 676) и AZD-2171 (см. статью Hennequin et al.,Proceedings of the American Association of Cancer Research 2004, 45, реферат 4539). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с ингибиторами киназ aurora (см. статью Mortlock et al., Curr. TopicsMed. Chem. 2005, 5, 199). Они включают без ограничения перечисленным VX-680 (см. статью Harringtonet al., Nature Med. 2004, 10, 262) и РНА-680632 (см. статью Fancelli et al., Proceedings of the American Association of Cancer Research 2005, 46, реферат LB-113). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с ингибиторами bcr-abl и/или src. Они включают без ограничения перечисленным AZD-0530 (см. статью Gallagher et al., Proceedings of the American Association of CancerResearch 2005, 46, реферат 3972), AMN-107 и BMS-354825 (см. статью O'Hare et al., Cancer Res. 2005,65(11), 4500). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с ингибиторами пути трансдукции Raf/MEK/ERK (см. статьюSci. 2001, 114, 2903-2910). Они включают без ограничения перечисленным PD-325901 (см. статью SeboltLeopold et al., Proceedings of the American Association of Cancer Research 2004, 45, реферат 4003) и ARRY142886 (см. статью Wallace et al., Proceedings of the American Association of Cancer Research 2004, 45, реферат 3891). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с ингибиторами гистондеацетилазы. Примеры данных агентов включают без ограничения перечисленным субероиланилидгидроксамовую кислоту (SAHA), LAQ-824Clinical Oncology 2004, 23, реферат 3028). В другом варианте осуществления фармацевтические композиции, соответствующие настоящему изобретению, можно комбинировать с другими противораковыми агентами, такими как ингибиторы протеасом и ингибиторы m-TOR. Они включают без ограничения перечисленным бортецомиб (см. статью Маскау et al., Proceedings of the American Society for Clinical Oncology 2004, 23, Реферат 3109) и CCl-779(см. статью Wu et al., Proceedings of the American Association of Cancer Research 2004, 45, реферат 3849). Как правило, использование цитотоксических и/или цитостатических противораковых агентов в комбинации с фармацевтическими композициями, соответствующими настоящему изобретению, служит для(1) достижения повышенной эффективности в плане снижения роста опухоли или даже устранения-6 010832 опухоли по сравнению с введением любого из агентов в виде монотерапии,(2) обеспечения введения меньших количеств применяемых агентов,(3) осуществления протокола химиотерапевтического лечения, которое хорошо переносится пациентом с меньшими вредными фармакологическими осложнениями, чем наблюдают с химиотерапевтическими препаратами на основе одного агента и рядом других комбинированных терапевтических препаратов,(4) обеспечения лечения более широкого спектра различных типов рака у млекопитающих, особенно у человека,(5) получения более высокого уровня ответа у проходящих лечение пациентов,(6) получения более длительной продолжительности жизни у проходящих лечение пациентов по сравнению с обычными методами химиотерапии,(7) получения более длительного периода развития опухоли и/или(8) достижения результатов по эффективности и переносимости, по меньшей мере, настолько же хороших, как получаемые при монотерапевтическом использовании агентов сравнительно с известными примерами, когда комбинации других противораковых агентов дают антагонистические эффекты. Полагают, что компетентный специалист в данной области, используя предшествующую информацию и информацию, доступную в области техники, может применить настоящее изобретение в самой полной мере. Обычному специалисту в данной области будет очевидно, что в данном изобретении могут быть сделаны изменения и модификации, не выходящие из сущности и объема изобретения, как оно представлено в данном контексте. Все выше- и нижеприведенные публикации, заявки и патенты, включены в данном контексте в виде ссылки. Синтетическое получение соединения, используемого в данном изобретении, описано в примере 1. Репрезентативные соли соединения, представленного в примере 1, описаны в примерах 2, 3 и 4. Новые составы твердых дисперсий соединения формулы I описаны в примерах 5-20. Примеры будут служить для дальнейшей иллюстрации изобретения без его ограничения. Примеры В данном описании используют следующие сокращенные названия: ВЭЖХ - жидкостная хроматография высокого давления (высокоэффективная жидкостная хроматография),ЖХ-МС - масс-спектроскопия, сопряженная с жидкостной хроматографией,ЖХВУ - время удерживания при жидкостной хроматографии,ТП - температура плавления,ЯМР - спектроскопия ядерного резонанса,ТСХ - тонкослойная хроматография,ВУ - время удержания,ЭС - электроспрей,ВРМС - масс-спектроскопия высокого разрешения. Получение 4-амино-3-фторфенола В сухую колбу, продутую аргоном, добавляют 10% Pd/C (80 мг), а затем 3-фтор-4-нитрофенол (1,2 г, 7,64 ммоль) в виде раствора в этилацетате (40 мл). Смесь перемешивают в атмосфере Н 2 в течение 4 ч. Смесь фильтруют через слой целита и выпаривают растворитель при пониженном давлении, получая целевой продукт в виде твердого вещества желто-коричневого цвета (940 мг, 7,39 ммоль, выход 97%),Данные 1 Н ЯМР-спектроскопии (DMSO-d6) 4,38 (s, 2H), 6,29-6,35 (m, 1H), 6,41 (dd, J=2,5, 12,7, 1 Н), 6,526,62 (m, 1H), 8,76 (s, 1H). Получение метиламида 4-(4-амино-3-фторфенокси)пиридин-2-карбоновой кислоты-7 010832 цвета дают перемешиваться при 0 С в течение 25 мин. К смеси добавляют 4-хлор-N-метил-2 пиридинкарбоксамид (516 мг, 3,0 ммоль) в виде раствора в диметилацетамиде (4 мл). Реакционную смесь нагревают при 100 С в течение 16 ч. Смесь охлаждают до комнатной температуры, гасят Н 2 О (20 мл) и экстрагируют этилацетатом (440 мл). Объединенные органические фазы промывают Н 2 О (230 мл),сушат (MgSO4) и упаривают, получая масло красно-коричневого цвета. Данные 1 Н ЯМР-спектроскопии указывают на присутствие остаточного количества диметилацетамида, поэтому масло вводят в диэтиловый эфир (50 мл) и дополнительно промывают солевым раствором (5 ч 30 мл). Органический слой сушат(MgSO4) и концентрируют, получая 950 мг целевого продукта в виде твердого вещества краснокоричневого цвета, которое используют на следующей стадии без очистки. Пример 1. Получение метиламида 44-[3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты К раствору метиламида 4-(4-амино-3-фторфенокси)пиридин-2-карбоновой кислоты (177 мг, 0,68 ммоль) в толуоле (3 мл) добавляют 4-хлор-3-(трифторметил)фенилизоцианат (150 мг, 0,68 ммоль). Смесь перемешивают при комнатной температуре в течение 72 ч. Реакционную смесь концентрируют при пониженном давлении и остаток растирают с диэтиловым эфиром. Полученное в результате твердое вещество собирают фильтрованием и сушат в вакууме в течение 4 часов, получая заявленное соединение (155 мг, 0,32 ммоль, выход 47%). Данные 1 Н ЯМР-спектроскопии (DMSO-d6) 2,78 (d, J=4,9, 3 Н), 7,03-7,08 (m, 1 Н), 7,16 (dd, J=2,6, 5,6,1H), 7,32 (dd, J=2,7, 11,6, 1H), 7,39 (d, J=2,5, 1H), 7,60 (s, 2H), 8,07-8,18 (m, 2H), 8,50 (d, J=5,7, 1H), 8,72 (s,1H), 8,74-8,80 (m, 1H), 9,50 (s, 1H), MC (ВЭЖХ/ЭС) 483,06 m/z= (M + 1). Способ получения 4-хлор-N-метил-2-пиридинкарбоксамида описан в статье Bankston et al. "A Scaleable Synthesis of BAY 43-9006: A Potent Rat Kinase Inhibitor for the Treatment of Cancer" (Масштабируемый синтез BAY 43-9006 - сильного ингибитора киназы Raf для лечения рака) Org. Proc. Res. 2002, 6(6),777-781. Пример 2. Получение метиламидгидрохлорида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты Соединение, полученное в примере 1 в виде свободного основания (2,0 г), растворяют в безводном тетрагидрофуране (15 мл) и добавляют 4 М HCl/диоксан (в избытке). Затем раствор концентрируют в вакууме, получая 2,32 г твердого вещества не совсем белого цвета. Неочищенную соль растворяют в горячем этаноле (125 мл), добавляют активированный уголь и нагревают смесь с обратным холодильником в течение 15 мин. Горячую суспензию фильтруют через слой целита 521 и дают охладиться до комнатной температуры. Колбу помещают в замораживатель на ночь. Кристаллическое твердое вещество собирают вакуумной фильтрацией, промывают этанолом, затем гексаном и сушат на воздухе. Маточные растворы концентрируют и дают кристаллизоваться (в замораживателе) в течение ночи. Собирают вторую партию твердого вещества и объединяют с первой партией. Бесцветную соль сушат в вакуумном сушильном шкафу при 60 С в течение двух суток. Выход полученной соли хлористо-водородной кислоты составляет 1,72 г (79%). Температура плавления 215 С Элементный анализ: Пример 3. Получение метиламидмезилата 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты Соединение, полученное в примере 1 в виде свободного основания (2,25 г), растворяют в этаноле(100 мл) и добавляют исходный раствор метансульфоновой кислоты (в избытке). Затем раствор концентрируют в вакууме, получая масло желтого цвета. Добавляют этанол и повторяют концентрирование,-8 010832 получая 2,41 г твердого вещества не совсем белого цвета. Неочищенную соль растворяют в горячем этаноле (125 мл) и затем медленно охлаждают для кристаллизации. После достижения комнатной температуры колбу помещают в замораживатель на ночь. Бесцветный кристаллический материал собирают фильтрованием в вакууме, осадок на фильтре промывают этанолом, затем гексаном и сушат на воздухе,получая 2,05 г материала, который сушат в вакуумном сушильном шкафу при 60 С в течение ночи. Температура плавления 231 С. Элементный анализ: Пример 4. Получение метиламидфенилсульфоната 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты Соединение, полученное в примере 1 в виде свободного основания (2,25 г), суспендируют в этаноле(50 мл) и добавляют бензолсульфоновую кислоту (0,737 г) в этаноле (50 мл). Смесь нагревают при сильном перемешивании. Весь твердый материал растворяют, чтобы получить раствор красноватого цвета. Раствору дают охладиться до комнатной температуры и наносят царапины на колбу. Образование кристаллов происходит медленно, обнаруживают несколько затравочных кристаллов, добавляют в раствор и помещают в замораживатель на ночь. В колбе образуется твердое вещество серовато-желто-коричневого цвета, материал разбивают на более мелкие части и собирают фильтрованием в вакууме. Твердое вещество промывают этанолом, затем гексаном и сушат на воздухе. Масса продукта составляет 2,05 г, выход 69%. Температура плавления 213 С. Элементный анализ: Пример 5. Получение твердой дисперсии 1+4 метиламида 44-(3-(4-хлор-3 трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты с поливинилпирролидоном. В открытом флаконе одну часть соединения, полученного в примере 1 в виде свободного основания, смешивают с четырьмя частями поливинилпирролидона (PVP-25/Kollidon 25) и растворяют в достаточном количестве смеси 1:1 ацетона и этанола до тех пор, пока все порошки не растворятся. Открытый флакон помещают в вакуумный сушильный шкаф, установленный на 40 С, и продолжают сушку в течение по меньшей мере 24-48 ч. Пример 6. Получение твердой дисперсии 1+3 метиламида 44-(3-(4-хлор-3 трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты с поливинилпирролидо-9 010832 ном. Одну часть соединения формулы I в виде основания и три части поливинилпирролидона (PVP25/Kollidon 25) растворяют в 30 частях смеси 80:20 ацетон/этанол (мас./мас.). С помощью роторного вакуумного испарителя удаляют растворитель при 70 С. Сухой остаток удаляют из колбы испарителя и просеивают (630 мкм). Пример 7. Получение твердой дисперсии 1+7 метиламида 44-(3-(4-хлор-3 трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты с поливинилпирролидоном. Одну часть соединения формулы I в виде основания и семь частей PVP-25 растворяют в 30 частях смеси 80:20 ацетон/этанол (мас./мас.). С помощью роторного вакуумного испарителя удаляют растворитель при 70 С. Сухой остаток удаляют из колбы испарителя и просеивают (630 мкм). Пример 8. Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с гидроксипропилцеллюлозой (НРС), полученная экструзией расплава. Две части соединения формулы I в виде основания смешивают с одной частью мальтитола и семью частями НРС-М. Смесь экструдируют, используя лабораторный двухчервячный экструдер при температуре 160-200 С. Экструдированный материал разрезают и затем измельчают с помощью лабораторной ударной мельницы. Полученный порошок можно использовать в том виде, как он получен, или из него далее можно приготовить смесь, например, для препаратов в виде пакетиков, капсул или таблеток. Пример 9. Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с ПВП (поливинилпирролидоном) и натрийкроскармеллозой. Готовят раствор 0,4 кг соединения формулы I в виде основания и 1,2 кг ПВП 25 в смеси с 6,4 кг ацетона и 1,6 кг этанола. Используя вакуумный гранулятор с псевдоожиженным слоем, данный раствор наносят распылением на слой порошка 1,6 кг натрийкроскармеллозы при температуре 60-70 С. После сушки продукт просеивают (1 мм). Гранулят можно использовать в том виде, как он получен, или из него далее можно приготовить смесь, например, для препаратов в виде пакетиков, капсул или таблеток. Пример 10. Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)-уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с ПВП и натрийкрахмалгликолятом. Данный материал получают аналогично тому, как описано в примере 9, за исключением того, что раствор наносят распылением на слой порошка 1,6 кг натрий крахмалгликолята типа A (Explotab). Пример 11: Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с ПРП и натрийкроскармеллозой. Готовят раствор 0,4 кг соединения формулы I в виде основания и 1,6 кг ПВП 25 в смеси с 6,4 кг ацетона и 1,6 кг этанола. Используя вакуумный гранулятор с псевдоожиженным слоем, данный раствор наносят распылением на слой порошка 2 кг натрийкроскармеллозы при температуре 60-70 С. После сушки продукт просеивают (1 мм). Гранулят можно использовать в том виде, как он получен, или из него далее можно приготовить смесь, например, для препаратов в виде пакетиков, капсул или таблеток. Пример 12. Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с ПВП, натрийкроскармеллозой и микрокристаллической целлюлозой. Данный материал получают аналогично тому, как описано в примере 11, за исключением того, что раствор наносят распылением на слой порошка 1 кг натрий кроскармеллозы и 1 кг микрокристаллической целлюлозы. Пример 13. Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с HPC-SL и натрийкроскармеллозой. Готовят раствор 0,4 кг соединения формулы I в виде основания и 1,6 кг HPC-SL B 20 кг ацетона. Используя вакуумный гранулятор с псевдоожиженным слоем, данный раствор наносят распылением на слой порошка 2 кг натрийкроскармеллозы при температуре 60-70 С. После сушки продукт просеивают (1 мм). Гранулят можно использовать в том виде, как он получен, или из него далее можно приготовить смесь, например, для препаратов в виде пакетиков, капсул или таблеток. Пример 14. Твердая дисперсия метиламида 44-(3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты с HPC-L и натрийкроскармеллозой. Готовят раствор 0,4 кг соединения формулы I в виде основания и 1,6 кг HPC-L в 28 кг. Используя вакуумный гранулятор с псевдоожиженным слоем, данный раствор наносят распылением на слой порошка 2 кг натрийкроскармеллозы при температуре 60-70 С. После сушки продукт просеивают (1 мм). Гранулят можно использовать в том виде, как он получен, или из него далее можно приготовить смесь,например, для препаратов в виде пакетиков, капсул или таблеток. Пример 15. Таблетки, включающие твердую дисперсию метиламида 44-(3-(4-хлор-3 трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты. Гранулят, полученный в примере 11, уплотняют роликом и просеивают через сито 3 и 1 мм. Затем- 10010832 уплотненный гранулят смешивают с 0,54 кг натрийкроскармеллозы, 24 г коллоидного безводного оксида кремния и 36 г стеарата магния. Данную готовую для прессования смесь прессуют в ротационном таблеточном прессе для получения таблеток, включающих 20, 50 и 100 мг соединения формулы I. Таблетки могут иметь пленочное покрытие для защиты от света. Пример 16. Таблетки, включающие твердую дисперсию метиламида 44-(3-(4-хлор-3 трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты. Гранулят, полученный в примере 12, уплотняют роликом и просеивают через сито 3 и 1 мм. Затем уплотненный гранулят смешивают с 0,54 кг натрийкроскармеллозы, 24 г коллоидного безводного оксида кремния и 36 г стеарата магния. Данную, готовую для прессования смесь прессуют в ротационном таблеточном прессе для получения таблеток, включающих 20, 50 и 100 мг соединения формулы I. Таблетки могут иметь пленочное покрытие для защиты от света. Пример 17. Таблетки, включающие твердую дисперсию метиламида 44-(3-(4-хлор-3 трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты. Готовят раствор 0,4 кг соединения формулы I в виде основания и 1,2 кг ПВП 25 в смеси с 6,4 кг ацетона и 1,6 кг этанола. Используя вакуумный гранулятор с псевдоожиженным слоем, данный раствор наносят распылением на слой порошка, состоящий из 0,8 кг натрийкроскармеллозы и 0,8 кг микрокристаллической целлюлозы, при температуре 60-70 С. После сушки продукт просеивают (1 мм). Гранулят уплотняют роликом и просеивают через сито 3 и 1 мм. Затем уплотненный гранулят смешивают с 1,34 кг натрийкроскармеллозы, 24 г коллоидного безводного оксида кремния и 36 г стеарата магния. Данную готовую для прессования смесь прессуют в ротационном таблеточном прессе для получения таблеток,включающих 20, 50 и 100 мг соединения формулы I. Таблетки могут иметь пленочное покрытие для защиты от света. Пример 18. Сравнение растворения лекарственного препарата новых фармацевтических композиций и обычных препаратов соединения формулы I. Растворение лекарственных препаратов на основе составов новой твердой дисперсии, описанных в примере 6 и 7, изучают, используя лопастное устройство "Apparatus 2" USP 28-NF 23 (Фармакопеи Соединенных Штатов Америки USP 28 2005) при температуре 370,5 С и скорости работы лопастей 75 об./мин. В качестве растворяющей среды используют 900 мл ацетатного буфера рН 4,5 USP с добавлением 0,1% (мас./об.) лаурилсульфата натрия в качестве поверхностно-активного вещества. В каждую емкость вносят количество твердой дисперсии, эквивалентное 50 мг соединения формулы I в виде основания. В процессе растворения тест-образцы пропускают через фильтр и растворенное количество лекарственных субстанций определяют УФ-спектрометрией. Определенное количество активного агента рассчитывают как % (мас./мас.) от общей дозы (50 мг). На фиг. 1 растворение лекарственного препарата твердой дисперсии, описанной в примере 6 и 7,сравнивают с физической смесью 1+7 соединения формулы I в виде основания с PVP 25, полученной смешиванием активного агента и наполнителя в смесителе Turbula (принятый состав). Фиг. 1 Результаты демонстрируют, что растворение лекарственного препарата физической смеси происходит медленно и неполностью. Вследствие низкой растворимости активного агента растворяется только около 20% дозы, составляющей 50 мг. Однако твердые дисперсии показывают быстрое и почти полное растворение активного агента. Приблизительно 90% дозы, эквивалентной приблизительно 45 мг соединения, соответствующего данному изобретению, растворяется в течение 1 ч, несмотря на низкую раство- 11010832 римость активного агента в данной среде (2,3 мг/900 мл при 37 С). Твердые новые фармацевтические композиции, полученные в примере 6 и 7, которые включают активный агент в существенной мере аморфной форме, показывают явное супернасыщение по сравнению с физической смесью активного агента и PVP, и в течение по меньшей мере 1 ч существенная перекристаллизация не наблюдается. Обусловленная быстрым растворением сильная способность к образованию супернасыщенных растворов и хорошая стабильность супернасыщенного раствора препаратов новой твердой дисперсии, соответствующих данному изобретению, как считают, подходят для достижения улучшенного всасывания, биодоступности и эффективности при лечении гиперпролиферативных процессов, в том числе рака. Пример 19. Сравнение пероральной биодоступности ряда обычных препаратов соединения, представленного в примере 1, и новой фармацевтической композиции, представленной в примере 5. Однократную дозу соединений, представленных в примерах 1, 2, 3, 4 и 5, перорально вводят каждому из подвергнутых голоданию самцов крыс Wistar (массой 220-250 г; в возрасте 6-8 недель). Соединения, полученные в примерах 1-4, вводят перорально через зонд в препарате, описанном в табл. 1. Твердую дисперсию, описанную в примере 5 (1,25 мг лекарственной субстанции в 5 мг PVP-25), вводят в количестве 9 капсул. Вводят по одной капсуле на крысу. Через постоянный катетер в яремной вене отбирают приблизительно 0,4 мл цельной крови через 0,25, 0,5, 1, 2, 4, 7, 24 и 48 ч после введения дозы. Образцы крови центрифугируют (в течение приблизительно 5 мин.) с целью получения плазмы, которую затем переносят в соответствующим образом помеченные флаконы и хранят замороженными (-20 С) до проведения анализа исходного лекарственного препарата. Образцы плазмы анализируют ЖХ/МС/МС на концентрации исходного лекарственного препарата и рассчитывают фармакокинетические параметры, используя Watson LIMS. Таблица 1. Сравнительная пероральная биодоступность у крыс различных препаратов соединения формулы I Площадь под кривой Доза 5 мг/кг фармацевтической композиции, представленной в примере 5, означает 5 мг лекарственной субстанции (соединение, представленное в примере 1)/кг массы тела. Относительные биодоступности у крыс рассчитывают на основании данных по внутривенной болюсной дозе 2 мг/кг для той же линии крыс при использовании раствора активного агента в носителе Cremophor RH40:этанол:вода(12,5:12,5:75). Экспозиция плазмы в воздействующей части суспензии в 0,5% растворе тилозы (9,9% F) отображает кристаллическую микронизированную лекарственную субстанцию со следующими характеристиками: 208 С (начало), 211 С (пик), Н = 91,4 Дж/г. Фармацевтическая композиция на основе твердой дисперсии 1+4 соединения, соответствующего данному изобретению, с поливинилпирролидоном (PVP-25, см. пример 5) обеспечивает улучшенное всасывание и воздействие при пероральном введении у крыс по сравнению с двумя обычными препаратами свободного основания и тремя обычными препаратами фармацевтически приемлемых солей соединения формулы I.- 12010832 Пример 20. Сравнение воздействия новой фармацевтической композиции и обычного препарата соединения формулы I Однократные дозы соединения, соответствующего данному изобретению, в форме обычного и нового препарата вводят перорально с помощью зонда подвергнутым голоданию самцам крыс (приблизительно 250 г, 3 крысы/одну точку времени). Обычный препарат представляет собой суспензию микронизированного соединения формулы I в виде основания в водном 0,5% растворе тилозы. Новый препарат представляет собой гранулят твердой дисперсии, представленный в примере 11,который суспендируют в воде перед введением. Для обычного препарата дозы 2, 10 и 50 мг лекарственной субстанции/кг массы тела используют в объеме 5 мл/кг массы тела. Для новой композиции, представленной в примере 11, включающей 10% соединения, соответствующего данному изобретению, количество 20, 100 и 500 мг гранулята/кг массы тела(эквивалентно дозам 2, 10 и 50 мг/кг, соответственно) вводят в 5 мл воды/кг массы тела. Через постоянный катетер в яремной вене отбирают приблизительно 0,5 мл цельной крови через 0,5, 1, 2, 4, 7, 9 и 24 ч после введения дозы. Образцы крови центрифугируют с целью получения плазмы,которую затем переносят в соответствующим образом помеченные флаконы и хранят замороженными(-15 С) до проведения анализа исходного лекарственного препарата. Образцы плазмы анализируют ЖХ/МСМС на концентрации исходного лекарственного препарата и рассчитывают фармакокинетические параметры. Результаты представляют в табл. 2. Таблица 2. Сравнение воздействия на крыс различных препаратов соединения формулы I- максимальная концентрация Данные по AUC и сmax показывают существенные различия в воздействии активного агента после перорального введения обычного и нового препарата: воздействие, полученное после введения новой композиции, соответствующей данному изобретению, существенно сильнее по сравнению с воздействием обычного суспензионного препарата. При дозах 2 и 10 мг/кг AUC повышается на коэффициент 2,5-3,5 и cmax повышается на коэффициент 2,9, соответственно, 4,8 для новой композиции, соответствующей данному изобретению. В самой высокой дозе 50 мг/кг повышение даже более выражено: оба, как AUC,так и cmax нового препарата в 5 раз выше, чем у обычной суспензии. Это показывает, что даже при введении высоких доз в исследованиях на животных всасывание и воздействие при пероральном введении существенно улучшаются при использовании новых композиций, соответствующих данному изобретению, включающих соединение формулы I в форме твердой дисперсии, по сравнению с обычными препаратами данного лекарственного агента. Основываясь на данных фактах, можно предположить, что данный новый тип фармацевтической композиции, включающий твердую дисперсию соединения формулы I, приведет в результате к повышенному всасыванию и воздействию, пониженной вариабельности среди пациентов и общей повышенной эффективности при лечении гиперпролиферативных процессов, включая рак. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для лечения гиперпролиферативных процессов, содержащая метиламид 4-[4-[3-(4 хлор-3-трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты и/или его соли,гидраты, сольваты в форме твердой дисперсии. 2. Композиция для лечения гиперпролиферативных процессов, содержащая твердую дисперсию,включающую, по меньшей мере, соединение формулы I, и фармацевтически приемлемый матричный образователь 3. Композиция по п.2, в которой матричный образователь включает полимерные наполнители или неполимерные наполнители, способные к растворению или диспергированию соединения формулы I. 4. Композиция по п.2, в которой матричный образователь включает комбинацию полимерных наполнителей и неполимерных наполнителей, способных к растворению или диспергированию соединения формулы I. 5. Композиция по п.2, в которой матричный образователь включает водорастворимый полимер. 6. Композиция по п.5, в которой матричный образователь включает по меньшей мере один полимер,выбранный из группы, включающей поливинилпирролидон, соповидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, полиэтиленгликоль и полиэтиленоксид. 7. Композиция по п.6, в которой агентом матричного образователя является поливинилпирролидон. 8. Композиция по п.7, в которой соотношение масс соединения формулы I, рассчитанного как основание, не содержащее растворитель, и поливинилпирролидона составляет от 1:0,5 до 1:20. 9. Композиция по п.6, в которой агентом матричного образователя является гидроксипропилцеллюлоза. 10. Композиция по п.9, в которой соотношение масс соединения формулы I, рассчитанного как основание, не содержащее растворитель, и гидроксипропилцеллюлозы составляет от 1:0,5 до 1:20. 11. Композиция по любому из пп.1-10, в которой твердая дисперсия включает натрийкроскармеллозу, натрийкрахмалгликолят, кросповидон, гидроксипропилцеллюлозу с низким уровнем замещения,крахмал, микрокристаллическую целлюлозу или их комбинацию. 12. Композиция по п.8, в которой твердая дисперсия включает поливинилпирролидон и натрийкроскармеллозу. 13. Композиция по п.8, в которой твердая дисперсия включает поливинилпирролидон и натрийкрахмалгликолят. 14. Композиция по п.8, в которой твердая дисперсия включает поливинилпирролидон, натрийкроскармеллозу и микрокристаллическую целлюлозу. 15. Композиция по п.10, в которой твердая дисперсия включает гидроксипропилцеллюлозу и натрийкроскармеллозу. 16. Композиция по п.10, в которой твердая дисперсия включает гидроксипропилцеллюлозу и по меньшей мере один наполнитель, который представляет собой сахар, сахароспирт или циклодекстрин. 17. Композиция по любому из пп.1-16, в которой твердая дисперсия является, по существу, однородной. 18. Композиция по любому из пп.1-17, которая содержит соединение формулы I, по существу, в аморфной форме. 19. Композиция по любому из пп.1-18, которая представляет собой фармацевтическую композицию для перорального применения. 20. Композиция по любому из пп.1-19, которая представляет собой фармацевтическую композицию в форме таблетки. 21. Композиция по любому из пп.1-19, которая представляет собой фармацевтическую композицию в форме капсулы. 22. Композиция по любому из пп.1-19, которая представляет собой фармацевтическую композицию в форме порошка, гранулы или саше. 23. Способ получения твердой дисперсии соединения формулы I в котором одновременно обрабатывают соединение формулы I и по меньшей мере один агент матричного образователя методом экструзии горячего расплава, методом покрытия горячим расплавом, методом приллирования, методом замораживания, методом выпаривания растворителя или их комбинациями. 24. Способ по п.23, в котором твердую дисперсию получают обработкой соединения формулы I и по меньшей мере одного агента матричного образователя экструзией горячего расплава. 25. Способ по п.23, в котором твердую дисперсию получают обработкой соединения формулы I и по меньшей мере одного агента матричного образователя методами выпаривания растворителя.- 14010832 26. Способ по п.25, в котором по меньшей мере один растворитель выбран из группы, включающей метанол, этанол, н-пропанол, изопропанол и ацетон. 27. Способ по п.26, в котором в качестве растворителя используют смесь этанола и ацетона. 28. Способ по любому из пп.23-27, в котором твердую дисперсию далее подвергают по меньшей мере одной дополнительной стадии обработки, которая представляет собой помол, просеивание, уплотнение роликом, измельчение, отсеивание, смешивание или их комбинацию. 29. Способ по любому из пп.23-28, который включает дополнительную стадию получения состава твердой дисперсии по меньшей мере с одним фармацевтически приемлемым носителем с образованием смеси и формования указанной смеси в виде таблеток, наполненных капсул или саше. 30. Фармацевтическая композиция, полученная способом по любому из пп.23-29. 31. Способ лечения гиперпролиферативных процессов, отличающийся тем, что млекопитающему, в том числе человеку, вводят фармацевтическую композицию по любому из пп.1-22 и 30 в виде монотерапии или в комбинации с другими методами лечения. 32. Способ лечения рака, отличающийся тем, что млекопитающему, в том числе человеку, вводят фармацевтическую композицию по любому из пп.1-22 и 30 в виде монотерапии или в комбинации с другими методами лечения. 33. Способ лечения рака, отличающийся тем, что млекопитающему, в том числе человеку, вводят фармацевтическую композицию по любому из пп.1-22 и 30 в виде монотерапии или в комбинации с радиотерапией. 34. Способ лечения рака, отличающийся тем, что человеку вводят фармацевтическую композицию по любому из пп.1-22 и 30 в комбинации с цитотоксической терапией. 35. Способ лечения рака, отличающийся тем, что человеку вводят фармацевтическую композицию по любому из пп.1-22 и 30 в комбинации с другой противораковой терапией, направленной на VEGFR,PDGFR, src, abl flt-3, EGFR, HER-2, aurora, raf, MEK, ERK, киназу PI-3, AKT, mTOR или HDAC.
МПК / Метки
МПК: A61K 9/10, A61K 31/17, A61K 47/30, A61P 35/00, A61K 31/4425
Метки: вещества, гиперпролиферативных, композиция, лечения, дисперсии, варианты, получения, твёрдой, процессов, рака, способ
Код ссылки
<a href="https://eas.patents.su/16-10832-kompoziciya-varianty-i-sposob-dlya-lecheniya-giperproliferativnyh-processov-sposob-lecheniya-raka-varianty-i-sposob-polucheniya-tvyordojj-dispersii-veshhestva.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция (варианты) и способ для лечения гиперпролиферативных процессов, способ лечения рака (варианты) и способ получения твёрдой дисперсии вещества</a>