Новые соединения 4-оксо-4, 6, 7, 8-тетрагидропирроло[1, 2-а]пиразин-6-карбоксамида, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 8688
Опубликовано: 29.06.2007
Авторы: Бенуа Ален, Рюпэн Ален, Валле Мари-Одиль, Глоанек Филипп, Де Нантей Гийом, Парментье Жан-Жилль, Вербёрен Тони
Формула / Реферат
1. Соединения 4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида формулы (I)
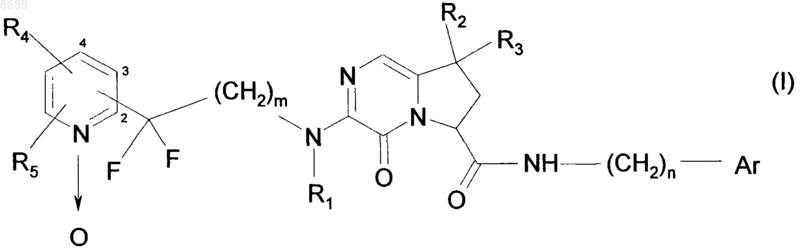
в которой  представляет собой 1-оксидопиридильную группу, замещенную остатком молекулы в любом из положений 2, 3 и 4,
представляет собой 1-оксидопиридильную группу, замещенную остатком молекулы в любом из положений 2, 3 и 4,
m и n каждый равен 1,
R1 представляет собой атом водорода,
R2 и R3, которые могут быть одинаковыми или разными, каждый представляет собой атом, выбранный из водорода и линейного или разветвленного (С1-С6)алкила,
R4 и R5 каждый представляет собой атом водорода или являются смежными и вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо,
Аr представляет собой арильную или гетероарильную группу,
их энантиомеры и соли присоединения с фармацевтически приемлемой кислотой,
где под "арильной группой" подразумевается фенил, необязательно замещенный одной или несколькими одинаковыми или разными группами, выбранными из галогена и карбамоилметокси, необязательно замещенной у атома азота одной группой, выбранной из линейного или разветвленного (С1-С6)алкила и пиридилалкила, в котором алкильная часть является линейной или разветвленной С1-С6,
и под "гетероарильной группой" подразумевается моноциклическая ароматическая группа, которая имеет 5 кольцевых членов и содержит три атома азота или один атом серы, и подразумевается, что этот гетероарил может быть необязательно замещен оксогруппой.
2. Соединение формулы (I) в соответствии с п.1, в котором конфигурация асимметрического центра в альфа-положении относительно амида представляет собой (S)-конфигурацию.
3. Соединение формулы (I) в соответствии с любым из пп.1-2, в котором R2 представляет собой атом водорода, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой.
4. Соединение формулы (I) в соответствии с любым из пп.1-3, в котором R3 представляет собой атом водорода, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой.
5. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R4 и R5 каждый представляет собой атом водорода, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой.
6. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R4 и R5 являются смежными и вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой.
7. Соединение формулы (I) в соответствии с любым из пп.1-6, в котором Аr представляет собой фенильную или тиенильную группу, каждая из которых может быть необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из галогена и карбамоилметокси, необязательно замещенной у атома азота одной группой, выбранной из линейного или разветвленного (С1-С6)алкила и пиридилалкила, в котором алкильная часть является линейной или разветвленной C1-С6, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой.
8. Соединение формулы (I) в соответствии с п.7, в котором Аr представляет собой фенильную группу, незамещенную или замещенную одним или несколькими одинаковыми или разными атомами галогена, выбранными из фтора и хлора, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой.
9. Соединение формулы (I) в соответствии с п.1, выбранное из
3-{[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино}-N-(2-фторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера,
3-{[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино}-N-(2,6-дифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера,
3-{[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино}-N-(2-хлорбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера;
3-{[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино}-N-(2,5-дифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера,
3-{[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино}-N-(2,3-дифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера и
3-{[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино}-N-(2,3,6-трифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера.
10. Способ получения соединений 4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида формулы (I) в соответствии с п.1, в котором соединение формулы (II)
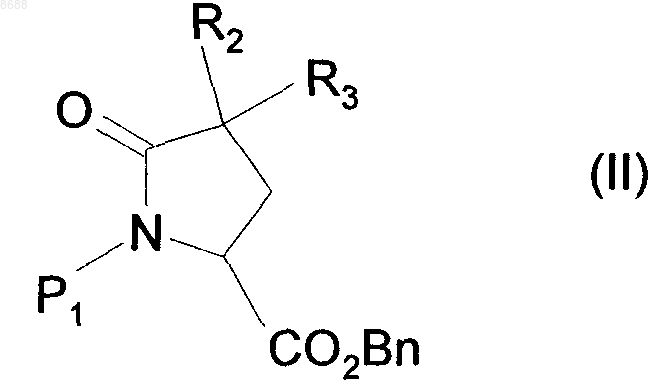
где R2 и R3 имеют значения, указанные для формулы (I),
P1 представляет собой защитную группу для функциональной аминогруппы и
Вn представляет собой бензильную группу,
восстанавливают с использованием восстановителя, получая соединение формулы (III)
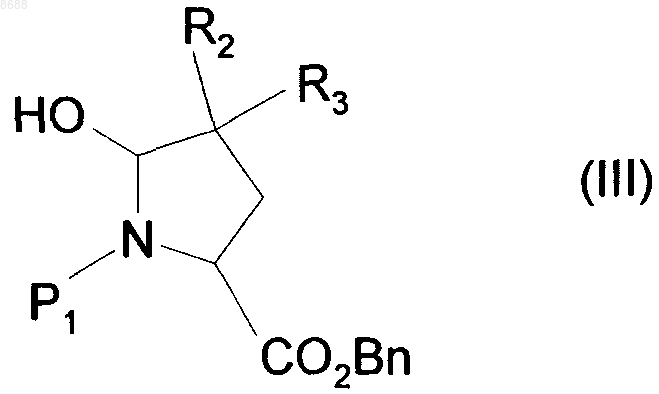
где R2, R3, P1 и Вn имеют значения, указанные выше,
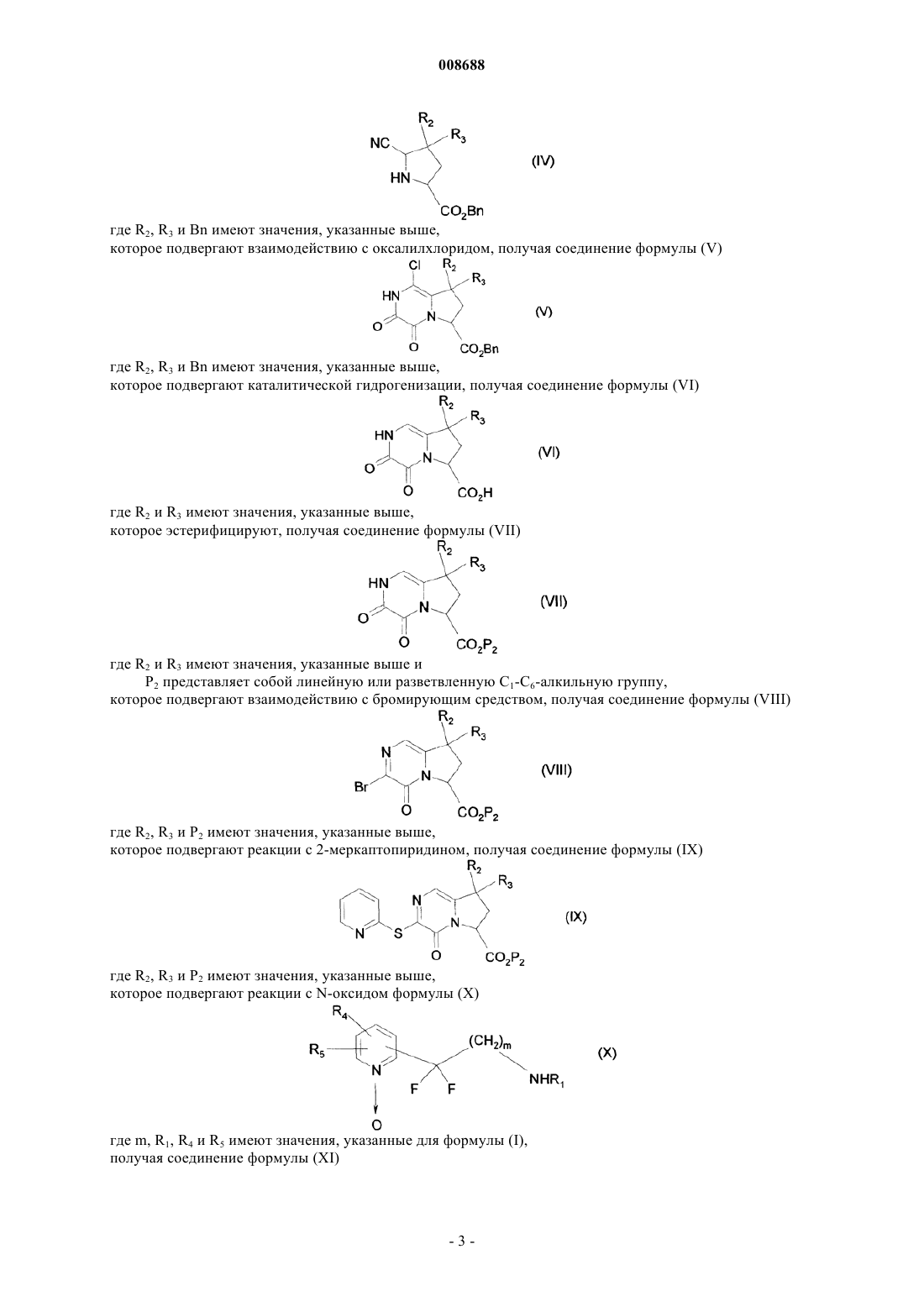
гидроксильную группу которого превращают в метоксигруппу и затем в цианогруппу при помощи стандартных реакций, известных из области органической химии, получая после снятия защиты с функциональной аминогруппы соединение формулы (IV)
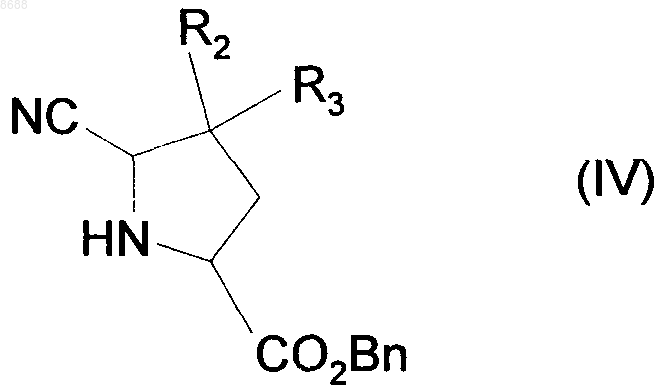
где R2, R3 и Вn имеют значения, указанные выше,
которое подвергают взаимодействию с оксалилхлоридом, получая соединение формулы (V)
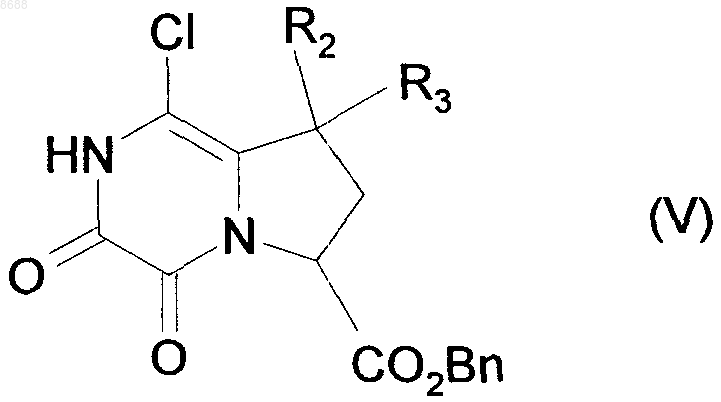
где R2, R3 и Вn имеют значения, указанные выше,
которое подвергают каталитической гидрогенизации, получая соединение формулы (VI)
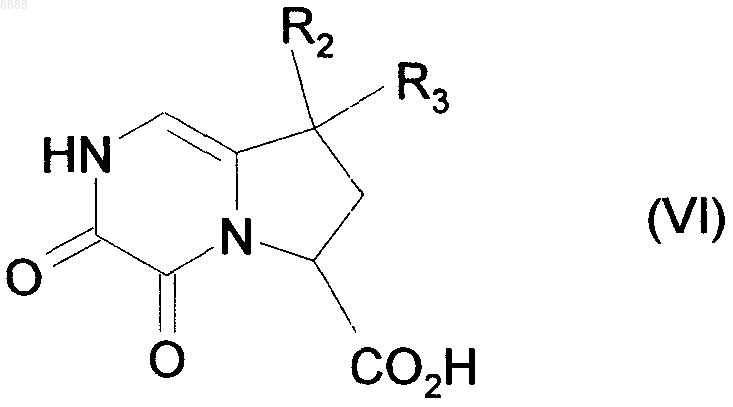
где R2 и R3 имеют значения, указанные выше,
из которого затем получают сложный эфир формулы (VII)
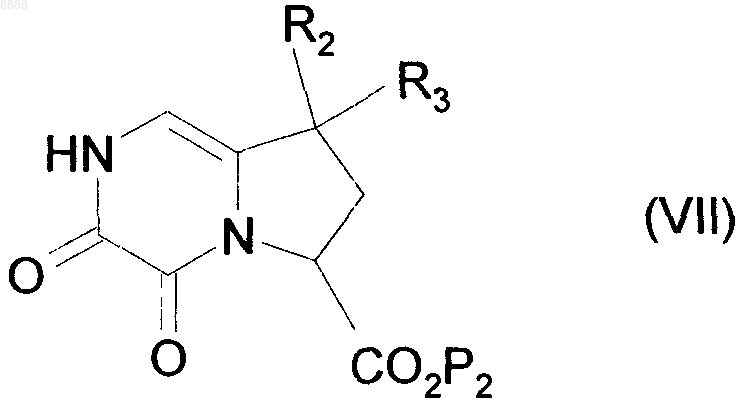
где R2 и R3 имеют значения, указанные выше, и
Р2 представляет собой линейную или разветвленную C1-С6-алкильную группу,
которое подвергают взаимодействию с бромирующим средством, получая соединение формулы (VIII)
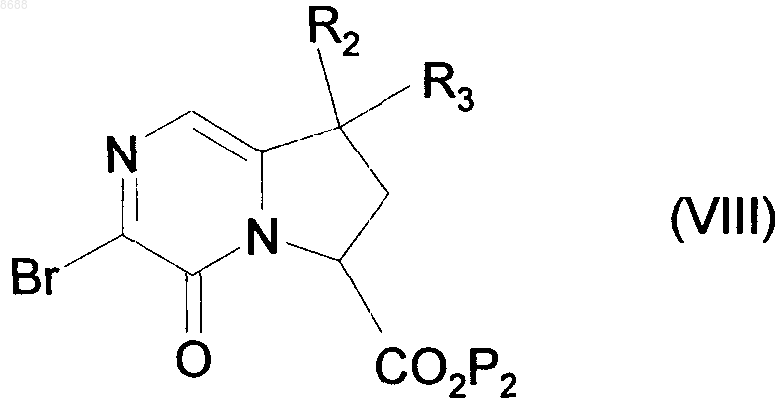
где R2, R3 и Р2 имеют значения, указанные выше,
которое подвергают реакции с 2-меркаптопиридином, получая соединение формулы (IX)
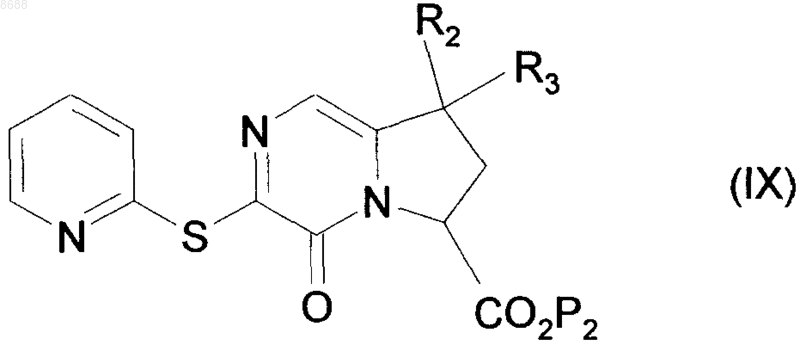
где R2, R3 и Р2 имеют значения, указанные выше,
которое подвергают реакции с N-оксидом формулы (X)

где m, R1, R4 и R5 имеют значения, указанные для формулы (I),
получая соединение формулы (XI)

где m, R1, R2, R3 R4 R5 и Р2 имеют значения, указанные выше,
при снятии защиты с кислотной функциональной группы которого получают соединение формулы (XII)

где m, R1 R2, R3 R4 и R5 имеют значения, указанные выше,
которое подвергают реакции с соединением формулы (XIII)
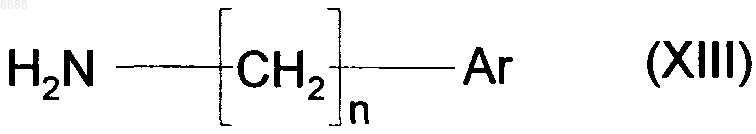
где n и Аr имеют значения, указанные для формулы (I),
в присутствии агента сочетания с получением соединения формулы (I).
11. Фармацевтическая композиция, обладающая ингибирующим действием в отношении тромбина, которая в качестве активного компонента содержит соединение по любому из пп.1-9 в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными носителями.
12. Применение соединений формулы (I) в соответствии с любым из пп.1-9 для приготовления лекарственных средств для применения в качестве ингибиторов тромбина.
13. Применение соединений формулы (I) в соответствии с любым из пп.1-9 для приготовления лекарственных средств для применения для лечения стабильной и нестабильной стенокардии, нарушений тромботического происхождения и/или вызывающих тромботические осложнения, для лечения или предотвращения инфаркта миокарда и венозного или артериального тромбоза, и для лечения осложнений заболеваний сосудов и сердечно-сосудистых заболеваний, таких как атеросклероз, артериит, заболевания вен, и для лечения любых расстройств, связанных с образованием и/или активностью тромбина.
Текст
008688 Настоящее изобретение относится к новым соединениям 4-оксо-4,6,7,8-тетрагидропирроло[1,2-а] пиразин-6-карбоксамида, к способу их получения, к фармацевтическим композициям, которые их содержат, и к их применению в качестве ингибиторов тромбина. Тромбин является ключевым ферментом в свертывании крови и играет решающую роль в нарушениях, таких как венозный и артериальный тромбозы, в особенности в связи с его способностью вызывать аутоамплификацию каскада свертывания крови (F. Toti и др., Sang, Thrombose, Vaisseaux 1992, 4, 483-494 и Т.М. Reilly и др., Blood Coagulation and Fibrinolysis 1992, 3, 513-517). Прямое и специфическое ингибирование тромбина является более эффективным и характеризуется сниженным риском возникновения кровотечений по сравнению с лечением гепарином. В настоящее время известны прямые ингибиторы тромбина, однако, недостатком таких пептидных веществ является их неэффективность при пероральном введении. Пептидомиметические соединения, обладающие антитромботической активностью при пероральном введении, уже описаны в литературе. Они включают, например, соединения бороновой кислоты,описанные в патентных заявках ЕР 293881, ЕР 471651, ЕР 615978 и ЕР 792883, и соединения, описанные в патентных заявках WO 9429336, WO 9523609 и ЕР 1069132. Задачей настоящего изобретения является получение новых ингибиторов тромбина, которые активны при пероральном введении, а также обладают хорошей абсорбцией, эффективностью, селективностью и надежностью при применении. В этом отношении является важным получить соединения, которые обладают минимальным риском взаимодействия с пищевыми продуктами или лекарственными средствами. В частности, настоящее изобретение относится к соединениям формулы (I) представляет собой 1-оксидопиридильную группу, замещенную остатком молекулы в в которой любом из положений 2, 3 и 4,m и n каждый представляет собой целое число 1,R1 представляет собой атом водорода,R2 и R3, которые могут быть одинаковыми или разными, каждый представляет собой атом, выбранный из атомов водорода и линейного или разветвленного (С 1-С 6)алкила,R4 и R5 каждый представляет собой атом водорода или являются смежными и вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо,Ar представляет собой арильную или гетероарильную группу,к их энантиомерам и их солям присоединения с фармацевтически приемлемой кислотой. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновые кислоты, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, камфорную кислоту и т.д. Под "арильной группой" подразумевают фенил (хотя это могут быть и бифенилил или нафтил), который может быть необязательно замещен одной или несколькими одинаковыми или разными группами,выбранными из галогена,карбамоилметоксигруппы, необязательно замещенной у атома азота одной группой, выбранной из линейного или разветвленного (С 1-С 6)алкила и пиридилалкила, в котором алкильная часть является линейной или разветвленной C1-С 6. Под "гетероарильной группой" подразумевают моноциклическую ароматическую группу, которая имеет 5 кольцевых членов и содержит три атома азота и один атом серы, и подразумевают, что этот гетероарил необязательно может быть замещен оксогруппой. Среди гетероарильных групп принципиально могут быть также такие, как тиенил, пиридил, фурил,пирролил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиримидинил, пиразинил, пиридазинил, индолил, бензофурил и хинолил. Как уже указывалось выше, m предпочтительно представляет-1 008688 собой 1, n предпочтительно представляет собой 1, R1, R2 и R3 каждый предпочтительно представляет собой атом водорода. В предпочтительном варианте осуществления изобретение относится к соединениям (I), в которыхR4 и R5 каждый представляет собой атом водорода. В другом предпочтительном варианте осуществления изобретение относится к соединениям (I), в которых R4 и R5 являются смежными и вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо. В самом общем виде группа Аr принципиально может представлять собой фенильную, тиенильную или пиридильную группу, каждая из которых незамещена или замещена одной или несколькими одинаковыми или разными группами, выбранными из галогена,линейного или разветвленного (С 1-С 6)алкила, необязательно замещенного гидрокси, карбокси или карбамоильной группой, где карбамоильная группа сама необязательно замещена одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами,линейного или разветвленного (С 1-С 6)алкокси,гидрокси,тригало-(С 1-С 6)алкила, в котором алкильная часть может быть линейной или разветвленной,аминогруппы, необязательно замещенной одной или двумя линейными или разветвленными (С 1 С 6)алкильными группами,карбоксиметокси,и карбамоилметокси, необязательно замещенного у атома азота одной или двумя группами, выбранными из линейного или разветвленного (C1-С 6)алкил, гидрокси-(С 1-С 6)алкила, где алкильная часть может быть линейной или разветвленной, алкоксиалкила, в котором алкокси и алкильная части каждая представляет собой линейный или разветвленный С 1-С 6, и пиридилалкила, в котором алкильная часть является линейной или разветвленной. Более предпочтительно, Аr представляет собой фенильную группу, незамещенную или замещенную одним или несколькими одинаковыми или разными атомами галогена, выбранными из фтора и хлора. Предпочтительными соединениями формулы (I) являются 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-фторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид и его (6S) энантиомер; 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,6-дифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид и его (6S) энантиомер; 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-хлорбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид и его (6S) энантиомер; 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,5-дифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид и его (6S) энантиомер; 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3-дифторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид и его (6S) энантиомер, и 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3,6-трифторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамид и его (6S) энантиомер. Изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что соединение формулы (II) где R2 и R3 имеют значения, указанные для формулы (I),P1 представляет собой защитную группу для функциональной аминогруппы и Вn представляет собой бензильную группу,восстанавливают, используя восстановитель, получая соединение формулы (III) где R2, R3, P1 и Вn имеют значения, указанные выше,гидрокси-функциональную группу которого превращают в метоксигруппу и затем в цианофунциональную группу при помощи стандартных реакций в области органической химии, получая, после снятия защиты с функциональной аминогруппы, соединение формулы (IV) где R2, R3 и Вn имеют значения, указанные выше,которое подвергают взаимодействию с оксалилхлоридом, получая соединение формулы (V) где R2, R3 и Вn имеют значения, указанные выше,которое подвергают каталитической гидрогенизации, получая соединение формулы (VI) где R2 и R3 имеют значения, указанные выше,которое эстерифицируют, получая соединение формулы (VII) где R2 и R3 имеют значения, указанные выше и Р 2 представляет собой линейную или разветвленную С 1-С 6-алкильную группу,которое подвергают взаимодействию с бромирующим средством, получая соединение формулы (VIII) где R2, R3 и P2 имеют значения, указанные выше,которое подвергают реакции с 2-меркаптопиридином, получая соединение формулы (IX) где m, R1, R4 и R5 имеют значения, указанные для формулы (I),получая соединение формулы (XI) где m, R1, R2, R3, R4, R5 и Р 2 имеют значения, указанные выше,при снятии защиты с кислотной функциональной группы которого получают соединение формулы (XII) где m, R1, R2, R3, R4 и R5 имеют значения, указанные выше, которое подвергают реакции с соединением формулы (XIII) где n и Аr имеют значения, указанные для формулы (I),в присутствии связующего вещества, получая соединение формулы (I). Соли присоединения соединений формулы (I) получают путем взаимодействия соединения с фармацевтически приемлемой кислотой. Соединения формулы (I) имеют асимметрический центр и поэтому способны существовать в виде рацемической смеси или в оптически активной форме. Оптически активные соединения формулы (I) могут быть получены, например, путем применения соответствующего оптически активного соединения формулы (II) в качестве исходного вещества или путем разделения соответствующей рацемической смеси (I), например, при помощи хиральной ВЭЖХ. Предпочтительными соединениями формулы (I) являются те соединения, в которых конфигурация асимметрического центра в альфа-положении относительно амида представляет собой (S)конфигурацию. Соединения формулы (II) получают путем бензилирования соответствующих кислот. Соединения в соответствии с настоящим изобретением обладают чрезвычайно ценными фармакологическими свойствами. Они являются эффективными ингибиторами тромбина, которые активны при пероральном введении. Эти свойства, которые проявляются соединениями, делают их пригодными для лечения стабильной или нестабильной стенокардии, нарушений тромботического происхождения и/или вызывающих тромботические осложнения, для лечения или предотвращения инфаркта миокарда и венозного или артериального тромбоза, и для лечения осложнений заболеваний сосудов и сердечно-сосудистых заболеваний,таких как атеросклероз, артериит, заболевания вен, и для лечения любых расстройств, связанных с образованием и/или активностью тромбина. Они также могут применяться при лечении в сочетании с тромболитическим средством. Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента одно соединение формулы (I) совместно с одним или несколькими подходящими инертными, нетоксичными наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций, суспензии для питья и т.д. Полезная дозировка может адаптироваться в зависимости от природы и тяжести расстройства, пути введения и возраста и веса тела пациента. Доза изменяется от 1 до 500 мг в сутки на одно или несколько введений. Примеры, представленные далее, приведены с целью иллюстрации изобретения. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами. Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (инфракрасный ЯМР, масс-спектрометрия).-4 008688 Пример 1. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-фторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Стадия А. Бензил N-трет-бутоксикарбонил-5-оксопролинат. При 0 С добавляли 11 ммоль диметиламинопиридина и 11 ммоль ди-трет-бутил дикарбоната к 10 ммоль бензил 5-оксопролината (способ получения которого описан Е. Campaigne и др. (J. Heterocycl.Chem. 1975, 12, 391 в растворе дихлорметана. После перемешивания в течение 24 ч при температуре окружающей среды реакционную смесь промывали и затем высушивали и упаривали, получая ожидаемый продукт в виде вязкого масла. Стадия Б. Бензил N-трет-бутоксикарбонил-5-гидроксипролинат. В атмосфере аргона и при -78 С 18 ммоль 1 М раствор гидрида диизобутилалюминия в гексане добавляли к 10 ммоль соединения, полученного на вышеописанной стадии в растворе в тетрагидрофуране. После перемешивания в течение 20 мин при -78 С добавляли насыщенный водный раствор хлорида аммония, затем добавляли водный 10%-ный раствор карбоната натрия. После перемешивания в течение ночи при температуре окружающей среды реакционную смесь фильтровали и фильтрат выпаривали и ресуспендировали в дихлорметане. Органическую фазу промывали, высушивали и затем выпаривали. Остаток очищали путем хроматографии на силикагеле, используя смесь 95/5 дихлорметана/этилацетата в качестве элюента. Ожидаемый продукт получали в виде желтого масла. Стадия В. Бензил N-трет-бутоксикарбонил-5-метоксипролинат. 0,1% раствор пара-толуолсульфокислоты в безводном метаноле (88 мл) добавляли к 10 ммоль соединения, полученного на вышеописанной стадии. После перемешивания в течение получаса добавляли водный 10%-ный раствор карбоната натрия и продукт экстрагировали дихлорметаном. Ожидаемый продукт получали в виде светло-желтого масла. Стадия Г. Гидрохлорид бензил 5-цианопролината. При -40 С и в атмосфере аргона 5 об.% раствор тетрахлорида олова в безводном дихлорметане (7,1 мл), и после этого цианид триметилсилила (206 ммоль), добавляли к 10 ммоль соединения, полученного на вышеописанной стадии. После перемешивания в течение 2 ч при -40 С добавляли водный 10%-ный раствор карбоната натрия, водную фазу экстрагировали дихлорметаном, и органическую фазу промывали, высушивали и затем выпаривали. Полученный остаток очищали путем хроматографии на силикагеле,используя смесь 95/5 дихлорметана/этилацетата в качестве элюента. Полученное желтое масло растворяли в этилацетате и затем пропускали через поток газа НСl в течение 30 мин при 0 С. После перемешивания в течение ночи при температуре окружающей среды образованный осадок отфильтровывали, промывали этилацетатом и высушивали в вакууме, используя эксикатор. Стадия Д. Бензил 1-хлор-3,4-диоксо-2,3,4,6,7,8-гексагидропирроло[1,2-а]пиразин-6-карбоксилат. При 0 С оксалилхлорид (144 мл) добавляли к 200 г соединения, полученного на вышеописанной стадии в растворе в толуоле. Затем смесь доводили до температуры окружающей среды и перемешивали в течение 15 ч, и затем растворитель упаривали. Полученный остаток очищали путем хроматографии на диоксиде кремния, используя смесь 9/1 дихлорметана/метанола в качестве элюента, получая ожидаемый продукт. Стадия Е. 3,4-Диоксо-2,3,4,6,7,8-гексагидропирроло[1,2-а]пиразин-6-карбоновая кислота. 3 г соединения, полученного на вышеописанной стадии, растворяли в 50 мл этанола и затем добавляли 1,43 мл триэтиламина, после этого 0,5 г палладия-на-угле. Затем смесь помещали в атмосферу водорода при температуре окружающей среды и атмосферном давлении в течение 5 ч. После удаления катализатора путем фильтрации растворитель выпаривали, получая ожидаемый продукт. Стадия Ж. Этил 3,4-диоксо-2,3,4,6,7,8-гексагидропирроло[1,2-а]пиразин-6-карбоксилат. 11,83 мл хлорида триметилсилила при 0 С по каплям добавляли к суспензии 1,83 г соединения, полученного на вышеописанной стадии, в 20 мл безводного этанола. Затем реакционную смесь перемешивали при температуре окружающей среды в течение 15 ч. Растворитель выпаривали, и остаток ресуспендировали в дихлорметане. Органическую фазу промывали, высушивали, фильтровали и упаривали, и после этого неочищенный продукт очищали путем хроматографии на диоксиде кремния (элюент: дихлорметан/этанол 95/5) получая ожидаемый продукт. Стадия З. Этил 3-бром-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксилат. 34,7 г двухосновного фосфата натрия (Na2HPO4) в 90 мл дихлорэтана и затем 100 г оксибромида фосфора (РОВr3) в 340 мл дихлорэтана добавляли к 73 г соединения, полученного на вышеописанной стадии, суспендированного в 400 мл дихлорэтана. Затем реакционную смесь нагревали при 50 С в течение 16 ч, после этого охлаждали до 0 С, используя баню с водой и льдом, и добавляли 650 мл 10%-го раствора карбоната натрия. Органическую фазу промывали водой, затем водные фазы объединяли и экстрагировали изопропилацетатом. Объединенные органические фазы концентрировали до 160 мл, и затем добавляли 160 мл изопропилацетата и смесь снова концентрировали до 160 мл. После этого смесь помещали на баню при 50 С и добавляли 250 мл н-гептана в течение 1 ч. Через 60 мин при 50 С полученный осадок отфильтровывали, промывали смесью 1/3 изопропилацетата и н-гептана, и высушивали, получая ожидаемый продукт.-5 008688 Стадия И. Этил 4-оксо-3-(2-пиридилтио)-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксилат. 34,3 г 2-меркаптопиридина добавляли тремя порциями с 20 минутными интервалами к 80,5 г соединения, полученного на вышеописанной стадии, в растворе в 410 мл ацетонитрила. Добавление является экзотермическим и температура реакционной смеси повышается до 35 С. Смесь становилась гетерогенной. После перемешивания в течение 1 ч 45 мин растворитель выпаривали и остаток ресуспендировали в этилацетате и в воде. Органическую фазу промывали, высушивали,фильтровали и упаривали досуха. Полученный остаток очищали на хроматографической колонке (дихлорметан/этанол 98/2, затем 95/5), получая ожидаемый продукт в виде оранжевого масла, которое медленно кристаллизовалось. Стадия К. Этил 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксилат. 2,78 г 2,2-дифтор-2-(1-оксидо-2-пиридил)этанамина и затем 1,5 г хлорида цинка добавляли к 4,6 г соединения, полученного на вышеописанной стадии, суспендированного в 30 мл ацетонитрила. После этого смесь нагревали в колбе с обратным холодильником в течение 15 ч. Реакционная смесь становилась прозрачной. После этого растворитель упаривали и остаток ресуспендировали в дихлорметане. Органическую фазу промывали, высушивали, фильтровали и упаривали, и полученный остаток очищали путем хроматографии на диоксиде кремния (элюент: дихлорметан/изопропанол 9/1), получая ожидаемый продукт. Стадия Л. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоновая кислота. 2 эквивалента 1 н. раствора гидроокиси натрия добавляли к 9 г соединения, полученного на вышеописанной стадии, в растворе в 100 мл диоксана и 20 мл воды. Через 24 ч при температуре окружающей среды смесь подкисляли, используя 2 эквивалента 1 н. соляной кислоты, и после этого реакционную смесь выпаривали. Остаток дважды ресуспендировали в 30 мл толуола и высушивали, получая ожидаемый продукт в виде белого твердого вещества. Стадия М. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-фторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. 3 г соединения, полученного на вышеописанной стадии, подвергали взаимодействию с 1,18 г 2 фторбензиламина в присутствии 3,57 г гексафторфосфата 3-оксида 1-[бис(диметиламино)метилен]-1 Н 1,2,3-триазоло[4,5-b]пиридиния (HATU) и 1,64 мл диизопропилэтиламина в 60 мл диметилформамида. После перемешивания в течение 15 ч при температуре окружающей среды растворитель выпаривали и полученный остаток ресуспендировали в этилацетате и в воде. Органическую фазу промывали, высушивали и затем выпаривали, и остаток очищали путем хроматографии на диоксиде кремния, получая ожидаемый продукт в виде рацемической смеси. Элементный микроанализ:(6R)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-фторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Рацемическую смесь из примера 1 разделяли путем препаративной ВЭЖХ с хиральной фазой (колонка Chiralpak AD, элюент: ацетонитрил/изопропанол/диэтиламин 500/500/1). Первый из полученных таким образом энантиомеров представляет собой ожидаемый продукт. Пример 3.(6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-фторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Рацемическую смесь из примера 1 разделяли путем препаративной ВЭЖХ с хиральной фазой (колонка Chiralpak AD, элюент: ацетонитрил/изопропанол/диэтиламин 500/500/1). Второй из полученных таким образом энантиомеров представляет собой ожидаемый продукт. Коэффициент вращения: D=-116,07 (метанол, 20 С, с=1,4). Пример 4. (6R)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-2-[2-(этиламино)-2-оксоэтокси]бензил-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2-[2-(аминометил)фенокси]-N-этилацетамидом на стадии 1, с последующим разделением полученной таким образом рацемической смеси путем препаративной хиральной ВЭЖХ (колонкаChiralpak AD, элюент: ацетонитрил/изопропанол/диэтиламин 500/500/1). Первый из полученных таким образом энантиомеров представляет собой ожидаемый продукт. Элементный микроанализ:-6 008688 Коэффициент вращения: D=+93,1 (метанол, 20 С, с=0,7). Пример 5. (6S)-3-[2 а-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-2-[2-(этиламино)-2-оксоэтокси]бензил-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт представляет собой второй из энантиомеров, разделенных в примере 4. Коэффициент вращения: D=-98,8 (метанол, 20 С, с=0,8). Пример 6. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,4-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2,4-дифторбензиламином на стадии М. Масс-спектрометрия ESI/ (ацетонитрил/вода): [M+H]+=478,15. Пример 7. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,6-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2,6-дифторбензиламином на стадии М. Точка плавления: 227-228 С. Элементный микроанализ: Пример 8. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-хлорбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2-хлорбензиламином на стадии М. Элементный микроанализ: Пример 9. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(3,4-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиридазин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 3,4-дифторбензиламином на стадии М. Точка плавления: 204 С. Элементный микроанализ: Пример 10. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,5-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2,5-дифторбензиламином на стадии М. Точка плавления: 189 С. Элементный микроанализ: Пример 11. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,6-дихлорбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2,6-дихлорбензиламином на стадии М. Точка плавления: 122 С. Элементный микроанализ:-7 008688 Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2-хлор-6-фторбензиламином на стадии М. Точка плавления: 221 С. Элементный микроанализ: Пример 13. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2,3-дифторбензиламином на стадии М. Точка плавления: 142 С. Элементный микроанализ: Пример 14. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(3,5-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 3,5-дифторбензиламином на стадии М. Точка плавления: 218-219 С. Элементный микроанализ: Пример 15. Гидрохлорид 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-N-[2-(2-оксо 2-[2-(2-пиридил)этил]аминоэтокси)бензил]-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида. Стадия А. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-N-[2-(2-оксо-2-[2-(2 пиридил)этил]аминоэтокси)бензил]-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2-[2-(аминометил)фенокси]-N-[2-(2-пиридил)этил]ацетамидом на стадии М. Стадия Б. Гидрохлорид 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-N-[2-(2-оксо-2[2-(2-пиридил)этил]аминоэтокси)бензил]-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида. Ожидаемый продукт получали путем подкисления соединения, полученного на вышеописанной стадии, при помощи соляной кислоты. Элементный микроанализ: Пример 16. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,6-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси из примера 7 на хиральной ВЭЖХ колонке. Коэффициент вращения: D=-118,46 (метанол, 20 С, с=0,95). Пример 17. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,5-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси из примера 10 на хиральной ВЭЖХ колонке. Коэффициент вращения: D=-89,65 (метанол, 20 С, с=0,57). Пример 18. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-хлор-6-фторбензил)-4 оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси из примера 12 на хиральной ВЭЖХ колонке. Коэффициент вращения: D=-101,49 (метанол, 20 С, с=1,3). Пример 19. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3-дифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид.-8 008688 Ожидаемый продукт получали путем разделения рацемической смеси из примера 13 на хиральной ВЭЖХ колонке. Коэффициент вращения: D=-102,06 (метанол, 20 С, с=0,8). Пример 20. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-хлорбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси из примера 8 на хиральной ВЭЖХ колонке. Коэффициент вращения: D=-105,65 (метанол, 20 С, с=0,85). Пример 21. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3,6-трифторбензил)-4 оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Стадия А. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3,6-трифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 2,3,6-трифторбензиламином на стадии М. Стадия Б. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3,6-трифторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси, полученной на вышеописанной стадии, на хиральной ВЭЖХ колонке. Коэффициент вращения: D=-118,25 (метанол, 20 С, с=1). Пример 22.(6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-бензил-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамид гидрохлорид. Стадия А. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-бензил-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин бензиламином на стадии М. Стадия Б. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-бензил-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси, полученной на вышеописанной стадии, на хиральной ВЭЖХ колонке. Стадия В. Гидрохлорид (6S)-3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-бензил-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида. Ожидаемый продукт получали путем подкисления соединения, полученного на вышеописанной стадии, при помощи соляной кислоты. Элементный микроанализ:(6S)-3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(3 тиенилметил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 22, заменяя бензиламин 3-тиенилметиламином на стадии А. Элементный микроанализ:(6S)-3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2 тиенилметил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 22, заменяя бензиламин 2-тиенилметиламином на стадии А. Элементный микроанализ:-9 008688 Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2,2 дифтор-2-(1-оксидо-2-пиридил)этанамин 2,2-дифтор-2-(1-оксидо-4-пиридил)этанамином на стадии К. Стадия Б.(6S)-3-[2,2-Дифтор-2-(1-оксидо-4-пиридил)этил]амино-N-(2-фторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси, полученной на вышеописанной стадии, на хиральной ВЭЖХ колонке. Элементный микроанализ: Пример 26. (6S)-3-[2,2-Дифтор-2-(1-оксидо-3-пиридил)этил]амино-N-(2-фторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 25, заменяя 2,2 дифтор-2-(1-оксидо-4-пиридил)этанамин 2,2-дифтор-2-(1-оксидо-3-пиридил)этанамином на стадии А. Элементный микроанализ: Пример 27. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-8,8-диметил-N-(2-фторбензил)-4 оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя бензил 5-оксопролинат бензил 4,4-диметил-5-оксо-2-пирролидинкарбоксилатом на стадии А. Пример 28. (6R)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-8,8-диметил-N-(2-фторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Рацемическую смесь из примера 27 разделяли путем препаративной ВЭЖХ с хиральной фазой. Первый из полученных таким образом энантиомеров представляет собой ожидаемый продукт. Элементный микроанализ: Пример 29. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-8,8-диметил-N-(2-фторбензил)-4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Рацемическую смесь из примера 27 разделяли путем препаративной ВЭЖХ с хиральной фазой. Второй из полученных таким образом энантиомеров представляет собой ожидаемый продукт. Элементный микроанализ:(6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-N-[(5-оксо-4,5 дигидро-1H-1,2,4-триазол-3-ил)метил]-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Стадия А. 3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-N-[(5-оксо-4,5-дигидро-1 Н 1,2,4-триазол-3-ил)метил]-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2 фторбензиламин 5-(аминометил)-2,4-дигидро-3H-1,2,4-триазол-3-оном на стадии М. Стадия Б. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-пиридил)этил]амино-4-оксо-N-[(5-оксо-4,5-дигидро 1 Н-1,2,4-триазол-3-ил)метил]-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси, полученной на вышеописанной стадии, на хиральной ВЭЖХ колонке. Элементный микроанализ: Пример 31. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-хинолинил)этил]амино-N-(2-фторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Стадия А. 3-[2,2-Дифтор-2-(1-оксидо-2-хинолинил)этил]амино-N-(2-фторбензил)-4-оксо-4,6,7,8- 10008688 тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали в соответствии с методикой, описанной в примере 1, заменяя 2,2 дифтор-2-(1-оксидо-2-пиридил)этанамин 2,2-дифтор-2-(1-оксидо-2-хинолинил)этанамином на стадии К. Стадия Б. (6S)-3-[2,2-Дифтор-2-(1-оксидо-2-хинолинил)этил]амино-N-(2-фторбензил)-4-оксо 4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамид. Ожидаемый продукт получали путем разделения рацемической смеси, полученной на вышеописанной стадии, на хиральной ВЭЖХ колонке. Элементный микроанализ: Фармакологические исследования соединений по изобретению Пример 32. Ингибирование тромбина и фибринолизирующих сериновых протеаз. Для определения ингибирующей активности продуктов согласно изобретению в условиях in vitro по отношению к тромбину человека (Sigma, специфическая активность 3230 UNIH/мг), очищенный фибриноген человека (4 ммоль, Stago) (Fg) добавляли к определенному количеству тромбина (0,7 нмоль), который предварительно инкубировали с тестируемым ингибитором или без него (20 С, 10 мин). Ингибиторы, ферменты и субстраты разводили в одном и том же буфере (0,01 ммоль фосфатном буфере, рН 7,4, содержащем 0,12 М хлорид натрия и 0,05% бычий сывороточный альбумин) и затем вносили в полистироловый микротитровальный планшет в объеме 50 мкл. Определяли фибрин, который образуется под воздействием тромбина, при помощи спектрофотометра при 405 нм через 10-15 мин взаимодействия при 20 С. В таблице, приведенной ниже, указаны концентрации соединений в нмолях, которые ингибируют на 50% активность фермента (IC50) тромбина по сравнению с контролем без продукта. Полученные результаты свидетельствуют о том, что соединения в соответствии с изобретением являются эффективными ингибиторами действия тромбина человека на фибриноген человека. Таблица Пример 33. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит дозу 10 мг: Соединение из примера 3 10 г Гидроксипропилцеллюлоза 2 г Картофельный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения 4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида формулы (I) представляет собой 1-оксидопиридильную группу, замещенную остатком молекулы в- 11008688 любом из положений 2, 3 и 4,m и n каждый равен 1,R1 представляет собой атом водорода,R2 и R3, которые могут быть одинаковыми или разными, каждый представляет собой атом, выбранный из водорода и линейного или разветвленного (С 1-С 6)алкила,R4 и R5 каждый представляет собой атом водорода или являются смежными и вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо,Аr представляет собой арильную или гетероарильную группу,их энантиомеры и соли присоединения с фармацевтически приемлемой кислотой,где под "арильной группой" подразумевается фенил, необязательно замещенный одной или несколькими одинаковыми или разными группами, выбранными из галогена и карбамоилметокси, необязательно замещенной у атома азота одной группой, выбранной из линейного или разветвленного (С 1-С 6)алкила и пиридилалкила, в котором алкильная часть является линейной или разветвленной С 1-С 6,и под "гетероарильной группой" подразумевается моноциклическая ароматическая группа, которая имеет 5 кольцевых членов и содержит три атома азота или один атом серы, и подразумевается, что этот гетероарил может быть необязательно замещен оксогруппой. 2. Соединение формулы (I) в соответствии с п.1, в котором конфигурация асимметрического центра в альфа-положении относительно амида представляет собой (S)-конфигурацию. 3. Соединение формулы (I) в соответствии с любым из пп.1-2, в котором R2 представляет собой атом водорода, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой. 4. Соединение формулы (I) в соответствии с любым из пп.1-3, в котором R3 представляет собой атом водорода, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой. 5. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R4 и R5 каждый представляет собой атом водорода, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой. 6. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R4 и R5 являются смежными и вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой. 7. Соединение формулы (I) в соответствии с любым из пп.1-6, в котором Аr представляет собой фенильную или тиенильную группу, каждая из которых может быть необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из галогена и карбамоилметокси, необязательно замещенной у атома азота одной группой, выбранной из линейного или разветвленного (С 1 С 6)алкила и пиридилалкила, в котором алкильная часть является линейной или разветвленной C1-С 6, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой. 8. Соединение формулы (I) в соответствии с п.7, в котором Аr представляет собой фенильную группу, незамещенную или замещенную одним или несколькими одинаковыми или разными атомами галогена, выбранными из фтора и хлора, его энантиомеры и соли присоединения с фармацевтически приемлемой кислотой. 9. Соединение формулы (I) в соответствии с п.1, выбранное из 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-фторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера,3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,6-дифторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера,3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2-хлорбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера; 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,5-дифторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера,3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3-дифторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера и 3-[2,2-дифтор-2-(1-оксидо-2-пиридил)этил]амино-N-(2,3,6-трифторбензил)-4-оксо-4,6,7,8 тетрагидропирроло[1,2-а]пиразин-6-карбоксамида и его (6S) энантиомера. 10. Способ получения соединений 4-оксо-4,6,7,8-тетрагидропирроло[1,2-а]пиразин-6-карбоксамида формулы (I) в соответствии с п.1, в котором соединение формулы (II) где R2 и R3 имеют значения, указанные для формулы (I),P1 представляет собой защитную группу для функциональной аминогруппы и Вn представляет собой бензильную группу,- 12008688 восстанавливают с использованием восстановителя, получая соединение формулы (III) где R2, R3, P1 и Вn имеют значения, указанные выше,гидроксильную группу которого превращают в метоксигруппу и затем в цианогруппу при помощи стандартных реакций, известных из области органической химии, получая после снятия защиты с функциональной аминогруппы соединение формулы (IV) где R2, R3 и Вn имеют значения, указанные выше,которое подвергают взаимодействию с оксалилхлоридом, получая соединение формулы (V) где R2, R3 и Вn имеют значения, указанные выше,которое подвергают каталитической гидрогенизации, получая соединение формулы (VI) где R2 и R3 имеют значения, указанные выше,из которого затем получают сложный эфир формулы (VII) где R2 и R3 имеют значения, указанные выше, и Р 2 представляет собой линейную или разветвленную C1-С 6-алкильную группу,которое подвергают взаимодействию с бромирующим средством, получая соединение формулы (VIII) где R2, R3 и Р 2 имеют значения, указанные выше,которое подвергают реакции с 2-меркаптопиридином, получая соединение формулы (IX) где m, R1, R4 и R5 имеют значения, указанные для формулы (I),получая соединение формулы (XI) где m, R1, R2, R3 R4 R5 и Р 2 имеют значения, указанные выше,при снятии защиты с кислотной функциональной группы которого получают соединение формулы (XII) где m, R1 R2, R3 R4 и R5 имеют значения, указанные выше,которое подвергают реакции с соединением формулы (XIII) где n и Аr имеют значения, указанные для формулы (I),в присутствии агента сочетания с получением соединения формулы (I). 11. Фармацевтическая композиция, обладающая ингибирующим действием в отношении тромбина,которая в качестве активного компонента содержит соединение по любому из пп.1-9 в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными носителями. 12. Применение соединений формулы (I) в соответствии с любым из пп.1-9 для приготовления лекарственных средств для применения в качестве ингибиторов тромбина. 13. Применение соединений формулы (I) в соответствии с любым из пп.1-9 для приготовления лекарственных средств для применения для лечения стабильной и нестабильной стенокардии, нарушений тромботического происхождения и/или вызывающих тромботические осложнения, для лечения или предотвращения инфаркта миокарда и венозного или артериального тромбоза, и для лечения осложнений заболеваний сосудов и сердечно-сосудистых заболеваний, таких как атеросклероз, артериит, заболевания вен, и для лечения любых расстройств, связанных с образованием и/или активностью тромбина.
МПК / Метки
МПК: C07D 487/04, A61P 7/02, A61K 31/4985
Метки: способ, 2-а]пиразин-6-карбоксамида, содержат, композиции, которые, новые, фармацевтические, соединения, 4-оксо-4, 8-тетрагидропирроло[1, получения
Код ссылки
<a href="https://eas.patents.su/15-8688-novye-soedineniya-4-okso-4-6-7-8-tetragidropirrolo1-2-apirazin-6-karboksamida-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения 4-оксо-4, 6, 7, 8-тетрагидропирроло[1, 2-а]пиразин-6-карбоксамида, способ их получения и фармацевтические композиции, которые их содержат</a>
Следующий патент: Вихревая топка
Случайный патент: Клапанный узел для открывания и закрывания топливопровода