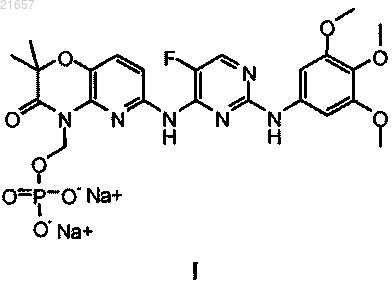
Синтез динатриевой соли n4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-n2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина
Номер патента: 21657
Опубликовано: 31.08.2015
Авторы: Фелфер Ульфрид, Волберг Михаэль, Гизельбрехт Карл-Хайнц
Формула / Реферат
1. Способ получения соединения формулы I
включающий:
а) контактирование кислотного сольвата соединения формулы II
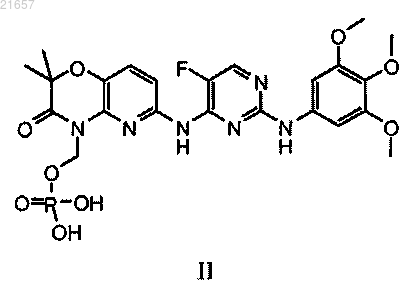
кислотный компонент которого представляет собой карбоновую кислоту R1OOH, где R1 представляет собой -Н или С1-С4алкил, необязательно замещенный вплоть до трех раз галогенами,
с амидом, представляющим собой R30CON(R2)2, где каждый R2 независимо представляет собой -Н или С1-С4алкил, или оба R2 вместе с азотом, к которому они присоединены, образуют 4-6-членное алифатическое кольцо, и R30 представляет собой -Н или С1-С4алкил; или R30 и один из R2 вместе с углеродом и азотом, к которым они присоединены, соответственно, образуют 4-6-членное алифатическое кольцо, и другой R2 независимо представляет собой -Н или С1-С4алкил,
в условиях, пригодных для образования амидного сольвата соединения формулы II; и
b) контактирование амидного сольвата с водным основанием, содержащим ионы натрия, в условиях, пригодных для образования соединения формулы I.
2. Способ по п.1, где амид представляет собой вторичный амид или третичный амид.
3. Способ по п.1, где амид представляет собой N,N-диалкилформамид, N,N-диалкилацетамид, N-алкилпирролидинон или N-алкилпиперидон.
4. Способ по п.3, где амид представляет собой N,N-диалкилформамид и условия, пригодные для образования амидного сольвата соединения формулы II, включают температуру от приблизительно 20 до приблизительно 70°C.
5. Способ по п.4, где амид представляет собой N,N-диметилформамид (DMF) и условия, пригодные для образования амидного сольвата, включают повторное суспендирование кислотного сольвата в DMF при температуре приблизительно 50°C.
6. Способ по п.1, где водное основание на стадии b) содержит гидроксид натрия и спирт и условия, пригодные для образования соединения формулы I, включают температуру от приблизительно 40 до приблизительно 80°C и pH от приблизительно 8 до приблизительно 10,5.
7. Способ по п.6, где водное основание на стадии b) содержит гидроксид натрия (NaOH) и изопропиловый спирт (IPA) и условия, пригодные для образования соединения формулы I, включают температуру приблизительно 80°C и pH приблизительно 9.
8. Способ получения соединения формулы I
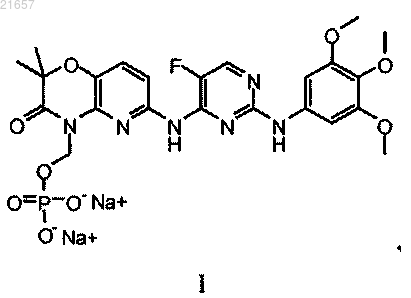
включающий контактирование соединения формулы VI
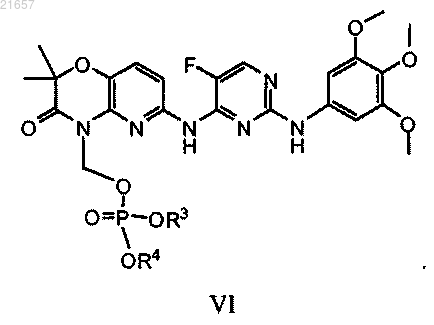
где каждый из R3 и R4 независимо представляет собой C1-C6 алкил;
с кислотой в условиях, пригодных для образования кислотного сольвата соединения формулы II
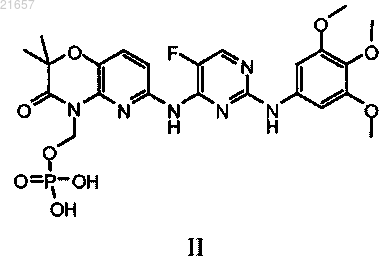
контактирование кислотного сольвата соединения формулы II с амидом в условиях, пригодных для образования амидного сольвата соединения формулы II; и
контактирование амидного сольвата соединения формулы II с водным основанием, содержащим ионы натрия, в условиях, пригодных для образования соединения формулы I.
9. Способ по п.1 или 8, где соединение формулы I находится в форме гидрата.
10. Способ по п.9, где гидрат представляет собой гексагидрат.
Текст
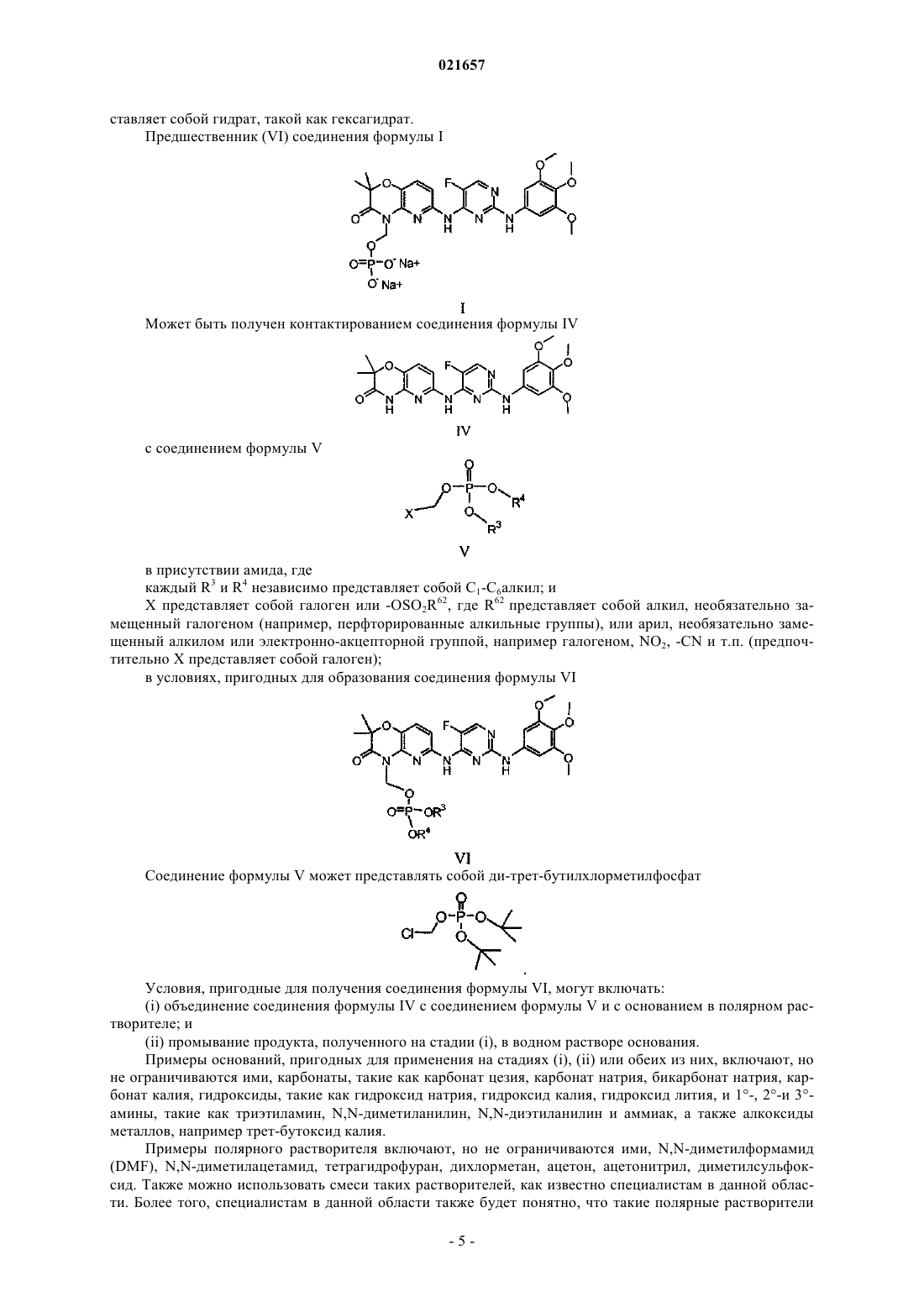
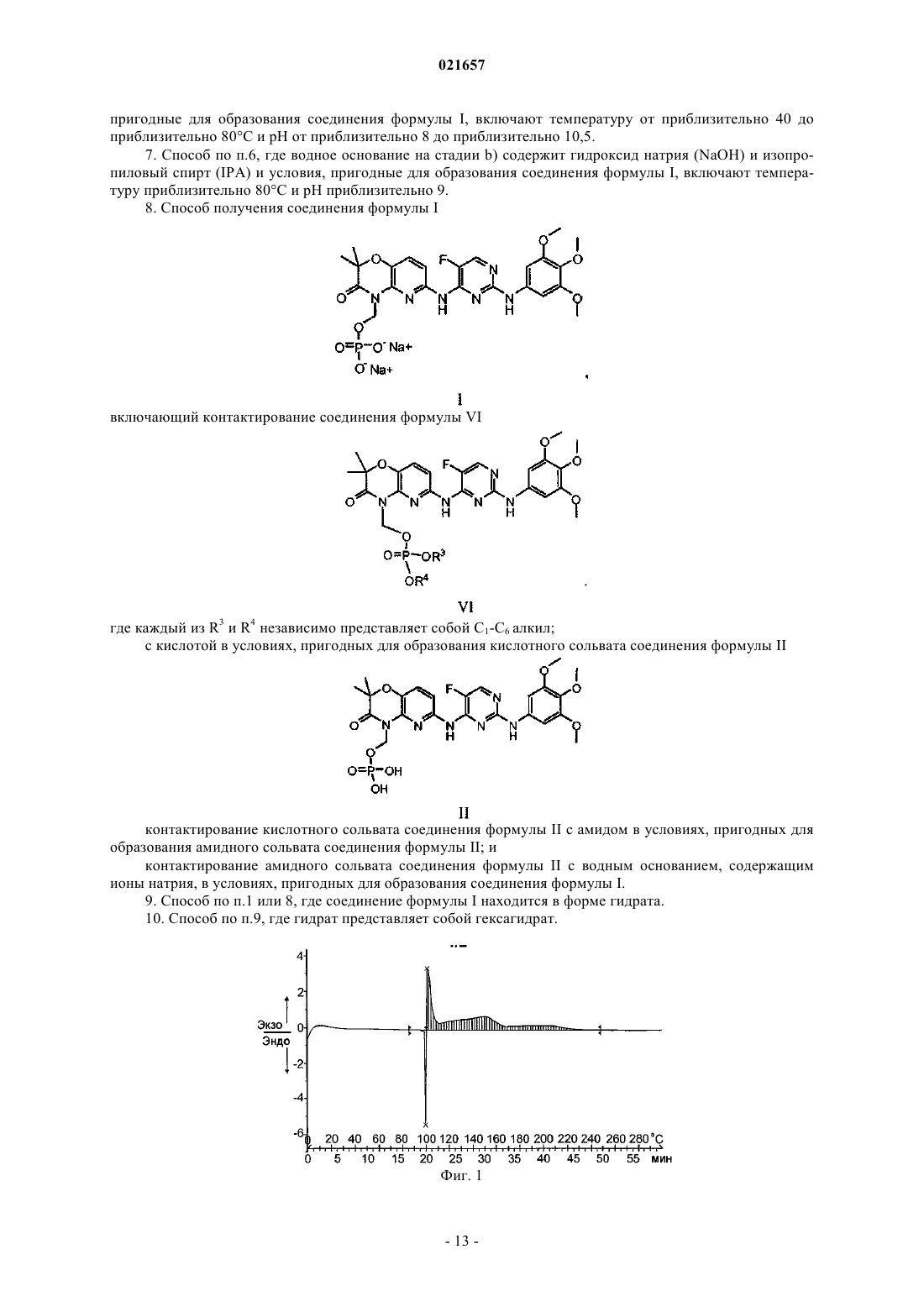
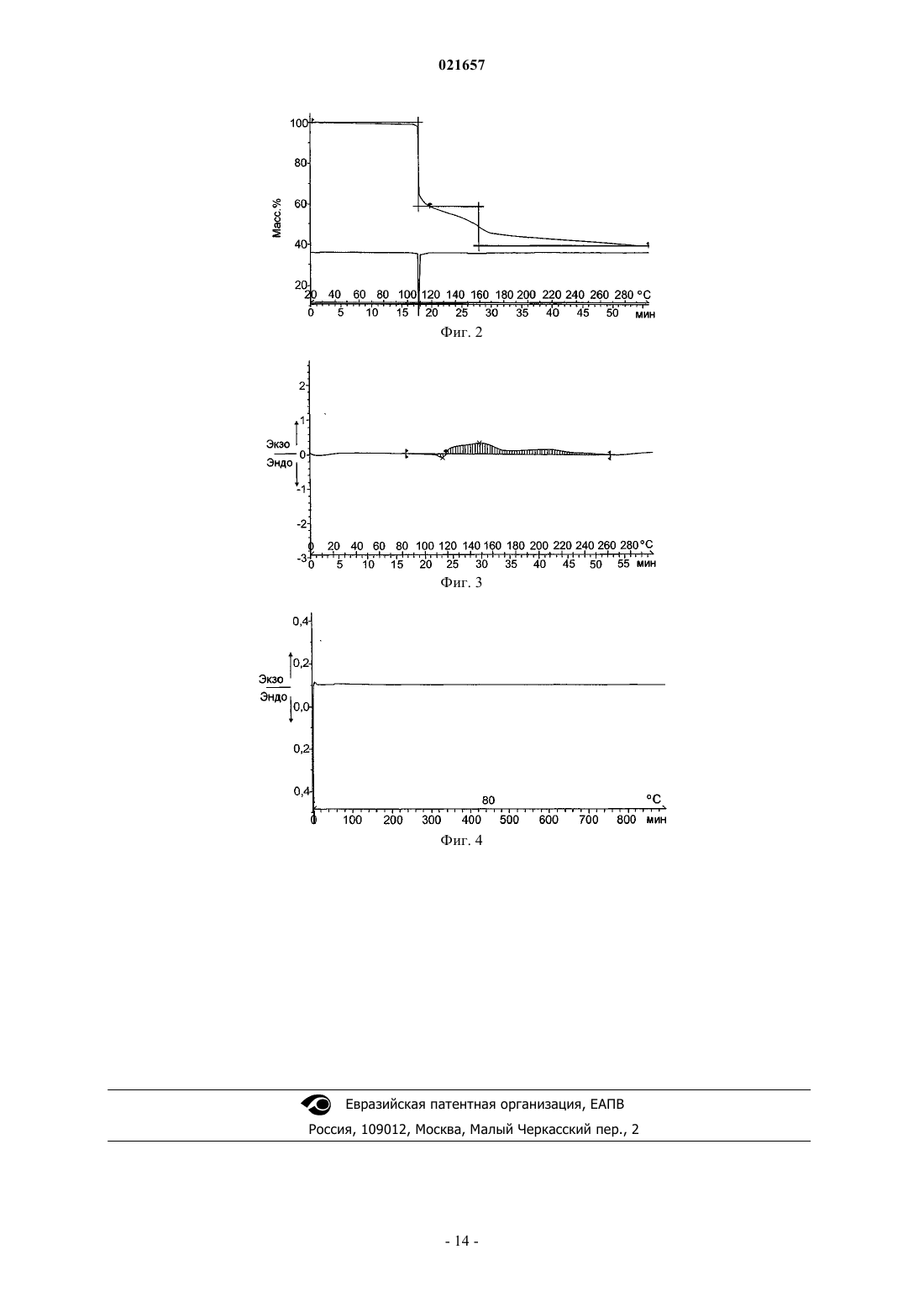
СИНТЕЗ ДИНАТРИЕВОЙ СОЛИ N4-(2,2-ДИМЕТИЛ-4[(ДИГИДРОФОСФОНОКСИ)МЕТИЛ]-3-ОКСО-5-ПИРИДО[1,4]ОКСАЗИН-6-ИЛ)-5 ФТОР-N2-(3,4,5-ТРИМЕТОКСИФЕНИЛ)-2,4-ПИРИМИДИНДИАМИНА Это изобретение относится к области фармацевтической/технологической химии. В настоящем документе описан способ получения динатриевой соли N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фторN2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина, в частности гидратов (таких как гексагидрат). Это соединение пригодно для лечения и профилактики различных заболеваний. Также описан способ получения N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5 пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина. Оба способа включают применение амида. Уровень техники Область, к которой относится изобретение Это изобретение относится к области фармацевтической/технологической химии. В настоящем документе описаны способы синтеза 2,4-пиримидиндиаминов, а также промежуточных соединений, используемых в них. В качестве одного из вариантов осуществления в настоящем документе предусмотрен способ получения динатриевой соли N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5 пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (соединение формулы I), в частности гидратов (таких как гексагидрат) соединения формулы I, 2,4-пиримидиндиамина,который пригоден для лечения и профилактики различных заболеваний. Краткое изложение уровня техники Были открыты различные классы соединений 2,4-пиримидиндиамина, которые обладают множеством терапевтических применений. См., например, заявку США с серийным 10/355543, поданную 31 января 2003 г. (US 2004/0029902 A1), международную заявку с серийнымPCT/US 03/03022, поданную 31 января 2003 г. (WO 03/063794), заявку США с серийным 10/631029, поданную 29 июля 2003 г. (US 2007/0060603), международную заявку с серийнымPCT/US 03/24087 (WO 2004/014382), заявку США с серийным 10/903263, поданную 30 июля 2004 г. (US 2005/0234049) и международную заявку с серийнымPCT/US 2004/24716 (WO 2005/016893). Каждая из этих заявок включена в качестве ссылки в полном объеме. Один из способов получения соединений 2,4-пиримидиндиамина описан в заявке США с серийным 11/539074, поданной 5 октября 2006 г., которая включена в настоящий документ посредством ссылки в полном объеме. Сущность изобретения Изобретение включает способ получения динатриевой соли N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (соединение формулы I) а также его гидратов (таких как гексагидрат). Соединение формулы I (и его гидраты) представляет собой 2,4-пиримидиндиамин, который пригоден для лечения и профилактики различных заболеваний. Специалисту в данной области будет понятно, что варианты осуществления, обобщенно представленные выше, можно использовать вместе в любой пригодной комбинации для получения вариантов осуществления, не указанных явно выше, и что такие варианты осуществления рассматриваются как часть настоящего изобретения. Краткое описание чертежей На фиг. 1 проиллюстрирован эксперимент по динамической дифференциальной сканирующей калориметрии (DSC) в закрытой чаше с чистым ди-трет-бутилхлорметилфосфатом (3,834 мг). На фиг. 2 проиллюстрирован эксперимент по термографическому анализу (TGA) с чистым ди-третбутилхлорметилфосфатом (7,7 мг). На фиг. 3 проиллюстрирован эксперимент по динамической дифференциальной сканирующей калориметрии в закрытой чаше с 36% раствором ди-трет-бутилхлорметилфосфата (5,6 мг) в DMAc. На фиг. 4 проиллюстрирован эксперимент по изотермической дифференциальной сканирующей калориметрии в закрытой чаше с 36% раствором ди-трет-бутилхлорметилфосфата (10,9 мг) в DMAc при 80 С. Подробное описание изобретения 1. Определения. Как используют в настоящем документе, следует применять следующие определения, если нет иных указаний. Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют те же значения, которые обычно понимает специалист в области, к которой относится это изобретение. Хотя при осуществлении на практике или тестировании настоящего изобретения можно использовать любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем документе, предпочтительные способы, устройства и материалы описаны в настоящем документе. Все публикации, цитированные в настоящем документе, включены в настоящий документ посредством ссылок для целей описания и раскрытия методик, реагентов и инструментов, описанных в публикациях, которые можно использовать применительно к изобретению. Ничто в настоящем документе не следует истолковывать как допущение того, что это изобретение дает право на противопоставление факта создания изобретения с более ранним приоритетом."Амид" относится к группе R20CON (R21)2, где R20 выбран из водорода или необязательно замещенного алкила; и каждый R21 независимо представляет собой водород или необязательно замещенный алкил, или оба из R21 и азот, к которому они присоединены, образуют 4-6-членное алифатическое кольцо; или R20 и один из R21 вместе с углеродом и азотом, к которым они присоединены, соответственно, образуют 4-6-членное азотсодержащее кольцо, и другой R21 представляет собой водород или необязательно замещенный алкил. Амиды включают первичные амиды, вторичные амиды (такие как, но не ограничиваясь ими, алкилформамиды и ацетамиды, такие как N-метилацетамид) и третичные амиды (такие как, но не ограничиваясь ими, N,N-диалкилацетамиды, N,N-диалкилформамиды, N-алкилпирролидоны и Nалкилпиперидоны). Конкретные примеры третичных амидов, пригодных для применения в описанных в настоящем документе сольватах, включают, но не ограничиваются ими, N,N-диметилацетамид, N,Nдиметилформамид, N-метилпирролидинон, N-метилпиперидинон."Алкил" относится к одновалентным насыщенным алифатическим гидрокарбильным группам,имеющим от 1 до 8 атомов углерода, например от 1 до 6 атомов углерода или от 1 до 4 атомов углерода. Этот термин включает в качестве примера линейные и разветвленные гидрокарбильные группы, такие как метил (СН 3-), этил (СН 3 СН 2-), н-пропил (СН 3 СН 2 СН 2-), изопропил CH3)2CH-), н-бутил(СН 3 СН 2 СН 2 СН 2-), изобутил СН 3)2 СНСН 2-), втор-бутил СН 3)(СН 3 СН 2)СН-), трет-бутил СН 3)3 С-), нпентил (СН 3 СН 2 СН 2 СН 2 СН 2-) и неопентил СН 3)3 ССН 2-). Также в качестве примера термину "С 1 С 4 алкил" соответствуют метильная группа, этильная группа, н-пропил, изопропильная группа, нбутильная группа, изобутильная группа, втор-бутильная группа и трет-бутил. Аналогично, термины, указывающие числовые диапазоны атомов углерода большего размера, соответствуют любому линейному или разветвленному гидрокарбилу, входящему в этот числовой диапазон. Такое включение применимо к другим терминам гидрокарбила, содержащим такие числовые диапазоны."Основание" относится к веществу, которое может принимать протоны. Примеры оснований включают, но не ограничиваются ими, карбонаты, такие как карбонат цезия, карбонат натрия, бикарбонат натрия, карбонат калия, гидроксиды, такие как гидроксид натрия, гидроксид калия, гидроксид лития и аммиак."Сольват" относится к комплексу, образованному комбинацией по меньшей мере одной молекулы растворителя по меньшей мере с одной молекулой или ионом растворенного вещества. Специалисту в данной области будет понятно, что стехиометрия растворителя относительно растворенного вещества в сольватах может составлять более одного, равна одному или составлять меньше одного. Растворитель может представлять собой органическое соединение, неорганическое соединение или смесь обоих из них. Некоторые примеры растворителей включают, но не ограничиваются ими, метанол, уксусную кислоту, N,N-диметилформамид, тетрагидрофуран, диметилсульфоксид и воду. Как используют в настоящем документе, термин "сольват" не предназначен для ограничения соединений-сольватов, описанных в настоящем документе, каким-либо конкретным типом связи (такой как ионные или координатные ковалентные связи). Термин "замещенный", когда его используют для определения конкретной группы или радикала,означает, что один или каждый из нескольких атомов водорода указанной группы или радикала независимо друг от друга заменены теми же или отличающимися группами заместителей, как определено ниже. Группы заместителей на необязательно замещенных алкилах представляют собой алкил, галоген,галоалкил, нитрозо и циано. Аналогично, понятно, что указанные выше определения не предполагают включения недопустимых паттернов замещения (таких как углерод, замещенный пятью группами, т.е. пятивалентный углерод). Такие недопустимые паттерны замещения хорошо понятны специалисту в данной области. 2. Способ. В настоящем документе описаны способы синтеза 2,4-пиримидиндиаминов, а также промежуточных соединений, используемых в них. В качестве одного из вариантов осуществления в настоящем документе предусмотрен способ получения динатриевой соли N4-(2,2-диметил-4-[(дигидрофосфонокси) метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина(соединение формулы I) (включая его гидраты, в частности гексагидрат), 2,4-пиримидиндиамина, который пригоден для лечения или профилактики различных заболеваний. Соединение формулы I описано в патенте США 7449458, поданном 19 января 2006 г., который включен в настоящий документ посредством ссылки в полном объеме. Фосфатсодержащие прогруппы,такие как в соединениях формул I, II, III и VI, могут увеличивать растворимость соединений 2,4 пиримидиндиамина, которые проявляют плохую растворимость в физиологических условиях (например,растворимость менее чем приблизительно 10 мкг/мл). Фосфатсодержащие прогруппы могут способствовать растворимости исходного активного соединения 2,4-пиримидиндиамина, что, в свою очередь, может увеличивать его биодоступность при пероральном введении. Фосфатные прогруппы могут метаболизи-2 021657 роваться ферментами-фосфатазами, находящимися в пищеварительном тракте, позволяя усваивать исходное активное лекарственное средство. В патенте США 7449458, поданном 19 января 2006 г., описано, что растворимость в воде и пероральная биодоступность конкретного биологически активного соединения 2,4-пиримидиндиамина, такого как соединение формулы IV значительно возрастали, когда их получали так, чтобы они включали прогруппу на атоме азота кольца,как в соединении формулы II В то время как было выявлено, что растворимость в воде соединения формулы IV находится в диапазоне приблизительно 1-2 мкг/мл в водном буфере в физиологических условиях, было выявлено, что растворимость соответствующего фосфатного пролекарства (соединение формулы II) составляла более чем 5 мг/мл в тех же условиях или была приблизительно в 2000 раз большей. Эта увеличенная растворимость в воде обеспечивает лучшее растворение в кишечнике, тем самым способствуя пероральному введению. Способ получения соединения формулы I описан в заявке США с серийным 11/539074, поданной 5 октября 2006 г., которая включена в настоящий документ в качестве ссылки в полном объеме. В широком аспекте изобретение относится к способу получения амидного сольвата соединения формулы II (ниже) (формула IIa) и превращения его в соединение формулы I. Более конкретно, изобретение относится к способу, где кислотный сольват соединения формулы II превращают в амидный сольват и амидный сольват превращают в соединение формулы I. В более конкретном варианте осуществления изобретение относится к способу получения соединения формулы I включающему: а) контактирование кислотного сольвата соединения формулы II кислотный компонент которого представляет собой карбоновую кислоту R1COOH, где R1 представляет собой -Н или С 1-С 4 алкил, необязательно замещенный вплоть до трех раз галогенами, с амидом, представляющим собой R30CON(R2)2, где каждый R2 независимо представляет собой -Н или С 1-С 4 алкил, или оба R2 вместе с азотом, к которому они присоединены, образуют 4-6-членное алифатическое кольцо, и мо представляет собой -Н или С 1-С 4 алкил, в условиях, пригодных для образования амидного сольвата соединения формулы II; иb) контактирование амидного сольвата с водным основанием, содержащим ионы натрия, в условиях, пригодных для образования соединения формулы I. В конкретном варианте осуществления соединение формулы I представляет собой гидрат, такой как гексагидрат. В некоторых вариантах осуществления амид представляет собой вторичный амид или третичный амид. В некоторых вариантах осуществления амид выбран из группы, состоящей из N,Nдиалкилформамида, N,N-диалкилацетамида, N-алкилпирролидинона и N-алкилпиперидона. В некоторых вариантах осуществления амид представляет собой N,N-диалкилформамид и условия,пригодные для образования амидного сольвата соединения формулы II, включают температуру от приблизительно 20C до приблизительно 70C. В некоторых вариантах осуществления амид представляет собой N,N-диметилформамид (DMF) и условия, пригодные для образования амидного сольвата, включают повторное суспендирование кислотного сольвата в DMF при температуре приблизительно 50C. В некоторых вариантах осуществления водное основание на стадии b) выше включает гидроксид натрия (NaOH) и спирт, и условия, пригодные для образования соединения формулы I, включают температуру от приблизительно 40C до приблизительно 80C и pH от приблизительно 8 до приблизительно 10,5. В некоторых вариантах осуществления водное основание на стадии b) выше включает гидроксид натрия (NaOH) и изопропиловый спирт (IPA), и условия, пригодные для образования соединения формулы I, включают температуру приблизительно 80C и pH приблизительно 9. В другом варианте осуществления изобретение относится к способу получения соединения формулы I включающему контактирование соединения формулы VI где каждый из R3 и R4 независимо представляет собой C1-C6 алкил; с кислотой в условиях, пригодных для образования кислотного сольвата соединения формулы II контактирование кислотного сольвата соединения формулы II с амидом в условиях, пригодных для образования амидного сольвата соединения формулы II; и контактирование амидного сольвата соединения формулы II с водным основанием, включающим ионы натрия, в условиях, пригодных для образования соединения формулы I. В конкретном варианте осуществления соединение формулы I, получаемое этим способом, пред-4 021657 Может быть получен контактированием соединения формулы IV в присутствии амида, где каждый R3 и R4 независимо представляет собой С 1-С 6 алкил; иX представляет собой галоген или -OSO2R62, где R62 представляет собой алкил, необязательно замещенный галогеном (например, перфторированные алкильные группы), или арил, необязательно замещенный алкилом или электронно-акцепторной группой, например галогеном, NO2, -CN и т.п. (предпочтительно X представляет собой галоген); в условиях, пригодных для образования соединения формулы VI Соединение формулы V может представлять собой ди-трет-бутилхлорметилфосфат Условия, пригодные для получения соединения формулы VI, могут включать:(i) объединение соединения формулы IV с соединением формулы V и с основанием в полярном растворителе; и(ii) промывание продукта, полученного на стадии (i), в водном растворе основания. Примеры оснований, пригодных для применения на стадиях (i), (ii) или обеих из них, включают, но не ограничиваются ими, карбонаты, такие как карбонат цезия, карбонат натрия, бикарбонат натрия, карбонат калия, гидроксиды, такие как гидроксид натрия, гидроксид калия, гидроксид лития, и 1-, 2-и 3 амины, такие как триэтиламин, N,N-диметиланилин, N,N-диэтиланилин и аммиак, а также алкоксиды металлов, например трет-бутоксид калия. Примеры полярного растворителя включают, но не ограничиваются ими, N,N-диметилформамид(DMF), N,N-диметилацетамид, тетрагидрофуран, дихлорметан, ацетон, ацетонитрил, диметилсульфоксид. Также можно использовать смеси таких растворителей, как известно специалистам в данной области. Более того, специалистам в данной области также будет понятно, что такие полярные растворители могут включать неполярные компоненты в смеси с одним или несколькими полярными растворителями,при условии, что полученная смесь растворителей является полярной. Растворители, обычно считающиеся полярными, включают растворители, имеющие диэлектрическую константупо меньшей мере приблизительно 5 и, как правило, более чем приблизительно 7 или 8. Например, тетрагидрофуран имеет диэлектрическую константу 7,6, в то время как DMF имеет диэлектрическую константу 37. Основание на стадии (i) выше включает по меньшей мере один из карбоната цезия (Cs2CO3) и карбоната калия (K2CO3); полярный растворитель включает по меньшей мере одно из DMF и N,Nдиметилацетамида (DMAc); и водное основание на стадии (ii) выше включает по меньшей мере один из бикарбоната натрия (NaHCO3) и гидроксида натрия (NaOH). Соединение формулы VI в некоторых случаях не выделяют. В некоторых случаях соединение формулы V стабилизируют с помощью растворителя N,Nдиметилацетамида (DMAc). Как правило, соединение формулы V, такое как ди-трет-бутилхлорметилфосфат, является нестабильным продуктом. В качестве примера ди-трет-бутилхлорметилфосфат претерпевает разложение при хранении с выделением тепла и газообразного изобутена. Что касается схемы ниже и без связи с теорией,полагают, что присутствие следовых количеств кислоты катализирует отщепление О-трет-бутильной группы от ди-трет-бутилхлорметилфосфата А с получением моно-трет-бутильного соединения С с высвобождением изобутена. Соединение С может действовать как источник кислоты, далее запуская аутокаталитический распад фосфата Е. Как указано пунктирной линией на схеме ниже, фосфат Е также может предоставлять протоны для аутокаталического распада А. Распад А является экзотермическим и приводит к двум молям изобутена на моль А. При хранении в адиабатических условиях теплота и давление, формирующиеся при распаде, могут быть существенными. На фиг. 1 проиллюстрировано, что хранение ди-трет-бутилхлорметилфосфата в адиабатических условиях может приводить к распаду, при котором значительно возрастают как давление, так и температура. На фиг. 1 проиллюстрирован эксперимент по динамической дифференциальной сканирующей калориметрии (DSC) в закрытой чаше с чистым ди-трет-бутилхлорметилфосфатом (нагревание от 0 до 300C со скоростью 5C/мин при скорости потока N2 50 мл/мин). Ссылаясь на фиг. 1, после эндотермического сигнала (начало высвобождения изобутена при образовании кислотных побочных продуктов; экстраполированный пик при 99,10C с шириной пика 0,33C и интегрированной площадью 108,45 мДж) наблюдают очень отчетливый экзотермический сигнал при приблизительно 100C (экстраполированный пик при 100,57C с шириной пика 3,99C и интегрированной площадью 2717,05 мДж),который является типичным для аутокаталитического распада. На фиг. 2 проиллюстрирован эксперимент по термографическому анализу (TGA) с чистым ди-трет-бутилхлорметилфосфатом, демонстрирующий,что наблюдается непрерывный распад с выделением газообразного изобутена. На фиг. 2 образец нагревали от 20 до 300C со скоростью 5C/мин при скорости потока N2 80 мл/мин. Образец продемонстрировал снижение массы на 41,465% (3,189 мг) между приблизительно 21 и 119C; и снижение массы на 19,526% (1,502 мг) между приблизительно 119 и 300C. Большая часть изобутена резко отделяется при 110C; после 1 ч при 300C масса образца соответствует кислоте Е, как изображено выше. Следующие тесты показали, что увеличение давления вследствие высвобождения изобутена может составлять до 80 бар. Также изобутен является воспламеняемым газом, таким образом, вентилирование больших количеств изобутена может быть опасным. Таким образом, обычно является важным конструирование оборудования для хранения соединения формулы V, которое может выдерживать создающееся давление. Также необходимо принимать различные другие меры безопасности, такие как контроль температуры, время дистилляции и размер клапана безопасности, чтобы избежать повреждения оборудования в ходе нежелательной реакции распада. Было обнаружено, что добавление N,N-диметилацетамида (DMAc) стабилизирует ди-третбутилхлорметилфосфат, так чтобы соединение можно было хранить при приблизительно 60C без ауто-6 021657 каталитического распада и без образования газа (см. фиг. 3-4). На фиг. 3 проиллюстрирован эксперимент по динамической дифференциальной сканирующей калориметрии в закрытой чаше с 36% раствором дитрет-бутилхлорметилфосфатом в DMAc (нагревание от 0 до 300C при скорости 5C/мин при скорости потока N2 50 мл/мин). После эндотермического сигнала (небольшая потеря изобутена вследствие следового количества кислоты; экстраполированный пик при 116,42C с шириной пика 6,19C и интегрированной площадью -70,78 мДж) наблюдают плавный экзотермический сигнал при 120C (без наблюдения резкого экзотермического сигнала при 99-100C; экстраполированный пик при 129,74C с шириной пика 42,52C и интегрированной площадью 1362,40 мДж). Это указывает на то, что система не подвергается аутокаталитическому распаду. На фиг. 4 проиллюстрирован эксперимент по изотермической дифференциальной сканирующей калориметрии (DSC) в закрытой чаше с 36% раствором ди-третбутилхлорметилфосфата в DMAc при 80C (при скорости потока N2 50 мл/мин). Не наблюдают эндотермического или экзотермического распада 36% раствора ди-трет-бутилхлорметилфосфата в DMAc при температурах хранения (45, 60 и даже 80C) в течение 15 ч, таким образом, ди-третбутилхлорметилфосфат является стабилизированным. В действительности, изотермическое нагревание при 60C 36% раствора из 68,7 г ди-трет-бутилхлорметилфосфата в DMAc в течение более чем 96 ч не приводило к образованию газа (изобутен). Следует понимать, что для стаблизации соединения формулы V, включая ди-третбутилхлорметилфосфат, можно использовать любой амид, такой как, но не ограничиваясь им, DMAc. Такие амиды хорошо известны специалисту в данной области. Примеры таких амидов включают, но не ограничиваются ими, N,N-диметилацетамид, N,N-диметилформамид, N-метилпирролидинон. В некоторых вариантах осуществления к комбинации амида и ди-трет-бутилхлорметилфосфата необязательно можно добавлять растворитель. В некоторых вариантах осуществления амид также может представлять собой растворитель. Например, DMAc можно использовать в качестве амида, а также в качестве растворителя. Усовершенствованный способ синтеза соединения формулы I является таким, как проиллюстрировано на схемах I-VII ниже. 3. Схемы синтеза. Исходные материалы, используемые в синтезе, описанном в настоящем документе, являются коммерчески доступными. Синтез соединения формулы V является таким, как показано на схеме I ниже. Схема I Согласно схеме I соединение формулы V получают реакцией группы диалкилфосфата калия (R3 иR , как определено в настоящем документе выше) с алкилирующим средством (X, как определено в настоящем документе выше), таким как галометилхлорсульфат, в присутствии катализатора межфазного переноса (РТС). Многочисленные примеры катализаторов межфазного переноса известны специалистам в данной области. Примеры таких катализаторов межфазного переноса включают, но не ограничиваются ими, соли тетраалкиламмония, такие как соли тетрабутиламмония. Например, ди-трет-бутилхлорметилфосфат можно получать реакцией ди-трет-бутилфосфата калия или натрия (PDP) с хлорметилхлорсульфатом(CMCS) в присутствии бисульфата тетрабутиламмония (TBAHS). На схеме Ia ниже (а также на фиг. 1-4 и в примерах ниже) показано, что коррекция pH и добавлениеN,N-диметилацетамида (DMAc) стабилизируют ди-трет-бутилхлорметилфосфат, так что соединение можно держать при приблизительно 60C без образования газа. Схема Ia 4 Следует понимать, что синтез ди-трет-бутилхлорметилфосфата на схеме Ia представлен только для целей иллюстрации. Синтез других фосфатов соединения формулы V по представленной ниже схеме Ia можно проводить общепринятой адаптацией способа. Кроме того, для получения ди-третбутилхлорметилфосфата можно использовать соли натрия или другие соли ди-трет-бутилфосфата и другие условия реакции. Синтез соединения формулы VIa из соединения формулы IV является таким, как проиллюстрировано на схеме II ниже. Согласно схеме II соединение формулы IV обрабатывают ди-трет-бутилхлорметилфосфатом с получением соединения формулы VIa (как на стадии В примера 1 в настоящем документе). Следует понимать, что реакция соединения формулы IV с ди-трет-бутилхлорметилфосфатом представлена только для целей иллюстрации. Другие фосфаты, такие как соединение формулы V, описанное в настоящем документе, можно подвергать реакции с соединением формулы IV с получением соединения формулы VI с использованием общепринятой адаптации способа. Стадии, описанные ниже для соединения формулыVIa, также можно применять к соединению формулы VI. В некоторых вариантах осуществления при синтезе соединения формулы VIa используют Cs2CO3 в качестве основания и DMAc в качестве растворителя. Основание Cs2CO3 можно заменять на K2CO3 илиKOtBu, каждый из них отдельно или в комбинации друг с другом или Cs2CO3. Соединение формулы VIa может быть выделено в виде твердого вещества, а также может быть получено в виде раствора в метилтрет-бутиловом эфире (MtBE). Синтез кислотного сольвата соединения формулы II из соединения формулы VIa является таким,как проиллюстрировано на схеме III и представлено на стадии С примера 1 ниже. Схема III Согласно схеме III соединение формулы VIa растворяют в смеси кислоты R1-COOH (R1 является таким, как определено в настоящем документе выше) и воды и нагревают до приблизительно 55-70C. Например, как описано на стадии С примера 1 соединение формулы VIa растворяют в уксусной кислоте и воде (4:1 АсОН:Н 2 О) и нагревают до 67C с получением сольвата соединения формулы II с уксусной кислотой. Синтез амидного сольвата соединения формулы II из кислотного сольвата соединения формулы II является таким, как проиллюстрировано на схеме IV и показано на стадии С примера 1. где соединение формулы I необязательно имеет форму гидрата, такого как гексагидрат. Превращение кислотного сольвата соединения формулы II в амидный сольват соединения формулыII включает повторное суспендирование кислотного сольвата соединения формулы II в третичном амиде,таком как R30CON(R2)2 (где R2 и R30 являются такими, как определено в настоящем документе выше),между приблизительно 20-50C. Например, как описано на стадии С примера 1 сольват соединения формулы II с уксусной кислотой повторно суспендируют в DMF при приблизительно 40C с получением сольвата соединения формулы II с DMF. Эта стадия ресуспендирования кислотного сольвата с получением сольвата соединения формулы II с DMF приводит к более высококачественному продукту с меньшим количеством исходного материала и побочных продуктов, как, например, истощение соединения формулы IV до 1 мол.% и п-димера до 0,1 мол.%. Продукт является стабильным при 40C в течение приблизительно 24 ч. Этот усовершенствованный способ приводит к улучшенной фильтрационной способности продукта. Этот усовершенствованный способ далее приводит к увеличению выхода приблизительно на 10%. Синтез соединения формулы I из амидного сольвата соединения формулы II проиллюстрирован на стадии D примера 1. Амидный сольват соединения формулы II отбирают в спирт, такой как смесь изопропиловый спирт/вода, где pH доводят до величины от приблизительно 9 до приблизительно 10,5 добавлением основания, такого как NaOH. Раствор нагревают до температуры от приблизительно 40 до приблизительно 80C. В одном варианте осуществления сольват соединения формулы II с DMF обрабатывают смесью изопропиловый спирт/вода при температуре приблизительно 80C и pH приблизительно 8-10,2 с получением соединения формулы I. Примеры Изобретение далее поясняется с помощью следующих примеров, которые предназначены только для иллюстрации определенных аспектов изобретения и не предназначены для ограничения объема. В примерах ниже, а также на протяжении заявки следующие сокращения имеют следующие значения. Если не определено, термины имеют их общепринятые значения. см - сантиметрIPA - изопропиловый спирт мбар - миллибар МеОН - метанолPOCl3 - оксихлорид фосфора. Пример 1. А. Получение ди-трет-бутилхлорметилфосфата. Методика I. Получение стабилизированного ди-трет-бутилхлорметилфосфата. Получение ди-трет-бутилхлорметилфосфата описано в литературе, например в Mantyla, et al. Tetrahedron Letters, 43(2002), 3793-3794 и Chadwick, et al. US 2006/0047135. Авторы изобретения открыли усовершенствование этих способов, посредством которых повышается выход с высокой чистотой, и дитрет-бутилхлорметилфосфат стабилизируется под действием амида. Конкретный пример ниже иллюстрирует этот аспект изобретения. Неожиданно было открыто, что ди-трет-бутилхлорметилфосфат можно синтезировать с превосходным выходом (90%) и чистотой (99%) путем дозированного добавления 2,5 экв. CMCS в двухфазную смесь PDP и катализатор межфазного переноса TBAHS в смеси DCM/вода и коррекции величины pH до 8 путем одновременного добавления 20% водного раствора NaOH. Кроме того, было открыто, что стабильность ди-трет-бутилхлорметилфосфата значительно увеличивалась и не наблюдали аутокаталитического распада путем получения 30 мас.% раствора в диметилацетамиде (DMAc). Описание способа. ди-трет-Бутилхлорметилфосфат синтезировали с использованием катализируемой TBAHS реакции межфазного переноса PDP в DCM/H2O с 2,5 экв. CMCS при 18C. Проводили мониторинг pH и доводили его до 8 добавлением 20% водного NaOH.DCM удаляли при 20C и pH7 при пониженном давлении (рециклирование DCM). К неочищенному ди-трет-бутилхлорметилфосфату добавляли MtBE и TBAHS удаляли промыванием слоя MtBE 2% водным раствором бикарбоната. Для стабилизации ди-трет-бутилхлорметилфосфата добавляли DMAc, a затем MtBE отгоняли. Выход составил 90% в расчете на исходный материал PDP. Чистота ди-третбутилхлорметилфосфата в DMAc согласно 1H-ЯМР 99%. Эта методика имеет, по меньшей мере, следующие преимущества: 1) можно использовать жидкое основание (водный NaOH) вместо избытка твердого основания, такого как NaHCO3, Na2HPO4 илиNa2CO3; 2) реакцию можно проводить в более концентрированном состоянии, поскольку избыток менее растворимых бикарбонатов или фосфатов заменяют растворимыми хлоридами, тем самым минимизируя требования к объему и время реакции при одновременном увеличении выхода. Также увеличивается стабильность ди-трет-бутилхлорметилфосфата при вплоть до 40C, путем получения, например, 30 мас.% раствора в DMAc. В конкретном примере 56,3 г PDP (1,0 мол.экв.: 91,2 мас.%) смешивали с 3,53 г TBAHS (0,05 экв.),60 г воды и 300 г DCM. При комнатной температуре к реакционной смеси дозированно добавляли 86,6 гCMCS (2,5 экв.) в течение 4 ч. В ходе дозированного добавления CMCS pH доводили до 8 добавлением 227 г 20% водного NaOH. Полученную двухфазную реакционную смесь перемешивали в течение ночи при 20C. DCM отгоняли при 20C при пониженном давлении (500300 мбар) из двухфазной смеси. После добавления к осадку 200 мл MtBE слои разделяли. Водный слой удаляли и органический слой промывали один раз 300 мл 2% водного NaHCO3 для удаления катализатора межфазного переноса. После добавления 90 мл DMAc MtBE отгоняли при 40C и пониженном давлении. Жидкий азот барботировали через полученную смесь в течение 1 ч для удаления следовых количеств DCM и MtBE. Получали дитрет-бутилхлорметилфосфат (128 г масла) и анализировали его с помощью 1 Н-ЯМР, продемонстрировавшего выход ди-трет-бутилхлорметилфосфата 90,7% (ди-трет-бутилхлорметилфосфат: 36,4%; DMAc: 63,4 мас.%; DCM: 0,03 мас.%; MtBE: 0,01 мас.%; РТС: 0,01 мас.%; вода: 0,6 мас.%). Дополнительные преимущества включают: 1) DCM можно рециркулировать, 2) РТС можно удалять однократной экстракцией, 3) требуется только 5 мол.% РТС и 4) все, за исключением следовых количеств DCM и MtBE, удаляются барботированием N2. В. Получение соединения формулы VIa в MtBE. Описание синтеза соединения формулы VIa. 27,3 г (1,2 экв.) карбоната цезия, 185 г N,N-диметилацетамида, 33,5 г соединения формулы IV (1 экв., 70 ммоль) и 74 г 30,6 мас.% ди-трет-бутилхлорметилфосфата (1,25 экв.) в DMAc объединяли и перемешивали при 40C в течение ночи. Получали бежевую суспензию. Суспензию охлаждали до комнатной температуры и добавляли по 118 мл каждого из МТВЕ и воды. Фазы разделяли, и водный слой промывали 94 мл МТВЕ. Каждый органический слои промывали 94 мл воды. Органические слои давали 187,9 г соединения VIa в МТВЕ (выход 74% в расчете на 70 ммоль соединения формулы IV). С. Получение соединения формулы IIa (сольват с амидом). Описание. Уксусную кислоту (168,6 г, 160,6 мл) объединяли с равным количеством воды и смесь нагревали до 67C. Раствор соединения формулы VIa (187 г, 170 мл) в МТВЕ, полученный, как описано выше, добав- 11021657 ляли к водному раствору уксусной кислоты. Большую часть МТВЕ отгоняли при атмосферном давлении и полученный раствор перемешивали в течение 2 ч с получением желтой суспензии. Оставшийся МТВЕ отгоняли при 300 мбар и суспензию охлаждали до 20C и фильтровали с получением не совсем белого твердого вещества. Осадок на фильтре промывали холодным ацетоном (2160 мл) и сушили в течение ночи при 30C с получением 29,8 г соединения формулы II в качестве сольвата с уксусной кислотой. Суспензию 29,8 г соединения формулы II в качестве сольвата с уксусной кислотой в стехиометрии 1:1 или приблизительно 1:1 и 150 мл DMF нагревали до 50C и перемешивали в течение 2 ч. Затем суспензию охлаждали до комнатной температуры и фильтровали. Осадок на фильтре промывали три раза 98 мл МТВЕ и сушили в вакууме в течение ночи при 30C. Получали сольват соединения формулы II (26,7 г) с амидом (выход 55% в расчете на 70 ммоль соединения IV).D. Получение гексагидрата соединения формулы I. Сольват с амидом (10 г, 15 ммоль) суспендировали в 100 мл воды и перемешивали в течение 1 ч. Затем добавляли 50 мл IPA и pH доводили от 3,3 до 8,5 добавлением 31,9 г 1 М NaOH. Реакционную смесь нагревали до 82C, перемешивали в течение 1 ч, фильтровали через 10-микронный фильтр, охлаждали до 20C и перемешивали в течение ночи. Полученную суспензию фильтровали и осадок на фильтре промывали два раза 40 мл ацетона и сушили в вакууме в течение ночи при 40C с получением 8,6 г гексагидрата соединения формулы I (выход 77%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I включающий: а) контактирование кислотного сольвата соединения формулы II кислотный компонент которого представляет собой карбоновую кислоту R1OOH, где R1 представляет собой -Н или С 1-С 4 алкил, необязательно замещенный вплоть до трех раз галогенами,с амидом, представляющим собой R30CON(R2)2, где каждый R2 независимо представляет собой -Н или С 1-С 4 алкил, или оба R2 вместе с азотом, к которому они присоединены, образуют 4-6-членное алифатическое кольцо, и R30 представляет собой -Н или С 1-С 4 алкил; или R30 и один из R2 вместе с углеродом и азотом, к которым они присоединены, соответственно, образуют 4-6-членное алифатическое кольцо, и другой R2 независимо представляет собой -Н или С 1-С 4 алкил,в условиях, пригодных для образования амидного сольвата соединения формулы II; иb) контактирование амидного сольвата с водным основанием, содержащим ионы натрия, в условиях, пригодных для образования соединения формулы I. 2. Способ по п.1, где амид представляет собой вторичный амид или третичный амид. 3. Способ по п.1, где амид представляет собой N,N-диалкилформамид, N,N-диалкилацетамид, Nалкилпирролидинон или N-алкилпиперидон. 4. Способ по п.3, где амид представляет собой N,N-диалкилформамид и условия, пригодные для образования амидного сольвата соединения формулы II, включают температуру от приблизительно 20 до приблизительно 70C. 5. Способ по п.4, где амид представляет собой N,N-диметилформамид (DMF) и условия, пригодные для образования амидного сольвата, включают повторное суспендирование кислотного сольвата в DMF при температуре приблизительно 50C. 6. Способ по п.1, где водное основание на стадии b) содержит гидроксид натрия и спирт и условия,- 12021657 пригодные для образования соединения формулы I, включают температуру от приблизительно 40 до приблизительно 80C и pH от приблизительно 8 до приблизительно 10,5. 7. Способ по п.6, где водное основание на стадии b) содержит гидроксид натрия (NaOH) и изопропиловый спирт (IPA) и условия, пригодные для образования соединения формулы I, включают температуру приблизительно 80C и pH приблизительно 9. 8. Способ получения соединения формулы I включающий контактирование соединения формулы VI где каждый из R3 и R4 независимо представляет собой C1-C6 алкил; с кислотой в условиях, пригодных для образования кислотного сольвата соединения формулы II контактирование кислотного сольвата соединения формулы II с амидом в условиях, пригодных для образования амидного сольвата соединения формулы II; и контактирование амидного сольвата соединения формулы II с водным основанием, содержащим ионы натрия, в условиях, пригодных для образования соединения формулы I. 9. Способ по п.1 или 8, где соединение формулы I находится в форме гидрата. 10. Способ по п.9, где гидрат представляет собой гексагидрат.
МПК / Метки
МПК: C07F 9/6561
Метки: синтез, соли, динатриевой, n4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-n2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина
Код ссылки
<a href="https://eas.patents.su/15-21657-sintez-dinatrievojj-soli-n4-22-dimetil-4-digidrofosfonoksimetil-3-okso-5-pirido14oksazin-6-il-5-ftor-n2-345-trimetoksifenil-24-pirimidindiamina.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез динатриевой соли n4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-n2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина</a>
Предыдущий патент: Дистанционно управляемая переносная пусковая установка для переносного противотанкового ракетного комплекса
Следующий патент: Минеральные волокна и их применение
Случайный патент: Переработка углеводородного газа