Производные хинолина и их применение
Номер патента: 18798
Опубликовано: 30.10.2013
Авторы: Мальм Йохан, Ванберг Йохан, Бекман Ульрика, Вестман Якоб, Нехотяева Наталья
Формула / Реферат
1. Соединение формулы (I)
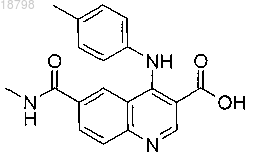
в которой n = 0;
R1 и R2 независимо выбраны из водорода, С1-4алкила и С3-4циклоалкила;
R3 представляет собой водород;
R4 представляет собой фенил, где указанный фенил необязательно замещен по меньшей мере одной группой R5; и R5 выбран из С1-4алкила и С1-4алкокси;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 и R2 представляют собой независимо водород или C1-4алкил.
3. Соединение по п.2, где R1 и R2 представляют собой независимо водород или метил.
4. Соединение по любому из пп.1-3, где R1 представляет собой Н.
5. Соединение по любому из пп.1-4, где R5 выбран из С1-3алкила и С1-3алкокси.
6. Соединение по п.5, где R5 выбран из метила и метокси.
7. Соединение по п.6, которое является
6-(метилкарбамоил)-4-[(4-метилфенил)амино]хинолин-3-карбоновой кислотой или ее фармацевтически приемлемой солью.
8. Соединение по п.6, которое является
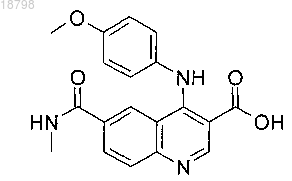
4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоновой кислотой или ее фармацевтически приемлемой солью.
9. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли в антиангиогенной терапии.
10. Фармацевтическая композиция для лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза, содержащая терапевтически эффективное количество соединения по любому из пп.1-8 или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый эксципиент.
11. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза.
12. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза.
13. Способ терапевтического лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза, путем введения терапевтически эффективного количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в этом.
Текст
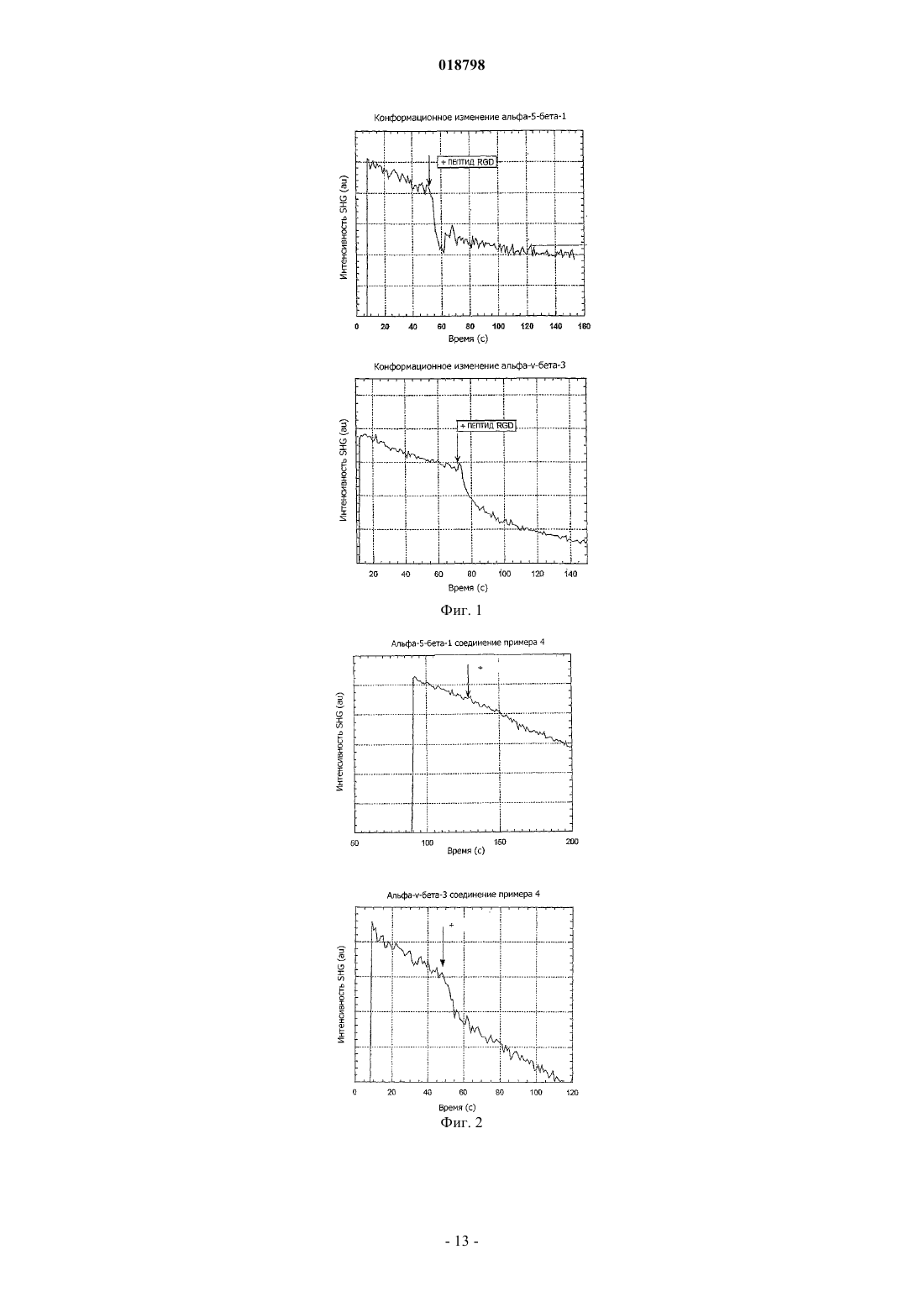
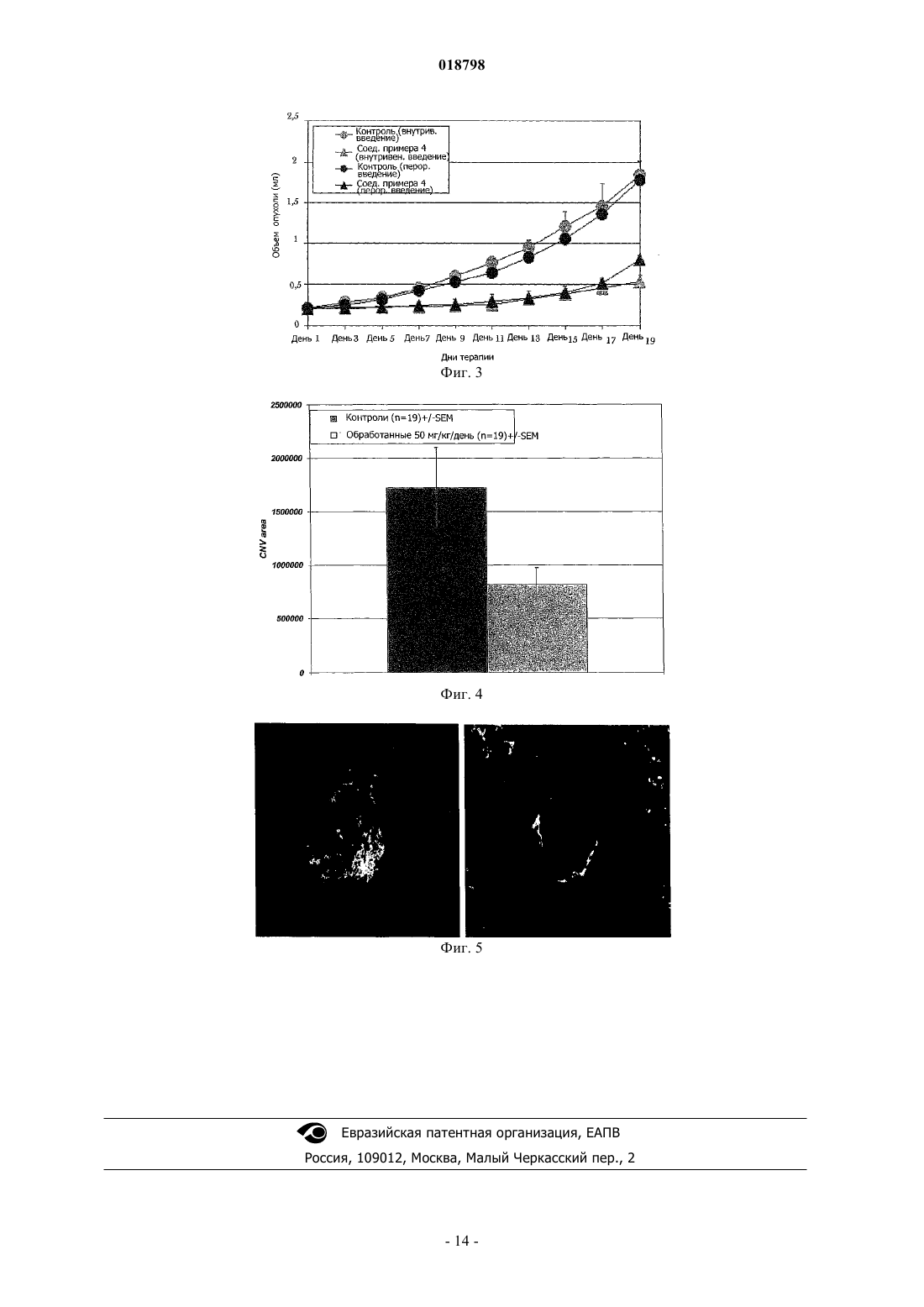
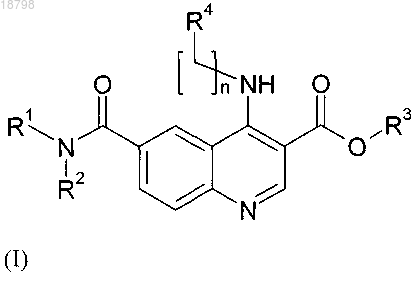
а также его фармацевтически приемлемые соли. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения. Соединение является применимым для лечения рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна,воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека или псориаза. Область техники, к которой относится изобретение Настоящее изобретение относится к производным хинолина и их применению в терапии. Более конкретно настоящее изобретение относится к производным хинолина для лечения рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза. Предшествующий уровень техники Развитие кровеносных сосудов (ангиогенез), развитие новых капилляров из ранее имеющихся сосудов является важным для развития эмбриона, образования органа, генерации и ремоделирования ткани[Folkman, J.Shing, Y. (1992) J. Biol. Chem. 267, 10931-10934]. Такое развитие способствует также развитию и прогрессированию различных патологических состояний, включающих в себя рост опухоли и метастаз, сердечно-сосудистые заболевания, диабетическую ретинопатию, ревматоидный артрит и псориаз [Folkman, J. (1995) Nat. Med. 1, 27-312]. Развитие кровеносных сосудов и образование и развитие кровеносных сосудов являются комплексными многостадийными процессами, которые включают в себя пролиферацию, миграцию и дифференцировку эндотелиальных клеток, разрушение внеклеточного матрикса, образование трубок и спрутинг новых капиллярных ветвей [Hanahan, D.Folkman, J. (1996) Cell 86, 353-364; Risau, W. (1997) Nature (London) 386, 671-674]. Сложность ангиогенных процессов позволяет предположить существование многочисленных регуляций системы, которая может попеременно включаться или выключаться. Считается, что включение ангиогенного фенотипа в тканях зависит от локального изменения баланса между ангиогенными стимуляторами и ингибиторами [Folkman, J. (1995) N.Engl. J. Med. 333, 1757-1763]. Среди многих описанных ангиогенных факторов фактор васкулярного эндотелиального роста(VEGF)/фактор васкулярной проницаемости является одним из лучше всего охарактеризованных позитивных регуляторов с его особой специфичностью для васкулярных эндотелиальных клеток [Senger,D.R., Galli, S.J., Dvorak, A.M., Perruzzi, С.A., Harvey, V.S.Dvorak. H.F. (1983) Science 219, 983-985;Ferrara, N.Henzel, W.J. (1989) Biochem. Biophys. Res. Commun. 161, 851-858; Gospodarowicz, D., Abraham, J.A.Schilling, J. (1989) Proc. Natl. Acad. Sci. USA 86, 7311-7315]. Биологические действия VEGF включают в себя стимуляцию пролиферации, миграции, дифференцировки эндотелиальных клеток, образование трубок, увеличение васкулярной проницаемости и поддержание васкулярной целостности [Mustonen, Т.Alitalo, K. (1995) J. Cell Biol. 129, 895-898; Ferrara, N.Davis-Smyth, Т. (1997) Endocr. Rev. 18, 4-25; Thomas, K. (1996) J. Biol. Chem. 271, 603-606; Risau, W. (1997) Nature (London) 386, 671-674;Breier, G.Risau, W. (1997) Trends Cell Biol. 6, 454-456]. Ангиогенные реакции, индуцированные VEGF,опосредуются рецепторами тирозинкиназы, которые экспрессируются главным образом на васкулярных клетках эндотелиальной линии дифференцировки [Mustonen, Т.Alitalo, K. (1995) J. Cell Biol 129, 895898; De Vries, С, Escobedo, J.A., Ueno, H., Huck, K., Ferrara, N.Williams, L.T. (1992) Science 255, 989-99;Bohlen, P. (1992) Biochem. Biophys. Res. Commun.187, 1579-1586]. Ингибирование адгезии клетки к мембране эндотелиальной клетке (ЕСМ), основная стадия для активации, выживания, "нацеливания" и миграции активированных эндотелиальных клеток, может быть одним из наиболее перспективных механизмов направленной доставки для действия против развития кровеносных сосудов (ангиогенеза). В этих механизмах принимает участие не только VEGF, но многие из этих взаимодействий опосредуются также интегринами, семейством полифункции рецепторов клеточной адгезии. Членами семейства интегринов являются нековалентно связанные /-гетеродимеры,которые опосредуют взаимодействия клетка-клетка, клетка-внеклеточный матрикс и клетка-патоген. До настоящего времени известны 19 различных -субединиц интегрина и 8 различных -субединиц, которые соединяются с образованием по меньшей мере 25 различных /-гетеродимеров с различной специфичностью для лиганда. Лигандами для внеклеточного домена многих интегринов являются белки внеклеточного матрикса и внутриклеточный домен интегринов либо непосредственно, либо опосредованно соединяется с внутриклеточными компонентами, такими как киназы и цитоскелет. Интегрины служат в качестве двунаправленных передающих сигналы рецепторов, в результате чего активности белков и экспрессия генов изменяются интегринами в ответ на связывание лиганда с их внеклеточным доменом, который называют также передающим сигнал наружу. С другой стороны, аффинность интегринов модулируется в ответ на внутриклеточные изменения, такие как связывание белков с внеклеточным доменом интегрина, который называют передающим сигнал внутрь [Humphries (2000) Biochem Soc Trans. 28, 311;Hynes (2002) Cell, 110, 673]. Несколько исследований по картине интегринов на активированных эндотелиальных клетках мышей с дефицитом генов и исследования ингибирования на моделях ангиогенных животных с применением антител, пептидов и маленьких молекул дали информацию о интегринах и белках ЕСМ, включенных в критические стадии развития кровеносных сосудов [Brooks (1994) Science, 264, 569; Brooks (1996) Eur.Kim (2000) Am J. Pathol., 156, 1345]. Из этой работы явствует, что рецепторы фибронектина -v3, -v-5 и рецептор фибронектина -51 играют критическую роль в развитии кровеносных сосудов. Экс-1 018798 прессия -51 значительно позитивно регулируется в кровеносных сосудах опухолей человека и после стимуляции факторами роста и после экспрессии -51 регулирует выживание и миграцию эндотелиальных клеток in vitro и in vivo. Сущность изобретения Согласно экспериментам, проведенным авторами настоящего изобретения, только ингибирование рецептора фибронектина -51 пока предоставило биологические данные, которые полностью согласуются с его предполагаемой ролью при развитии кровеносных сосудов. Поэтому без желания быть связанным с какой-либо теорией предполагают, что -51 может быть предпочтительной мишенью для разработки антиангиогенных лекарственных средств и, следовательно, может иметь огромный терапевтический потенциал для лечения неоваскуляризации в опухолях, в глазах и при воспалительных процессах. Авторами настоящего изобретения теперь обнаружено, что новые производные хинолина с определенной структурой боковых цепей способны эффективно блокировать интегрины и потенциально тирозинкиназы, в особенности рецептор фибронектина -51. По сравнению с подобными аналогами в данной области соединения настоящего изобретения имеют также улучшенные свойства растворимости. Следовательно, согласно одному аспекту, настоящее изобретение относится к соединению формулы (I) где n= 0,R1 и R2 независимо выбраны из водорода, C1-4 алкила или C3-4 циклоалкила,R3 представляет собой водород;R4 представляет собой фенил, где указанный фенил необязательно замещен по меньшей мере одной группой R5 иR5 выбран из С 1-4 алкила и С 1-4 алкокси; а также его фармацевтически приемлемым солям. Согласно следующему аспекту изобретение относится к соединению формулы (I), указываемому в контексте выше, или ее фармацевтически приемлемой соли для применения в терапии. Согласно следующему аспекту настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемым солям для применения при лечении заболеваний, таких как рак, диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна, хроническое воспаление,"удар" (мозгового кровоизлияния), ишемия миокарда, атеросклероз, рост опухоли и макулярный отек. Согласно еще одному следующему аспекту настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемых солей для изготовления лекарственного средства для лечения таких заболеваний, как рак, диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна, хроническое воспаление, "удар", ишемия миокарда, атеросклероз, рост опухоли и макулярный отек. Согласно другому аспекту изобретение относится к способу лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пята, хронического воспаления, "удара", ишемии миокарда, атеросклероза, роста опухоли и макулярного отека, введением терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в таком лечении. Следующие аспекты и варианты осуществления изобретения являются аспектами и вариантами,указываемыми в формуле изобретения. Перечень фигур Фиг. 1 представляет собой диаграмму сигнала SHG как функцию времени, полученную с меченым рецептором -51 (верхняя) и -v3 (нижняя) и пептидом, полученным из фибронектина, показывающую конформационное изменение рецептора. Фиг. 2 представляет собой диаграмму сигнала SHG как функцию времени, полученную с меченым рецептором -51 (верхняя) и -v3 (нижняя) в присутствии соединения изобретения и пептида, полученного из фибронектина, показывающую ингибирование (отсутствие конформационного изменения) рецептора -51 соединением изобретения, но неv3 (конформационное изменение). Фиг. 3 представляет собой диаграмму объема (мл) опухоли у мышей, получивших подкожно имплантированные клетки рака легких, как функцию дней терапии пероральным и внутривенным (25 мг/кг/день) введением соединения изобретения по сравнению с введением только наполнителя. Фиг. 4 является столбчатой диаграммой, представляющей ингибирование индуцированной лазером хороидальной неоваскуляризации (CNV) у мышей, которым давали перорально соединение изобретения при дозе 50 мг/кг. Фиг. 5 является изображением ретинального эпителия у мышиной модели с индуцированной лазером CNV: по существу, круглая зона является разрушенным ретинальным пигментным эпителием (RPE) и оболочкой Бруха (ВМ). Белая зона показывает прорастание сосудов в лазерное пятно. На левой стороне показана контрольная сетчатка с сильным прорастанием новых сосудов, на правой стороне показана сетчатка только с небольшим (только у краев) прорастанием сосудов после обработки соединением изобретения. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение относится к производным хинолин-3-карбоновой кислоты, которые можно применять для лечения заболеваний и состояний, таких как рак, диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна, воспаление, "удар" (мозговое кровоизлияние), ишемия миокарда,атеросклероз, макулярный отек, псориаз и тому подобное у млекопитающих. Получение соединений изобретения находится вполне в пределах возможности специалиста в данной области. В качестве примера эфир хинолин-3-карбоновой кислоты можно получить способом в четыре стадии, в котором сначала подходящее производное анилина подвергают реакции с подходящим моно- или диэтиловым сложным эфиром, образованный промежуточный продукт циклизуют, получая при этом производное хинолин-4-ола, которое затем превращают в соответствующее галогенпроизводное, и, наконец, это производное подвергают реакции с подходящим амином с образованием эфира хинолин-3-карбоновой кислоты. Эфир хинолин-3-карбоновой кислоты затем гидролизуют, получая при этом соответствующую кислоту. Полный синтез иллюстрируется схемой реакции 1. Схема реакции 1 Что касается указанной выше последовательности реакций, выбор подходящих компонентов реакции, а также условий реакции вполне находится в пределах квалификации специалиста в данной области. Другой синтетический способ, применимый для получения соединений изобретения иллюстрируется на схеме реакции 2. В этом случае синтез начинают исходя из п-броманилина и амидную группу вводят на последней стадии. Итак, имеется несколько путей для получения соединений изобретения, в которых порядок введения групп R1, R2, R3 и R4 является хорошо известным специалисту в данной области. Термин "алкил", применяемый в контексте отдельно или как часть другой группы, относится к ациклическому радикалу с неразветвленной или разветвленной цепью, содержащему 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода в неразветвленной цепи, т.е. метиле, этиле, пропиле, бутиле, пентиле, гексиле,гептиле, октиле, нониле, дециле. Алкильная группа предпочтительно содержит 1, 2, 3 или 4 атома углерода в неразветвленной цепи, которая может быть также замещена 1, 2 или 3 атомами галогена, которые могут быть одинаковыми или разными и находятся в любом доступном положении, определяемом относительно каждого символа. Когда присутствует такая замещенная алкильная группа, предпочтительным галогеном является фтор, например в -CF3, -CHF2, -CH2F, -CHFCH2F и тому подобное. Если не указано иначе, термин "низший алкил", применяемый в контексте как часть другой группы,включает в себя как неразветвленные, так и разветвленные углеводороды, насыщенные или ненасыщенные, содержащие 1, 2, 3 или 4 атома углерода, такие как метил, этил, пропил, изопропил, бутил, третбутил или изобутил. Как указано в контексте выше, рассматриваемые алкильные группы могут быть ненасыщенными(алкенильными или алкинильными) углеводородными радикалами. Термин "алкенил", применяемый в контексте, отдельно или как часть другой группы, относится к радикалам с неразветвленной или разветвленной цепью с 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомами углерода,которые содержат по меньшей мере одну углерод-углеродную двойную связь. Предпочтительно присутствует одна углерод-углеродная двойная связь, такая как в виниле, 2-пропениле, 3-бутениле, 2-бутениле,4-пентениле, 3-пентениле, 2-гексениле, 3-гексениле, 2-гептениле, 3-гептениле, 4-гептениле, 3-октениле,3-нонениле, 4-децениле, 3-ундецениле, 4-додецениле и тому подобное с неразветвленной цепью. Алкенильная группа предпочтительно содержит 2, 3 или 4 атома углерода в неразветвленной цепи. Неразветвленная или разветвленная часть алкенильной группы может быть необязательно замещена 1, 2 или 3 атомами галогена, которые могут быть одинаковыми или разными, причем предпочтительным атомом галогена является фтор. Термин "алкинил", применяемый в контексте, отдельно или как часть другой группы, относится к радикалам с неразветвленной или разветвленной цепью с 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомами углерода и по меньшей мере одной углерод-углеродной тройной связью. Предпочтительно присутствует одна углерод-углеродная тройная связь в неразветвленной цепи, такой как 2-пропинил, 3-бутинил, 2-бутинил, 4 пентинил, 3-пентинил, 2-гексинил, 3-гексинил, 2-гептинил, 3-гептинил, 4-гептинил, 3-октинил, 3 нонинил, 4-децинил и тому подобное. Алкинильная группа предпочтительно содержит 2, 3 или 4 атома углерода в неразветвленной цепи. Неразветвленная часть алкинильной группы может быть необязательно замещена 1, 2 или 3 атомами галогена, которые могут быть одинаковыми или разными, причем предпочтительным атомом галогена является фтор. Применяемый в контексте отдельно или как часть другой группы термин "циклоалкил" включает в себя насыщенные циклические углеводородные группы или частично ненасыщенные (содержащие 1 или 2 двойные связи) циклические углеводородные группы, содержащие одно кольцо и всего 3, 4, 5, 6, 7, 8, 9,10, 11 или 12 атомов углерода, предпочтительно 3 или 4 атома углерода, образующих кольцо, которое включает в себя циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил,циклогексенил и тому подобное. Циклический углеводородный радикал может быть моно-, би- или три-4 018798 циклическим. Циклоалкильная группа может быть необязательно замещена 1, 2 или 3 атомами галогена,которые могут быть одинаковыми или разными, причем предпочтительным атомом галогена является фтор. Применяемый в контексте термин "гетероциклил" означает, если не оговорено иначе, неароматическую циклическую группу, содержащую один или несколько гетероатомов, предпочтительно выбранных из N, О и S, такую как азиридинил, азетидинил, дигидропиранил, дигидропиридил, дигидропирролил,диоксоланил, диоксанил, дитианил, дитиоланил, имидазолидинил, имидазолинил, морфолинил, оксетанил, оксиранил, пирролидинил, пирролидинонил, пиперидил, пиперазинил, пиперидинил, пиразолидинил, хинуклидинил, сульфалонил, 3-сульфоленил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридил, тиетанил, тииранил, тиоланил, тиоморфолинил, тритианил, тропанил, моносахарид и тому подобное. Термин "галоген" относится к атомам фтора, хлора, брома и иода. Применяемый в контексте термин "арил" означает ароматическую группу, такую как фенил или нафтил и тому подобное. Применяемый в контексте термин "гетероарил" означает моно-, би- или трициклическую гетероароматическую группу, содержащую один или несколько гетероатомов, предпочтительно выбранных из О, N и S, такую как пиридил, хинолинил, фуранил, тиенил, оксадиазолил, тиадиазолил, тиазолил, оксазолил, пиразолил, триазолил, тетразолил, изоксазолил, изотиазолил, изохинолинил, нафтиридинил, имидазолил, феназинил, фенотиазинил, фталазинил, индолил, пиридазинил, хиназолинил, хинолизинил, хиноксалинил, тетрагидроизохинолинил, пиразинил, индазолил, индолинил, пиримидинил, тиофенетил, пиранил, карбазолил, хроманил, циннолинил, акридинил, бензимидазолил, бензодиоксанил, бензодиоксепинил, бензодиоксолил, бензофуранил, бензотиазолил, бензобензоксадиазолил, бензоксазинил, бензоксазолил, бензоморфолинил, бензоселенадиазолил, бензотиенил, пуринил, птеридинил и тому подобное. Применяемый в контексте термин "замещенный" означает, если не оговорено иначе, что соединение или группа замещена по меньшей мере одним остатком, выбранным из насыщенного или ненасыщенного, разветвленного, неразветвленного или циклического низшего алкила, гидроксила, амина, сульфида, силила, галогена, нитрила, карбоновой кислоты, сульфоновой кислоты, низшего алкокси, замещенного низшим алкилом вторичного или третичного амина, (низший алкил)амидов, низших алкиловых простых эфиров, (низший алкил)кетона, (низший алкил)сульфида, низших эфиров карбоновой кислоты,низшего эфира сульфоновой кислоты, (низший алкил)сульфона, (низший алкил)сульфоксида, (низший алкил)сульфонамида, низшего алкилового спирта, (низший алкил)ацетила, ди(низший алкил)дисульфида и тому подобное. Таким образом, согласно первому аспекту изобретение относится к соединению формулы (I)R1 и R2 независимо выбраны из водорода, C1-4 алкила или С 3-4 циклоалкила;R4 представляет собой фенил, где указанный фенил необязательно замещен по меньшей мере одной группой R5 иR5 выбран из С 1-4 алкила и С 1-4 алкокси; а также его фармацевтически приемлемым солям. В одном варианте осуществления изобретения R1 и R2 независимо выбраны из водорода и С 1-4 алкила или С 3-4 циклоалкила. Например, R1 и R2 могут быть независимо выбраны из водорода и разветвленного или неразветвленного С 1-4 алкила, например водорода, метила, этила и пропила, в частности водорода и метила. В одном варианте осуществления по меньшей мере один из R1 и R2 не является водородом. В одном варианте осуществления R1 представляет собой водород и R2 не является водородом. В соединениях изобретения соединения формулы (I) R4 представляет собой замещенный или незамещенный фенил. Так, в одном варианте осуществления соединение формулы (I) может быть представлено формулой где R1, R2, R3 и n имеют значения, указанные выше, m равно 0-5, например 1-3 или 1-2, в частности 1; и R5 представляет собой заместитель, который имеет значения, указанные выше, и предпочтительно выбран из С 1-С 3 алкила и С 1-С 3 алкокси, такого как метил, этил, метокси и этокси, например метила и метокси. В одном варианте осуществления в соединении формулы (I') m равно 0 или 1, например 1. В одном конкретном варианте осуществления в соединении формулы (I') m равно 1 и R5 находится в пара-положении, т.е. соединение изобретения можно представить формулой (I") где R1, R2, R3, R5 и n имеют значения, указанные выше. В одном варианте осуществления соединение выбрано из 6-(метилкарбамоил)-4-[(4 метилфенил)амино]хинолин-3-карбоновой кислоты и 4-[(4-метоксифенил)амино]-6-(метилкарбамоил) хинолин-3-карбоновой кислоты или их фармацевтически приемлемых солей. Должно быть понятно, если не указано противоположное или очевидно из контекста, предполагается, что любая ссылка, сделанная в контексте на соединение формулы (I), относится также к соединению формулы (I') или (I"), эти две формулы являются вариантами осуществления, включенными в объем формулы (I). Соединения изобретения могут присутствовать в виде солей, которые также находятся в объеме данного изобретения. Предпочтительными являются фармацевтически приемлемые (т.е. нетоксичные,физиологически приемлемые) соли. Например, соединения изобретения могут образовывать кислотно-аддитивные соли, например, у функциональной аминогруппы. Их можно получить, например, с сильными неорганическими кислотами,такими как минеральные кислоты, например серная кислота, фосфорная кислота или галогеноводородная кислота; сильными органическими кислотами, такими как алканкарбоновые кислоты с 1-4 атомами углерода, которые являются незамещенными или замещенными, например, галогеном, например уксусная кислота, насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевая,малоновая, янтарная, малеиновая, фумаровая, фталевая или терафталевая кислота, гидроксикарбоновые кислоты, например аскорбиновая, гликолевая, молочная, яблочная, винная или лимонная кислота, аминокислоты (например, аспарагиновая или глутаминовая кислота или лизин или аргинин) или бензойная кислота, или органические сульфоновые кислоты, такие как (C1-C4)алкил- или арилсульфоновые кислоты, которые являются незамещенными или замещенными, например, галогеном, например метил- или птолуолсульфоновая кислота. При желании, можно также получить соответствующие кислотноаддитивные соли соединения, у которого дополнительно присутствует основный центр. Соединения формулы I, имеющие по меньшей мере одну кислотную группу (например, СООН), могут также образовывать соли с основаниями. Подходящими солями с основаниями являются, например,соли металлов, такие как соли щелочных металлов или соли щелочно-земельных металлов, например соли натрия, калия или магния, или соли с аммиаком или органическим амином, таким как морфолин,тиоморфолин, пиперидин, пирролидин, моно-, ди- или три(низший алкил)амин, например этил-, третбутил-, диэтил-, диизопропил-, триэтил-, трибутил- или диметилпропиламин, или моно-, ди- или тригидрокси(низший алкил)амин, например моно, ди- или триэтаноламин. Кроме того, можно получить соответствующие внутренние соли. Включены также соли, которые являются неподходящими для фармацевтических применений, но которые можно применять, например, для выделения или очистки свободных соединений формулы I или их фармацевтически приемлемых солей. Введение терапевтического агента изобретения включает в себя введение терапевтически эффективного количества агента изобретения. Термин "терапевтически эффективное количество", применяемый в контексте, относится к количеству терапевтического агента для лечения или профилактики состояния, излечимого введением композиции изобретения. Такое количество является количеством, достаточным для проявления поддающегося обнаружению терапевтического или профилактического или улучшающего состояние действия. Действие может включать в себя, например, лечение или профилактику перечисленных в контексте состояний. Точное эффективное количество для субъекта будет зависеть от размера (массы) и общего состояния субъекта, природы и тяжести подвергаемого лечению состояния, рекомендаций лечащего врача и лекарственных средств или комбинации лекарственных средств, выбранных для введения. Поэтому нельзя точно указать заранее точное эффективное количество. В случае перорального введения доза может, однако, варьировать от приблизительно 0,01 до приблизительно 1000 мг в день соединения формулы (I) или соответствующего количества его фармацевтически приемлемой соли. Композицию согласно изобретению можно изготовить для любого пути введения, например перорального, внутривенного, кожного или подкожного, назального, внутримышечного или внутрибрюшинного. Точная природа носителя или другого вещества будет зависеть от пути введения. Для парентерального введения применяют парентерально приемлемый водный раствор, который не содержит пирогены и имеет требуемое значение рН, требуемую изотоничность и стабильность. Специалисты в данной области вполне в состоянии приготовить подходящие растворы, многочисленные способы для этого описаны в литературе. Фармацевтически приемлемые эксципиенты, описанные в контексте, например наполнители, адъюванты, носители или разбавители, являются хорошо известными специалистам в данной области и легко коммерчески доступными. Фармацевтически приемлемым носителем может быть носитель, который является химически инертным в отношении активных соединений и который не обладает вредными побочными действиями или токсичностью в условиях применения. Примеры фармацевтических препаратов можно найти в Remington: The Science and Practice of Pharmacy. A. R. Gennaro, Editor. Lippincott, Williamsand Wilkins, 20th edition (2000). Рассматриваются все стереоизомеры соединений настоящего изобретения, либо в форме смеси, либо в чистой или, по существу, чистой форме. Соединения настоящего изобретения могут иметь асимметричные центры у любого из атомов углерода, включая любой атом углерода заместителей R. Следовательно, соединения формулы I могут существовать в энантиомерных или диастереомерных формах или в виде их смесей. В способах получения в качестве исходных веществ можно применять рацематы, энантиомеры или диастереомеры. Когда получают диастереомерные или энантиомерные продукты, их можно разделить общепринятыми способами, какими являются, например, хроматография или фракционная кристаллизация. Соединения согласно формуле (I) могут быть применимыми для лечения различных заболеваний,таких как рак, диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна, воспаление, "удар" (мозговое кровоизлияние), ишемия миокард, атеросклероз, макулярный отек и псориаз. Лечение может быть профилактическим, паллиативным или целебным. Соединения настоящего изобретения можно применять или вводить в комбинации с одним или несколькими дополнительными лекарственными средствами, применимыми при лечении гиперпролиферативных заболеваний, например, цитостатическим агентом. Компоненты могут быть в одном и том же препарате или в разных препаратах для введения одновременно или последовательно. Соединения настоящего изобретения можно также применять или вводить в комбинации с другим лечением, таким как лучевая терапия для лечения рака. Примерами цитостатических агентов для применения, указываемого в контексте выше, являются алкилирующие ДНК агенты, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, соединения, препятствующие синтезу РНК и ДНК, соединения, полимеризующие цитоскелет, и соединения, деполимеризующие цитоскелет. Изобретение иллюстрируется следующими неограничивающими примерами. Примеры Пример 1. Этил-6-(метилкарбамоил)-4-[(4-метилфенил)амино]хинолин-3-карбоксилат (промежуточный продукт)(а) Получение промежуточного соединения диэтилового эфира 2-[(4-бромфениламино)метилен] малоновой кислоты Микроволновый сосуд на 20 мл загружали 4-броманилином (6,881 г, 40,0 ммоль), диэтилэтоксиметиленмалонатом (8,650 г, 40,0 ммоль) и толуолом (5 мл). Сосуд закрывали колпачком и смесь нагревали микроволновым излучением при 150 С в течение 30 мин. После охлаждения раствор выливали на 50 мл энергично перемешиваемого изогексана. Образовывался плотный белый осадок и суспензию его перемешивали в течение еще 15 мин. Суспензию фильтровали и продукт промывали 20 мл изогексана. Продукт сушили в вакууме, получая при этом 11,678 г (85%) диэтилового эфира 2-[(4 бромфениламино)метилен]малоновой кислоты. МС (ESI+) m/z 342, 344 (МН+).b) Получение промежуточного соединения этилового эфира 6-бром-4-хлорхинолин-3-карбоновой кислоты Микроволновый сосуд на 20 мл загружали диэтиловым эфиром 2-[(4-бромфениламино)метилен] малоновой кислоты (1,711 г, 5,0 ммоль) и POCl3 (фосфорилхлорид, 10,0 мл, 16,8 г, 109 ммоль). Сосуд закрывали колпачком и смесь нагревали микроволновым излучением ступенчатым образом до 180 С(велось наблюдение за давлением) на протяжении 5 мин и затем смесь выдерживали при 180 С в течение 30 мин. Избыточный POCl3 выпаривали и остаток распределяли между CH2Cl2 (40 мл) и 2 н. NaOH (водный) (40 мл). Водный слой экстрагировали CH2Cl2 (240 мл). Органические слои объединяли, сушилиNa2CO3 и упаривали. Остаток очищали на колонке (силикагель, CH2Cl2 в качестве элюента). Чистые фракции объединяли, упаривали и остаток сушили в вакууме, получая при этом 0,821 г (52%) этилового эфира 6-бром-4-хлорхинолин-3-карбоновой кислоты. МС (ESI+) m/z 314, 316 (МН+). с) Получение промежуточного соединения, этилового эфира 6-бром-4-п-толиламинохинолин-3 карбоновой кислоты Микроволновый сосуд на 20 мл загружали этиловым эфиром 6-бром-4-хлорхинолин-3-карбоновой кислоты (0,786 г, 2,50 ммоль), п-толуидином (0,268 г, 2,50 ммоль) и сухим 1,4-диоксаном (15 мл). Сосуд закрывали колпачком и смесь нагревали микроволновым излучением при 150 С в течение 30 мин. После охлаждения образовывался желтый осадок. Суспензию выливали на 2 н. NaOH (водный) (100 мл) и водный слой экстрагировали CH2Cl2 (380 мл). Органические слои объединяли и промывали Н 2 О (100 мл),сушили MgSO4 и упаривали. Остаток очищали на колонке (силикагель, изогексан/EtOAc, 1:1). Чистые фракции объединяли, упаривали и остаток сушили в вакууме, получая при этом 0,748 г (78%) этилового эфира 6-бром-4-п-толиламинохинолин-3-карбоновой кислоты. МС (ESI+) m/z 385, 387 (МН+).d) Микроволновый сосуд на 2 мл загружали этиловым эфиром 6-бром-4-п-толиламинохинолин-3 карбоновой кислоты (0,100 ммоль), палладациклом Херрманна (транс-ди-(-ацетато)бис-[о-(ди-отолилфосфино)бензил]дипалладий(II), 4,7 мг, 0,0050 ммоль), [(t-Bu)3PH]BF4 (5,9 мг, 0,020 ммоль),Мо(СО)6 (52,8 мг, 0,20 ммоль), 1,5 экв. метиламина (2 М раствор в ТГФ) и сухим ТГФ (1,0 мл). Наконец,добавляли DBU (1,8-диазабицикло[5.4.0]ундец-7-ен, 0,045 мкл, 0,30 ммоль) и сосуд сразу закрывали тефлоновой мембраной и подвергали микроволновому излучению в течение 5 мин при 130 С. Летучие компоненты удаляли при пониженном давлении и остаток очищали колоночной хроматографией, получая при этом этил-6-(метилкарбамоил)-4-[(4-метилфенил)амино]хинолин-3-карбоксилат. Пример 2. 6-Метилкарбамоил-4-п-толиламинохинолин-3-карбоновая кислота Этил-6-(метилкарбамоил)-4-[(4-метилфенил)амино]хинолин-3-карбоксилат гидролизовали в основных условиях с применением NaOH (водного). Конечный продукт очищали колоночной хроматографией. Пример 3. Этил-4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоксилат (промежуточный продукт)(а) Получение промежуточного соединения диэтилового эфира 2-[(4-бромфениламино)метилен] малоновой кислоты 4-Броманилин (10 г, 0,058 моль) и 12,58 г диэтоксиметиленмалоната (1 экв.) нагревали при 150 С в течение 3 ч в герметизированной трубке. Реакционную смесь затем охлаждали и разбавляли гексаном, в результате чего осаждался твердый продукт. Это твердое вещество отделяли фильтрованием, промывали несколько раз гексаном и сушили в вакууме, получая при этом 17,8 г (89%) диэтилового эфира 2-[(4 бромфениламино)метилен]малоновой кислоты. 1 Н ЯМР (300 МГц, CDCl3)11,03 (d, 1H, J=13 Гц, -NH-), 8,48 (d, 1 Н, J=13 Гц, -CH=C), 7,49 (м, 2H,ароматический), 7,10-7,01 (м, 2 Н, ароматический), 4,42-4,22 (м, 4 Н, -CH2-CH3), 1,45-1,26 (м, 6 Н, -CH2CH3); ЖХ-МС (m/z) 343,9 (М+1).b) Получение промежуточного соединения этилового эфира 6-бром-4-хлорхинолин-3-карбоновой кислоты(фосфорилхлорид, 31,5 мл) при 150 С в герметизированной трубке в течение приблизительно 6 ч. Избыточный POCl3 удаляли роторным испарителем и неочищенную смесь разбавляли дихлорметаном. Экстракт в дихлорметане промывали 10% раствором NaOH, сушили над сульфатом натрия и очищали колоночной хроматографией (силикагель, гексан/этилацетат, 80:20), получая при этом 2,3 г (50%) этилового эфира 6-бром-4-хлорхинолин-3-карбоновой кислоты. 1(с) Получение промежуточного соединения этил-6-бром-4-[(4-метоксифенил)амино]хинолин-3 карбоксилата п-Анизидин (0,43 г) и этиловый эфир 6-бром-4-хлорхинолин-3-карбоновой кислоты (1 г) смешивали в диоксане и нагревали в микроволновом реакторе при 150 С в течение 30 мин. Реакционную смесь разбавляли петролейным эфиром. Образованный твердый продукт отделяли фильтрованием и сушили, получая при этом 1,3 г (100%) этил-6-бром-4-[(4-метоксифенил)амино]хинолин-3-карбоксилата. 1(d) Этил-6-бром-4-[(4-метоксифенил)амино]хинолин-3-карбоксилат (0,25 г, 0,623 ммоль) добавляли к ТГФ с последующим добавлением палладацикла Херрманна (транс-ди-(-ацетато)бис-[о-(ди-отолилфосфино)бензил]дипалладий(II), 0,031 ммоль), [(t-Bu)3PH]BF4 (тетрафторборат три-третбутилфосфония, 0,125 ммоль), Мо(СО)6 (гексакарбонилмолибден, 1,246 ммоль), метиламина (1,5 экв., 2 н. раствор в ТГФ) и DBU (1,8-диазабицикло[5.4.0]ундец-7-ен, 1,869 ммоль). Реакционную смесь нагревали при 130 С в течение 5 мин в микроволновом реакторе. Реакционную смесь концентрировали и затем очищали на колонке (силикагель, дихлорметан/метанол, 98:2), получая при этом 0,25 г (71%) этил-4-[(4 метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоксилата. Этил-4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоксилат (0,2 г) перемешивали с LiOH (85,5 мг) в 6 мл смеси МеОН:ТГФ:Н 2 О (2:2:2) на протяжении ночи. Реакционную смесь концентрировали и водный слой промывали этилацетатом. Водные слои объединяли и подкисляли водным HCl и образованный осадок отделяли фильтрованием и сушили, получая при этом 0,142 г (60%) 4-[(4 метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоновой кислоты. 1(25 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. После водной обработки реакционную смесь экстрагировали, концентрировали и сушили над безводным сульфатом натрия, получая при этом сырой продукт, которые позже очищали колоночной хроматографией, получая при этом 0,05 г (выход 55%) бутил-4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3 карбоксилат. 1 К суспензии 0,1 г 4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоновой кислоты в дихлорметане добавляли EDCHCl (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, 0,161 г), HOBt (N-гидроксибензотриазол, 0,042 г), DMAP (4-диметиламинопиридин, 0,17 г) и 20 мл метанола и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. После водной обработки реакционную смесь экстрагировали, концентрировали и сушили над безводным сульфатом натрия, получая при этом сырой продукт, который позже очищали колоночной хроматографией, получая при этом 0,062 г (60%) метил-4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоксилата. 1 Биологические испытания Анализ интегринов Этот анализ проводили Biodesy (Burlingame, California, USA). Очищенные интегрины получали из университетских и коммерческих источников. -51 и -v3 получали из университетских источников в виде рекомбинантных растворимых белков (внеклеточный домен). Протокол стандартного мечения, разработанный для интегринов, применяли для каждого из трех белков. Все белки успешно метили при среднем отношении метка:белок 4:1. Два растворимых меченых белка (-51 и -v3) продуцировали фоновые сигналы SHG (вторичная гормоновая генерация). Они вызвали также сигналы конформационного изменения при воздействии на них GRGDSP (RGD-пептид,полученный из фибронектина пептид Gly-Arg-Gly-Asp-Ser-Pro). Пептид добавляли при концентрации 400 мкМ, и изменения сигналов были немедленными (фиг. 1). Затем соединение примера 4 преинкубировали при 100 мкМ с мечеными белками в течение 20 мин. Затем добавляли пептид RGD (400 мкМ) для стимуляции белка и испытания каждого соединения на ингибирование. Соединение примера 4 предотвращало RGD-индуцированное конформационное изменение в -5-1 и поэтому является эффективным ингибитором RGD-индуцированного конформационного изменения. С другой стороны, соединение примера 4 не оказывало влияния на -v3, когда конформационное изменение в белке было очевидным (фиг. 2). Модель опухолевого ксенотрансплантата 6-Недельных самок мышей SCID применяли для изучения опухолей. Приблизительно 106 клеток рака легкого Calu-6 человека, растущих в логарифмической фазе, собирали и ресуспендировали в среде и раствор отдельных клеток в объеме 100 мл имплантировали подкожно в правый бок каждого животного. 10 мышей применяли в группах обработки и 10 мышей применяли в контрольных группах. Системную обработку пероральным введением или внутривенными инъекциями либо 100 мкл наполнителя, либо активного вещества (25 мг/кг/день) начинали, когда опухоли достигали размера 300 мм 3 и продолжали по одному разу ежедневно в течение всего 17 дней. Видимые опухоли присутствовали через 5-10 дней после имплантации. Первичные опухоли измеряли штангенциркулями в указанные дни. Объемы опухолей вычисляли, как описано, согласно формуле: длинаширина 20,52. Соединение примера 4 вводили (внутривенное и пероральное введение, 25 мг/кг/день) мышам, которые обнаруживали убедительные результаты по эффективности соединения на этой животной модели (фиг. 3). Соединение изобретения обладает сильным противоопухолевым действием при ингибировании объема опухоли на 52% для пероральной обработки и 71% для внутривенной обработки. Соединение изобретения значительно ингибирует также развитие кровеносных сосудов в обеих группах. Индуцированная лазером модель CNV глаза мыши В этой модели соединение примера 4, применяемое отдельно, значительно ингибировало рост CNV(хороидальнную неоваскуляризацию) глаза, 42%, по сравнению с контролем при введении перорально 50 мг/кг/день (фиг. 4 и 5). Эта индуцированная лазером CNV является в высокой степени репродуцируемой моделью, которая имитирует многие характерные черты CNV, имеющую место во влажной форме связанной с возрастом дегенерации желтого пятна (AMD), основной причины слепоты в пожилом возрасте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R1 и R2 независимо выбраны из водорода, С 1-4 алкила и С 3-4 циклоалкила;R4 представляет собой фенил, где указанный фенил необязательно замещен по меньшей мере одной группой R5; и R5 выбран из С 1-4 алкила и С 1-4 алкокси; и его фармацевтически приемлемые соли. 2. Соединение по п.1, где R1 и R2 представляют собой независимо водород или C1-4 алкил. 3. Соединение по п.2, где R1 и R2 представляют собой независимо водород или метил. 4. Соединение по любому из пп.1-3, где R1 представляет собой Н. 5. Соединение по любому из пп.1-4, где R5 выбран из С 1-3 алкила и С 1-3 алкокси. 6. Соединение по п.5, где R5 выбран из метила и метокси. 6-(метилкарбамоил)-4-[(4-метилфенил)амино]хинолин-3-карбоновой кислотой или ее фармацевтически приемлемой солью. 8. Соединение по п.6, которое является 4-[(4-метоксифенил)амино]-6-(метилкарбамоил)хинолин-3-карбоновой кислотой или ее фармацевтически приемлемой солью. 9. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли в антиангиогенной терапии. 10. Фармацевтическая композиция для лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза, содержащая терапевтически эффективное количество соединения по любому из пп.1-8 или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый эксципиент. 11. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза,макулярного отека и псориаза. 12. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния), ишемии миокарда, атеросклероза, макулярного отека и псориаза. 13. Способ терапевтического лечения заболевания, выбранного из рака, диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна, воспаления, "удара" (мозгового кровоизлияния),ишемии миокарда, атеросклероза, макулярного отека и псориаза, путем введения терапевтически эффективного количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в этом.
МПК / Метки
МПК: C07D 215/54, A61P 35/00, A61K 31/4706
Метки: применение, хинолина, производные
Код ссылки
<a href="https://eas.patents.su/15-18798-proizvodnye-hinolina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина и их применение</a>
Предыдущий патент: Непрерывный способ этерификации жирных кислот гетерогенным катализом
Следующий патент: Устройство для подачи рабочей жидкости противовыбросового превентора
Случайный патент: Основанные на биполярных транзисторах с изолированным затвором/полевых транзисторах устройство, система и способ энергосбережения