Соединения фосфиновой аминокислоты и содержащие их фармацевтические композиции
Номер патента: 12447
Опубликовано: 30.10.2009
Авторы: Жюлльен Никола, Див Винсан, Йотакис Атанасиос, Макаритис Анастасиос, Скальбер Элизабет
Формула / Реферат
1. Соединения формулы (I)
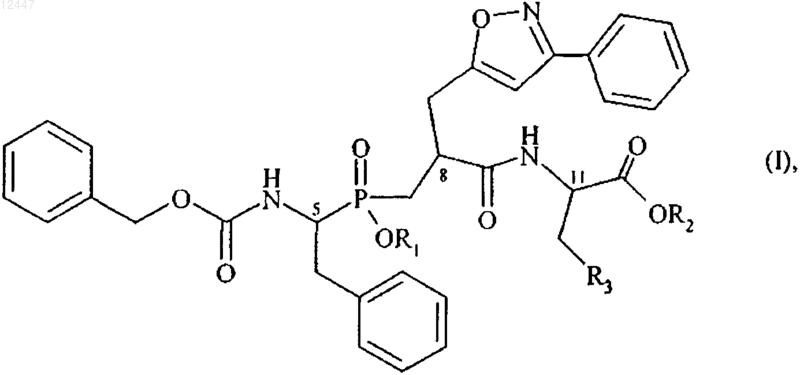
в которой
R1 представляет собой атом водорода или группу, выбранную из (С1-C6)алкилкарбонилокси-(С1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлённым, и (С1-C6)алкилкарбонилтио-(С1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлённым,
R2 представляет собой атом водорода или группу, выбранную из (С1-C6)алкилкарбонилокси-(С1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлённым, арилкарбонилтио-(С1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлённым, и арил-(С1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлённым, и арильный остаток которого необязательно замещён (С1-C6)алкилкарбонилоксигруппой,
R3 представляет собой фенильную группу, необязательно замещённую гидроксигруппой, или R3 представляет собой 3-индолильную группу, или
R1 также может представлять собой линейную или разветвлённую (C1-C6)алкильную группу и R2 представляет собой линейную или разветвлённую (С1-C6)алкильную группу, когда R3 представляет собой фенильную группу, замещённую гидроксигруппой,
их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием и их гидраты и сольваты.
2. Соединения формулы (I) по п.1, отличающиеся тем, что R1 и R2 каждый представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием.
3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, что R1 представляет собой атом водорода и R3 представляет собой фенильную группу, замещённую гидроксигруппой, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием.
4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что R2 представляет собой атом водорода и R3 представляет собой фенильную группу, замещённую гидроксигруппой, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием.
5. Соединения формулы (I) по п.1, которые представляют собой
(5R,8R,11S)-5-бензил-6-гидрокси-11-(1H-индол-3-илметил)-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,
(5R,8R,11S)-5,11-дибензил-6-гидрокси-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,
(5R,8R,11S)-5-бензил-6-гидрокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,
их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием.
6. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение по любому из пп.1-5 в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями.
7. Фармацевтические композиции по п.6, используемые при получении лекарственного средства для лечения артериальной гипертензии и её осложнений, включая лёгочную артериальную гипертензию, ишемии миокарда, стенокардии, сердечной недостаточности, васкулопатии, нефропатии, диабетических ретинопатий, атеросклероза и рестеноза после пластической операции на сосудах, острой или хронической почечной недостаточности, цереброваскулярных заболеваний, включая инсульт и субарахноидальное кровоизлияние, и периферической ишемии.
Текст
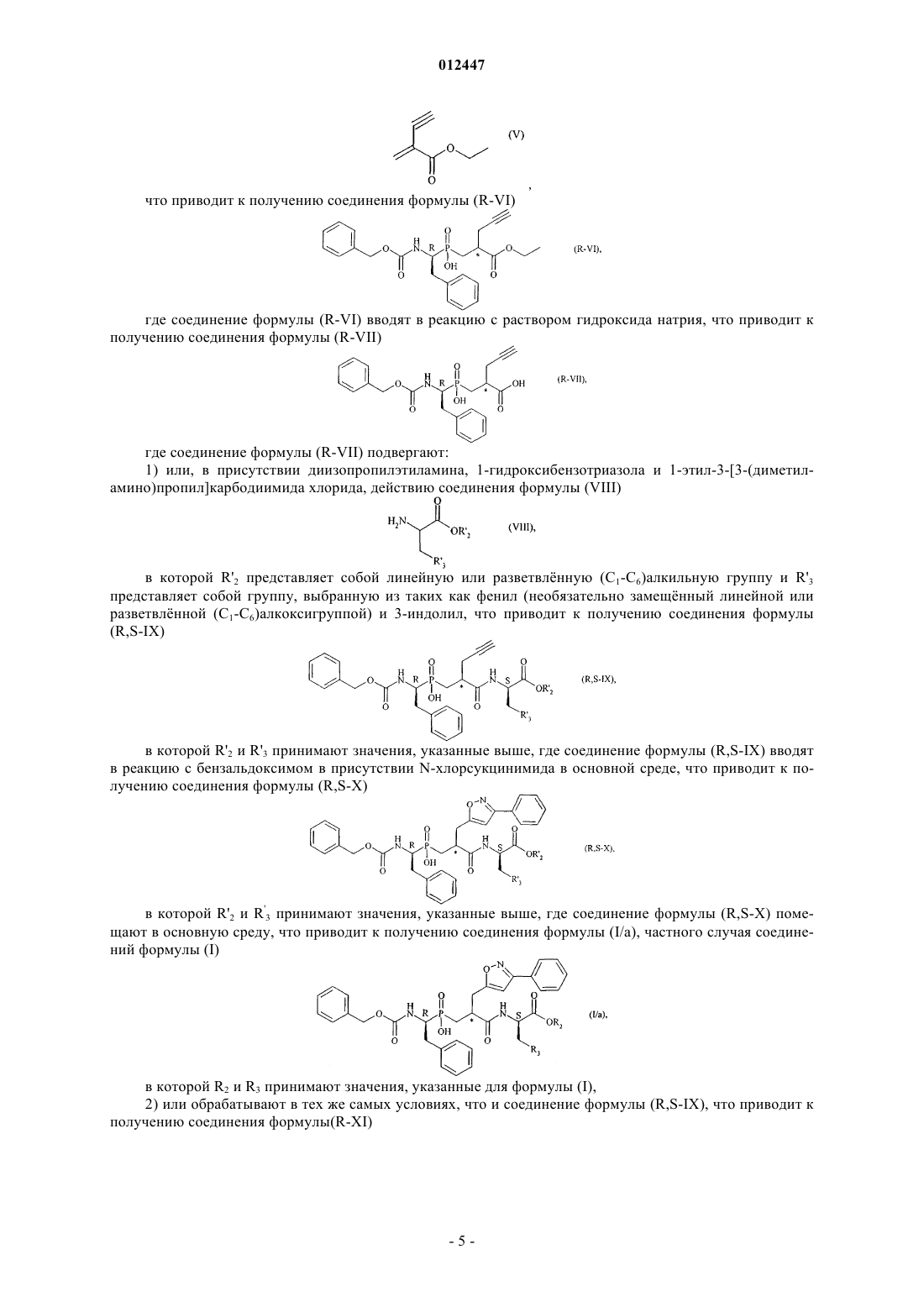
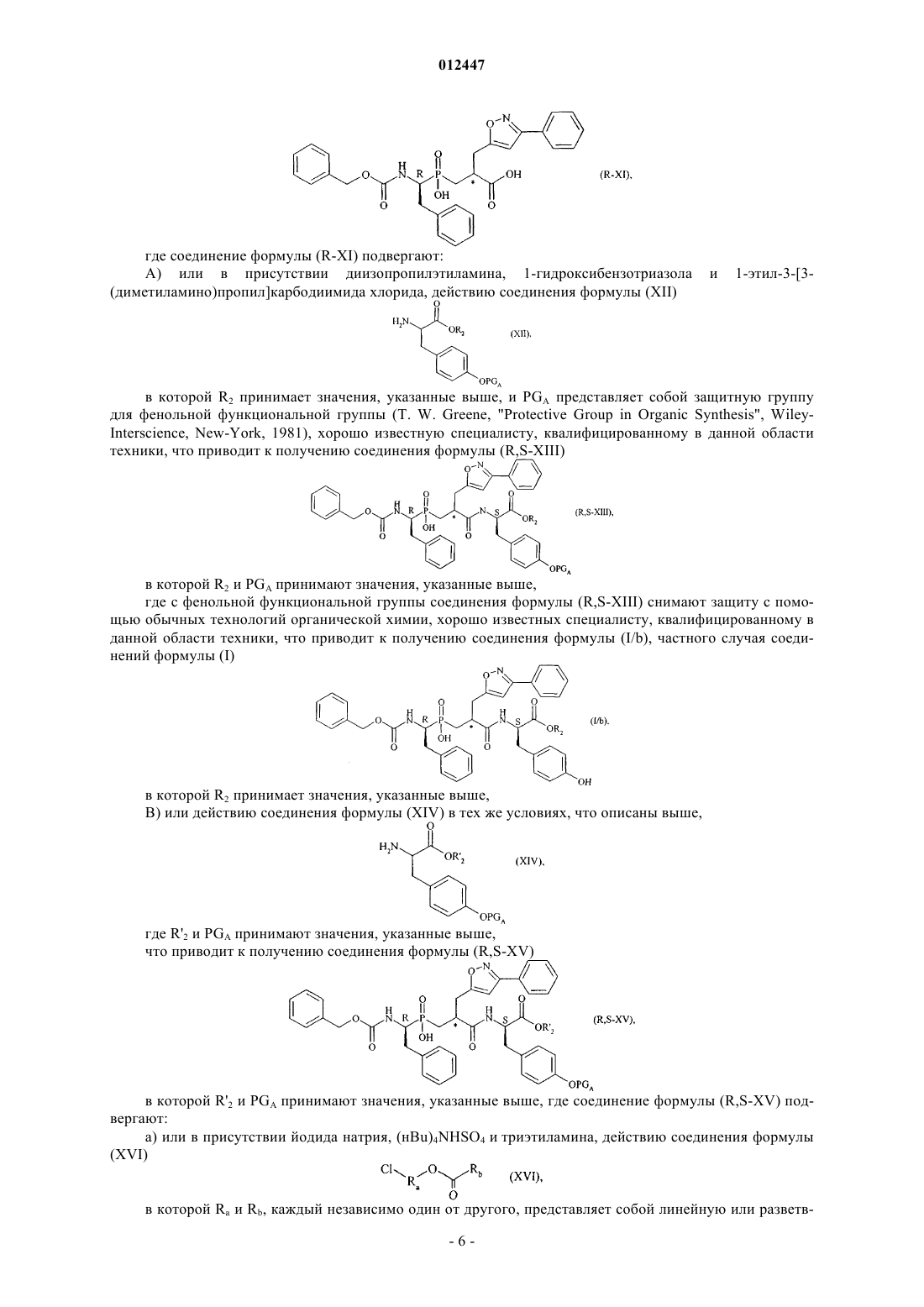
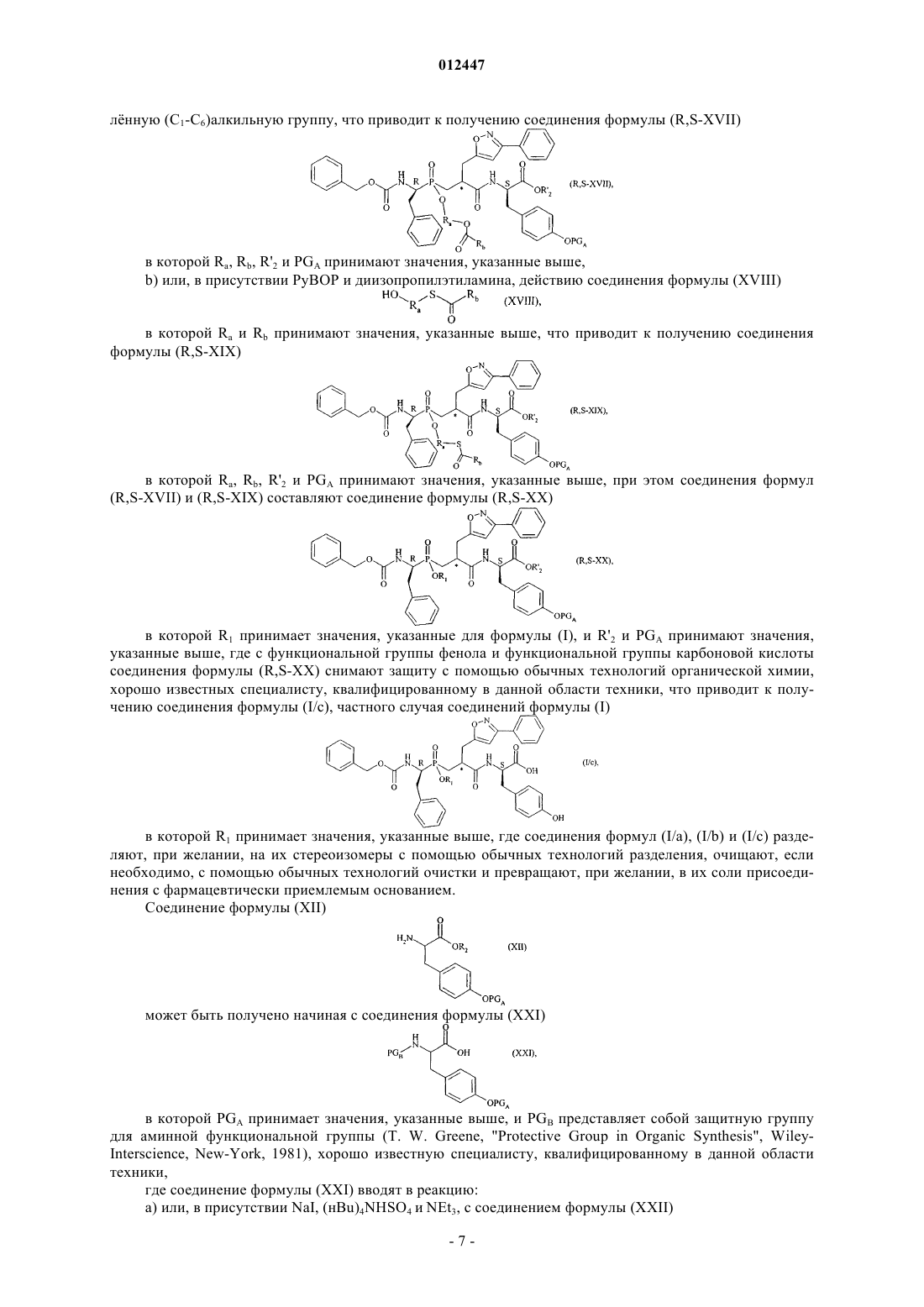
012447 Настоящее изобретение относится к новым соединениям фосфиновой аминокислоты, к способу их получения и к фармацевтическим композициям, содержащим их. Новые соединения фосфиновой аминокислоты в соответствии с данным изобретением имеют замечательное свойство одновременно ингибировать ангиотензин I - превращающий фермент (АСЕ) и эндотелин - превращающий фермент (ЕСЕ). Баланс, который существует между вазоактивными пептидами вазоконстрикторами (ангиотензин II,эндотелин-1), с одной стороны, и вазодилататорами (натрийуретические факторы, брадикинин), с другой стороны, составляет важный элемент в регулировании артериального давления. Синтез и разложение этих пептидов находятся под контролем различных ферментов, среди которых три цинк металлопротеазы, как считается, играют преобладающую роль: ангиотензин I - превращающий фермент (АСЕ), который, с одной стороны, превращает ангиотензинI, неактивный декапептид, в ангиотензин II, активный октапептид, и, с другой стороны, разлагает брадикинин в неактивные пептиды,эндотелин - превращающий фермент (ЕСЕ), который расщепляет большой эндотелин-1 с образованием эндотелина-1 и, кажется, принимает участие в меньшей степени в разложении брадикинина,нейтральная эндопептидаза (NEP), которая инактивирует атриальный натрийуретический пептид(ANP) и брадикинин с образованием неактивных пептидов. Ангиотензин II представляет собой вазоконстриктор и антинатрийуретический октапептид. Эндотелины представляют собой вазоконстриктор и антинатрийуретические полипептиды, состоящие из приблизительно двадцати аминокислот, которые содержат два дисульфидных мостика, связывающих цистеиновые остатки. Брадикинин представляет собой вазодилататор и натрийуретический нонапептид. Ангиотензин II, эндотелин и брадикинин представляют собой наиболее важные полипептиды, которые ранее считались вовлечнными в регулирование тонуса сосудов, сердечно-сосудистую коррекцию и гидроэлектролитический гомеостаз. Их метаболизм, главным образом, контролируется тремя ферментами АСЕ, ЕСЕ и NEP. Артериальная гипертензия и также другие сердечно-сосудистые патологии характеризуются нарушением равновесия в пептидном балансе в сторону вазоконстрикторных пептидов, которые оказывают общее неблагоприятное действие в рено-сердечно-сосудистой сфере (удерживание воды и натрия, сердечно-сосудистая гипертрофия и т. д.). Несмотря на основные терапевтические достижения, сделанные в 1980-х с помощью селективных АСЕ ингибиторов, разработка новых соединений была признана необходимой для того, чтобы ещ более улучшить контроль кровяного давления пациентов с гипертензией, а также их продолжительность жизни (благоприятное действие на основные сердечно-сосудистые факторы риска). Три металлопротеазы АСЕ, ЕСЕ и NEP соответственно кажутся многообещающими целями для лечения сердечно-сосудистых болезней. Поэтому, для того, чтобы побороть неблагоприятные вазоконстрикторные эффекты ангиотензина II и эндотелина-1 и промотировать защитные вазодилататорные эффекты ANP и брадикинина, были разработаны АСЕ, NEP и ЕСЕ ингибиторы. Известно большое количество соединений, имеющих одну или другую из этих активностей. Многочисленные патентные публикации описывают соединения аминокислоты, которые являются полезными в качестве АСЕ и ЕСЕ ингибиторов и полезными в качестве смешанных ACE/NEP иECE/NEP ингибиторов. Селективные АСЕ ингибиторы, которые используются как антигипертензивные вещества в течение нескольких лет, описаны в описании патента US 4396772. Формулы описанных соединений включают: Описания патентов WO 97/32874 и US 5476847 раскрывают соединения, которые представляют собой ЕСЕ ингибиторы. Формулы описанных соединений включают в описании патента WO 97/32874-1 012447 В соответствии с патентной заявкой WO 95/35302 известны определнные соединения фосфиновой кислоты, которые имеют ЕСЕ ингибиторную активность, полезную в лечении сердечно-сосудистых болезней. Формулы описанных соединений включают Смешанные ACE/NEP ингибиторы (класс "ингибиторов вазопептидазы") также синтезированы и клинически протестированы. Смешанные ACE/NEP ингибиторы описаны в патентных описаниях WO 97/24341, WO 96/22998,WO 93/08142 и ЕР 0723974. Описанные соединения представляют собою сульфурированные производные пептидов. В Bioorganic and Medical Chemistry Letters, 1996, 6 (11), 1257-1260, описаны соединения фосфиновой кислоты, которые имеют смешанную ACE/NEP ингибиторную активность, полезную в лечении сердечно-сосудистых болезней. Формулы указанных соединений включают Указанные соединения имеют антигипертензивную эффективность, которая больше, чем эффективность селективных АСЕ ингибиторов. Тем не менее, они имеют основные вторичные эффекты, в особенности, касающиеся ангионевротического отека, вполне вероятно связанного с избытком брадикинина(Trends in Pharmacological Sci., 2001, 22, 106-109; The Lancet, 2001, 358, 1525-1532). Это привело к приостановке клинической разработки наиболее прогрессивных смешанных ACE/NEP ингибиторов, таких как омапатрилат (omapatrilate) (Curr Opin Investig Drugs, 2001, 2, 1414-1422). Фармакологические свойства смешанных ACE/NEP ингибиторов, описанных в предыдущем уровне техники, не придают значения основной сердечно-сосудистой роли эндотелиновой системы (Journal of Hypertension, 1998, 16 (8), 10811098), а также вовлечению NEP в разложение эндотелина-1 (J. Biol. Chem., 1990, 265, 14150-14155). Соответственно, лечение, используя смешанные ACE/NEP ингибиторы, имеет следствием повышение уровня эндотелина-1, которое в течение длительного времени может оказаться вредным для ожидаемых терапевтических благоприятных эффектов. Наконец, смешанные ECE/NEP ингибиторы описаны в Life Sciences, 2000, 67 (9), 1025-1033 иNaunyn-Schmiedeberg's Arch. Pharmacol, 358 (1, suppl 1): R 513-514 (Abstr). Формулы указанных соединений представляют собой: в Life Sciences Заинтересованность в наличии смешанных ECE/NEP ингибиторов заключается в том, чтобы снизить уровень эндотелина, при этом повышая уровень натрийуретических пептидов и, соответственно,получить суммарный или синергетический эффект, который является благоприятным для лечения сердечно-сосудистых и почечных болезней. Тем не менее, так как NEP представляет собой одного из самых важных участников в разложении брадикинина in vivo, клиническая остановка, обеспеченная ACE/NEP ингибиторами, также безусловно аннулировала развитие других множественных ингибиторов вазопептидаз, включая комбинированное ингибирование NEP, а именно смешанных ECE/NEP или тройных ECE/ACE/NEP ингибиторов.-2 012447 С другой стороны, альтернативой смешанных АСЕ/ЕСЕ ингибиторов остатся многообещающее,дающее возможности ожидание повышенной сердечно-сосудистой эффективности и хорошей безопасности применения. Такие соединения должны делать возможным снижение образования двух мощных вазоконстрикторных пептидов, ангиотензина II и эндотелина-1, и повышение уровней брадикинина до приемлемой степени. Более того, интересно отметить, что хотя ангиотензиновая и эндотелиновая системы функционируют независимо, они также могут функционировать согласованно. Это "взаимное влияние" между двумя системами было исследовано на экспериментальном уровне, а также на клиническом уровне. Роль эндотелина-1 в качестве медиатора определнных сердечно-сосудистых эффектов ангиотензина II была особенно исследована (Hypertension, 1997, 30, 29-34; Cardiovasc. Res., 1999, 43, 300-307; Hypertension, 2002,40, 840-846; Clin. Exp. Pharmacol. Physiol., 2003, 30, 278-283; Hypertension, 2002, 39, 715-720; Hypertension, 2003, 42, 825-830; Bioorg. Med. Chem. Letters, 2003, 13, 1093-1096). В целом полученные данные предполагают, что ингибирование одной из указанных систем приводит к гиперактивности другой системы, которая способствует методу "смешанного ингибирования" для того, чтобы усилить терапевтический потенциал каждого из этих свойств, при этом избегая обратного регулирования. Наконец, доказательство концепции смешанного АСЕ/ЕСЕ ингибирования, то есть, так сказать, терапевтического благоприятного эффекта, ожидаемого для этого подхода, ранее проанализировано на экспериментальном уровне, в трх терапевтических направлениях: артериальная гипертензия, сердечная недостаточность и почечная защита. Доказательство указанной концепции в основном обеспечивается объединением двух селективных соединений: с одной стороны, селективного АСЕ ингибитора или ангиотензин II AT1 рецепторного блокатора для блокирования ангиотензиновой системы и, с другой стороны, эндотелии-1 ETA рецепторного блокатора или смешанного эндотелин-1 ETA/ETB рецепторного блокатора или, в редких случаях, ЕСЕ ингибитора для блокирования эндотелина. В литературе оказана большая поддержка данной концепции. Терапевтические положительные эффекты продемонстрированы у животных или на структурном уровне или на функциональном уровне в артериальной гипертензии (J Cardiovasc Pharmacol, 2000, 36, S337 - S341; Clin Sci., 2002, 103, 363S - 366S;Am J Hypertens., 2003, 16, 324-328) и сердечной недостаточности (Cardiovasc. Res., 2002, 54, 85-94; Circulation, 2002, 106, 1159-1164). Ожидается сильная защита определнных целевых органов, таких как почка и мозг (J. Am. Soc. Nephrol., 2001, 12, 2572-2584). Клиническое отображение всех этих предклинических результатов могло бы обеспечить нормализацию большего числа пациентов с помощью смешанного лечения. Возможно, что положительный эффект на "кровяное давление", в течение продолжительного времени, будет дополняться более хорошей защитой целевых органов артериальной гипертензии (т. е. предотвращение "поражения целевого органа" на сердечно-сосудистом, почечном и мозговом уровнях), а также положительными эффектами на определнные факторы риска, таким образом, предотвращая осложнения артериальной гипертензии. Цель настоящего изобретения заключается в обеспечении новых соединений, которые ведут себя как смешанные АСЕ/ЕСЕ ингибиторы, не оказывая никакого ингибирующего действия на NEP. Соответственно, соединения настоящего изобретения являются очень эффективными в лечении артериальной гипертензии и е осложнений, включая такие как лгочная артериальная гипертензия, ишемия миокарда, стенокардия, сердечная недостаточность, васкулопатии, нефропатии, диабетические ретинопатии, атеросклероз и рестеноз после пластической операции на сосудах, острая или хроническая почечная недостаточность, цереброваскулярные заболевания, включая инсульт и субарахноидальное кровоизлияние, и периферическая ишемия. В частности, настоящее изобретение относится к соединениям формулы (I)R1 представляет собой атом водорода или группу, выбранную из таких как: (C1-C6)алкилкарбонилокси-(С 1-C6)алкил, где каждый алкильный остаток может быть линейным или разветвлнным, и(С 1-C6)алкилкарбонилтио-(С 1-C6)алкил, где каждый алкильный остаток может быть линейным или разветвлнным, R2 представляет собой атом водорода или группу, выбранную из таких как (C1-C6)алкилкарбонилокси-(C1-C6)алкил, где каждый алкильный остаток может быть линейным или разветвлнным,арилкарбонилтио-(C1-C6)алкил, где каждый алкильный остаток может быть линейным или разветвлнным, и арил-(С 1-C6)алкил, где каждый алкильный остаток может быть линейным или разветвлнным, и-3 012447 арильный остаток которого необязательно замещн с помощью (С 1-C6)алкилкарбонилоксигруппы,R3 представляет собой фенильную группу, необязательно замещнную гидроксигруппой, или R3 представляет собой 3-индолильную группу, илиR1 также может представлять собой линейную или разветвлнную (C1-C6)алкильную группу и R2 представляет собой линейную или разветвлнную (C1-C6)алкильную группу, когда R3 представляет собой фенильную группу, замещнную гидроксигруппой, к их энантиомерам и диастереоизомерам, а также к их солям присоединения с фармацевтически приемлемым основанием, и к их гидратам и сольватам. Из числа фармацевтически приемлемых оснований можно отметить, не подразумевая никакого ограничения, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. В соответствии с предпочтительным воплощением данного изобретения предпочтительные соединения представляют собой соединения, в которых R1 и R2 каждый представляет собой атом водорода. В соответствии со вторым предпочтительным воплощением данного изобретения, предпочтительные соединения представляют собой соединения, в которых R1 представляет собой атом водорода и R3 представляет собой фенильную группу, замещнную гидроксигруппой. В соответствии с третьим предпочтительным воплощением данного изобретения, предпочтительные соединения представляют собой соединения, в которых R2 представляет собой атом водорода и R3 представляет собой фенильную группу, замещнную гидроксигруппой. Среди предпочтительных соединений данного изобретения можно отметить, в частности:(5R,8R,11S)-5-бензил-6-гидрокси-11-(1H-индол-3-илметил)-3,9-диоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,(5R,8R,11S)-5,11-дибензил-6-гидрокси-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2 окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,(5R,8R,11S)-5-бензил-6-гидрокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Энантиомеры, диастереоизомеры и соли присоединения с фармацевтически приемлемым основанием, предпочтительных соединений образуют неотъемлемую часть данного изобретения. Настоящее изобретение также относится к способу получения соединений формулы (I), где способ характеризуется тем, что в качестве исходного материала используют дифенилметанамина хлорид, который вводят в реакцию с фенилацетальдегидом в присутствии фосфиновой кислоты, Н 3 РО 2 и соляной кислоты, что приводит к получению соединения формулы (II) где соединение формулы (II) подвергают действию водной бромисто-водородной кислоты, что приводит к получению соединения формулы (III) где соединение формулы (III) вводят в реакцию с бензил хлорформиатом в основной среде, что приводит к получению соединения формулы (IV) где соединение формулы (IV) смешивают с R-(+)-N,N-(фенил)(этил)амином и затем подвергают действию соляной кислоты, что приводит к получению соединения формулы (R-IV), R энантиомера соединения формулы (IV) где соединение формулы (R-IV) вводят в реакцию, в присутствии 1,1,1,3,3,3-гексаметилдисилазана,с соединением формулы (V) что приводит к получению соединения формулы (R-VI) где соединение формулы (R-VI) вводят в реакцию с раствором гидроксида натрия, что приводит к получению соединения формулы (R-VII) где соединение формулы (R-VII) подвергают: 1) или, в присутствии диизопропилэтиламина, 1-гидроксибензотриазола и 1-этил-3-[3-(диметиламино)пропил]карбодиимида хлорида, действию соединения формулы (VIII) в которой R'2 представляет собой линейную или разветвлнную (C1-C6)алкильную группу и R'3 представляет собой группу, выбранную из таких как фенил (необязательно замещнный линейной или разветвлнной (C1-C6)алкоксигруппой) и 3-индолил, что приводит к получению соединения формулы в которой R'2 и R'3 принимают значения, указанные выше, где соединение формулы (R,S-IX) вводят в реакцию с бензальдоксимом в присутствии N-хлорсукцинимида в основной среде, что приводит к получению соединения формулы (R,S-X) в которой R'2 и R'3 принимают значения, указанные выше, где соединение формулы (R,S-X) помещают в основную среду, что приводит к получению соединения формулы (I/а), частного случая соединений формулы (I) в которой R2 и R3 принимают значения, указанные для формулы (I),2) или обрабатывают в тех же самых условиях, что и соединение формулы (R,S-IX), что приводит к получению соединения формулы(R-XI) где соединение формулы (R-XI) подвергают: А) или в присутствии диизопропилэтиламина, 1-гидроксибензотриазола(диметиламино)пропил]карбодиимида хлорида, действию соединения формулы (XII) 1-этил-3-[3 в которой R2 принимает значения, указанные выше, и PGA представляет собой защитную группу для фенольной функциональной группы (Т. W. Greene, "Protective Group in Organic Synthesis", WileyInterscience, New-York, 1981), хорошо известную специалисту, квалифицированному в данной области техники, что приводит к получению соединения формулы (R,S-XIII) в которой R2 и PGA принимают значения, указанные выше,где с фенольной функциональной группы соединения формулы (R,S-XIII) снимают защиту с помощью обычных технологий органической химии, хорошо известных специалисту, квалифицированному в данной области техники, что приводит к получению соединения формулы (I/b), частного случая соединений формулы (I) в которой R2 принимает значения, указанные выше,В) или действию соединения формулы (XIV) в тех же условиях, что описаны выше, где R'2 и PGA принимают значения, указанные выше,что приводит к получению соединения формулы (R,S-XV) в которой R'2 и PGA принимают значения, указанные выше, где соединение формулы (R,S-XV) подвергают: а) или в присутствии йодида натрия, (нBu)4NHSO4 и триэтиламина, действию соединения формулы(XVI) в которой Ra и Rb, каждый независимо один от другого, представляет собой линейную или разветв-6 012447 лнную (С 1-C6)алкильную группу, что приводит к получению соединения формулы (R,S-XVII) в которой Ra, Rb, R'2 и PGA принимают значения, указанные выше,b) или, в присутствии РуВОР и диизопропилэтиламина, действию соединения формулы (XVIII) в которой Ra и Rb принимают значения, указанные выше, что приводит к получению соединения формулы (R,S-XIX) в которой Ra, Rb, R'2 и PGA принимают значения, указанные выше, при этом соединения формул(R,S-XVII) и (R,S-XIX) составляют соединение формулы (R,S-XX) в которой R1 принимает значения, указанные для формулы (I), и R'2 и PGA принимают значения,указанные выше, где с функциональной группы фенола и функциональной группы карбоновой кислоты соединения формулы (R,S-XX) снимают защиту с помощью обычных технологий органической химии,хорошо известных специалисту, квалифицированному в данной области техники, что приводит к получению соединения формулы (I/с), частного случая соединений формулы (I) в которой R1 принимает значения, указанные выше, где соединения формул (I/a), (I/b) и (I/с) разделяют, при желании, на их стереоизомеры с помощью обычных технологий разделения, очищают, если необходимо, с помощью обычных технологий очистки и превращают, при желании, в их соли присоединения с фармацевтически приемлемым основанием. Соединение формулы (XII) может быть получено начиная с соединения формулы (XXI) в которой PGA принимает значения, указанные выше, и PGB представляет собой защитную группу для аминной функциональной группы (Т. W. Greene, "Protective Group in Organic Synthesis", WileyInterscience, New-York, 1981), хорошо известную специалисту, квалифицированному в данной области техники,где соединение формулы (XXI) вводят в реакцию: а) или, в присутствии NaI, (нBu)4NHSO4 и NEt3, с соединением формулы (XXII) в которой R2 принимает значения, указанные выше, что приводит к получению соединения формулы (XXIII) в которой PGA, PGB и R2 принимают значения, указанные выше,b) или, в присутствии EDC.HCl и 4-диметиламинопиридина, с соединением формулы (XXIV) в которой R2 принимает значения, указанные выше,что приводит к получению соединения формулы (XVIII), как определено выше,где с аминной функциональной группы соединения формулы (XXIII) снимают защиту в соответствии с обычными технологиями органической химии, хорошо известными специалисту, квалифицированному в данной области техники. Настоящее изобретение также относится к фармацевтическим композициям, которые включают соединения формулы (I) в комбинации с одним или более фармацевтически приемлемыми наполнителями. Из числа фармацевтических композиций в соответствии с данным изобретением особенно можно отметить те, которые подходят для перорального, парентерального, назального, под- или чреcкожного,ректального, подъязычного, глазного или респираторного применения, и в особенности таблетки или драже, подъязычные таблетки, сашеты, пакеты, желатиновые капсулы, глоссеты (таблетки для медленного растворения под языком), лекарственные леденцы, суппозитории, кремы, мази, кожные гели и инъекционные или питьевые ампулы. Полезная доза изменяется в соответствии с полом, возрастом и весом пациента, путм применения,природой терапевтического показания и любыми связанными лечениями и колеблется от 0,1 мг до 1 г в 24 ч, за одно или более применений. Следующие примеры иллюстрируют данное изобретение, не ограничивая его никоим образом. Следующие получения приводят к соединениям данного изобретения или к синтезу промежуточных соединений применения в получении данного изобретения. Используемые исходные материалы являются коммерческими продуктами или получают в соответствии с известными способами получения. Структуры соединений, описанных в примерах, определяют в соответствии с общеизвестными спектрофотометрическими технологиями (ИК, ЯМР, масс-спектрометрия).(5R,8,11S) соединение понимают в значении рацемической смеси 2 диастереоизомеров, имеющих абсолютные конфигурации (5R,8S,11S) и (5R,8R,11S). Получение 1. Этил 2-метилен-4-пентиноат. 34,9 г диэтилмалоната медленно добавляют к раствору EtONa, полученному путм растворения 5,0 г натрия в 280 мл абсолютного этанола. Реакционную смесь нагревают при 50 С в течение 1 ч и затем к указанной смеси каплями добавляют 38,8 мл 3-бром-1-пропина в 100 мл абсолютного этанола. Реакционную смесь перемешивают в течение 12 ч при указанной температуре. После выпаривания при сниженном давлении, остаток переносят в диэтиловый эфир и экстрагируют водой. Органическую фазу сушат над сульфатом натрия, фильтруют и затем выпаривают при сниженном давлении. Полученное масло переносят в 100 мл абсолютного этанола и затем каплями добавляют раствор KOH (12,2 г в 340 мл этанола). После перемешивания при комнатной температуре в течение 1,5 ч этанол выпаривают при сниженном давлении, и остаток растворяют в воде и экстрагируют диэтиловым эфиром. Водную фазу охлаждают с помощью ледяной бани, подкисляют с помощью 2 М HCl до рН 1 и экстрагируют диэтиловым эфиром. Органическую фазу сушат над сульфатом натрия, фильтруют и затем выпаривают при сниженном давлении, 35,0 мл пиридина, 13,4 г параформальдегида и 1,85 мл пиперидина добавляют к полученному остатку, и реакционную смесь перемешивают при 100-105 С в течение 3 ч. После охлаждения до комнатной температуры указанную смесь разбавляют с помощью 400 мл диэтилового эфира и органическую фазу последовательно промывают водой, 2 М HCl, 5% раствором NaHCO3 и насыщенным раствором NaCl. Органическую фазу сушат над сульфатом натрия, фильтруют и затем выпаривают при сниженном давлении. Хроматография на силикагеле (петролейный эфир (40-60 С)/диэтиловый эфир: 9,5/0,5-8/12) позволяет выделить ожидаемый продукт. Rf = 0,31 (петролейный эфир (40-60 С)/диэтиловый эфир: 9,5/0,5). Получение 2. 2-[1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил)(гидрокси)фосфорил]метил-4-пентиновая кислота. Стадия А. 1-(Бензгидриламино)-2-фенилэтилфосфиновая кислота/ 51,5 мл 50% водного раствора Н 3 РО 2 добавляют к суспензии 109,5 г дифенилметанамина хлорида в 750 мл этанола 90%, и затем реакционную смесь нагревают до 85-90 С. При указанной температуре, 58,4-8 012447 мл фенилацетальдегида в 175 мл этанола добавляют в течение периода 3 ч, и нагревание продолжают в течение ещ 3 ч, что сопровождается перемешиванием в течение 16 ч при комнатной температуре. Осадок, который образовался, фильтруют, промывают холодным этанолом и диэтиловым эфиром и затем сушат, таким образом, позволяя выделить ожидаемый продукт. Стадия В. 1-Амино-2-фенилэтилфосфиновая кислота. 181,1 г соединения стадии А, показанной выше, в 500 мл бромистоводородной кислоты нагревают при 110-120 С в течение 2 ч. Указанную смесь затем концентрируют при сниженном давлении, и остаток разбавляют с помощью воды и экстрагируют диэтиловым эфиром. Водную фазу концентрируют и к остатку добавляют 600 мл абсолютного этанола. 60 мл предварительно охлажднного пропиленоксида медленно добавляют к реакционной смеси, которую поддерживают при 0 С. Ожидаемый продукт, который выпадает в осадок при охлаждении, отфильтровывают, промывают диэтиловым эфиром и затем сушат. Стадия С. 1-[(Бензилокси)карбонил]амино-2-фенилэтилфосфиновая кислота. 110 мл 4 М раствора гидроксида натрия добавляют к суспензии 49,4 г соединения стадии В, представленной выше, в 120 мл воды. Реакционную смесь доводят до 0 С, и затем 45,5 мл бензилхлорформиата добавляют в течение 1 ч. Указанную смесь перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 4 ч, при этом доводят рН указанного раствора до 9-10 путм добавления 2 М раствора гидроксида натрия. Указанную смесь затем перемешивают при комнатной температуре в течение ночи и затем экстрагируют диэтиловым эфиром. Водную фазу подкисляют путм добавления 6 М соляной кислоты. Ожидаемый продукт, выпавший в осадок, фильтруют, промывают водой и диэтиловым эфиром и затем сушат над Р 2 О 5. Стадия D. (1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтилфосфиновая кислота. Раствор 83,4 г соединения стадии С, представленной выше, в 1000 мл абсолютного этанола нагревают при орошении. Раствор 34,4 мл R-(+)-N,N-(фенил)(этил)амина в 170 мл этанола медленно добавляют к реакционной смеси. Через 15 мин, реакционную смесь доводят до комнатной температуры и охлаждают при 4 С в течение ночи. Образованный осадок фильтруют и промывают абсолютным этанолом и диэтиловым эфиром. Твердое вещество перекристаллизовывают из 445 мл абсолютного этанола. Полученную соль суспендируют в 300 мл 6 М соляной кислоты и перемешивают в течение 2-3 ч. Твердое вещество фильтруют, промывают с помощью H2O и Et2O, и затем сушат над Р 2 О 5. Вращение плоскости поляризации света []20D = -46,7 (1% в абсолютном этаноле). Стадия Е. (1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил-[2-(этоксикарбонил)-4-пентинил] фосфиновая кислота. 1,3 ммоль соединения получения 1 добавляют каплями к смеси 1 ммоль соединения стадии D, представленной выше, и 5 ммоль HMDS, который нагревают при 110 С в течение 1 ч в атмосфере аргона. Реакционную смесь нагревают при 100-105 С в течение ещ 3 ч. Затем е охлаждают до 70 С, и абсолютный этанол добавляют небольшими порциями вс ещ в атмосфере аргона. Перемешивание продолжают в течение ещ 15 мин при указанной температуре. Растворитель затем выпаривают при сниженном давлении. Хроматография на силикагеле (хлороформ/метанол/уксусная кислота: 7/0,3/0,3) позволяет выделить ожидаемый продукт. Стадия F. 2-[1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил)(гидрокси)фосфорил]метил-4 пентиновая кислота. Раствор 1 ммоль соединения стадии Е, представленной выше, в 9 мл этанола охлаждают до 0 С. 5-6 ммоль 1 М гидроксида натрия добавляют небольшими порциями, и затем реакционную смесь перемешивают при комнатной температуре в течение 6-8 ч. После подкисления с помощью 2 М HCl этанол выпаривают, и остаток переносят в воду и экстрагируют этилацетатом. Органическую фазу промывают водой и насыщенным раствором хлорида натрия и затем сушат над сульфатом натрия и выпаривают при сниженном давлении. Ожидаемый продукт получают путм осаждения из смеси диэтиловый эфир/петролейный эфир. Получение 3. 3-[1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил)(гидрокси)фосфорил]-2-[(3 фенил-5-изоксазолил)метил]пропионовая кислота. Стадия А. 2-[1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил)(гидрокси)фосфорил]метил-4 пентиновая кислота. Данное соединение получают в соответствии с процедурой, описанной в литературе (A. Makaritis etal., Chem. Eur. J., 2003, 9, 2079-2094). Стадия В. 3-[1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил)(гидрокси)фосфорил]-2-[(3 фенил-5-изоксазолил)метил]пропионовая кислота. 1,3-Диполярное циклоприсоединение выполняют на соединении стадии А, представленной выше,используя бензальдегид оксим, в соответствии с процедурой, описанной в литературе (A. Makaritis et al,Chem. Eur. J., 2003, 9, 2079-2094). Пример 1. (5R,8R,11S)-5-Бензил-6-гидрокси-11-(1H-индол-3-илметил)-3,9-диоксо-1-фенил-8-[(3 фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Стадия А. (1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил-[2-([(1S)-1-(1 Н-индол-3-илметил)-9 012447 2-метокси-2-оксоэтил]аминокарбонил)-4-пентинил]фосфиновая кислота. К суспензии 1 ммоль соединения получения 2 в 20 мл дихлорметана добавляют 3 ммоль диизопропилэтиламина, 1 ммоль 1-триптофанметилового сложного эфира гидрохлорида, 1 ммоль HOBt и 4 ммольEDC.HCl. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и затем разбавляют дихлорметаном. 1 М соляную кислоту затем добавляют с образованием двух фаз. Органическую фазу промывают с помощью 1 М HCl, сушат над сульфатом натрия и затем концентрируют при сниженном давлении. Ожидаемый продукт получают путм осаждения из смеси диэтиловый эфир/петролейный эфир. Стадия В. (1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил-3-[(1S)-1-(1 Н-индол-3-илметил)2-метокси-2-оксоэтил]амино-3-оксо-2-[(3-фенил-4-изоксазолил)метил)]пропилфосфиновая кислота. 6 ммоль бензальдоксима растворяют в 5 мл хлороформа, и 2 капли пиридина добавляют к указанному раствору. Затем добавляют 6 ммоль N-хлорсукцинимида и после перемешивания в течение 10 мин при комнатной температуре реакционную смесь перемешивают при 45 С в течение 3-4 ч. Затем добавляют 1 ммоль соединения стадии А, представленной выше, а также 7 ммоль триэтиламина. Реакционную смесь перемешивают при 45 С в течение 96 ч и затем концентрируют при сниженном давлении, и остаток переносят в этилацетат и промывают с помощью 1 М HCl и насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и концентрируют при сниженном давлении. Ожидаемый продукт получают путм осаждения из смеси диэтиловый эфир/петролейный эфир. Стадия С. (5R,8,11S)-5-Бензил-6-гидрокси-11-(1 Н-индол-3-илметил)-3,9-диоксо-1-фенил-8-[(3 фенил-4-изоксазолил)метил)]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Указанный продукт получают в соответствии с процедурой стадии F получения 1, используя соединение стадии В, представленной выше, вместо соединения стадии Е. Стадия D. (5R,8R,11S)-5-Бензил-6-гидрокси-11-(1 Н-индол-3-илметил)-3,9-диоксо-1-фенил-8-[(3 фенил-4-изоксазолил)метил)1-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид (R,R,S) диастереоизомер получают путм очищения соединения стадии С, представленной выше, изократическим способом с буфером, который состоит из 40% ацетонитрила и 60% 83,3 мМ формиата аммония при рН 6,4, используя 25030 мм AIT колонку (носитель Kromasil С 18 гранулы 5 мкм, поры 100 ). Macспектрометрия (ES/MS) = 733,2 Da. Пример 2. (5R,8R,11S)-5,11-Дибензил-6-гидрокси-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил) метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Стадия А. 2-([(1S)-1-Бензил-2-трет-бутокси-2-оксоэтил]аминокаубонил)-4-пентинил-1R)-1[(бензилокси)карбонил]амино-2-фенилэтил)фосфиновая кислота. Данное соединение получают в соответствии с процедурой, описанной в cтадии А примера 1, используя гидрохлорид L-фенилаланин О-трет-бутилового сложного эфира вместо гидрохлорида 1 триптофан метилового сложного эфира. Стадия В. 3-[(1S)-1-Бензил-2-трет-бутокси-2-оксоэтил]амино-3-оксо-2-[(3-фенил-5-изоксазолил) метил]пропил 1R)-1-[(бензилокси)карбонил]амино-2-фенилэтил)фосфиновая кислота. Данное соединение получают в соответствии с процедурой, описанной в стадии В примера 1, используя соединение стадии А, представленной выше. Продукт очищают с помощью хроматографии на силикагеле (хлороформ/ метанол/ уксусная кислота : 7/0,3/0,3). Стадия С. (5R,8,11S)-5,11-Дибензил-6-гидрокси-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил) метил]-2-окса-4,10-диаза-б-фосфадодекан-12-оновой кислоты 6-оксид. Продукт получают путм введения в реакцию соединения cтадии В, представленной выше, с трифторуксусной кислотой, триизопропиламином, дихлорметаном и водой в соотношении 85/2,5/10/2,5. Стадия D. (5R,8R,11S)-5,11-Дибензил-6-гидрокси-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил) метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид.(R,R,S) диастереоизомер получают путм очистки соединения стадии С, представленной выше,изократическим способом, используя полупрепаративную 25010 мм AIT колонку (носитель Kromasil(5R,8R,11S)-5-Бензил-6-гидрокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3 фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Стадия А. (1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил-[2-([(1S)-2-трет-бутокси-1-(4-третбутоксибензил)-2-оксоэтил]аминокарбонил)-4-пентинил]фосфиновая кислота. Данное соединение получают в соответствии с процедурой, описанной в стадии А примера 1, используя гидрохлорид L-тирозин О-ди-трет-бутилового сложного эфира вместо гидрохлорида 1 триптофан метилового сложного эфира. Стадия В. (1R)-1-[(Бензилокси)карбонил]амино-2-фенилэтил-3-[(1S)-2-трет-бутокси-1-(4-третбутоксибензил)-2-оксоэтил]амино-3-оксо-2-[(3-фенил-5-изоксазолил)метил]пропилфосфиновая кислота. Данное соединение получают в соответствии с процедурой, описанной в cтадии В примера 2, ис- 10012447 пользуя соединение стадии А, представленной выше. Стадия С. (5R,8,11S)-5-Бензил-6-гидрокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3-фенил 5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Данное соединение получают в соответствии с процедурой, описанной в стадии С примера 3, используя соединение стадии В, представленной выше. Стадия(R,R,S) диастереоизомер получают путм очищения соединения стадии С, представленной выше,изократическим способом, используя полупрепаративную 25010 мм AIT колонку (носитель KromasilC18 гранулы 10 мкм, поры 100 ). Изократическое элюирование в кислых условиях: 43% ацетонитрила; 0,1% трифторуксусной кислоты. Mac-спектрометрия (ES/MS) = 711,3 Da. Пример 4. (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-3,9,12,16-тетраоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2,13,15-триокса-4,10-диаза-17,17-диметилоктадекан-6-фосфиновая кислота. Стадия А. N-[(Бензилокси)карбонил]-4-[(трет-бутоксикарбонил)окси]фенилаланин. Гидроксид калия добавляют к раствору 10 ммоль N-[(бензилокси)карбонил]-4-гидроксифенилаланина пока не достигнут рН 12. Реакционную смесь охлаждают в ледяной бане, и добавляют 1,5 эквивалента Boc2 О, и указанную смесь затем возвращают к комнатной температуре, при этом поддерживая рН раствора при 12 путм добавления твердого гидроксида калия. Через 2 ч добавляют ещ 0,5 эквивалента Boc2O. Через 18 ч, указанную смесь затем концентрируют при сниженном давлении и водную фазу экстрагируют смесью (1/1) Et2O/ петролейный эфир. Водную фазу подкисляют в твердом состоянии с помощью 2 М HCl пока не достигнут рН раствора 1, и потом экстрагируют дважды этилацетатом. Хроматография (хлороформ/ метанол: 9,5/0,5) позволяет выделить ожидаемый продукт. Стадия В. [(2-[(Бензилокси)карбонил]амино-3-(4-[(трет-бутоксикарбонил)окси]фенилпропаноил)окси]метил пивалат. К раствору 2,5 ммоль соединения стадии А, представленной выше, в 15 мл хлороформа добавляют(нBu)4NHSO4 (0,5 эквивалента), триэтиламин (2 эквивалента), йодид натрия (1 эквивалент) и хлорметил пивалат (2 эквивалента). Реакционную смесь нагревают при орошении в течение 18 ч и затем концентрируют. Остаток растворяют в диэтиловом эфире и экстрагируют водой, дважды с помощью 0,5 М HCl,дважды с помощью 5% NaHCO3, и водой. Органическую фазу концентрируют и хроматография (дихлорметан/ метанол: 9,9/0,1-9,5/0,5) позволяет выделить ожидаемый продукт. Стадия С. [(2-Амино-3-4-[(трет-бутоксикарбонил)окси]фенилпропаноил)окси]метил 2,2-диметилпропаноат гидрохлорид. 2 ммоль соединения стадии В, представленной выше, растворяют в смеси (2/1) этанол/вода, и несколько капель 0,5 М HCl добавляют пока не достигнут рН 1. Реакционную смесь гидрогенируют с помощью водородной колбы в присутствии Pd/C (300 мг) в качестве катализатора. Через 2,5 ч указанную смесь фильтруют через целит и затем выпаривают досуха, что приводит к получению ожидаемого продукта. Стадия D. (5R,8,11S)-5-Бензил-11-4-[(трет-бутоксикарбонил)окси]бензил-3,9,12,16-тетраоксо-1 фенил-8-[(3-фенил-5-изоксазолил)метил]-2,13,15-триокса-4,10-диаза-17,17-диметилоктадекан-6 фосфиновая кислота. К суспензии 1,3 ммоль соединения получения 3 в 7 мл дихлорметана добавляют 3 эквивалента диизопропилэтиламина, 1 эквивалент соединения стадии С, представленной выше, 1 эквивалент HOBt и 5 эквивалентов EDC.HCl. Реакционную смесь перемешивают в течение 75 мин и затем концентрируют при сниженном давлении. Остаток растворяют в 50 мл смеси (9/1) этилацетат / диэтиловый эфир и затем экстрагируют четыре раза с помощью 1 М HCl, H2O, три раза с помощью 5% NH4HCO3, H2O, дважды с помощью 5% NaHCO3, Н 2 О, 1 М HCl и затем солевым раствором. Органическую фазу концентрируют и хроматография (хлороформ/ метанол/ уксусная кислота: 9,5/0,4/0,1) позволяет выделить ожидаемый продукт. Стадия Е: (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-3,9,12,16-тетраоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2,13,15-триокса-4,10-диаза-17,17-диметилоктадекан-6-фосфиновая кислота. 1 ммоль соединения стадии D, представленной выше, растворяют в 10 мл муравьиной кислоты и 200 мкл триизопропилсилана. Реакционную смесь перемешивают при комнатной температуре в течение 50 мин и затем концентрируют при сниженном давлении. Остаток растворяют в этилацетате и экстрагируют дважды солевым раствором, дважды с помощью 5 % NaHCO3, солевым раствором, 1 М HCl и солевым раствором. Органическую фазу концентрируют, что приводит к получению ожидаемого продукта.(5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-3,9,12-триоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2,13-диокса-4,10-диазапентадекан-6-фосфиновая кислота. Стадия А. 2-[(Бензилокси)карбонил]амино-3-4-[(трет-бутоксикарбонил)окси]фенилэтил пропаноат. К раствору 4 ммоль соединения стадии А примера 4 в 5 мл абсолютного этанола добавляют HOBt(1,1 эквивалент), EDC.HCl (1,1 эквивалент), DMAP (каталитическое количество) и DIPEA (1,1 эквивалент). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и затем концентри- 11012447 руют. Остаток растворяют в диэтиловом эфире, и экстрагируют водой, дважды с помощью 0,5 М HCl,дважды с помощью 5% NaHCO3 и водой. Водную фазу сушат над Na2SO4 и затем концентрируют, что приводит к получению ожидаемого продукта. Стадия В. 2-Амино-3-4-[(трет-бутоксикарбонил)окси]фенилэтил пропаноат гидрохлорид. Продукт получают в соответствии с процедурой, описанной в стадии С примера 4, используя соединение стадии А, представленной выше. Стадия С.(5R,8,11S)-5-Бензил-11-4-[(трет-бутоксикарбонил)окси]бензил 3,9,12-триоксо-1 фенил-8-[(3-фенил-5-изоксазолил)метил]-2,13-диокса-4,10-диазапентадекан-6-фосфиновая кислота. Продукт получают в соответствии с процедурой, описанной в стадии D примера 4, используя соединение стадии В, представленной выше. Стадия D. (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-3,9,12-триоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2,13-диокса-4,10-диазапентадекан-6-фосфиновая кислота. Продукт получают в соответствии с процедурой, описанной в стадии Е примера 4, используя соединение стадии С, представленной выше. Mac-спектрометрия (MS-ESI) = 740,2 (М+H)+. Пример 6. (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-3,9,12,17-тетраоксо-1,17-дифенил-8-[(3-фенил-5-изоксазолил)метил]-2,13-диокса-4,10-диаза-16-тиагептадекан-6-фосфиновая кислота. Стадия А. 2-(Бензоилсульфанил)-3-(4-трет-бутоксифенил)-2-[(9 Н-флуорен-9-илметокси)карбонил] аминоэтил пропаноат. Указанное соединение получают в соответствии с процедурой, описанной в стадии А примера 5,используя FmocTyr (OBut)(OH) вместо соединения стадии А примера 4 и используя PhCOSCH2CH2OH(описанный в литературе I. Lefebvre et al., J. Med. Chem., 1995, 38, 3941-3950) вместо абсолютного этанола в дихлорметане. Стадия B. 2-(Бензоилсульфанил)-2-амино-3-(4-трет-бутоксифенил)этил пропаноат. 1,5 ммоль соединения стадии А, представленной выше, растворяют в 12 мл диметилформамида и 3 эквивалентах диэтиламина. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем концентрируют при сниженном давлении. Остаток растворяют в этилацетате и экстрагируют три раза водой и солевым раствором. Хроматография (хлороформ/метанол: 9,5/0,5) и затем осаждение из смеси (2/1) петролейный эфир/ диэтиловый эфир позволяет выделить ожидаемый продукт. Стадия С. (5R,8,11S)-5-Бензил-11-(4-трет-бутоксибензил)-3,9,12,17-трет-оксо-1,17-дифенил-8-[(3 фенил-5-изоксазолил)метил]-2,13-диокса-4,10-диаза-16-тиагептадекан-6-фосфиновая кислота. Продукт получают в соответствии с процедурой, описанной в стадии D примера 4, используя соединение стадии В, представленной выше. Стадия D. (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-3,9,12,17-тетраоксо-1,17-дифенил-8-[(3 фенил-5-изоксазолил)метил]-2,13-диокса-4,10-диаза-16-тиагептадекан-6-фосфиновая кислота. Продукт получают в соответствии с процедурой, описанной в стадии Е примера 4, используя соединение стадии С, представленной выше. Mac-спектрометрия (MS-ESI) = 874,3 (М-Н)Пример 7. (5R,8,11S)-5-Бензил-11-4-(трет-бутоксибензил)-6-[2-(этантиоат)этокси 1-3,9-диоксо-1 фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Стадия A. (5R,8,11S)-5-Бензил-11-(4-трет-бутоксибензил)-3,9,12-триоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2,13-диокса-4,10-диаза-14,14-диметилпентадекан-6-фосфиновая кислота. Продукт получают в соответствии с процедурой, описанной в стадии D примера 4, используя соединение получения 3 и HCl.HTyr(OBut)OBut. Стадия В. трет-Бутил (5R,8,11S)-5-бензил-11-4-(трет-бутоксибензил)-6-[2(этантиоат)этокси]-3,9 диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6-оксид. 0,36 ммоль соединения стадии А, представленной выше, растворяют в 4 мл диметилформамида и затем добавляют 3 эквивалента DIPEA, 3 эквивалента CH3COSCH2CH2OH (I. Lefebvre et al., J. Med.Chem., 1995, 38, 3941-3950) и 3 эквивалента РуРОВ. Реакционную смесь перемешивают при комнатной температуре в течение 48 ч и затем разбавляют этилацетатом. Органическую фазу экстрагируют четыре раза с помощью 1 М HCl, H2O, три раза с помощью 5% NH4HCO3, дважды с помощью 1 М HCl и затем солевым раствором. Органическую фазу сушат и затем концентрируют. Хроматография (хлороформ/ метанол: 9,8/0,2) позволяет выделить ожидаемый продукт. Стадия С. (5R,8,11S)-5-Бензил-11-4-(трет-бутоксибензил)-6-[2(этантиоат)-этокси]-3,9-диоксо-1 фенил-8-[(3-фенил-5-изоксазолил)метил 1-2-окса-4,10-диаза-6-фосфадодекан-l2-овой кислоты 6-оксид. Продукт получают в соответствии с процедурой, описанной в стадии Е примера 4, используя соединение стадии В, представленной выше. Mac-спектрометрия (MS-ESI) = 814,3 (М+H)+. Пример 8. Этил (5R,8,11S)-5-бензил-6-этокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3 фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6-оксид. Стадия А. Этил (5R,8,11S)-5-бензил-11-4-[(трет-бутоксикарбонил)окси]бензил-6-этокси-3,9 диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6-оксид. Продукт получают в соответствии с процедурой, описанной в стадии В примера 7, используя соединение стадии С примера 5 и этанол. Стадия В. Этил (5R,8,11S)-5-бензил-6-этокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3- 12012447 фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6-оксид. Продукт получают в соответствии с процедурой, описанной в cтадии примера 4, используя соединение стадии А, представленной выше. Mac-спектрометрия (MS-ESI) = 768,3 (М+Н)+; 790,3 (M+Na+)+. Пример 9. Этил (5R,8,11S)-5-бензил-11-(4-гидроксибензил)-6-[2-метил-1-(пропионилокси)пропокси]-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6 оксид. Стадия А. Этил (5R,8,11S)-5-бензил-11-4-[(трет-бутоксикарбонил)окси]бензил-6-[2-метил-1(пропионилокси)пропокси]-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6 фосфадодекан-12-аота 6-оксид. Продукт получают в соответствии с процедурой, описанной в стадии В примера 7, используя соединение стадии С примера 5 и BrCH(CH(CH3)2)OCOEt (M. Neuenschwander et al., Helv. Chim. acta, 1978,61, 2047-2058). Стадия В. Этил (5R,8,11S)-5-бензил-11-(4-гидроксибензил)-6-[2-метил-1-(пропионилокси)пропокси]3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)-метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6-оксид. Продукт получают в соответствии с процедурой, описанной в стадии Е примера 4, используя соединение стадии А, представленной выше. Mac-спектрометрия (MS-APCI) = 868,4 (М+Н)+: 885,5(М+NH4+)+. Пример 10. (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-6-[2-метил-1-(пропионилокси)пропокси 3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Стадия А. трет-Бутил (5R,8,11S)-5-бензил-11-(4-трет-бутоксибензил)-6-[2-метил-1-(пропионилокси) пропокси]-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оата 6-оксид. Продукт получают в соответствии с процедурой, описанной в cтадии А примера 9, используя соединение стадии А примера 7 вместо соединения стадии С примера 5. Mac-спектрометрия (MS-ESI) = 974.5 (M+Na+)+. Стадия В. (5R,8,11S)-5-Бензил-11-(4-гидроксибензил)-6-[2-метил-1-(пропионилокси)пропокси]3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид. Продукт получают в соответствии с процедурой, описанной в стадии Е примера 4, используя соединение стадии А, представленной выше. Mac-спектрометрия (MS-ESP = 838,5 (M-H)-. Фармакологическое исследование соединения согласно изобретению Пример А. In vitro ингибиторный эффект на ангиотензин-превращающий фермент (АСЕ) и эндотелин-превращающий фермент (ЕСЕ). Для того, чтобы сравнить их специфичность, соединения указанных примеров протестировали на 2 ферментах: АСЕ (рекомбинантная человеческая форма) и ЕСЕ (рекомбинантная человеческая форма изоформы ЕСЕ-1 с). Испытания проводили в двух повторах на 96-ячеистых планшетах. Ингибитор инкубировали вместе с ферментом в течение 45 мин перед добавлением субстрата с подавленной флуоресценцией. Излучаемую флуоресценцию определяют и измеряют на ридере для планшетов Fluoroscan AscentMca-Arg-Pro-Pro-Gly-Phe-Ser-Ala-Phc-Lys(Dnp)COOH (5 мкМ; RD Systems) с ЕСЕ. Соединения данного изобретения показывают хорошее ингибирование АСЕ и ЕСЕ, с IC50 значениями 25 нМ и 8 нМ соответственно. Полученные результаты подсуммированы в следующей таблице:R1 представляет собой атом водорода или группу, выбранную из (С 1-C6)алкилкарбонилокси-(С 1C6)алкила, где каждый алкильный остаток может быть линейным или разветвлнным, и (С 1C6)алкилкарбонилтио-(С 1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлнным,R2 представляет собой атом водорода или группу, выбранную из (С 1-C6)алкилкарбонилокси-(С 1C6)алкила, где каждый алкильный остаток может быть линейным или разветвлнным, арилкарбонилтио(С 1-C6)алкила, где каждый алкильный остаток может быть линейным или разветвлнным, и арил-(С 1C6)алкила, где каждый алкильный остаток может быть линейным или разветвлнным, и арильный остаток которого необязательно замещн (С 1-C6)алкилкарбонилоксигруппой,R3 представляет собой фенильную группу, необязательно замещнную гидроксигруппой, или R3 представляет собой 3-индолильную группу, илиR1 также может представлять собой линейную или разветвлнную (C1-C6)алкильную группу и R2 представляет собой линейную или разветвлнную (С 1-C6)алкильную группу, когда R3 представляет собой фенильную группу, замещнную гидроксигруппой,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием и их гидраты и сольваты. 2. Соединения формулы (I) по п.1, отличающиеся тем, что R1 и R2 каждый представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием. 3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, что R1 представляет собой атом водорода и R3 представляет собой фенильную группу, замещнную гидроксигруппой, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием. 4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что R2 представляет собой атом водорода и R3 представляет собой фенильную группу, замещнную гидроксигруппой, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием. 5. Соединения формулы (I) по п.1, которые представляют собой(5R,8R,11S)-5-бензил-6-гидрокси-11-(1H-индол-3-илметил)-3,9-диоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,(5R,8R,11S)-5,11-дибензил-6-гидрокси-3,9-диоксо-1-фенил-8-[(3-фенил-5-изоксазолил)метил]-2 окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,(5R,8R,11S)-5-бензил-6-гидрокси-11-(4-гидроксибензил)-3,9-диоксо-1-фенил-8-[(3-фенил-5 изоксазолил)метил]-2-окса-4,10-диаза-6-фосфадодекан-12-оновой кислоты 6-оксид,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемым основанием. 6. Фармацевтические композиции, включающие в качестве активного ингредиента по крайней мере одно соединение по любому из пп.1-5 в комбинации с одним или более фармацевтически приемлемыми,инертными, нетоксичными наполнителями или носителями. 7. Фармацевтические композиции по п.6, используемые при получении лекарственного средства для лечения артериальной гипертензии и е осложнений, включая лгочную артериальную гипертензию,ишемии миокарда, стенокардии, сердечной недостаточности, васкулопатии, нефропатии, диабетических ретинопатий, атеросклероза и рестеноза после пластической операции на сосудах, острой или хронической почечной недостаточности, цереброваскулярных заболеваний, включая инсульт и субарахноидальное кровоизлияние, и периферической ишемии.
МПК / Метки
МПК: C07F 9/30, C07F 9/32, A61K 31/675
Метки: содержащие, композиции, фосфиновой, фармацевтические, соединения, аминокислоты
Код ссылки
<a href="https://eas.patents.su/15-12447-soedineniya-fosfinovojj-aminokisloty-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения фосфиновой аминокислоты и содержащие их фармацевтические композиции</a>
Предыдущий патент: Способ производства 1,2-дихлорэтана
Следующий патент: Пищевая липидная композиция в форме частиц
Случайный патент: Проходческо-очистная машина