Соль фосфорной кислоты ингибитора дипептидилпептидазы-iv
Номер патента: 9042
Опубликовано: 26.10.2007
Авторы: Уэнслоу Роберт М.Мл., Сайпс Стефен Ховард, Ферлита Расселл Р., Чэнь Алекс Миньхуа, Ли Айван, Хансен Карл, Видра Вики К.
Формула / Реферат
1. Дигидрофосфат 4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина структурной формулы I
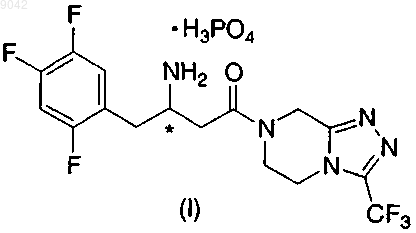
или ее фармацевтически приемлемый гидрат.
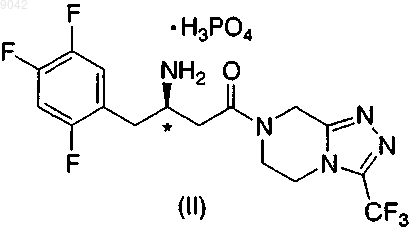
2. Соль по п.1 структурной формулы II, имеющая (R)-конфигурацию хирального центра, обозначенного *
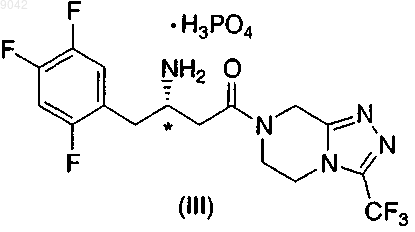
3. Соль по п.1 структурной формулы III, имеющая (S)-конфигурацию хирального центра, обозначенного *
4. Соль по п.2, отличающаяся тем, что она представляет собой кристаллический моногидрат.
5. Соль по п.4, характеризующаяся характерными абсорбционными полосами на рентгеновской порошковой дифракционной картине со спектральными d-расстояниями, равными 7,42, 5,48 и 3,96 Е.
6. Соль по п.5, дополнительно характеризующаяся характерными абсорбционными полосами на рентгеновской порошковой дифракционной картине со спектральными d-расстояниями, равными 6,30, 4,75 и 4,48 Е.
7. Соль по п.6, дополнительно характеризующаяся характерными абсорбционными полосами на рентгеновской порошковой дифракционной картине со спектральными d-расстояниями, равными 5,85, 5,21 и 3,52 Е.
8. Соль по п.7, дополнительно характеризующаяся рентгеновской порошковой дифракционной картиной, представленной на фиг. 1.
9. Соль по п.4, характеризующаяся спектром твердофазного ядерно-магнитного резонанса углерода-13 CPMAS, содержащим сигналы при 169,1, 120,8 и 46,5 м.д.
10. Соль по п.9, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса углерода-13 CPMAS, содержащим сигналы при 159,0, 150,9 и 40,7 м.д.
11. Соль по п.10, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса углерода-13 CPMAS, представленным на фиг. 2.
12. Соль по п.4, характеризующаяся спектром твердофазного ядерно-магнитного резонанса фтора-19 MAS, содержащим сигналы при -64,5, -114,7, -136,3 и -146,2 м.д.
13. Соль по п.12, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса фтора-19 MAS, содержащим сигналы при -96,5, -104,4, -106,3 и -154,5 м.д.
14. Соль по п.13, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса фтора-19 MAS, представленным на фиг. 3.
15. Соль по п.4, характеризующаяся кривой термогравиметрического анализа, представленной на фиг. 4.
16. Соль по п.4, характеризующаяся дифференциальной сканирующей калориметрической кривой, представленной на фиг. 4.
17. Лекарственное вещество, включающее детектируемое количество кристаллического моногидрата по п.4.
18. Лекарственное вещество по п.17, включающее от приблизительно 5 до приблизительно 100 мас.% указанного кристаллического моногидрата.
19. Лекарственное вещество по п.17, включающее от приблизительно 10 до приблизительно 100 мас.% указанного кристаллического моногидрата.
20. Лекарственное вещество по п.17, включающее от приблизительно 25 до приблизительно 100 мас.% указанного кристаллического моногидрата.
21. Лекарственное вещество по п.17, включающее от приблизительно 50 до приблизительно 100 мас.% указанного кристаллического моногидрата.
22. Лекарственное вещество по п.17, включающее от приблизительно 75 до приблизительно 100 мас.% указанного кристаллического моногидрата.
23. Лекарственное вещество по п.17, вся масса которого, по существу, представляет собой указанный кристаллический моногидрат.
24. Фармацевтическая композиция для лечения диабета II типа, включающая терапевтически эффективное количество соли по п.1 или ее фармацевтически приемлемого сольвата в сочетании с одним или более фармацевтически приемлемыми носителями.
25. Фармацевтическая композиция для лечения диабета II типа, включающая терапевтически эффективное количество соли по п.4 или ее фармацевтически приемлемого сольвата в сочетании с одним или более фармацевтически приемлемыми носителями.
26. Способ лечения диабета II типа, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соли по п.1 или ее фармацевтически приемлемого гидрата.
27. Способ лечения диабета II типа, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соли по п.4.
Текст
009042 Область техники Настоящее изобретение относится к конкретной соли ингибитора дипептидилпептидазы-IV. Более конкретно, данное изобретение относится к дигидрофосфату 4-оксо-4-[3-(трифторметил)-5,6 дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина, представляющего собой сильный ингибитор дипептидилпептидазы-IV. Эта новая соль и ее кристаллические гидраты могут быть использованы для лечения и предотвращения заболеваний и состояний, при которых назначают ингибитор дипептидилпептидазы-IV, в частности, диабета 2 типа, ожирения и повышенного кровяного давления. Изобретение также касается фармацевтических композиций, включающих указанный дигидрофосфат и его кристаллические гидраты, которые могут быть использованы для лечения диабета 2 типа,ожирения и повышенного кровяного давления, равно как и способов получения указанного дигидрофосфата и его кристаллических гидратов и фармацевтических композиций на их основе. Уровень техники Ингибирование дипептидилпептидазы-IV (DP-IV), фермента, инактивирующего как глюкозозависимый инсулинотропный пептид (GIP), так и глюкагоноподобный пептид 1 (GLP-1), представляет собой новый подход к лечению и предотвращению диабета 2 типа, также известного как инсулиннезависимый сахарный диабет (NIDDM). Был сделан обзор терапевтического потенциала ингибиторов DP-IV для лечения диабета 2 типа: C.F. Deacon and J.J. Hoist, "Dipeptidyl peptidase IV inhibition as an approach to theWO 03/004498 (опубликованная 16 января 2003 г.) на имя MerckCo., описывает класс бетааминотетрагидротриазоло[4,3-а]пиразинов, которые представляют собой сильные ингибиторы DP-IV и поэтому могут быть использованы для лечения диабета 2 типа. В WO 03/004498 конкретно описан 4 оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5 трифторфенил)бутан-2-амин. Фармацевтически приемлемые соли данного соединения в целом входят в объем WO 03/004498. Однако в вышеприведенной ссылке отсутствует описание впервые обнаруженной одноосновной соли-дигидрофосфата 4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1(2,4,5-трифторфенил)бутан-2-амина, имеющей приводимую ниже структурную формулу I. Сущность изобретения Настоящее изобретение касается нового дигидрофосфата ингибитора дипептидилпептидазы-IV(DP-IV), т.е. 4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5 трифторфенил)бутан-2-амина, и его кристаллических гидратов, в частности, кристаллического моногидрата. Дигидрофосфат и кристаллические гидраты согласно настоящему изобретению обеспечивают преимущества при получении фармацевтических композиций 4-оксо-4-[3-(трифторметил)-5,6 дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина, такие как легкость обработки, транспортировки и дозирования. В частности, они имеют повышенную физическую и химическую стабильность, такую как стабильность к нагрузке, высоким температурам и влажности, а также улучшенные физико-химические свойства, такие как растворимость и скорость растворения, которые делают их особенно подходящими для получения различных фармацевтических препаративных форм. Данное изобретение также касается фармацевтических композиций, включающих новую соль и ее гидраты, а также способов их применения в качестве ингибиторов DP-IV, в частности, для предотвращения или лечения диабета 2 типа, ожирения и повышенного кровяного давления. Краткое описание фигур Фиг. 1 представляет характерную рентгеновскую дифракционную картину кристаллического моногидрата дигидрофосфата структурной формулы II. Фиг. 2 представляет спектр ядерно-магнитного резонанса (ЯМР) с кроссполяризационным вращением под магическим углом (CPMAS) углерода-13 кристаллического моногидрата дигидрофосфата структурной формулы II. Фиг. 3 представляет спектр ядерно-магнитного резонанса (ЯМР) с вращением под магическим углом (MAS) фтора-19 кристаллического моногидрата дигидрофосфата структурной формулы II. Фиг. 4 представляет типичную кривую термогравиметрического анализа (TGA) кристаллического моногидрата дигидрофосфата структурной формулы II. Фиг. 5 представляет типичную кривую дифференциальной сканирующей калориметрии (DSC) кристаллического моногидрата дигидрофосфата структурной формулы II. Подробное описание изобретения Данное изобретение касается новой одноосновной соли-дигидрофосфата 4-оксо-4-[3(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2 амина следующей структурной формулы I: или ее кристаллического гидрата. В частности, данное изобретение касается кристаллического моногидрата дигидрофосфата формулы I. Дигидрофосфат согласно настоящему изобретению имеет центр асимметрии у стереогенного атома углерода, обозначенного , и поэтому может существовать в виде рацемата, рацемической смеси и отдельных энантиомеров, при этом все изомерные формы входят в объем настоящего изобретения. Отдельные энантиомеры, по существу, свободные от другого, входят в объем настоящего изобретения, равно как и смеси двух энантиомеров. Один из вариантов настоящего изобретения касается дигидрофосфата (2R)-4-оксо-4-[3(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2 амина структурной формулы II или его кристаллического гидрата. Второй вариант настоящего изобретения касается дигидрофосфата (2S)-4-оксо-4-[3(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2 амина структурной формулы III или его кристаллического гидрата. Более конкретно, дигидрофосфат согласно настоящему изобретению включает один молярный эквивалент монопротонированного катиона 4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3 а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина и один молярный эквивалент аниона дигидрофосфата (бифосфата). В соответствии с другим вариантом настоящего изобретения дигидрофосфат формул I-III представляет собой кристаллический моногидрат. Согласно одной из категорий данного изобретения кристаллический гидрат представляет собой кристаллический моногидрат. Следующий вариант настоящего изобретения касается лекарственного вещества из дигидрофосфата формул I-III, включающего кристаллический моногидрат, присутствующий в детектируемом количестве. Под "лекарственным веществом" подразумевается активный фармацевтический ингредиент ("API"). Количество кристаллического гидрата в лекарственном веществе может быть определено с помощью физических способов, таких как рентгеновская порошковая дифракция, твердофазная ядерная магнитнорезонансная спектроскопия с вращением под магическим углом (MAS) фтора-19, твердофазная ядерная магнитно-резонансная спектроскопия с кроссполяризационным вращением под магическим углом(CPMAS) углерода-13, твердофазная инфракрасная спектроскопия с фурье-преобразованием и спектроскопия комбинационного рассеяния Рамана. Согласно первой категории данного варианта в лекарственном веществе присутствует от приблизительно 5 до приблизительно 100 мас.% кристаллического моногидрата. Согласно второй категории данного варианта в лекарственном веществе присутствует от приблизительно 10 до приблизительно 100 мас.% кристаллического моногидрата. Согласно третьей категории данного варианта в лекарственном веществе присутствует от приблизительно 25 до приблизительно 100 мас.% кристаллического моногидрата. Согласно четвертой категории данного варианта в лекарственном веществе присутствует от приблизительно 50 до приблизительно 100 мас.% кристаллического моногидрата. Согласно пятой категории данного варианта в лекарственном веществе присутствует от приблизительно 75 до приблизительно 100 мас.% кристаллического моногидрата. В соответствии с шестой категорией данного варианта, по существу, все лекарственное вещество из дигидрофосфата представляет собой кристаллический моногидрат согласно настоящему изобретению, т.е. лекарственное вещество из дигидрофосфата, по существу, представляет собой моногидрат в чистой фазе.-2 009042 Кристаллический дигидрофосфат согласно настоящему изобретению имеет фармацевтические преимущества перед свободным основанием и ранее описанным гидрохлоридом (WO 03/004498) при получении фармацевтического лекарственного продукта, содержащего фармакологически активный ингредиент. В частности, повышенная химическая и физическая стабильность кристаллического моногидрата дигидрофосфата обладает преимущественными свойствами при получении твердых фармацевтических препаративных форм, содержащих фармакологически активный ингредиент. Дигидрофосфат согласно настоящему изобретению, проявляющий сильные свойства по ингибированию DP-IV, особенно подходит для предотвращения или лечения диабета 2 типа, ожирения и повышенного кровяного давления. Другой аспект настоящего изобретения касается способа предотвращения или лечения клинических состояний, при которых назначают ингибитор DP-IV, включающего введение пациенту, нуждающемуся в таком предотвращении или лечении, профилактически или терапевтически эффективного количества дигидрофосфата структурной формулы I или его гидрата, в частности, кристаллического моногидрата. Такие клинические состояния включают диабет, в частности, диабет 2 типа, гипергликемию, инсулинорезистентность и ожирение. Настоящее изобретение также касается использования дигидрофосфата структурной формулы I или ее гидрата, в частности, кристаллического моногидрата, для получения лекарственного средства для предотвращения или лечения клинических состояний, при которых назначают ингибитор DP-IV. Настоящее изобретение также касается фармацевтических композиций, включающих дигидрофосфатную соль структурной формулы I или его гидрат, в частности, кристаллический моногидрат, в сочетании с одним или более фармацевтически приемлемыми носителями или наполнителями. Согласно первому варианту фармацевтическая композиция включает терапевтически эффективное количество активного фармацевтического ингредиента в смеси с фармацевтически приемлемыми наполнителями, в которых активный фармацевтический ингредиент включает детектируемое количество кристаллического моногидрата согласно настоящему изобретению. В соответствии со вторым вариантом фармацевтическая композиция включает терапевтически эффективное количество активного фармацевтического ингредиента в смеси с фармацевтически приемлемыми наполнителями, в которых активный фармацевтический ингредиент включает от приблизительно 5 до приблизительно 100 мас.% кристаллического моногидрата согласно настоящему изобретению. В соответствии с первой категорией второго варианта активный фармацевтический ингредиент в таких композициях включает от приблизительно 10 до приблизительно 100 мас.% кристаллического моногидрата. В соответствии со второй категорией данного варианта активный фармацевтический ингредиент в таких композициях включает от приблизительно 25 до приблизительно 100 мас.% кристаллического моногидрата. В соответствии с третьей категорией данного варианта активный фармацевтический ингредиент в таких композициях включает от приблизительно 50 до приблизительно 100 мас.% кристаллического моногидрата. В соответствии с четвертой категорией данного варианта активный фармацевтический ингредиент в таких композициях включает от приблизительно 75 до приблизительно 100 мас.% кристаллического моногидрата. В соответствии с пятой категорией данного варианта, по существу, весь активный фармацевтический ингредиент представляет собой кристаллический моногидрат дигидрофосфата согласно настоящему изобретению, т.е. активный фармацевтический ингредиент, по существу, представляет собой моногидрат дигидрофосфата в чистой фазе. Композиции согласно данному изобретению предпочтительно имеют вид разовых препаративных форм, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные растворы или суспензии,дозируемые аэрозоли или жидкие распылители, капли, ампулы, устройства для самостоятельных инъекций или суппозитории. Данные композиции предназначены для перорального, парентерального, интраназального, сублингвального или ректального введения, либо для введения путем ингаляции или инсуфляции. Получение композиций согласно настоящему изобретению может быть легко осуществлено способами, известными в данной области техники, например, описанными в Remington's Pharmaceutical Sciences, 17th ed., 1995. Схему приема выбирают в соответствии с различными факторами, включая тип, вид, возраст, массу, пол и медицинское состояние пациента; тяжесть подвергаемого лечению состояния; способ введения,а также почечную и печеночную функцию пациента. Врач средней квалификации, ветеринар или клиницист может легко определить и назначить эффективное количество лекарственного средства, необходимое для предотвращения, противодействия или задержки развития состояния. Пероральные дозы согласно настоящему изобретению, применяемые для получения вышеуказанного действия, варьируются от приблизительно 0,01 мг на кг массы тела в день (мг/кг/день) до приблизительно 100 мг/кг/день, предпочтительно от 0,01 до 10 мг/кг/день и наиболее предпочтительно от 0,1 до 5,0 мг/кг/день. При пероральном введении композиции предпочтительно имеют вид таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 200 и 500 мг активного ингредиента для симптоматического подбора дозы для подвергаемого лечению пациента. Лекарственное средство обычно содержит приблизительно от 0,01 до 500 мг активного ингредиента, предпочтительно приблизительно от 1 до 200 мг активного ингредиента. При внутривенном введении наиболее предпочтительные дозы варьируются приблизительно от 0,1 до 10 мг/кг/мин во время вливания с постоянной скоростью. Кристалли-3 009042 ческие формы композиций согласно настоящему изобретению предпочтительно вводят в виде разовой суточной дозы, либо общая суточная доза может быть введена в виде разделенных доз два, три или четыре раза в сутки. Кроме того, кристаллические формы композиций согласно настоящему изобретению могут быть введены интраназальным способом путем местного применения подходящих интраназальных наполнителей, либо трансдермальными способами, с помощью трансдермальных накладок на кожу, хорошо известных рядовым специалистам в данной области техники. При введении с использованием трансдермальной системы доставки предпочтительным, безусловно, является непрерывное, а не прерывистое введение дозы при осуществлении всей схемы приема композиции. При использовании способов согласно настоящему изобретению подробно описанные здесь дигидрофосфат и кристаллические гидраты способны образовывать активный фармацевтический ингредиент,обычно вводимый в смеси с подходящими фармацевтическими разбавителями, наполнителями или носителями (в целом называемыми здесь "материалами-носителями"), выбранными с учетом предполагаемого вида использования, т.е. таблетки для перорального использования, капсулы, эликсиры, сиропы и т.п.,и соответствующими известным фармацевтическим способам. Например, при пероральном введении в виде таблетки или капсулы активный фармацевтический ингредиент может быть соединен с нетоксичным, фармацевтически приемлемым инертным носителем для перорального введения, таким как лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, магния стеарат, дикальция фосфат, кальция сульфат, маннит, сорбит и т.п.; при пероральном введении в жидком виде активный фармацевтический ингредиент может быть соединен с любым нетоксичным, фармацевтически приемлемым инертным носителем для перорального введения, таким как этанол, глицерин, вода и т.п. Более того, при желании или необходимости в смесь могут быть также введены подходящие связующие вещества, смазывающие вещества, расщепляющие агенты и красящие агенты. Подходящие связующие вещества могут включать крахмал, желатин, природные сахара, такие как глюкоза или беталактоза, кукурузные подсластители, природные и синтетические смолы, такие как аравийская камедь,трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, используемые в таких препаративных формах, включают натрия олеат, натрия стеарат,магния стеарат, натрия бензоат, натрия ацетат, натрия хлорид и т.п. Расщепители включают, без ограничений, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и т.п. Было установлено, что дигидрофосфат структурной формулы I и кристаллический моногидрат имеют высокую растворимость в воде, что делает их особенно подходящими для получения составов, в частности, составов для интраназального и внутривенного применения, которые требуют относительно концентрированных водных растворов активного ингредиента. Было установлено, что растворимость кристаллического моногидрата дигидрофосфата формулы I в воде составляет около 72 мг/мл. Согласно следующему аспекту настоящее изобретение касается способа получения дигидрофосфата формулы I, включающего взаимодействие 4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3 а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина следующей структурной формулы IV: с приблизительно одним эквивалентом фосфорной кислоты в подходящем С 1-С 5 алканоле, таком как метанол, этанол, изопропиловый спирт (IPA), изоамиловый спирт (IAA), или водном С 1-С 5 алканоле. Взаимодействие осуществляют в диапазоне температур от приблизительно 25 С до приблизительно 80 С. Раствор фосфорной кислоты может быть добавлен к раствору амина, либо наоборот. Кристаллический моногидрат дигидрофосфата получают кристаллизацией из водного раствора дигидрофосфата согласно описанной ниже методике. Общие способы кристаллизации моногидрата дигидрофосфата структурной формулы I(1) кристаллизация из смеси соединения I в этаноле и воде таким образом, что содержание воды составляет более 31 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя.(b) В системе изоамиловый спирт (IАА)/вода при температуре 25 С:(1) кристаллизация из смеси соединения I в IAA и воде таким образом, что содержание воды составляет более 2,9 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя.(1) кристаллизация из смеси соединения I в IAA и воде таким образом, что содержание воды со-4 009042 ставляет более 3,6 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя.(1) кристаллизация из смеси соединения I в IAA и воде таким образом, что содержание воды составляет более 4,5 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя.(e) В системе изопропиловый спирт (IРА)/вода при температуре 25 С:(1) кристаллизация из смеси соединения I в IPA и воде таким образом, что содержание воды составляет более 7,0 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя.(1) кристаллизация из смеси соединения I в IPA и воде таким образом, что содержание воды составляет более 8,1 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя.(1) кристаллизация из смеси соединения I в IPA и воде таким образом, что содержание воды составляет более 20 мас.%;(2) извлечение получаемой твердой фазы;(3) удаление из нее растворителя. Исходное соединение структурной формулы IV может быть получено способами, представленными ниже на схемах 1-3 и в примере 1. Согласно следующему аспекту настоящее изобретение касается способа лечения и/или предотвращения клинических состояний, при которых назначают ингибитор DP-IV, включающего введение пациенту, нуждающемуся в таком предотвращении или лечении, профилактически или терапевтически эффективного количества соли вышеприведенной формулы I или ее кристаллического гидрата. Следующие неограничивающие примеры предназначены для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие объем или сущность данного изобретения. Описанные здесь соединения могут существовать как таутомеры, такие как кето-енольные таутомеры. Отдельные таутомеры, равно как и их смеси, относятся к соединениям структурной формулы I. Термин "% энантиомерного избытка" (сокращенно "эи") означает процентное содержание основного энантиомера относительно процентного содержания второстепенного энантиомера. Таким образом,70% энантимерный избыток соответствует образованию 85% одного энантиомера и 15% другого. Термин Стадия А. Получение бисгидразида (1-1). Гидразин (20,1 г, 35 мас.% в воде, 0,22 моль) смешивают с 310 мл ацетонитрила. В течение 60 мин добавляют 31,5 г этилтрифторацетата (0,22 моль). Внутренняя температура повышается с 14 до 25 С. Полученный раствор выдерживают при температуре 22-25 С в течение 60 мин. Раствор охлаждают до 7 С. 17,9 г 50% водного NaOH (0,22 моль) и 25,3 г хлорацетилхлорида (0,22 моль) добавляют одновременно в течение 130 мин при температуре ниже 16 С. По завершении взаимодействия смесь подвергают вакуумной дистилляции для удаления воды и этанола при температуре 2730 С и давлении 2627 мм рт.ст. Во время дистилляции медленно добавляют 720 мл ацетонитрила, поддерживая постоянный объем (приблизительно 500 мл). Смесь фильтруют, удаляя хлорид натрия. Осадок промывают приблизительно 100 мл ацетонитрила. После удаления растворителя получают бис-гидразид 1-1 (43,2 г, выход 96,5%, чистота 94,4% по площади в результате анализа ВЭЖХ). 1 Н-ЯМР (400 МГц, ДMCO-d6):4,2 (с, 2 Н), 10,7 (с, 1 Н) и 11,6 (с, 1 Н) м.д. 13 С-ЯМР (100 МГц, ДМСО-d6):41,0, 116,1 (к, J = 362 Гц), 155,8 (к, J = 50 Гц) и 165,4 м.д. Стадия В. Получение 5-(трифторметил)-2-(хлорметил)-1,3,4-оксадиазола (1-2). Бисгидразид 1-1 со стадии А (43,2 г, 0,21 мол) в ацетонитриле (ACN) (82 мл) охлаждают до 5 С. Добавляют оксихлорид фосфора (32,2 г, 0,21 мол), поддерживая температуру ниже 10 С. Смесь нагревают до 80 С и выдерживают при данной температуре в течение 4 ч до тех пор, пока ВЭЖХ не покажет менее 2% площади 1-1. В отдельном сосуде смешивают 260 мл IPAc и 50 мл воды и охлаждают до 0 С. Реакционную взвесь загружают в тушильник, поддерживая внутреннюю температуру на уровне ниже 10 С. После добавления смесь энергично перемешивают в течение 30 мин, температуру повышают до комнатной температуры и водный слой отделяют. Затем органический слой промывают 215 мл 20 маc.% водным солевым раствором. Согласно анализу ВЭЖХ, выход после обработки составляет 86-92%. Летучие вещества удаляют дистилляцией при давлении 75-80 мм рт. ст. и температуре 55 С, получая масло,которое может быть использовано непосредственно на стадии С без дальнейшей очистки. Продукт также может быть подвергнут очистке дистилляцией, при этом выход 1-2 составляет 70-80%. 1 Н-ЯМР (400 МГц, CDCl3):4,8 (с, 2 Н) м.д. 13 С-ЯМР (100 МГц, CDCl3):32,1, 115,8 (к, J = 337 Гц), 156,2 (к, J = 50 Гц) и 164,4 м.д. Стадия С. Получение N- [(2Z)-пиперазин-2-илиден]трифторацетогидразида (1-3). К раствору этилендиамина (33,1 г, 55 мол) в метаноле (150 мл), охлажденному до -20 С, добавляют дистилированный оксадиазол 1-2 со стадии В (29,8 г, 0,16 моль), поддерживая внутреннюю температуру на уровне -20 С. Завершив добавление, полученную взвесь выдерживают при температуре -20 С в течение часа. Затем добавляют этанол (225 мл) и взвесь медленно нагревают до -5 С. Через 60 мин при температуре -5 С взвесь фильтруют и промывают этанолом (60 мл) при температуре -5 С. Получают амидин 1-3 в виде белого твердого вещества с выходом 72% (24,4 г, чистота 99,5 мас.% по площади в результате анализа ВЭЖХ). 1H-ЯМР (400 МГц, ДМСО-d6):2,9 (т, 2 Н), 3,2 (т, 2 Н), 3,6 (с, 2 Н) и 8,3 (ш, 1 Н) м.д. 13 С-ЯМР (100 МГц, ДМСО-d6):40,8, 42,0, 43,3, 119,3 (к, J = 350 Гц), 154,2 и 156,2 (к, J = 38 Гц) м.д. Стадия D. Получение 3-(трифторметил)-5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-а]пиразина гидрохлорида (1-4). Суспензию амидина 1-3 (27,3 г, 0,13 моль) в 110 мл метанола нагревают до 55 С. При данной температуре в течение 15 мин добавляют 37% хлористо-водородную кислоту (11,2 мл, 0,14 моль). Во время добавления все твердые вещества растворяются, образуя прозрачный раствор. Смесь выдерживают в течение 30 мин. Раствор охлаждают до 20 С и выдерживают при данной температуре до образования затравочного слоя (от 10 мин до часа). При температуре 20 С в течение часа добавляют 300 мл МТВЕ. Полученную взвесь охлаждают до 2 С, выдерживают в течение 30 мин и фильтруют. Твердые вещества промывают 50 мл этанола:МТВЕ (1:3) и сушат в вакууме при 45 С. Выход триазола 1-4 составляет 26,7 г (чистота 99,5 мас.% по площади в результате анализа ВЭЖХ). 1 Стадия А. Получение 4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)ил]-1-(2,4,5-трифторфенил)бутан-2-она (2-3). 2,4,5-Трифторфенилуксусную кислоту (2-1) (150 г, 0,789 моль), кислоту Meldrum (125 г, 0,868 моль) и 4-(диметиламино)пиридин (DMAP) (7,7 г, 0,063 мол) помещают в 5-литровую трехгорлую колбу. Одной порцией при комнатной температуре добавляют N,N-диметилацетамид (DMAc) (525 мл) для растворения твердых веществ. N,N-диизопропилэтиламина (282 мл, 1,62 моль) добавляют одной порцией при комнатной температуре, поддерживая температуру ниже 40 С. По каплям в течение 1-2 ч добавляют пивалоилхлорид (107 мл, 0,868 моль), поддерживая температуру от 0 до 5 С. Реакционную смесь выдерживают при температуре 5 С в течение часа. Одной порцией добавляют триазолгидрохлорид 1-4 (180 г,0,789 моль) при температуре 40-50 С. Реакционный раствор выдерживают при температуре 70 С в течение нескольких часов. Затем по каплям добавляют водный раствор гидрокарбоната натрия (625 мл) при температуре 20-45 С. Партию затравляют кристаллами и выдерживают при температуре 20-30 С в течение 1-2 ч. Затем по каплям в течение 2-3 ч дополнительно добавляют 525 мл водного раствора гидрокарбоната натрия. После старения при комнатной температуре в течение нескольких часов взвесь охлаждают до 0-5 С и выдерживают в течение часа перед фильтрацией твердого вещества. Влажный осадок промывают с замещением 20% водным DMAc (300 мл), затем двумя дополнительными порциями 20% водного DMAc (400 мл) и, наконец, водой (400 мл). Осадок сушат всасыванием при комнатной температуре. Выделенный выход конечного продукта 2-3 составляет 89%. Стадия В. Получение (2Z)-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин 7(8H)-ил]-1-(2,4,5-трифторфенил)бут-2-ен-2-амина (2-4). В 5-литровую круглодонную колбу помещают метанол (100 мл), кетоамид 2-3 (200 г) и ацетат аммония (110,4 г). Затем добавляют метанол (180 мл) и 8% водный гидроксид аммония (58,6 мл), поддерживая температуру во время добавления на уровне ниже 30 С. К реакционной смеси дополнительно добавляют метанол (100 мл). Смесь нагревают при температуре дефлегмации и выдерживают в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, а затем приблизительно до 5 С на ледяной бане. Через 30 мин твердую часть фильтруют и сушат, получая 2-4 в виде твердого вещества (180 г); т.пл. 271,2 С. Стадия С. Получение (2R)-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин 7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина (2-5). В 500-миллилитровую колбу помещают димер хлор(1,5-циклооктадиен)родия(I) [Rh(cod)Cl]2 (292 мг, 1,18 ммоль) и (R,S) t-бутил Josiphos (708 мг, 1,3 ммоль) в атмосфере азота. Затем добавляют дегазированный МеОН (200 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. В 4 литровый автоклав для гидрирования помещают енаминамид 2-4 (118 г, 0,29 моль) вместе с МеОН (1 л). Взвесь подвергают дегазированию. Затем раствор катализатора переносят в автоклав для гидрирования в-7 009042 атмосфере азота. После трехкратного дегазирования енаминамид гидрируют под давлением 200 фунт/кв.дюйм газообразного водорода при температуре 50 С в течение 13 ч. Результаты ВЭЖХ показывают, что аналитический выход составляет 93%, а оптическая чистота - 94% энантиомерного избытка. Оптическую чистоту повышают еще больше следующим образом. Раствор метанола из реакции гидрогенизации (18 г в 180 мл МеОН) концентрируют и заменяют его метил t-бутиловым эфиром(МТВЕ) (45 мл). К полученному раствору добавляют водный раствор Н 3 РО 4 (0,5 М, 95 мл). После разделения слоев 3N NaOH (35 мл) добавляют к водному слою, который затем экстрагируют МТВЕ (180 мл + 100 мл). Затем раствор МТВЕ концентрируют, а растворитель заменяют горячим толуолом (180 мл, температура около 75 С). Затем раствору горячего толуола дают возможность медленно охладиться до 0 С(5-10 ч). Кристаллы выделяют фильтрацией (13 г, выход 72%, 98-99% энантиомерного избытка); т.пл. 114,1-115,7 С. 1H-ЯМР (300 МГц, CD3CN):7,26 (м), 7,08 (м), 4,90 (с), 4,89 (с), 4,14 (м), 3,95 (м), 3,40 (м), 2,68 (м),2,49 (м), 1,40 (шс). Соединение 2-5 существует в виде связанных с амидом ротамеров. Если не указано иначе, главные и второстепенные ротамеры сгруппированы вместе, поскольку сигналы углерода-13 разрешены недостаточно хорошо. 13 С-ЯМР (CD3CN):171,8, 157,4 (ддд, JCF = 242,4, 9,2, 2,5 Гц), 152,2 (главный), 151,8 (второстепенный), 149,3 (ддд, JCF = 246,7, 14,2, 12,9 Гц), 147,4 (ддд, JCF = 241,2, 12,3, 3,7 Гц), 144,2 (к, JCF = 38,8 Гц),124,6 (ддд, JCF = 18,5, 5,9, 4,0 Гц), 120,4 (дд, JCF = 19,1, 6,2 Гц), 119,8 (к, JCF = 268,9 Гц), 106,2 (дд, JCF = 29,5, 20,9 Гц), 50,1, 44,8, 44,3 (главный), 43,2 (второстепенный), 42,4, 41,6 (второстепенный), 41,4, 39,6,38,5 (второстепенный), 36,9. Кристаллическое свободное основание также может быть выделено следующим образом.(a) После завершения стадии гидрогенизации реакционную смесь загружают 25 мас.% Ecosorb C941. Смесь перемешивают в атмосфере азота в течение часа, а затем фильтруют. Осадок промывают 2 л/кг метанола. Восстановление свободного основания составляет около 95%, а оптическая чистота - около 95% энантиомерного избытка.(b) Раствор свободного основания в метаноле концентрируют до объема 3,5-4,0 л/кг (в расчете на загрузку свободного основания), а затем заменяют растворитель изопропанолом (IPA) до получения конечного объема 3,0 л/кг IPA.(c) Взвесь нагревают до 40 С и выдерживают при 40 С в течение часа, а затем охлаждают до 25 С в течение 2 ч.(d) В течение 7 ч добавляют гептан (7 л/кг) и взвесь перемешивают в течение 7 ч при температуре 22-25 С. Концентрация надосадочной жидкости до фильтрования составляет 10-12 мг/г.(e) Взвесь фильтруют, а твердый остаток промывают 30% IРА/гептана (2 л/кг).(f) Твердое вещество сушат в вакуумной печи при температуре 40 С.(g) Оптическая чистота свободного основания составляет около 99% энантиомерного избытка. Для определения процентной величины превращения в продукт используют следующие условия с высокоэффективной жидкостной хроматографии (ВЭЖХ): Колонка:tBu Josiphos: 8,7 мин Для определения оптической чистоты были использованы следующие условия высокоэффективной жидкостной хроматографии (ВЭЖХ): Колонка:(S)-амин 2-5: 11,2 мин Моногидрат дигидрофосфата (2R)-4-оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3 а]пиразин-7(8H)-ил]-1-(2,4,5-трифторфенил)бутан-2-амина. В 250-миллилитровую круглодонную колбу, оборудованную подвесной мешалкой, нагревающим кожухом и термопарой, загружают 31,5 мл изопропанола (IPA), 13,5 мл воды, 15,0 г (36,9 ммоль) (2R)-4 оксо-4-[3-(трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-а]пиразин-7(8H)-ил]-1-(2,4,5 трифторфенил)бутан-2-амина в виде свободного основания и 4,25 г (36,9 ммоль) 85% водной фосфорной кислоты. Смесь нагревают до 75 С. При низких температурах образуется густой белый осадок, который растворяется, когда температура достигает 75 С. Раствор охлаждают до 68 С и выдерживают при данной температуре в течение 2 ч. Во время выдерживания образуется взвешенный слой твердых веществ (раствор может быть затравлен 0,5-5 маc.% небольших частиц дважды перемолотого моногидрата). После этого взвесь охлаждают со скоростью 4 С/ч до 21 С, а затем выдерживают в течение ночи. Потом к взвеси добавляют 105 мл IPA. Через час смесь фильтруют и промывают 45 мл IPA (твердые вещества также могут быть промыты водой/раствором IPA, чтобы избежать превращения в другие кристаллические формы). Твердые вещества сушат на фритте с отверстием для воздуха. Получают 18,6 г твердых веществ. В результате измерения при помощи ВЭЖХ процентной величины площади было установлено, что чистота твердых веществ превышает 99,8% (условия ВЭЖХ описаны выше). Анализ гранулометрического состава полученных твердых веществ показывает, что средний PSD составляет 80 мкм, при этом 95% - менее 180 мкм. Рентгеновская порошковая дифракция и термогравиметрический анализ показывают, что кристаллическая форма твердых веществ является моногидратной. Исследования при помощи рентгеновской порошковой дифракции широко используются для характеристики молекулярных структур, кристалличности и полиморфизма. Рентгеновская порошковая дифракционная картина кристаллического моногидрата дигидрофосфата была получена на рентгеновской дифракционной системе Philips Analytical X'Pert PRO X-ray Diffraction System с пультом PW3040/60. В качестве источника была использована керамическая рентгеновская трубка Сu LEF с К-альфа излучением PW3373/00. Фиг. 1 показывает рентгеновскую дифракционную картину кристаллического моногидрата дигидрофосфата структурной формулы II. Моногидрат имеет характерные дифракционные пики, соответствующие d-расстояниям 7,42, 5,48 и 3,96 . Моногидрат более точно характеризуется d-расстояниями 6,30, 4,75 и 4,48 . Моногидрат еще более точно характеризуется d-расстояниями 5,85, 5,21 и 3,52 . Помимо вышеописанных рентгеновских дифракционных картин кристаллическая моногидратная форма дигидрофосфата структурной формулы II также характеризуется своим спектром твердофазного ядерного магнитного резонанса (ЯМР) углерода-13 и фтора-19. Твердофазный ЯМР спектр углерода-13 получают на системе ЯМР Bruker DSX 400WB, используя 4-мм двухрезонансный датчик Bruker CPMAS. ЯМР спектр углерода-13 использует кроссполяризационное вращение под магическим углом протона/углерода-13 с кроссполяризацией с переменной амплитудой. Образец вращают при 15,0 кГц, в целом получая 2048 разверток с интервалом между циклами 20 с. Перед осуществлением FT к спектру применяют расширение линии, составляющее 40 Гц. Химические сдвиги определяют по шкале TMS, используя карбонильный углерод глицина (176,03 м.д.) для вторичного сравнения. Твердофазный ЯМР спектр фтора-19 получают на системе ЯМР Bruker DSX 400WB, используя 4 мм двухрезонансный датчик Bruker CPMAS. ЯМР спектр использует простую импульсную программу по сбору импульсов. Образцы вращают при 15,0 кГц, в целом получая 16 с интервалом между циклами 30 с. Чтобы свести к минимуму фон фтора, применяют торцевую крышку vespel. Перед осуществлением FT к спектру применяют расширение линии, составляющее 100 Гц. Химические сдвиги определяют, используя поли(тетрафторэтилен) (тефлон) для внешнего вторичного сравнения, которое показывает химический сдвиг, равный -122 м.д. Фиг. 2 показывает твердофазный ЯМР спектр CPMAS углерода-13 кристаллической моногидратной формы дигидрофосфата структурной формулы II. Моногидратная форма имеет характерные сигналы с величинами химического сдвига 169,1, 120,8 и 46,5 м.д. Более точная характеристика моногидратной формы включает сигналы с величинами химического сдвига 159,0, 150,9 и 40,7 м.д. Фиг. 3 показывает твердофазный ЯМР спектр MAS фтора-19 кристаллической моногидратной формы дигидрофосфата структурной формулы II. Моногидратная форма имеет характерные сигналы с величинами химического сдвига -64,5, -114,7 и -146, м.д. Более точная характеристика моногидратной формы включает сигналыс величинами химического сдвига -96,5, -104,4 и -154,5 м.д. Фиг. 4 представляет характерную кривую термогравиметрического анализа (TGA) кристаллической моногидратной формы дигидрофосфата структурной формулы II. Используют прибор Perkin Elmer, модель TGA 7, или подобный прибор. Эксперименты осуществляют в токе азота со скоростью нагревания 10 С/мин до максимальной температуры приблизительно 250 С. После автоматического тарирования баланса в платиновую чашу помещают от 5 до 20 мг образца, печь поднимают и включают программу нагревания. Прибор автоматически собирает данные по массе/температуре. Анализ результатов осущест-9 009042 вляют, выбирая функцию Delta Y среди математического обеспечения прибора, а также выбирая температуры, между которыми определяют потерю массы. Потерю массы определяют вплоть до начала разложения/упаривания. TGA показывает потерю массы около 3,3647%, начиная от комнатной температуры приблизительно до 250 С. Фиг. 5 представляет характерную кривую DSC кристаллической моногидратной формы дигидрофосфата структурной формулы II. Используют прибор ТА Instruments DSC 2910 или подобный прибор. От 2 до 6 г образца взвешивают в открытой чаше. Затем чашу зажимают и помещают на место образца в ячейку калориметра. Пустую чашу помещают в положение для сравнения. Ячейку калориметра закрывают и через нее пропускают поток азота. Программу нагревания устанавливают на уровне нагревания образца со скоростью 10 С/мин до температуры приблизительно 250 С. Включают программу нагревания. Завершив серию, данные анализируют при помощи программы DSC анализа, содержащейся в системе математического обеспечения. Эндотерму плавления интегрируют между точками температуры базовой линии, находящимися выше и ниже температурного диапазона, на протяжении которого наблюдается эндотерма. Получаемые данные включают температуру начала, пиковую температуру и энтальпию. Кристаллический моногидрат дигидрофосфата согласно настоящему изобретению имеет фазовую чистоту по меньшей мере около 5% формы с вышеописанными физическими характеристиками, определяемыми при помощи рентгеновской порошковой дифракции, ЯМР фтора-19 MAS, ЯМР углерода-13CPMAS и DCS. Согласно одному из вариантов фазовая чистота составляет по меньшей мере около 10% формы с вышеуказанными твердофазными физическими характеристиками. Согласно второму варианту фазовая чистота составляет по меньшей мере около 25% формы с вышеуказанными твердофазными физическими характеристиками. Согласно третьему варианту фазовая чистота составляет по меньшей мере около 50% формы с вышеуказанными твердофазными физическими характеристиками. Согласно четвертому варианту фазовая чистота составляет по меньшей мере около 75% формы с вышеуказанными твердофазными физическими характеристиками. Согласно пятому варианту фазовая чистота составляет по меньшей мере около 90% формы с вышеуказанными твердофазными физическими характеристиками. Согласно шестому варианту кристаллический моногидрат дигидрофосфата представляет собой, по существу, чистую фазовую форму с вышеописанными твердофазными физическими характеристиками. Под термином "фазовая чистота" подразумевается твердофазная чистота моногидрата дигидрофосфата с учетом конкретной кристаллической или аморфной формы соли, определяемая твердофазными физическими способами, описанными в данном изобретении. Было установлено, что кристаллический моногидрат дигидрофосфата является стабильным в условиях окружающей среды. Было также установлено, что при нагревании выше 40 С в потоке очень сухого азота он превращается в дегидратированный моногидрат. Дегидратированный моногидрат опять превращается в моногидрат в условиях окружающей среды. Примеры фармацевтических композиций 1) Способ прямого прессования. Моногидрат дигидрофосфата прессуют в таблетки, применяя способ прямого прессования. 100-мг таблетка включает 12 8,4 мг активного ингредиента, 127,8 мг микрокристаллической целлюлозы, 127,8 мг маннита (или 127,8 мг дикальция фосфата), 8 мг кроскармелозы натрия, 8 мг магния стеарата и 16 мгOpadry белого (патентованный материал для покрытий, выпускаемый Colorcon, West Point, PA). Активный ингредиент, микрокристаллическую целлюлозу, маннит (или дикальция фосфат) и кроскармелозу вначале смешивают, а затем полученную смесь смазывают стеаратом магния и прессуют в таблетки. Затем на таблетки наносят пленку из Opadry White. 2) Способ прессования прокаткой. Моногидрат дигидрофосфата прессуют в таблетки, применяя способ прессования прокаткой. 100-мг таблетка включает 128,4 мг активного ингредиента, 4 5 мг микрокристаллической целлюлозы, 111,6 мг дикальция фосфата, 6 мг кроскармелозы натрия, 9 мг магния стеарата и 16 мг Opadry белого (патентованный материал для покрытий, выпускаемый Colorcon, West Point, PA). Активный ингредиент, микрокристаллическую целлюлозу, дикальция фосфат и кроскармелозу вначале смешивают, а затем полученную смесь смазывают третьей частью от всего количества стеарата магния и прессуют прокаткой в виде полос. Затем полосы измельчают, а полученные гранулы смазывают оставшимся количеством стеарата магния и прессуют в виде таблеток. Затем на таблетки наносят пленку из Opadry White. 3) Водный состав для внутривенного (i.v.) использования представляет собой моногидрат дигидрофосфата формулы I в 10 мМ ацетата натрия/0,8% насыщенного солевого раствора при рН 4,50,2. Для получения состава, имеющего концентрацию 4,0 мг/мл, 800 мг NaCl растворяют в 80 мл воды, затем добавляют 57,5 мкл ледяной уксусной кислоты, после чего - 512 мг моногидрата дигидрофосфата. рН доводят до 4,50,2 при помощи 0,1 N раствора NaOH. Объем конечного раствора доводят до 100,0 мл при помощи воды. 2,0-мг/мл раствор может быть получен разбавлением 25,0 мл 4,0-мг/мл раствора до 100,0 мл плацебо. или ее фармацевтически приемлемый гидрат. 2. Соль по п.1 структурной формулы II, имеющая (R)-конфигурацию хирального центра, обозначенного 4. Соль по п.2, отличающаяся тем, что она представляет собой кристаллический моногидрат. 5. Соль по п.4, характеризующаяся характерными абсорбционными полосами на рентгеновской порошковой дифракционной картине со спектральными d-расстояниями, равными 7,42, 5,48 и 3,96 . 6. Соль по п.5, дополнительно характеризующаяся характерными абсорбционными полосами на рентгеновской порошковой дифракционной картине со спектральными d-расстояниями, равными 6,30,4,75 и 4,48 . 7. Соль по п.6, дополнительно характеризующаяся характерными абсорбционными полосами на рентгеновской порошковой дифракционной картине со спектральными d-расстояниями, равными 5,85,5,21 и 3,52 . 8. Соль по п.7, дополнительно характеризующаяся рентгеновской порошковой дифракционной картиной, представленной на фиг. 1. 9. Соль по п.4, характеризующаяся спектром твердофазного ядерно-магнитного резонанса углерода 13 CPMAS, содержащим сигналы при 169,1, 120,8 и 46,5 м.д. 10. Соль по п.9, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса углерода-13 CPMAS, содержащим сигналы при 159,0, 150,9 и 40,7 м.д. 11. Соль по п.10, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса углерода-13 CPMAS, представленным на фиг. 2. 12. Соль по п.4, характеризующаяся спектром твердофазного ядерно-магнитного резонанса фтора 19 MAS, содержащим сигналы при -64,5, -114,7, -136,3 и -146,2 м.д. 13. Соль по п.12, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса фтора-19 MAS, содержащим сигналы при -96,5, -104,4, -106,3 и -154,5 м.д. 14. Соль по п.13, дополнительно характеризующаяся спектром твердофазного ядерно-магнитного резонанса фтора-19 MAS, представленным на фиг. 3. 15. Соль по п.4, характеризующаяся кривой термогравиметрического анализа, представленной на фиг. 4. 16. Соль по п.4, характеризующаяся дифференциальной сканирующей калориметрической кривой,представленной на фиг. 4. 17. Лекарственное вещество, включающее детектируемое количество кристаллического моногидрата по п.4. 18. Лекарственное вещество по п.17, включающее от приблизительно 5 до приблизительно 100 мас.% указанного кристаллического моногидрата.- 11009042 19. Лекарственное вещество по п.17, включающее от приблизительно 10 до приблизительно 100 мас.% указанного кристаллического моногидрата. 20. Лекарственное вещество по п.17, включающее от приблизительно 25 до приблизительно 100 мас.% указанного кристаллического моногидрата. 21. Лекарственное вещество по п.17, включающее от приблизительно 50 до приблизительно 100 мас.% указанного кристаллического моногидрата. 22. Лекарственное вещество по п.17, включающее от приблизительно 75 до приблизительно 100 мас.% указанного кристаллического моногидрата. 23. Лекарственное вещество по п.17, вся масса которого, по существу, представляет собой указанный кристаллический моногидрат. 24. Фармацевтическая композиция для лечения диабета II типа, включающая терапевтически эффективное количество соли по п.1 или ее фармацевтически приемлемого сольвата в сочетании с одним или более фармацевтически приемлемыми носителями. 25. Фармацевтическая композиция для лечения диабета II типа, включающая терапевтически эффективное количество соли по п.4 или ее фармацевтически приемлемого сольвата в сочетании с одним или более фармацевтически приемлемыми носителями. 26. Способ лечения диабета II типа, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соли по п.1 или ее фармацевтически приемлемого гидрата. 27. Способ лечения диабета II типа, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соли по п.4.
МПК / Метки
МПК: A61P 3/10, C07D 487/04, A61K 31/4985
Метки: фосфорной, соль, кислоты, ингибитора, дипептидилпептидазы-iv
Код ссылки
<a href="https://eas.patents.su/14-9042-sol-fosfornojj-kisloty-ingibitora-dipeptidilpeptidazy-iv.html" rel="bookmark" title="База патентов Евразийского Союза">Соль фосфорной кислоты ингибитора дипептидилпептидазы-iv</a>
Предыдущий патент: Способ получения 1-октена
Следующий патент: Новые соединения пиридопиримидинона, способ их получения и фармацевтические композиции, которые их содержат
Случайный патент: Ген, кодирующий новый маркер рака












