Способы получения, фармацевтические композиции и способы применения твердой формы v вещества xlf-iii-43
Номер патента: 24071
Опубликовано: 31.08.2016
Авторы: Ван Чэн, Се Пин, Лю Янь, Чжэн Ли, Чэнь Сяогуан
Формула / Реферат
1. Твердая форма V вещества XLF-III-43 формулы (I)
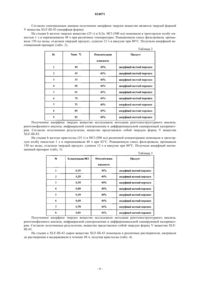
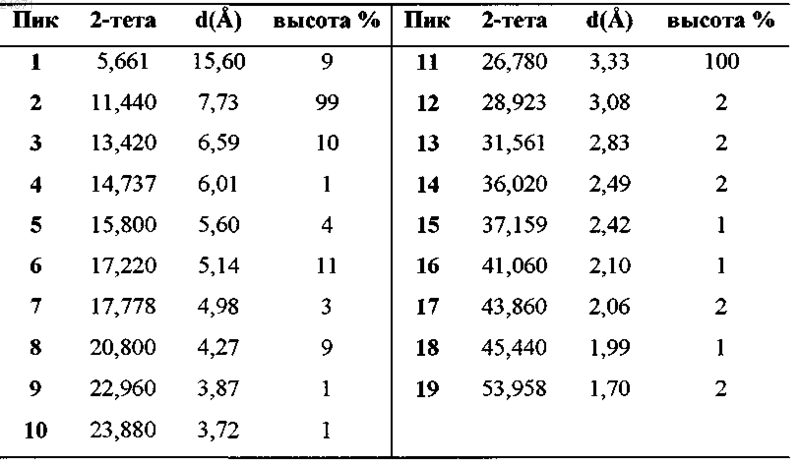
характеризующаяся пиками при анализе дифракции рентгеновских лучей на порошке (CuKα излучение), которые характеризуются нижеследующими значениями 2-тета (°), значениями d (Å), а также относительной интенсивностью дифракционных пиков: значения высоты пиков (высота в %).
2. Твердая форма V вещества XLF-III-43 по п.1, характеризующаяся тем, что на кривой ДСК имеется эндотермический пик с температурой перехода около 169°С и экзотермический пик с температурой перехода около 345°C.
3. Твердая форма V вещества XLF-III-43 по п.1, характеризующаяся тем, что инфракрасный спектр поглощения содержит пики поглощения при 3565,3, 3488,9, 3238,7, 3104,2, 1719,8, 1669,1, 1621,6, 1560,6, 1537,0, 1488,0, 1471,6, 1445,9, 1379,1, 1359,7, 1313,6, 1285,7, 1258,6, 1152,8, 1237,1, 1194,2, 1118,6, 1071,3, 1021,5, 968,3, 917,5, 893,2, 848,5, 835,4, 789,2, 763,4, 746,7, 727,2, 674,4, 623,1, 579,1, 559,4, 528,8, 506,1, 427,9 см-1, причем основными характеристическими пиками поглощения являются пики при 3565,3, 3488,9, 3238,7, 1719,8, 1669,1, 1560,6, 1379,1, 1258,6, 1237,1, 1194,2, 835,4, 427,9 см-1.
4. Фармацевтическая композиция для изготовления лекарственного средства для лечения диабетической нефропатии или гипертензивной нефропатии, включающая терапевтическую дозу твердой формы V вещества XLF-III-43 по любому из пп.1-3 и фармакодинамически приемлемый носитель.
5. Фармацевтическая композиция по п.4, которая находится в форме, выбранной из группы, состоящей из таблетки, капсулы, пилюли, препарата для инъекций, системы с замедленным высвобождением, системы с контролируемым высвобождением.
6. Применение твердой формы V вещества XLF-III-43 по любому из пп.1-3 для изготовления лекарственного средства для лечения диабетической нефропатии или гипертензивной нефропатии.
7. Способ лечения нарушения функции почек, которое представляет собой диабетическую нефропатию или гипертензивную нефропатию, включающий введение терапевтической дозы твердой формы V вещества XLF-III-43 по любому из пп.1-3.
8. Способ получения твердой формы V вещества XLF-III-43, включающий следующие стадии:
(а) образец XLF-III-43 помещают в индивидуальный или смешанный растворитель и нагревают до полного растворения, затем выдерживают в среде в интервале температур от 75 до 85°C при относительной влажности ниже 90% для полной перекристаллизации, получая образец твердого вещества XLF-III-43;
(b) образец твердого вещества XLF-III-43 со стадии (а) отделяют от раствора;
(c) переносят отделенный образец твердого вещества XLF-III-43, полученный на стадии (b), в разбавленную соляную кислоту более чем на 1 сутки, получая твердую форму V;
(d) высушивают полученную твердую форму V для удаления растворителя с поверхности,
где индивидуальный растворитель выбран из ДМФА, метанола, этанола, 95%-ного этанола, водного раствора аммиака, соляной кислоты и воды;
смешанный растворитель выбран из комбинаций метанола, этанола, 95%-ного этанола, ДМФА, водного раствора аммиака, соляной кислоты и воды в различных подходящих пропорциях.
Текст
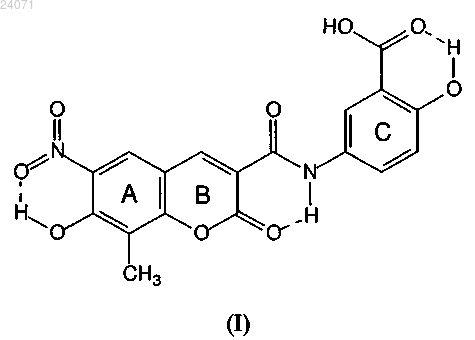
СПОСОБЫ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ТВРДОЙ ФОРМЫ V ВЕЩЕСТВА XLF-III-43 Данное изобретение показывает применение твердой формы V вещества XLF-III-43 в качестве исходного лекарственного вещества, оно относится к способам получения твердой формыV вещества XLF-III-43 в качестве исходных лекарственных веществ, к применению твердой формы V вещества XLF-III-43 в чистом виде и в виде смешанных кристаллов с различными соотношениями в качестве активных компонентов для разработки различных медицинских препаратов и фармацевтических композиций. Кроме того, изобретение также относится к применению твердой формы V вещества XLF-III-43 в качестве исходного лекарственного вещества для лечения нарушений функции почек, сердечно-мозговых сосудистых заболеваний, гипертонии,сахарного диабета типа II, осложнений при гипертонии и сахарном диабете, опухолей, предраковых состояний, эдемы, а также для получения терапевтического эффекта за счет повышения концентрации лекарства в крови при действии кристаллических форм для лечения заболеваний.(71)(73) Заявитель и патентовладелец: ИНСТИТЬЮТ ОФ МЭТЭРИЯ МЕДИКА, ЧАЙНИЗ ЭКЭДЕМИ ОФ МЕДИКЛ САЙНСИЗ (CN) Область техники Настоящее изобретение относится к применению твердой формы V вещества XLF-III-43 в качестве исходного лекарственного вещества, способам получения твердой формы V вещества XLF-III-43, применению твердой формы V в чистом виде и в виде смешанных кристаллов в различных соотношениях в качестве активных компонентов, а также разработке различных лекарственных средств и фармацевтических композиций. Кроме того, изобретение также относится к применению кристаллических формXLF-III-43 в качестве исходных лекарственных веществ для лечения нарушений функции почек, сердечно-мозговых сосудистых заболеваний, гипертонии, сахарного диабета типа II, осложнений при гипертонии и сахарном диабете, опухолей, предраковых состояний, эдемы и т.д. для повышения концентрации лекарств в крови за счет эффектов применения кристаллических форм и усиления терапевтического воздействия при лечении указанных заболеваний. Уровень техникиXLF-III-43: 3-(3'-карбокси-4'-гидроксианилинокарбо)-6-нитро-7-гидрокси-8-метилкумарин). Ниже представлена структура данного вещества: В патентах КНРCN 1506359 и CN 1829506 имеется информация об изобретении новых производных диарбарона (Diarbarone), способах получения, фармацевтических композициях на их основе и их применении. Настоящий документ относится к способам получения вещества XLF-III-43 и его производных, способам применения фармацевтических композиций, включающих эти соединения, при лечении нарушений функции почек, гипертонии, сердечно-мозговых сосудистых заболеваний, сахарного диабета типа II, опухолей, предраковых состояний, эдемы. Сущность изобретения Первая цель настоящего изобретения: предлагается твердая форма V вещества XLF-III-43. Вторая цель настоящего изобретения: предлагаются способы получения твердой формы V веществаXLF-III-43. Третья цель настоящего изобретения: получение различных лекарственных препаратов в форме таблеток, капсул, пилюль, составов для инъекций и препаратов с замедленным высвобождением и контролируемым высвобождением на основе фармацевтических композиций, содержащих твердую форму V вещества XLF-III-43 в качестве лекарственного сырья, а также один или несколько вспомогательных компонентов. Четвертая цель настоящего изобретения: достижение изменения концентрации лекарственного вещества в крови и улучшенного терапевтического действия за счет различий кристаллических формXLF-III-43 при использовании твердой формы V вещества XLF-III-43 в качестве лекарственного сырья при лечении нарушений функции почек, сердечно-мозговых сосудистых заболеваний, гипертонии, сахарного диабета типа II, осложнений при гипертонии и сахарном диабете, опухолей, предраковых состояний, эдемы. Пятая цель настоящего изобретения: обеспечение лекарственных препаратов и фармацевтических композиций, содержащих образцы твердой формы V вещества XLF-III-43 в качестве активных компонентов, используемых для лечения нарушений функции почек, сердечно-мозговых сосудистых заболеваний, гипертонии, сахарного диабета типа II, осложнений при гипертонии и сахарном диабете, опухолей,предраковых состояний, эдемы. Для достижения целей настоящего изобретения использованы следующие технические методы. Морфологические характеристики твердой формы V (аморфная форма) вещества XLF-III-43. 1. Твердая форма V вещества XLF-III-43 характеризуется тем, что в ней содержится связанная вода в аморфной форме, но не содержатся молекулы других растворителей. При исследовании твердой формыV вещества XLF-III-43 методом дифракции рентгеновских лучей на порошке (излучение CuK) получены дифракционные пики, которые характеризуются параметрами положения - 2-тета , d , а также относительной интенсивностью дифракционных пиков: значениями высоты пиков (высота в %). Ниже приведены характеристические значения пиков кристаллических твердых веществ (табл. 1, фиг. 3).-1 024071 Таблица 1 Характеристические величины для пиков при исследовании образца формы V вещества XLF-III-43 методом дифракции рентгеновских лучей на порошке 2. На кривой ДСК твердой формы V (аморфная форма) вещества XLF-III-43 (фиг. 4) наблюдается эндотермический пик с температурой перехода около 169 С и экзотермический пик с температурой перехода около 345 С. 3. Инфракрасный спектр поглощения твердой формы V (аморфная форма) вещества XLF-III-43(фиг. 5) содержит пики поглощения при 3565,3, 3488,9, 3238,7, 3104,2, 1719,8, 1669,1, 1621,6, 1560,6,1537,0, 1488,0, 1471,6, 1445,9, 1379,1, 1359,7, 1313,6, 1285,7, 1258,6, 1152,8, 1237,1, 1194,2, 1118,6, 1071,3,1021,5, 968,3, 917,5, 893,2, 848,5, 835,4, 789,2, 763,4, 746,7, 727,2, 674,4, 623,1, 579,1, 559,4, 528,8, 506,1,427,9 см-1, причем основными характеристическими пиками поглощения твердой формы V (аморфная форма) вещества XLF-III-43 являются пики при 3565,3, 3488,9, 3238,7, 1719,8, 1669,1, 1560,6, 1379,1,1258,6, 1237,1, 1194,2, 835,4, 427,9 см-1. Касательно твердой формы V вещества XLF-III-43 по настоящему изобретению оптимальной в качестве активного лекарственного компонента является практически чистая твердая форма V веществаXLF-III-43 (практически не содержащая какой-либо другой твердой формы XLF-III-43). Однако настоящее изобретение также предусматривает использование твердой формы V вещества XLF-III-43 в смеси с одной или несколькими другими кристаллическими формами XLF-III-43. Если активным компонентом лекарственного средства является смесь твердой формы V вещества XLF-III-43 и других кристаллических форм XLF-III-43, содержание этого компонента должно быть оптимизировано до величины не менее 50% твердой формы V вещества XLF-III-43, более оптимально - до величины не менее 70% твердой формы V вещества XLF-III-43, затем 80, 90, 95% и наиболее оптимально - до величины не менее 98% твердой формы V вещества XLF-III-43. Настоящее изобретение также предусматривает одну фармацевтическую композицию, содержащую твердую форму V вещества XLF-III-43 и носитель, приемлемый с точки зрения фармакодинамических свойств. Настоящее изобретение также обеспечивает способ получения твердой формы V (аморфная форма) вещества XLF-III-43:(a) образец XLF-III-43 помещают в индивидуальный или смешанный растворитель и нагревают до полного растворения, затем выдерживают в среде в интервале температур от 75 до 85 С при относительной влажности ниже 90% для полной перекристаллизации, получая образец твердого вещества(b) образец твердого вещества XLF-III-43 со стадии (а) отделяют от раствора;(c) переносят отделенный образец твердого вещества XLF-III-43, полученный на стадии b), в разбавленную соляную кислоту на период больше чем 1 сутки, получая твердую форму V;(d) высушивают твердую форму V для удаления растворителя с поверхности. Система растворителей может представлять собой индивидуальный растворитель или смесь растворителей. Например, растворитель может представлять собой ДМФА или смешанный растворитель,содержащий другой растворитель и ДМФА. Индивидуальные растворители, которые смешиваются с ДМФА, могут быть выбраны из следующей группы: метанол, этанол, 95%-ный этанол, водный раствор-2 024071 аммиака, соляная кислота, вода. К оптимальным растворителям относятся: ДМФА, этанол, 95%-ный этанол, наилучшим из которых является ДМФА. Смешанные растворители выбираются из комбинаций метанола, этанола, 95%-ного этанола,ДМФА, водного раствора аммиака, соляной кислоты и воды (комбинации двух видов или большего количества индивидуальных растворителей). Оптимальный смешанный растворитель - это смесь ДМФА с водой. Диапазон температуры - от 75 до 85 С, оптимально от 77 до 84 С, наиболее оптимально от 78 до 82 С. Диапазон относительной влажности - ниже 90%, оптимально ниже 70%, предпочтительно ниже 50%, наиболее оптимально ниже 40%. Время кристаллизации - от 24 до 120 ч, оптимально от 36 до 96 ч, наиболее оптимально 48 ч. Настоящее изобретение также относится к фармацевтическим композициям, содержащим твердую форму V вещества XLF-III-43 в качестве активных компонентов. Процесс приготовления фармацевтических композиций заключается в том, что несколько вспомогательных компонентов перемешивают с одной чистой твердой формой V вещества XLF-III-43. Указанные комбинированные лекарственные препараты готовят методами, общеизвестными в области медицины. Образцы твердой формы V вещества XLF-III-43 могут комбинироваться с одним или несколькими видами твердых или жидких наполнителей и/или вспомогательных фармацевтически приемлемых веществ, затем из них готовят любые препараты, пригодные для приема людьми или животными. Содержание твердой формы V вещества XLF-III-43 в фармацевтических композициях обычно составляет от 0,1 до 95 мас.%. Твердая форма V вещества XLF-III-43 или содержащие его фармацевтические композиции могут приниматься в виде разовых доз. Возможные способы приема: через кишечник или минуя кишечник, в частности прием внутрь, внутривенное введение, внутримышечное введение, подкожное впрыскивание,введение в полость носа, через слизистую оболочку полости рта, в глаза, через легкие и дыхательные пути, через кожу, влагалище, прямую кишку и т.д. Принимаемые лекарственные формы могут быть жидкими, твердыми или полутвердыми. Жидкие лекарственные формы могут представлять собой растворы (включая истинные растворы и коллоидные растворы), эмульсии (включая эмульсии типа масло в воде, вода в масле и многокомпонентные эмульсии), суспензии, препараты для инъекций (включая жидкие составы для уколов, порошки для инъекций и составы для трансфузии), глазные капли, капли в нос, лосьоны и жидкие мази. Твердые лекарственные формы могут представлять собой таблетки (включая обычные таблетки; кишечно-растворимые таблетки; таблетки для трансбуккального приема; диспергируемые таблетки; жевательные таблетки; шипучие таблетки; таблетки, распадающиеся в полости рта), капсулы (включая твердые капсулы, эластичные капсулы, кишечно-растворимые капсулы), гранулы, порошки, маленькие пилюли, каплеобразные пилюли,свечи, пленки, покрытия, аэрозоли. Полутвердые лекарственные формы могут представлять собой мази,гели и пасты. Твердая форма V вещества XLF-III-43 может быть введена в обычный лекарственный препарат, а также в систему с замедленным высвобождением, систему с контролируемым высвобождением, препарат с адресным действием и в разнообразные системы доставки веществ. Для приготовления таблеток, содержащих твердую форму V вещества XLF-III-43, могут быть использованы различные виды наполнителей, известных в медицине, в том числе разбавители, адгезивы,смачиватели, разрыхлители, смазывающие компоненты, скользящие компоненты. В качестве разбавителя может служить крахмал, декстрин, сахароза, глюкоза, лактоза, маннит, сорбит, ксилит, микрокристаллическая целлюлоза, сульфат кальция, фосфат кальция, карбонат кальция и т.д. В качестве смачивателя может использоваться вода, этанол, изопропанол и т.д. В качестве адгезива может использоваться крахмальная паста, декстрин, патока, мед, раствор глюкозы, микрокристаллическая целлюлоза, акациевый гуммиарабик, желатиновый гуммиарабик, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза,гидроксипропилметилцеллюлоза, этилцеллюлоза, акриловая смола, карбомер, поливинилпирролидон,полиэтиленгликоль и т.д. В качестве разрыхлителя может использоваться сухой крахмал, микрокристаллическая целлюлоза, олигомерная замещенная гидроксипропилцеллюлоза, сшитый поливинилпирролидин, кроскармеллоза натрия, карбоксиметилкрахмал натрия, бикарбонат натрия и лимонная кислота,эфир полиоксиэтиленсорбитола и жирных кислот, додецилсульфат натрия и т.д. В качестве смазывающих и скользящих компонентов может применяться порошок талька, диоксид кремния, стеарат, тартрат,парафиновое масло, полиэтиленгликоль и т.д. Кроме того, таблетки также могут быть изготовлены как таблетки с оболочкой, например таблетки с оболочкой из сахара, таблетки с пленочным покрытием, кишечно-растворимые таблетки, таблетки с двойной оболочкой, таблетки с несколькими оболочками. Для изготовления лекарственной формы в виде капсул твердая форма V вещества XLF-III-43 в качестве активного компонента может быть перемешано с разбавителем и скользящим компонентом, затем смесь может быть помещена в твердую или эластичную капсулу. Возможен также вариант, при котором после смешивания активного ингредиента, т.е. твердой формы V вещества XLF-III-43, с разбавителем,-3 024071 адгезивом, разрыхлителем и изготовления из этой смеси гранул или маленьких пилюль, последние помещают в твердые или эластичные гранулы. Различные типы разбавителей, адгезивов, смачивателей,разрыхлителей и скользящих веществ, используемые при изготовлении таблеток из твердой формы V вещества XLF-III-43, могут использоваться и при изготовлении капсул на основе твердой формы V вещества XLF-III-43. Для изготовления составов для инъекций на основе твердой формы V вещества XLF-III-43 в качестве растворителей могут использоваться вода, этанол, изопропанол, пропиленгликоль или их смеси. Кроме того, к растворителям необходимо в умеренном количестве добавлять солюбилизатор, вспомогательный растворитель, регулятор рН, регулятор осмотического давления, обычно используемые в области медицины. В качестве солюбилизатора или вспомогательного растворителя могут быть использованы полоксамер, лецитин, гидроксипропилциклодекстрин и т.д. В качестве регулятора рН могут применяться фосфат, ацетат, соляная кислота, гидроксид натрия и т.д. В качестве регулятора осмотического давления могут применяться хлорид натрия, маннитол, глюкоза, фосфат, ацетат и т.д. При изготовлении лиофилизированного порошка для инъекций в качестве вспомогательных компонентов могут использоваться маннит и глюкоза. Кроме того, в лекарственные препараты по мере необходимости могут добавляться окрашивающие добавки, консерванты, отдушки, корригенты и другие добавки. Для достижения терапевтического эффекта фармацевтических композиций по настоящему изобретению их можно применять любым существующим в медицине способом. Дозировка фармацевтических композиций на основе твердой формы V вещества XLF-III-43 может варьироваться в широких пределах в зависимости от характеристик и тяжести заболеваний, подлежащих профилактике и лечению, состояния конкретного пациента или животного, способа приема и лекарственной формы. Вообще говоря, диапазон приемлемых суточных доз для кристаллических формXLF-III-43 составляет от 0,001 до 150 мг/кг массы тела, предпочтительно от 0,1 до 100 мг/кг массы тела, более предпочтительно от 1 до 60 мг/кг массы тела, оптимально от 2 до 30 мг/кг массы тела. Вышеуказанная доза может приниматься в виде однократной дозы или быть разделена на несколько доз, в зависимости от клинического опыта врача и режима дозировки других лекарственных средств. Вещества и их комбинации по настоящему изобретению могут приниматься по отдельности либо в сочетании с другими целебными средствами или лекарствами, используемыми при симптоматическом лечении. При использовании данных веществ во взаимодействии с другими целебными средствами их дозировку следует корректировать с учетом конкретных условий. В настоящем изобретении обнаружено, что форма V вещества XLF-III-43 существует в твердом состоянии. Разработаны также 5 различных технологий получения для указанной твердой формы. Обнаружено, что твердая форма V вещества XLF-III-43 содержится в крови живых организмов в разной лекарственной концентрации. Изобретено лекарственное сырье и твердые фармацевтические композиции,принимаемые в различных дозировках, активными компонентами которых являются твердая форма V и смешанные кристаллы в различных соотношениях. Обнаружено, что твердая форма V вещества XLF-III43 может использоваться в качестве лекарственного сырья при профилактике и/или лечении нарушений функции почек, сердечно-мозговых сосудистых заболеваний, гипертонии, сахарного диабета типа II, осложнений при гипертонии и сахарном диабете, опухолей, предраковых состояний и эдемы, в особенности при профилактике и/или лечении диабетической нефропатии и гипертензивной нефропатии. Обнаружено, что твердая форма V вещества XLF-III-43 влияет на его содержание в крови живых организмов,а также что определенные кристаллические формы могут усиливать клинический терапевтический и профилактический эффект лекарственных средств. Номенклатура или сокращения:N,N'-диметилформамид (или ДМФА), молекулярная формула (CH3)2NCHO. Перечень чертежей Фиг. 1. Молекулярная структура XLF-III-43. Фиг. 2. Стереохимическая проекция молекулы XLF-III-43. Фиг. 3. Спектр дифракции рентгеновских лучей на порошке образца твердой формы V (аморфная форма) XLF-III-43. Фиг. 4. Кривая ДСК образца твердой формы V (аморфная форма 1) XLF-III-43. Фиг. 5. Инфракрасный спектр поглощения образца твердой формы V (аморфное вещество) XLF-III43. Фиг. 6. Анализ концентрации лекарственного средства в крови крыс для XLF-III-43, полученного перекристаллизацией из разных растворителей. Сведения, подтверждающие возможность осуществления изобретения Методики экспериментов. Для более наглядной иллюстрации технической реализации данного изобретения ниже приведены практические примеры, которые, однако, не ограничивают настоящее изобретение. Примеры получения Синтез образца XLF-III-43. ДМФА (35 кг) и (5,2 кг) гидролитического материала загружали в реактор объемом 100 л и перемешивали до получения раствора, в который затем загружали пиридин (1,6 кг). К реакционной смеси медленно при перемешивании прибавляли оксалилхлорид (3,0 кг). По окончании прибавления оксалилхлорида продолжали перемешивание реакционной смеси в течение еще 30 мин, далее поочередно вводили 5-аминосалициловую кислоту (3,2 кг) и пиридин (3,2 кг) и перемешивали 5 ч при 50-60 С. Реакционную смесь оставляли на ночь, после чего фильтровали и промывали ДМФА, разбавленной соляной кислотой и водой. Смесь сушили, получая 7,5 кг сырого продукта XLF-III-43. Очистка перекристаллизацией. В реактор загружали сырой XLF-III-43 (7,5 кг), ДМФА (106 кг) и древесный уголь (0,2 кг) и перемешивали 30 мин при 150 С. Далее реакционную смесь фильтровали и фильтрат оставляли на ночь. Осадок отделяли фильтрованием, промывали и сушили. Вещество XLF-III-43 (5,3 кг) было получено с выходом около 70,7%. Ниже описана аналитическая аппаратура, применявшаяся в практических экспериментах, и условия измерений. Рентгеноструктурный анализ с использованием отдельного кристалла. Дифрактометр MAC DIP-2030K, Япония. Условия эксперимента: MoK-излучение, графитовый монохроматор, расстояние от кристалла до пластины изображения d=100 мм, напряжение на трубке - 50 кВ, ток разряда - 90 мА, -сканирование,максимальный угол 2 50, диапазон съемки 0180, (угол поворота пластины) 5, шаг 5, скорость съемки 1,5/мин, двукратное сканирование каждой дифракционной картины, съемка суммарно 36 дифракционных картин. Анализ дифракции рентгеновских лучей на порошке. Рентгеновский дифрактометр D/max-2550 (Rigaku, Япония). Условия эксперимента: MoK-излучение, графитовый монохроматор, напряжение на лампе - 40 кВ,ток разряда - 150 мА, интервал сканирования по 2 - 3-80, скорость сканирования - 8/мин, шаг - 0,02,ограничивающие щели: DS = 1, RS = 0,15 мм, SS = 1. ИК-спектрометр. Фурье ИК-спектрометр Nicolet 5700 (American Thermoelectricity Company (Thermo. Условия эксперимента: таблетки с KBr. Дифференциальный сканирующий калориметр. Дифференциальный сканирующий калориметр EXSTAR 6200 (Perfect Engineering Company, Япония). Условия эксперимента: алюминиевый тигель, стандарт - Al2O3, N2 = 60 мл/мин, скорость подъема температуры - 10 С/мин. Пример 1. Получение образца твердой формы V вещества XLF-III-43. Стадия а. Сырое вещество XLF-III-43 (36 г) и ДМФА(540 мл) помещали в круглодонную колбу объемом 1 л. Смесь нагревали до 150 С на масляной бане. После полного растворения XLF-III-43 раствор помещали в среду с температурой 82 С, относительной влажностью 40% и выдерживали течение 48 ч. Получали желтое твердое вещество (25,5). Стадия b. Полученные желтые кристаллы (25 г) и 0,2 н. HCl (500 мл) помещали в трехгорлую колбу емкостью 1 л и перемешивали 48 ч при 50 С. Реакционную смесь фильтровали, промывали 150 мл воды, отделяли твердый продукт, сушили 12 ч в вакууме при 80 С. Получали аморфный неочищенный препарат с выходом 92%. При рентгенофазовом анализе (CuK излучение) полученного аморфного вещества зарегистрированы положения дифракционных пиков: величины 2-тетаили dи относительные интенсивности дифракционных пиков: высота пика (высота, %). В табл. 3 приведены данные для характеристических пиков полученного твердого вещества, а на фиг. 3 приведена рентгенограмма. Аморфный твердый продукт содержал только одну молекулу связанной воды, но не содержал других молекул растворителя. На кривой ДСК полученного аморфного твердого вещества (фиг. 4) имеется эндотермический пик с температурой перехода около 169 С и экзотермический пик с температурой перехода при 345 С. Инфракрасный спектр поглощения полученного аморфного твердого вещества (фиг. 5) содержит пики при 3565,3, 3488,9, 3238,7, 3104,2, 1719,8, 1669,1, 1621,6, 1560,6, 1537,0, 1488,0, 1471,6, 1445,9,1379,1, 1359,7, 1313,6, 1285,7, 1258,6, 1152,8, 1237,1, 1194,2, 1118,6, 1071,3, 1021,5, 968,3, 917,5, 893,2,848,5,835,4, 789,2, 763,4, 746,7, 727,2, 674,4, 623,1, 579,1, 559,4, 528,8, 506,1, 427,9 см-1, причем основными характеристическими пиками поглощения полученного аморфного твердого вещества являются пики при 3565,3, 3488,9, 3238,7, 1719,8, 1669,1, 1560,6, 1379,1, 1258,6, 1237,1, 1194,2, 835,4, 427,9 см-1.-5 024071 Согласно спектральным данным полученное аморфное твердое вещество является твердой формойV вещества XLF-III-43 (аморфная форма). На стадии b желтое твердое вещество (25 г) и 0,2 н. HCl (500 мл) помещали в трехгорлую колбу емкостью 1 л и перемешивали 48 ч при различных температурах. Реакционную смесь фильтровали, промывали 150 мл воды, отделяли твердый продукт, сушили 12 ч в вакууме при 80 С. Получали аморфный неочищенный препарат (табл. 2). Таблица 2 Полученное аморфное твердое вещество исследовали методами рентгеноструктурного анализа,рентгенофазового анализа, инфракрасной спектроскопии и дифференциальной сканирующей калориметрии. Согласно полученным результатам, вещество представляло собой твердую форму V веществаXLF-III-43. На стадии b желтые кристаллы (25 г) и HCl (500 мл) различной концентрации помещали в трехгорлую колбу емкостью 1 л и перемешивали 48 ч при 82C. Реакционную смесь фильтровали, промывали 150 мл воды, отделяли твердый продукт, сушили 12 ч в вакууме при 80 С. Получали аморфный неочищенный препарат (табл. 3). Таблица 3 Полученное аморфное твердое вещество исследовали методами рентгеноструктурного анализа,рентгенофазового анализа, инфракрасной спектроскопии и дифференциальной сканирующей калориметрии. Согласно полученным результатам, вещество представляло собой твердую форму V вещества XLFIII-43. На стадии a XLF-III-43 сырое вещество XLF-III-43 помещали в различные растворители, нагревали до растворения и выдерживали в течение 48 ч, получая кристаллы (табл. 4). На стадии b желтое твердое вещество (5 г) и HCl (100 мл) различной концентрации помещали в трехгорлую колбу емкостью 500 мл л и перемешивали 48 ч при 82 С. Далее реакционную смесь фильтровали, промывали 150 мл воды, отделяли твердый продукт, сушили 12 ч в вакууме при 80 С. Получали аморфный желтый порошок. Полученное аморфное твердое вещество исследовали методами рентгеноструктурного анализа,рентгенофазового анализа, инфракрасной спектроскопии и дифференциальной сканирующей калориметрии. Согласно полученным результатам, вещество представляло собой твердую форму V веществаXLF-III-43. Приготовление фармацевтических композиций твердой формы V вещества XLF-III-43 (таблетки). В качестве активного компонента брали индивидуальный образец твердой формы V вещества XLFIII-43, который вводили в фармацевтические композиции с несколькими вспомогательными веществами. В каждой таблетке содержалось около 5-60 мг лекарственного вещества. Состав таблеток приведен в табл. 5. Таблица 5 Состав таблеток XLF-III-43 Способ получения фармацевтической композиции на основе активного компонента - твердой формы V вещества XLF-III-43: исходное вещество смешивают с несколькими вспомогательными веществами, добавляют 1% раствора натриевой соли гидроксиметилцеллюлозы, размешивают с получением мягкого материала, гранулируют методом просеивания, влажные гранулы высушивают и просеивают, до-7 024071 бавляют порошки стеарата магния и талька и изготавливают таблетки. Практический пример 2. Влияние различных кристаллических форм на концентрацию лекарственного вещества в крови крыс. 1. Образцы кристаллов: кристаллическая форма II и твердая форма V вещества XLF-III-43, дисперсант кристаллической формы II (получен измельчением кристаллической формы II и твердой формы V вещества XLF-III-43). 2. Методическое исследование определения концентрации лекарственного вещества в крови.(1) Условия эксперимента. Аппаратура. ВЭЖХ: хроматографическая система Уотерс 2690, УФ-детектор 2487, система управления хроматографом Milnicousamidem 32. Колонка: 4,6250 мм Spherisorb C18 5 мкм; скорость потока: 1,0 мл/мин; температура колонки: 25; обнаружение на длине волны: 330 нм. После проведения твердофазной экстракции образцы плазмы непосредственно вводили в хроматограф и анализировали.(2) Исследование специфичности: согласно полученным результатам, наличие в крови эндогенных веществ и метаболитов не мешает определению.(3) Градуировочная кривая и линейный участок: в интервале концентраций XLF-III-43 5-200 нг/мл с хорошей точностью соблюдается линейная зависимость (коэффициент корреляции r=0,9999).(4) Анализ добавок: степень извлечения при экстракции (более 75%) соответствует требованиям Государственного управления по контролю за продуктами и лекарствами (Китай, SFDA) для фармакокинетических методов.(5) Чувствительность: предел обнаружения - 2 нг/мл, предел количественного определения 5 нг/мл. 3. Фармакокинетическое исследование. Результаты предварительных фармакокинетических измерений кристаллических форм и аморфной формы XLF-III-43 показали, что (фиг. 6) после однократного перорального приема XLF-III-43 в количестве 30 мг/кг максимальная концентрация в плазме Cmax составила 2 мкг/мл, время достижения максимальной концентрации (Tmax) - 0,5 ч, период полувыведения - обнаруживалось через 36 ч, но не обнаруживалось через 48 ч. Через определенный промежуток времени твердая форма V вещества XLF-III-43 обнаруживалась в крови в более высокой концентрации, чем кристаллическая форма II вещества XLF-III-43. Между концентрациями в плазме кристаллической формы II вещества XLF-III-43 и дисперсанта кристаллической формы II вещества XLF-III-43 существенной разницы не обнаружено. Пример 3. Влияние разных твердых форм XLF-III-43 на острое нарушение функции почек у мышей,вызванное цисплатином. Цель: наблюдение влияния разных кристаллических форм XLF-III-43 на острое нарушение функции почек у мышей, вызванное цисплатином Материалы. Реагенты: кристаллическая форма I, II и твердая форма V вещества XLF-III-43 в виде суспензий с 0,5% натрий-карбоксиметилцеллюлозы. Положительный контроль: лозартан калия, компания ATIRA Hangzhou Merck SharpDohmePharmaceutics, партия: S1241. Исходное лекарственное вещество: цисплатин (ДДП), компании Shandong Qilu Pharmaceutics. Животные: самцы куньминских мышей массой 16-22 г, приобретены в Институте лабораторных исследований животных (Institute of Laboratory Animal Sciences) Китайской академии медицинских наук(тип II, сертификатSCXK-Jing 2000-0006). Всех мышей кормили в стандартных контейнерах для разведения, по 5 мышей на 1 контейнер, контейнеры содержали в сухом и чистом состоянии. Помещение,где содержались животные, проветривали и обеззараживали в определенное время. Световые условия от 8:00 до 20:00, комнатная температура - 20-26 С, влажность - 40-70%, корм - чистый корм для животных, приобретен в Центре для животных Академии военных медицинских наук (Animal Center of Academy of Military Medical Sciences), сертификат -: SCXX-(army)2002-001. Набор для биохимического исследования сыворотки: Компания с ограниченной ответственностьюBeihua Refined Chemical, Пекин. Аппаратура: сканирующий планшет-ридер WELLSCAN MK3; центрифуга Germent SIGMA3K 15; рефрижераторная центрифуга TGL-16G, компании по производству научного оборудования (Anting Scientific Instrument Factory), Шанхай; встряхиватель, Бохемия-Нью-Йорк, США. Методы. Разделение животных на группы: в соответствии с массой тела, самцы куньминских мышей массой 18-22 г случайным образом делили на 9 групп: контрольная группа; группа, получающая цисплатин (модельная); группа, получающая лозартан калия; группы, получающие три кристаллические формыXLF-III-43, для всех групп n=8. Моделирование и введение: препарат-8 024071 дня до введения цисплатина путем интраперитонеальной инъекции группа лозатран калия и группы кристаллических форм XLF-III-43 получали интраперитонеально соответствующие препараты. Животным контрольной группы вводили равный объем физиологического раствора. Определение показателей сыворотки: образцы крови собирали из глазничного венозного сплетения на 3, 5 и 7 сутки после введения цисплатина. Определяли азот мочевины (BUN) и креатинин (Scr) сыворотки с помощью набора для биохимического исследования сыворотки. Результаты: в модельной группе значения Scr и BUN сыворотки сильно увеличились, что подтверждает правильность выбора модели животных. Среди групп, получивших препарат, наилучший эффект защиты функции почек с хорошим соотношением доза-эффект обнаружен для группы, получивший аморфную форму XLF-III-43. Таблица 6 А Защитный эффект различных форм XLF-III-43 против острого нарушения функции почек у мышей, вызванного цисплатином(3 суток после введения цисплатина) Таблица 6B Защитный эффект различных форм XLF-III-43 против острого нарушения функции почек у мышей, вызванного цисплатином(5 суток после введения цисплатина)-9 024071 Таблица 6C Защитный эффект различных форм XLF-III-43 против острого нарушения функции почек у мышей, вызванного цисплатином(7 суток после введения цисплатина) характеризующаяся пиками при анализе дифракции рентгеновских лучей на порошке (CuK излучение), которые характеризуются нижеследующими значениями 2-тета , значениями d , а также относительной интенсивностью дифракционных пиков: значения высоты пиков (высота в %). 2. Твердая форма V вещества XLF-III-43 по п.1, характеризующаяся тем, что на кривой ДСК имеется эндотермический пик с температурой перехода около 169 С и экзотермический пик с температурой перехода около 345C. 3. Твердая форма V вещества XLF-III-43 по п.1, характеризующаяся тем, что инфракрасный спектр поглощения содержит пики поглощения при 3565,3, 3488,9, 3238,7, 3104,2, 1719,8, 1669,1, 1621,6, 1560,6,1537,0, 1488,0, 1471,6, 1445,9, 1379,1, 1359,7, 1313,6, 1285,7, 1258,6, 1152,8, 1237,1, 1194,2, 1118,6, 1071,3,1021,5, 968,3, 917,5, 893,2, 848,5, 835,4, 789,2, 763,4, 746,7, 727,2, 674,4, 623,1, 579,1, 559,4, 528,8, 506,1,427,9 см-1, причем основными характеристическими пиками поглощения являются пики при 3565,3,3488,9, 3238,7, 1719,8, 1669,1, 1560,6, 1379,1, 1258,6, 1237,1, 1194,2, 835,4, 427,9 см-1.- 10024071 4. Фармацевтическая композиция для изготовления лекарственного средства для лечения диабетической нефропатии или гипертензивной нефропатии, включающая терапевтическую дозу твердой формыV вещества XLF-III-43 по любому из пп.1-3 и фармакодинамически приемлемый носитель. 5. Фармацевтическая композиция по п.4, которая находится в форме, выбранной из группы, состоящей из таблетки, капсулы, пилюли, препарата для инъекций, системы с замедленным высвобождением, системы с контролируемым высвобождением. 6. Применение твердой формы V вещества XLF-III-43 по любому из пп.1-3 для изготовления лекарственного средства для лечения диабетической нефропатии или гипертензивной нефропатии. 7. Способ лечения нарушения функции почек, которое представляет собой диабетическую нефропатию или гипертензивную нефропатию, включающий введение терапевтической дозы твердой формы V вещества XLF-III-43 по любому из пп.1-3. 8. Способ получения твердой формы V вещества XLF-III-43, включающий следующие стадии:(а) образец XLF-III-43 помещают в индивидуальный или смешанный растворитель и нагревают до полного растворения, затем выдерживают в среде в интервале температур от 75 до 85C при относительной влажности ниже 90% для полной перекристаллизации, получая образец твердого вещества(b) образец твердого вещества XLF-III-43 со стадии (а) отделяют от раствора;(c) переносят отделенный образец твердого вещества XLF-III-43, полученный на стадии (b), в разбавленную соляную кислоту более чем на 1 сутки, получая твердую форму V;(d) высушивают полученную твердую форму V для удаления растворителя с поверхности,где индивидуальный растворитель выбран из ДМФА, метанола, этанола, 95%-ного этанола, водного раствора аммиака, соляной кислоты и воды; смешанный растворитель выбран из комбинаций метанола, этанола, 95%-ного этанола, ДМФА,водного раствора аммиака, соляной кислоты и воды в различных подходящих пропорциях.
МПК / Метки
МПК: A61P 9/12, A61P 13/12, A61P 9/14, A61P 9/10, A61P 7/10, C07D 311/16, A61K 31/37, A61P 3/10, A61P 35/00
Метки: вещества, композиции, твердой, способы, применения, фармацевтические, xlf-iii-43, получения, формы
Код ссылки
<a href="https://eas.patents.su/14-24071-sposoby-polucheniya-farmacevticheskie-kompozicii-i-sposoby-primeneniya-tverdojj-formy-v-veshhestva-xlf-iii-43.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения, фармацевтические композиции и способы применения твердой формы v вещества xlf-iii-43</a>
Предыдущий патент: Способ и композиция для улучшенного извлечения углеводородов
Следующий патент: Фармацевтическая дозированная форма, включающая производное глюкопиранозилдифенилметана, и применения для улучшения гликемического контроля у пациентов
Случайный патент: Способ подземного взрывания горной породы