Производные деоксиактагардина в
Формула / Реферат
1. Производное деоксиактагардина В, выбранное из деоксиактагардина В (7-амино-1-гептиламид монокарбоксамид), деоксиактагардина В (9-амино-1-нониламид монокарбоксамид), деоксиактагардина В (12-амино-1-додециламид монокарбоксамид), или его фармацевтически приемлемая соль или сольват.
2. Производное деоксиактагардина В по п.1, представляющее собой деоксиактагардин В (7-амино-1-гептиламид монокарбоксамид) или его фармацевтически приемлемую соль или сольват.
3. Фармацевтическая композиция, содержащая производное деоксиактагардина В по п.1 или 2 и фармацевтически приемлемый наполнитель.
4. Композиция по п.3, предназначенная для перорального введения или парентерального введения.
5. Применение производного деоксиактагардина В по п.1 или 2 для лечения микробной инфекции.
6. Применение композиции по п.3 или 4 для лечения микробной инфекции.
7. Применение по п.5 или 6, отличающееся тем, что микробная инфекция представляет собой инфекцию Clostridium.
8. Применение по п.7, отличающееся тем, что инфекция Clostridium представляет собой инфекцию Clostridium difficile.
9. Применение по п.8, отличающееся тем, что инфекция С. difficile представляет собой инфекцию толстой кишки и/или нижних отделов кишечника.
10. Применение по п.5 или 6, отличающееся тем, что микробная инфекция представляет собой избыточный бактериальный рост в тонком кишечнике.
11. Применение производного деоксиактагардина В по п.1 или 2 для лечения ульцеративного колита или синдрома раздраженного кишечника.
12. Применение композиции по п.3 или 4 для лечения ульцеративного колита или синдрома раздраженного кишечника.
13. Способ получения производного деоксиактагардина В по п.1, заключающийся во взаимодействии деоксиактагардина В с диаминоалканом, выбранным из группы, состоящей из 1,7-диаминогептана, 1,9-диаминононана и 1,12-диаминододекана, в присутствии бензотриазол-1-илокси-трипирролидинфосфония гексафторфосфата (РуВОР) в диметилформамиде (ДМФА).
14. Способ по п.13, отличающийся тем, что деоксиактагардин В синтезируют в Actinoplanes liguriae.
Текст
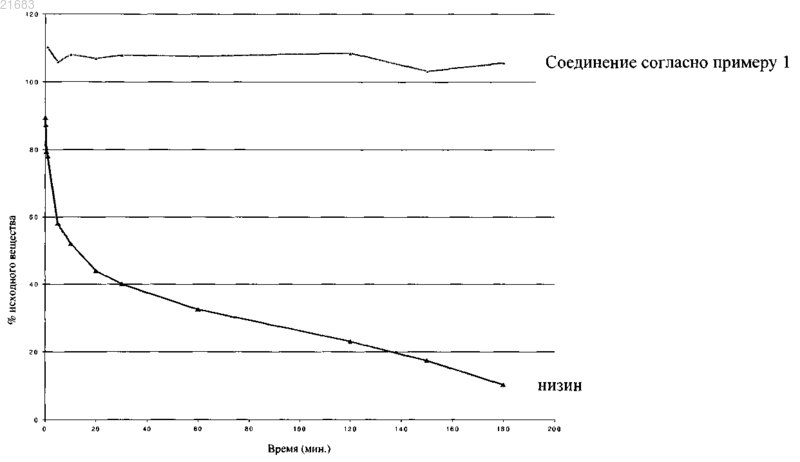
Изобретение относится к конкретным производным деоксиактагардина типа В, выбранным из деоксиактагардина В (7-амино-1-гептиламид монокарбоксамид), деоксиактагардина В (9-амино-1 нониламид монокарбоксамид), деоксиактагардина В (12-амино-1-додециламид монокарбоксамид) или его фармацевтически приемлемой соли или сольвата. Указанные соединения подходят для лечения микробных инфекций, например инфекции Clostridium, в частности С. difficile,локализованной в толстой кишке и/или в нижних отделах кишечника, а также для лечения диареи,вызванной микробной инфекцией. Вадман Сьрд Николаас (GB) Нилова М.И. (RU)(71)(73) Заявитель и патентовладелец: НОВАКТА БИОСИСТЕМС ЛИМИТЕД (GB) Настоящее изобретение относится к конкретным новым соединениям, фармацевтическим композициям, содержащим указанные соединения, и применению соединений и композиций для лечения микробных инфекций, в частности инфекции С. difficile, в частности, локализованной в толстой кишке и/или нижних отделах кишечника. Многие антибиотические соединения были выделены из природных источников, включая микроорганизмы. Часто антибиотические соединения обладают сложной химической структурой, в частности сложной стереохимической структурой. Недавно был идентифицирован ряд новых химических соединений антибиотиков на основе деоксиактагардина В, как описано в WO 2007/083112. Деоксиактагардин В синтезируется бактериями Actinoplanes liguriae, при этом указанное соединение и ряд его производных обладают многообещающими антибактериальными свойствами. Согласно настоящему изобретению были найдены новые соединения-аналоги деоксиактагардина типа В, обладающие оптимизированными свойствами, что делает указанные соединения особенно подходящими для применения для лечения микробных инфекций, например инфекции Clostridium, такой как С. perfringens, С. difficile, C. tetani и/или С. botulinum, в частности С. difficile, в частности инфекции толстой кишки и/или нижних отделов кишечника и диареи, вызванной микробной инфекцией. Согласно одному из аспектов предложено производное деоксиактагардина В, выбранное из деоксиактагардина В (7-амино-1-гептиламид монокарбоксамид),деоксиактагардина В (9-амино-1-нониламид монокарбоксамид),деоксиактагардина В (12-амино-1-додециламид монокарбоксамид),или его фармацевтически приемлемая соль или сольваты. Производные деоксиактагардина В (соединения), описанные в настоящем изобретении, обладают преимуществами, заключающимися в том, что они обладают очень высокой антибактериальной активностью против одного или более штамма С. difficile, например, в случае если активность определяют при помощи стандартного исследования, такого как минимальная ингибирующая концентрация (MIC), как правило, соединения, описанные в настоящем изобретении, обладают значением MIC, равным 2 мкг/мл или менее, одного или более штамма С. difficile. Кроме того, конкретные соединения, описанные согласно настоящему изобретению, обладают очень высокой активностью против ряда распространенных штаммов С. difficile. Дополнительно, соединения, описанные в настоящем изобретении, особенно подходят для введения людям и животным, так как указанные соединения обладают низкой антибактериальной активностью против естественной микрофлоры кишечника человеческого организма. В случае лечения диареи, вызванной микробной инфекцией, такой как С. difficile, ожидают снижение повторных симптомов в результате лечения соединениями согласно настоящему изобретению по сравнению с лечением известными антибиотиками вследствие способности естественной микрофлоры выживать при лечении соединениями согласно настоящему изобретению. В частности, соединения, описанные в настоящем изобретении, обладают очень низкой активностью против Bacteroides fragilis, Bacteroides thetaiotaomicron, Bifidobacteriumlongum, Lactobacillus rhamnosus и относительно низкой активностью против Peptostreptococcus anaerobius и Bifidobacterium adolescentis. Кроме того, при пероральном введении соединения, описанные в настоящем изобретении, не абсорбируются системно организмом, что обеспечивает возможность доставки активного вещества в относительно высокой концентрации в требуемый участок толстой кишки/кишечника. Таким образом, отсутствие системного высвобождения соединений в организм при парентеральном введении позволяет минимизировать любые возможные проявления побочных эффектов у пациентов. Инфекция и/или избыточный рост С. difficile являются наиболее распространенными проблемами у пациентов в период госпитализации. Это представляет собой реальную проблему для системы здравоохранения и может представлять собой угрозу для жизни подверженных болезням пациентов, таких как пожилые пациенты. В настоящее время применение ванкомицина является стандартным способом лечения тяжелых случаев инфекции С. difficile. Следовательно, для того чтобы альтернативные соединения, применяемые для лечения С. difficile, являлись полезными, необходимо, чтобы указанные соединения обладали активностью, примерно равной или большей по сравнению с активностью ванкомицина. Некоторые конкретные соединения проходят исследования для оценки возможности лечения С. difficile и/или резистентного к ванкомицину энтерококка, однако при этом часто активный ингредиент разлагается кислотой и/или ферментами в желудке или кишечнике. Такие соединения требуют парентеральной доставки или применения особых составов, таких как составы, находящиеся в кишечно-растворимой оболочке или капсуле, для обеспечения доставки активного ингредиента в толстую кишку в неразложившейся форме. Неожиданно было обнаружено, что соединения согласно настоящему изобретению несмотря на то, что указанные соединения содержат пептидные компоненты, не разлагаются в какойлибо значительной степени кислотой или ферментами желудка. Таким образом, соединения, описанные в настоящем изобретении, особенно подходят для перорального введения, что может являться преимуществом, так как при пероральном введении существует свобода выбора простых и эффективных составов,-1 021683 содержащих соединения, обеспечивающих локальную доставку неразложившегося активного вещества в толстую кишку. Конкретные соединения, описанные в настоящем изобретении, можно получить при помощи синтеза деоксиактагардина В в качестве промежуточного вещества у A. liguriae. Выход деоксиактагардина В в два раза или более превосходит выход промежуточных веществ-аналогов актагардина типа А, получаемых Actinoplanes garbadinensis, что может являться важным с точки зрения коммерческой/производственной перспективы. Физические свойства соединений, описанных в настоящем изобретении, такие как растворимость,стабильность и т.д., подходят для требуемого терапевтического применения. Краткое описание чертежей Фиг. 1 иллюстрирует восприимчивость к ферментативному расщеплению низина и производного деоксиактагардина В согласно примеру 1; на фиг. 2 представлены результаты in vivo модели для С. difficile; на фиг. 3 представлено количество соединений, выделяемых из организма в результате перорального введения; на фиг. 4 представлены данные анализа ВЭЖХ исходных веществ согласно примеру 1; на фиг. 5 представлены данные анализа ВЭЖХ после завершения реакции, представленной в примере 1; на фиг. 6 представлены данные анализа ВЭЖХ после концентрирования соединения согласно примеру 1 на С 18 Bond Elut; на фиг. 7 представлены данные анализа ВЭЖХ соединения согласно примеру 1 после проведения флэш-хроматографии. Подробное описание изобретения Согласно одному из аспектов настоящего описания предложено производное деоксиактагардина В(соединение), выбранное из деоксиактагардина В (7-амино-1-гептиламид монокарбоксамид), деоксиактагардина В (9-амино-1-нониламид монокарбоксамид), деоксиактагардина В (12-амино-1-додециламид монокарбоксамид), или его фармацевтически приемлемая соль или сольват. Соединения, представленные в настоящем описании, обладают значением MIC против по меньшей мере одного штамма С. difficile, равным 1 цг/мл или менее, и, как правило, значением активности против других распространенных штаммов С. difficile, равным 2 мкг/мл или менее. Некоторые соединения, описанные в настоящем изобретении, обладают активностью против ряда распространенных штаммов С.difficile, равной 1 и г/мл или менее. Способы получения соединений, аналогичных соединениям, описанным в настоящем изобретении,описаны в WO 2007/083112. Соединения, описанные в настоящем изобретении, могут находиться в виде и/или могут быть введены в форме фармацевтически приемлемой соли. Для обзора подходящих солей см. Берджа с соавт.(Berge et al.), J. Pharm. Sci., 1977, 66, 1-19. Как правило, фармацевтически приемлемую соль можно легко получить с применением, при необходимости, соответствующей кислоты или основания. Соль можно осаждать из раствора и собирать при помощи фильтрования или выделять при помощи выпаривания растворителя, например соединение согласно изобретению можно растворять в подходящем растворителе, например спирте, таком как метанол,после чего добавлять кислоту в указанном растворителе или другом подходящем растворителе. Затем можно осаждать непосредственно полученную в результате добавления кислоты соль или добавлять менее полярный растворитель, такой как диизопропиловый эфир или гексан, и выделять соль при помощи фильтрования. Специалистам в данной области техники станет очевидно, что в случае, если соединение согласно изобретению содержит более чем одну основную группу, могут быть получены бис- или трис-соли, которые также представляют собой соли согласно настоящему изобретению. Подходящие соли присоединения получают из неорганических или органических кислот, которые образуют нетоксичные соли, примерами являются лактобионат, манделат (включая (S)-(+)-манделат, (R)(-)-манделат и (R,S)-манделат), гидрохлорид, гидробромид, гидройодид, сульфат, бисульфат, нитрат,фосфат, гидрофосфат, глутамат, ацетат, трифторацетат, малеат, малат, фумарат, лактат, тартрат, цитрат,формиат, глюконат, сукцинат, этилсукцинат (4-этокси-4-оксобутаноат), пируват, оксалат, оксалоацетат,сахарат, бензоат, глюколят, глюкуронат, алкил- или арилсульфонаты (например, метансульфонат, этансульфонат, бензолсульфонат или п-толуолсульфонат) и изетионат. Дополнительным или альтернативным примером является мезилат. Фармацевтически приемлемые соли оснований включают аммонийные соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, и соли органических оснований, включая соли первичных, вторичных и третичных аминов, таких как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-Dглюкамин. Специалистам в области органической химии станет очевидно, что многие органические соедине-2 021683 ния могут образовывать комплексы с растворителями, в которых указанные соединения подвергают взаимодействию или из которых они осаждаются или кристаллизуются. Указанные комплексы известны как"сольваты". Например, комплекс с водой известен как "гидрат". Сольваты соединений согласно настоящему изобретению включены в рамки настоящего изобретения. Соли соединений согласно настоящему изобретению могут образовывать сольваты (например, гидраты), в описание также включены все указанные сольваты. Термин "пролекарство", используемый в настоящем описании, означает соединение, которое превращается в организме, например, в результате гидролиза в крови в активную форму, которая обладает медицинским действием. Фармацевтически приемлемые пролекарства описаны в работах Т. Higuchi andof prodrugs", Advanced Drug Delivery Reviews (1996) 19(2) 115-130, содержание каждой из которых включено в настоящее описание по всей полноте посредством ссылки. Пролекарства представляют собой любые ковалентно связанные носители, которые высвобождают соединение согласно настоящему изобретению in vivo, в случае, если указанное пролекарство вводят пациенту. Пролекарства, как правило, получают при помощи модификации функциональных групп таким образом, чтобы модифицированная группа разлагалась при помощи общепринятых манипуляций или in vivo с получением исходного соединения. Пролекарства включают, например, соединения, описанные в настоящем изобретении, в которых гидроксильная, амино- или сульфгидрильная группы связаны с любой группой, которая при введении пациенту разлагается с образованием гидроксильной, аминоили сульфгидрильной групп. Таким образом, типичные примеры пролекарств включают (но не ограничиваются только ими) ацетатные, формиатные и бензоатные производные спиртовой, сульфгидрильной и аминофункциональной групп соединений согласно настоящему изобретению. Также в случае карбоновой кислоты (-СООН) можно применять сложные эфиры, такие как метиловые сложные эфиры, этиловые сложные эфиры и т.д. Сложные эфиры могут быть активными сами по себе и/или могут гидролизоваться в условиях in vivo в организме человека. Подходящие фармацевтически приемлемые гидролизуемые in vivo сложноэфирные группы включают группы, которые быстро разлагаются в организме человека с образованием исходной кислоты или ее соли. Соединения согласно настоящему изобретению могут существовать в виде индивидуальных энантиомеров или диастереомеров. Все указанные изомерные формы, а также их смеси, включены в рамки настоящего изобретения. Разделение диастереомеров или цис- и транс-изомеров можно проводить при помощи общепринятых способов, например фракционной кристаллизации, хроматографии или ВЭЖХ. Стереомерная смесь агента также может быть получена из соответствующего оптически чистого промежуточного вещества или при помощи разделения, например, при помощи ВЭЖХ соответствующей смеси с применением подходящей хиральной подложки или при помощи фракционной кристаллизации диастереомерных солей,получаемых, при необходимости, в результате взаимодействия соответствующей смеси с подходящим оптически активным основанием, или кислотой. Соединения согласно настоящему изобретению, представленные в настоящем описании, также могут охватывать таутомерные формы, например кето/енольные таутомеры. Соединения согласно настоящему изобретению могут находиться в кристаллической или аморфной форме. Кроме того, некоторые кристаллические формы соединений согласно настоящему изобретению могут существовать в виде полиморфов, причем все указанные формы включены в рамки настоящего описания. Согласно другому аспекту в настоящем изобретении предложена фармацевтическая композиция,содержащая в качестве активного ингредиента соединение согласно настоящему изобретению или его фармацевтически приемлемое производное вместе с фармацевтически приемлемым наполнителем, разбавителем и/или носителем, применяемая в терапии, в частности, для лечения человека или животного,страдающих от состояния, симптомы которого облегчаются в результате действия антимикробного соединения. Согласно другому аспекту в изобретении предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединений, описанных в настоящем изобретении, и фармацевтически приемлемый наполнитель, разбавитель и/или носитель (включая их комбинации). Также согласно настоящему описанию предложен способ получения фармацевтической композиции, который включает смешение соединения согласно настоящему изобретению или его фармацевтически приемлемого производного с фармацевтически приемлемым наполнителем, разбавителем и/или носителем. Соединения согласно настоящему изобретению могут быть приготовлены в форме, предназначенной для введения при помощи любого подходящего способа, предназначенного для применения в лечении человека или в ветеринарии, соответственно в рамки настоящего описания включены фармацевтиче-3 021683 ские композиции, содержащие соединение согласно настоящему изобретению, предназначенные для применения в лечении человека или в ветеринарии. Указанные композиции в результате применения одного или более подходящего наполнителя, разбавителя и/или носителя можно применять согласно любым традиционным способам. Подходящие наполнители, разбавители и носители, предназначенные для терапевтического применения, хорошо известны в области фармацевтики и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co. (под ред. A.P. Дженнаро (A.R. Gennaro), 1985). Выбор фармацевтического наполнителя, разбавителя и/или носителя можно проводить с учетом требуемого способа введения и принятой фармацевтической практики. Фармацевтические композиции могут содержать в качестве (или дополнительно) наполнителя, разбавителя и/или носителя любое(ые) подходящее(ие) связывающее(ие) вещество(а), смазку(и), суспендирующий(е) агент(ы), образующий(е) оболочку агент(ы), повышающий(е) растворимость агент(ы). В фармацевтической композиции могут присутствовать консерванты, стабилизаторы, красители и даже ароматизаторы. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и сложные эфиры n-гидроксибензойной кислоты. Также можно применять антиоксиданты и суспендирующие агенты. Согласно некоторым вариантам реализации агенты, описанные в настоящем изобретении, также можно применять в комбинации с циклодекстрином. Циклодекстрины, как известно, образуют комплексы включения и комплексы, не содержащие включение, с молекулами лекарственного средства. Образование комплекса лекарственное средство-циклодекстрин может модифицировать растворимость, скорость растворения, биодоступность и/или стабильность молекулы лекарственного средства. Комплексы лекарственное средство-циклодекстрин, как правило, полезны в большинстве дозированных форм и способов введения. В качестве альтернативы образования комплекса непосредственно с лекарственным средством циклодекстрин можно применять в качестве вспомогательной добавки, например в качестве носителя, разбавителя или агента, улучшающего растворимость. Альфа-, бета- и гамма-циклодекстрины применяют наиболее часто, подходящие примеры описаны в WO 91/11172, WO 94/02518 и WO 98/55148. Соединения, описанные в настоящем изобретении, можно измельчать с применением известных способов измельчения, таких как мокрое измельчение, с получением частиц с размером, подходящим для получения таблеток и составов других типов. Мелкодисперсные (состоящие из наночастиц) препараты,содержащие соединения согласно настоящему изобретению, можно получать при помощи способов, известных в данной области техники, см., например, патентную заявку WO 02/00196 (SmithKline Beecham). Способы введения (доставки) включают, но не ограничиваются одним или более из следующих: пероральный (например, в виде сухого порошка/состава, содержащего свободно текучие частицы, таблетки, капсулы, или в виде распыляемого раствора или суспензии), ректальный, трансбуккальный или подъязычный. Соединения, описанные в настоящем изобретении, особенно подходят для перорального введения. В некоторых случаях возможно введение соединений, описанных в настоящем изобретении, при помощи топического, трансмукозального (например, в виде назального спрея или аэрозоля для ингаляции), назального, парентерального (например, в инъецируемой форме), желудочно-кишечного, интраспинального, интраперитонеального, внутримышечного, внутривенного, внутриматочного, внутриглазного, внутрикожного, внутричерепного, интратекального, внутривагинального, интрацеребровентрикулярного, внутримозгового, подкожного, офтальмологического (включая интравитреальный или интракамеральный) или чрезкожного способа. В зависимости от различных систем доставки к композициям/составам могут быть предъявлены различные требования. В качестве примера фармацевтическая композиция, описанная в настоящем изобретении, может быть получена с учетом проведения доставки с применением мини-насоса или при помощи трансмукозального способа, например, в виде назального спрея или аэрозоля для ингаляции или распыляемого раствора, или парентеральной доставки, при которой композиция входит в состав инъецируемой формы, доставляемой при помощи, например, внутривенного, внутримышечного или подкожного способа. Как альтернатива, состав может быть разработан с учетом проведения доставки при помощи обоих указанных способов. При необходимости фармацевтические композиции можно вводить при помощи ингаляции, в виде свеч или пессариев, топически в виде лосьона, раствора, крема, мази или присыпки, с применением трансдермального пластыря, перорально в виде таблеток, содержащих наполнители, такие как крахмал или лактоза, или в капсулах или суппозиториях индивидуально или в смеси с наполнителями, или в виде эликсиров, растворов или суспензий, содержащих ароматизаторы или красители, или можно вводить в виде парентеральной инъекции, например, внутривенно, внутримышечно или подкожно. В случае парентерального введения наиболее подходят композиции в виде стерильного водного раствора, которые могут содержать другие вещества, например соли и моносахариды в количестве, достаточном для получения раствора изотонического крови. В случае трансбуккального или подъязычного введения композиции можно вводить в виде таблеток или пастилок, которые могут быть получены традиционными способами. Следует понимать, что не все соединения необходимо вводить при помощи одного способа. Например, в случае если композиция содержит более чем один активный компонент, указанные компонен-4 021683 ты можно вводить при помощи различных способов. Композиции, описанные в настоящем изобретении, включают композиции, предназначенные конкретно для парентерального, перорального, трансбуккального, ректального, топического, офтальмологического, назального применения или применения в виде имплантантов или в мочеполовой системе. Согласно одному из аспектов настоящего изобретения агенты доставляются перорально, соответственно агент находится в форме, подходящей для пероральной доставки. В случае если соединения, описанные в настоящем изобретении, вводят парентерально, примеры указанного введения включают один или более способ из внутривенного, внутриартериального, интраперитонеального, интратекального, внутрижелудочкового, интрауретрального, надчревного, внутримозгового, внутримышечного или подкожного введения агента и/или введения с применением инфузионных способов. Соединения согласно настоящему изобретению можно вводить (например, перорально или топически) в виде таблеток, капсул, суппозиториев, эликсиров, растворов или суспензий, которые могут содержать ароматизаторы или красители, с немедленным, отложенным, модифицированным, замедленным,прерывистым или контролируемым высвобождением. Соединения согласно настоящему изобретению также могут быть предназначены для лечения человека или ветеринарии в форме, подходящей для перорального или трансбуккального введения, например,в виде растворов, гелей, сиропов, жидкостей для полоскания рта, или сухого порошка, смешиваемого с водой или другим подходящим носителем перед применением, возможно с ароматизаторами и красителями. Также можно применять твердые композиции, такие как таблетки, капсулы, пастилки, пастилы,пилюли, болюсы, порошок, пасты, гранулы, драже или предварительно смешанные препараты. Твердые и жидкие композиции, предназначенные для перорального применения, можно получать согласно способам, хорошо известным в данной области техники. Указанные композиции также могут содержать один или более фармацевтически приемлемых носителей и наполнитель, которые могут находиться в твердой или жидкой форме. Таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, сульфат кальция, двухосновный фосфат кальция и глицин, маннит, прежелатинированный крахмал, кукурузный крахмал, картофельный крахмал, разрыхлители, такие как натрия гликолят крахмала, кроскармеллоза натрия и конкретные сложные силикаты и вещества, связывающие гранулы, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и камедь. Дополнительно могут содержаться смазки, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции аналогичного типа также можно применять в качестве наполнителей капсул из желатина или ГПМЦ (гидроксипропилметилцеллюлозы). В указанном случае предпочтительные наполнители включают микрокристаллическую целлюлозу, лактозу, карбонат кальция, сульфат кальция,двухосновный фосфат кальция и маннит, прежелатинированный крахмал, кукурузный крахмал, картофельный крахмал или полиэтиленгликоли с высокой молекулярной массой. В случае водных суспензий и/или эликсиров агент можно объединять с различными подсластителями или ароматизаторами, окрашивающими веществами или красителями, эмульгаторами и/или суспендирующими агентами и разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, а также с комбинациями указанных веществ. Капсулы могут быть наполнены порошком (индивидуального лекарственного средства или в виде смеси с выбранным(и) наполнителем(ями или в качестве альтернативы жидкостью, при этом каждая капсула содержит одно или более соединение согласно настоящему изобретению и носитель. В случае,если капсула наполнена порошком, соединения согласно настоящему изобретению и/или носитель могут быть измельчены или размолоты с получением вещества с подходящим размером частиц. Соединения, описанные в настоящем изобретении, могут находиться в оболочке, например в кишечно-растворимой оболочке, в случае перорального введения в виде таблетки или капсулы. Таблетка или капсула, при необходимости, могут, например, находиться в оболочке, представляющей собой тонкую пленку, такую как пленка EUDRAGIT, производство Rohm Pharma Polymers, которая обеспечивает контролируемое растворение в желудочно-кишечном тракте. Пленки доступны в виде катионных полимеров, таких как EUDRAGIT E 100 (сополимеры аминоалкилметакрилата) или в виде анионных акриловых полимеров, таких как EUDRAGIT L (сополимеры метакриловой кислоты) и EUDRAGIT S. Также доступны проницаемые акриловые полимеры, такие как EUDRAGIT RL (сополимер аминометакрилата) и EUDRAGIT RS. Указанные оболочечные составы могут быть получены в виде водной дисперсии, возможно содержащей дополнительные ингредиенты, такие как тальк, силиконовая противопенная эмульсия, полиэтиленгликоль. Как альтернатива, оболочечный состав может быть получен в виде раствора органического полимера. В качестве альтернативы таблетки могут быть покрыты оболочкой с применением оболочечных си-5 021683OPADRY. Оболочки можно получать при помощи известных способов, например: 1) взвешивания требуемого количества пленочной оболочечной системы OPADRY,2) взвешивания требуемого количества воды или другого(их) растворителя(ей) в сосуде для перемешивания,3) перемешивания растворителей с образованием воронкообразного водоворота при помощи лопастной мешалки, расположенной в центре сосуда на наиболее низком возможном расстоянии до дна сосуда, в отсутствие доступа воздуха к жидкости,4) равномерного и быстрого добавления порошка OPADRY в воронкообразный водоворот, не допуская флотации порошка на поверхности жидкости,5) при необходимости, увеличения скорости перемешивания для сохранения воронкообразного водоворота,6) снижения скорости перемешивания после добавления всех порошковых ингредиентов и продолжения перемешивания в течение примерно 45 мин. Оболочки можно наносить при помощи известных способов с применением аппаратов для нанесения оболочки на таблетки. Толщина нанесенной оболочки, как правило, находится в диапазоне от 5 до 35 мкм, например от 10 до 30 мкм, более конкретно 10 или 20 мкм, в зависимости от требуемого действия. В качестве альтернативы таблетку или капсулу, при необходимости, можно поместить в другую капсулу (предпочтительно капсулу из ГПМЦ, такую как Capsugel) с получением конфигурации таблетка в капсуле или капсула в капсуле, которая при введении пациенту приводит к контролируемому растворению в желудочнокишечном тракте, обеспечивая действие, аналогичное действию, достигаемому при применении кишечно-растворимой оболочки. Таким образом, согласно одному из аспектов в настоящем изобретении предложен твердый дозируемый состав, содержащий соединение формулы (I) или (II), например, в котором состав содержит кишечно-растворимую оболочку. Согласно другому аспекту в настоящем изобретении предложен твердый дозируемый состав, содержащий защитную капсулу в качестве внешнего слоя, например состав вида таблетка в капсуле или капсула в капсуле. Кишечно-растворимая оболочка может обеспечивать улучшенную стабильность по сравнению с безоболочечными составами. Соединения, описанные в настоящем изобретении, также можно вводить перорально в ветеринарии в виде жидкой лекарственной формы, такой как раствор, суспензия или дисперсия активного ингредиента, вместе с фармацевтически приемлемым носителем или наполнителем. Соединения согласно настоящему изобретению также, например, могут входить в состав свечей,например, содержащих стандартные основы для свечей, применяемых для лечения человека или в ветеринарии, или в состав пессариев, например, содержащих стандартные основы для пессариев. Соединения, описанные в настоящем изобретении, также можно применять в комбинации с другими терапевтическими агентами. В настоящем описании, таким образом, предложена согласно другому аспекту комбинация, содержащая соединение согласно настоящему изобретению, или его фармацевтически приемлемое производное и дополнительный терапевтический агент. Комбинация, например, может представлять собой комбинацию соединения согласно настоящему изобретению и антибиотика, такого как ванкомицин. Комбинация может находиться в виде объединенного состава или может быть упакована в различные составы для одновременной или последовательной доставки. В случае, если соединение, описанное в настоящем изобретении, или его фармацевтически приемлемое производное применяют в комбинации со вторым терапевтическим агентом, обладающим активностью против того же болезненного состояния, дозировка каждого соединения может отличаться от дозировки, требуемой при применении индивидуального соединения. Подходящие дозировки очевидны специалистам в данной области техники. Следует понимать, что количество соединения, описанного в настоящем изобретении, требуемое для лечения, может изменяться в зависимости от природы состояния,требующего лечения, и возраста и состояния пациента и, наконец, от решения лечащего врача или ветеринара. Соединения, описанные в настоящем изобретении, при необходимости, можно применять, например, для введения с другими активными ингредиентами, такими как кортикостероиды. Комбинации, представленные выше, могут подходящим образом быть предназначены для применения в виде фармацевтического состава, и, таким образом, фармацевтические составы, содержащие комбинацию, определенную выше, вместе с фармацевтически приемлемым носителем или наполнителем,составляют дополнительный аспект настоящего изобретения. Индивидуальные компоненты указанных комбинаций можно вводить последовательно или одновременно в отдельных или комбинированных фармацевтических составах при помощи любого подходящего способа. В случае последовательного введения первым можно вводить соединение, описанное в настоящем изобретении, или второй терапевтический агент. В случае одновременного введения комбинацию можно вводить в виде одной или различных фармацевтических композиций. Следует понимать, что в случае объединения в одном составе два соединения должны быть стабильными и совместимыми друг с другом и другими компонентами состава. В случае раздельных составов указанные вещества можно применять в любых подходящих составах любыми подходящими способами, известными в данной области техники для указанных веществ. Композиции могут содержать 0,01-99% активного вещества. В случае топического введения, например, композиции, как правило, содержат 0,01-10%, более предпочтительно 0,01-1% активного вещества. Как правило, врачи определяют фактическую дозировку, которая наиболее подходит индивидуальному пациенту. Конкретная дозировка и частота дозирования любого конкретного пациента могут изменяться и зависят от ряда факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия указанного соединения, возраст, массу тела, общее состояние здоровья, пол, диету, режим и время введения, скорость выведения, комбинацию лекарственных средств, степень тяжести конкретного состояния и пациента, которого подвергают терапии. В случае перорального и парентерального введения человеку ежедневную дозировку агента можно вводить в виде единственной или различных доз. В случае системного введения ежедневная дозировка,применяемая для лечения взрослого человека, находится в диапазоне, составляющем 2-100 мг/кг массы тела, предпочтительно 5-60 мг/кг массы тела, причем указанную дозировку можно вводить, например, в виде от 1 до 4 доз в день в зависимости от способа введения и состояния пациента. В случае, если композиция содержится в стандартных дозированных формах, каждая стандартная форма предпочтительно содержит от 100 мг до 1 г активного ингредиента. Продолжительность лечения обусловлена скоростью ответа, а не произвольным количеством дней. Согласно одному из вариантов реализации лечение продолжают в течение 1-21 или более дней. Согласно одному из аспектов в настоящем изобретении предложено применение соединения согласно настоящему изобретению в терапии, например, для лечения микробных инфекций, таких как инфекция С. difficile, в частности диареи, вызванной указанной инфекцией или одной или более микробными инфекциями, представленными в настоящем описании, в частности при помощи пероральной доставки соединения согласно настоящему изобретению. Согласно одному из аспектов предложено применение соединения согласно настоящему изобретению для лечения тифлита (у животных). Согласно одному из аспектов соединение согласно настоящему изобретению применяют для контроля синдрома избыточного бактериального роста. Синдром избыточного роста (СИБР) возникает в случае, если стандартно низкое количество колоний бактерий в верхнем ЖКТ и/или нижних отделах кишечника значительно возрастает. Согласно одному из аспектов предложено применение соединения согласно настоящему изобретению для профилактики, лечения или сдерживания СРК (синдрома раздраженного кишечника). В качестве примера применения антибиотиков для лечения СРК см. Rifaximin Treatment for Symptoms of IrritableBowel Syndrome, Andrea L. Fumi and Katherine Trexler, The Annals of Pharmacotherap, 2008, 4, 408. Согласно одному из вариантов реализации соединение согласно настоящему изобретению полезно для лечения ульцеративного колита, а также профилактического лечения для предотвращения повторного возникновения указанного заболевания. Соединения особенно подходят для лечения стероидного рефракторного ульцеративного колита; см., например, Steroid-refractory ulcerative colitis treated with corticosteroids, metronidazole and vancomycin: a case report, авторы J. Miner, M.M. Gillan, P. Alex, M. Centola,BMC Gastroenterology 2005, 5:3. Соединения, описанные в настоящем изобретении, особенно подходят для длительного лечения. Согласно представленному выше описанию соединения, описанные в настоящем изобретении,можно применять для лечения людей и/или животных. Согласно одному из аспектов предложено соединение согласно настоящему изобретению, применяемое для производства лекарственного средства для лечения микробных инфекций, таких как инфекция С. difficile, в частности диареи, вызванной указанной инфекцией. Согласно одному из аспектов предложен способ лечения, включающий стадию введения терапевтически эффективного количества соединения согласно настоящему изобретению, или фармацевтической композиции, содержащей указанное соединение, пациенту (человеку или животному), нуждающемуся в подобном лечении, например, для лечения инфекции/болезни или заболевания, описанных в настоящем описании. В рамках настоящего описания термин "содержащий" следует понимать как "включающий". Аспекты настоящего изобретения, содержащие конкретные элементы, также распространяются на альтернативные варианты реализации, "состоящие" или "состоящие, по существу" из соответствующих элементов. Примеры Пример 1. Деоксиактагардина В (7-амино-1-гептиламид монокарбоксамид). Деоксиактагардин В (2,5 г), 1,7-диаминогептан (0,52 г) и диизопропилэтиламин (0,44 мл) растворяли в сухом диметилформамиде (10 мл). По частям в течение 2 ч добавляли раствор гексафторфосфата бензотриазол-1-илокси-трис-пирролидинофосфония (РуВОР) (1,04 г) в сухом диметилформамиде (5 мл). После проведения реакции проводили анализ ВЭЖХ (см. табл. 1) и добавляли РуВОР до израсходования исходных веществ (фиг. 4 и 5). Таблица 1 Условия проведения аналитической ВЭЖХ для разделения лантибиотика (например, актагардина, актагардина В или деоксиактагардина В) и диаминоалкановых производных продуктов Неочищенную реакционную смесь выливали в 30% водный раствор метанола и полученный раствор помещали в колонку Varian Bond Elut C18 (30 г). Затем колонку последовательно промывали 50, 60,70, 80, 90% водными растворами метанола, причем основная часть требуемого вещества элюировала с фракцией, содержащей 70% метанола (фиг. 6). Колоночная хроматография на силикагеле (элюент: дихлорметан:этанол:аммиак 10:8:1) приводила к получению вещества с 90% чистотой, определенной при помощи УФ-детектирования при 210 нм (фиг. 7). Выход: 1,4 г. Масса: рассчитанная (М+2 Н)+2 993, экспериментальная 992,91. Продукт анализировали при помощи 13 С ЯМР спектоскопии при 500 МГц (растворитель: D3 ацетонитрил:вода в отношении 7:3). Список пиков представлен в табл. 2. Таблица 2 Список пиков атомов углерода 13 соединения согласно примеру 1 Пример 2. Получение метансульфонатной соли соединения согласно примеру 1. Показано, что для получения растворов, подходящих для перорального или внутривенного дозирования, подходят метансульфонатная соль соединения согласно примеру 1. Соединение согласно примеру 1 суспендировали в воде и добавляли избыток метансульфокислоты для получения прозрачного раствора. Удаляли избыток метансульфокислоты в результате помещения раствора в колонку Bond Elut С 18, которую готовили согласно инструкции производителя, тщательно промывали колонку водой и элюировали метансульфонатную соль метанолом. Удаляли растворитель при помощи выпаривания с получением метансульфонатной соли в виде белого порошка. Метансульфонатная соль соединения согласно примеру 1 обладала растворимостью в воде, равной примерно 20 мг/мл. Пример 3. Альтернативный способ получения соединения согласно примеру 1 деоксиактагардина В[7-(m-бутоксикарбониламидо)-1-гептиламид монокарбоксамид]. Получали с применением способа, описанного для получения соединения согласно примеру 1, из деоксиактагардина В и 7-(m-бутоксикарбониламидо)-1-аминогептана. 75% (М+2 Н)+2 1043, экспериментальная 1044,11. Т-бутоксикарбонат подвергали гидролизу при помощи обработки 4 Н водным раствором соляной кислоты в течение 3 ч при комнатной температуре. Смесь нейтрализовали до рН 7 и проводили очистку, описанную в примере 1, с получением титульного соединения. Выход 65%. Соединения, представленные далее, получали при помощи способов, аналогичных способу, применявшемуся в примере 1. Пример 4. Деоксиактагардина В (2-амино-1-этиламид монокарбоксамид). Получали из деоскиактагардина и 1,2-этилендиамина при помощи способа, описанного выше в примере 1. Выход 96%. Масса: рассчитанная (М+2 Н)+2 958, экспериментальная 959,02. Пример 5. Деоксиактагардина В (3-амино-1-пропиламид монокарбоксамид). Получали из деоксиактагардина и 1,3-диаминопропана при помощи способа, описанного выше в примере 1. Выход: 87%. Масса: рассчитанная (М+2 Н)+2 965, экспериментальная 965,04. Пример 6. Деоксиактагардина В (5-амино-1-пентиламид монокарбоксамид). Получали из деоксиактагардина и 1,5-диаминопентана при помощи способа, описанного выше в примере 1.-9 021683 Выход: 83%. Масса: рассчитанная (М+2 Н)+2 979, экспериментальная 980,06. Пример 7. Деоксиактагардина В (9-амино-1-нониламид монокарбоксамид). Получали из деоксиактагардина и 1,9-диаминононана при помощи способа, описанного выше в примере 1. Выход: 84%. Масса: рассчитанная (М+2 Н)+2 1007, экспериментальная 1007,51. Пример 8. Деоксиактагардина В (12-амино-1-додециламид монокарбоксамид). Получали из деоксиактагардина и 1,12-диаминододекана при помощи способа, описанного выше в примере 1. Выход: 74%. Масса: рассчитанная (М+2 Н)+2 1028, экспериментальная 1027,51. Пример 9. Антибактериальная активность лантибиотиков типа В. Соединения согласно настоящему изобретению обладают антимикробной активностью in vitro и invivo. Указанные соединения являются активными против Clostridium difficile и могут обладать улучшенной активностью по сравнению с деоксиактагардином В. Исследование восприимчивости штаммов Clostridium difficile проводили путем двукратного последовательного разбавления антибиотика в агар-агаре Wilkins-Chalgren Anaerobe в анаэробных условиях. Ванкомицин применяли в качестве лекарственного средства сравнения. Культуры С. difficile вносили в предварительно стандартизированные планшеты Braziers (C.C.E.Y.) с агар-агаром и выращивали при 37 С в течение 48 ч в анаэробных условиях. От двух до трех колоний, выращенных в течение 48 ч культур, инокулировали в 5 мл предварительно стандартизированного бульона Шедлера (Schaedlers Broth) и выращивали при 37 С в течение 24 ч в анаэробных условиях. Указанную культуру разбавляли предварительно стандартизированным 0,9% раствором NaCl для достижения мутности, равной 0,5 стандарта мутности по Макфарланду, и добавляли в планшеты, содержащие лекарственные средства в итоговом количестве, равном 105 cfu/лунку. Также указанную культуру добавляли в контрольные планшеты, не содержавшие лекарственные средства. Планшеты инкубировали в анаэробной камере при 37 С в течение 48 ч и исследовали рост. MIC представляла собой минимальную концентрацию лекарственного средства, при которой лекарственное средство полностью ингибировало рост или вызывало значительное снижение роста по сравнению с ростом в планшетах, не содержавших лекарственное средство. Таблица 3 Данные MIC (мкг/мл) деоксиактагардина В (DAB) и его производных (чем меньше значение полученного результата,тем больше активность исследуемого соединения) Пример 10. Стабильность лантибиотиков типа В в жидкости, содержащейся в кишечнике. Соединения на основе лантибиотиков, предложенные согласно настоящему изобретению, могут обладать повышенной устойчивостью к ферментативному разложению по сравнению с лантибиотиками типа А, такими как низин. В частности, соединения могут обладать повышенной устойчивостью к кишечному соку по сравнению с лантибиотиками типа А. Низин и соединение согласно примеру 1 исследовали на восприимчивость к ферментативному расщеплению в кишечнике с применением имитируемой кишечной жидкости (SIF). SIF получали на основе стандартных растворов USP для имитируемой кишечной жидкости, активность подтверждали на альбумине бычьей сыворотки (АБС) (Hilger et al, Clin. Exp. Immunol., 2001, 123, 387-94). Соединения инкуби- 10021683 ровали в SIF при 37C, концентрацию определяли при помощи аналитической ВЭЖХ (УФдетектирование при 210 нм с применением условий, представленных в табл. 1). На фиг. 1 показано, что низин быстро разлагался в SIF с периодом полураспада, равным примерно от 15 до 20 мин. Быстрое разложение низина в указанное среде поддерживает выводы о том, что клиническая применимость низина для лечения инфекций толстой кишки значительно ограничена при том, что соединение может быть защищено от разложения ферментами при помощи обеспечивающего защиту состава. На фиг. 1 также показано, что соединение согласно примеру 1 является, по существу, стабильным вSIF и, вероятно, обладает подходящей стабильностью для лечения инфекций С. difficile толстой кишки. Пример 11. Эффективность антибиотиков типа В in vivo для лечения вызванного С. difficile тифлита на модели хомяков. Эффективность соединений согласно настоящему изобретению in vivo для лечения инфекций С. difficile, индуцированного клиндамицином тифлита хомяков, оценивали на стандартной животной моделиCDAD. Результаты обобщены на фиг. 2. Группам, состоящим из 6 животных, вводили примерно 107 клеток штамма 4013 С. difficile, через 24 ч вводили подкожно дозу, равную 10 мг/кг, клиндамицина фосфата. Через 24 ч группам вводили носитель, ванкомицин или соединение согласно примеру 1 три раза в день в дозировке, равной 10 мг/кг/день. Процедура, описанная выше, вызывала инфекцию C. difficile у исследуемых животных, от которой все животные, которых лечили только носителем, умирали в течение 3 дней. Наоборот, все животные,которых лечили ванкомицином или производным DAB, выживали в течение всего 5-дневного периода дозирования, что подтверждает защитное действие указанных соединений. Пример 12. ADME в модели крысы. Соединение согласно примеру 1 вводили перорально крысам в течение 7 дней и выделяли из фекалий при помощи экстракции в метаноле. На фиг. 3 представлено количество выделенного вещества по сравнению с количеством вещества, введенным крысам. С учетом того, что количество выделенного вещества зависит от числа экстракций, данные показывают, что по меньшей мере от 60 до 70% соединения согласно примеру 1 можно выделить в неизменном виде после прохождения через ЖХТ и соединение согласно примеру 1 может находиться в высокой концентрации в толстой кишке. Пример 13. Токсикология в модели крысы. Соединение согласно примеру 1 исследовали в 7-дневном эксперименте для определения токсичности в модели крысы. В одном из исследований применяли дозировку вещества, равную 50 мг/кг/день,вводимую внутривенно в течение 7 дней. В другом исследовании применяли дозировку вещества, равную 200 мг/кг/день, вводимую перорально в течение 7 дней. Дозировки для внутривенного и перорального введения значительно превосходили предполагаемый клинический уровень дозирования (примерно 3-30 мг/кг/день при помощи перорального дозирования). В течение эксперимента не наблюдали значительных токсикологических эффектов и в результате некропсии не обнаруживали повреждения органов. Соединение согласно примеру 1, вводимое перорально в дозировке, равной 50 мг/кг/день, переносилось сирийскими хомяками без значительных признаков токсичности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное деоксиактагардина В, выбранное из деоксиактагардина В (7-амино-1-гептиламид монокарбоксамид), деоксиактагардина В (9-амино-1-нониламид монокарбоксамид), деоксиактагардина В(12-амино-1-додециламид монокарбоксамид), или его фармацевтически приемлемая соль или сольват. 2. Производное деоксиактагардина В по п.1, представляющее собой деоксиактагардин В (7-амино 1-гептиламид монокарбоксамид) или его фармацевтически приемлемую соль или сольват. 3. Фармацевтическая композиция, содержащая производное деоксиактагардина В по п.1 или 2 и фармацевтически приемлемый наполнитель. 4. Композиция по п.3, предназначенная для перорального введения или парентерального введения. 5. Применение производного деоксиактагардина В по п.1 или 2 для лечения микробной инфекции. 6. Применение композиции по п.3 или 4 для лечения микробной инфекции. 7. Применение по п.5 или 6, отличающееся тем, что микробная инфекция представляет собой инфекцию Clostridium. 8. Применение по п.7, отличающееся тем, что инфекция Clostridium представляет собой инфекциюClostridium difficile. 9. Применение по п.8, отличающееся тем, что инфекция С. difficile представляет собой инфекцию толстой кишки и/или нижних отделов кишечника. 10. Применение по п.5 или 6, отличающееся тем, что микробная инфекция представляет собой избыточный бактериальный рост в тонком кишечнике. 11. Применение производного деоксиактагардина В по п.1 или 2 для лечения ульцеративного колита или синдрома раздраженного кишечника. 12. Применение композиции по п.3 или 4 для лечения ульцеративного колита или синдрома раз- 11021683 драженного кишечника. 13. Способ получения производного деоксиактагардина В по п.1, заключающийся во взаимодействии деоксиактагардина В с диаминоалканом, выбранным из группы, состоящей из 1,7-диаминогептана,1,9-диаминононана и 1,12-диаминододекана,в присутствии бензотриазол-1-илокситрипирролидинфосфония гексафторфосфата (РуВОР) в диметилформамиде (ДМФА). 14. Способ по п.13, отличающийся тем, что деоксиактагардин В синтезируют в Actinoplanes liguriae. Хроматограмма ВЭЖХ деоксиактагардина В Фиг. 4 Хроматограмма ВЭЖХ реакционной смеси согласно примеру 1 Фиг. 5 Хроматограмма ВЭЖХ реакционной смеси согласно примеру 1 после С 18 Bond Elut Фиг. 6 Хроматограмма ВЭЖХ соединения согласно примеру 1,очищенного при помощи флэш-хроматографии
МПК / Метки
МПК: A61K 38/12, C07K 7/54
Метки: деоксиактагардина, производные
Код ссылки
<a href="https://eas.patents.su/14-21683-proizvodnye-deoksiaktagardina-v.html" rel="bookmark" title="База патентов Евразийского Союза">Производные деоксиактагардина в</a>
Предыдущий патент: Система, способствующая адгезии, для резиновых изделий
Следующий патент: Устройство и очистительная установка для удаления сажи и аналогичных отложений
Случайный патент: Гибкая упаковка влажных салфеток












