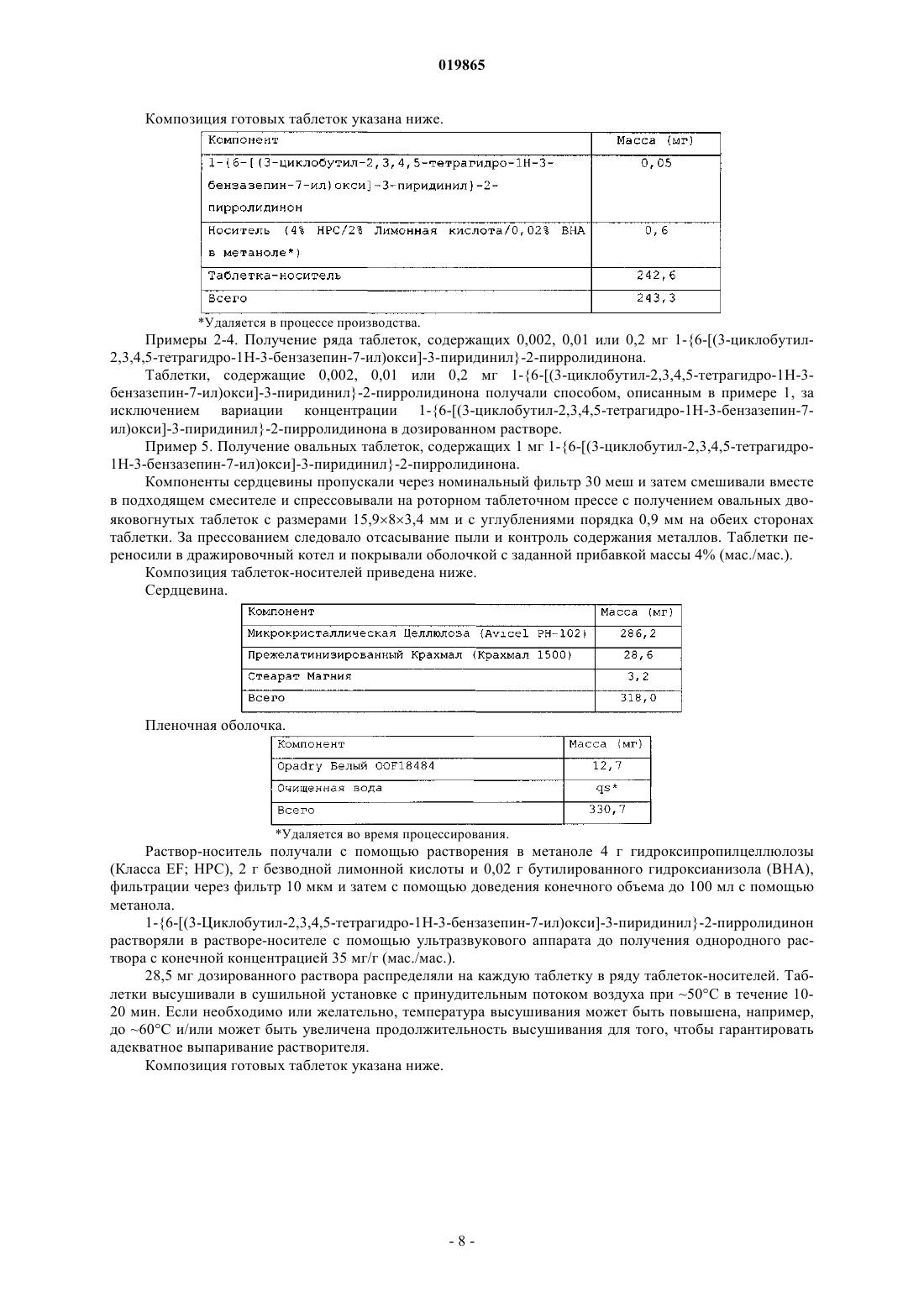
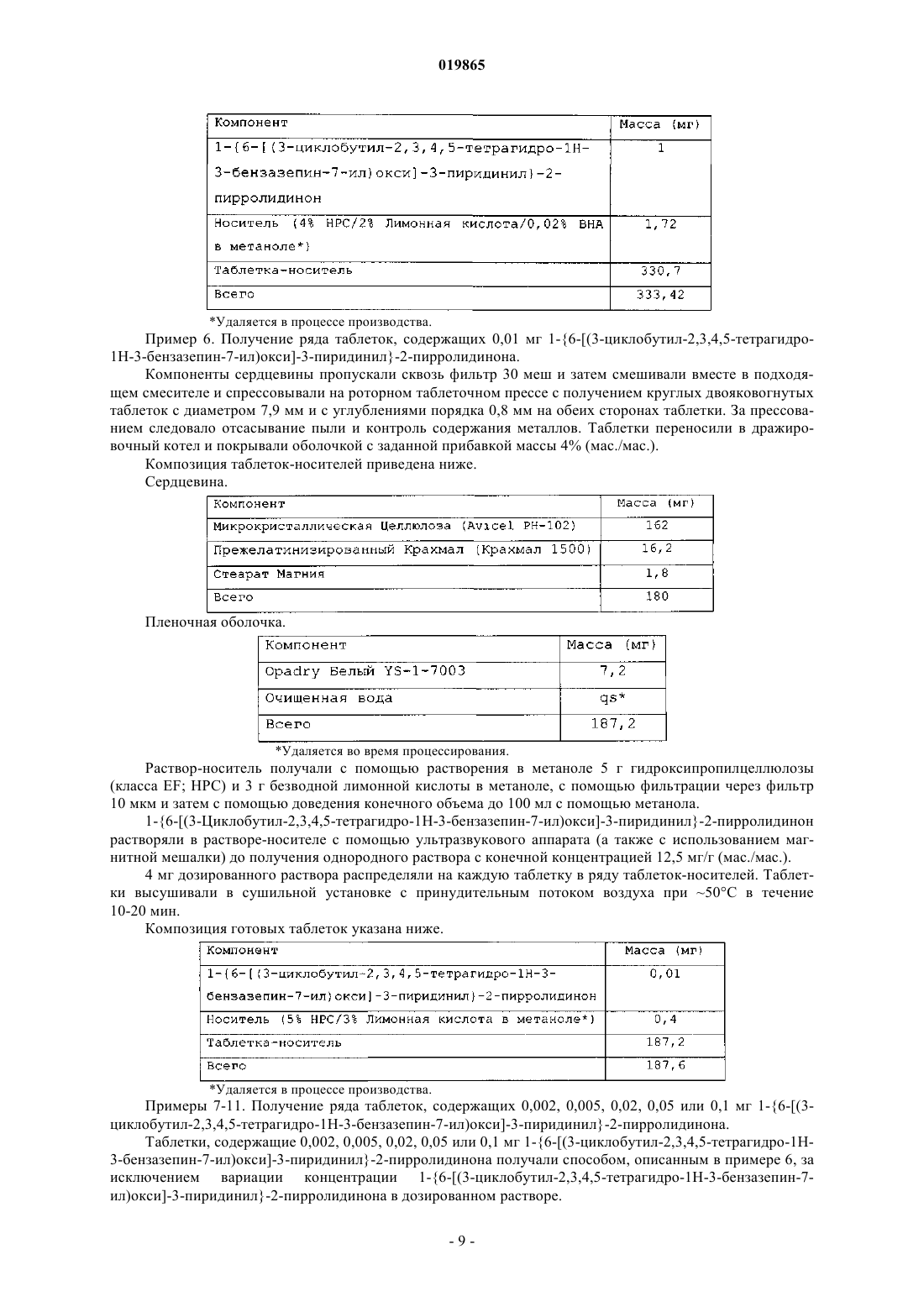
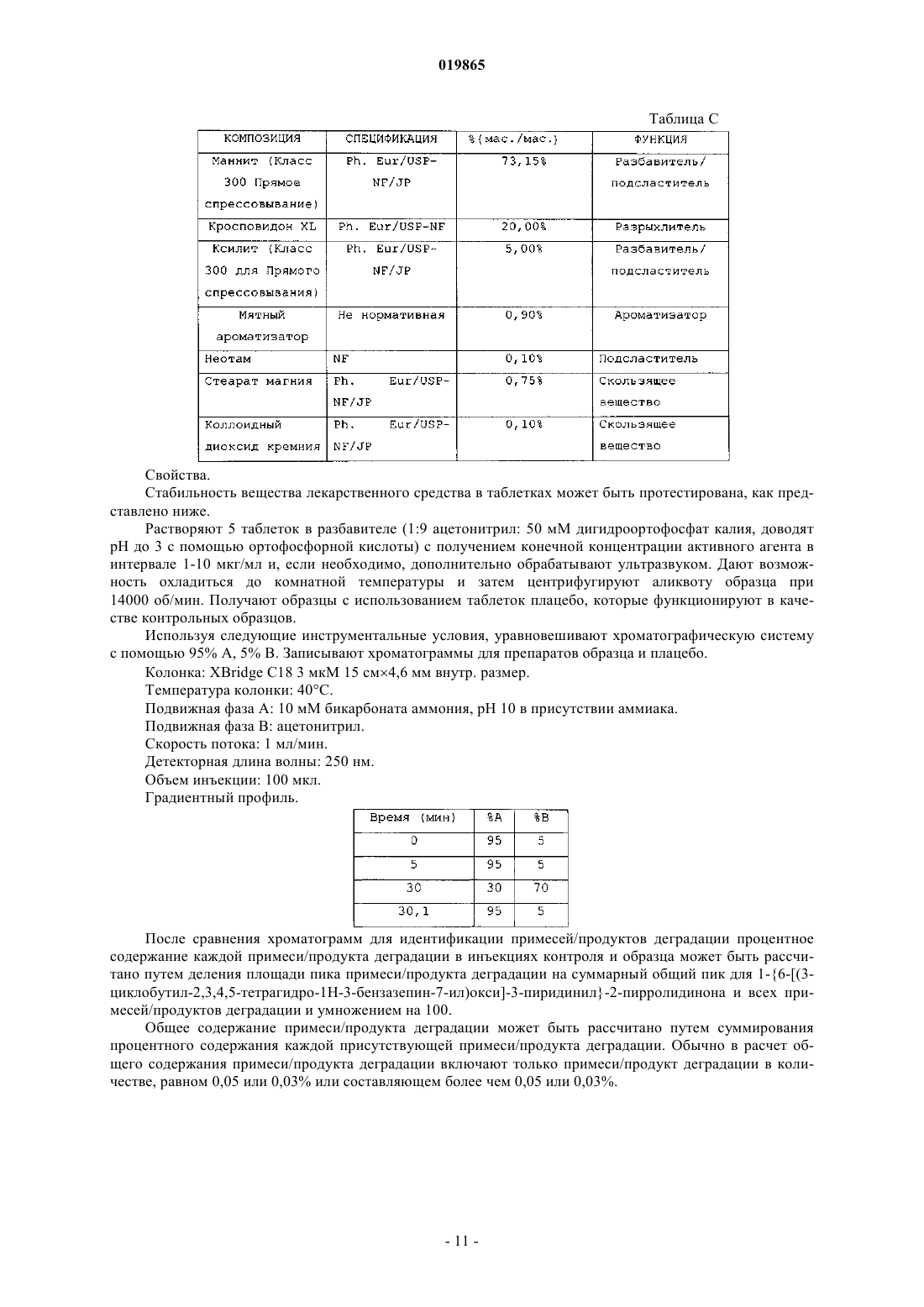
Лекарственная форма, содержащая 1{6-[(3-циклобутил-2,3,4,5-тетрагидро-1н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинон или его соль и стабилизатор, который уменьшает его деградацию
Номер патента: 19865
Опубликовано: 30.06.2014
Авторы: Каллингфорд Дэвид Джеффри, Ли Юй, Кларк Аллан Джеймс
Формула / Реферат
1. Лекарственная форма для орального введения, которая содержит таблетку-носитель, по меньшей мере, частично покрытую оболочкой, включающая:
a) 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинон или его фармацевтически приемлемую соль и
b) стабилизатор, который уменьшает деградацию 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона в лекарственной форме, где указанный стабилизатор выбран из группы, состоящей из лимонной кислоты, яблочной кислоты, аскорбиновой кислоты и их солей, бикарбоната натрия, бутилированного гидроксианизола и бутилированного гидрокситолуола.
2. Лекарственная форма для орального введения по п.1, где оболочка дополнительно содержит пленкообразующее вещество.
3. Лекарственная форма для орального введения по п.2, где пленкообразующее вещество представляет собой гидроксипропилцеллюлозу.
4. Лекарственная форма для орального введения по любому из предшествующих пунктов, где указанная таблетка-носитель имеет по меньшей мере одну полость.
5. Лекарственная форма для орального введения по п.4, где указанная оболочка находится в полости на указанной таблетке-носителе.
6. Лекарственная форма для орального введения по любому из пп.2-5, где, по существу, отсутствует абсорбция 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона или его фармацевтически приемлемой соли таблеткой-носителем.
7. Лекарственная форма для орального введения по п.6, где на указанную таблетку-носитель нанесено покрытие.
8. Лекарственная форма для орального введения по любому из предшествующих пунктов, которая содержит от 1 мкг до 1 мг 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона в расчете его как количество свободного основания.
9. Лекарственная форма для орального введения по любому из предшествующих пунктов, которая включает 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинон в виде свободного основания.
10. Лекарственная форма для орального введения по любому из пп.1-7, где указанный стабилизатор представляет собой лимонную кислоту и где молярное соотношение свободного основания 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона и лимонной кислоты находится в интервале между 1,5:1 и 1:500.
11. Лекарственная форма для орального введения по любому из предшествующих пунктов, где лекарственная форма и/или оболочка содержит от 2 до 100 мкг 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона в расчете его как количество свободного основания.
12. Лекарственная форма для орального введения, определенная по любому из пп.1-11, для применения в лечении неврологических заболеваний.
13. Способ получения лекарственной формы для орального введения, определенной в п.1, включающий распределение раствора или суспензии 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора на таблетке-носителе, где указанный стабилизатор выбран из группы, состоящей из лимонной, яблочной, аскорбиновой кислот и их солей, бикарбоната натрия, бутилированного гидроксианизола и бутилированного гидрокситолуола.
14. Способ по п.13, где раствор или суспензию 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора получают с использованием органического растворителя, представляющего собой метанол, этанол, ацетон, уксусную кислоту или метиленхлорид.
15. Способ по п.13 или 14, где стабилизатор представляет собой лимонную кислоту и присутствует в растворе или суспензии в количестве 2-3% мас./об.
16. Способ по пп.13, 14 или 15, где в лекарственной форме таблетка-носитель, по меньшей мере, частично покрыта оболочкой, как определено по п.1, и где оболочка дополнительно содержит пленкообразующее вещество по п.2, которое представляет собой гидроксипропилцеллюлозу, и где в способе гидроксипропилцеллюлоза присутствует в растворе или суспензии в количестве 4-6% мас./об.
17. Способ по пп.13-15 или 16, где таблетку-носитель и распределенные раствор/суспензию нагревают для выпаривания избытка жидкости, в результате образуется оболочка по меньшей мере на части поверхности таблетки-носителя.
18. Способ по любому из пп.13-17, где таблетка-носитель, получаемая в способе, имеет полость или углубление, которое обеспечивает наличие лунки для раствора или суспензии 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора для помещения их в лунки после распределения.
19. Способ по п.18, в котором получают двояковогнутые таблетки, имеющие полости с обеих сторон.
20. Применение 1-{6-[(3-циклобутил-2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинона или его фармацевтически приемлемой соли для получения лекарственной формы для орального введения, определенной в любом из пп.1-11, для лечения неврологических заболеваний.
Текст
ЛЕКАРСТВЕННАЯ ФОРМА, СОДЕРЖАЩАЯ 16-[(3-ЦИКЛОБУТИЛ-2,3,4,5 ТЕТРАГИДРО-1 Н-3-БЕНЗАЗЕПИН-7-ИЛ)ОКСИ]-3-ПИРИДИНИЛ-2-ПИРРОЛИДИНОН ИЛИ ЕГО СОЛЬ И СТАБИЛИЗАТОР, КОТОРЫЙ УМЕНЬШАЕТ ЕГО ДЕГРАДАЦИЮ Изобретение относится к твердой оральной лекарственной форме, которая включает таблеткуноситель, по меньшей мере, частично покрытую оболочкой, и включает a) 1-6-[(3 циклобутил-2,3,4,5-тетрагидро-1H-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемую соль и b) стабилизатор, который уменьшает деградацию 1-6[(3-циклобутил-2,3,4,5-тетрагидро-1H-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона в лекарственной форме, где указанный стабилизатор выбран из группы, состоящей из лимонной кислоты, яблочной кислоты, аскорбиновой кислоты и их солей, бикарбоната натрия,бутилированного гидроксианизола и бутилированного гидрокситолуола, а также к способу получения указанной твердой оральной лекарственной формы и к применению лекарственной формы для лечения неврологических заболеваний. Кларк Аллан Джеймс (US),Каллингфорд Дэвид Джеффри (GB),Ли Юй (US) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) Настоящее изобретение относится к новой лекарственной форме, к способу получения лекарственной формы и к применению лекарственной формы в лекарственном средстве. В международной патентной заявке WO 2004/056369 описаны определенные производные бензазепина, включающие 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон. В заявке WO 2004/056369 указано, что производные бензазепина могут быть получены с использованием стандартных методов. Однако в явной форме не было описано лекарственной формы, содержащей 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон. В первом аспекте в настоящем изобретении предлагается лекарственная форма, включающая: а) 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон или его фармацевтически приемлемую соль;b) стабилизатор, который уменьшает деградацию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона в лекарственной форме по сравнению с лекарственной формой, лишенной указанного стабилизатора; и с) фармацевтически приемлемое вспомогательное вещество. Лекарственная форма может быть адоптирована для введения пациенту с помощью любого желаемого пути введения. Например, лекарственные формы включают адоптированные лекарственные формы для (1) перорального введения, такие как таблетки, капсулы, каплеты, пилюли, пастилки, порошки, сиропы, эликсиры, суспензии, растворы, эмульсии, пакетики и крахмальные капсулы; (2) парентерального введения, такие как стерильные растворы, суспензии, имплантаты и порошки для восстановления;(3) трансдермального введения, такие как трансдермальные пластыри; (4) ректального и вагинального введения, такие как суппозитории, пессарии и пенки; (5) ингаляции и интраназального введения, такие как сухие порошки, аэрозоли, суспензии и растворы (жидкости для пульверизации и капли); (6) местного введения, такие как кремы, мази, лосьоны, растворы, пасты, капли, жидкости для распыления, пенки и гели; (7) окулярного введения, такие как капли, мази, жидкости для пульверизации, суспензии и вставки и (8) буккального и подъязычного введения, такие как пастилки, пластыри, жидкости для пульверизации,капли, жевательные резинки и таблетки. В контексте данного изобретения термин "фармацевтически приемлемое вспомогательное вещество" обозначает любое фармацевтически приемлемое вещество, присутствующее в лекарственной форме,отличной от 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинона или его фармацевтически приемлемой соли и стабилизатора. Подходящие фармацевтически приемлемые вспомогательные вещества будут варьироваться в зависимости от конкретной выбранной лекарственной формы и включают разбавители, связующие вещества, разрыхлители и суперразрыхлители, скользящие вещества, вещества, способствующие скольжению, агенты оболочки, увлажняющие агенты, растворители, корастворители, эмульгаторы, подсластители, ароматизирующие агенты,агенты, маскирующие аромат, агенты-красители, агенты, предотвращающие слипание, увлажнители,хелатирующие агенты, пластификаторы, агенты, увеличивающие вязкость, агенты, модифицирующие интенсивность, консерванты, поверхностно-активные вещества. Специалисту будет понятно, что определенные фармацевтически приемлемые вспомогательные вещества могут выполнять более чем одну функцию и могут выполнять альтернативные функции в зависимости от того, насколько много вспомогательного вещества присутствует в композиции, и от того, какие еще ингредиенты присутствуют в композиции. Указание по выбору подходящих фармацевтически приемлемых вспомогательных веществ доступно в публикации Remington's Pharmaceutical Sciences (Компания Mack Publishing). Лекарственные формы по изобретению могут быть получены с использованием методов и способов, известных специалистам в данной области. Некоторые из способов, используемых в данной области,описаны в публикации Remington's Pharmaceutical Sciences (Компания Mack Publishing). В одном воплощении изобретение относится к твердой пероральной лекарственной форме, такой как таблетка или капсула, включающей 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемую соль, стабилизатор и разбавитель. Подходящие разбавители включают сахариды (например, лактозу, сахарозу, декстрозу),сахарные спирты (например, маннит, сорбит), крахмал (например, кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал), целлюлозу и ее производные (например, микрокристаллическую целлюлозу), сульфат кальция и двуосновный фосфат кальция. Лекарственная форма может дополнительно включать другие стандартные вспомогательные вещества, такие как связующие вещества,разрыхлители, скользящие вещества и вещества, способствующие скольжению. Подходящие связующие вещества включают крахмал (например, кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал), желатин, камедь, альгинат натрия, альгиновую кислоту, трагант, гуаровую камедь,поливинилпирролидон и целлюлозу и ее производные (например, этилцеллюлозу, метилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу). Подходящие разрыхлители включают крахмалы, поперечно сшитый поливинилпирролидон, натрий крахмал глюколат, кроскармеллозу, альгиновую кислоту и натрий карбоксиметилцеллюлозу. Стандартные скользящие вещества включают стеариновую кислоту, стеарат магния и стеарат кальция. Стандарт-1 019865 ные вещества, способствующие скольжению, включают тальк или коллоидный диоксид кремния. Пероральная твердая лекарственная форма может дополнительно включать внешнюю оболочку, которая может обладать косметическими или функциональными свойствами. В более конкретном аспекте в настоящем изобретении предлагается лекарственная форма, предназначенная для перорального введения, включающая таблетку-носитель, которая, по меньшей мере, частично покрыта оболочкой, включающей: а) 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон или его фармацевтически приемлемую соль иb) стабилизатор, который уменьшает деградацию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона в лекарственной форме по сравнению с лекарственной формой, лишенной указанного стабилизатора. В контексте настоящего описания термин "таблетка-носитель" обозначает таблетку, которая, по существу,свободна от 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3 пиридинил-2-пирролидинона или его фармацевтически приемлемых солей. Типично, когда таблетка не содержит терапевтического агента, хотя изобретением охвачены воплощения, в которых таблетканоситель содержит один или более терапевтических агентов. Состав таблетки-носителя не является важным при условии, что он является фармацевтически приемлемым. Однако таблетка-носитель должна иметь подходящий размер и форму для функционирования в качестве таблетки, предназначенной для перорального введения. Может использоваться любой тип таблетки, например такие типы, как описано в публикации Remington, The Science and Practice ofPharmacy, 21-е изд., 2005 (под ред. D.В. Troy). В одном воплощении таблетка-носитель образуется с помощью стандартного метода спрессовывания и включает до 100% мас./мас. разбавителя или смеси разбавителей. Стандартные разбавители включают сахариды (например, лактозу, сахарозу, декстрозу), сахарные спирты (например, маннит, сорбит), крахмал (например, кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал), целлюлозу и ее производные (например, микрокристаллическую целлюлозу), сульфат кальция и двуосновный фосфат кальция. Таблетка может дополнительно включать связующее вещество или смесь связующих веществ в количестве до 100% мас./мас. Подходящие связующие вещества включают крахмал (например, кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал), желатин, камедь, альгинат натрия, альгиновую кислоту, трагант, гуаровую камедь, поливинилпирролидон и целлюлозу и ее производные (например, этилцеллюлозу, метилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу). Таблетки-носители также могут содержать другие стандартные вспомогательные вещества, такие как скользящие вещества (например, стеариновая кислота, стеарат магния и стеарат кальция) и вещества,способствующие скольжению (например, тальк или коллоидный диоксид кремния). В одном воплощении скользящие вещества и вещества, способствующие скольжению, каждое из них присутствуют в количестве до 10% мас./мас, более конкретно, в количестве до 5% мас./мас. В другом воплощении субстраты, образованные с помощью литьевого прессования, такие как формованные таблетки, или оболочек капсул могут быть использованы в качестве таблеток-носителей. Подходящие термопластические вещества, предназначенные для литьевого прессования, включают гидроксипропилцеллюлозу, этилцеллюлозу, метакрилаты и поливинилацетат. В одном воплощении таблетка-носитель представляет собой таблетку, включающую микрокристаллическую целлюлозу (например, Avicel PH-102), прежелатинизированный крахмал (например, крахмал 1500) и стеарат магния. В более конкретном воплощении таблетка-носитель содержит следующую композицию. В альтернативном воплощении субстрат-носитель может быть составлен так, чтобы он распадался во рту при пероральном введении, это так называемая "перорально распадающаяся таблетка" или субстрат "ODT". Альтернативно, субстрат-носитель может быть составлен так, чтобы он распадался в воде,это так называемая "быстрорастворимая таблетка" или субстрат "FDT". Таблетка-носитель снабжена субстратом или подложкой для оболочки. В одном воплощении таблетки-носители покрыты оболочкой,чтобы,по существу,предотвратить абсорбцию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли таблетками-носителями. Однако изобретением охвачены воплощения, в которых существует абсорбция 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли таблетками-2 019865 носителями. Подходящие оболочки для таблеток-носителей включают водные пленочные оболочки, такие как коммерчески доступные от фирмы Colorcon, например оболочки Opadry ("Opadry белый 00F18484" илиOpadry белый YS-1-7003"). Другие подходящие оболочки включают Surelease (этилцеллюлозу). Лекарственная форма может быть альтернативно покрыта оболочкой из устойчивого в желудочной среде и растворимого в кишечнике полимерного вещества. Подходящие полимерные вещества включают ацетофталат целлюлозы, ацетопропионат целлюлозы, тримеллитат целлюлозы и сополимеры акрила и метакрила. Могут быть добавлены красящие вещества. В одном воплощении таблетка-носитель покрыта пленочной оболочкой с увеличением массы на 2-6%. Понятно, что в воплощениях, где таблетка-носитель покрыта оболочкой для того, чтобы, по существу, предотвратить абсорбцию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3 пиридинил-2-пирролидинона или его фармацевтически приемлемой соли, выбранная пленочная оболочка должна быть нерастворима в растворителе, используемом в процессе получения лекарственной формы. Например, в случае, где используется система водного растворителя, водная пленочная оболочка(подобная Opadry) немедленно распадется и является предпочтительной нерастворимая в воде оболочка (например, Surelease или Eudragit). В одном воплощении оболочка, содержащая 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемая соль, только частично покрывает таблетку-носитель. В более конкретном воплощении таблетки-носители сформованы так, чтобы содержать одну или более рисок или углублений. Таким образом, в таких воплощениях оболочка,содержащая 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3 пиридинил-2-пирролидинон или его фармацевтически приемлемую соль, может, по существу, присутствовать в полости таблетки-носителя. Лекарственная форма и/или оболочка, которая, по меньшей мере, частично покрывает таблеткуноситель, включает 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон ("свободное основание") или его фармацевтически приемлемую соль. В контексте данного изобретения ссылка на свободное основание или фармацевтически приемлемую соль охватывает сольваты и гидраты свободного основания или фармацевтически приемлемой соли. 1-6-[(3-Циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон может быть получен согласно известным методам, таким как те, что описаны в WO 2004/056369. Описание WO 2004/056369 введено сюда с помощью ссылки. Фармацевтически приемлемые соли 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинона при добавлении кислот включают гидробромид, гидрохлорид,сульфат, нитрат, фосфат, сукцинат, малеат, формиат, ацетат, пропионат, фумарат, цитрат, тартрат, лактат, бензоат, салицилат, глутамат, аспартат, п-толуолсульфонат, бензолсульфонат, метансульфонат, этансульфонат, нафталинсульфонат (например, 2-нафталинсульфонат) или соли капроевой кислоты. Такие соли могут быть образованы с помощью реакции с подходящей кислотой, необязательно в подходящем растворителе, таком как органический растворитель, с получением соли, которая может быть выделена,например, с помощью кристаллизации и фильтрации. Лекарственная форма и/или оболочка могут содержать свободное основание, фармацевтически приемлемую соль (в стехиометрическом соотношении или нет) или их смесь. В одном воплощении лекарственная форма содержит свободное основание. В одном воплощении оболочка содержит свободное основание. В одном воплощении лекарственная форма и/или оболочка содержит 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон в количестве от 1 мкг до 1 мг, по измерениям его в виде количества присутствующего основания (которое,за исключением любого количества добавленной кислоты, образует соли). В более конкретном воплощении лекарственная форма и/или оболочка содержит 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон в количестве от 1 до 200 мкг, более конкретно в количестве от 2 до 100 мкг по измерениям его в виде количества присутствующего основания. Лекарственная форма и/или оболочка дополнительно содержит фармацевтически приемлемый стабилизатор, который уменьшает деградацию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинона (или его фармацевтически приемлемой соли) в лекарственной форме, содержащей стабилизатор, по сравнению с лекарственной формой, лишенной стабилизатора. Деградация 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинона (или его фармацевтически приемлемой соли) в лекарственной форме может быть проанализирована с помощью измерения общего содержания примеси/продукта деградации в лекарственной форме с использованием градиентной HPLC, используя метод, описанный ниже. Специалисту будет понятно, что, за исключением присутствия или отсутствия стабилизатора, лекарственные формы должны быть сравнимы по остальным признакам и должны храниться при одинаковых условиях в течение одинаковых интервалов времени. В одном воплощении среднее общее содержание примеси/продукта деградации, при хранении в течение 1 месяца при относительной влажности 75%, рассчитанное на основе по меньшей мере 3 образцов лекарственной формы, содержащей стабилизатор, составило по меньшей мере на 50% меньше, чем среднее общее содержание примеси/продукта деградации, при хранении при сравнимых условиях, рассчитанное на основе по меньшей мере 3 образцов сравнимой лекарственной формы, лишенной указанного стабилизатора. В другом воплощении среднее общее содержание примеси/продукта деградации по меньшей мере 3 образцов лекарственной формы, содержащей стабилизатор, которую хранили при температуре 30 С,относительной влажности 65%, не должно превышать 10%, более конкретно 5%. Определенные фармацевтически приемлемые антиоксиданты могут функционировать в качестве стабилизаторов в контексте настоящего изобретения. Фармацевтически приемлемые антиоксиданты включают те, что описаны в публикации The Handbook of Pharmaceutical Excipients, Third Edition, 2000(Ed. A.H. Kibbe). В одном воплощении стабилизатор выбирают из группы, состоящей из лимонной кислоты, яблочной кислоты, аскорбиновой кислоты и ее солей, бикарбоната натрия, бутилированного гидроксианизола и бутилированного гидрокситолуола. Комбинации стабилизаторов также могут использоваться в настоящем изобретении. В одном воплощении стабилизатор представляет собой лимонную кислоту и необязательно бутилированный гидроксианизол. В одном воплощении оболочка содержит лимонную кислоту и необязательно бутилированный гидроксианизол. Стабилизатор или стабилизаторы должны присутствовать в лекарственной форме и/или в оболочке в достаточном количестве для уменьшения деградации 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли. В определенных воплощениях, включающих лимонную кислоту, молярное соотношение свободного основания к лимонной кислоте находится в интервале от 1,5:1 до 1:500. Оболочка может дополнительно содержать пленкообразующее вещество, такое как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза,поливиниловый спирт, поливинилпирролидон, каррагенан (каппа, йота или лямбда), желатин, полиэтиленгликоль, полиэтиленоксид, пуллулан или акриловый полимер (например, EUDRAGIT классов RL, RS,E, L, S, FS30D) или любую их комбинацию. В одном воплощении пленкообразующее вещество представляет собой гидроксипропилцеллюлозу. Специалисту в данной области будет очевидно, что любое пленкообразующее вещество, включенное в лекарственную форму, должно быть растворимо в растворителе, используемом при ее получении. Оболочка может дополнительно содержать другие вспомогательные вещества. Например, было обнаружено, что определенные системы растворителей, такие как водные системы, требуют добавления поверхностно-активных веществ (например, полисорбатов 20, 40, 80, Тритона 100, натрий лаурил сульфата или тилоксопола) и/или предупреждающих вспенивание агентов (полидиметилсилоксана или диметикона). Таким образом, в следующем воплощении оболочка дополнительно содержит одно или более поверхностно-активных веществ и/или один или более предупреждающих вспенивание агентов. Лекарственная форма может быть дополнительно покрыта оболочкой. Подходящие оболочки включают те, что перечислены выше в качестве подходящих оболочек таблетки-носителя. В одном воплощении лекарственная форма покрывается оболочкой с прибавлением массы на 2-6%. Лекарственная форма необязательно может быть упакована в среде с низким содержанием кислорода. Этого можно достичь путем включения поглотителя растворенного в воде кислорода в упаковку лекарственной формы. Подходящие поглотители растворенного в воде кислорода включаютPharmaKeep KH и KD (коммерчески доступные от компании Sud Chemie) и специальный поглотитель растворенного в воде кислорода StabilOx (коммерчески доступные от компании MultisorbTechnologies). Альтернативно, лекарственные формы могут упакованы во флаконы, которые непроницаемы для кислорода. Алюминиево-алюминиевые блистеры также могут использоваться для упаковки лекарственных форм в среде с низким содержанием кислорода. В другом аспекте в изобретении предлагается способ получения лекарственной формы по изобретению. Способ включает распределение раствора или суспензии 1-6-[(3-циклобутил-2,3,4,5-тетрагидро 1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора на таблетку-носитель. Может использоваться любой растворитель при условии, что стабилизатор и любые другие вспомогательные вещества, присутствующие в оболочке, растворимы в растворителе. Растворитель обычно является летучим и должен быть фармацевтически приемлемым в количествах (остаточных), в которых он присутствует в использованной лекарственной форме. Подходящие растворители включают воду, органические растворители, пропелленты, сжиженные газы и летучие силиконы. В одном воплощении раствор или суспензию 1-6-[(3-циклобутил-2,3,4,5 тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора получают с использованием органического растворителя, такого как ме-4 019865 танол, этанол, ацетон, уксусная кислота или метиленхлорид. Также могут использоваться смеси растворителей (например, вода-этанол). В одном воплощении растворителем является метанол. В следующем аспекте в изобретении предлагается раствор или суспензия 1-6-[(3-циклобутил 2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора в системе растворителей. В одном воплощении раствор или суспензия дополнительно включают одно или более пленкообразующих веществ и/или поверхностноактивных веществ и/или предупреждающих вспенивание агентов. В другом воплощении растворителем является органический растворитель, такой как метанол, этанол, ацетон, уксусная кислота или метиленхлорид, более конкретно, метанол. В определенных воплощениях, в которых стабилизатором является лимонная кислота, она присутствует в растворе или в суспензии в количестве, составляющем 2-3% мас./об., конкретно 3% мас./об. В определенных воплощениях, в которых стабилизатором является бутилированный гидроксианизол, он присутствует в растворе или в суспензии в количестве, составляющем 0,01-0,1% мас./об., конкретно 0,02% мас./об. В определенных воплощениях, в которых пленкообразующим веществом является гидроксипропилцеллюлоза, она присутствует в растворе или в суспензии в количестве, составляющем интервал 4-6% мас./об., конкретно 4% мас./об. Таблетка-носитель и распределенный раствор/суспензия могут быть нагреты (например, в сушильной установке с принудительным потоком воздуха) для испарения избыточной жидкости и в результате образуется оболочка по меньшей мере на части поверхности таблетки-носителя. Лекарственная форма необязательно может быть затем покрыта оболочкой согласно методам, известным из уровня техники. Таблетка-носитель, используемая в способе получения лекарственной формы, может иметь полость или углубление, которое обеспечивает наличие лунки для раствора или суспензии 1-6-[(3-циклобутил 2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора для помещения его туда после распределения. Обычно применяются двояковогнутые таблетки, имеющие полости с обеих сторон. Могут использоваться две полости для принятия раствора или суспензии 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3 пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора. Альтернативно, одна из полостей может использоваться для принятия раствора или суспензии 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора, и оставшаяся полость может использоваться для принятия другого терапевтического агента с получением лекарственной формы, содержащей два различных терапевтических агента. В следующем воплощении растворы различных терапевтических агентов могут располагаться один поверх другого. Лекарственная форма по настоящему изобретению может быть получена с использованием устройства, описанного в публикации WO 2005/123569, которая введена сюда с помощью ссылки. Более конкретно, лекарственная форма по настоящему изобретению может быть получена с помощью устройства,содержащего распределительный модуль для точного распределения определенного количества раствора или суспензии 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинона или его фармацевтически приемлемой соли и стабилизатора на таблетки-носители. Устройство также может иметь поддерживающее приспособление для поддержки таблеток-носителей, которое может непрерывно передвигаться вдоль устройства, пока распределительный модуль распределяет раствор/суспензию на каждую из таблеток-носителей. Устройство может также иметь систему сушки, которая высушивает или выпаривает растворитель из раствора/суспензии, помещенного на каждую из таблеток-носителей. Поддерживающее приспособление может передвигаться непрерывно вдоль устройства, пока система сушки высушивает лекарственную форму на каждой из таблеток-носителей. Система сушки может высушивать лекарственную форму с использованием нагретого воздуха, инфракрасного или микроволнового нагревания. Устройство также может иметь систему покрытия оболочкой, с помощью которой наносится покрытие в виде оболочки на лекарственную форму. Система покрытия оболочкой может иметь тампонное печатающее устройство или распылитель, который наносит покрытие в виде оболочки на каждый из субстратов-носителей. Поддерживающее приспособление может непрерывно передвигаться, пока система нанесения покрытия в виде оболочки наносит покрытие на каждую из таблеток-носителей. Устройство может также иметь систему сушки для покрытия в виде оболочки, которая высушивает покрытие на каждой из таблеток-носителей. Очевидно, что устройство, описанное выше, может вторично вырабатывать таблетки-носители любое количество раз для того, чтобы добавлять растворы или суспензии различных терапевтических агентов. Альтернативно, устройство может иметь дополнительные последовательно расположенные системы распределения для добавления каждого из растворов/суспензий в таблетки-носители. 1-6-[(3-Циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон и его фармацевтически приемлемые соли представляют собой Н 3-антагонисты, обладающие полезными терапевтическими свойствами. Более конкретно, считается, что 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-5 019865 1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон и его фармацевтически приемлемые соли имеют потенциальное применение в лечении заболеваний, включающих болезнь Альцгеймера, деменцию (включая деменцию с тельцами Леви и сосудистую деменцию), возрастную дисфункцию памяти,умеренные когнитивные расстройства, когнитивные расстройства, эпилепсию, мигрень, болезнь Паркинсона, рассеянный склероз (включая утомляемость), инсульт, боль невропатического происхождения(включая невралгию, неврит и позвоночную боль), воспалительную боль (включая остеоартрит, ревматоидный артрит, острую воспалительную боль и позвоночную боль) и заболевания расстройства сна(включая гиперсомнолентное расстройство, избыточную дневную сонливость, нарколепсию, расстройство сна, связанное с болезнью Паркинсона и утомляемостью, особенно при рассеянном склерозе); психиатрические заболевания (такие как шизофрения (конкретно, когнитивное расстройство шизофрении) и биполярное расстройство), расстройство внимания, синдром гиперактивности, депрессия (включая большое депрессивное расстройство), тревожность и зависимость; другие заболевания, включающие ожирение и желудочно-кишечные расстройства. Соответственно, в следующем аспекте в настоящем изобретении предлагается лекарственная форма, предназначенная для применения в терапии. Более конкретно, в изобретении предлагается лекарственная форма, предназначенная для применения в лечении или профилактике вышеописанных расстройств, конкретно неврологических и психиатрических расстройств. В изобретении дополнительно предлагается способ лечения или профилактики вышеописанных расстройств у млекопитающих, включая людей, способ включает введение больному лекарственной формы по настоящему изобретению. В другом аспекте в изобретении предлагается применение 1-6-[(3-циклобутил-2,3,4,5-тетрагидро 1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемой соли в производстве лекарственной формы по изобретению, предназначенной для применения в лечении вышеописанных расстройств. 1-6-[(3-Циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3 пиридинил-2-пирролидинон или его фармацевтически приемлемые соли могут применяться в комбинации с другими терапевтическими агентами. Когда 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемая соль предназначены для применения в лечении болезни Альцгеймера, то они могут применяться в комбинации с лекарственными средствами, о которых заявлено, что они являются полезными в качестве лечения, смягчающего заболевание, или применяются для симптоматического лечения болезни Альцгеймера. Подходящие примеры таких других терапевтических агентов могут представлять собой симптоматические агенты, например, такие как известные агенты для смягчения холинергической передачи, такие агенты,как агонисты или аллостерические модуляторы M1 мускаринового рецептора, антагонисты М 2 мускаринового рецептора, ацетилхолинэстеразные ингибиторы (такие как тетрагидроаминоакридин, донепезил гидрохлорид и ривастигмин), агонисты или аллостерические модуляторы никотинового рецептора (такие как агонисты или аллостерические модуляторы 7 или агонисты или аллостерические модуляторы 42), агонисты PPAR (такие как агонисты PPAR), частичные агонисты рецептора 5-НТ 4, агонисты рецептора 5-НТ 6 или агонисты рецептора 5 НТ 1 А и агонисты или модуляторы рецептора NMDA или агенты, смягчающие заболевание, такие как ингибиторы - или -секретазы. Когда 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон или его фармацевтически приемлемая соль предназначены для применения в лечении нарколепсии, то они могут применяться в комбинации с лекарственными средствами, о которых заявлено, что они являются полезными в качестве лечения нарколепсии. Подходящие примеры таких других терапевтических агентов включают модафинил, армодафинил и блокаторы усвоения моноамина. Когда 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон или его фармацевтически приемлемая соль предназначены для применения в лечении шизофрении, то они могут применяться в комбинации с лекарственными средствами, о которых заявлено,что они являются полезными в качестве лечения шизофрении, включающими:i) нейролептики, включающие типичные нейролептики (например, хлорпромазин, тиоридазин, мезоридазин, флуфеназин, перфеназин, прохлорперазин, трифлуоперазин, тиотиксин, галоперидол, молиндон и локсапин), атипичные нейролептики (например, клозапин, оланзапин, рисперидон, кетиапин, арипиразол, зипрасидон, амисулприд и арипипразол), ингибиторы переносчика 1 глицина и лиганды метаботропного рецептора;ii) лекарственные средства, предназначенные для лечения экстрапирамидных побочных эффектов,например антихолинергики (такие как бензтропин, бипериден, проциклидин и тригексифенидил) и допаминергики (такие как амантадин);iii) антидепрессанты, включающие ингибиторы усвоения серотонина (такие как циталопрам, эскиталопрам, флуоксетин, пароксетин, дапоксетин и сертралин), ингибиторы повторного усвоения двойного действия для серотонина/норадреналина (такие как венлафаксин, дулоксетин и милнасипран), ингибиторы повторного усвоения норадреналина (такие как ребоксетин), трициклические антидепрессанты (такие как амитриптилин, кломипрамин, имипрамин, мапротилин, нортриптилин и тримипрамин), ингибиторыiv) анксиолитики, включающие бензодиазепины, такие как алпразолам и лоразепам; иv) когнитивные усилители, например ингибиторы холинэстеразы (такие как такрин, донепезил, ривастигмин и галантамин). Таким образом, в следующем аспекте в изобретении предлагается лекарственная форма, включающая таблетку-носитель, которая, по меньшей мере, частично покрыта оболочкой, включающей 1-6-[(3 циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемую соль и стабилизатор, причем лекарственная форма дополнительно включает дополнительный терапевтический агент или агенты. Очевидно, что дополнительный терапевтический агент может присутствовать в таблетке-носителе. Альтернативно, как обсуждалось выше, оболочка, содержащая дополнительные терапевтические агенты,может располагаться на таблетке-носителе. Там, где таблетка-носитель имеет две полости, одна полость может содержать оболочку, содержащую 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемую соль и стабилизатор, и вторая полость может содержать оболочку, содержащую дополнительный терапевтический агент или агенты. Альтернативно, оболочки, содержащие 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин 7-ил)окси]-3-пиридинил-2-пирролидинон или его фармацевтически приемлемую соль и стабилизатор, и дополнительный терапевтический агент могут располагаться один поверх другого. Когда 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон или его фармацевтически приемлемая соль применяется в комбинации со вторым терапевтическим агентом, активным против такого же болезненного состояния, доза 1-6-[(3-циклобутил 2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон (или его фармацевтически приемлемой соли) может отличаться от дозы, когда 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон (или его фармацевтически приемлемая соль) применяется индивидуально. Подходящие дозы легко определяются специалистами в данной области. Следующие примеры иллюстрируют изобретение, но никоим образом его не ограничивают. Примеры Пример 1. Получение ряда таблеток, содержащих 0,05 мг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро 1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона. Компоненты сердцевины пропускали сквозь фильтр 30 меш и затем смешивали вместе в подходящем смесителе и спрессовывали на роторном таблеточном прессе с получением круглых двояковогнутых таблеток с диаметром 9,525 мм и с углублениями порядка 0,8 мм на обеих сторонах таблетки. За прессованием следовало отсасывание пыли и контроль содержания металлов. Таблетки переносили в дражировочный котел и покрывали оболочкой с заданной прибавкой массы 4% (мас./мас.). Композиция таблеток-носителей приведена ниже. Сердцевина. Удаляется во время процессирования.(Класса EF; НРС), 2 г безводной лимонной кислоты и 0,02 г бутилированного гидроксианизола (ВНА),фильтрации через фильтр 10 мкм и затем с помощью доведения конечного объема до 100 мл с помощью метанола. 1-6-[(3-Циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон растворяли в растворе-носителе с помощью ультразвукового аппарата до получения однородного раствора с конечной концентрацией 5 мг/г (мас./мас.). 10 мг дозированного раствора распределяли на каждую таблетку в ряду таблеток-носителей. Таблетки высушивали в сушильной установке с принудительным потоком воздуха при 40 С в течение 10-20 мин. Композиция готовых таблеток указана ниже. Примеры 2-4. Получение ряда таблеток, содержащих 0,002, 0,01 или 0,2 мг 1-6-[(3-циклобутил 2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона. Таблетки, содержащие 0,002, 0,01 или 0,2 мг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона получали способом, описанным в примере 1, за исключением вариации концентрации 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинона в дозированном растворе. Пример 5. Получение овальных таблеток, содержащих 1 мг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро 1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона. Компоненты сердцевины пропускали через номинальный фильтр 30 меш и затем смешивали вместе в подходящем смесителе и спрессовывали на роторном таблеточном прессе с получением овальных двояковогнутых таблеток с размерами 15,983,4 мм и с углублениями порядка 0,9 мм на обеих сторонах таблетки. За прессованием следовало отсасывание пыли и контроль содержания металлов. Таблетки переносили в дражировочный котел и покрывали оболочкой с заданной прибавкой массы 4% (мас./мас.). Композиция таблеток-носителей приведена ниже. Сердцевина. Удаляется во время процессирования.(Класса EF; НРС), 2 г безводной лимонной кислоты и 0,02 г бутилированного гидроксианизола (ВНА),фильтрации через фильтр 10 мкм и затем с помощью доведения конечного объема до 100 мл с помощью метанола. 1-6-[(3-Циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон растворяли в растворе-носителе с помощью ультразвукового аппарата до получения однородного раствора с конечной концентрацией 35 мг/г (мас./мас.). 28,5 мг дозированного раствора распределяли на каждую таблетку в ряду таблеток-носителей. Таблетки высушивали в сушильной установке с принудительным потоком воздуха при 50 С в течение 1020 мин. Если необходимо или желательно, температура высушивания может быть повышена, например,до 60 С и/или может быть увеличена продолжительность высушивания для того, чтобы гарантировать адекватное выпаривание растворителя. Композиция готовых таблеток указана ниже. Пример 6. Получение ряда таблеток, содержащих 0,01 мг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро 1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона. Компоненты сердцевины пропускали сквозь фильтр 30 меш и затем смешивали вместе в подходящем смесителе и спрессовывали на роторном таблеточном прессе с получением круглых двояковогнутых таблеток с диаметром 7,9 мм и с углублениями порядка 0,8 мм на обеих сторонах таблетки. За прессованием следовало отсасывание пыли и контроль содержания металлов. Таблетки переносили в дражировочный котел и покрывали оболочкой с заданной прибавкой массы 4% (мас./мас.). Композиция таблеток-носителей приведена ниже. Сердцевина. Удаляется во время процессирования.(класса EF; НРС) и 3 г безводной лимонной кислоты в метаноле, с помощью фильтрации через фильтр 10 мкм и затем с помощью доведения конечного объема до 100 мл с помощью метанола. 1-6-[(3-Циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинон растворяли в растворе-носителе с помощью ультразвукового аппарата (а также с использованием магнитной мешалки) до получения однородного раствора с конечной концентрацией 12,5 мг/г (мас./мас.). 4 мг дозированного раствора распределяли на каждую таблетку в ряду таблеток-носителей. Таблетки высушивали в сушильной установке с принудительным потоком воздуха при 50 С в течение 10-20 мин. Композиция готовых таблеток указана ниже. Примеры 7-11. Получение ряда таблеток, содержащих 0,002, 0,005, 0,02, 0,05 или 0,1 мг 1-6-[(3 циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона. Таблетки, содержащие 0,002, 0,005, 0,02, 0,05 или 0,1 мг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н 3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона получали способом, описанным в примере 6, за исключением вариации концентрации 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)окси]-3-пиридинил-2-пирролидинона в дозированном растворе. Следующие примеры (пример 12 и пример 13) представляют собой пример таблетки, которая может быть получена согласно изобретению. Пример 12. Получение субстрата таблетки-носителя с пероральным распадом (ODT). а) Получение субстрата ODT-носителя.StarLac и Neotame пропускают через номинальный фильтр 20 меш. Смесь и непросеянный мятный ароматизатор переносят в подходящий смеситель и перемешивают в течение приблизительно 10 мин. Стеарат магния пропускают через номинальный фильтр 30 меш, переносят в смеситель и всю смесь перемешивают в течение приблизительно 2 мин. Массы используемых веществ рассчитывают исходя из процентного содержания массовых долей, приведенных в табл. А. Смесь спрессовывают в соответствии с заданными спецификациями (например, круглые, двояковогнутые таблетки с размером диаметра(8-9,5) мм на подходящем роторном прессе с применением подходящего оборудования для производства таблеток. Таблетки пропускали через пылеуловитель и контрольное устройство содержания металлов. Таблица Аb) Получение этилцеллюлозной оболочки для применения к таблетке с помощью тампонной печати. Этилцеллюлозу растворяют в метаноле с перемешиванием и добавляют триэтилцитрат. Массы используемых веществ рассчитывают исходя из процентного содержания массовых долей,приведенных в табл. В. Достаточное количество метанола добавляют с приведением к целевой концентрации на основе соотношения мас./мас. Раствор переносят в емкость для чернил тампонного печатающего устройства, оборудованного подходящим трафаретом изображения с круглым изображением, имеющим чуть меньший диаметр, чем фактический диаметр таблетки. Устанавливают подходящую полимерную пластинку для соответствия с пластинкой трафарета изображения. Таблетки подаются на тампонное печатающее устройство в определенном порядке соответственно трафарету. Тампонное печатающее устройство может наносить 2-4 слоя на таблетку-носитель для нанесения покрытия, которое обеспечивает защитный слой для ослабления инфильтрации растворителя в субстрат-носитель без покрытия во время процесса распределения жидкости. Таблица В Метанол удаляется путем выпаривания. Пример 13. Альтернативное получение субстрата таблетки-носителя с пероральным распадом(ODT). Маннит, кросповидон XL, ксилит и Неотам пропускают сквозь номинальный фильтр 20 меш, смесь и непросеянный мятный ароматизатор переносят в подходящий смеситель и перемешивают в течение приблизительно 10 мин. Стеарат магния и коллоидный диоксид кремния пропускают сквозь номинальный фильтр 30 меш, переносят в подходящий смеситель и перемешивают всю смесь в течение приблизительно 2 мин. Массы используемых веществ рассчитывают исходя из процентного содержания массовых долей, приведенных в табл. С. Смесь спрессовывают в соответствии с заданными спецификациями (например, круглые, двояковогнутые таблетки диаметром (8-9,5 мм) на подходящем роторном прессе с применением подходящего оборудования для производства таблеток. Таблетки пропускали через пылеуловитель и контрольное устройство содержания металлов. Этилцеллюлозное покрытие может быть получено и нанесено, как описано в примере 12. Свойства. Стабильность вещества лекарственного средства в таблетках может быть протестирована, как представлено ниже. Растворяют 5 таблеток в разбавителе (1:9 ацетонитрил: 50 мМ дигидроортофосфат калия, доводят рН до 3 с помощью ортофосфорной кислоты) с получением конечной концентрации активного агента в интервале 1-10 мкг/мл и, если необходимо, дополнительно обрабатывают ультразвуком. Дают возможность охладиться до комнатной температуры и затем центрифугируют аликвоту образца при 14000 об/мин. Получают образцы с использованием таблеток плацебо, которые функционируют в качестве контрольных образцов. Используя следующие инструментальные условия, уравновешивают хроматографическую систему с помощью 95% А, 5% В. Записывают хроматограммы для препаратов образца и плацебо. Колонка: XBridge C18 3 мкМ 15 см 4,6 мм внутр. размер. Температура колонки: 40 С. Подвижная фаза А: 10 мМ бикарбоната аммония, рН 10 в присутствии аммиака. Подвижная фаза В: ацетонитрил. Скорость потока: 1 мл/мин. Детекторная длина волны: 250 нм. Объем инъекции: 100 мкл. Градиентный профиль. После сравнения хроматограмм для идентификации примесей/продуктов деградации процентное содержание каждой примеси/продукта деградации в инъекциях контроля и образца может быть рассчитано путем деления площади пика примеси/продукта деградации на суммарный общий пик для 1-6-[(3 циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона и всех примесей/продуктов деградации и умножением на 100. Общее содержание примеси/продукта деградации может быть рассчитано путем суммирования процентного содержания каждой присутствующей примеси/продукта деградации. Обычно в расчет общего содержания примеси/продукта деградации включают только примеси/продукт деградации в количестве, равном 0,05 или 0,03% или составляющем более чем 0,05 или 0,03%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лекарственная форма для орального введения, которая содержит таблетку-носитель, по меньшей мере, частично покрытую оболочкой, включающая:a) 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон или его фармацевтически приемлемую соль иb) стабилизатор, который уменьшает деградацию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона в лекарственной форме, где указанный стабилизатор выбран из группы, состоящей из лимонной кислоты, яблочной кислоты, аскорбиновой кислоты и их солей, бикарбоната натрия, бутилированного гидроксианизола и бутилированного гидрокситолуола. 2. Лекарственная форма для орального введения по п.1, где оболочка дополнительно содержит пленкообразующее вещество. 3. Лекарственная форма для орального введения по п.2, где пленкообразующее вещество представляет собой гидроксипропилцеллюлозу. 4. Лекарственная форма для орального введения по любому из предшествующих пунктов, где указанная таблетка-носитель имеет по меньшей мере одну полость. 5. Лекарственная форма для орального введения по п.4, где указанная оболочка находится в полости на указанной таблетке-носителе. 6. Лекарственная форма для орального введения по любому из пп.2-5, где, по существу, отсутствует абсорбция 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинона или его фармацевтически приемлемой соли таблеткой-носителем. 7. Лекарственная форма для орального введения по п.6, где на указанную таблетку-носитель нанесено покрытие. 8. Лекарственная форма для орального введения по любому из предшествующих пунктов, которая содержит от 1 мкг до 1 мг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3 пиридинил-2-пирролидинона в расчете его как количество свободного основания. 9. Лекарственная форма для орального введения по любому из предшествующих пунктов, которая включает 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2 пирролидинон в виде свободного основания. 10. Лекарственная форма для орального введения по любому из пп.1-7, где указанный стабилизатор представляет собой лимонную кислоту и где молярное соотношение свободного основания 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона и лимонной кислоты находится в интервале между 1,5:1 и 1:500. 11. Лекарственная форма для орального введения по любому из предшествующих пунктов, где лекарственная форма и/или оболочка содержит от 2 до 100 мкг 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н 3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона в расчете его как количество свободного основания. 12. Лекарственная форма для орального введения, определенная по любому из пп.1-11, для применения в лечении неврологических заболеваний. 13. Способ получения лекарственной формы для орального введения, определенной в п.1, включающий распределение раствора или суспензии 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора на таблетке-носителе, где указанный стабилизатор выбран из группы, состоящей из лимонной, яблочной, аскорбиновой кислот и их солей, бикарбоната натрия, бутилированного гидроксианизола и бутилированного гидрокситолуола. 14. Способ по п.13, где раствор или суспензию 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3 бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтически приемлемой соли и стабилизатора получают с использованием органического растворителя, представляющего собой метанол, этанол, ацетон, уксусную кислоту или метиленхлорид. 15. Способ по п.13 или 14, где стабилизатор представляет собой лимонную кислоту и присутствует в растворе или суспензии в количестве 2-3% мас./об. 16. Способ по пп.13, 14 или 15, где в лекарственной форме таблетка-носитель, по меньшей мере, частично покрыта оболочкой, как определено по п.1, и где оболочка дополнительно содержит пленкообразующее вещество по п.2, которое представляет собой гидроксипропилцеллюлозу, и где в способе гидроксипропилцеллюлоза присутствует в растворе или суспензии в количестве 4-6% мас./об. 17. Способ по пп.13-15 или 16, где таблетку-носитель и распределенные раствор/суспензию нагревают для выпаривания избытка жидкости, в результате образуется оболочка по меньшей мере на части поверхности таблетки-носителя. 18. Способ по любому из пп.13-17, где таблетка-носитель, получаемая в способе, имеет полость или углубление, которое обеспечивает наличие лунки для раствора или суспензии 1-6-[(3-циклобутил 2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил-2-пирролидинона или его фармацевтиче- 12019865 ски приемлемой соли и стабилизатора для помещения их в лунки после распределения. 19. Способ по п.18, в котором получают двояковогнутые таблетки, имеющие полости с обеих сторон. 20. Применение 1-6-[(3-циклобутил-2,3,4,5-тетрагидро-1 Н-3-бензазепин-7-ил)окси]-3-пиридинил 2-пирролидинона или его фармацевтически приемлемой соли для получения лекарственной формы для орального введения, определенной в любом из пп.1-11, для лечения неврологических заболеваний.
МПК / Метки
МПК: A61K 9/50, A61K 9/00, A61K 9/20, A61K 31/55
Метки: 1{6-[(3-циклобутил-2,3,4,5-тетрагидро-1н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинон, уменьшает, содержащая, стабилизатор, деградацию, соль, форма, лекарственная
Код ссылки
<a href="https://eas.patents.su/14-19865-lekarstvennaya-forma-soderzhashhaya-16-3-ciklobutil-2345-tetragidro-1n-3-benzazepin-7-iloksi-3-piridinil-2-pirrolidinon-ili-ego-sol-i-stabilizator-kotoryjj-umenshaet-ego-degradaciy.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственная форма, содержащая 1{6-[(3-циклобутил-2,3,4,5-тетрагидро-1н-3-бензазепин-7-ил)окси]-3-пиридинил}-2-пирролидинон или его соль и стабилизатор, который уменьшает его деградацию</a>
Предыдущий патент: Крупномасштабное производство станнсопорфина высокой чистоты
Следующий патент: Детектирование кавитации
Случайный патент: Применение фумагиллола и его производных для приготовления лекарств, предназначенных для борьбы с кишечными инфекциями, и фармацевтическая композиция на их основе