Комбинированные препараты, содержащие бифепрунокс и l-допу
Номер патента: 14576
Опубликовано: 30.12.2010
Авторы: Тюлп Мартинус Т.М., Маккрири Эндрю К., Ван Схарренбург Гюстаф Й.М.
Формула / Реферат
1. Комбинированный препарат, содержащий
(i) бифепрунокс или его N-оксид
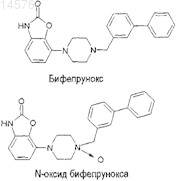
или фармацевтически приемлемые соли указанных соединений, и
(ii) L-DOPA или ее фармацевтически приемлемые соли, для одновременного, раздельного или последовательного использования в лечении расстройств, требующих восстановления функции дофаминергической системы.
2. Препарат по п.1, дополнительно содержащий ингибитор декарбоксилазы.
3. Препарат по п.1 или 2, дополнительно содержащий ингибитор СОМТ.
4. Препарат по любому из пп.1, 2 или 3, дополнительно содержащий ингибитор МАО-В.
5. Применение препарата по любому из пп.1-4 для производства лекарственного средства для лечения расстройств, требующих восстановления функции дофаминергической системы.
6. Применение по п.5, в котором указанное расстройство представляет собой болезнь Паркинсона.
7. Применение по п.5, в котором указанное расстройство представляет собой синдром беспокойных ног.
8. Фармацевтическая композиция, содержащая в дополнение к фармацевтически приемлемому носителю и/или по меньшей мере одному фармацевтически приемлемому вспомогательному веществу фармакологически активное количество препарата по любому из пп.1-4 в качестве активных ингредиентов.
9. Способ лечения болезни Паркинсона или синдрома беспокойных ног у человека или животного, который нуждается в таком лечении, включающий введение пациенту одновременно, раздельно или последовательно, определенного количества бифепрунокса, или его N-оксида, или их фармацевтически приемлемой соли и определенного количества L-DOPA, в котором количества эффективны для лечения.
10. Способ по п.9, в котором дополнительно вводится определенное количество ингибитора декарбоксилазы, и/или ингибитора СОМТ, и/или ингибитора МАО-В.
11. Применение бифепрунокса или его N-оксида для производства лекарственного средства для лечения синдрома беспокойных ног.
12. Препарат для лечения синдрома беспокойных ног, представляющий собой бифепрунокс или его N-оксид.
Текст
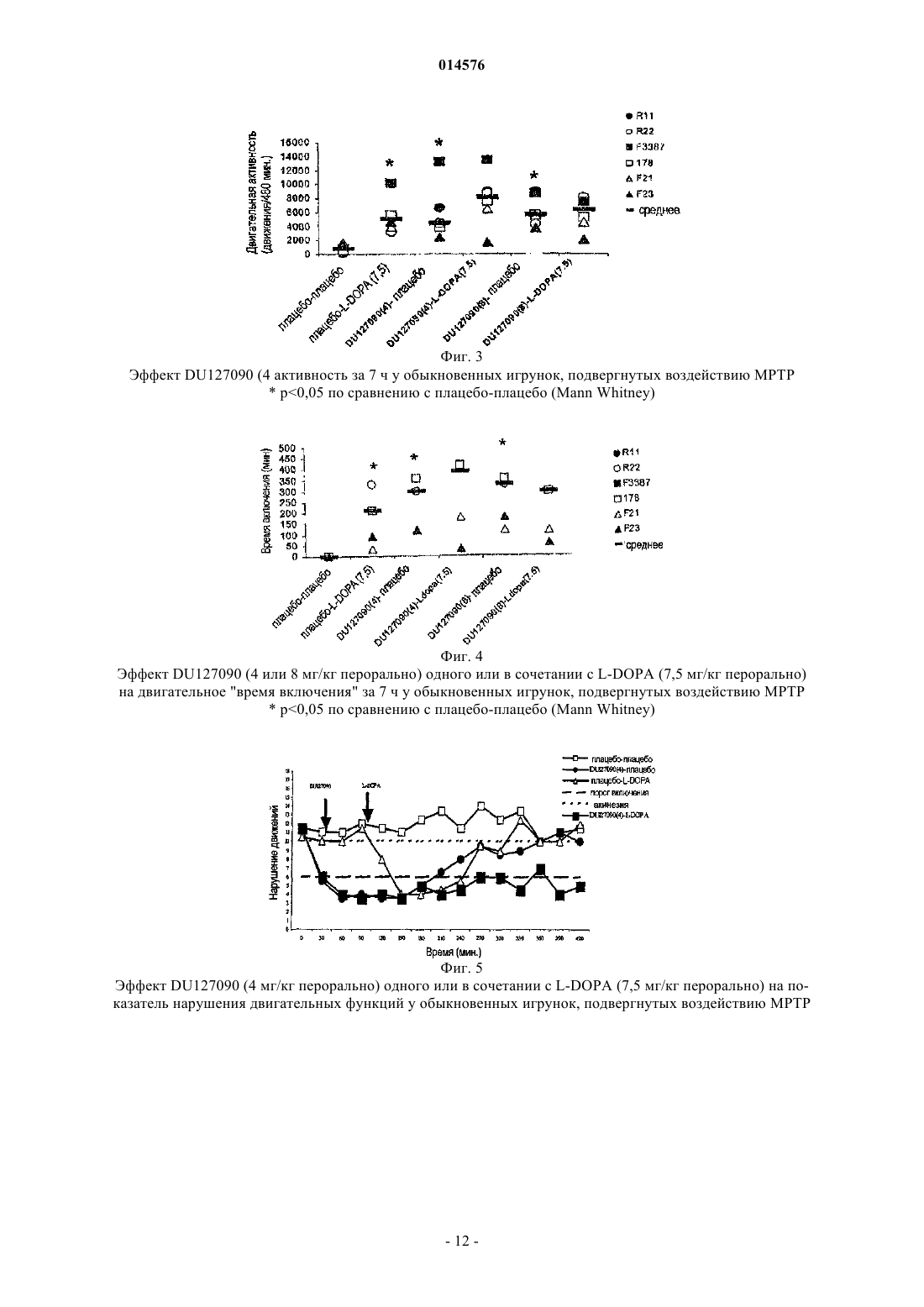
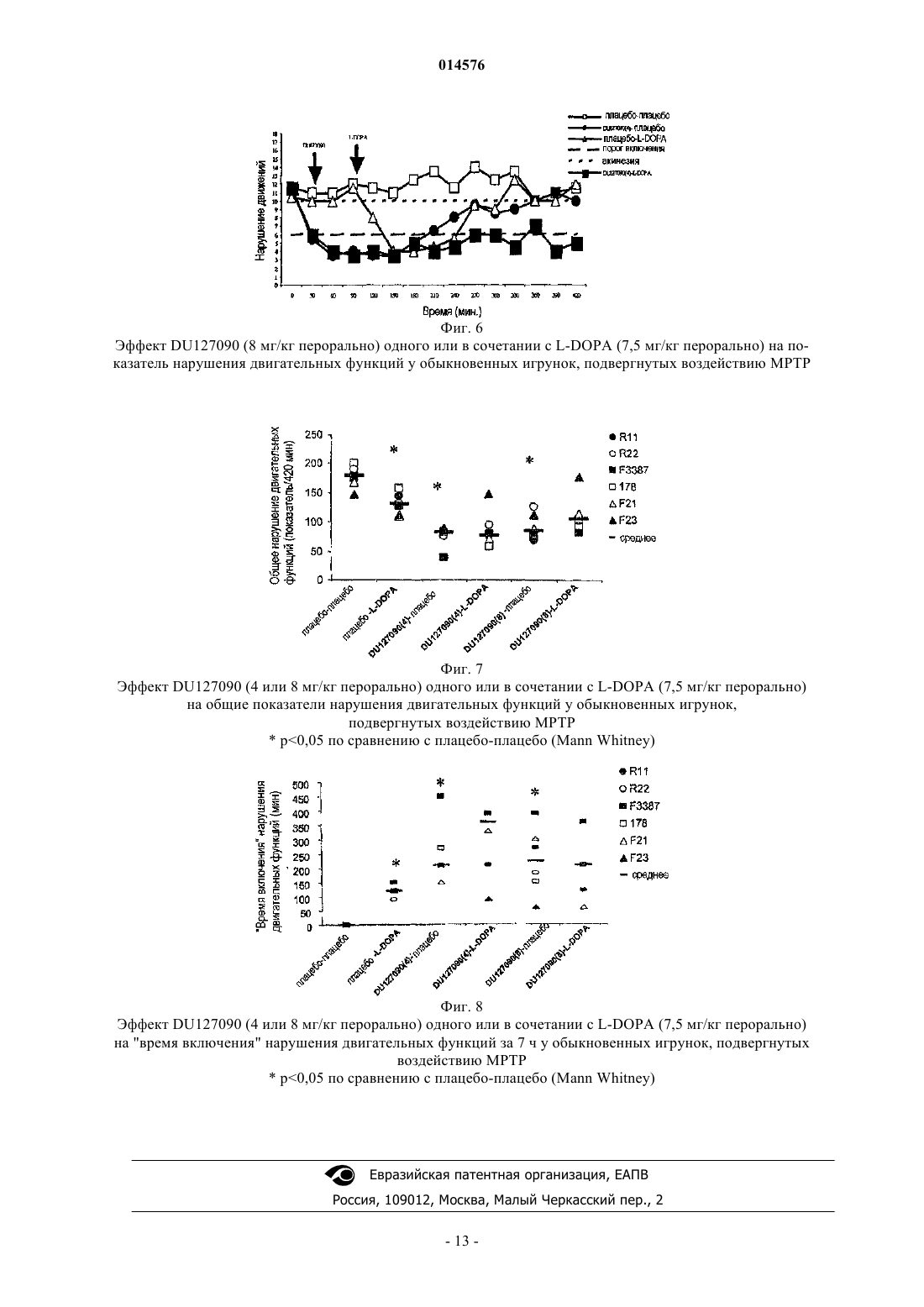
Маккрири Эндрю К., Ван Схарренбург Гюстаф Й.М., Тюлп Мартинус Т.М. (NL) Представитель: Изобретение касается применения сочетания препарата бифепрунокса, или его N-оксида, или фармакологически приемлемых солей указанных соединений и L-допы для одновременного, раздельного или последовательного применения при лечении расстройств, требующих восстановления функции дофаминергической системы, в частности, при болезни Паркинсона и при синдроме беспокойных ног. 014576 Область техники, к которой относится изобретение Изобретение касается использования сочетания препарата бифепрунокса или его N-оксида, или фармакологически приемлемых солей указанных соединений и L-допы, для одновременного, раздельного или последовательного применения при лечении расстройств, требующих восстановления функции дофаминергической системы, в частности при болезни Паркинсона и при синдроме беспокойных ног. Уровень техники Постоянный тремор рук и ног, движения тела, которые постепенно становятся более скованными,медленными и слабыми, и маскообразное выражение лица являются симптомами, которые наблюдаются в истории болезни пациентов. В 1817 г. Джеймс Паркинсон описал указанную группу симптомов как дрожательный паралич, и вскоре заболевание было названо по имени врача, который первым подробно его описал. Патогенез болезни Паркинсона включает разрушение нервных клеток в substantia nigra, части мозга, отвечающей за движения. Потеря приблизительно 80% стриарного дофамина при болезни Паркинсона вызывает основные симптомы: акинезию, ригидность и брадикинезию (Hornykiewicz, 1966). Пациентам сложно начать движение и отмечается постуральная неустойчивость и нарушение координации. Современная фармакотерапия болезни Паркинсона основана на восстановлении функции дофаминергической системы (Blandini, 2000; Lledo, 2000). Дофамин не проникает через гематоэнцефалический барьер и, следовательно, не может быть использован для лечения болезни Паркинсона, взамен используют его непосредственный предшественник, L-DOPA (левовращающий энантиомер 3,4 дигидроксифенилаланина, также обозначаемый как леводопа), так как он проникает в мозг, где декарбоксилируется до дофамина. Но леводопа декарбоксилируется также и в периферических тканях. Таким образом, только небольшая часть введенной леводопы транспортируется в мозг. Карбидопа подавляет декарбоксилирование периферической леводопы, но сама не может проникать через гематоэнцефалический барьер и не обладает влиянием на метаболизм леводопы в мозге. Считается, что сочетание карбидопы и леводопы более эффективно воздействует на симптомы болезни Паркинсона. Тем не менее, определенные ограничения становятся очевидными в пределах от двух до пяти лет начальной терапии. Так как заболевание прогрессирует, эффект каждой дозы становится короче (эффект привыкания), и у некоторых пациентов имеются непредсказуемые изменения от подвижности до неподвижности (включение-выключение эффекта). Периоды включения обычно связаны с высокими плазменными концентрациями и часто включают в себя патологические непроизвольные движения, т.е. дискинезии. Периоды выключения коррелируют с низким плазменным уровнем леводопы и брадикинетическими эпизодами(Jankovic, 1993; Rascol, 2000). Это заставляло врачей откладывать начало лечения L-DOPA до предшествующего лечения дофаминергическими агонистами. Однако использование полных агонистов дофаминовых рецепторов, таких как апоморфин, бромокриптин, лисурид, перголид, прамипексол или ропинирол также имеет ограничения: они являются причиной дискинезии, вызывают психозоподобные симптомы, включая галлюцинации, ортостатическую гипотензию, сонливость и другие побочные эффекты (Lozano, 1998; Bennett, 1999). Предполагается, что указанные побочные эффекты могут быть преодолены использованием частичных агонистов D2/3 рецепторов дофамина (т.е., соединений, которые не стимулируют D2/3 рецепторы дофамина максимально) (Jenner 2002). Такие соединения гипотетически будут способны к стимуляции D2/3 рецепторов дофамина при низком тонусе дофаминергической системы, в то же время они способны препятствовать чрезмерной стимуляции D2 рецепторов дофамина при высоком тонусе дофаминергической системы, таким образом,вызывая стабилизацию дофаминергической передачи в мозге (Jenner 2002). Агонисты 5-HT1A рецепторов могут смягчать индуцирование дискинезии, так как агонист 5-HT1A рецепторов тандоспирон уменьшает дискинезию при лечении L-DOPA пациентов с болезнью Паркинсона (Kannari, 2002) и вызванные галоперидолом экстрапирамидные побочные эффекты у приматов(Christoffersen, 1998). Позднее предположили, что саризотан, агонист 5-HT1A рецепторов и лиганд дофаминовых рецепторов может смягчать дискинетические симптомы (Olanow, 2004; Bara-Jimenez, 2005;Bibbiani, 2001). Присутствие агониста 5-HT1A рецепторов может быть выгодно для терапевтических воздействий частичных агонистов D2/3 рецепторов (Johnston, 2003). Недавно были представлены различные комбинированные препараты, содержащие L-DOPA и один или более других ингибиторов ферментов. Хорошо известны сочетания L-DOPA/карбидопа (например,Sinemet), L-допа/бенсеразид (например, Madopar) и L-DOPA/карбидопа/энтакапон (например,Stalevo, (Jost, 2005. Позднее ингибиторы катехоламин-О-метилтрансферазы (СОМТ), такие как толкапон и энтакапон, были предложены для смежной терапии с L-DOPA. Указанные соединения повыша-1 014576 ют период полураспада L-DOPA без значительного повышения Смакс. Таким образом, они увеличивают продолжительность действия, но склонны повышать выраженность побочных эффектов, зависимых от пиковой концентрации, включая зависимую от пиковой концентрации дискинезию. Толкапон обладает значительным токсическим действием на печень у небольшого процента пациентов. Другая стратегия,нацеленная на замедление метаболизма дофамина, представляет собой использование ингибиторов моноаминоксидазы-В (МАО-В) в сочетании с L-DOPA. Введение ингибиторов МАО, однако, связано с отрицательными побочными эффектами, которые ограничивают их применение. Указанные эффекты включают, например, тошноту, головокружение, шаткость походки, боль в животе, слабость, спутанность,галлюцинации, сухость во рту, беспокойный сон, дискинезии и головную боль. Особенностью сочетания препаратов является то, что они существуют во множестве различных дозовых сочетаний, так как с течением заболевания обычно требуются более высокие дозы L-DOPA для контролирования его симптомов. Сочетание препаратов в форме таблеток, содержащих фиксированные количества лекарственных средств, удобно для использования, но одновременно создает ограничение приспосабливаемости. Иллюстрацией факта, что фиксированные сочетания не являются всегда успешными, представляет собой, например, использование селективного ингибитора МАО-В селегилина в лечении болезни Паркинсона. На ранней стадии заболевания селегилин может быть дан в качестве монотерапии: соединение замедляет метаболизм эндогенного дофамина достаточно для удержания симптомов в приемлемых границах. На более поздней стадии заболевания может стать необходимым использование L-DOPA. Когда эффективность L-DOPA начинает снижаться, для решения этой проблемы обычно, в первую очередь,используют ингибитор декарбоксилазы, подобный карбидопа (см. выше), и, когда этого недостаточно,совместная терапия с селегилином будет восстанавливать эффективность L-DOPA уменьшением разрушения дофамина, образующегося из L-DOPA. Таким образом, на практике L-DOPA и селегилин вводят в отдельных препаратах, которые могут быть даны одновременно или последовательно. Пациенты, серьезно страдающие синдромом беспокойных ног (RLS; также известным как синдром Экбома), фактически не могут оставаться в сидячем положении или ровно стоять неподвижно. Виды деятельности, которые требуют сохранения двигательного покоя и ограниченные когнитивной стимуляцией,такие как перемещение (автомобиль, самолет, поезд и т.д.) или присутствие на длительных заседаниях,лекциях, кинофильмах или других представлениях, становятся трудными, если не невозможными. Страдая от указанных ощущений, которые становятся более тяжелыми ночью, в добавление к ухудшающемуся качеству жизни пациенты с RLS обнаруживают, что спать практически невозможно. Побуждение двигаться, которое увеличивается в периоды отдыха, может быть полностью рассеяно движением, таким как ходьба. Однако, как только движение прекращается, симптомы возвращаются с увеличенной интенсивностью. Если пациент с RLS вынужден лежать спокойно, симптомы продолжат проявляться скачкообразно, в конечном счете, ноги будут непроизвольно двигаться, немедленно смягчая симптомы. Ритмичные или полуритмичные движения ног наблюдаются, если пациент пытается лечь(Pollmacher, 1993). Описанные движения обозначают как дискинезию бодрствования (DWA) (Hening,1986) или, в общем случае, периодические движения конечностей во время бодрствования (PLMV). Клинически, RLS выявляют, если находят четыре диагностических критерия: (1) ощущение побуждения двигать конечностями (обычно ногами); (2) моторное возбуждение уменьшает ощущения; (3) в покое симптомы возобновляются или усиливаются; и (4) отмечают циркадные изменения в появлении или тяжести симптомов RLS, что проявляется усилением симптомов в вечернее или ночное время (Allen, 2001). Современные лекарственные средства для RLS разнообразны и обладают нежелательными побочными эффектами. Лечение включает введение агонистов дофамина, других дофаминергических средств,бензодиазепинов, опиатов и противосудорожных средств. В случаях, когда RLS вызвана вторым состоянием, таким как беременность, последняя стадия заболевания почек, лечением эритропоэтином или дефицитом железа, устранение состояния, такое как роды или лечение традиционным добавлением железа,может уменьшить или устранить симптомы, по крайней мере, в некоторых случаях (Allen, 2001). ОднакоRLS, не являющиеся вторичными состояниями (идиопатический RLS), представляют собой большие терапевтические проблемы. Дофаминергические средства, такие как леводопа, в общем случае предоставляют, эффективное начальное лечение, но при длительном использовании, приблизительно у 80% пациентов с RLS появляется устойчивость и усиление симптомов (Allen, 2001); описанное осложнение также является общим для агонистов дофамина (Earley, 1996). Другие альтернативные средства, бензодиазепины, опиаты и противосудорожные средства не являются такими же эффективными как дофаминергические средства (Chesson, 1999; Hening, 1999). Несмотря на изменения режима лечения, 15-20% пациентов находят, что все лекарственные средства неадекватны, так как имеют побочные эффекты и ограниченное лечебное благоприятное воздействие.DU 127090, 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3H)-бензоксазолон, также известный как бифепрунокс, связывается с дофаминовыми D2-подобными рецепторами и 5-HT1A рецепторами; он представляет собой частичный агонист D2/3 рецепторов дофамина и также является частичным агонистом серотониновых 5-HT1A рецепторов (WO 97/36893; Van Vliet, 2000; Feenstra, 2001, 2002; Hesselink,2003a,b, Mealy, 2004). В WO 2007/023141 раскрыто, что in vivo N-оксид бифепрунокса быстро превращается в исходное соединение, следовательно, действует как пролекарство. Подробное описание изобретения Задачей настоящего изобретения было совершенствовать лечебное средство, такое же эффективное как L-DOPA, но не обладающее его побочными эффектами, в частности, не обладающее его свойством включать-выключать эффект, вызывающим дискинезию во время включения и эпизоды брадикинезии во время периодов выключения. Неожиданно, при изучении игрунок, подвергнутых действию МРТР, на животных моделях с определенным значением для болезни Паркинсона, было найдено, что сочетанное лечение L-DOPA и бифепруноксом уменьшает пиковую двигательную активность, наблюдаемую после отдельного применения LDOPA, так что гиперактивность не регистрировали. Длительность активности (время включение) послеL-DOPA была увеличена сочетанным введением бифепрунокса. Сущность изобретения представляет собой сочетание препаратов бифепрунокса или его N-оксида,или их фармакологически приемлемых солей, гидратов или сольватов, и L-DOPA и, необязательно, ингибитора декарбоксилазы и/или, необязательно, СОМТ-ингибитора, и/или, необязательно, ингибитора МАО-В, для одновременного, раздельного или последовательного использования в лечении расстройств,требующих восстановления функции дофаминергической системы, в частности, при болезни Паркинсона и при синдроме беспокойных ног. Изобретение относится к применению бифепрунокса или его N-оксида, вернее пролекарства, в случаях, когда L-DOPA вызывает дискинезии или может ускорять появление дискинезии. В таких случаях специфические фармакологические влияния соединений, а именно, частичный агонизм с D2 и D3 дофаминовыми рецепторами, так же как полный агонизм с 5-HT1A серотониновыми рецепторами, вызовет блокаду дискинензии без уменьшения терапевтического эффекта L-DOPA. Настоящее изобретение относится к фармацевтическим композициям, содержащим:(i) бифепрунокс, его N-оксид, или их фармакологически приемлемые соли, гидраты или сольваты, и(ii) L-DOPA, в смеси с фармакологически приемлемым вспомогательным средством, разбавителем или носителем. В дополнительном аспекте настоящее изобретение относится к наборам частей, включающих:(i) емкость, содержащую бифепрунокс, его N-оксид, или их фармакологически приемлемые соли,гидраты или сольваты, необязательно в смеси с фармакологически приемлемым вспомогательным средством, разбавителем или носителем, и(ii) емкость, содержащую L-DOPA, необязательно в смеси с фармакологически приемлемым вспомогательным средством, разбавителем или носителем, и(iii) инструкции для последовательного, раздельного или одновременного введения бифепрунокса иL-DOPA пациенту, который нуждается в их введении. В соответствии с дополнительным аспектом изобретения предоставлен способ изготовления набора частей, обозначенных в данном документе, который включает приведение компонента (i), определенного выше, в связь с компонентом (ii), указанным выше, предоставляя два компонента, приемлемых для введения в связи друг с другом. Приведение двух компонентов в связь друг с другом включает в себя то, что компоненты (i) и (ii) могут быть:(i) предоставлены как отдельные композиции (т.е. независимые друг от друга), которые последовательно соединены вместе для использования в соединении друг с другом в сочетанной терапии; или(ii) упакованы и представлены вместе как отдельные компоненты совместной упаковки для использования в соединении друг с другом в сочетанной терапии. Также в другом аспекте настоящее изобретение относится к способам для лечения пациента, страдающего от состояния, при котором необходимо или желательно восстановить дофаминергическую функцию или предрасположенного к такому состоянию, которые включают введение пациенту терапевтически эффективного общего количества(i) бифепрунокса, его N-оксида, или их фармакологически приемлемых солей, гидратов или сольватов, необязательно в смеси с фармакологически приемлемым вспомогательным средством, разбавителем или носителем в соединении с(ii) L-DOPA, необязательно в смеси с фармакологически приемлемым вспомогательным средством,разбавителем или носителем. Также в другом аспекте изобретение относится к использованию фармацевтических композиций,содержащих:(i) бифепрунокс, его N-оксид или их фармакологически приемлемые соли, гидраты или сольваты и(ii) L-DOPA в смеси с фармакологически приемлемым вспомогательным средством, разбавителем-3 014576 или носителем в производстве лекарственного средства для лечения состояния, при котором необходимо или желательно восстановление функции дофаминергической системы. Определения Примеры ингибиторов декарбоксилазы представляют собой карбидопу и бенсеразид. Примеры ингибиторов катехоламин-О-метилтрансферазы (СОМТ) представляют собой энтакапон, нитекапон и толкапон, и ингибиторы моноаминоксидазы-В (МАО-В) включают депренил, (-)-депренил (селегелин), десметилдепренил, N-пропаргил-1-(R)аминоиндан (расагалин), фенелзин (нардил), транилципромин (парнат), CGP3466, фуразолидон, изокарбоксазид, паргилин, метиклотиазид и прокарбазин. Для предоставления более сжатого описания некоторые количественные выражения даны в данном документе неуточненными с термином приблизительно. Ясно, что использован ли термин приблизительно точно или нет, каждое число, указанное в данном документе, предназначено обозначать фактическую определенную величину и также предназначено обозначать приблизительное соответствие для указанной определенной величины, которое будет обоснованно предположено специалистом в данной области, включая приблизительные величины, соответствующие экспериментальным условиям и/или измерениям для таких определенных величин. На всем протяжении описания и формулы изобретения в данном документе слово содержать и варианты слова, такие как содержащий и содержит, не предназначены исключать другие добавки, компоненты, целые числа или стадии. Термин композиция, использованный в данном документе, охватывает средство, содержащее специфические ингредиенты в предопределенных количествах или соотношениях, так же, как и какоелибо средство, которое получено непосредственно или опосредованно, сочетанием специализированных ингредиентов в специфических количествах. В отношении фармацевтических композиций указанный термин охватывает средство, содержащее один или более активных ингредиентов и необязательный носитель, содержащий инертные ингредиенты, так же, как и какое-либо средство, которое получено непосредственно или опосредованно, сочетанием, комплексированием или агрегированием каких-либо двух или более ингредиентов, или посредством разделения одного или более ингредиентов, или посредством других типов реакций или взаимодействий одного или более ингредиентов. В общем случае фармацевтические композиции получают равномерным и тесным введением в соединение активного ингредиента с жидким носителем или тонкодисперсным носителем, или с ними обоими, и затем, при необходимости,формованием продукта в нужную композицию. Фармацевтическая композиция содержит достаточно активного соединения для получения необходимого воздействия на развитие или состояние заболевания. Соответственно, фармацевтические композиции согласно настоящему изобретению охватывают какиелибо композиции, изготовленные смешиванием соединения согласно настоящему изобретению и фармацевтически приемлемого носителя. Фармацевтически приемлемым обозначен носитель, разбавитель или эксципиент, который должен быть совместимым с другими ингредиентами композиции и должен не быть вредным для объекта воздействия. В контексте настоящей заявки термин комбинированный препарат включает оба соответствующих сочетания, подразумевающих бифепрунокс и другие лекарственные средства, физически объединенные в один препарат, такой как таблетка или жидкость для инъекций, так же как и набор частей,содержащих бифепрунокс и L-DOPA в отдельных дозированных формах, совместно с инструкцией для использования, необязательно с дополнительными способами для облегчения соблюдения правильного введения составляющих соединений, например, этикеткой или схемой. Фармакотерапия соответствующими сочетаниями по определению является одновременной. Составные части набора частей могут быть введены или одновременно, или в различные временные интервалы. Терапия, являющаяся или сопровождающей, или последовательной, будет зависеть от характеристик других используемых лекарственных средств, таких как начало и длительность действия, плазменные уровни, клиренс и т.д., так же,как и от заболевания, его стадии и характеристик отдельного пациента. Вводимая доза композиции будет зависеть от значимых симптомов, возраста, массы и пола пациента и может быть определена врачом. Дозировки предпочтительно будут в интервале от 0,01 до 10 мг/кг. Обычная суточная доза активных ингредиентов изменяется в широком интервале и будет зависеть от различных факторов, таких как основной симптом, путь введения, возраст, масса и пол пациента, и может быть определена врачом. В общем случае дозировки для перорального и парентерального применения будут находится в интервале от 0,1 до 1000 мг в сутки всех активных ингредиентов. Термин терапевтически эффективное количество, использованный в данном документе, означает количество лекарственного средства для лечения состояния, поддающегося лечению введением композиции согласно изобретению. Указанное количество представляет собой количество, достаточное для проявления определяемого лечебного или смягчающего ответа в тканевой системе у животного или человека. Эффект может заключаться, например, в лечении состояний, перечисленных в данном документе. Определенное эффективное количество для пациента будет зависеть от размеров пациента и состояния здоровья, природы и степени состояния, которое лечат, рекомендаций лечащего специалиста (научного сотрудника, ветеринара, врача или другого клинициста) и лекарственных средств или сочетания-4 014576 лекарственных средств, выбранных для введения. Таким образом, нет специфического, строго определяемого заранее эффективного количества. Термин фармацевтически приемлемая соль означает те соли, которые, обоснованно в медицинском аспекте, приемлемы для использования в контакте с тканями людей и животных, без выраженного токсичного, раздражающего, аллергенного воздействия и тому подобного, и сопоставимы с рациональным соотношением преимущество/риск. Фармацевтически приемлемые соли хорошо изучены в данной области. Они могут быть получены in situ, при конечном выделении и очищении соединений изобретения, или отдельно, реакцией их с фармацевтически приемлемыми не токсическими основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты. Фармацевтически приемлемые соли могут быть предоставлены с использованием стандартных методик, хорошо известных в данной области, например, смешиванием соединения согласно настоящему изобретению с подходящей кислотой, например органической или неорганической кислотой. Введение в соединении с заключается в том, что соответствующие композиции, содержащие бифепрунокс и L-DOPA, вводят последовательно, раздельно и/или одновременно на протяжении курса лечения соответствующего состояния, которое может быть острым или хроническим. Предпочтительно термин включает в себя то, что две композиции вводят (необязательно неоднократно) в достаточно близкие сроки для благоприятного для пациента эффекта, который становится больше на протяжении курса лечения соответствующего состояния, чем в случае, когда вводят две композиции (необязательно неоднократно) по отдельности, в отсутствие другой композиции, на протяжении некоторого курса терапии. Определение, обеспечивает ли сочетание больший благоприятный эффект в отношении, и на протяжении курса лечения, отдельного состояния, будет зависеть от состояния, которое лечат или предупреждают, но может быть выполнено обычным образом специалистом в данной области. Таким образом, термин в соединении с включает в себя то, что одна или более композиций могут быть введены (необязательно,неоднократно) до, после и/или в одно и то же время с введением другого компонента. При использовании в данном контексте, термин введено одновременно и вводимый в то же время включает в себя то, что отдельные дозы бифепрунокса и L-DOPA вводят в пределах 48 ч, например 24, 18, 12, 6, 3, 2, 1 ч или 30 мин каждый от другого. Термин лечение, использованный в данном документе, означает воздействие на заболевание или состояние млекопитающего, предпочтительно человека, и включает в себя (1) подавление заболевания или состояния, т.е. прекращение его развития, (2) смягчение заболевания или состояния, т.е. вызывание обратного развития, или (3) прекращение симптомов заболевания. Использованный в данном документе термин терапевтическое лечение предназначен охватывать профилактические, диагностические и терапевтические схемы, осуществляемые in vivo и ex vivo у людей и других млекопитающих. Термин субъект, использованный в данном документе, означает животное, предпочтительно млекопитающее, более предпочтительно человека, который был объектом лечения, наблюдения или эксперимента. Примеры Воздействие нейротоксином МРТР (1-метил-4-фенил-1,2,3,6-тетрагидропиридином) приводит к истощению запасов дофамина в хвостатом ядре и скорлупе и паркинсоноподобному состоянию у не человекообразных и человекообразных приматов (Lange 1992; Langston, 1984; Langston, 1986). Пример 1. Взаимодействие между бифепруноксом и L-DOPA Животные: В исследовании использовали обыкновенных игрунок (Callithrix jacchus) (n=6, возраст от 3 до 5 лет; 5 самок и 1 самец), на которых предварительно воздействовали МРТР (2 мг/кг/сут п/к в течение 5 дней, и у которых проявлялся стабильный двигательный дефицит). Описываемые животные были восприимчивыми к L-DOPA, и не было исследования отсутствия лекарственного воздействия. У них не была экспериментально вызвана дискинезия, хотя некоторые дискинезии были представлены. Лекарственное воздействие: Бифепрунокса мезилат суспендировали в 10% растворе сукрозы и ввели перорально через зонд в объеме 2,0 мл/кг. L-DOPA: сложный метиловый эфир L-3,4-дигидроксифенилаланина (L-dopa) (SigmaChemical Co, UK) растворили в 10% растворе сукрозы и ввели перорально через зонд в объеме 2,0 мл/кг. Карбидопа: (Merck, Sharp и Dohme, UK) ввели перорально в виде суспензии в 10% растворе сукрозы в объеме 2,0 мл/кг. Домперидон: (2,0 мг/кг перорально, Sigma UK) растворили в 10% сукрозе и вводили за 60 мин до введения бифепрунокса в объеме 2,0 мл/кг. Бифепрунокс (4 или 8 мг/кг перорально свободного основания) или его носитель (10% сукрозу) вводили по отдельности и в сочетании с L-DOPA (7,5 мг/кг перорально свободного основания, дан в сочетании с карбидопой, 12,5 мг/кг перорально) игрункам, которые подверглись воздействию МРТР (n=6). Животных подвергли воздействию бифепрунокса или его носителя за 90 мин до введения L-DOPA или введения его носителя. Карбидопу вводили за 30 мин до введения L-DOPA. Домперидон вводили за 60 мин до введения бифепрунокса.-5 014576 Исследования поведения: Во всех исследованиях животных приучали к садкам для изучения поведения в течение 1 ч перед лечением. Животных поместили по отдельности в садки, не ограничивающие активность (506070 см),снабженные прозрачными плексигласовыми дверцами для предоставления четкого обзора для наблюдения. Каждый садок оборудовали 8 горизонтально ориентированными инфракрасными излучателями и соответствующими датчиками, расположенными так, чтобы давать возможность максимально оценивать движение. Двигательную активность оценивали как число прерываний светового луча, вызванных движением животных, накопленных в 10-минутные интервалы в течение 7 ч. Животным обеспечивали 60 минутный адаптационный период в функциональных садках, во время которого анализировали базовую активность, до введения лекарственного средства. Включение порога чувствительности определили как 3-кратную базовую активность у игрунков, подвергнутых воздействию МРТР. Гиперактивность определили как 3-кратную базовую активность у игрунков, не подвергнутых воздействию вещества. Время включения представляло собой период времени в минутах, когда активность была выше порога включения. Животных подвергли воздействию бифепрунокса, плацебо и/или L-DOPA. После лекарственного воздействия проанализировали двигательную активность и нарушение двигательной функции животных,как описано ниже, в течение 6 ч, следующих за введением лекарственного средства. Животные, использованные в исследовании, оставались в автоматизированных функциональных клетках в течение не более 8 ч в любой из дней исследования, и им предоставляли по меньшей мере 3-дневный восстановительный период между лекарственными воздействиями для обеспечения необходимого самочувствия животных. Двигательную активность, нарушение двигательных функций и наличие дискинезии оценили следующим образом. Двигательная активность: Во всех исследованиях животных приучали к садкам для изучения поведения в течение 1 ч перед лечением бифепруноксом. Животных затем подвергали воздействию соответствующих лекарственных средств. После лечения животных исследовали в отношении антипаркинсонической активности в течение 6 ч, используя автоматизированные функциональные садки, и оценкой двигательных нарушений независимым наблюдателем. Двигательное время включения определили как период времени, когда животные демонстрируют активность свыше 3 базовой активности или двигательная активность 100 постоянно была выше. Показатели нарушения двигательных функций и дискинезии: Нарушение двигательных функций и дискинезию оценили до и во время последних 10 мин каждого 30-минутного интервала после введения бифепрунокса в течение 6 ч, следующих за лекарственным воздействием. Использовали следующие шкалы оценки нарушения функций. Оценка нарушения функций: нарушение двигательных функций животных оценили в виде нижеперечисленного: активность (норма 0, вялость 2); реагирование (норма 0, уменьшено 1, медленное 2, отсутствует 3); сдерживание движений (присутствует 0, уменьшено 1, отсутствует 2); внимание и движения глаз (норма 0, патологические 1); положение тела (норма 0, патологическое туловища +1, патологическое конечностей +1, патологическое нижней части тела или грубые нарушения 4) ; равновесие/координация(норма 0, нарушено 1, неустойчивость 2, спонтанное падение 3); вокализация (норма 0, уменьшена 1,отсутствует 2); подвижность (норма 0, брадикинезия/гиперкинезия 1, акинезия/гиперкинезия 2). Седация была указана, если применяли. Время включения нарушения движений определили как период времени, когда животные демонстрировали показатель нарушения движений 6 или менее (порог включения). Данные и статистический анализ: данные представлены в виде средней двигательной активности(движения/30 мин) или показателя нарушения движений (показатель за 10 мин/30 мин) в течение 7 часового периода эксперимента или в виде общей двигательной активности (движения/420 мин) или нарушения двигательных функций (общий показатель за 420 мин). Данные проанализировали Kruskall Wallis ANOVA и затем Mann Whitney тестом, соответственно. Исследования скорректировали для множественных сравнений, используя формулу: где а=5% Отдельные группы животных из использованных в исследовании подвергали воздействию плацебо и использовали для статистического сравнения. Пример 2. Эффекты бифепрунокса на индуцированный L-DOPA регресс двигательной слабости Двигательная активность:L-DOPA (7,5 мг/кг перорально) плюс карбидопа (12,5 мг/кг перорально за 30 мин перед L-DOPA) повышали двигательную активность по сравнению с введением плацебо (фиг. 1, 2, 3 и 4) непосредственно после введения. Пиковая активность (средняя 1627, интервал 832-2289 число движений за 30 мин) была достигнута между 60 и 180 мин после введения L-DOPA. Средняя продолжительность активности(время включения) составило 180 мин/420 мин (фиг. 4). Общая двигательная активность и двигательное время включения составляло более, чем у животных, подвергнутых действию плацебо (р 0,05, Mann-6 014576 Бифепрунокс (4 мг/кг перорально) повышал двигательную активность по сравнению с введением плацебо (фиг. 1 и 3) непосредственно после введения. Пиковая активность (средняя 685, интервал 5121967 число движений за 30 мин) была достигнута между 60 и 180 мин после введения. Средняя продолжительность активности (время включения) составила 240 мин/420 мин (фиг. 4). Общая двигательная активность и двигательное время включения составляло более, чем у животных, подвергнутых действию плацебо (р 0,05, Mann Whitney). Бифепрунокс (8 мг/кг перорально) повышал двигательную активность по сравнению с введением плацебо (фиг. 2 и 3) непосредственно после введения. Пиковая активность (средняя 1110, интервал 6692058 число движений за 30 мин) была достигнута между 60 и 300 мин после введения. Средняя продолжительность активности (время включения) составило 345 мин/420 мин. (фиг. 4). Общая двигательная активность и двигательное время включения составляло более, чем у животных, подвергнутых действию плацебо (р 0,05, Mann Whitney). Предварительное введение бифепрунокса (4 мг/кг перорально), за 90 мин до L-DOPA (7,5 мг/кг перорально) плюс карбидопа (12,5 мг/кг перорально за 30 мин. до L-DOPA) повышает двигательную активность по сравнению с базовой (фиг. 2 и 3) непосредственно после введения. Пиковая активность(средняя 1581, интервал 556-2232 число движений за 30 мин) была достигнута между 60 и 390 мин после введения. Средняя продолжительность активности (время включения, 390 мин/420 мин (фиг. 4) была незначительно выше, чем после введения одной L-DOPA и бифепрунокса. Общая двигательная активность имела тенденцию повышаться по сравнению с одной L-DOPA и одним бифепруноксом (4 мг/кг перорально) (фиг. 1, 2, 3 и 4). Предварительное введение бифепрунокса (8 мг/кг перорально) за 90 мин до L-DOPA (7,5 мг/кг перорально) плюс карбидопа (12,5 мг/кг, перорально за 30 мин до L-DOPA) повышает двигательную активность по сравнению с базовой (фиг. 2 и 3) непосредственно после введения. Пиковая активность(средняя 1211, интервал 409-1342 число движений за 30 мин) была достигнута между 60 и 360 мин после введения. Средняя продолжительность активности (время включения, 300 мин/420 мин (фиг. 4) была незначительно короче, чем после введения только бифепрунокса. Общая двигательная активность и продолжительность активности (время включения) не отличались по сравнению с введением одного бифепрунокса (8 мг/кг перорально) и L-DOPA (7,5 мг/кг перорально) и карбидопа (12,5 мг/кг, перорально за 30 мин до L-DOPA) (фиг. 2- 4). Нарушение двигательных функций:L-DOPA (7,5 мг/кг перорально) плюс карбидопа (12,5 мг/кг перорально за 30 мин до L-DOPA) уменьшали выраженность нарушения двигательных функций по сравнению с введением плацебо (фиг. 5,6, 7 и 8) непосредственно после введения (р 0,05, сравнительно с контрольным воздействием плацебо,Mann Whitney). Пиковая активность (средний показатель, 3; 1627, интервал показателей 2-4) была достигнута между 30 и 300 (средняя 75) минутами после введения L-DOPA. Время включения нарушения функций для одной L-DOPA составляло 120 мин/420 мин. Бифепрунокс (4 мг/кг перорально) уменьшал показатели нарушения двигательных функций по сравнению с введением плацебо (фиг. 5 и 7) непосредственно (30-60 мин) после введения (р 0,05, сравнительно с контрольным воздействием плацебо, Mann Whitney). Пиковые показатели (средний показатель, 3; интервал показателей 2-4) были достигнуты между 30 и 240 мин после введения. Средняя продолжительность активности (время включения) составило 210 мин/420 мин (фиг. 8). Бифепрунокс (8 мг/кг перорально) уменьшал показатели нарушения двигательных функций по сравнению с введением плацебо (фиг. 6 и 7) непосредственно после введения (р 0,05, сравнительно с контрольным воздействием плацебо, Mann Whitney). Общее уменьшение нарушения функций было ниже, чем у животных, подвергнутых воздействию плацебо (фиг. 7). Пиковые показатели (средний показатель 3; интервал показателей 2-5) были достигнуты между 30 и 150 мин после введения. Продолжительность активности (время включения) составила 225 мин/420 мин, была больше, чем при воздействии плацебо (фиг. 8). Предварительное введение бифепрунокса (4 мг/кг перорально) за 90 мин до L-DOPA (7,5 мг/кг перорально) плюс карбидопа (12,5 мг/кг, перорально за 30 мин до L-DOPA) снижало нарушение двигательных функций на протяжении периода исследования (фиг. 5 и 7). Пиковые показатели (средний 3; интервал 2-4) были достигнуты между 60 и 240 мин после введения. Продолжительность активности (время включения) составила 360 мин/420 мин. Продолжительность активности имела тенденцию увеличиваться по сравнению с одним бифепруноксом (фиг. 8). Предварительное введение бифепрунокса (8 мг/кг перорально) за 90 мин до L-DOPA (7,5 мг/кг перорально) плюс карбидопа (12,5 мг/кг, перорально за 30 мин до L-DOPA) уменьшало нарушение двигательных функций (фиг. 6 и 7). Пиковые показатели (средний 3; интервал 2-5) были достигнуты между 60 и 120 мин после введения. Продолжительность активности (время включения) составила 165 мин/420 мин. Продолжительность активности (время включения) не отличалась по сравнению с введением одного бифепрунокса (8 мг/кг перорально) и L-DOPA (7,5 мг/кг перорально) и карбидопы (12,5 мг/кг, перорально за 30 мин до L-DOPA) (фиг. 8).L-DOPA (7,5 мг/кг перорально) повышает двигательную активность и уменьшает показатели нарушения двигательных функций у обыкновенных игрунок, подвергнутых воздействию МРТР. Бифепрунокс(4 и 8 мг/кг перорально) также повышает двигательную активность и уменьшает показатели нарушения двигательных функций. При введении в сочетании с L-DOPA бифепрунокс (4 или 8 мг/кг перорально) имеет тенденцию увеличивать общую двигательную активность и двигательное время включения по сравнению только с L-DOPA. Пример 3. Фармацевтические препараты Типы фармацевтических композиций, которые могут быть использованы, включают, но не ограничены перечисленным, таблетки, жевательные таблетки, капсулы (включая микрокапсулы), растворы, парентеральные растворы, мази (кремы и гели), свечи, суспензии и другие типы, раскрытые в данном документе или очевидные специалисту в данной области из документации и общих знаний в области техники. Композиции используют для перорального, внутривенного, подкожного, трахеального, бронхиального, интраназального, пульмонального, чрескожного, буккального, ректального, парентерального или других путей введения. Фармацевтическая композиция содержит по меньшей мере один препарат согласно изобретению в смеси с фармацевтически приемлемым адъювантом, разбавителем и/или носителем. Общее приемлемое количество активных ингредиентов находится в интервале от приблизительно 0,1% (мас./мас.) до приблизительно 95% (мас./мас.) композиции, приемлемо от 0,5 до 50% (мас./мас.) и предпочтительно от 1% до 25% (мас./мас.). Молярное соотношение между бифепруноксом (или его Nоксидом) и L-DOPA может находиться в интервале от приблизительно 1000:1 до 1:1000, приемлемо в интервале от 300:1 до 1:300, и предпочтительно от 50:1 до 1:50. Препараты по изобретению могут быть приведены в формы, приемлемые для введения, способами обычных технологических процессов с использованием вспомогательных веществ, таких как жидкость или твердое вещество, порошкообразные ингредиенты, такие как фармацевтические обычные жидкие или твердые наполнители и сухие разбавители, растворители, эмульгаторы, мягчители, отдушки, красители и/или буферные вещества. Часто используемые вспомогательные вещества включают карбонат магния, диоксид титана, лактозу, сахарозу, сорбит, маннит и другие сахара и сахарные спирты, тальк, лактопротеин, желатин, крахмал, амилопектин, целлюлозу и ее производные, животные и растительные масла,такие как рыбий жир, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, такие как, например, стерильная вода и моно- или многоатомные спирты, такие как глицерин, так же,как и дезинтегрирующие вещества и увлажняющие вещества, такие как стеарат магния, стеарат кальция,стеарилфумарат натрия или полиэтиленгликолевые воски. Смесь может быть затем сформована в гранулы или в таблетки. Активные ингредиенты могут быть раздельно предварительно смешены с другими неактивными ингредиентами до того, как будут смешены для образования композиции. Активные ингредиенты могут быть также смешены друг с другом до того, как будут смешены с неактивными ингредиентами для образования композиции. Мягкие желатиновые капсулы могут быть получены как капсулы, содержащие активные ингредиенты изобретения, растительное масло, жир или другие подходящие носители для мягких желатиновых капсул. Твердые желатиновые капсулы могут содержать гранулы активных ингредиентов. Твердые желатиновые капсулы могут также содержать активные ингредиенты совместно с твердыми порошкообразными ингредиентами, такими как лактоза, сахароза, сорбит, маннит, картофельный крахмал, кукурузный крахмал, амилопектин, производные целлюлозы или желатин. Единицы дозировки для ректального применения могут быть получены (i) в форме свечей, которые содержат активное вещество, смешанное с нейтральной жировой основой; (ii) в форме желатиновых ректальных капсул, которые содержат активное вещество в смеси с растительным маслом, парафиновым маслом или другими приемлемыми носителями для желатиновых ректальных капсул; (iii) в форме готовой микроклизмы или (iv) в форме композиции сухой микроклизмы, которую растворяют в подходящем растворителе непосредственно перед введением. Жидкие препараты могут быть получены в форме сиропов, эликсиров, концентрированных капель или суспензий, например, растворов или суспензий, содержащих активные ингредиенты и остаток, состоящий, например из сахаров или сахарных спиртов и смеси этанола, воды, глицерина, пропиленгликоля и полиэтиленгликоля. При необходимости, такие жидкие препараты могут содержать красящие вещества, ароматизаторы, консерванты, сахарин и карбоксиметилцеллюлозу или другие загустители. Жидкие препараты могут быть также получены в форме сухого порошка, восстанавливаемого приемлемым растворителем перед использованием. Растворы для парентерального введения могут быть получены в виде раствора композиции по изобретению в фармацевтически приемлемом растворителе. Указанные растворы могут также содержать стабилизирующие ингредиенты, консерванты и/или буферирующие ингредиенты. Растворы для парентерального введения могут быть также получены в виде сухого препарата, восстанавливаемого приемлемым растворителем перед использованием. Также предоставлены в соответствии с настоящим изобретением для использования в терапевтиче-8 014576 ском лечении композиции и наборы частей, содержащие один или более контейнеров, наполненных одним или более ингредиентами фармацевтической композиции по изобретению. С таким контейнером(контейнерами) могут быть связаны различные печатные материалы, такие как инструкции по применению или указания в форме предписанных государственным агентством, регулирующим производство,использование или хранение фармацевтических продуктов, которые отражают разрешение агентством производства, использования или продажи для введения человеку или животным. Использование композиций настоящего изобретения в производстве лекарственных средств для применения в лечении состояний, при которых желательно или необходимо восстановление дофаминергической функции, и способов лекарственного лечения или включающих введение терапевтически эффективного общего количества по меньшей мере одного препарата по изобретению пациенту, страдающему от состояния, при котором желательно или необходимо восстановление дофаминергической функции, или подверженного такому состоянию. Описание чертежей Фиг. 1 - влияние бифепрунокса (4 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на двигательную активность обыкновенных игрунок, подвергнутых воздействию МРТР; фиг. 2 - влияние бифепрунокса (8 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на двигательную активность обыкновенных игрунок, подвергнутых воздействию МРТР; фиг. 3 - влияние бифепрунокса (4 активность) в течение 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТР. р, 0,05 по сравнению с плацебо-плацебо (Mann Whitney); фиг. 4 - влияние бифепрунокса (4 или 8 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на двигательное время включения в течение 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТР. р 0,05 по сравнению с плацебо-плацебо (Mann Whitney); фиг. 5 - влияние бифепрунокса (4 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на показатель нарушения двигательных функций у обыкновенных игрунок, подвергнутых воздействию МРТР; фиг. 6 - влияние бифепрунокса (8 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на показатель нарушения двигательных функций у обыкновенных игрунок, подвергнутых воздействию МРТР; фиг. 7 - влияние бифепрунокса (4 или 8 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на общие показатели нарушения двигательных функций в течение 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТР. р 0,05 по сравнению с плацебо-плацебо (Mann Whitney); фиг. 8 - влияние бифепрунокса (4 или 8 мг/кг перорально), одного или в сочетании с L-DOPA (7,5 мг/кг перорально), на общее нарушение двигательных функций время включения в течение 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТР. р 0,05 по сравнению с плацебо-плацебо (Mann(i) бифепрунокс или его N-оксид или фармацевтически приемлемые соли указанных соединений и(ii) L-DOPA или ее фармацевтически приемлемые соли, для одновременного, раздельного или по- 10014576 следовательного использования в лечении расстройств, требующих восстановления функции дофаминергической системы. 2. Препарат по п.1, дополнительно содержащий ингибитор декарбоксилазы. 3. Препарат по п.1 или 2, дополнительно содержащий ингибитор СОМТ. 4. Препарат по любому из пп.1, 2 или 3, дополнительно содержащий ингибитор МАО-В. 5. Применение препарата по любому из пп.1-4 для производства лекарственного средства для лечения расстройств, требующих восстановления функции дофаминергической системы. 6. Применение по п.5, в котором указанное расстройство представляет собой болезнь Паркинсона. 7. Применение по п.5, в котором указанное расстройство представляет собой синдром беспокойных ног. 8. Фармацевтическая композиция, содержащая в дополнение к фармацевтически приемлемому носителю и/или по меньшей мере одному фармацевтически приемлемому вспомогательному веществу фармакологически активное количество препарата по любому из пп.1-4 в качестве активных ингредиентов. 9. Способ лечения болезни Паркинсона или синдрома беспокойных ног у человека или животного,который нуждается в таком лечении, включающий введение пациенту одновременно, раздельно или последовательно, определенного количества бифепрунокса, или его N-оксида, или их фармацевтически приемлемой соли и определенного количества L-DOPA, в котором количества эффективны для лечения. 10. Способ по п.9, в котором дополнительно вводится определенное количество ингибитора декарбоксилазы, и/или ингибитора СОМТ, и/или ингибитора МАО-В. 11. Применение бифепрунокса или его N-оксида для производства лекарственного средства для лечения синдрома беспокойных ног. 12. Препарат для лечения синдрома беспокойных ног, представляющий собой бифепрунокс или его Фиг. 3 Эффект DU127090 (4 активность за 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТРр 0,05 по сравнению с плацебо-плацебо (Mann Whitney) Фиг. 4 Эффект DU127090 (4 или 8 мг/кг перорально) одного или в сочетании с L-DOPA (7,5 мг/кг перорально) на двигательное "время включения" за 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТРр 0,05 по сравнению с плацебо-плацебо (Mann Whitney) Фиг. 5 Эффект DU127090 (4 мг/кг перорально) одного или в сочетании с L-DOPA (7,5 мг/кг перорально) на показатель нарушения двигательных функций у обыкновенных игрунок, подвергнутых воздействию МРТР Фиг. 6 Эффект DU127090 (8 мг/кг перорально) одного или в сочетании с L-DOPA (7,5 мг/кг перорально) на показатель нарушения двигательных функций у обыкновенных игрунок, подвергнутых воздействию МРТР Фиг. 7 Эффект DU127090 (4 или 8 мг/кг перорально) одного или в сочетании с L-DOPA (7,5 мг/кг перорально) на общие показатели нарушения двигательных функций у обыкновенных игрунок,подвергнутых воздействию МРТРр 0,05 по сравнению с плацебо-плацебо (Mann Whitney) Фиг. 8 Эффект DU127090 (4 или 8 мг/кг перорально) одного или в сочетании с L-DOPA (7,5 мг/кг перорально) на "время включения" нарушения двигательных функций за 7 ч у обыкновенных игрунок, подвергнутых воздействию МРТРр 0,05 по сравнению с плацебо-плацебо (Mann Whitney)
МПК / Метки
МПК: A61K 45/06, A61P 25/16, A61P 25/14, A61K 31/496, A61K 31/195
Метки: l-допу, препараты, содержащие, комбинированные, бифепрунокс
Код ссылки
<a href="https://eas.patents.su/14-14576-kombinirovannye-preparaty-soderzhashhie-bifeprunoks-i-l-dopu.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированные препараты, содержащие бифепрунокс и l-допу</a>
Предыдущий патент: Система безопасности для транспортных средств
Следующий патент: Шланг, усиленный по оси
Случайный патент: Фармацевтическая композиция, включающая солифенацин или его фармацевтически приемлемую соль