Фармацевтические композиции пептидов, имеющих низкую растворимость в физиологической среде
Формула / Реферат
1. Фармацевтическая композиция, включающая:
а) пептидный агонист ЛГРФ, пептидный антагонист ЛГРФ или пептид ГРФ в качестве активного ингредиента;
б) никотинамид и
с) физиологический водный раствор.
2. Фармацевтическая композиция по п.1, в которой активный ингредиент представляет пептидный антагонист ЛГРФ.
3. Фармацевтическая композиция по любому из предшествующих пунктов, в которой активный ингредиент представляет антид или человеческий ГРФ.
4. Фармацевтическая композиция по любому из предшествующих пунктов, которая лиофилизирована и воссоздана и дополнительно включает одно или более стабилизирующее вещество.
5. Фармацевтическая композиция по любому из предшествующих пунктов, которая дополнительно включает пропиленгликоль.
6. Фармацевтическая композиция по любому из предшествующих пунктов, которая пригодна для парентерального, перорального, назального или ингаляционного пути введения.
7. Фармацевтическая композиция по любому из предшествующих пунктов, дополнительно включающая один или более фармацевтически приемлемый наполнитель.
8. Фармацевтическая композиция по любому из предшествующих пунктов, которая пригодна для инъекций.
9. Фармацевтическая композиция по п.3, которая имеет следующие пределы изменения состава:
| Антид или чГРФ | 0,1-20,0 мг |
| Никотинамид | 10-300 мг |
| Пропиленгликоль | 0-800 мг |
| Водная фаза | Достаточное количество до 1,0 мл |
Текст
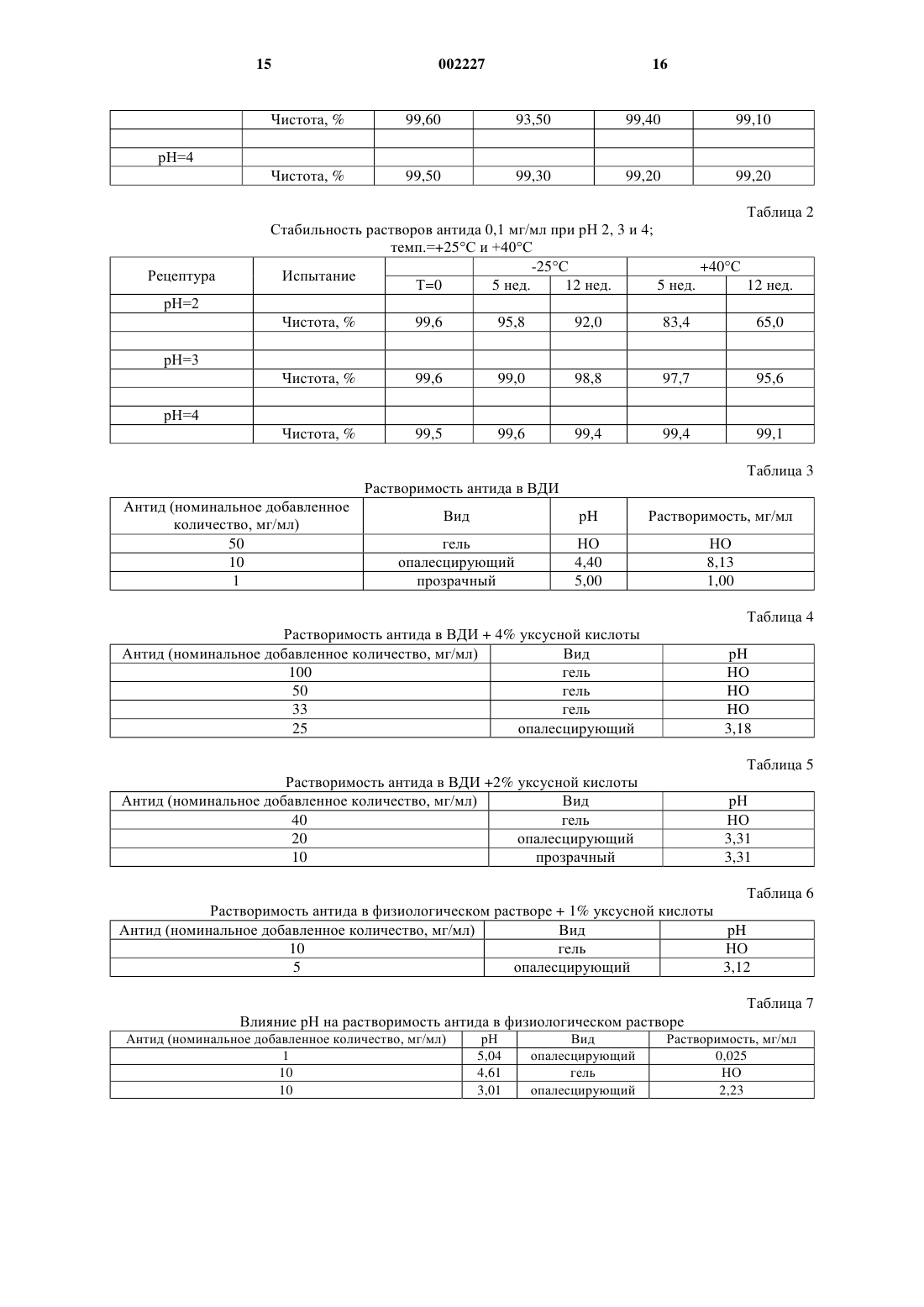
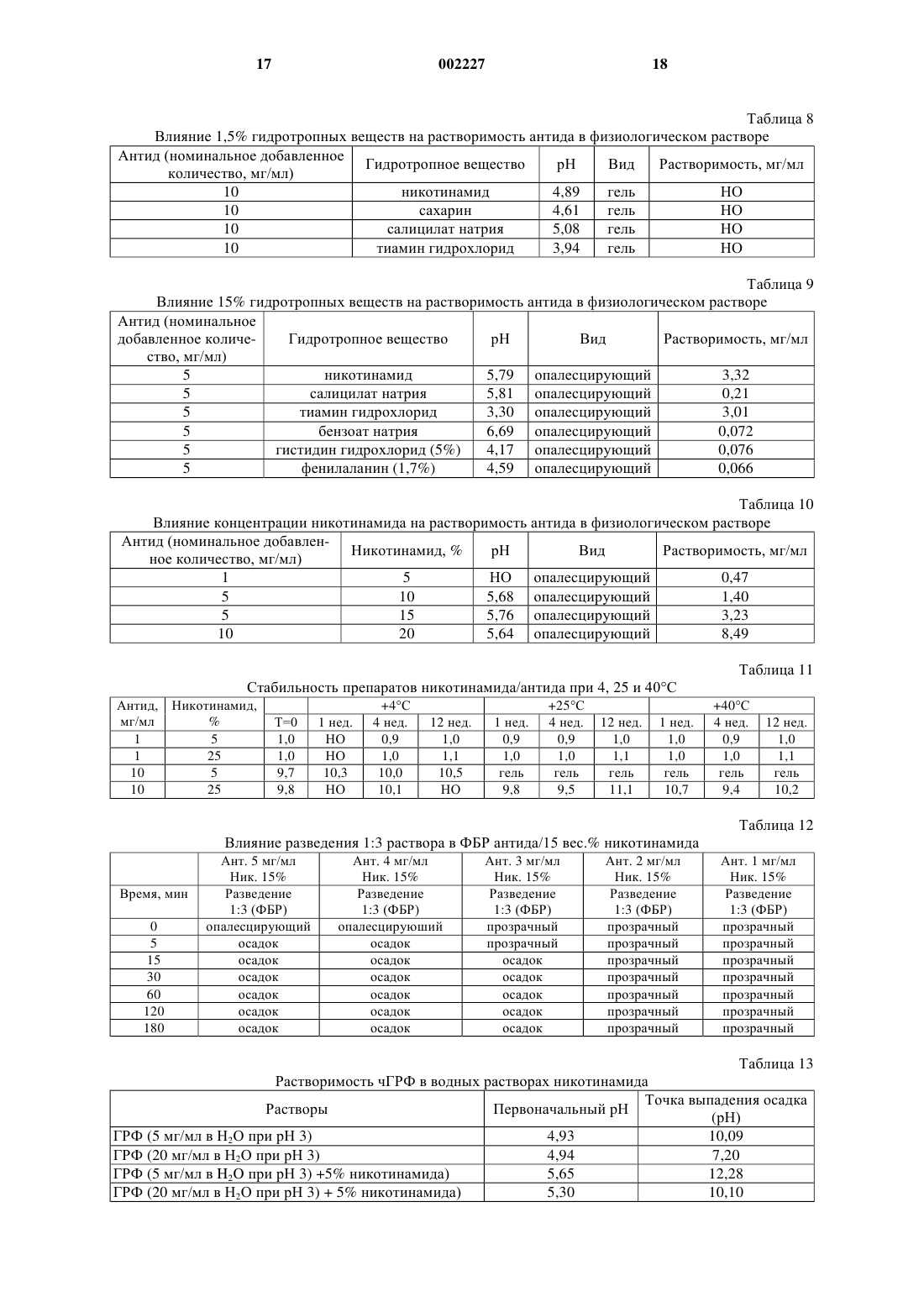
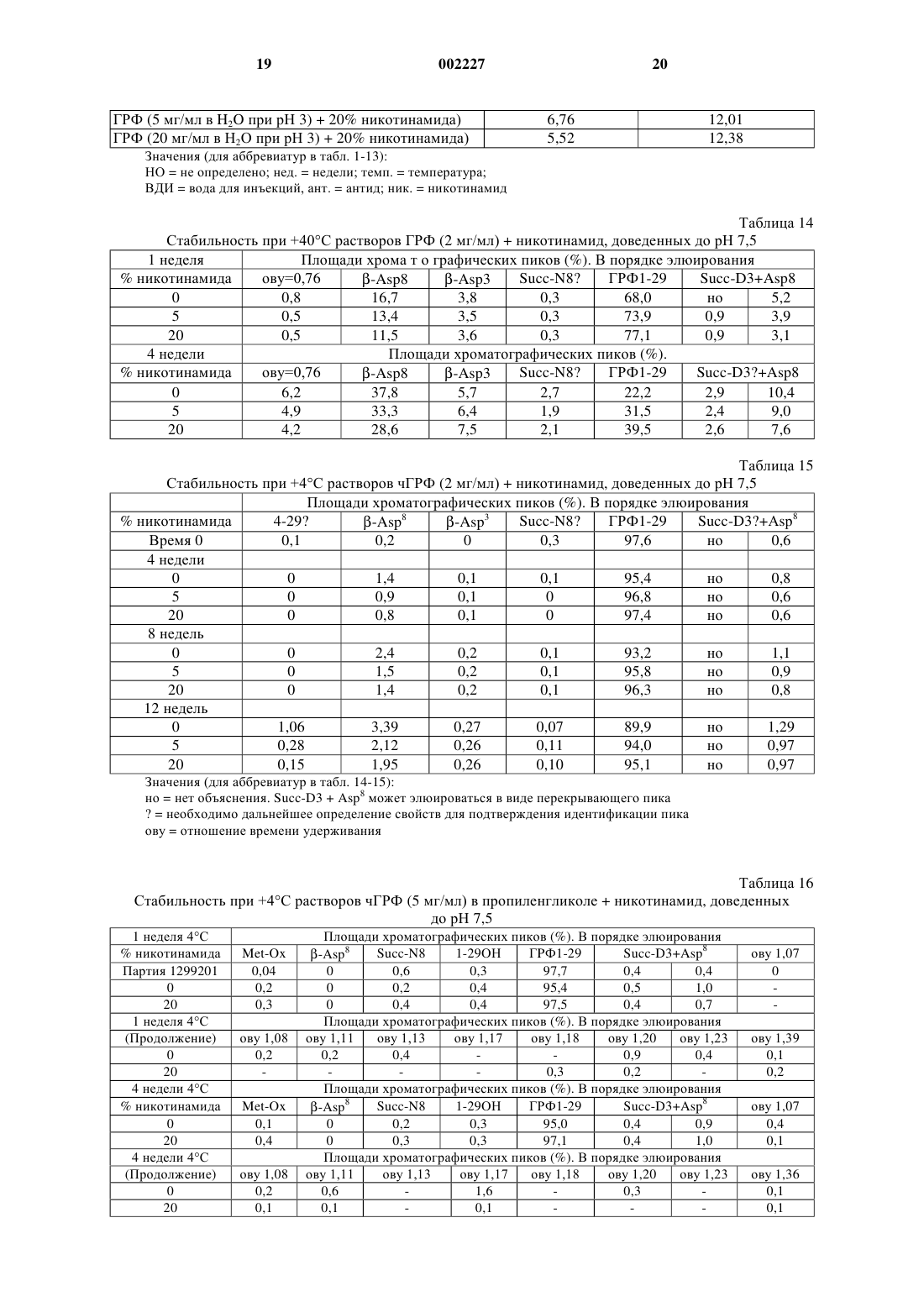
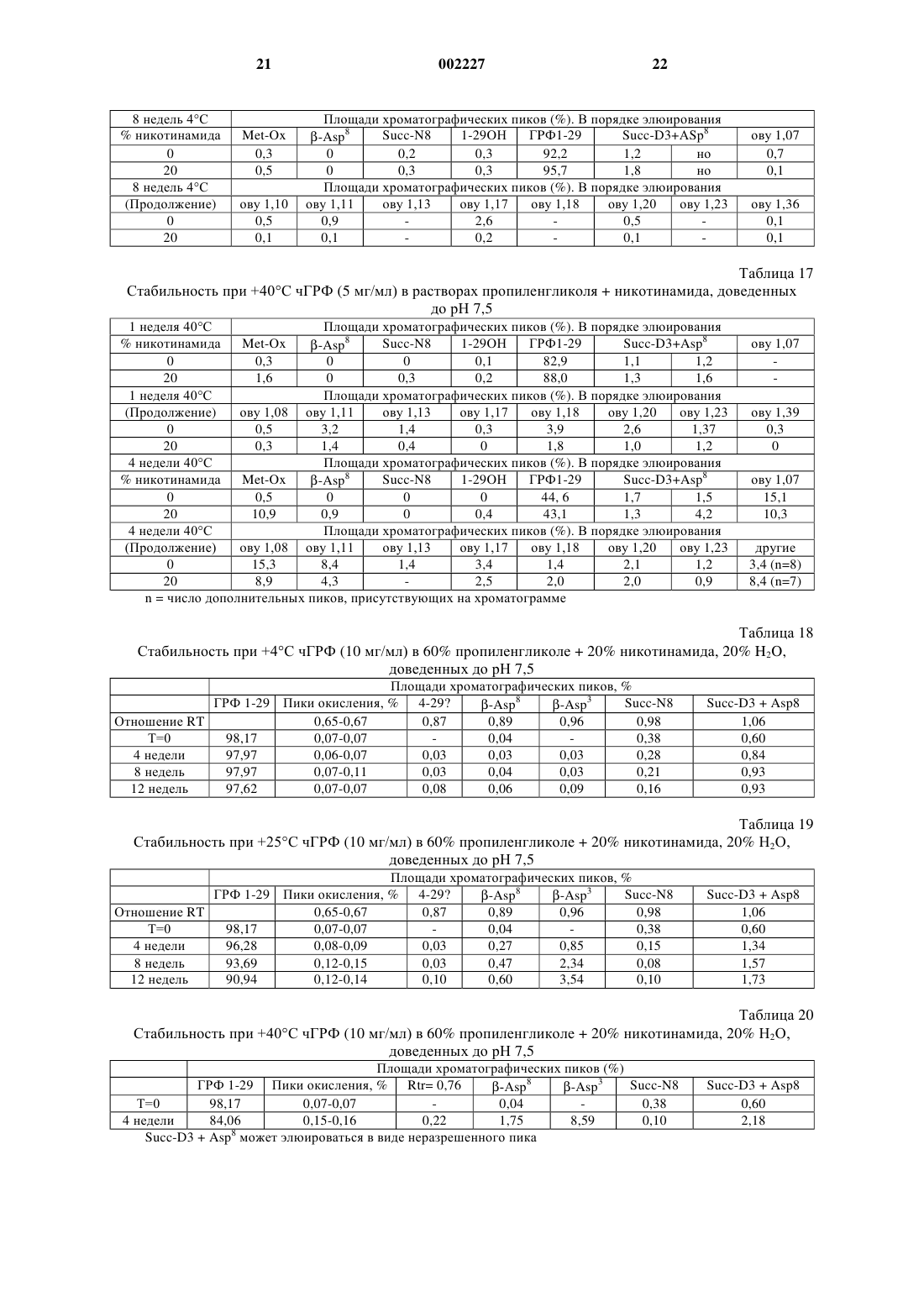
1 Область изобретения Данное изобретение относится к фармацевтической композиции, включающей: а) пептид, плохо растворимый в водном физиологическом солевом растворе, в качестве активного ингредиента; б) неионное ароматическое гидротропное фармацевтически приемлемое вещество и в) физиологический водный раствор. В соответствии с предпочтительным осуществлением данного изобретения пептид (а) является аналогом ЛГРФ или ГРФ пептидом. Предпосылки создания изобретения Часто бывает необходимо улучшить растворимость лекарственного вещества в физиологической среде, чтобы достичь клинической эффективности инъекционных форм лекарственных препаратов. Пептидные лекарственные вещества часто плохо растворимы в физиологической среде из-за наличия гидрофобных заместителей. Проблемы растворимости могут также приводить к плохому всасыванию при других путях введения, и в некоторых случаях соответствующие солюбилизирующие вещества могут помочь всасыванию лекарственных веществ при других путях введения, например, при пероральном или назальном. Примерами пептидных лекарственных веществ, которые так плохо растворимы в физиологической среде, являются пептиды-аналоги ЛГРФ и рилизинг фактор гормона роста ГРФ. Рилизинг гормон лютеинизирующего гормона (ЛГРФ или ГнРФ) представляет собой декапептид, секретируемый гипоталамусом и способный вызывать выделение как ЛГ (лютеинизирующего гормона), так и ФСГ (фолликулостимулирующего гормона). Он имеет следующую формулу: pyroGlu-His-Trp-Ser-Tyr-GlyLeu-Arg-Pro-Gly-NH2. ЛГРФ может или стимулировать секрецию гонадотропина или быть сильным ингибитором. При введении путем точной пульсации ЛГРФ может поддерживать нормальную циклическую секрецию гонадотропина. Пульсирующее введение ЛГРФ с использованием компьютеризированного насоса было использовано с хорошими результатами для индукции овуляции у женщин с отсутствием овуляции, связанным с дисфункцией гипоталамуса. При постоянном введении ЛГРФ или его агонисты, как было доказано, являются сильными ингибиторами секреции гонадотропина, дающими временную(полностью обратимую) гонадотропиновую специфическую лекарственную гипофизэктомию. К настоящему времени синтезированы тысячи аналогов ЛГРФ, которые могут действовать или как агонисты, или как антагонисты. Чтобы получить антагонисты ЛГРФ, которые действуют путем связывания рецепторов, необходимо заменить несколько аминокислот в мо 002227 2 лекуле ЛГРФ. Для антагонистов также необходимы точные топологические характеристики для достижения высокого сродства связывания с рецепторами. Существует много недавно синтезированных аналогов ЛГРФ, в которых аминокислоты содержат ароматические или другие функциональные группы, способные к так называемому гидротропному взаимодействию. Использование антагонистов ЛГРФ с немедленным подавлением ими выделения гонадотропина может быть полезно в таких областях терапии, как контрацепция и при лечении гормонозависимых расстройств. В случае гормонозависимых опухолей специфическим преимуществом может являться исключение первоначальной стимуляторной фазы, создаваемой агонистами ЛГРФ. В отношении обзора по аналогам ЛГРФ см. Karten and Rivier, 1986. Антид, в частности, является сильным антагонистом ЛГРФ, формула, биологическая активность и получение которого описаны в патенте ЕР 377665. В результате исследований, проведенных заявителем, было установлено, что антид обладает очень плохой растворимостью в 0,9% растворе NaCl (растворимость 25 мкг/мл) или другой изотонической среде, такой как фосфатнобуферный солевой раствор (растворимость была равна 16 мкг/мл). Предыдущие водные лекарственные формы антида, как было показано, имеют плохую биодоступность и плохую воспроизводимость фармакокинетических показателей. Это связано с тем, например, что антид присутствует в месте инъекции в концентрациях выше 25 мкг/мл, что приводит к образованию осадка при контакте с физиологической средой. Этот осадок может быть желеобразным по природе и обладает неблагоприятным воздействием на всасываемость лекарственного вещества, что показано проведенными заявителем клиническими исследованиями. Другие антагонисты рилизинг-гормона гонадотропина в водных растворах могут образовывать гелеобразные структуры и, кроме того,как известно, растворимость повышается, когда рН раствора снижается, благодаря усилению ионизации молекулы (Cannon J.B., et al., 1995). ГРФ (также называемый соматорелином) является пептидом, секретируемым гипоталамусом, который вызывает выделение гормона роста из передней доли гипофиза. Он существует в природе в виде пептидов из 44, 40 и 37 аминокислот; форма из 44 аминокислот, возможно,может превращаться в формы меньшего размера, но, как сообщено, все они активны, причем активность определяется первыми 29 аминокислотными остатками. Пептид, соответствующий аминокислотной последовательности 1-29 человеческого ГРФ [hGRF(1-29)], [чГРФ(1-29)], также называемый серморелином, был получен путем технологии рекомбинантных ДНК, как описано в европейском патенте ЕР 105759. 3 Серморелин использовали в виде ацетата для диагностики и лечения дефицита гормона роста. ГРФ имеет терапевтическое значение для лечения некоторых связанных с гормоном роста расстройств. Использование ГРФ для стимуляции выделения ГР является физиологичным способом индуцирования роста длинных костей или анаболизма белков. Хорошо известно, что природная форма ГРФ может страдать от химической деградации в водном растворе, главным образом Asn в положении 8, что приводит к снижению биологической активности (Friedman et al., 1991; Bongers et al., 1992). Основные гидролитические реакции, происходящие с ГРФ, чувствительны к рН, и как сообщается, представляют собой изменениеAsn8 при рН выше 7 (Felix A.M., 1991). Из-за сочетанных путей деградации нестабилизированные водные растворы ГРФ наиболее стабильны в интервале рН 4-5. Воngers et al. (Bongers et al., 1992) показали, что реакция дезамидирования у Asn8 быстро усиливается, когда рН повышается выше рН 3. Разные исследователи получили аналоги ГРФ путем замены аминокислот в последовательности природного ГРФ для улучшения химической стабильности (Serono Symposia USA,1996; Friedman, 1991). В то время как модификация может быть эффективным средством для улучшения стабильности и сохранения биоактивности, она может нежелательной из-за изменения иммуногенности, которая могла бы стать проблемой при хронической терапии, такой как при дефиците гормона роста. Из литературы известно, что в некоторых случаях добавление ароматических веществ к растворам белков может вызывать отрицательное воздействие на растворимость, приводящее к выпадению осадка. Например, когда ароматические вещества приводили в контакт с рекомбинантным человеческим гормоном роста(рчГР), происходили конформационные изменения или денатурация, приводящие к образованию агрегатов рчГР (Маа Y.F. and Hsu С.С.,1996). Кроме того, чтобы продемонстрировать,что это не является общим феноменом, было показано, что производные ароматических аминокислот давали улучшенную растворимость и повышенную абсорбцию гормона роста (LeoneBay A. et al., 1996). Никотинамид, как сообщалось, солюбилизирует обычные фармацевтические соединения(т.е. непептиды с молекулярным весом менее 1000 Да) путем комплексообразования с переносом заряда, называемым также гидротропной солюбилизацией. Этот процесс может происходить в результате взаимодействия ароматических групп солюбилизирующего вещества и 4 ароматических или других соответствующих групп в молекуле лекарственного вещества. Например, см. Rasool et al., 1991. Однако было обнаружено, и соответствующие данные представлены в экспериментальной части, что другие молекулы, содержащие ароматические группы, такие как бензоатные или салицилатные, которые могли бы взаимодействовать путем гидротропного механизма(Jain N.K. and Patel V.V. 1986), дают только небольшое улучшение растворимости аналога ЛГРФ (антид) в физиологическом растворе. В европейской патентной заявке 0649655 описана солюбилизация водорастворимого противоязвенного лекарственного препарата с использованием никотинамида для получения применимой инъекционной формы. Заявлено много потенциальных производных активной составляющей, однако, не представлены данные по экспериментам in vivo, демонстрирующим улучшенную эффективность. В заявке РСТ WO 96/10417 описано совместное введение человеческого инсулина AspB28 и никотинамида для достижения быстрого начала проявления гипогликемического эффекта. Заявленный интервал концентраций никотинамида составлял 0,01-1 М (0,01-12 вес.%), но предпочтительно от 0,05-0,5 М. Документ дает доказательства более быстрого всасывания во время исследования in vivo у свиней, однако, механизм, путем которого осуществляется улучшенная абсорбция, не установлен, и поэтому из этого документа нельзя извлечь никаких обобщающих указаний. Описание изобретения Было обнаружено, что когда к водному раствору пептидного лекарственного препарата,который обычно плохо растворим в водном физиологическом солевом растворе, добавляют неионное ароматическое гидротропное вещество, его растворимость повышается, и к тому же полученные фармацевтические композиции проявляют превосходную стабильность. В частности, было обнаружено, что когда к раствору антида в физиологическом растворе(0,9% NaCl) добавляют никотинамид, последний может способствовать растворимости этого лекарственного препарата. Конечная концентрация солюбилизированного антида зависит от концентрации добавленного никотинамида и с повышением концентрации никотинамида увеличивается экспоненциально, как показано ниже. Как известно, растворимость антагонистов рилизинг гормона гонадотропина повышается по мере того, как снижается рН раствора, однако, представленные здесь в экспериментальной части данные для антида показывают, что повышенная растворимость не связана с эффектом рН. К тому же было обнаружено, что никотинамид может также повышать растворимость антида в чисто водной среде. 5 Поэтому основным объектом данного изобретения является получение фармацевтической композиции, включающей: а) пептид, плохо растворимый в водном физиологическом солевом растворе, в качестве активного ингредиента; б) неионное ароматическое гидротропное фармацевтически приемлемое вещество; и в) физиологический водный раствор. Активным пептидным ингредиентом может быть пептид - аналог ЛГРФ или рилизинг фактор гормона роста ГРФ. Предпочтительно,аналог ЛГРФ является антагонистом. Более предпочтительно то, что он является антидом,чГРФ или его ПЭГ-конъюгантами. По этому изобретению выражение "чГРФ" используется для охвата всех человеческих пептидов ГРФ, с указанием, в частности, пептидов 1-44, 1-40, 1-29 и их соответствующих амидов(содержащих -NH2 на своем конце). Все они имеются в продаже. Предпочтительным чГРФ является чГРФ(1-29)-NH2. Пептид ГРФ, использованный в примерах, является коммерческим продуктом, которому дано описание в разделе"Материалы". Также было открыто то, что добавление никотинамида к водным растворам чГРФ может снизить скорость дезамидирования Asn8 и дополнительных продуктов деградации, не все из которых были идентифицированы к настоящему времени. Известно, что Asn8 может разрушаться в водном растворе с образованием следующих продуктов деградации: -Asp8, -Asp8 и сукцинимидил-Asn8. Также было установлено, что ГРФ может растворяться в неводных растворителях и благодаря последующему снижению активности воды в растворе предотвращается дезамидирование Asn8. Когда ГРФ растворяли в пропиленгликоле (ПГ), было обнаружено, что существуют альтернативные (не полностью охарактеризованные) пути деградации. Также было обнаружено, что путем включения никотинамида в неводный раствор, такой как ПГ, скорость образования некоторых из этих дополнительных продуктов деградации снижается. Не ограничивающий перечень соответствующих фармацевтически приемлемых неионных ароматических гидротропных веществ включает никотинамид, никотиновую кислоту,бензойную кислоту, салициловую кислоту, гентизиновую кислоту, аскорбиновую кислоту,гистидин, триптофан, фенилаланин, тирозин,крезол, фенол, ксантины, пиридоксин, фолиевую кислоту, сахарин. Неионные производные любых из вышеприведенных соединений также применимы в целях этого изобретения. Предпочтительным является никотинамид. Никотинамид является обычно используемым источником витамина В в фармацевтических продуктах и вводится главным образом пероральным путем, но также и путем инъек 002227 6 ций. Были рекомендованы дозы до 500 мг в сутки (разделенные на приемы), например, см.Martindale. Физиологический водный раствор может быть изотоническим солевым раствором или фосфатно-буферным солевым раствором, или любым соответствующим раствором, содержащим неорганические соли, с той же самой изотоничностью, что и физиологическая среда. Композиции данного изобретения могут быть пригодными для любого пути введения,такого как пероральное, парентеральное, назальное или ингаляционное введение. Они могут быть в жидкой форме, а также в твердой форме в виде однородной смеси (например, после распылительной сушки, лиофилизации и т.д.). Они могут быть, например (но не ограничиваясь этим), в твердой дозированной форме,такой как желатиновые капсулы для перорального приема, или изготовлены в форме для назальных или легочных ингаляций. Могут использоваться и другие фармацевтически приемлемые дозированные формы, такие как суспензии, эмульсии, микроэмульсии, микронизированные порошки, растворы, суппозитории, пессарии, микросферы, наносферы, имплантанты и т.д., причем абсорбция или стабильность пептидного лекарственного препарата улучшается путем комбинации с неионным гидротропным веществом. Пероральные микроэмульсии являются предпочтительными формами для введения. Поэтому композиции данного изобретения могут быть также лиофилизированы и снова растворены, и они могут дополнительно включать одно или более стабилизирующих веществ,а также одно или более фармацевтически приемлемых наполнителей. Примерами интервалов содержания веществ в композиции для инъекций являются следующие: Антид или чГРФ 0,1-20,0 мг Никотинамид 10-300 мг Пропиленгликоль 0-800 мг Водная фаза, достаточное количество до 1,0 мл Термин "пептид", как он используется в этой заявке, означает любое соединение, образованное из двух или более аминокислот. В нем аминогруппа (NH2) одной аминокислоты соединяется с карбоксильной группой (СООН) другой, образуя пептидную связь. Такие аминокислоты могут быть встречающимися в природе,химически синтезированными или модифицированными. Пептиды по этому изобретению имеют, обычно, до 100 аминокислот, предпочтительно до 50, более предпочтительно до 20. Выражение "плохо растворимый в водном физиологическом солевом растворе", которое использовано в данной заявке, означает, что в таком растворе при комнатной температуре без добавления кислот или оснований пептид проявляет растворимость 1 мг/мл и/или что рас 7 творимость в водном физиологическом солевом растворе на один порядок значения ниже, чем растворимость в одной воде при тех же самых условиях. Данное изобретение будет теперь описано с помощью следующих примеров, которые не должны истолковываться как ограничивающие каким-либо образом данное изобретение. В примерах будут ссылки на чертеж, описанный здесь ниже. Краткое описание чертежа Чертеж: представлена растворимость антида в 0,9% растворе NaCl в зависимости от концентрации никотинамида. График в полулогарифмическом масштабе показывает, что растворимость антида находится в логарифмической зависимости от концентрации присутствующего никотинамида. Важна линейная природа этого графика, так как она позволяет точно учесть эффекты разбавления и также показывает, что была достигнута равновесная растворимость лекарственного вещества в этих растворах. Примеры Материалы Антид в сыпучем виде (Bachem), серии 8901 и 9001 чГРФ(1-19)-NН 2 (Bachem), серии 1299201 и 1299202. Фосфатно-буферный физиологический солевой раствор Дулбекко (Sigma, D-8537). Гистидин гидрохлорид (Merck, 1.04351) марки "биохимический" (Biochemistry). Никотинамид (Fluka, 72345), марки, соответствующей требованиям USP. Фенилаланин (Merck, 7256) - марки "биохимический". Натрий бензоат (Merck, 6290) - маркиPh.Eur/NF. Натрий салицилат (Sigma, S-3007) - реагент для общих целей, 35 Н 1207. Тиамин гидрохлорид (Merck, 8181) - марки(Nuova Ompi). Все другие использованные реагенты были марки "аналитический", если не указано иначе. Оборудование Использовалось следующее оборудование. Система для ВЭЖХ Merck Hitachi (насосL-6200, детектор L-4250, автоматическое устройство для подачи образца AS-2000A, ПКCompaq, программное обеспечение HPLCManager 2000). Система для ВЭЖХ Waters (насос 626,контроллер 600S, детектор 994, автоматическое устройство для подачи образца 717, ПК NEC,программное обеспечение Maxima Baseline). Аппарат для лиофильной сушки (Edwards,Lyoflex мод. 06 и мод. 04). 8 Метод анализа на антид ОФ-ВЭЖХ с градиентным элюированием. Колонка С-18 (например, Vydac 218 ТР 54, 2504,6 мм). Определение в УФ при 215 нм, объем впрыскивания 15 мкл, подвижная фаза А: фосфатный буфер рН 4,5 (0,1 М), подвижная фаза В: ацетонитрил, скорость потока = 1,0 мл/мин,время потока = 23 мин. Во время анализа впрыскивался извне стандартный раствор в концентрации 100 мкг/мл. Градиент составлял: 77% А,23% В до 52% А, 48% В в течение 30 мин. Метод анализа на чГРФ Был разработан метод ОФ-ВЭЖХ для анализа на ГРФ(1-19)-NH2, с помощью которого возможна дифференциация следующих продуктов деградации: Окисленных: в Met27. Свободной кислоты: ГРФ(1-29)ОН. Дезамидо: -Asp8, -Asp8 и сукцинимидил 8Asn . Ацетилированных: ацетил Туr1. Изомеризованных: -Asp8 и сукцинимидил-Asn8. Усеченных: чГРФ(4-29)-NH2, ГРФ(9-29)NH2. Этот метод использовали для определения химической чистоты ряда растворов чГРФ при хранении при 4 С и при 40 С, что показано в следующих таблицах. Условия были подобными условиям, применяемым для антида, с использованием мобильной фазы, составленной из ACN/H2O, и с ТФУ вместо фосфатного буфера. Градиент работал в течение срока, равного 60 мин, с общим временем протока, равным 80 мин. Стабильность антида в водных растворах Производили предварительное испытание стабильности растворов антида 0,1 мг/мл при-20, 4, 25 и 40 С, чтобы оценить их стабильность при рН 2, 3 и 4. Растворы с концентрацией 0,1 мг/мл получали, растворяя антид в воде и доводя рН, используя 0,01 М соляную кислоту. Стабильность чГРФ в водных растворах Производили испытание стабильности водных растворов чГРФ 2,0, 5,0 и 10,0 мг/мл,содержащих никотинамид, при 4 и 40 С, чтобы оценить их стабильность при рН 7,5. Также оценивали эффект добавления пропиленгликоля. Исследования по солюбилизации антида Исследования по солюбилизации производили, чтобы изучить эффект:- рН (растворы подкисляли или уксусной кислотой, или соляной кислотой),- гидротропных веществ (никотинамида,натрийсахарина, салицилата натрия, бензоата натрия, гистидина гидрохлорида, тиамина гидрохлорида, фенилаланина). Физиологический солевой раствор, использованный в этих исследованиях, соответствует 0,9% раствору хлорида натрия. 9 На основе результатов предыдущих исследований к испытуемому раствору добавляли избыток антида и визуально наблюдали, чтобы оценить растворимость после уравновешивания в течение ночи при 25 С. После визуального анализа отбирали ряд растворов для дальнейшего количественного определения растворимости путем фильтрования (0,45 мкм фильтры) и соответствующего разбавления с использованием ОФ-ВЭЖХ метода, описанного выше. Исследования по растворимости чГРФ Исследования по растворимости проводили для изучения действия физиологического раствора и фосфатного буфера рН 7 на растворимость чГРФ. Определение количества растворенного чГРФ производили путем фильтрования уравновешенного раствора через 0,45 мкм фильтр перед разбавлением и анализом ВЭЖХ. Изготовление лиофилизированной лекарственной формы антида 50 флаконов лиофилизированного продукта антид/никотинамид изготавливают следующим образом: 1) отвешивают 0,7 г ацетата антида (представленного в виде сухого порошка), отвешивают 3,5 г маннита и добавляют примерно 50 мл воды для инъекций (ВДИ),2) переводят оба вещества в раствор путем легкого перемешивания,3) доводят до конечного веса 70 г добавлением ВДИ,4) заполняют флаконы 1 мл раствора,5) цикл лиофилизации: загружают продукт при комнатной температуре. Доводят продукт до -40 С и выдерживают в течение 1,5 ч, затем применяют вакуум. Производят первичную сушку в течение 2 ч. Повышают температуру стеллажа до+20 С и выдерживают в течение 16 часов. Повышают температуру стеллажа до+40 С и выдерживают в течение 5 ч до завершения процесса. Результаты и обсуждение Стабильность антида в водных растворах Результаты трехмесячного испытания на стабильность растворов 0,1 мг/мл антида, доведенных до рН 2, 3 и 4 с использованием соляной кислоты и сохраняемых при -20, +4, +25 и+40 С представлены в табл. 1 и 2. Процент разложения повышался по мере снижения рН, что определилось наблюдаемыми оценками чистоты. Также было отмечено, что хранение при-20 С отрицательно влияло на стабильность продукта, когда рН был ниже 4. Исследования по растворимости антида Действие рН В табл. 3 и 7 обобщены наблюдения, собранные для получения информации по поведению растворимости антида в воде для инъекций(ВДИ), ВДИ подкисляется НСl или уксусной кислотой, физиологическим солевым раствором или физиологическим раствором, подкисленным уксусной кислотой. В согласии с предыдущими исследованиями растворимость антида повышалась, когда рН снижался. В табл. 3 естественный рН в растворе ацетата антида составляет от 4,4 до 5,0, в зависимости от растворенного количества. Антид мог легко растворяться в воде при концентрации 1,0 мг/мл, однако, без дополнительного подкисления, как было обнаружено, предел растворимости составляет 8,1 мг/мл. рН не измеряли, в процессе превращения раствора в гель. Когда антид добавляли в количестве 50 мг/мл в воду, рН которой доведен до рН 3,0 соляной кислотой, образовывался гель, что указывало на частичную растворимость. На основании этих результатов необходимо было добавлять дополнительное количество кислоты до получения полного растворения при этой концентрации. В табл. 4 и 5 показано, что значительные количества уксусной кислоты были не эффективны для растворения антида в воде. Добавление 2% уксусной кислоты в воду, что эквивалентно 0,33 М раствору (как полагают, слишком концентрированной для использования в целях изготовления инъекционных препаратов), как было обнаружено, эффективно для растворения 10 и 20 мг/мл антида. Добавление 5 мг/мл антида в 1% уксусную кислоту давало раствор с рН 3,12 в присутствии физиологического солевого раствора. Раствор сохранял опалесценцию, указывающую на то,что растворимость лекарственного вещества была менее 5 мг/мл; точное количество не определялось (табл. 6). В табл. 7 показано, что антид при концентрации 10 мг/мл в физиологическом растворе не растворялся при рН 3,0 или 4,6, при использовании 4% уксусной кислоты для достижения снижения рН. рН измеряли после приготовления раствора, после чего постепенно образовывался гель, что указывало на частичную растворимость лекарственного вещества. Растворимость лекарственного вещества в физиологическом растворе при рН 3,0, как было обнаружено,составляет 2,2 мг/мл по сравнению со значением, равным 0,025 мг/мл при естественном рН,равным 5,04, для этого раствора. Действие гидротропных солюбилизирующих веществ на растворимость антида Оценено действие различных гидротропных веществ (1,5% и 15 вес.%) в физиологических солевых растворах и описано в табл. 8 и 9. Никотинамид и гидрохлорид тиамина, как доказано, являются наиболее эффективными солюбилизирующими веществами. В табл. 8 показано действие низких концентраций (1,5 вес.%) гидротропных веществ,выбранных по рН раствора, измеренного перед 11 добавлением лекарственного вещества, однако,они были неэффективны при солюбилизации антида при уровне 10 мг/мл в физиологическом растворе. Эксперимент, описанный в табл. 8, повторяли с использованием низкой концентрации лекарственного вещества и высокой концентрации гидротропного вещества, как описано в табл. 9. После определения количества растворенного антида, было обнаружено, что никотинамид является очень хорошим солюбилизирующим средством для антида при 3,3 мг/мл,растворенных в 15% по весу растворе никотинамида в физиологическом растворе при рН 5,8. Тиамин гидрохлорид также солюбилизировал значительные количества антида в физиологическом растворе при 3,0 мг/мл, растворенных в 15% по весу растворе в физиологическом растворе. В этом случае, однако, подкисление, создаваемое кислой солью тиамина, вызывало существенное снижение рН до 3,3, и солюбилизирующая сила большей частью обусловлена кислотностью раствора. Ионные гидротропные вещества не дают хорошей растворимости антида в физиологическом растворе. Никотинамид Были проведены дополнительные исследования, чтобы подтвердить солюбилизирующее действие никотинамида на антид в физиологическом растворе и определить наиболее эффективную для использования концентрацию. Действие этой концентрации никотинамида на растворимость антида показана в табл. 10, где, как было обнаружено, 20% никотинамида в физиологическом растворе обеспечивает растворимость 8,5 мг/мл антида. Эти результаты представлены графически на чертеже. График в полулогарифмическом масштабе показывает, что растворимость антида находится в логарифмической зависимости от концентрации присутствующего никотинамида. Линейная природа этого графика является важной, так как позволяет точно рассчитывать эффекты разведения, а также показывает, что в этих растворах достигнута равновесная растворимость для этого лекарственного вещества. Так как доказано, что никотинамид является очень хорошим солюбилизирующим средством для антида, были предприняты дополнительные исследования, чтобы подтвердить химическую совместимость между никотинамидом и антидом. Изготавливали четыре лекарственные формы антида и никотинамида с разным соотношением концентраций и доведенные до рН 5 и испытывали в течение 3 месяцев при +40,+25 и +4 С. Данные по стабильности представлены в табл. 11. Повышенная вязкость с образованием осадка наблюдалась в лекарственной форме,содержащей 10 мг/мл антида и 5% никотинамида, через 1 неделю при +40 и +25 С; не наблюдалось изменений в образцах, которые хранили 12 при +4 С. Это показывает, что растворимость антида в растворах никотинамида в физиологическом растворе снижается, когда повышается температура. Никакого химического разложения не наблюдалось в лекарственных формах через 3 месяца, что указывает на то, что не существует химической несовместимости между двумя веществами при исследуемых соотношениях. Хроматографические кривые анализа на антид были идентичными кривым стандартов с добавлением пика более рано элюируемого никотинамида, который появляется при времени удерживания, равного 3,2 мин. Количества никотинамида, необходимые для того, чтобы солюбилизировать антид после инъекции могут быть больше, чем изотоническая концентрация никотинамида, которая равна 4,5%. Поэтому после инъекции в экстраваскулярную область, жидкости организма должны будут снова уравновешиваться, чтобы достичь осмотического равновесия, что приводит к разбавлению солюбилизирующего вещества. В целях имитации потенциального разбавления инъекционной лекарственной формы, которое может происходить, было изучено действие разбавления лекарственных форм, содержащих антид и никотинамид в фосфатно-буферном растворе (ФБР) путем следующих in vitro экспериментов. Делали указанные разбавления, чтобы довести концентрацию никотинамида до 5% путем добавления ФБР. Готовили растворы антида с концентрацией от 1 до 5 мг/мл в 15% никотинамиде/ВДИ с последующим разбавлением в ФБР с коэффициентом 3. Наблюдения производили в течение срока, равного 3 ч, и эффект разбавления в ФБР показан в табл. 12. Эти результаты находятся в хорошем согласии с растворимостью, определенной для антида в этих системах, представленной в табл. 10, где раствор 5% никотинамида в физиологическом растворе может солюбилизировать примерно 0,5 мг/мл антида. Данные показывают,что возможно получение слегка перенасыщенного раствора антида в жидкостях организма путем изготовления, например, раствора антида 2 мг/мл в 15% никотинамиде. При разбавлении до 5% этот раствор должен содержать 0,67 мг/мл антида, который сохраняется в растворе во время исследований, представленных выше. Поэтому в соответствующих лекарственных формах, содержащих, например, 15% никотинамида и 2 мг/мл антида или 5% никотинамида и 0,5 мг/мл антида, может, например,снижать образование осадка в месте инъекции после введения. Другие соответствующие лекарственные формы, такие как те, которые описаны выше, могут быть определены по графикам растворимости на чертеже и являются предпочтительными в соответствии с данным изобретением. В результате примеров, представленных выше, можно заключить, что антид может быть эффективно солюбилизирован с помощью ряда веществ, которые являются неионными ароматическими гидротропными соединениями, тогда как добавление ионизированных веществ снижает растворимость в водной среде. Растворимость антида, как показано,увеличивается при снижении рН, тогда как химическая стабильность антида снижается, когда рН снижается ниже значения рН 4. Было также обнаружено, что антид остается химически стабильным в присутствии никотинамида. Изучение растворимости чГРФ Растворимость чГРФ количественно определяли при 25 С в воде в сравнении с физиологическим раствором (хранили в течение одной недели для достижения равновесия) и ФБР, который хранили в течение 5 дней. Растворимости были равны ВДИ 1 мг/мл,0,9% NaCl 0,042 мг/мл,ФБР 0,032 мг/мл. После хранения при 40 С в течение одной недели, наблюдалась следующая растворимость: 0,9% NaCl 0,097 мг/мл,0,9% NaCl + 5% никотинамида 0,875 мг/мл. Растворы чГРФ (5 и 20 мг/мл) готовили в воде, рН которой доводили до рН 3,0, и добавляли 5 или 20% никотинамида. Путем повышения рН определяли точку преципитации чГРФ. Результаты показывают способность никотинамида солюбилизировать чГРФ даже при высоком рН. Результаты представлены в табл. 13. Стабильность чГРФ в водных растворах Путем включения никотинамида в водные растворы чГРФ было открыто, что вещество также обладает способностью значительно снижать химическое разрушение этого пептида. ГРФ, как известно, быстро разрушается в водном растворе путем дезамидирования, скорость которого повышается при повышении рН выше области 4-5. Водные растворы чГРФ готовили в воде, рН которой доводили до 7,5, содержащей или 0,5 или 20% никотинамида, и хранили в течение срока до 12 недель при 4 и 40 С. Данные, представленные в табл. 14 и 15,показывают, что скорость дезамидирования существенно снижалась в присутствии никотинамида, в частности, скорость дезамидирования у аспарагина в положении 8 в чГРФ, причем рас 14 творы более стабильны при более низкой температуре. Так как дезамидирование происходит в растворе, активность воды является важным фактором управления скоростью разложения. Поэтому, так как чГРФ растворим в пропиленгликоле, была изучена стабильность чРГФ в растворе этого растворителя, чтобы понять действие на реакции дезамидирования. Данные, представленные в табл. 16 и 17,показывают, что разложение путем дезамидирования у аспарагина в положении 8 было снижено до очень низкого уровня в этом растворе. Данные также показывают, что чГРФ, растворенный в пропиленгликоле обнаруживает существенное разрушение путями, которые пока еще полностью не выяснены, с образованием многочисленных новых продуктов разложения, дающих пики элюирования после основного пика для чГРФ при примененных условиях хроматографии. По этим данным можно ясно увидеть, что добавление никотинамида к раствору чГРФ в пропиленгликоле вызывает существенное снижение уровня этих продуктов разложения. На скорость разложения опять влияли температура растворов, причем растворы при 4 С были более стабильны, чем при 40 С. Чтобы оценить действие сочетания обоих,никотинамида и пропиленгликоля, в водном растворе чГРФ, 10 мг чГРФ растворяли в растворе, содержащем 60% пропиленгликоля и 20% никотинамида, доведенного до рН 7,5. Данные, представленные в табл. 18, 19 и 20, показывают, что разложение путем дезамидирования у аспарагина в положении 8 снижалось в этом растворе до очень низкого уровня и при 4 С скорость разложения была достаточно низкой, чтобы ее учитывать при фармацевтическом применении. Эти данные свидетельствуют о стабилизации водных растворов чГРФ путем использования никотинамида и включения пропиленгликоля. Полагают, что для различного фармацевтического применения композиция может быть оптимизирована, или что другие неводные растворители могут быть использованы для снижения активности воды. Однако для эффективного фармацевтического действия необходимо стабилизирующее действие никотинамида. Таблица 1 Стабильность растворов антида 0,1 мг/мл при рН 2, 3 и 4; темп.=+4 С и -20 С Таблица 2 Стабильность растворов антида 0,1 мг/мл при рН 2, 3 и 4; темп.=+25 С и +40 С Растворимость антида в ВДИ + 4% уксусной кислоты Антид (номинальное добавленное количество, мг/мл) Вид 100 гель 50 гель 33 гель 25 опалесцирующий Растворимость антида в ВДИ +2% уксусной кислоты Антид (номинальное добавленное количество, мг/мл) Вид 40 гель 20 опалесцирующий 10 прозрачный Таблица 6 Растворимость антида в физиологическом растворе + 1% уксусной кислоты Антид (номинальное добавленное количество, мг/мл) Вид рH 10 гель НО 5 опалесцирующий 3,12 Таблица 7 Влияние рН на растворимость антида в физиологическом растворе Антид (номинальное добавленное количество, мг/мл) 1 10 10 Вид опалесцирующий гель опалесцирующий Таблица 8 Влияние 1,5% гидротропных веществ на растворимость антида в физиологическом растворе Антид (номинальное добавленное Гидротропное вещество рН Вид Растворимость, мг/мл количество, мг/мл) 10 никотинамид 4,89 гель НО 10 сахарин 4,61 гель НО 10 салицилат натрия 5,08 гель НО 10 тиамин гидрохлорид 3,94 гель НО Таблица 9 Влияние 15% гидротропных веществ на растворимость антида в физиологическом растворе Антид (номинальное добавленное количеГидротропное вещество рН Вид Растворимость, мг/мл ство, мг/мл) 5 никотинамид 5,79 опалесцирующий 3,32 5 салицилат натрия 5,81 опалесцирующий 0,21 5 тиамин гидрохлорид 3,30 опалесцирующий 3,01 5 бензоат натрия 6,69 опалесцирующий 0,072 5 гистидин гидрохлорид (5%) 4,17 опалесцирующий 0,076 5 фенилаланин (1,7%) 4,59 опалесцирующий 0,066 Таблица 10 Влияние концентрации никотинамида на растворимость антида в физиологическом растворе Антид (номинальное добавленНикотинамид, % рН Вид Растворимость, мг/мл ное количество, мг/мл) 1 5 НО опалесцирующий 0,47 5 10 5,68 опалесцирующий 1,40 5 15 5,76 опалесцирующий 3,23 10 20 5,64 опалесцирующий 8,49 Таблица 11 Стабильность препаратов никотинамида/антида при 4, 25 и 40 С Антид, Никотинамид,мг/мл Ант. 5 мг/мл Ник. 15% Разведение 1:3 (ФБР) опалесцирующий осадок осадок осадок осадок осадок осадок Ант. 4 мг/мл Ник. 15% Разведение 1:3 (ФБР) опалесцируюший осадок осадок осадок осадок осадок осадок Ант. 3 мг/мл Ник. 15% Разведение 1:3 (ФБР) прозрачный прозрачный осадок осадок осадок осадок осадок Ант. 2 мг/мл Ник. 15% Разведение 1:3 (ФБР) прозрачный прозрачный прозрачный прозрачный прозрачный прозрачный прозрачный Ант. 1 мг/мл Ник. 15% Разведение 1:3 (ФБР) прозрачный прозрачный прозрачный прозрачный прозрачный прозрачный прозрачный Таблица 13 Растворимость чГРФ в водных растворах никотинамида Точка выпадения осадка Растворы Первоначальный pН Таблица 14 Стабильность при +40 С растворов ГРФ (2 мг/мл) + никотинамид, доведенных до рН 7,5 1 неделя Площади хрома т о графических пиков (%). В порядке элюирования-Asp3 0 0,8 16,7 3,8 0,3 68,0 но 5,2 5 0,5 13,4 3,5 0,3 73,9 0,9 3,9 20 0,5 11,5 3,6 0,3 77,1 0,9 3,1 4 недели Площади хроматографических пиков (%).-Asp3 0 6,2 37,8 5,7 2,7 22,2 2,9 10,4 5 4,9 33,3 6,4 1,9 31,5 2,4 9,0 20 4,2 28,6 7,5 2,1 39,5 2,6 7,6 Таблица 15 Стабильность при +4 С растворов чГРФ (2 мг/мл) + никотинамид, доведенных до рН 7,5 Площади хроматографических пиков (%). В порядке элюирования-Asp8 Время 0 0,1 0,2 0 0,3 97,6 но 0,6 4 недели 0 0 1,4 0,1 0,1 95,4 но 0,8 5 0 0,9 0,1 0 96,8 но 0,6 20 0 0,8 0,1 0 97,4 но 0,6 8 недель 0 0 2,4 0,2 0,1 93,2 но 1,1 5 0 1,5 0,2 0,1 95,8 но 0,9 20 0 1,4 0,2 0,1 96,3 но 0,8 12 недель 0 1,06 3,39 0,27 0,07 89,9 но 1,29 5 0,28 2,12 0,26 0,11 94,0 но 0,97 20 0,15 1,95 0,26 0,10 95,1 но 0,97 Значения (для аббревиатур в табл. 14-15): но = нет объяснения. Succ-D3 + Asp8 может элюироваться в виде перекрывающего пика= необходимо дальнейшее определение свойств для подтверждения идентификации пика ову = отношение времени удерживания Таблица 16 Стабильность при +4 С растворов чГРФ (5 мг/мл) в пропиленгликоле + никотинамид, доведенных до рН 7,5 1 неделя 4 С Площади хроматографических пиков (%). В порядке элюирования-Asp8 0 0,6 0,3 97,7 0,4 0,4 0 0,2 0,4 95,4 0,5 1,0 0 0,4 0,4 97,5 0,4 0,7 Площади хроматографических пиков (%). В порядке элюирования ову 1,11 ову 1,13 ову 1,17 ову 1,18 ову 1,20 ову 1,23 0,2 0,4 0,9 0,4 0,3 0,2 Площади хроматографических пиков (%). В порядке элюирования-Asp8 0 0,2 0,3 95,0 0,4 0,9 0 0,3 0,3 97,1 0,4 1,0 Площади хроматографических пиков (%). В порядке элюирования ову 1,11 ову 1,13 ову 1,17 ову 1,18 ову 1,20 ову 1,23 0,6 1,6 0,3 0,1 0,1 Площади хроматографических пиков (%). В порядке элюирования-Asp8 0 0,2 0,3 92,2 1,2 но 0 0,3 0,3 95,7 1,8 но Площади хроматографических пиков (%). В порядке элюирования ову 1,11 Таблица 17 Стабильность при +40 С чГРФ (5 мг/мл) в растворах пропиленгликоля + никотинамида, доведенных до рН 7,5 1 неделя 40 С Площади хроматографических пиков (%). В порядке элюирования-Asp8 0 0,3 0 0 0,1 82,9 1,1 1,2 20 1,6 0 0,3 0,2 88,0 1,3 1,6 1 неделя 40 С Площади хроматографических пиков (%). В порядке элюированияoву 1,23 0 0,5 3,2 1,4 0,3 3,9 2,6 1,37 20 0,3 1,4 0,4 0 1,8 1,0 1,2 4 недели 40 С Площади хроматографических пиков (%). В порядке элюирования-Asp8 0 0,5 0 0 0 44, 6 1,7 1,5 20 10,9 0,9 0 0,4 43,1 1,3 4,2 4 недели 40 С Площади хроматографических пиков (%). В порядке элюирования Таблица 20 Стабильность при +40 С чГРФ (10 мг/мл) в 60% пропиленгликоле + 20% никотинамида, 20% Н 2 О,доведенных до рН 7,5 Площади хроматографических пиков (%) ГРФ 1-29 Пики окисления, % Rtr= 0,76 24 а) пептидный агонист ЛГРФ, пептидный антагонист ЛГРФ или пептид ГРФ в качестве активного ингредиента; б) никотинамид и с) физиологический водный раствор. 2. Фармацевтическая композиция по п.1, в которой активный ингредиент представляет пептидный антагонист ЛГРФ. 3. Фармацевтическая композиция по любому из предшествующих пунктов, в которой активный ингредиент представляет антид или человеческий ГРФ. 4. Фармацевтическая композиция по любому из предшествующих пунктов, которая лиофилизирована и воссоздана и дополнительно включает одно или более стабилизирующее вещество. 5. Фармацевтическая композиция по любому из предшествующих пунктов, которая дополнительно включает пропиленгликоль. 6. Фармацевтическая композиция по любому из предшествующих пунктов, которая пригодна для парентерального, перорального,назального или ингаляционного пути введения. 7. Фармацевтическая композиция по любому из предшествующих пунктов, дополнительно включающая один или более фармацевтически приемлемый наполнитель. 8. Фармацевтическая композиция по любому из предшествующих пунктов, которая пригодна для инъекций. 9. Фармацевтическая композиция по п.3,которая имеет следующие пределы изменения состава: Антид или чГРФ 0,1-20,0 мг Никотинамид 10-300 мг Пропиленгликоль 0-800 мг Водная фаза Достаточное количество до 1,0 мл
МПК / Метки
МПК: A61K 38/09
Метки: низкую, среде, физиологической, композиции, имеющих, пептидов, фармацевтические, растворимость
Код ссылки
<a href="https://eas.patents.su/13-2227-farmacevticheskie-kompozicii-peptidov-imeyushhih-nizkuyu-rastvorimost-v-fiziologicheskojj-srede.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции пептидов, имеющих низкую растворимость в физиологической среде</a>
Предыдущий патент: Способ производства сахарного сиропа из сахаросодержащего сырья
Следующий патент: Устройства с декоративным и имеющим форму символа оттягиваемым ушком для открывания емкостей и способы их изготовления
Случайный патент: Способ конверсии углеводородов