Способ получения кристаллического (r)-толтеродина тартрата
Номер патента: 16325
Опубликовано: 30.04.2012
Авторы: Кациркова Мартина, Гейтманкова Людмила, Восатка Вацлав, Свобода Мартин, Легоцкий Микулас, Ямпилек Йосеф, Томасек Вацлав
Формула / Реферат
1. Способ получения кристаллического R-толтеродина тартрата, который характеризуется приведенными ниже свойствами:
(а) по меньшей мере 90% всех присутствующих кристаллов имеют размер менее чем 30 мкм,
(б) по меньшей мере 40% массы кристаллического вещества имеет размер частиц менее 250 мкм,
(в) максимальный размер кристаллов не превышает 800 мкм,
(г) содержит менее чем 0,1 мас.% нежелательного энантиомера S-толтеродина тартрата,
(д) аналитический тест на сульфатную золу (Европейская Фармакопея) дает значение ниже чем 0,1%;
который включает по меньшей мере одну кристаллизацию этого вещества из воды.
2. Способ по п.1, где неочищенный R-толтеродина тартрат суспендируют в воде, суспензию нагревают до кипения и выдерживают при этой температуре до растворения с последующей кристаллизацией путем охлаждения раствора.
3. Способ по п.2, где массовое отношение R-толтеродина тартрата к воде составляет от 1:5 до 1:20.
4. Способ по п.3, где массовое отношение R-толтеродина тартрата к воде составляет от 1:7 до 1:15.
5. Способ по любому из пп.1-4, где рацемическую соль толтеродина гидробромид сначала преобразуют под действием основания в толтеродин, который затем преобразуют в тартрат путем взаимодействия с винной кислотой в растворе C1-C3 спирта, и соответствующий диастереоизомер кристаллизуют, после возможной кристаллизации продукта из этанола проводят конечную кристаллизацию из воды.
Текст
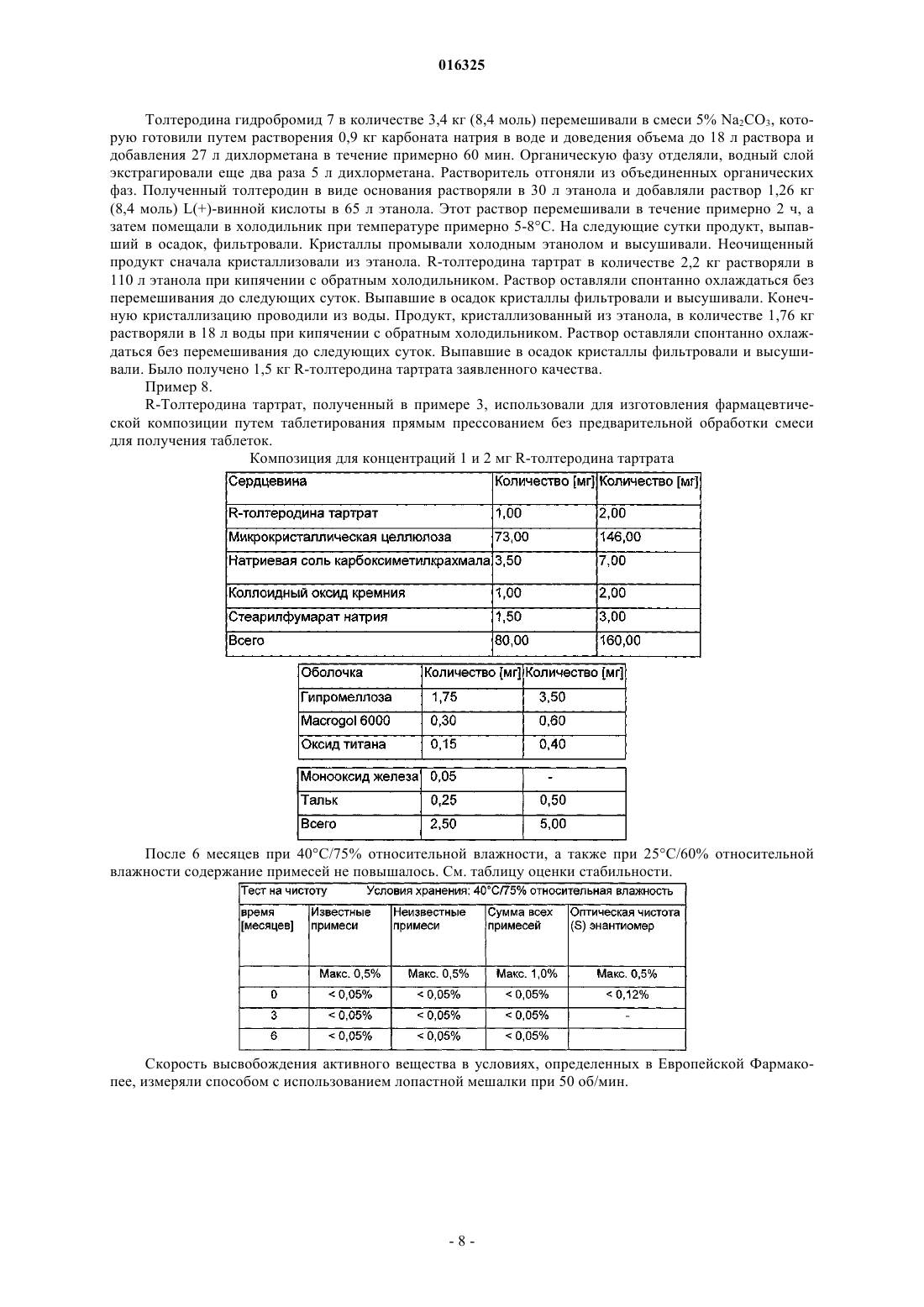
СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО (R)-ТОЛТЕРОДИНА ТАРТРАТА Изобретение относится к способу получения кристаллического R-толтеродина тартрата,имеющему следующие характеристики: (а) по меньшей мере 90% всех присутствующих кристаллов имеют размер менее чем 30 мкм, (б) по меньшей мере 40% массы кристаллического вещества имеет размер частиц менее 250 мкм, (в) максимальный размер кристаллов не превышает 800 мкм, (г) содержит менее чем 0,1 мас.% нежелательного энантиомера S-толтеродина тартрата,(д) аналитический тест на сульфатную золу (Европейская Фармакопея) дает значение ниже чем 0,1%; где способ включает по меньшей мере одну кристаллизацию этого вещества из воды. 016325 Область техники Изобретение относится к способу получения кристаллической соли 2-[(1R)-3-[бис-(1 метилэтил)амино]-1-фенилпропил]-4-метилфенола с (2R,3R)-2,3-дигидроксибутандиовой кислотой, известному спазмолитику мочевой системы, с предпочтительными кристаллическими характеристиками. Предшествующий уровень техники Толтеродин является известным антагонистом холинергических рецепторов, который применяют для лечения нестабильного мочевого пузыря, который, в свою очередь, связан с недержанием мочи. 2-[(1R)-3-[бис-(1-Метилэтил)амино]-1-фенилпропил]-4-метилфенол, известный под названием толтеродин, альтернативно R-толтеродин, применяют в фармацевтической композиции в форме его соли с Толтеродин обычно применяют в форме солей. Чаще всего применяемой является соль (2R,3R)-2,3 дигидроксибутандиовой кислоты (1:1), известной также под названием L-винная кислота. Толтеродин, способ его получения и его фармакологические эффекты были впервые описаны в патенте ЕР 325571. Конечная стадия получения R-толтеродина тартрата описана в примере 9 упомянутого документа. Рацемический толтеродин растворяют в этаноле. К этому раствору добавляют спиртовой раствор винной кислоты. Смесь нагревают в течение нескольких минут, а затем охлаждают, что вызывает кристаллизацию. С целью получения чистого вещества продукт снова перекристаллизуют из этанола. Чистота полученного таким образом R-толтеродина тартрата обычно недостаточно удовлетворительна, и кристаллизацию нужно повторять несколько раз. Как показано ниже в примерах, даже после трех перекристаллизаций содержание нежелательного S-толтеродина все еще составляет 0,2%. Несмотря на тот факт, что содержание органических примесей было удовлетворительным, возникла проблема с неорганическими примесями, что следует из результата определения сульфатной золы в количестве 0,34%. Эти результаты были погранично удовлетворительными и не соответствовали даже более строгим требованиям к фармацевтически активным ингредиентам. При повторных кристаллизациях концентрации примесей уменьшаются очень медленно при возрастающих затратах. Вопрос, таким образом, заключался в том, являются ли полученные примеси удовлетворительными для фармацевтических композиций. Проблему составляла стабильность фармацевтической композиции. Применение обычно изготовленной фармацевтической композиции, упомянутой в цитируемом документе ЕР 325571, не обеспечивает достаточно стабильного препарата; с течение времени продукты распада были обнаружены в композиции в более высокой концентрации, чем приемлемая концентрация. Композиция, описанная в ЕР 325571, имеет приведенный ниже состав В соответствии с цитируемым патентным документом композицию прессовали в таблетки, которые могут быть, но не обязательно, дополнительно покрыты оболочкой. Композиция, зарегистрированная и продаваемая в Чешской Республике, соответствует, по меньшей мере, качественно вышеупомянутому описанию, и выбран вариант с покрытием оболочкой. Эта оболочка состоит из гидроксипропилметилцеллюлозы, микрокристаллической целлюлозы, стеариновой кислоты и диоксида титана (данные представлены только качественно). Этот зарегистрированный препарат упакован в блистеры, изготовленные из поливинилхлорида, который покрыт слоем поливинилиденхлорида (ПВХ/ПВДХ). Тесты на стабильность показали (пример 1), что, хотя композиция является погранично удовлетворительной в отношении требований к стабильности, общее увеличение содержания примесей очень значительно, и в случае неправильного хранения чистота может снизиться настолько, что препарат станет неприменимым. Задача, таким образом, состояла в том, чтобы получить композицию, которая была бы абсолютно-1 016325 приемлемой в отношении стабильности. Другая задача состоит в гарантии того, что композиция, содержащая продукт, изготовленный таким путем, достигает требуемой скорости высвобождения активного вещества, которая, в свою очередь, непосредственно связана с фармакологической эффективностью препарата. Обычной стратегией является уменьшение размера кристаллов. В результате вышеописанной кристаллизации образуются большие кристаллы, которые не дают возможности достаточно быстрого высвобождения активного вещества и непригодны для применения. Измельчение полученных таким образом кристаллов затруднительно. Измельченные частицы обладают значительной липкостью и склонны к прилипанию к механизму или к образованию агрегатов. Настоящее изобретение решает вышеупомянутые задачи. Краткое описание изобретения Согласно изобретению предложен способ получения кристаллического R-толтеродина тартрата,имеющего приведенные ниже параметры:(а) по меньшей мере 90% всех присутствующих кристаллов имеют размер меньше чем 30 мкм,(б) по меньшей мере 40% массы кристаллического вещества менее чем 250 мкм,(в) максимальный размер кристаллов не превышает 800 мкм,(г) содержит менее чем 0,1 мас.% нежелательного энантиомера S-толтеродина тартрата,(д) аналитический тест на сульфатную золу (Европейская Фармакопея) дает значение ниже чем 0,1%,который включает по меньшей мере одну кристаллизацию из воды. Кристаллизация из воды прежде не была описана. Предложенный способ позволяет получить субстанцию, которая решает вышеописанную задачу изобретения. Способ предпочтительно включает суспендирование сырого R-толтеродина тартрата в воде, нагревание суспензии до кипения и поддержание при этой температуре до растворения с последующей кристаллизацией путем охлаждения раствора. Предпочтительно использовать массовое отношение Rтолтеродина тартрата к воде от 1:5 до 1:20, предпочтительно от 1:7 вплоть до 1:15. Этот способ можно осуществлять таким образом, что рацемическую соль толтеродина гидробромид преобразуют с помощью основания в толтеродин, который затем преобразуют в тартрат путем взаимодействия с винной кислотой в растворе C1-С 3 спирта и кристаллизуют соответствующий диастереоизомер, и после возможной кристаллизации продукта из этанола проводят конечную кристаллизацию из воды. Подробное описание изобретения Соображения, касающиеся препарата с долговременной стабильностью, включали очевидное требование к удалению даже следовых количеств тех элементов, которые были определены в первом приближении посредством измерения сульфатной золы. Что касается стабильности, данная примесь, таким образом, оказалась очень важной. С учетом отрицательного влияния этих элементов было ясно, что вещество, которое должно быть стабильным в течение длительного времени, должно иметь низкое содержание сульфатной золы. Значения ниже 0,3% оказались удовлетворительными. Проблема скорости высвобожденияR-толтеродина тартрат слабо растворим в воде, и поэтому можно предсказать проблемы со скоростью его высвобождения в водной среде. Скорость высвобождения играет важную роль в биодоступности препарата. Общая стратегия улучшения биодоступности состоит в измельчении препарата. Однако в случае R-толтеродина тартрата очень трудно измельчить частицы. Оказалось, что частицы содержали либо слишком большие кристаллы, либо имели слишком высокое содержание порошкообразных частиц,что создавало трудности в обращении с этим материалом. В основном было возможно измельчить материал до очень мелких частиц и, следовательно, получить, например, вплоть до 90% всех частиц меньше чем 30 мкм. Однако очень мелкие частицы образовывали агрегаты, которые, вероятно, не разрушались в водной среде, и проблема скорости высвобождения, таким образом, не была решена полностью. Для успешного изготовления препарата условие массовых отношений оказалось важным; то есть необходимо, чтобы по меньшей мере 40% (массы) всех частиц проходило через сито 250 мкм. Последнее условие исключает частоту появления изолированных больших кристаллов. Несмотря на тот факт, что их число является пренебрежимо малым, они могут составлять значительную долю по массе. Следовательно, ни один кристалл не должен превышать 800 мкм по размеру. Проблема нежелательного S-толтеродина Оптическая чистота является очевидным важным требованием к фармацевтическим веществам. В случае R-толтеродина тартрата содержание противоположного энантиомера после трех кристаллизаций из этанола составляет примерно 0,2%. Это значение до сих пор казалось удовлетворительным. Однако требования, касающиеся чистоты веществ, применяемых в фармацевтических композициях, становятся строже. Вещества с содержанием S-толтеродина менее чем 0,1% лучше соответствуют этим новым требованиям.-2 016325 Методика получения активного ингредиента Сам R-толтеродина тартрат принадлежит к фармацевтическим ингредиентам, которые слабо растворимы в холодной воде, результатом чего являются вышеупомянутые проблемы с высвобождением активного вещества из фармацевтической композиции в водной среде. Вероятно поэтому в литературе описана кристаллизация из этанола. Неожиданно оказалось, что в результате кристаллизации из воды получают активное вещество, которое соответствует обсужденным выше параметрам препарата. Краткое описание чертежей На графических материалах представлены результаты измерения размера частиц вещества, изготовленного в соответствии с примером 2, микроскопическим способом. На фиг. 1 представлена партия I, где 91,95% всех частиц имеют размер менее 30 мкм; 40,9 мас.% материала должно проходить через сито 250 мкм и максимальный размер кристалла составляет 623 мкм. На фиг. 2 представлена партия II, где 94,73% частиц имеют размер менее 30 мкм; 47,2 мас.% материала должно проходить через сито 250 мкм и максимальный размер кристалла составляет 439 мкм. На фиг. 3 представлена партия III, где 89,29% частиц имеют размер менее 30 мкм; 41,3 мас.% материала должно проходить через сито 250 мкм и максимальный размер кристалла составляет 702 мкм. Примеры Изобретение проиллюстрировано более подробно в приведенных ниже примерах. Пример 1. Фармацевтическая композиция в соответствии с ЕР 325571. Такой же качественный состав препарата, как для имеющегося в продаже препарата, использовали для изготовления лабораторных партий. Технологию прямого прессования использовали для обработки препарата. Имеющийся в продаже препарат 1 и 2 мг. Препарат - таблетки, покрытые оболочкой. Оценка стабильности полученного вещества (маркированная партия 020104) и имеющегося в продаже вещества Оценку стабильности проводили в двух упаковках, ПВХ (поливинилхлорид) и ПВХ/ПВДХ (поливинилиденхлорид). Для каждого типа упаковки в левой колонке приведено содержание примеси, присутствующей в самом большом количестве, а в правой колонке приведено суммарное содержание всех примесей. После 3 месяцев при 40 С и относительной влажности 75% суммарное содержание примесей повысилось до 0,56% в упаковке ПВХ и до 0,36% в упаковке ПВХ/ПВДХ. После 6 месяцев при 40 С и относительной влажности 75% суммарное содержание примесей повысилось до 0,92% в упаковке ПВХ и до 0,83% в упаковке ПВХ/ПВДХ аналогично исходному имеющемуся-3 016325 в продаже веществу, см. таблицу выше. Пример 2 (сравнительный). Новая композиция без кальция гидрофосфата дигидрата была предложена для опытных партий. Вещество является неудовлетворительным в отношении содержания примесей после 3 месяцев при 40 С/75% о.в., после 6 месяцев при 30 С/65% о.в. и после 9 месяцев в нормальных условиях, то есть 25 С/60% о.в., см. таблицы оценки стабильности. Оценка стабильности. Номер партии: 0413 09 04 блистер ПВХ, A1, 40 С/75% о.в. Пример 3. Стресс-тесты. В приведенных ниже тестах повышение содержания примесей измеряли для бинарных смесей ак-4 016325 тивного агента и смазывающего агента в отношении 1:1,5 (по массе) во влажном воздухе при температуре 80 С, в течение 6 ч. Стресс-тесты Оказалось, что повышение содержания примесей в присутствии стеарата магния в несколько раз выше, чем в случае других тестируемых смазывающих агентов. Пример 4. Новая композиция без гидрофосфата кальция дигидрата и стеарата магния. Стеарат магния был заменен стеарилфумаратом натрия. После 6 месяцев при 40 С/75% о.в., а также при 25 С/60% о.в. отсутствовало повышение содержания примесей, см. таблицу оценки стабильности. Композиция для концентраций 1 и 2 мг толтеродина тартрата Пример 5. Подобно композиции в примере 4 приведенная ниже композиция также показала очень хорошие свойства стабильности Смесь готовили в гомогенизаторе вращательного типа. Смесь первых четырех компонентов перемешивали в течение 15 мин после отсеивания, после чего добавляли стеарилфумарат натрия, и смесь гомогенизировали дополнительно в течение 5 мин. Затем смесь переносили, используя ленточный транспортер, в таблеточную машину, где ее прессовали. Пример 6. Анализ кристаллизации.R-толтеродина тартрат был получен в соответствии со схемой-6 016325 Методика: толтеродина гидробромид 7 перемешивали в смеси 5% Na2CO3 и дихлорметана до растворения продукта примерно 1 ч. Органическую фазу отделяли и фильтровали. Водную фазу экстрагировали еще дважды дихлорметаном. Объединенные органические фазы экстрагировали водой и концентрировали в роторном вакуумном испарителе. Полученный толтеродин в виде основания растворяли в этаноле и добавляли раствор L(+)-винной кислоты в этаноле. После добавления затравки раствор оставляли без перемешивания при комнатной температуре до следующего дня. После фильтрования неочищенный продукт кристаллизовали из этанола, партию I три раза, партии II и III дважды, примерно 50 л растворителя на 1 кг R(+)-толтеродина тартрата. Четвертую кристаллизацию партии I и третью кристаллизацию партии II и партии III проводили из воды примерно 10 л воды на 1 кг R(+)-толтеродина тартрата. После двух кристаллизаций из этанола содержание S-толтеродина было все еще неудовлетворительным. После кристаллизации из воды содержание S-толтеродина уменьшилось до неизмеримого значения(0,07%) для обеих партий. В случае кристаллизации из этанола оно колебалось при пограничном значении приемлемости 0,2%. После трех кристаллизаций из этанола содержание сульфатной золы было все еще неудовлетворительным для партии I, оно составляло 0,34%. Поэтому проводили еще одну кристаллизацию. После кристаллизации содержание сульфатной золы составляло 0,03%. Содержание S-толтеродина также упало до ожидаемого значения. Для всех партий проводили измерение размера частиц без какой-либо обработки, используя микроскопический способ. Результаты. Партия I (фиг. 1): 91,95% всех частиц менее чем 30 мкм; 40,9% от массы вещества должно проходить через сито 250 мкм, и максимальный размер кристалла составляет 623 мкм. Партия II (фиг. 2): 94,73% частиц менее чем 30 мкм; 47,2% от массы вещества должно проходить через сито 250 мкм, и максимальный размер кристалла составляет 439 мкм. Партия III (фиг. 3): 89,29% частиц менее чем 30 мкм; 41,3% от массы вещества должно проходить через сито 250 мкм, и максимальный размер кристалла составляет 702 мкм. Пример 7. Наиболее предпочтительный способ получения API.-7 016325 Толтеродина гидробромид 7 в количестве 3,4 кг (8,4 моль) перемешивали в смеси 5% Na2CO3, которую готовили путем растворения 0,9 кг карбоната натрия в воде и доведения объема до 18 л раствора и добавления 27 л дихлорметана в течение примерно 60 мин. Органическую фазу отделяли, водный слой экстрагировали еще два раза 5 л дихлорметана. Растворитель отгоняли из объединенных органических фаз. Полученный толтеродин в виде основания растворяли в 30 л этанола и добавляли раствор 1,26 кг(8,4 моль) L(+)-винной кислоты в 65 л этанола. Этот раствор перемешивали в течение примерно 2 ч, а затем помещали в холодильник при температуре примерно 5-8 С. На следующие сутки продукт, выпавший в осадок, фильтровали. Кристаллы промывали холодным этанолом и высушивали. Неочищенный продукт сначала кристаллизовали из этанола. R-толтеродина тартрат в количестве 2,2 кг растворяли в 110 л этанола при кипячении с обратным холодильником. Раствор оставляли спонтанно охлаждаться без перемешивания до следующих суток. Выпавшие в осадок кристаллы фильтровали и высушивали. Конечную кристаллизацию проводили из воды. Продукт, кристаллизованный из этанола, в количестве 1,76 кг растворяли в 18 л воды при кипячении с обратным холодильником. Раствор оставляли спонтанно охлаждаться без перемешивания до следующих суток. Выпавшие в осадок кристаллы фильтровали и высушивали. Было получено 1,5 кг R-толтеродина тартрата заявленного качества. Пример 8.R-Толтеродина тартрат, полученный в примере 3, использовали для изготовления фармацевтической композиции путем таблетирования прямым прессованием без предварительной обработки смеси для получения таблеток. Композиция для концентраций 1 и 2 мг R-толтеродина тартрата После 6 месяцев при 40 С/75% относительной влажности, а также при 25 С/60% относительной влажности содержание примесей не повышалось. См. таблицу оценки стабильности. Скорость высвобождения активного вещества в условиях, определенных в Европейской Фармакопее, измеряли способом с использованием лопастной мешалки при 50 об/мин.-8 016325 Высвобождение активного вещества в 0,1 М HCl Оказалось, что более чем 50% активного вещества высвобождается уже в течение 5 мин, 90% высвобождается в течение 15 м и практически все активное вещество высвобождается через 30 мин. Высвобождение активного вещества в фосфатном буфере рН 6,8 Более чем 70% активного вещества растворяется в течение 5 мин и более чем 90% в течение 20 мин. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения кристаллического R-толтеродина тартрата, который характеризуется приведенными ниже свойствами:(а) по меньшей мере 90% всех присутствующих кристаллов имеют размер менее чем 30 мкм,(б) по меньшей мере 40% массы кристаллического вещества имеет размер частиц менее 250 мкм,(в) максимальный размер кристаллов не превышает 800 мкм,(г) содержит менее чем 0,1 мас.% нежелательного энантиомера S-толтеродина тартрата,(д) аналитический тест на сульфатную золу (Европейская Фармакопея) дает значение ниже чем 0,1%; который включает по меньшей мере одну кристаллизацию этого вещества из воды. 2. Способ по п.1, где неочищенный R-толтеродина тартрат суспендируют в воде, суспензию нагревают до кипения и выдерживают при этой температуре до растворения с последующей кристаллизацией путем охлаждения раствора. 3. Способ по п.2, где массовое отношение R-толтеродина тартрата к воде составляет от 1:5 до 1:20. 4. Способ по п.3, где массовое отношение R-толтеродина тартрата к воде составляет от 1:7 до 1:15. 5. Способ по любому из пп.1-4, где рацемическую соль толтеродина гидробромид сначала преобразуют под действием основания в толтеродин, который затем преобразуют в тартрат путем взаимодействия с винной кислотой в растворе C1-C3 спирта, и соответствующий диастереоизомер кристаллизуют,после возможной кристаллизации продукта из этанола проводят конечную кристаллизацию из воды.
МПК / Метки
МПК: C07C 215/54, A61K 31/137, C07C 213/10, A61P 13/06
Метки: r)-толтеродина, кристаллического, получения, тартрата, способ
Код ссылки
<a href="https://eas.patents.su/13-16325-sposob-polucheniya-kristallicheskogo-r-tolterodina-tartrata.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения кристаллического (r)-толтеродина тартрата</a>
Предыдущий патент: Баббитовый сплав
Следующий патент: Вакцина
Случайный патент: Изделие, в частности шина, с наружной резиновой смесью, содержащей соль лантаноида