Полиморфная форма гидрохлорида придопидина
Номер патента: 23462
Опубликовано: 30.06.2016
Авторы: Зиммерманн Анна, Сонессон Клас, Питтельков Томас, Фреструп Брайан
Формула / Реферат
1. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина в кристаллической форме, причем кристаллическая форма представляет собой кристаллическую форму II, характеризуемая порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 8,9 и 4,1 или 6,1 и 4,9, или ее сольват.
2. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина по п.1, где кристаллическая форма является безводной.
3. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина в кристаллической форме по п.1 или 2, характеризуемая порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 6,1 и 4,9 и 8,9 и 4,1.
4. Фармацевтическая композиция для лечения, профилактики или облегчения дофамин-опосредованного нарушения, содержащая терапевтически эффективное количество гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина или ее сольвата по любому из пп.1-3 вместе с одним или несколькими адъювантами, эксципиентами, носителями и/или разбавителями.
5. Фармацевтическая композиция по п.4, в которой терапевтически эффективное количество 4-(3-метансульфонилфенил) -1-пропилпиперидина составляет от 1 до 500 мг.
6. Фармацевтическая композиция по п.4, в которой терапевтически эффективное количество 4-(3-метансульфонилфенил)-1-пропилпиперидина составляет от 10 до 100 мг.
7. Фармацевтическая композиция по п.4, в которой терапевтически эффективное количество 4-(3-метансульфонилфенил)-1-пропилпиперидина составляет от 25 до 50 мг.
8. Применение гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по любому из пп.1-3 в получении лекарственного средства для облегчения симптомов, лечения или профилактики дофамин-опосредованного нарушения.
9. Способ лечения, профилактики или облегчения дофамин-опосредованного нарушения у животного, включающий введение такому животному количества гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по любому из пп.1-3, эффективного для лечения, профилактики или облегчения дофамин-опосредованного нарушения.
10. Способ по п.9, в котором дофамин-опосредованное нарушение представляет собой болезнь Гентингтона.
Текст
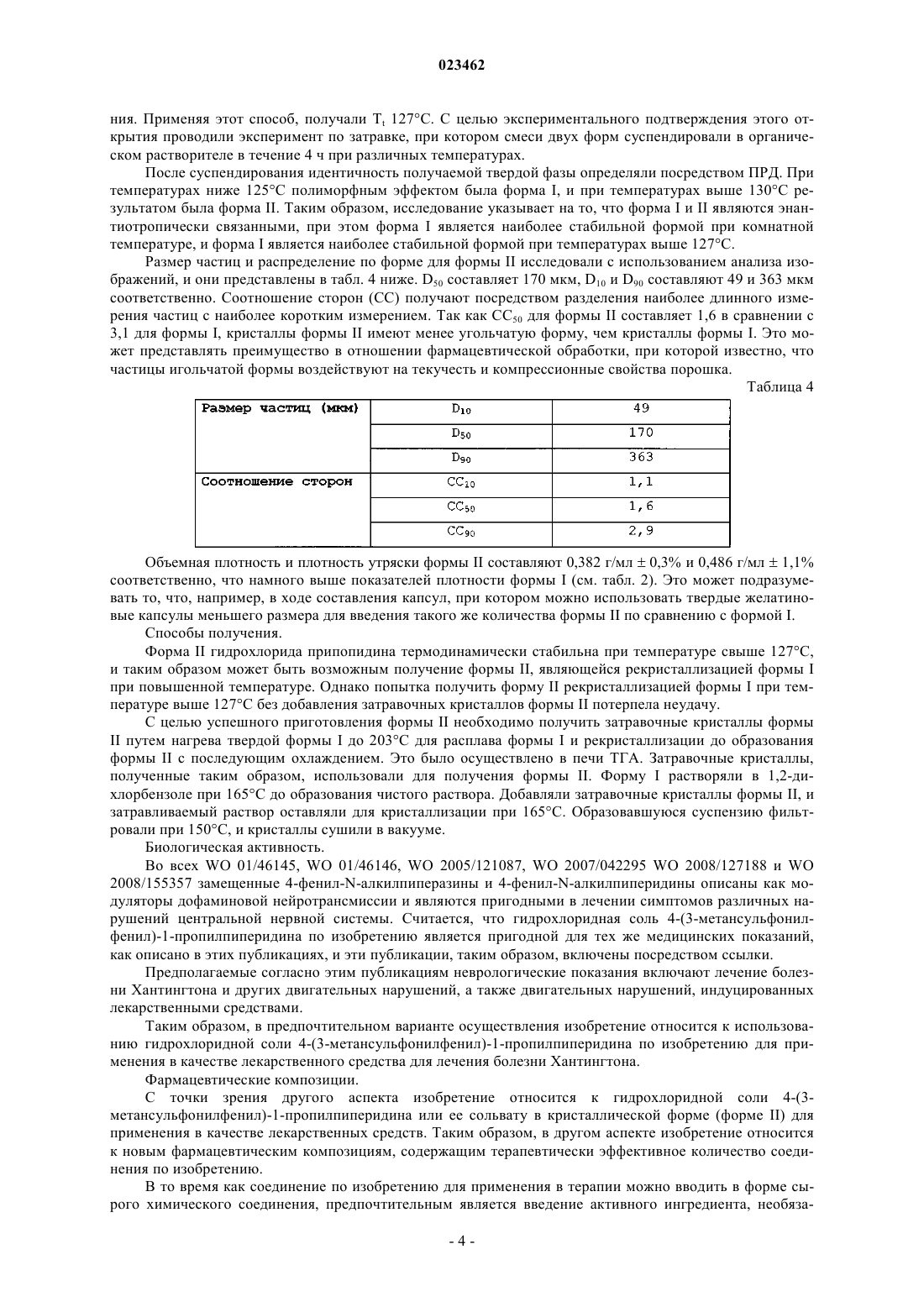
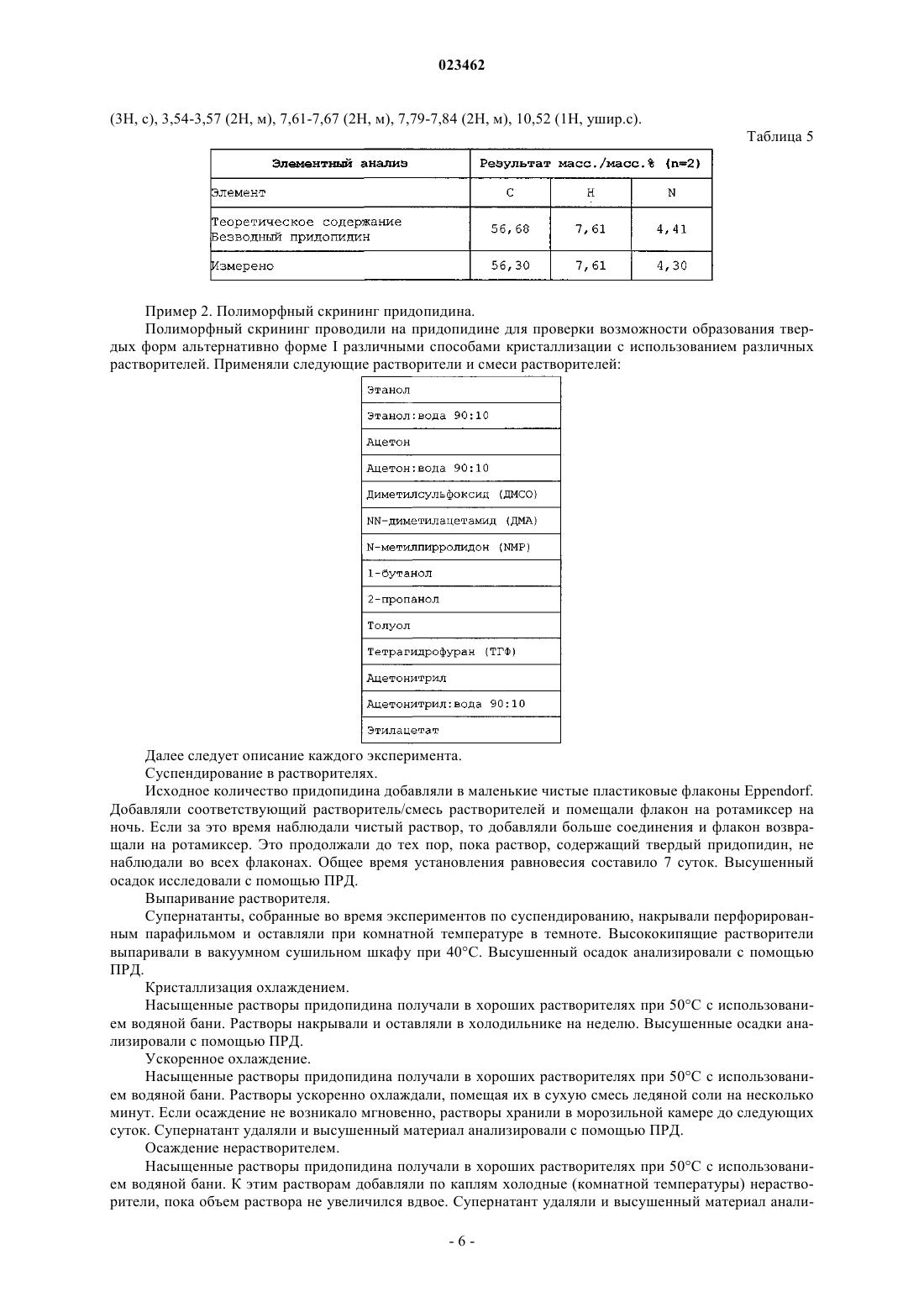
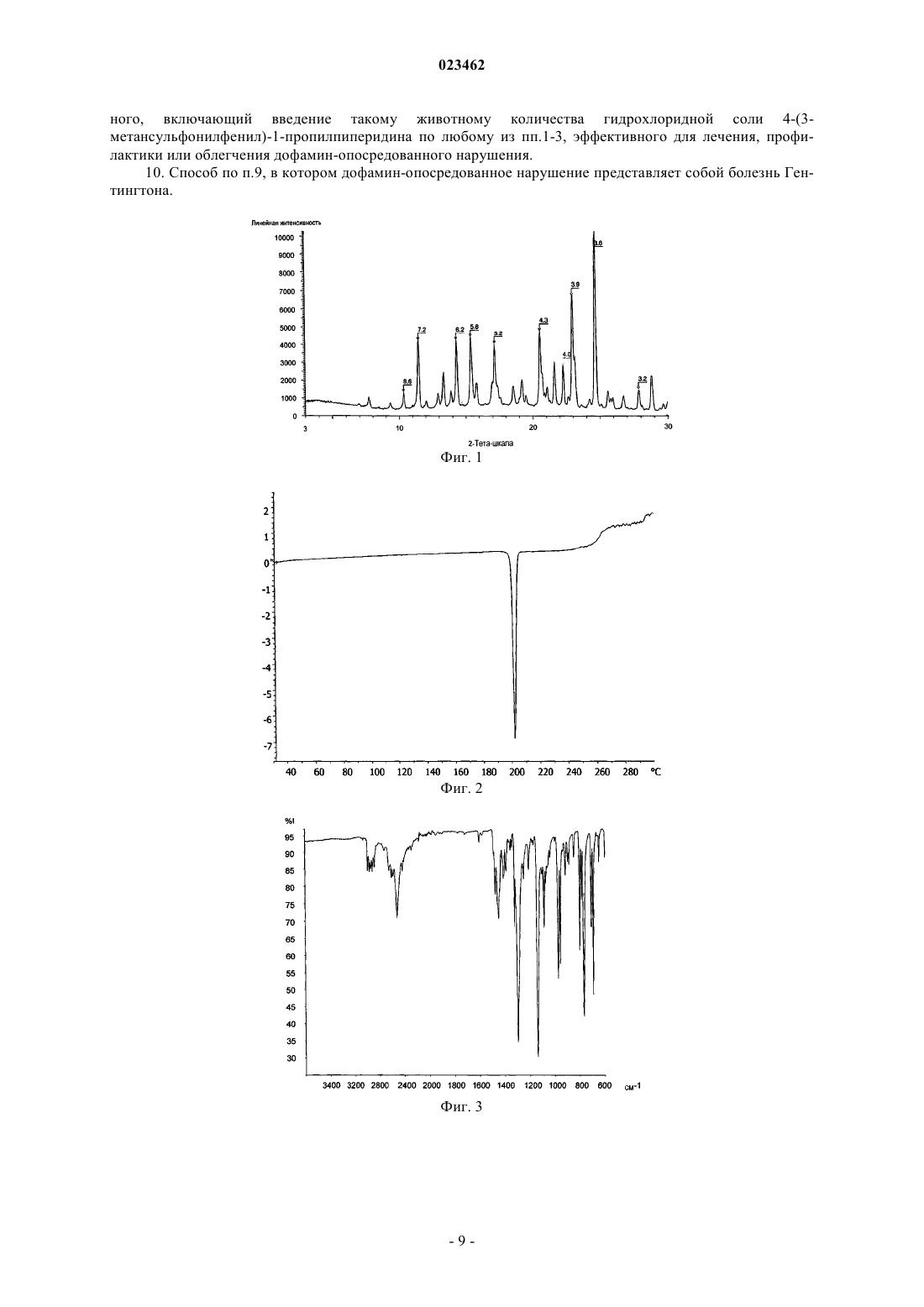
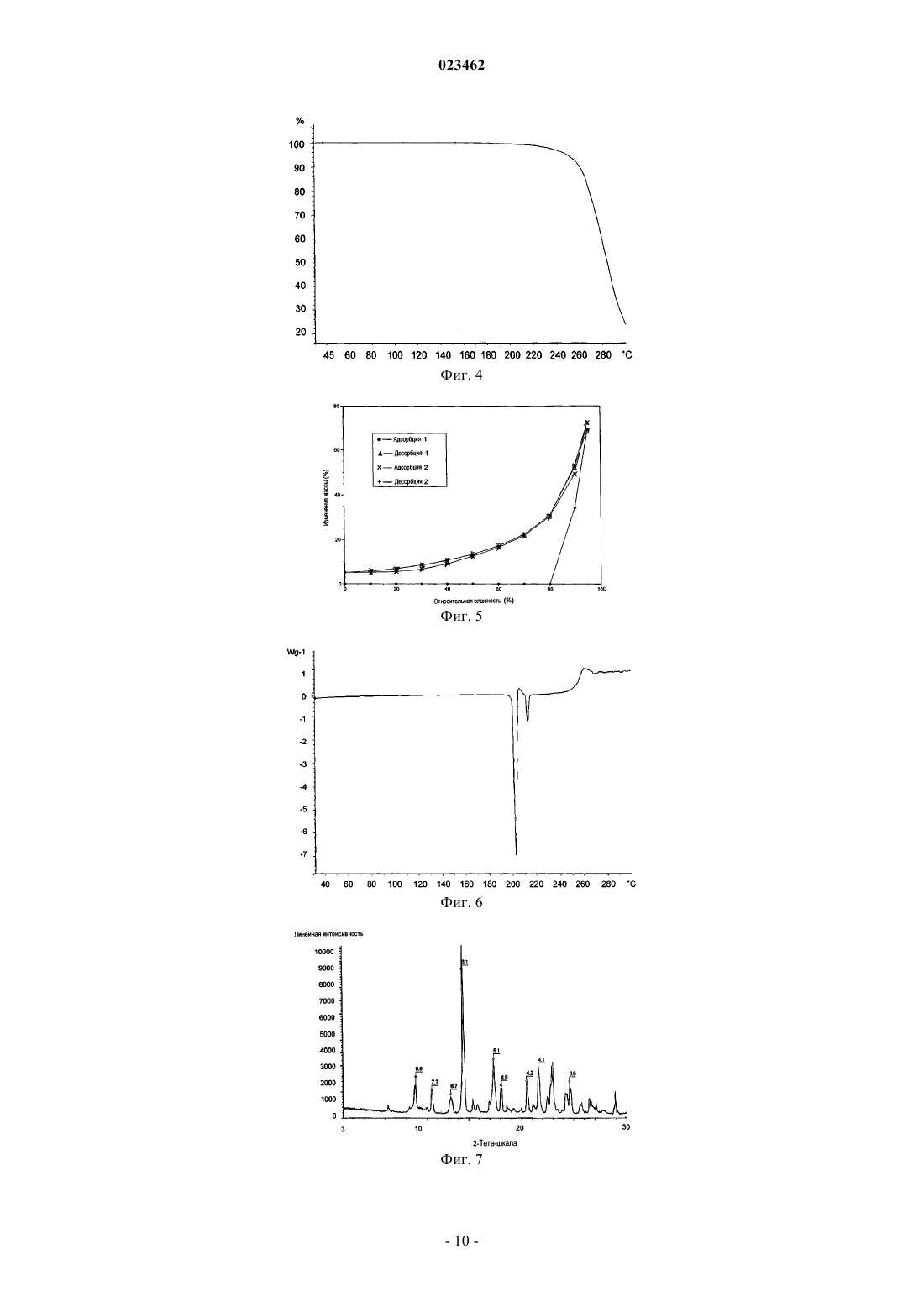
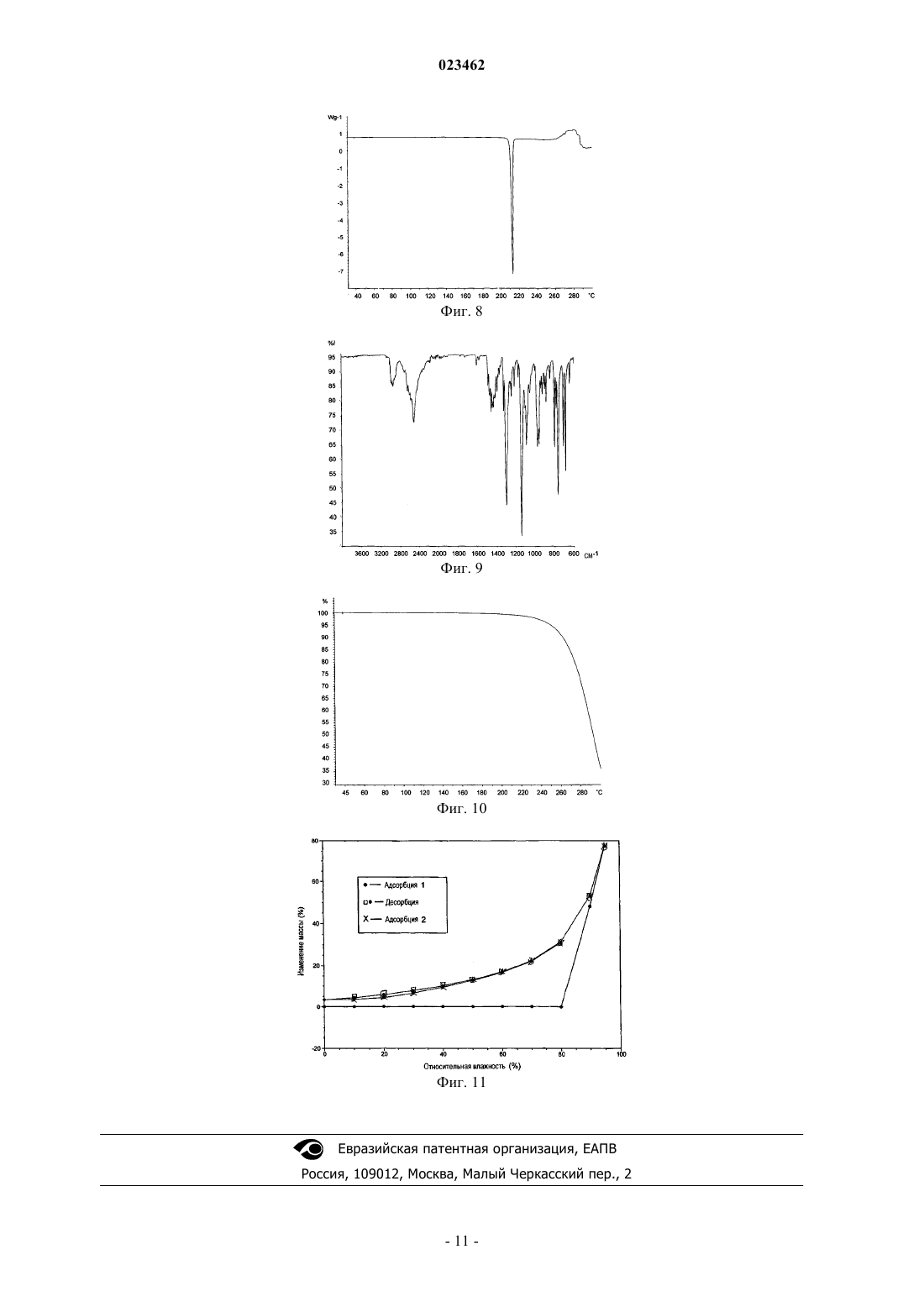
ПОЛИМОРФНАЯ ФОРМА ГИДРОХЛОРИДА ПРИДОПИДИНА Настоящее изобретение относится к новой кристаллической форме придопидина, лекарственному веществу, в настоящее время находящемуся на стадии разработки для лечения болезни Хантингтона. Более конкретно изобретение относится к полиморфной форме II гидрохлоридной соли придопидина, процессу получения такой полиморфной формы, фармацевтическим композициям, содержащим полиморфную форму II, и способам применения такой полиморфной формы.(71)(73) Заявитель и патентовладелец: ТЕВА ФАРМАСЬЮТИКАЛЗ ИНТЕРНЭШНЛ ГМБХ (CH) Область техники Настоящее изобретение относится к новой кристаллической форме придопидина, лекарственного вещества, в настоящее время находящегося на стадии разработки для лечения болезни Хантингтона. Более конкретно изобретение обеспечивает полиморфную форму II гидрохлоридной соли придопидина,процесс получения такой полиморфной формы, фармацевтические композиции, содержащие полиморфную форму II, и способы применения такой полиморфной формы. Уровень техники Полиморфизм в науке о материалах является способностью твердого материала существовать в более чем одной кристаллической форме, каждая из которых имеет различные ориентации и/или конформации молекул в кристаллической решетке. Полиморфизм имеет значение в разработке фармацевтических ингредиентов в связи с тем, что каждый полиморф проявляет уникальный набор физикохимических свойств ввиду различий в структурах кристаллов. Таким образом, растворимость и скорость растворения у полиморфов могут варьироваться, приводя к разности потенциалов в биодоступности. Кроме того, могут отличаться механические свойства, такие как текучесть и уплотняемость, которые воздействуют на технологические свойства соединения. Стабильность и продолжительность хранения соединения могут также зависеть от выбранного полиморфа. По этим причинам чрезвычайно важно выявлять существование различных полиморфных форм и давать характеристику обнаруженным формам. Выбор различных полиморфных форм обеспечивает новые возможности для повышения эффективности фармацевтического препарата. Полиморфный эффект химического синтеза определяют с помощью условий кристаллизации, таких как выбор растворителя (ей), скорость добавления растворителя, температура, скорость перемешивания,уровень перенасыщения и уровень загрязнения. Таким образом, различные процессы кристаллизации могут приводить к созданию различных полиморфов. Полиморфы также имеют различную стабильность и могут спонтанно превращаться из одной формы в другую. Полиморфы можно отличать друг от друга различными методами. Полиморфы отчетливо проявляют спектроскопические свойства, и их можно определять с использованием инфракрасной спектроскопии, рамановской спектроскопии и 13 С-ЯМР-спектроскопии. Ввиду того факта, что каждая кристаллическая форма преломляет рентгеновские лучи по-разному, для определения также можно использовать порошковую рентгеновскую дифракцию (ПРД). Кроме того, термические методы, такие как дифференциальная сканирующая калориметрия (ДСК) и термогравиметрический анализ (ТТА), могут обеспечить уникальную информацию по конкретному полиморфу. Придопидин, т.е. 4-(3-метансульфонилфенил)-1-пропилпиперидин, является лекарственным веществом, в настоящее время находящимся на стадии клинической разработки, для лечения болезни Хантингтона. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина и способ ее синтеза описаны в WO 01/46145. В WO 2006/040155 описан альтернативный способ синтеза 4-(3 метансульфонилфенил)-1-пропилпиперидина. При осуществлении данных методов синтеза результатом кристаллической фазы является температура плавления 199 С. Эта кристаллическая фаза обозначается формой I. Форма I гидрохлорида придопидина кристаллизуется в ромбической пространственной группеPna21 с параметрами кристаллической решетки a=10,5 , b=23,1 , с=6,9 , =90 С, =90C, =90 С и объемом клетки 1682 3. Форма I характеризуется с помощью рентгеновской порошковой дифрактограммы межатомным расстоянием в ангстремах, показанным в табл. 1 ниже, или дифрактограммой, по существу, такой, как изображено на фиг. 1; термограммой ДСК, по существу, такой, как показано на фиг. 2, с температурой начала эндотермического перехода, составляющей приблизительно 199 С; ИКспектром, по существу, таким, как изображено на фиг. 3; и термограммой ТГА, по существу, такой, как изображено на фиг. 4. Таблица 1 Согласно профилю динамической сорбции паров (DVS), форма I является негигроскопичной с относительной влажностью менее 80%, но растворяющейся за счет поглощения влаги при относительной влажности более 80% (фиг. 5). На ТГА показана форма I, являющаяся несольватированной формой (фиг. 4). Форма I легко растворима в водных жидкостях, обладая растворимостью в воде более 200 мг/мл. Размер частиц и распределение по форме для формы I исследовали с использованием анализа изображений и представили в табл. 2 ниже. D50 составляет 21 мкм, D10 и D90 составляют 9 и 42 мкм соответственно. Соотношение сторон (СС) получают путем разделения самого длинного измерения частиц и самого короткого измерения частиц. Поскольку СС 50 составляет 3,1, частицы имеют игольчатую форму. Объемная плотность и плотность утряски формы I составляют 0,212 г/мл 2,2% и 0,264 г/мл 1,1% соответственно. Полиморфный скрининг проводили на гидрохлориде придопидина, включая различные способы кристаллизации, такие как суспендирование в органических растворителях, выпаривание растворителя,кристаллизация охлаждением, ускоренное охлаждение и добавление антирастворителя. Широкий выбор растворителей применялся с целью повышения шанса обнаружения новых полиморфных форм. Однако кроме известной формы I не было обнаружено других форм в процессе скрининга. Сущность изобретения Обнаружение новых полиморфных форм лекарственного вещества обеспечивает новые возможности усовершенствования эксплуатационных характеристик лекарственного средства. Ключевые параметры, такие как температура плавления, гигроскопичность и степень кристалличности имеют первостепенное значение в выборе наиболее подходящей формы лекарственного средства. Кроме того, объемные свойства, такие как размер частиц и форма, могут оказывать влияние на получение лекарственного средства. Продопидин находится на стадии разработки в качестве гидрохлоридной соли, и настоящее изобретение относится к кристаллической форме II гидрохлоридной соли. Эта кристаллическая форма не была обнаружена в ходе проведения синтеза, описанного в WO 01/46145 и WO 2006/040155 выше, и не была найдена в ходе полиморфного скрининга, который, как описано выше, предназначался для способствования кристаллизации новых твердых форм. Таким образом, существование формы II не является очевидным. По настоящему изобретению определен новый полиморф гидрохлоридной соли 4-(3 метансульфонилфенил)-1-пропилпиперидина и обеспечен процесс его получения. В другом аспекте фармацевтические композиции, содержащие терапевтически эффективное количество гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению, вместе с одним или несколькими адъювантами, эксципиентами, носителям и/или разбавителями. С точки зрения другого аспекта изобретение относится к гидрохлориду 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению для применения в качестве лекарственного средства. В дополнительном аспекте изобретение относится к способу лечения, профилактики или облегчения дофамин-опосредованного нарушения, этот способ включает стадию введения такому нуждающемуся в этом живому организму животного терапевтически эффективного количества гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению. Другие цели по изобретению будут очевидны специалисту в данной области из следующего подробного описания и примеров. Подобное описание изобретения Придопидин является дофаминергическим стабилизатором, в настоящее время находящимся на стадии разработки для лечения болезни Хантингтона. Лекарственное вещество является слабой основой в форме третичного амина с рассчитанным значением pKa, составляющим 8,9. 4-(3-Метансульфонилфенил)-1-пропилпиперидин; придопидин. Новая кристаллическая форма гидрохлорида придопидина, форма II, была обнаружена в ходе анализа ДСК формы I. Для некоторых партий формы I согласно термограмме ДСК температура начала эндотермического перехода составила приблизительно 210 С, после эндотермического плавления формы I приблизительно 199 С (фиг. 6). Это указало на существование новой кристаллической фазы. С целью отделения кристаллической фазы образец формы I нагревали до 203 С, а затем охлаждали. Согласно ПРД, получившейся в результате твердой фазы, образовалась новая твердая форма, и эта форма обозначена формой II. Таким образом, в первом аспекте изобретение обеспечивает новую кристаллическую форму, форму В предпочтительном варианте осуществления кристаллическая форма II представлена в безводной форме. В другом предпочтительном варианте осуществления кристаллическая форма II представлена в безводной форме и несольватированной форме. Кристаллическая форма II по изобретению характеризуется с помощью рентгеновской порошковой дифрактограммы межатомным расстоянием в ангстремах, показанным в табл. 3 ниже, или дифрактограммой, по существу, такой, как изображено на фиг. 7. Таблица 3 Таким образом, в третьем предпочтительном варианте осуществления кристаллическая гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению характеризуется порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 6,1 и 4,9. В более предпочтительном варианте осуществления кристаллическая форма II по изобретению характеризуется порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 8,9 и 4,1. В третьем более предпочтительном варианте осуществления кристаллическая форма II по изобретению может характеризоваться порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 8,9, 7,7, 6,7, 6,1, 5,1, 4,9, 4,3, 4,1 и 3,6. В третьем предпочтительном варианте осуществления кристаллическая форма II по изобретению может характеризоваться термограммой ДСК, по существу, такой, как показано на фиг. 8. В четвертом предпочтительном варианте осуществления кристаллическая форма II по изобретению может характеризоваться температурой начала эндотермического перехода, составляющей приблизительно 210 С, как получено с помощью ДСК. В пятом предпочтительном варианте осуществления кристаллическая форма II по изобретению может характеризоваться ИК-спектром, по существу, таким, как изображено на фиг. 9. В шестом предпочтительном варианте осуществления кристаллическая форма II по изобретению может характеризоваться термограммой ТГА, по существу, такой, как изображено на фиг. 10. Форма II кристаллизуется в моноклининой пространственной группе P21/C с параметрами кристаллической решетки а=12,2 , b=13,5 , с=10,2 , =90 С, =91,1 С, =90 С и объемом клетки 1685 3. Согласно профилю динамической сорбции паров (DVS), форма II является негигроскопичной с относительной влажностью менее 80%, но растворяющейся за счет поглощения влаги при относительной влажности более 80% (фиг. 11). Согласно ТГА форма II является несольватированной формой (фиг. 10), и анализ по методу Карла-Фишера подтвердил безводную природу соли. Растворимость формы II при комнатной температуре не смогли определить, так как форма II быстро переходит в форму I при воздействии растворителя. Только одна полиморфная форма является термодинамически стабильной при данной температуре. Таким образом, представляет интерес определение полиморфа, являющегося наиболее стабильным при температуре окружающей среды, и того, насколько на отношения стабильности между полиморфами оказывает влияние изменение температуры. Стабильность при температуре окружающей среды определяли под воздействием на обе формы растворителя для образования взвеси. При воздействии растворителя происходил быстрый переход формы II в форму I, и исходя из этого форма I является стабильной формой при температуре окружающей среды. Относительную термодинамическую стабильность форм как функцию температуры исследовали на основе температурных данных. Согласно правилу теплоты плавления, предложенному BurgerRamberger (Burger A and Ramberger R: On the polymorphism of Pharmaceuticals and other molecular crystals; I. Mikrochim. Acta. II 1979 259-271,), полиморфы являются энантиотропически связанными, так как форма II имеет более высокую температуру плавления и более низкую теплоту плавления, чем форма I. Форма I имеет температуру плавления 199 С и теплоту плавления 34,8 кДж/моль, в то время как форма II имеет температуру плавления 210 С и теплоту плавления 32,0 кДж/моль, как определено с помощью ДСК. В седьмом предпочтительном варианте осуществления кристаллическая гидрохлоридная соль 4-(3 метансульфонилфенил)-1-пропилпиперидина по изобретению характеризуется термограммой ДСК, по существу, такой, как описано на фиг. 8, и температурой начала эндотермического перехода, составляющей приблизительно 210 С. Когда обе формы энантиотропически связаны, представляет интерес определение температуры перехода (Tt) с целью контроля результата синтеза и фармацевтической обработки. В Lian Yu (Yu L: Inferring thermodynamic stability relationship of polymorphs from melting data; J. Pharm. Sci. 1995 84 966-974) предложена модель, в которой Tt можно рассчитать на основе температуры плавления и теплоты плавле-3 023462 ния. Применяя этот способ, получали Tt 127 С. С целью экспериментального подтверждения этого открытия проводили эксперимент по затравке, при котором смеси двух форм суспендировали в органическом растворителе в течение 4 ч при различных температурах. После суспендирования идентичность получаемой твердой фазы определяли посредством ПРД. При температурах ниже 125 С полиморфным эффектом была форма I, и при температурах выше 130 С результатом была форма II. Таким образом, исследование указывает на то, что форма I и II являются энантиотропически связанными, при этом форма I является наиболее стабильной формой при комнатной температуре, и форма I является наиболее стабильной формой при температурах выше 127 С. Размер частиц и распределение по форме для формы II исследовали с использованием анализа изображений, и они представлены в табл. 4 ниже. D50 составляет 170 мкм, D10 и D90 составляют 49 и 363 мкм соответственно. Соотношение сторон (СС) получают посредством разделения наиболее длинного измерения частиц с наиболее коротким измерением. Так как CC50 для формы II составляет 1,6 в сравнении с 3,1 для формы I, кристаллы формы II имеют менее угольчатую форму, чем кристаллы формы I. Это может представлять преимущество в отношении фармацевтической обработки, при которой известно, что частицы игольчатой формы воздействуют на текучесть и компрессионные свойства порошка. Таблица 4 Объемная плотность и плотность утряски формы II составляют 0,382 г/мл 0,3% и 0,486 г/мл 1,1% соответственно, что намного выше показателей плотности формы I (см. табл. 2). Это может подразумевать то, что, например, в ходе составления капсул, при котором можно использовать твердые желатиновые капсулы меньшего размера для введения такого же количества формы II по сравнению с формой I. Способы получения. Форма II гидрохлорида припопидина термодинамически стабильна при температуре свыше 127 С,и таким образом может быть возможным получение формы II, являющейся рекристаллизацией формы I при повышенной температуре. Однако попытка получить форму II рекристаллизацией формы I при температуре выше 127 С без добавления затравочных кристаллов формы II потерпела неудачу. С целью успешного приготовления формы II необходимо получить затравочные кристаллы формыII путем нагрева твердой формы I до 203 С для расплава формы I и рекристаллизации до образования формы II с последующим охлаждением. Это было осуществлено в печи ТГА. Затравочные кристаллы,полученные таким образом, использовали для получения формы II. Форму I растворяли в 1,2-дихлорбензоле при 165 С до образования чистого раствора. Добавляли затравочные кристаллы формы II, и затравливаемый раствор оставляли для кристаллизации при 165 С. Образовавшуюся суспензию фильтровали при 150 С, и кристаллы сушили в вакууме. Биологическая активность. Во всех WO 01/46145, WO 01/46146, WO 2005/121087, WO 2007/042295 WO 2008/127188 и WO 2008/155357 замещенные 4-фенил-N-алкилпиперазины и 4-фенил-N-алкилпиперидины описаны как модуляторы дофаминовой нейротрансмиссии и являются пригодными в лечении симптомов различных нарушений центральной нервной системы. Считается, что гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению является пригодной для тех же медицинских показаний,как описано в этих публикациях, и эти публикации, таким образом, включены посредством ссылки. Предполагаемые согласно этим публикациям неврологические показания включают лечение болезни Хантингтона и других двигательных нарушений, а также двигательных нарушений, индуцированных лекарственными средствами. Таким образом, в предпочтительном варианте осуществления изобретение относится к использованию гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению для применения в качестве лекарственного средства для лечения болезни Хантингтона. Фармацевтические композиции. С точки зрения другого аспекта изобретение относится к гидрохлоридной соли 4-(3 метансульфонилфенил)-1-пропилпиперидина или ее сольвату в кристаллической форме (форме II) для применения в качестве лекарственных средств. Таким образом, в другом аспекте изобретение относится к новым фармацевтическим композициям, содержащим терапевтически эффективное количество соединения по изобретению. В то время как соединение по изобретению для применения в терапии можно вводить в форме сырого химического соединения, предпочтительным является введение активного ингредиента, необяза-4 023462 тельно в форме физиологически приемлемой соли, в фармацевтической композиции вместе с одним или несколькими адъювантами, эксципиентами, носителями, буферами, разбавителями и/или другими общепринятыми фармацевтическими вспомогательными средствами. Фармацевтические композиции по изобретению можно, в частности, составлять, как описано в WO 01/46145. Более подробное описание методов для состава и введения можно найти в последнем издании Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, штат Пенсильвания). Вводимая доза должна, конечно, быть тщательно скорректирована с учетом возраста, массы и состояния индивидуума, проходящего лечение, а также способа введения, лекарственной формы и схемы лечения и желаемого результата, и точную дозировку следует, конечно, определять практикующему врачу. Конкретная доза зависит от природы и степени тяжести подвергаемого лечению заболевания, назначается на усмотрение врача и может варьироваться посредством титрации дозы, исходя из конкретных обстоятельств по настоящему изобретению для получения желаемого терапевтического эффекта. Однако к настоящему времени предполагается, что фармацевтические композиции, содержащие от приблизительно 1 до приблизительно 500 мг активного ингредиента на индивидуальную дозу, предпочтительно от приблизительно 10 до приблизительно 100 мг, наиболее предпочтительно от приблизительно 25 до приблизительно 50 мг, являются подходящими для видов терапевтического лечения. Суточную дозу предпочтительно вводить индивидуальными дозировками от 1 до 4 раз ежедневно. Способы терапии. В другом аспекте изобретение относится к способу для лечения, профилактики или облегчения дофамин-опосредованного нарушения в живом организме животного, включая человека, этот способ включает стадию введения такому нуждающемуся в этом организму животного терапевтически эффективного количества гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по изобретению. В предпочтительном варианте осуществления дофамин-опосредованным нарушением является болезнь Хантингтона. Краткое описание чертежей Настоящее изобретение также проиллюстрировано со ссылкой на сопутствующие чертежи, на которых на фиг. 1 представлена отличительная порошковая рентгеновская дифракционная картина кристаллической формы I гидрохлорида придопидина; на фиг. 2 - отличительная термограмма ДСК кристаллической формы I гидрохлорида придопидина; на фиг. 3 - отличительный ИК-Фурье спектр кристаллической формы I гидрохлорида придопидина; на фиг. 4 - отличительная термограмма ТГА кристаллической формы I гидрохлорида придопидина; на фиг. 5 - отличительный профиль динамической сорбции паров (DVS) кристаллической формы I гидрохлорида придопидина в диапазоне относительной влажности 0-95%; на фиг. 6 - термограмма ДСК кристаллической формы I гидрохлорида придопидина, где присутствует эндотермичность, характерная как для формы I (199 С), так и формы II (210 С); на фиг. 7 - отличительная порошковая рентгеновская дифракционная картина кристаллической формы II гидрохлорида придопидина; на фиг. 8 - отличительная термограмма ДСК кристаллической формы II гидрохлорида придопидина; на фиг. 9 - отличительный ИК-Фурье спектр кристаллической формы II гидрохлорида придопидина; на фиг. 10 - отличительная термограмма ТГА кристаллической формы II гидрохлорида придопидина и на фиг. 11 - отличительный профиль динамической сорбции паров (DVS) кристаллической формыII гидрохлорида придопидина в диапазоне относительной влажности 0-95%. Примеры Изобретение также проиллюстрировано с ссылкой на следующие примеры, не предназначенные для ограничения каким-либо образом объема изобретения по формуле изобретения. Пример 1. Получение формы II придопидина. Для получения формы II в больших объемах (граммах) необходимо сначала получение затравочных кристаллов формы II в масштабе миллиграмм. Это осуществили посредством нагрева твердой формы I до 203 С для расплава формы I и последующей рекристаллизации до образования формы II с последующим охлаждением. Это происходило в печи ТГА. Таким образом, приблизительно получали 10 мг формы II. Для получения формы II 15 г придопидина формы I растворяли в 375 мл 1,2-дихлорбензола при нагреве до кипения с обратным холодильником при приблизительно 180 С. Образовался чистый раствор при приблизительно 165 С. Раствор переносили в масляную баню с 165 С и добавляли затравочные кристаллы придопидина формы II. Перемешивание начали, как только начали расти затравочные кристаллы. В течение 30 мин температуру понижали до 150 С. Спустя еще 30 мин суспензию фильтровали при 150 С с последующей промывкой гептаном. Кристаллы сушили в вакууме: температура плавления 210 С. Результаты CHN-анализа приведены ниже в табл. 5. ЯМР 1 Н ЯМР (ДМСО-d6): 0,93 (3H, т), 1,73-1,79 (2 Н, м), 2,00-2,13 (4 Н, м), 2,96-3,06 (5 Н, м), 3,23 Пример 2. Полиморфный скрининг придопидина. Полиморфный скрининг проводили на придопидине для проверки возможности образования твердых форм альтернативно форме I различными способами кристаллизации с использованием различных растворителей. Применяли следующие растворители и смеси растворителей: Далее следует описание каждого эксперимента. Суспендирование в растворителях. Исходное количество придопидина добавляли в маленькие чистые пластиковые флаконы Eppendorf. Добавляли соответствующий растворитель/смесь растворителей и помещали флакон на ротамиксер на ночь. Если за это время наблюдали чистый раствор, то добавляли больше соединения и флакон возвращали на ротамиксер. Это продолжали до тех пор, пока раствор, содержащий твердый придопидин, не наблюдали во всех флаконах. Общее время установления равновесия составило 7 суток. Высушенный осадок исследовали с помощью ПРД. Выпаривание растворителя. Супернатанты, собранные во время экспериментов по суспендированию, накрывали перфорированным парафильмом и оставляли при комнатной температуре в темноте. Высококипящие растворители выпаривали в вакуумном сушильном шкафу при 40 С. Высушенный осадок анализировали с помощью ПРД. Кристаллизация охлаждением. Насыщенные растворы придопидина получали в хороших растворителях при 50 С с использованием водяной бани. Растворы накрывали и оставляли в холодильнике на неделю. Высушенные осадки анализировали с помощью ПРД. Ускоренное охлаждение. Насыщенные растворы придопидина получали в хороших растворителях при 50 С с использованием водяной бани. Растворы ускоренно охлаждали, помещая их в сухую смесь ледяной соли на несколько минут. Если осаждение не возникало мгновенно, растворы хранили в морозильной камере до следующих суток. Супернатант удаляли и высушенный материал анализировали с помощью ПРД. Осаждение нерастворителем. Насыщенные растворы придопидина получали в хороших растворителях при 50 С с использованием водяной бани. К этим растворам добавляли по каплям холодные (комнатной температуры) нерастворители, пока объем раствора не увеличился вдвое. Супернатант удаляли и высушенный материал анали-6 023462 зировали с помощью ПРД. Компрессия. Порошком придопидина наполняли пуансон гидравлического ИК-пресса. Пуансон помещали в пресс и порошок подвергали компрессии в течение 24 ч при 10 Т. Спрессованный материал анализировали с помощью ПРД. Согласно ПРД анализам все образованные материалы являлись формой I. Пример 3. Аналитические способы. Порошковая рентгеновская дифракция. Эксперименты с помощью порошковой рентгеновской дифракции (ПРД) проводили с использованием дифрактометра Bruker D8 Advance, с конфигурацией как указано ниже: Образец помещали на держатель образца кремниевого монокристалла с нулевым фоном в тонкой вазелиновой пленке. Дифрактограммы получали с использованием Bruker "XRD Commander", версии 2.6.1, и оценивали с использованием "Bruker Evaluation", версии 11,0,0,3. После этой процедуры получали межатомное расстояние в ангстремах, показанное в табл. 2, и дифракторграмму, показанную на фиг. 8. Дифференциальная сканирующая калориметрия. Эксперименты с помощью дифференциальной сканирующей калориметрии (ДСК) проводили на дифференциальном сканирующем калориметре Mettler Toledo DSC 821e, с использованием MettlerToledo StarE комплекса программного обеспечения версии 9,2. Образец (приблизительно 3 мг) нагревали в алюминиевом чрене с маленьким отверстием от 30 до 300 С при 10 С/мин. ДСК непрерывно очищали сухим азотом и в установленном порядке калибровали с помощью индия и цинка. После этой процедуры получали термограмму ДСК, показанную на фиг. 9. Термогравиметрический анализ. Эксперименты по термогравиметрическому анализу (ТГА) проводили на Mettler Toledo TGA/SDTA 851 е. Образец (приблизительно 10 мг) нагревали в открытом алюминиевом тигеле от 30 до 300 С при 10 С/мин. ТГА непрерывно очищали сухим азотом и в установленном порядке калибровали с помощью индия и алюминия. Данные оценивали с использованием Mettler-Toledo StarE комплекса программного обеспечения версии 9,2. После этой процедуры получали термограмму ТГА, показанную на фиг. 11. ИК-Фурье спектроскопия. Эксперименты с помощью ИК-Фурье спектроскопии (FTIR) проводили на ИК-Фурье инструментеPerkin-Elmer Spectrum One, оборудованном установкой нарушенного полного отражения (ATR) Goldengate от Specac. Контроль системы осуществляли с помощью спектра версии 5.0.1 программного обеспечения. Образцы (приблизительно 1-2 мг) помещали непосредственно на алмазную поверхность устройства ATR и прижимали плотно к образцу. Образцы анализировали в диапазоне волновых чисел 4000-600 см-1. Инструмент в установленном порядке калибровали через внутренние полистирольные фильтры. После этой процедуры получали ИК-Фурье спектр кристаллической формы II гидрохлорида придопидина, показанный на фиг. 10. Титрация по методу Карла-Фишера. Определение содержания воды с использованием титрации по методу Карла-Фишера (КФ) проводили с использованием кулометра Metrohm KF 756 KF, оборудованного генератором с электродами без диафрагмы. Титратор был оборудован печью Metrohm 832 KF Thermoprep oven. Образец отвешивали в маленькие ВЭЖХ стеклянные флаконы, запечатывали и вводили в печь (130 С). Здесь использовали иглу для пункции резиновой прокладки ВЭЖХ флакона и использовали сухой газ-носитель (N2) для высвобождаемой воды через нагретую трубу к титрационной камере. Перед титрацией образца протитровали ряд нулевых проб для определения нулевого уровня. Результаты автоматически корректировали для пустого значения. Инструмент в установленном порядке контролировали с использованием стандартов на твердые вещества с утвержденным содержанием воды. Измерения профиля динамической сорбции паров. Измерения профиля динамической сорбции паров (DVS) проводили с использованием Q5000 SA из приборов термического анализа. Эксперименты проводили в два цикла сорбции/десорбции с относительной влажностью от 0 до 95%. До первого цикла сорбции образец уравновешивали при относительной влажности 20% и записывали первоначальную массу. Образцы анализировали в алюминиевом чрене. Влажность снижали до 0% и образец сушили до стабилизации массы в пределах указанного лимита. Температуру поддерживали постоянной на уровне 25 С. Максимальное время стадии составило 720 мин. Поток газа составил 200 см 3/мин. После этой процедуры получали DVS профили, показанные на фиг. 12.Copenhagen с использованием анализатора Flash EA 1112. Приблизительно 2 мг соединения взвешивали в маленьком оловянном стакане и помещали в камеру сгорания. Полученные в результате газы собирали в колонку и анализировали с помощью газовой хроматографии. Анализы проводили в двух повторениях. Анализ изображений. Микроскопический анализ проводили с использованием микроскопа Zeiss Axiolab (Carl Zeiss,г.Геттинген, Германия). Микрофотографии были сделаны с использованием цифровой камеры DeltaPix и версии программного обеспечения 1,6 Deltapix (Maaloev, Дания). 5 увеличение объектива (1,626 мкм/пиксель) использовали без иммерсионного масла и 40 увеличение объектива (0,208 мкм/пиксель) использовали с парафиновым маслом в качестве иммерсионного масла. Размер частиц определяли с использованием программного обеспечения Motic Image Plus 2,0 (Motic Group Inc., Китай), откалиброванного для изображений с соответствующим масштабом, сделанных с использованными объективами. Распределение размера частиц и распределение соотношения сторон рассчитывали с использованием версииMatlab 2009b (Mathworks Inc., США). Объемная плотность и плотность утряски. Определение плотности проводили, как описано в Ph. Eur. 2.9.34. Способ был изменен, так как количество образца, помещенного в 250 мл мерный стеклянный цилиндр составляло 50,0 г и осуществляли 2500 встряхиваний при 100 ударов/мин. Измерения проводили в трех повторениях. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина в кристаллической форме, причем кристаллическая форма представляет собой кристаллическую форму II, характеризуемая порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 8,9 и 4,1 или 6,1 и 4,9, или ее сольват. 2. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина по п.1, где кристаллическая форма является безводной. 3. Гидрохлоридная соль 4-(3-метансульфонилфенил)-1-пропилпиперидина в кристаллической форме по п.1 или 2, характеризуемая порошковой рентгеновской дифракционной картиной, отражающей соответствующие значения межатомного расстояния в ангстремах 6,1 и 4,9 и 8,9 и 4,1. 4. Фармацевтическая композиция для лечения, профилактики или облегчения дофаминопосредованного нарушения, содержащая терапевтически эффективное количество гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина или ее сольвата по любому из пп.1-3 вместе с одним или несколькими адъювантами, эксципиентами, носителями и/или разбавителями. 5. Фармацевтическая композиция по п.4, в которой терапевтически эффективное количество 4-(3 метансульфонилфенил) -1-пропилпиперидина составляет от 1 до 500 мг. 6. Фармацевтическая композиция по п.4, в которой терапевтически эффективное количество 4-(3 метансульфонилфенил)-1-пропилпиперидина составляет от 10 до 100 мг. 7. Фармацевтическая композиция по п.4, в которой терапевтически эффективное количество 4-(3 метансульфонилфенил)-1-пропилпиперидина составляет от 25 до 50 мг. 8. Применение гидрохлоридной соли 4-(3-метансульфонилфенил)-1-пропилпиперидина по любому из пп.1-3 в получении лекарственного средства для облегчения симптомов, лечения или профилактики дофамин-опосредованного нарушения. 9. Способ лечения, профилактики или облегчения дофамин-опосредованного нарушения у живот-8 023462 ного, включающий введение такому животному количества гидрохлоридной соли 4-(3 метансульфонилфенил)-1-пропилпиперидина по любому из пп.1-3, эффективного для лечения, профилактики или облегчения дофамин-опосредованного нарушения. 10. Способ по п.9, в котором дофамин-опосредованное нарушение представляет собой болезнь Гентингтона.
МПК / Метки
МПК: A61P 25/28, C07D 211/24, A61K 31/445
Метки: гидрохлорида, полиморфная, придопидина, форма
Код ссылки
<a href="https://eas.patents.su/12-23462-polimorfnaya-forma-gidrohlorida-pridopidina.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфная форма гидрохлорида придопидина</a>
Предыдущий патент: Способ получения металлургического кокса
Следующий патент: Производные бетулиновой кислоты с противовирусной активностью
Случайный патент: Удаление мочевины и аммиака из отработанных газов