Полиморфная форма гидрохлорида дабигатрана этексилата
Номер патента: 22496
Опубликовано: 29.01.2016
Авторы: Славик Ласло, Обрецан Магдольна, Понго Ласло, Шлегель Петер, Лукач Дьюла, Кирай Имре, Баркоци Йожеф, Мезёвари Моника, Боза Андраш, Ружич Дьёрдь, Вольк Балаж, Сабо Тибор, Данчо Андраш, Тринка Петер
Формула / Реферат
1. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8
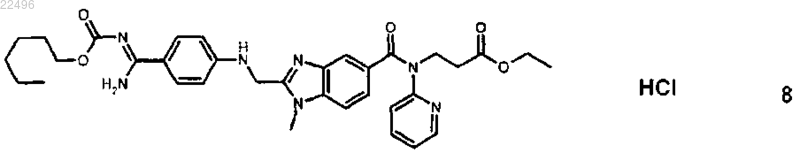
демонстрирующий рентгеновскую порошковую дифрактограмму с характеристическими пиками при угле отражения 2-тета (±0,2° 2-тета) примерно 4,720; 8,080; 15,340; 23,420.
2. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 по п.1, демонстрирующий рентгеновскую порошковую дифрактограмму с характеристическими пиками при угле отражения 2-тета (±0,2° 2-тета) примерно 4,720; 8,080; 9,540; 10,480; 11,320; 15,340; 18,460; 19,140; 23,420.
3. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 по п.1 или 2, демонстрирующий рентгеновскую порошковую дифрактограмму в соответствии с фиг. 10 и следующей таблицей:
Положение пиков и относительная интенсивность (>6%)
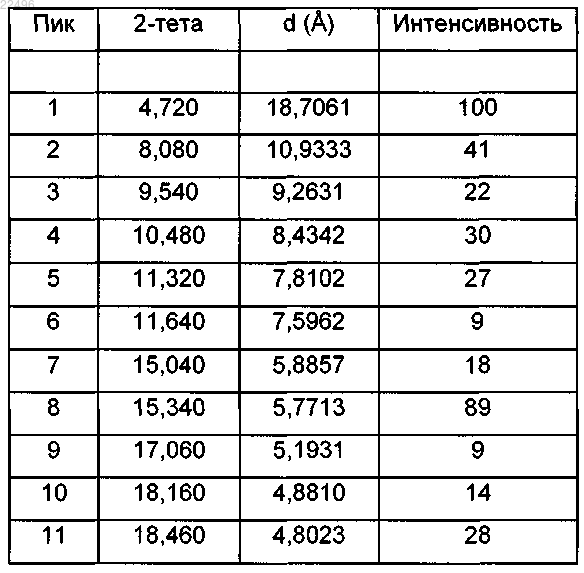
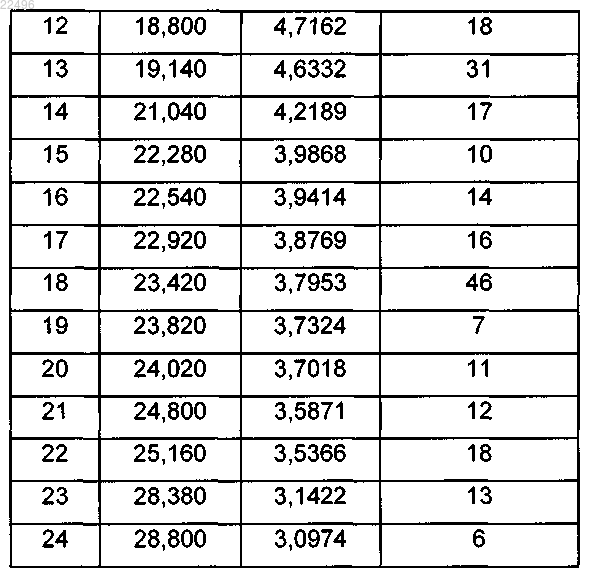
4. Способ получения гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3, который включает кристаллизацию любого полиморфного или аморфного основания дабигатрана этексилата или их смеси из полярного растворителя или смеси полярных растворителей в присутствии соляной кислоты.
5. Способ получения гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3, который включает кристаллизацию любой полиморфной или аморфной соли соляной кислоты и дабигатрана этексилата, ее сольвата, гидрата или их смесей из полярного растворителя или смеси полярных растворителей.
6. Применение гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3 в качестве лекарственного средства, обладающего эффектом ингибитора тромбина.
7. Фармацевтическая композиция, обладающая эффектом ингибитора тромбина, содержащая в качестве активного ингредиента терапевтически эффективное количество гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3 вместе с одним или более фармацевтически приемлемым наполнителем (наполнителями).
8. Применение композиции по п.7 для профилактики или лечения послеоперационных тромбозов глубоких вен и инсульта.
9. Применение гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3 для получения лекарственного средства для профилактики или лечения послеоперационных тромбозов глубоких вен и инсульта.
10. Способ профилактики и/или лечения послеоперационных тромбозов глубоких вен и инсульта, который включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3.
Текст
ПОЛИМОРФНАЯ ФОРМА ГИДРОХЛОРИДА ДАБИГАТРАНА ЭТЕКСИЛАТА Изобретение относится к новой полиморфной соли гидрохлориду дабигатрана этексилата формулы 11 и способу ее получения.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКЕДЕ РЕСВЕНЬТАРШАШАГ (HU) является пероральным антикоагулянтом, который обладает прямым эффектом ингибитора тромбина. Задачей настоящего изобретения является получение новой полиморфной формы соли дабигатрана этексилата и способ получения новой соли дабигатрана этексилата. Настоящее изобретение также относится к фармацевтическим препаратам, содержащим новую соль дабигатрана этексилата, и их применению для профилактики и лечения послеоперационного тромбоза глубоких вен и инсульта. Более подробно, целью настоящего изобретения является создание новой и морфологически равномерной полиморфы соли дабигатрана этексилата, образованной с соляной кислотой, способ ее получения, содержащая ее фармацевтическая композиция и ее применение для профилактики и лечения послеоперационных тромбозов глубоких вен и инсульта. Существующий уровень техники Дабигатрана этексилат был впервые описан в ЕР 966454 В 1 Хэуелом (Hauel) и соавторами. Согласно примеру 113 вышеуказанного патента, дабигатрана этексилат формулы 11 получают аналогичным образом в способе, описанном в примере 90 путем взаимодействия 1-метил-2-[N-(4 амидинофенил])аминометил]-5-бензимидазол-карбонат-N-(2-пиридил)-N-[2-(этоксикарбонил)этил]амидгидрохлорида и гексилхлорформиата. Приготовленное таким образом основание было охарактеризовано тонкослойной хроматографией и масс-спектрометрией. В приведенном описании нет данных, относящихся к кристаллографическим свойствам основания дабигатрана этексилата. Тот же способ, описанный в вышеуказанном патенте, раскрывается в публикации Хэуела и соавторов (J. Med. Chem. 2002, 45, 1757-1766), где основание дабигатрана этексилата характеризуется температурой плавления (128-129 С) и 1 Н-ЯМР (ядерный магнитный резонанс). Три полиморфных формы дабигатрана этексилата мезилата описаны в WO 2005/028468. Полиморфные формы, полученные из основания путем кристаллизации (форма I, II и полугидрат), были охарактеризованы порошковой рентгеновской дифрактограммой и кривыми дифференциальной сканирующей калориметрии. В WO 2006/114415 описаны 6 солей дабигатрана этексилата, такие как гидрохлорид, цитрат, тартрат, малонат, малеат и салицилат. Эти соли не были охарактеризованы порошковой рентгеновской дифрактограммой, только кривыми дифференциальной сканирующей калориметрии. Температуры плавления расположены по порядку следующим образом: 135, 170, 160, 100, 120, 155 С. В WO 2006/131491 описаны 3 полиморфных формы основания дабигатрана этексилата. Полиморфные формы, полученные путем кристаллизации, были охарактеризованы порошковой рентгеновской дифрактограммой, кривыми дифференциальной сканирующей калориметрии и измерением термогравиметрических данных. В WO 2008/043759 описаны другие соли дабигатрана этексилата и их полиморфные формы, такие как две полиморфы (I и II) соли, образованной с фосфорной кислотой, две полиморфы (III и IV) соли,образованной с фумаровой кислотой, три полиморфы (I, II и V) соли, образованной с щавелевой кислотой, три полиморфы (II, V и VI) соли, образованной с соляной кислотой, и четыре полиморфы (I, V, VI иVII) соли, образованной с п-толуолсульфоновой кислотой. Полиморфные формы были охарактеризованы порошковой рентгеновской дифрактограммой. Кроме того, форма IV соли, образованной с фумаровой кислотой, и четыре формы соли (I, V, VI и VII), образованной с п-толуолсульфоновой кислотой, также были охарактеризованы кривыми дифференциальной сканирующей калориметрии. В WO 2008/059029 описаны еще две безводные формы и три сольвата основания дабигатрана этексилата. Безводные формы II и IV, моногидратные формы I и II и сольват нитробензола формы I были охарактеризованы порошковой рентгеновской дифрактограммой и кривыми дифференциальной сканирующей калориметрии. Краткое изложение сущности изобретения Несмотря на тот факт, что много солей дабигатрана этексилата и их полиморфных форм уже известно, было неожиданно обнаружено, что могут быть получены некоторые новые химически и морфологически стабильные соли дабигатрана этексилата и их полиморфные формы. Объектом настоящего изобретения является новая полиморфная форма соли дабигатрана этексилата и способ ее получения. Настоящее изобретение также относится к фармацевтическим препаратам, содержащим новую соль дабигатрана этексилата, и их применению для профилактики и лечения послеоперационных тромбозов глубоких вен и инсультов. Солью дабигатрана этексилата настоящего изобретения является соль соляной Детальное описание изобретения В последнее время в фармацевтической промышленности появился серьезный спрос на способ,обеспечивающий продукт воспроизводимым образом, в морфологически однородном и чистом виде, в целях удовлетворения строгих требований фармацевтических стандартов. Известно, что различные полиморфные формы демонстрируют разницу в важных характеристиках, таких как время растворения,биологический выход и химическая стабильность. Получение морфологически однородного продукта важно также с технологической точки зрения,учитывая, что полиморфные формы имеют различные технологические свойства (при фильтрации, сушке, растворении и таблетировании). Более того, с экономической точки зрения очень важно, чтобы способ подходил для промышленного масштабирования, мог быть легко воспроизведен, и приводил к морфологически однородному продукту. До сих пор ни один способ для приготовления морфологически однородных солей дабигатрана, образующихся с серной или малеиновой кислотой, не был описан в литературе, и никаких аналитических данных (ИК-спектр, порошковые рентгеновские дифрактограммы или монокристаллические рентгеновские дифрактограммы), служащих для характеристики кристаллических форм не было предоставлено. Целью настоящего изобретения было создание морфологически однородной соли дабигатрана этексилата, которая отвечает фармацевтическим требованиям к физико-химическим свойствам и стабильности и которая может быть получена воспроизводимым способом даже в промышленном масштабе. Вышеупомянутая цель была достигнута путем получения новой кристаллической формы соли дабигатрана этексилата при помощи соляной кислоты, и способом ее получения. Неожиданно было обнаружено, что вышеупомянутая новая соль дабигатрана этексилата может быть получена в новой форме, которая морфологически однородна, а характеристика порошковой рентгеновской дифрактограммы и данные ДСК (дифференциальная сканирующая калориметрия) отличаются от данных характеристик известных форм солей дабигатрана этексилата. Объектом настоящего изобретения является гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8. На фиг. 1 показана порошковая рентгеновская дифрактограмма соли соляной кислоты, а в табл. 1 приведена характеристика пиков порошковой рентгеновской дифрактограммы. Таблица 1. Положение пиков и относительная интенсивность (6%). Условия измерения порошковой рентгеновской дифрактограммы были следующие: Аппарат: порошковый дифрактометр Miniflex II (корпорация Ригаку, Rigaku Corporation); Облучение: Toshiba A-20, CuK1 ( =1,54059 ), CuK2 (=1,54439 ); Напряжение: 30 кВ; Анодный ток: 15 мА; Аксессуары: щели Сольера, автоматическая смена образца; Стандартный образец: SRRP-432759, порошок кремния а = 5,430758 ; Измерение было устойчивым тета/тета сканированием: 4-50,00 2-тета; Размер шага: 0,02; Образец: не порошок; измеряли и хранили при комнатной температуре. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 настоящего изобретения имеет следующие наиболее характерные пики порошковой дифрактограммы: 2-тета ( 0,2 2-тета): 4,720; 8,080; 15,340; 23,420. Более детально, гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 настоящего изобретения имеет следующие наиболее характерные пики порошковой дифрактограммы: 2-тета (0,2 2 тета): 4,720; 8,080; 9,540; 10,480; 11,320; 15,340; 18,460; 19,140; 23,420. Термин "перекристаллизация", используемый в данном описании означает известный способ, при котором кристаллический продукт растворяют и получают заново в кристаллической форме. Кроме того,подразумевается способ, в котором известное полиморфное или аморфное соединение растворяют, и,путем перекристаллизации, получают различные полиморфные формы кристаллического соединения. Более того, термин "перекристаллизация" подразумевает способ, в котором известное полиморфное или аморфное соединение суспендируют в подходящем растворителе (растворимость 0,1-100 мг/мл при температуре рекристаллизации) при температуре, необходимой для изменения полиморфной формы, в течение достаточного времени и с добавлением затравочных кристаллов (если необходимо), предназначенных для того, чтобы вызвать и/или усилить преципитацию. После фильтрования суспензии, этот способ приводит к образованию кристаллического соединения с полиморфной формой, отличной от исходного соединения. Еще одним объектом настоящего изобретения является гидрохлорид дабигатрана этексилата (1:1)(форма IX) формулы 8. Было установлено, что рентгеновская порошковая дифрактограмма формы IX хлористоводородной соли отличается от известных хлористо-водородных солей дабигатрана этексилата,таких как формы II, V и VI, раскрытые в WO 2008/043759. Кроме того, температура плавления полиморфных форм по настоящему изобретению, которая была определена по максимуму пика кривой ДСК,следующая: форма IX: 181 С. Эта температура плавления отличается от температуры плавления формы I(135 С), раскрытой в WO 2006/114415. Известную форму I получают путем добавления соляной кислоты в этанол, формы II, V и VI получают добавлением соляной кислоты в смесь растворителей - ацетона и ТГФ, и перекристаллизацией сырого продукта, полученного выпариванием. Форму I получают суспен-3 022496 дированием продукта в этилацетате и ацетоне. Форму II перекристаллизовывают из 1,2-диметоксиэтана,форму V перекристаллизовывают из изопропилацетата, а форму VI перекристаллизовывают из ТГФ. Еще одним объектом настоящего изобретения является способ получения гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8. В соответствии с настоящим изобретением форму IX соли гидрохлорида получают, растворяя полиморфное или аморфное основание дабигатрана этексилата, его сольват, гидрат или их смесь в полярном растворителе или смеси полярных растворителей при температуре 25-110 С, и после растворения добавляют к смеси соляную кислоту. После охлаждения, раствор кристаллизуют при температуре 0-25 С в течение 8-168 часов. В соответствии с другим вариантом способа, полиморфную или аморфную соль соляной кислоты и дабигатрана этексилата, ее сольват, гидрат или их смесь суспендируют или растворяют в полярном растворителе или смеси полярных растворителей при температуре 25-110 С. Раствор кристаллизуют при температуре 0-25 С в течение 8-168 ч. Если необходимо, в смесь добавляют затравочные кристаллы. В соответствии с предпочтительным вариантом способа полиморфное или аморфное основание дабигатрана этексилата, его сольват, гидрат или их смесь или полиморфную или аморфную соль соляной кислоты и дабигатрана этексилата или их смесь суспендируют или растворяют в алифатическом спирте или смеси алифатических спиртов, или в алифатическом кетоне при температуре 25-110 С и далее к раствору добавляют смесь безводной или водной соляной кислоты и алифатического спирта или газообразной соляной кислоты. Раствор охлаждают и кристаллизуют при температуре 0-25 С в течение 8-168 ч. Если необходимо, в смесь добавляют затравочные кристаллы. Выпавший в осадок продукт отфильтровывают, промывают и сушат. Когда в качестве исходного соединения используют соли соляной кислоты и дабигатрана этексилата, дальнейшее добавление соляной кислоты не является необходимым. В соответствии с настоящим изобретением алифатический спирт, используемый при получении формы IX гидрохлорида дабигатрана этексилата, может быть выбран из С 1-4 спиртов, предпочтительно метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола или трет-бутанола, а наиболее предпочтительно этанола. Алифатический кетон может быть выбран из С 1-3 кетонов в виде цепи или кольца, предпочтительно метилэтилкетона, ацетона, циклогексанона, метилциклогексанона, а наиболее предпочтительно ацетона. В соответствии с наиболее предпочтительным вариантом способа полиморфное или аморфное основание дабигатрана этексилата, его сольват, гидрат или их смесь растворяют в этаноле при 40-45 С в присутствии изопропилового спирта, содержащего соляную кислоту. Раствор кристаллизуют при 0-5 С в течение 1-7 дней. Выпавший в осадок продукт отфильтровывают, промывают и сушат. Согласно другому варианту способа, полиморфную или аморфную соль соляной кислоты и дабигатрана этексилата, ее сольват, гидрат или их смесь растворяют в этаноле при 4 СМ 5 С. Раствор кристаллизуют при 0-5 С в течение 1-7 дней. Выпавший в осадок продукт отфильтровывают, промывают и сушат. Согласно другому варианту способа полиморфную или аморфную соль соляной кислоты и дабигатрана этексилата, ее сольват, гидрат или их смесь суспендируют в ацетоне при 20-30 С, и в смесь добавляют хлористоводородную соль формы IX. Раствор кристаллизуют при 20-30 С в течение 8-48 ч. Неожиданно было обнаружено, что новая полиморфа по настоящему изобретению обладает лучшими свойствами стабильности по сравнению со стабильностью известных полиморф в различных условиях хранения. Во время детального исследования было обнаружено, что новая форма IX соли соляной кислоты и дабигатрана этексилата (1:1) формулы 8 является более стабильной, чем форма II метансульфоновой кислоты (1:1), описанная в US 20050234104 и которая входит в состав "Прадакса" (Pradaxa). Форму II метансульфоновой кислоты (1:1) формулы 10 получают в соответствии с US20050234104. Были проведены сравнительные исследования термической стабильности формы II метансульфоновой кислоты (1:1) и формы IX соляной кислоты (1:1). Образцы хранили при температуре 40 С и при относительной влажности 75% в закрытом состоянии, и при 70 С в закрытых и открытых условиях в течение 6 недель. Состав образцовопределяли при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ) в начале эксперимента и по прошествии 6 недель; количества примесей свыше 0,03% по площади сложены вместе, и результирующие значения содержания примесей сравнили с результирующими значениями содержания примесей, измеряемыми в начальный момент, в соответствии со следующей формулой: Символы в приведенной выше формуле имеют следующее значение: ( примесей) [%] - увеличение количества суммарной примеси в процентах; (k примесей) - сумма суммарной примеси в начальный момент; (m примесей) - сумма суммарной примеси через 6 недель. Изменения значения количества суммарной примеси, рассчитанное по вышеприведенной формуле,-4 022496 приведено в табл. 15. Таблица 15. Изменение количества суммарной примеси при хранении Согласно табл. 15, в случае формы II соли метансульфокислоты и дабигатрана этексилата может наблюдается значительное увеличение (67%) количества суммарной примеси, особенно при умеренной температуре (40 С), в отличие от формы IX соли соляной кислоты с улучшенной температурной стабильностью; причем увеличение примеси не имеет существенного значения при этой температуре. Аналогичную тенденцию можно наблюдать во время хранения при температуре 70 С. Также было выполнено форсированное исследование стабильности (стресс-тест) выбранной соли дабигатрана этексилата, в котором образцы хранили при температуре 100 С в течение 24 ч, и изменение количества суммарной примеси ( примесей) и наиболее характерный продукт деградации, а именно соединение формулы 12 (12) были определены ЖХ/МС (жидкостная хроматография с массспектрометрией).примесей было рассчитано по приведенной выше формуле, а значение 12 было рассчитано аналогичной образом по следующей формуле: Символы в приведенной выше формуле имеют следующие значения:(12)[%] - увеличение количества продукта деградации, соединения формулы 12 в процентах;Cm- количество соединения формулы 12 после 6 недель;Ck - количество соединения формулы 12 в начальный момент. Результаты представлены в табл. 16. Таблица 16. Изменение количества общих примесей во время стресс-теста Согласно табл. 16 и увеличение количества суммарной примеси, и наиболее характерный продукт деградации (соединение формулы 12), значительно выше для формы II соли метансульфоновой кислоты,чем для формы IX соли соляной кислоты. Сравнительное исследование термической стабильности и форсированное исследование стабильности (стресс-тест), имитируют процессы деградации в фармацевтической композиции в ускоренном порядке. Результаты показывают, что форма IX соли соляной кислоты является более стабильной в композиции, чем форма II соли метансульфоновой кислоты. Это выгодное свойство формы IX соли соляной кислоты имеет большое значение в отношении получения и хранения фармацевтической композиции, и минимизации вредных побочных эффектов на организм человека. Еще одним общим недостатком всех солей метансульфокислоты является то, что при производстве активных фармацевтических ингредиентов следует уделять больше внимания различным способам. Вредные алкилмезилаты могут образовываться в присутствии спиртов, особенно этилового спирта в некоторых процедурных стадиях или их технологических операциях в процессе их производства, например в случае этанола может образовываться этилмезилат. Мутагенное или канцерогенное действие алкилмезилатов известно из литературы: Thompson L. H.,Mutant Isolation. Meth. Enzymol. 1979, 58, 308-322; Alderson Т., Chemically Induced Delayed Germinal Mutation in Drosophila. Nature 1965, 207, 164-167; Jenkins J. В., The Induction of Mosaic and Complete DumpyMutat. Res. 1978, 49, 313-340. Вирасепт (Нелфинавир) был отозван из продажи в 2007 г. компанией Hoffmann-La Roche, потому что он был загрязнен этилмезилатом вследствие неподходящего технологического способа. В связи с этим отзывом Европейское медицинское агентство (ЕМА) опубликовало уведомление, в котором ЕМА призывает фармацевтическую промышленность соблюдать жесткий контроль и проводить дальнейшие исследования в отношении композиций, содержащих мезилаты, тозилаты и безилаты(ЕМЕА/44714/2008). Большинство активных фармацевтических ингредиентов в виде соли, которые используются для терапии человека, превращаются в гидрохлориды из-за сильнокислого характера желудочной кислоты(соляной кислоты). Таким образом, освобождается кислота, которая связана активным фармацевтическим ингредиентом. Влияние свободных кислот, которые присутствуют в желудочном соке и которые слабее, чем соляная кислота, такие как метансульфоновая кислота, п-толуолсульфокислота и бензолсульфокислота, еще не было исследовано, и еще меньше данных об их реакции со спиртами, такими как этиловый спирт, приводящими к образованию мезилата. Таким образом, прежде чем их использовать,необходимы дальнейшие исследования. Еще одним объектом настоящего изобретения является применение вышеупомянутых морфологически однородных полиморф солей дабигатрана этексилата, образованных с соляной кислотой, в качестве лекарственных средств. Настоящее изобретение также относится к фармацевтической композиции, обладающей эффектом ингибитора тромбина, которая содержит в качестве активного ингредиента терапевтически эффективное количество вышеупомянутого дабигатрана этексилата вместе с одним или более фармацевтически приемлемыми наполнителями. Изобретение относится к ее применению для профилактики и лечения послеоперационных тромбозов глубоких вен и инсульта. Фармацевтическую композицию по настоящему изобретению вводят предпочтительно перорально или парентерально. Пероральными композициями являются, к примеру, таблетки, капсулы, драже, растворы, эликсиры, суспензии или эмульсии. Для парентерального введения используются внутривенные или внутримышечные инъекции. Фармацевтическая композиция по настоящему изобретению может содержать известные фармацевтические носители и/или вспомогательные вещества, обычно применяемые в фармацевтической промышленности. Фармацевтическими носителями могут быть, например, карбонат магния, стеарат магния,тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, натрия метилцеллюлоза, воск с низкой температурой плавления, масло какао и т.д. Использование носителя не является необходимым, если из носителя состоит капсула. Композиции, которые вводят перорально, кроме всего прочего могут представлять собой пастилки и пакеты. Твердые препараты, такие как таблетки, порошки,капсулы, пилюли, пакеты и пастилки предпочтительно использовать для перорального приема. Суппозитории содержат низкоплавкие воска (например, смесь глицеридов жирных кислот или какао-масло). Воск плавят и гомогенизируют в нем активный ингредиент. Расплавленную смесь заливают в форму соответствующего размера и формы и оставляют затвердевать при охлаждении. Таблетки получают путем смешивания активного ингредиента с соответствующими наполнителями в требуемых соотношениях и прессованием таблеток с подходящими размерами и формой. Порошки получают путем смешивания тонко распыленного активного ингредиента и носителей. Жидкие растворы представляют собой суспензии и эмульсии, которые могут обеспечить в случае необходимости замедленное высвобождение активного ингредиента. Желательно использовать растворы,содержащие воду или водные пропиленгликоли. Жидкие композиции для парентерального применения могут быть приготовлены в виде растворов, содержащих водные полиэтиленгликоли. Водные растворы для перорального введения готовят путем растворения активного ингредиента в воде с добавлением в раствор необходимых красителей, ароматизаторов, стабилизаторов и желирующих агентов. Активный ингредиент суспендируют в воде, в присутствии вязкой жидкости (например, природных или синтетических смол, канифолей, метилцеллюлозы, натрия карбоксиметилцеллюлозы, или любого другого суспендирующего агента). Другую часть твердой фармацевтической композиции в соответствии с изобретением преобразуют в жидкие композиции перед применением и вводят перорально. Жидкие композиции представляют собой растворы, суспензии или эмульсии, которые в дополнение к активному ингредиенту содержат красители, ароматизаторы, консерванты, буферы, искусственные или натуральные подсластители, диспергаторы, желирующие агенты и т.д. Фармацевтическую композицию по настоящему изобретению предпочтительно получают однократными дозами. Однократная доза содержит необходимое количество активного ингредиента. Однократные дозы могут продаваться в упаковках, содержащих отдельные количества композиций (например, упакованные таблетки, капсулы, порошки в ампулах или в контейнерах). Капсулы, таблетки, пакеты, пастилки и упаковки, содержащие несколько однократных доз, также являются однократными дозами. Еще одним объектом настоящего изобретения является способ получения вышеупомянутой фармацевтической композиции путем смешивания гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8, с фармацевтически приемлемыми твердыми или жидкими растворителями и/или эксципиентами,и путем приведения смеси в галенову форму. Фармацевтическую композицию по настоящему изобретению получают способами, известными в фармацевтической промышленности. Фармацевтическая композиция по настоящему изобретению может содержать дополнительные фармацевтически активные ингредиенты, совместимые с соединениями формулы 8 или их смеси. Еще одним объектом настоящего изобретения является применение новых кристаллических полиморфных соединений формулы 8 в качестве фармацевтически активных ингредиентов. Другим объектом настоящего изобретения является применение новых кристаллических полиморфных соединений формулы 8 для получения фармацевтической композиции, которая продлевает тромбиновое время, ингибирует тромбин и связанные с ним сериновые протеазы. Еще одним объектом настоящего изобретения является применение новых кристаллических полиморфных соединений формулы 8 для продления тромбинового времени и/или ингибирования тромбина и связанных с ним сериновых протеаз путем введения терапевтически приемлемой дозы соединений формулы 8 пациентам. Преимуществом настоящего изобретения является то, что новые кристаллические соединения формулы 8 морфологически однородны. Таким образом, такие свойства соединения, как время растворения,биовысвобождение, химическая стабильность и обрабатываемость (фильтрация, сушка, растворение и таблетирование) являются воспроизводимыми. Новые полиморфы по настоящему изобретению также могут быть получены воспроизводимым образом в промышленном масштабе. Настоящее изобретение поясняется следующими примерами, не ограничивающими объем изобретения. Примеры Пример 1. Получение гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8. 630 мг (1,0 ммоль) дабигатрана этексилата, 1,5 мл этанола и 130 мг соляной кислоты, содержащей изопропиловый спирт (28 мас.%, 1,0 ммоль), добавляли в круглодонную колбу объемом 10 см 3, реакционную смесь нагревали до 45 С. Полученный таким образом раствор выдерживали при 5 С в течение 1 недели. Кристаллическую суспензию фильтровали, промывали небольшим количеством этанола и сушили при комнатной температуре под вакуумом до постоянной массы. Выход: 335 мг (50,4%) Т.пл. (Температура плавления): 178-180 С. ЯМР (ДМСО, 500 МГц): 11,87 (b, 1H), 10,80 (b, 1 Н), 10,02 (b, 1H), 8,38 (m, 1 Н), 7,78 (b, 1 Н), 7,68(d, J=9,0 Гц, 2 Н), 7,55 (m, 1 Н), 7,50 (d, J=0,9 Гц, 1 Н), 7,46 (d, J=8,4 Гц, 1 Н), 7,19 (dd, J1=1,5 Гц, J2=8,6 Гц,1 Н), 7,12 (m, 1 Н), 6,93 (m, 1 Н), 6,89 (d, J=9,2 Гц, 2 Н), 4,73 (b, 2 Н), 4,26 (m, 2 Н), 4,22 (t, J=7,1 Гц, 2 Н),3,98 (q, J=7,1 Гц, 2H), 3,81 (s, 3 Н), 2,68 (t, J=7,1 Гц, 2 Н), 1,68 (m, 2 Н), 1,38 (m, 2H), 1,29 (m, 4H), 1,12 (t,J=7,1 Гц, 3 Н), 0,88 (m, 3 Н). ИК (KBr, см"1): 3296, 1734, 1648, 1578, 1468, 1207. Пример 2. Получение гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 500 мг (0,79 ммоль) дабигатрана этексилата добавляли в круглодонную колбу объемом 10 см 3, суспендировали его в 3 мл ацетона и добавляли по каплям при комнатной температуре смесь из 75 мкл 32 мас.% водной соляной кислоты (0,79 ммоль) и 2 мл ацетона. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и к суспензии добавляли соответствующие затравочные кристаллы(например соединение, получаемое в соответствии с примером 10). Суспензию перемешивали при комнатной температуре в течение 16-24 ч. Кристаллическую суспензию фильтровали, промывали небольшим количеством ацетона и сушили при комнатной температуре под вакуумом до постоянной массы. Выход: 470 мг (88%) Тпл.: 178-180 С Н-ЯМР (ДМСО, 500 МГц): 11,87 (b, 1H), 10,80 (b, 1H), 10,02 (b, 1H), 8,38 (m, 1 Н), 7,78 (b, 1 Н), 7,68(d, J=9,0 Гц, 2 Н), 7,55 (m, 1 Н), 7,50 (d, J=0,9 Гц, 1 Н), 7,46 (d, J1=8,4 Гц, 1 Н), 7.19 (dd, J1=1,5 Гц, J2=8,6 Гц, 1 Н), 7,12 (m, 1 Н), 6,93 (m, 1 Н), 6,89 (d, J=9,2 Гц, 2 Н), 4,73 (b, 2 Н), 4,26 (m, 2 Н), 4,22 (t, J=7,1 Гц, 2 Н),3,98 (q, J=7,1 Гц, 2 Н), 3,81 (s, 3 Н), 2,68 (t, J=7,1 Гц, 2 Н), 1,68 (m, 2 Н), 1,38 (m, 2 Н), 1,29 (m, 4 Н), 1,12 (t,J=7,1 Гц, 3 Н), 0,88 (m, 3 Н). ИК (KBr, см-1): 3296, 1734, 1648, 1578, 1468, 1207. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 демонстрирующий рентгеновскую порошковую дифрактограмму с характеристическими пиками при угле отражения 2-тета (0,2 2-тета) примерно 4,720; 8,080; 15,340; 23,420. 2. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 по п.1, демонстрирующий рентгеновскую порошковую дифрактограмму с характеристическими пиками при угле отражения 2-тета(0,2 2-тета) примерно 4,720; 8,080; 9,540; 10,480; 11,320; 15,340; 18,460; 19,140; 23,420. 3. Гидрохлорид дабигатрана этексилата (1:1) (форма IX) формулы 8 по п.1 или 2, демонстрирующий рентгеновскую порошковую дифрактограмму в соответствии с фиг. 10 и следующей таблицей: Положение пиков и относительная интенсивность (6%) 4. Способ получения гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3, который включает кристаллизацию любого полиморфного или аморфного основания дабигатрана этексилата или их смеси из полярного растворителя или смеси полярных растворителей в присутствии соляной кислоты. 5. Способ получения гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3, который включает кристаллизацию любой полиморфной или аморфной соли соляной кислоты и дабигатрана этексилата, ее сольвата, гидрата или их смесей из полярного растворителя или смеси полярных растворителей. 6. Применение гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3 в качестве лекарственного средства, обладающего эффектом ингибитора тромбина. 7. Фармацевтическая композиция, обладающая эффектом ингибитора тромбина, содержащая в качестве активного ингредиента терапевтически эффективное количество гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3 вместе с одним или более фармацевтически приемлемым наполнителем (наполнителями). 8. Применение композиции по п.7 для профилактики или лечения послеоперационных тромбозов глубоких вен и инсульта. 9. Применение гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3 для получения лекарственного средства для профилактики или лечения послеоперационных тромбозов глубоких вен и инсульта. 10. Способ профилактики и/или лечения послеоперационных тромбозов глубоких вен и инсульта,который включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества гидрохлорида дабигатрана этексилата (1:1) (форма IX) формулы 8 по любому из пп.1-3.
МПК / Метки
МПК: C07D 401/12, A61K 31/4439, A61P 7/02
Метки: гидрохлорида, полиморфная, дабигатрана, форма, этексилата
Код ссылки
<a href="https://eas.patents.su/10-22496-polimorfnaya-forma-gidrohlorida-dabigatrana-eteksilata.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфная форма гидрохлорида дабигатрана этексилата</a>
Предыдущий патент: Технология удаления закиси азота из газового потока
Следующий патент: Имплантат для артродеза
Случайный патент: Способ ингибирования прогрессивного развития или стабилизации волчаночного нефрита












