Полиморфная форма бензоата линаглиптина
Формула / Реферат
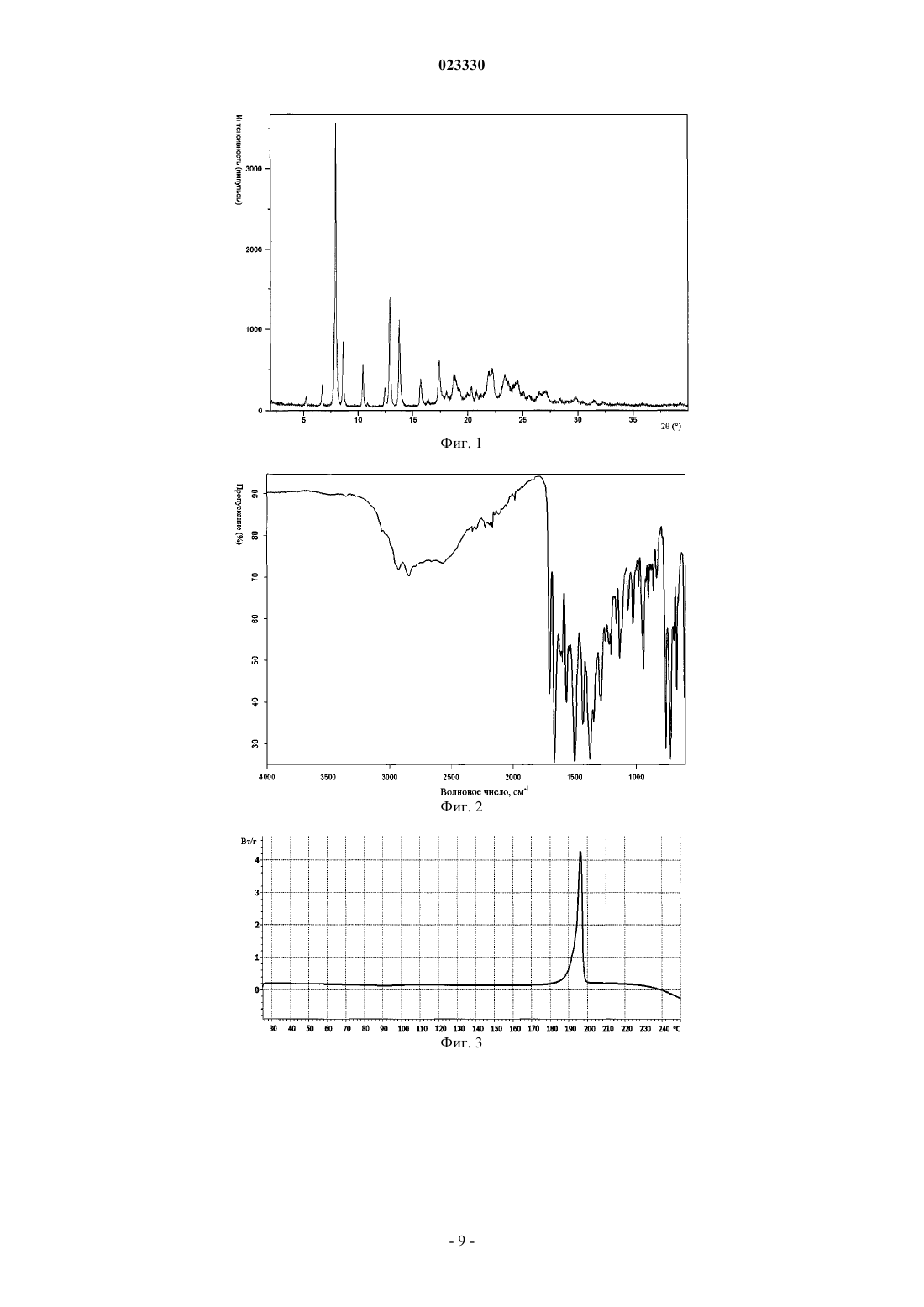
1. Кристаллическая форма II бензоата линаглиптина, которая характеризуется порошковой рентгеновской дифрактограммой, которая включает пики угла 2θ при 8,0±0,2°, 8,7±0,2°, 10,4±0,2°, 12,9±0,2°, 13,8±0,2° и 17,4±0,2°.
2. Кристаллическая форма II бензоата линаглиптина по п.1, которая характеризуется ИК-спектром, включающим пики при волновых числах 1701±2 см-1, 1663±2 см-1, 1134±2 см-1, 760±2 см-1 и 724±2 см-1.
3. Кристаллическая форма II бензоата линаглиптина по п.1 или 2, которая характеризуется кривой ДСК, на которой наблюдается эндотермический пик с начальной температурой плавления при приблизительно 193°С.
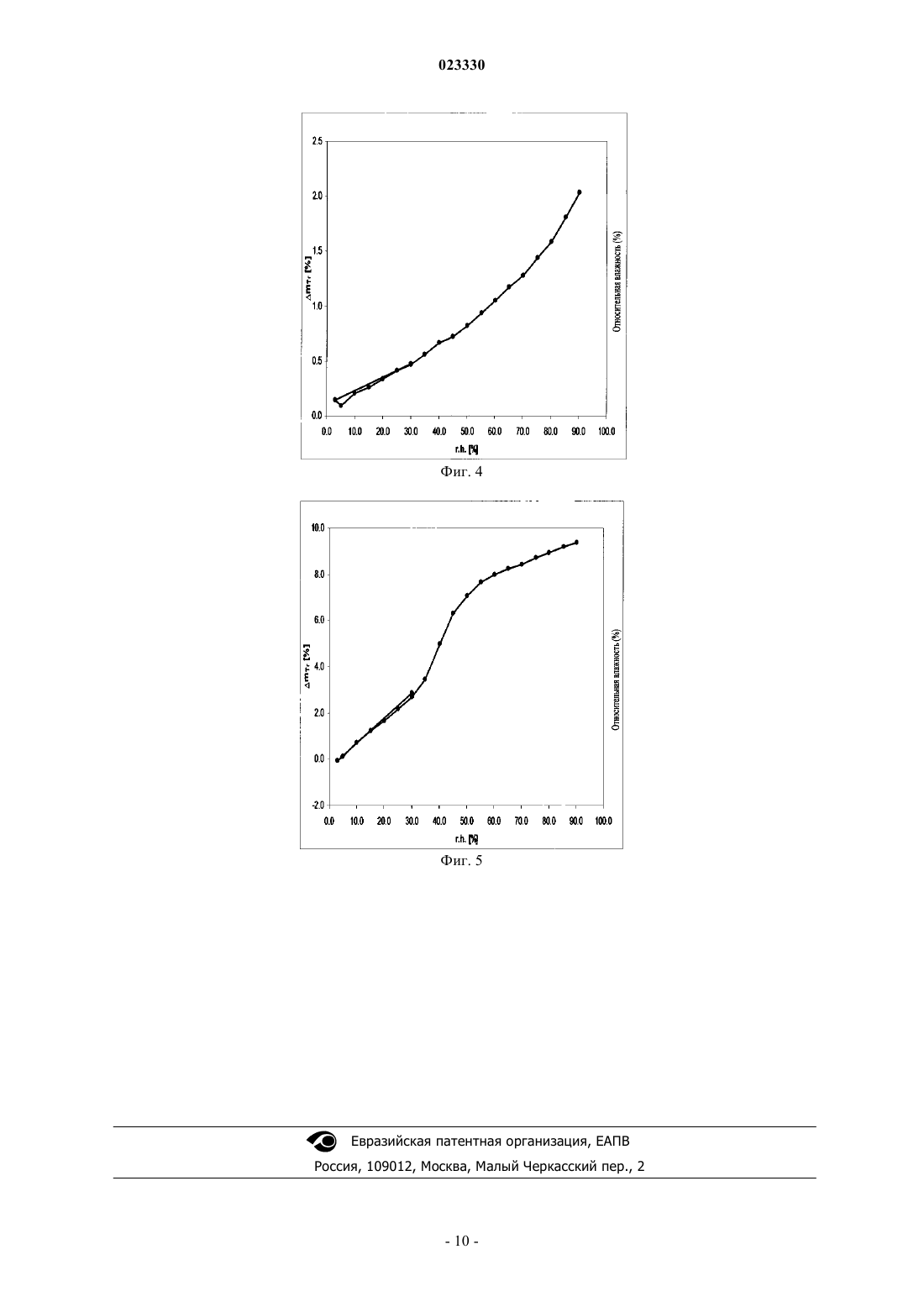
4. Кристаллическая форма II бензоата линаглиптина по любому из предшествующих пунктов, которая при относительной влажности приблизительно 3% характеризуется содержанием воды приблизительно 0 мас.%, а при относительной влажностью приблизительно 90% приблизительно 2,0 мас.% содержанием воды.
5. Кристаллическая форма II бензоата линаглиптина по любому из предшествующих пунктов в форме сфероидных частиц, при этом внешний диаметр сфероидных частиц находится в диапазоне от 10 до 100 мкм.
6. Способ получения кристаллической формы II бензоата линаглиптина по любому из пп.1-5, который включает следующие стадии:
а) растворение бензоата линаглиптина в ацетонитриле, при этом после нагревания получают концентрацию в диапазоне приблизительно от 10 до приблизительно 20 г/л,
б) охлаждение раствора со скоростью охлаждения ≤-1°С/мин для индукции кристаллизации при температуре выше 35°С,
в) отделение полученных кристаллов.
7. Фармацевтическая композиция для лечения сахарного диабета типа 2 и связанных с ним заболеваний, которая включает кристаллическую форму II бензоата линаглиптина по любому из пп.1-5 и по крайней мере один фармацевтически приемлемый эксципиент.
8. Фармацевтическая композиция по п.7, которая представляет собой пероральную лекарственную форму, прежде всего капсулу или таблетку.
9. Фармацевтическая композиция по п.7 или 8, которая дополнительно включает метформин, пиоглитазон, сульфонилмочевину или их фармацевтически приемлемую соль.
10. Фармацевтическая композиция по п.7 или 8, которая дополнительно включает
метформин или его фармацевтически приемлемую соль и
сульфонилмочевину или ее фармацевтически приемлемую соль.
11. Применение кристаллической формы II бензоата линаглиптина по любому из пп.1-5 для получения фармацевтической композиции, предназначенной для применения в зонах с климатом типа Af или Am согласно классификации климата по Кёппену-Гейгеру.
12. Способ получения фармацевтической композиции, по п.7, который включает стадию смешивания кристаллической формы II бензоата линаглиптина по любому из пп.1-5 по крайней мере с одним фармацевтически пригодным эксципиентом.
13. Способ по п.12, в котором смешивание проводят в ходе влажной грануляции.
14. Контейнер, который включает фармацевтическую композицию по любому из пп.7-10, при этом контейнер изготовлен из материала, который характеризуется проницаемостью для водяного пара, определенной согласно стандарту DIN 53122, а именно от 1,0 до 5000 г´м-2´сут-1.
15. Контейнер по п.14, который представляет собой блистерную упаковку, включающую пероральную лекарственную форму, при этом блистерная упаковка изготовлена из поливинилхлорида, полистирола, полиамида, полиэтиленвинилацетата, целлофана и/или ацетата целлюлозы.
Текст
ПОЛИМОРФНАЯ ФОРМА БЕНЗОАТА ЛИНАГЛИПТИНА В изобретении описана новая полиморфная форма бензоата линаглиптина и способы ее получения. Кроме того, в изобретении описано применение новой полиморфной формы для получения лекарственного средства. Кроме того, в изобретении описаны фармацевтические композиции,которые включают эффективное количество новой полиморфной формы бензоата линаглиптина. Область, к которой относится изобретение В изобретении предлагается новая полиморфная форма бензоата линаглиптина и способы ее получения. Кроме того, в настоящем изобретении предлагается применение новой полиморфной формы бензоата линаглиптина для получения лекарственного средства. В настоящем изобретении предлагаются также фармацевтические композиции, которые включают эффективное количество новой полиморфной формы бензоата линаглиптина. Кроме того, в настоящем изобретении предлагается фармацевтическая комбинация, которая включает эффективное количество новой полиморфной формы бензоата линаглиптина и метформина. Предпосылки создания изобретения Линаглиптин, 8-[(3R)-3-амино-1-пиперидинил]-7-(2-бутин-1-ил)-3,7-дигидро-3-метил-1-[(4-метил-2 хиназолинил)метил]-1-пурин-2,6-дион относится к ингибиторам дипептидилпептидазы-4 и предназначен для лечения сахарного диабета типа 2 при пероральном введении один раз в сутки. В третьем квартале 2010 г в контролирующие органы США, ЕС и Японии были поданы документы для получения одобрения на применение линаглиптина для лечения диабета, в третьем квартале 2011 г в Агентстве по контролю за продуктами питания и лекарственными средствами США (FDA) было получено одобрение линаглиптина. Химическая структура линаглиптина описывается следующей формулой I: В патенте ЕР 1532149 В 1 описан линаглиптин (как таковой) и его физиологически приемлемые соли неорганических или органических кислот. В заявке WO 2007/128721 А 1 описаны кристаллические формы А, В, С, D и Е линаглиптина в виде свободного основания. В заявке WO 2010/072776 А 1 описаны кристаллические кислотно-аддитивные соли линаглиптина,такие как бензоат. В указанной заявке бензоат линаглиптина характеризовали порошковой рентгеновской дифрактограммой и температурой плавления приблизительно 155 С, которую определяли по данным дифференциальной сканирующей калориметрии (ДСК), полученным в определенных условиях. Полиморфизм - способность одного вещества существовать в различных кристаллических формах. Вещество может существовать в нескольких кристаллических формах, которые характеризуются различными кристаллическими структурами и отличаются своими физическими свойствами, такими как температура плавления, порошковая рентгеновская дифрактограмма (ПРД) и ИК-спектр. Таким образом указанные полиморфные формы представляют собой различные твердые формы одного и того же соединения, из которого образуются кристаллы, однако они могут характеризоваться различными полезными физическими свойствами, которые могут оказывать прямое действие на способность к переработке и/или на получение лекарственной субстанции, например, на текучесть, а также на получение лекарственного продукта, например, на текучесть, а также стабильность, растворимость и биодоступность лекарственного продукта. Эти различные полиморфные формы с различными физическими свойствами можно в большей или меньшей степени использовать для решения конкретной задачи, например, для получения фармацевтического состава. Авторами настоящего изобретения было неожиданно установлено, что бензоат линаглиптина, описанный в заявке WO 2010/072776 А 1, является высоко гигроскопичным соединением. Однако переработка гигроскопичных соединений в стандартных условиях фармацевтической переработки, такой как влажная грануляция, связана с рядом проблем и требует применения специальных технологий и оборудования для исключения, например, химической деградации или трансформации полиморфной формы в ходе переработки. Кроме того, гигроскопичные соединения и фармацевтические композиции, содержащие указанные соединения, в большинстве случаев необходимо упаковывать в специальные емкости для обеспечения надлежащего качества продукта при хранении. Кристаллические формы бензоата линаглиптина, которые характеризуются улучшенной технологичностью в отношении благоприятных условий переработки, например, влажной грануляции, могут повысить эффективность получения фармацевтических композиций, включающих линаглиптин. Таким образом существует потребность в разработке твердых форм линаглиптина, которые позволяют исключить одну или более проблем, связанных с использованием известной формы I бензоата линаглиптина формулы. Краткое описание сущности изобретения Авторами было неожиданно установлено, что новая полиморфная форма бензоата линаглиптина, в дальнейшем форма II бензоата линаглиптина, является в значительной степени менее гигроскопичной по сравнению с кристаллическим бензоатом линаглиптина, описанным в заявке WO 2010/072776 А 1, которая более эффективно поддается переработке в стандартных условиях фармацевтической переработки,такой как влажная грануляция, по сравнению с бензоатом линаглиптина, который описан в заявке WO 2010/072776 А 1, в дальнейшем форма I бензоата линаглиптина. Прежде всего форму II бензоата линаг-1 023330 липтина можно перерабатывать в стандартных условиях фармацевтической переработки, таких как переработка в атмосфере с относительной влажностью приблизительно от 0 до 90%. Кроме того, форму II бензоата линаглиптина не требуется упаковывать в специальную емкость для сохранения надлежащего качества продукта при хранении. Таким образом, в настоящем изобретении предлагается новая полиморфная форма бензоата линаглиптина, в дальнейшем форма II бензоата линаглиптина. Форму II бензоата линаглиптина можно характеризовать дифрактограммой ПРД, которая включает характеристические пики угла 2 при 8,00,2, 8,70,2, 10,40,2, 12,90,2, 13,80,2 и 17,40,2. В другом варианте осуществления настоящего изобретения предлагается также способ получения формы II бензоата линаглиптина, который включает следующие стадии: а) растворение бензоата линаглиптина в ацетонитриле при нагревании,б) необязательно фильтрование раствора,в) медленное охлаждение раствора для индукции кристаллизации при температуре более 35 С,г) отделение полученных кристаллов и д) необязательно высушивание кристаллов. В еще одном варианте предлагается применение формы II бензоата линаглиптина для получения лекарственного средства. Кроме того, предлагается фармацевтическая композиция, которая включает эффективное количество формы II бензоата линаглиптина. Если не указано иное, то сокращения, использованные в данном контексте, имеют следующие значения: ПРД - порошковая рентгеновская дифрактограмма,Фурье-ИК - ИК-спектроскопия с Фурье-преобразованием,ОВ - относительная влажность,КТ - комнатная температура,ДСК - дифференциальная сканирующая калориметрия,mTR - изменение массы образца (определенное по данным титрования методом Карла Фишера). Краткое описание фигур На фиг. 1 представлена порошковая рентгеновская дифрактограмма (ПРД) формы II бензоата линаглиптина; на фиг. 2 - ИК-спектр с Фурье-преобразованием (Фурье-ИК) формы II бензоата линаглиптина; на фиг. 3 - кривая дифференциальной сканирующей калориметрии (ДСК) для формы II бензоата линаглиптина; на фиг. 4 - изотерма сорбции влаги для формы II бензоата линаглиптина; на фиг. 5 - изотерма сорбции влаги для формы I бензоата линаглиптина, которая описана в заявкеWO 2010/072776 А 1. Подробное описание изобретения В первом объекте настоящего изобретения предлагается новая и преимущественная кристаллическая форма бензоата линаглиптина (в дальнейшем форма II бензоата линаглиптина). Форму II бензоата линаглиптина можно характеризовать ПРД, которая включает характеристические пики угла 2 при 8,00,2, 8,70,2, 10,40,2, 12,90,2, 13,80,2 и 17,40,2. Предпочтительно форму II бензоата линаглиптина можно характеризовать ПРД, характеристические пики которой и их интенсивности представлены ниже в таблице Более предпочтительно ПРД может включать следующие пики угла 2: 5,20,2, 6,70,2, 12,40,2, 15,70,2, 18,80,2, 20,30,2, 22,20,2, 23,30,2 и 24,50,2. Еще более предпочтительно форму II бензоата линаглиптина можно характеризовать ПРД, характеристические пики которой и их интенсивности представлены ниже в таблице На фиг. 1 представлена типичная ПРД формы II бензоата линаглиптина. Форму II бензоата линаглиптина можно также характеризовать Фурье-ИК-спектром, который включает характеристические пики при 1701 2 см-1, 16632 см-1 , 11342 см-1 , 7602 см-1 и 7242 см-1 . Предпочтительно спектр может также включать пики при волновых числах 29252 см-1, 28412 см-1, 16002 см-1, 15662 см-1,14992 см-1, 14342 см-1, 13762 см-1, 13462 см-1, 12852 см-1, 12032 см-1, 11592 см-1, 10662 см-1, 10262 см-1, 9822 см-1, 9422 см-1, 9022 см-1, 8592 см-1, 8352 см-1, 6722 см-1 и 6092 см-1. Типичный Фурье-ИК-спектр представлен на фиг. 2. Кроме того, форму II бензоата линаглиптина можно характеризовать методом ДСК. На кривой ДСК наблюдается одна эндотерма плавления, при этом начало плавления наблюдается при температуре приблизительно 193 С. Типичная кривая ДСК приводится на фиг. 3. Согласно сравнительному анализу данных, представленных на фиг. 4 и 5, форма II бензоата линаглиптина в значительной степени менее гигроскопична, чем кристаллический бензоат линаглиптина, описанный в заявке WO 2010/072776 А 1, и следовательно в высшей степени пригодна для фармацевтических составов, например для применения при обработке влажной грануляцией для получения фармацевтических композиций, включающих линаглиптин. Кроме того, форма II бензоата линаглиптина более стабильна по сравнению с формой I при хранении в условиях высокой относительной влажности. В настоящем изобретении предлагается также способ получения формы II бензоата линаглиптина. Форму II бензоата линаглиптина можно получить способом, который включает стадии: а) растворение бензоата линаглиптина в ацетонитриле при нагревании, например от 50 до 82 С,б) необязательно фильтрование раствора,в) медленное охлаждение раствора для индукции кристаллизации при температуре более 35 С,г) отделение полученных кристаллов и д) необязательно высушивание кристаллов. На стадии а) в качестве исходного материала можно использовать любую форму бензоата линаглиптина, например аморфный бензоат линаглиптина, кристаллический бензоат линаглиптина или смесь аморфного и кристаллического бензоата линаглиптина. Кристаллический бензоат линаглиптина, который пригоден для использования в качестве исходного материала, представляет собой, например, бензоат линаглиптина, описанный в заявке WO 2010/072776 А 1. Исходный материал, бензоат линаглиптина,можно растворять в ацетонитриле. Обычно цель заключается в достижении концентрации бензоата линаглиптина в диапазоне от приблизительно 10 до 20 г/л. Температура растворения зависит от исходного количества бензоата линаглиптина, который добавляют в ацетонитрил, и таким образом от концентрации, которая будет получена после растворения, и может находиться в диапазоне приблизительно от 63 С (например, 10 г твердого бензоата линаглиптина добавляют в 1 л ацетонитрила, при этом после растворения получают концентрацию 10 г/л) до приблизительно 82 С (например, когда 20 г твердого бензоата линаглиптина добавляют в 1 л ацетонитрила, при этом после растворения получают концентрацию 20 г/л). Полученный раствор необязательно можно фильтровать (стадия б для удаления любых нерастворимых частиц. На стадии в) кристаллизацию формы II бензоата линаглиптина можно индуцировать при медленном охлаждении полученного раствора до температуры от приблизительно -70 до 50 С, предпочтительно от приблизительно -40 до приблизительно 40 С, более предпочтительно от приблизительно -20 до приблизительно 25 С, еще более предпочтительно раствор медленно охлаждают до 25 С. Термин "медленное охлаждение", использованный в данном контексте, обозначает, что скорость охлаждения составляет-1 С/мин, предпочтительно от -1 до -0,1 С/мин, более предпочтительно от -0,8 до -0,4 С/мин. После стадии охлаждения полученную суспензию можно перемешивать в течение приблизительно от 6 до 72 ч, более предпочтительно приблизительно от 6 до 48 ч, еще более предпочтительно от 6 до 24 ч. Затем кристаллы можно отделять любым стандартным способом, таким как фильтрование, центрифугирование или упаривание растворителя. На конечной стадии полученную форму II бензоата линаглиптина можно высушить, предпочти-3 023330 тельно в вакууме при температуре предпочтительно в диапазоне от приблизительно 25 до 100 С, более предпочтительно от приблизительно 40 до 90 С, еще более предпочтительно материал сушат при температуре от приблизительно 60 до 80 С в течение времени, достаточного для высушивания, например высушивание проводят во временном диапазоне от приблизительно 1 до 72 ч, более предпочтительно от приблизительно 6 до 48 ч, более предпочтительно от приблизительно 12 до 24 ч. Согласно настоящему способу форму II бензоата линаглиптина получают в виде сфероидальных частиц. Согласно данным световой микроскопии (увеличение 100) внешний вид таких частиц представляет собой массу сферической формы с множеством игл, выходящих из центра. Обычно внешний диаметр сфероидальных частиц находится в диапазоне от приблизительно 10 до 100 мкм, более предпочтительно от приблизительно 30 до 80 мкм, еще более предпочтительно от приблизительно 40 до 60 мкм. Неожиданно было установлено, что форма II бензоата линаглиптина по настоящему изобретению образуется только при кристаллизации при температуре выше 35 С. Это означает, что кристаллизация начинается при температуре выше 35 С, о чем свидетельствует появление в растворе первых видимых твердых частиц, по мере медленного снижения температуры раствора. Обычно специалист в данной области техники может определить начало кристаллизации, и таким образом легко может определить температуру кристаллизации. Если кристаллизация начинается при более низкой температуре, то форма II бензоата линаглиптина надлежащим образом не образуется. Для наилучшего обеспечения инициализации кристаллизации при температуре выше приблизительно 35 С следует использовать раствор, содержащий бензоат линаглиптина в концентрации 10 г/л, и поддерживать скорость охлаждения на уровне-1 С/мин. Как только кристаллизация начинается при температуре выше приблизительно 35 С, образуется форма II бензоата линаглиптина, которая остается стабильной при дальнейшем охлаждении раствора. Неожиданно было установлено, что форма II бензоата линаглиптина по настоящему изобретению менее гигроскопична, чем кристаллический бензоат линаглиптина, описанный в заявке WO 2010/072776 А 1. Форма II в атмосфере с относительной влажностью от 3 до 90% при температуре приблизительно 25 С поглощает только приблизительно 2 мас.% воды, в то время как кристаллический бензоат линаглиптина, описанный в заявке WO 2010/072776 А 1, в атмосфере с относительной влажностью от 3 до 90% при температуре приблизительно 25 С поглощает приблизительно 9,5 мас.% воды в расчете на общую массу. Кроме того, форма II бензоата линаглиптина более эффективно поддается переработке в условиях получения фармацевтических составов, такой как влажная грануляция, чем форма I, описанная в заявкеWO 2010/072776 А 1. Например, если жидкостью для грануляции является раствор, содержащий связующее вещество, такой как раствор коповидона в воде, а предварительно полученную смесь бензоата линаглиптина и разбавителя, такого как маннит, и дезинтегрирующего агента, такого как предварительно желатинированный крахмал, смачивают, а затем гранулируют в присутствии жидкости для грануляции,то форма II бензоата линаглиптина по настоящему изобретению имеет ряд преимуществ по сравнению с формой I. Кроме того, форма II бензоата линаглиптина не требует применения специальных технологий,таких как сухая грануляция, и/или специального оборудования в ходе переработки. Кроме того, при использовании формы II бензоата линаглиптина не требуется применение специальной упаковки формы II бензоата линаглиптина или фармацевтических композиций, включающих форму II бензоата линаглиптина, для хранения. Согласно настоящему изобретению форму II бензоата линаглиптина по изобретению, как описано выше, можно эффективно использовать в различных фармацевтических составах, предназначенных для применения при лечении сахарного диабета типа 2 и связанных с ним заболеваний. Следовательно, в настоящем изобретении предлагается также фармацевтическая композиция, которая включает форму II бензоата линаглиптина, как описано выше, и фармацевтически приемлемый носитель. Предпочтительно в настоящем изобретении предлагаются фармацевтические композиции, в которых более 95% бензоата линаглиптина "стабильно присутствует" в виде формы II бензоата линаглиптина, более предпочтительно форма II бензоата линаглиптина является единственной детектируемой кристаллической формой бензоата линаглиптина. Отсутствие других полиморфных форм бензоата линаглиптина, таких как форма I, можно установить при сравнивнении ПРД любой используемой кристаллической формы бензоата линаглиптина с ПРД формы II бензоата линаглиптина, например, полученной,как описано в примере 1, и представленной на фиг. 1, которую в данном случае можно использовать в качестве эталона 100%-ной формы II. Термин "стабильно присутствует", использованный в данном контексте, обозначает, что даже после хранения фармацевтического состава в течение 180 суток, предпочтительно даже после хранения в течение 3 лет, кристаллическая форма бензоата линаглиптина, названная формой II бензоата линаглиптина,которая изначально присутствовала в фармацевтической композиции, все еще присутствует в виде формы II бензоата линаглиптина после хранения в течение указанного периода времени. Фармацевтические композиции по настоящему изобретению, включающие форму II бензоата линаглиптина, могут дополнительно включать один или более фармацевтически приемлемых эксципиен-4 023330 тов. Указанные эксципиенты предпочтительно выбирают из группы, включающей наполнители, подсластители, буферные вещества, скользящие вещества, агенты, повышающие текучесть, ароматизаторы,смазывающие вещества, консерванты, ПАВ, увлажняющие агенты, связующие вещества, дезинтегрирующие агенты и загустители. Можно применять также и другие известные эксципиенты, которые используют для фармацевтических композиций. Кроме того, фармацевтическая композиция может включать также комбинацию двух или более эксципиентов, относящихся к одному из перечисленных выше членов описанной выше группы. Примеры эксципиентов, пригодных для использования в фармацевтических композициях по настоящему изобретению, включающих форму II бензоата линаглиптина, приводятся, например, в патенте ЕР 2023902 В 1 (см. абзацы [0005]-[0011]), который включен в настоящее описание в качестве ссылки. В патенте ЕР 2023902 В 1 (см. абзацы [0005] и [0006]) приводятся примеры разбавителей, пригодных для использования в фармацевтических композициях по настоящему изобретению, включающих форму II бензоата линаглиптина. Предпочтительными разбавителями, которые также можно использовать в фармацевтических композициях по настоящему изобретению, являются, например, порошкообразная целлюлоза, безводный двузамещенный фосфат кальция, дигидрат двузамещенного фосфата кальция, эритрит, гидроксипропилцеллюлоза, маннит, предварительно желатинизированный крахмал, гидроксипропилцеллюлоза с низкой степенью замещения или ксилит, при этом предпочтительными являются маннит и предварительно желатинизированный крахмал. В патенте ЕР 2023902 В 1 (абзац [0007]) приводятся примеры смазывающих веществ, пригодных для использования в фармацевтических композициях по настоящему изобретению, включающих форму II бензоата линаглиптина.Предпочтительными смазывающими веществами, которые также можно использовать в фармацевтических композициях по настоящему изобретению, являются, например, тальк, полиэтиленгликоль, бегенат кальция, стеарат кальция, гидрированное касторовое масло или стеарат магния,при этом предпочтительным является стеарат магния. В патенте ЕР 2023902 В 1 (абзац [0008]) приводятся примеры связующих веществ, пригодных для использования в фармацевтических композициях по настоящему изобретению, включающих форму II бензоата линаглиптина. Предпочтительными связующими веществами, которые также можно использовать в фармацевтических композициях по настоящему изобретению, являются, например, коповидон,гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлоза с низкой степенью замещения, при этом предпочтительными являются коповидон и предварительно желатинизированный крахмал. В патенте ЕР 2023902 В 1 (абзац [0010]) приводятся примеры дезинтегрирующих агентов, пригодных для использования в фармацевтических композициях по настоящему изобретению, включающих форму II бензоата линаглиптина. Предпочтительными дезинтегрирующими агентами, которые также можно использовать в фармацевтических композициях по настоящему изобретению, являются, например, кукурузный крахмал, кросповидон, гидроксипропилцеллюлоза с низкой степенью замещения или предварительно желатинизированный крахмал, при этом предпочтительным является кукурузный крахмал. В патенте ЕР 2023902 В 1 (абзац [0011]) приводится пример необязательного скользящего вещества,пригодного для использования в фармацевтических композициях по настоящему изобретению, включающих форму II бензоата линаглиптина. Необязательным скользящим веществом, которое также можно использовать в фармацевтических композициях по настоящему изобретению, является диоксид кремния. Примеры способов, пригодных для получения фармацевтических композиций по настоящему изобретению, приводятся, например, в патенте ЕР 2023902 В 1 (абзацы [0019]-[0026]), который включен в настоящее описание в качестве ссылки, при этом следует понимать, что во всех случаях, когда используются термины "активный ингредиент" или "ингибитор DPP-IV" в патенте ЕР 2023902 В 1, следует использовать эквивалентное количество формы II бензоата линаглиптина в расчете на количество линаглиптина в форме свободного основания по настоящему изобретению. Конкретные примеры получения составов по настоящему изобретению приводятся, например, в патенте ЕР 2023902 В 1 (абзацы [0027]-[0040]). Указанные примеры можно повторить, используя форму II бензоата линаглиптина по настоящему изобретению. Составы по настоящему изобретению обычно включают от 0,1 до 100 мг формы II бензоата линаглиптина, при этом предпочтительные дозы составляют 0,5, 1, 2,5, 5 и 10 мг (в расчете на количество свободного основания). Как описано выше, одно преимущество формы II по настоящему изобретению заключается в том,что она менее гигроскопична, чем форма I. Таким образом, с учетом указанного свойства формы II бензоата линаглиптина по настоящему изобретению специалист в данной области техники может выбрать для упаковки или заполнения фармацевтическими композициями, которые включают форму II бензоата линаглиптина по настоящему изобретению, недорогостоящие контейнеры или блистеры. Таким образом, в настоящем изобретении предлагается также контейнер, включающий фармацевтические композиции, которые содержат форму II бензоата линаглиптина по настоящему изобретению,прежде всего контейнер, изготовленный из материала, который характеризуется проницаемостью для водяного пара, определенной согласно стандарту DIN 53122 для фольги с толщиной 50 мкм, а именно от-5 023330 1,0 до 5000 гм-2 сут-1, более предпочтительно от 5 до 2000 гм-2 сут-1. Предпочтительными примерами указанных недорогостоящих упаковочных материалов, которые характеризуются относительно высокой проницаемостью для водяного пара, являются поливинилхлорид, полистирол, полиамид, полиэтиленвинилацетат, целлофан и ацетат целлюлозы. Указанные материалы можно использовать для упаковки фармацевтических композиций, включающих форму II бензоата линаглиптина, в блистеры в связи с низкой гигроскопичностью формы II по настоящему изобретению, что представляет очевидное преимущество формы II бензоата линаглиптина по настоящему изобретению с экономической точки зрения. В настоящем изобретении предлагается также применение формы II бензоата линаглиптина для получения фармацевтической композиции, предназначенной для продажи в тропической стране, в которой расположены зоны с климатом типа Af или Am согласно классификации климата по Кппену-Гейгеру. В одном предпочтительном варианте осуществления настоящего изобретения предлагается контейнер, изготовленный из материала, который характеризуется проницаемостью для водяного пара, определенной согласно стандарту DIN 53122 для фольги с толщиной 50 мкм, а именно от 1,0 до 5000 гм-2 сут-1, более предпочтительно от 5 до 2000 гм-2 сут-1, при этом фармацевтическая композиция предназначена для продажи в тропической стране, в которой расположены зоны с климатом типа Af или Am согласно классификации климата по Кппену-Гейгеру. Предпочтительными примерами указанных недорогостоящих упаковочных материалов, которые характеризуются относительно высокой проницаемостью для водяного пара, являются поливинилхлорид, полистирол, полиамид, полиэтиленвинилацетат, целлофан и ацетат целлюлозы. Указанные материалы можно использовать для упаковки фармацевтических композиций, включающих форму II бензоата линаглиптина, в блистеры, которые можно использовать даже в странах с влажным или избыточно влажным климатом в связи с низкой гигроскопичностью формы II по настоящему изобретению, что представляет очевидное преимущество формы II бензоата линаглиптина по настоящему изобретению с экономической точки зрения. В другом варианте осуществления настоящего изобретения предлагается фармацевтическая комбинация, которая включает эффективное количество формы II бензоата линаглиптина по настоящему изобретению и метформин или его фармацевтически приемлемую соль. Кроме того, в настоящем изобретении предлагается фармацевтическая комбинация, которая включает эффективное количество формы II бензоата линаглиптина по настоящему изобретению и пиоглитазон или его фармацевтически приемлемую соль. Кроме того, в настоящем изобретении предлагается фармацевтическая комбинация, которая включает эффективное количество формы II бензоата линаглиптина по настоящему изобретению и сульфонилмочевину или ее фармацевтически приемлемую соль. Кроме того, в настоящем изобретении предлагается фармацевтическая комбинация, которая включает эффективное количество формы II бензоата линаглиптина по настоящему изобретению и сульфонилмочевины или ее фармацевтически приемлемой соли, а также метформина или его фармацевтически приемлемой соли. В настоящем изобретении предлагается также контейнер, как описано выше, включающий фармацевтические композиции, содержащие комбинацию формы II бензоата линаглиптина и метформина или его фармацевтически приемлемой соли, формы II бензоата линаглиптина и пиоглитазона или его фармацевтически приемлемой соли, формы II бензоата линаглиптина и сульфонилмочевины или ее фармацевтически приемлемой соли, а также формы II бензоата линаглиптина, метформина или его фармацевтически приемлемой соли и сульфонилмочевины или ее фармацевтически приемлемой соли, соответственно прежде всего предлагается контейнер, изготовленный из материала, который характеризуется высокой проницаемостью для водяного пара, как описано выше, и/или предназначен для продажи в тропической стране, в которой расположены зоны с климатом типа Af или Am согласно классификации климата по Кппену-Гейгеру, как описано выше. При ознакомлении со следующим описанием для специалиста в данной области представляются очевидными другие объекты, признаки, преимущества и аспекты настоящего изобретения. Однако следует понимать, что описание и следующие конкретные примеры, определяющие предпочтительные варианты осуществления настоящего изобретения, приводятся только для иллюстрации. При ознакомлении с описанием и другими разделами заявки для специалиста в данной области техники представляется очевидным,что в пределах сущности и объема изобретения возможны различные изменения и модификации. Примеры Дифрактограммы ПРД получали на дифрактометре PANalytical X'Pert PRO, оборудованном тета/тета-гониометром, в режиме пропускания, с использованием излучения Cu-K1,2 (длина волны 0,15419 нм), с фокусирующим зеркалом и твердотельным детектором PIXcel. Дифрактограммы регистрировали в следующих условиях: напряжение на трубке 45 кВ, ток трубки 40 мА, пошаговое сканирование при 0,013 угла 2, 80 с на шаг (255 каналов), в угловом диапазоне от 2 до 40 угла 2, в условиях окружающей среды. Обычно точность измерений величины угла 2 находилась в диапазоне приблизительно 0,2. Таким образом дифракционный пик, который наблюдается при 5,0 угла 2, на множестве рентгеновских дифрактометрах при измерениях в стандартных условиях может находиться в диапазоне от 4,8 до 5,2 угла 2. ИК-спектр регистрировали в ячейке MKII Golden Gate Single Reflection Diamond ATR (нарушенное полное отражение) на ИК-спектрометре с Фурье преобразованием Tensor 27 FTIR фирмы Bruker с разрешением 4 см-1 в условиях окружающей среды. Для регистрации спектра образец в порошкообразной форме с кончика шпателя переносили на поверхность алмаза. Затем образец уплотняли на алмазе с использованием сапфировой пластины, и затем регистрировали спектр. Спектр чистого алмаза использовали в качестве фонового спектра. Обычно точность измерений величин волновых чисел находилась в диапазоне приблизительно 2 см-1. Таким образом пик в инфракрасной области, который наблюдается при 1716 см-1, может находиться в диапазоне от 1714 до 1718 см-1. Дифференциальную сканирующую калориметрию (ДСК) проводили в приборе Mettler Polymer DSCR. Образец (5,3 г) нагревали в алюминиевом тигле (40 мкл) с алюминиевой перфорированной крышкой от 25 до 250 С, при этом скорость нагрева составляла 10 С/мин. В качестве газа для продувки использовали азот (скорость продувки составляла 50 мл/мин). Поглощение влаги кристаллическими формами бензоата линаглиптина определяли на анализаторе динамической сорбции/десорбции водяного пара. Соответственно обе формы выдерживали в атмосфере,относительная влажность (ОВ) которой составляла приблизительно 28%, и начальное содержание воды определяли титрованием по методу Карла Фишера. Затем проводили эксперимент по оценке поглощения влаги на анализаторе сорбции влаги SPSx-1 (фирмы Projekt Messtechnik, Ульм), осуществляя пошаговое повышение ОВ в диапазоне от 3 до 90% в течение приблизительно 2,5 сут при 250,1 С. Пример 1. Получение полиморфной формы II бензоата линаглиптина. Суспензию бензоата линаглиптина (0,60 г) в ацетонитриле (40 мл) нагревали с обратным холодильником (Тбани 82 С), при этом получали прозрачный раствор. Раствор охлаждали до приблизительно 25 С в течение приблизительно 90 мин, при этом кристаллизация начиналась при приблизительно 60 С. Полученную суспензию перемешивали при приблизительно 25 С в течение еще приблизительно 13 ч, затем кристаллы отделяли фильтрованием. Кристаллы высушивали в вакууме при 80 С в течение приблизительно 24 ч, при этом получали 0,48 г полиморфной формы II бензоата линаглиптина. Полиморфную форму II бензоата линаглиптина характеризовали методами ПРД, ИК-спектроскопии, ДСК, а также методом сорбции водяных паров, полученные результаты представлены на фиг. 1-4. Пример 2. Получение полиморфной формы II бензоата линаглиптина. Суспензию бензоата линаглиптина (0,60 г) в ацетонитриле (30 мл) нагревали с обратным холодильником (Тбани 82 С), при этом получали прозрачный раствор. Раствор охлаждали до приблизительно 25 С в течение приблизительно 90 мин, при этом кристаллизация начиналась при приблизительно 75 С. Полученную суспензию перемешивали при приблизительно 25 С в течение еще приблизительно 5 ч, затем кристаллы отделяли фильтрованием. Кристаллы высушивали в вакууме при 80 С в течение приблизительно 15 ч, при этом получали 0,47 г полиморфной формы II бензоата линаглиптина. Сравнительный пример 1. Получение бензоата линаглиптина. Суспензию бензоата линаглиптина (0,60 г) в ацетонитриле (40 мл) нагревали с обратным холодильником (Тбани 82 С), при этом получали прозрачный раствор. Раствор быстро охлаждали, помещая реакционный сосуд в ледяную баню, через 5 мин наблюдали образование кристаллов при температуре приблизительно 0 С. Полученную суспензию перемешивали на ледяной бане в течение еще приблизительно 2 ч, затем кристаллы отделяли фильтрованием. Кристаллы высушивали в вакууме при 80 С в течение приблизительно 13 ч, при этом получали 0,44 г бензоата линаглиптина в виде смеси аморфной и кристаллической форм бензоата линаглиптина, но которая не представляла собой форму II. Сравнительный пример 2. Получение бензоата линаглиптина. Суспензию бензоата линаглиптина (0,30 г) в ацетонитриле (60 мл) нагревали с обратным холодильником (Тбани 82 С), при этом получали прозрачный раствор. Раствор охлаждали приблизительно до 25 С в течение приблизительно 90 мин, но при этом образование кристаллов не наблюдалось. Затем раствор перемешивали на ледяной бане, при этом кристаллизация начиналась при приблизительно 0 С. Полученную суспензию перемешивали на ледяной бане в течение еще приблизительно 3,5 ч, затем кристаллы отделяли фильтрованием. Кристаллы высушивали в вакууме при 80 С в течение приблизительно 15 ч,при этом получали 0,14 г бензоата линаглиптина в виде смеси аморфной и кристаллической форм бензоата линаглиптина, но которая не представляла собой форму II. Ссылочный пример 1. Получение кристаллического бензоата линаглиптина, описанного в заявкеWO 2010/072776 А 1. Смесь линаглиптина в виде свободного основания (2,50 г) в изопропаноле (20 мл) нагревали с обратным холодильником. В горячую суспензию добавляли бензойную кислоту (646 мг), растворенную в изопропаноле (5 мл). Смесь охлаждали до приблизительно 25 С и перемешивали при указанной температуре в течение еще приблизительно 7,5 ч. Твердое вещество отделяли фильтрованием и сушили при 40 С в течение приблизительно 13 ч, при этом получали 2,94 г кристаллического бензоата линаглиптина в виде формыI бензоата линаглиптина, описанной в заявке WO 2010/072776 А 1, что подтверждали методом ПРД. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма II бензоата линаглиптина, которая характеризуется порошковой рентгеновской дифрактограммой, которая включает пики угла 2 при 8,00,2, 8,70,2, 10,40,2, 12,90,2,13,80,2 и 17,40,2. 2. Кристаллическая форма II бензоата линаглиптина по п.1, которая характеризуется ИК-спектром,включающим пики при волновых числах 17012 см-1, 16632 см-1, 11342 см-1, 7602 см-1 и 7242 см-1. 3. Кристаллическая форма II бензоата линаглиптина по п.1 или 2, которая характеризуется кривой ДСК, на которой наблюдается эндотермический пик с начальной температурой плавления при приблизительно 193 С. 4. Кристаллическая форма II бензоата линаглиптина по любому из предшествующих пунктов, которая при относительной влажности приблизительно 3% характеризуется содержанием воды приблизительно 0 мас.%, а при относительной влажностью приблизительно 90% приблизительно 2,0 мас.% содержанием воды. 5. Кристаллическая форма II бензоата линаглиптина по любому из предшествующих пунктов в форме сфероидных частиц, при этом внешний диаметр сфероидных частиц находится в диапазоне от 10 до 100 мкм. 6. Способ получения кристаллической формы II бензоата линаглиптина по любому из пп.1-5, который включает следующие стадии: а) растворение бензоата линаглиптина в ацетонитриле, при этом после нагревания получают концентрацию в диапазоне приблизительно от 10 до приблизительно 20 г/л,б) охлаждение раствора со скоростью охлаждения -1 С/мин для индукции кристаллизации при температуре выше 35 С,в) отделение полученных кристаллов. 7. Фармацевтическая композиция для лечения сахарного диабета типа 2 и связанных с ним заболеваний, которая включает кристаллическую форму II бензоата линаглиптина по любому из пп.1-5 и по крайней мере один фармацевтически приемлемый эксципиент. 8. Фармацевтическая композиция по п.7, которая представляет собой пероральную лекарственную форму, прежде всего капсулу или таблетку. 9. Фармацевтическая композиция по п.7 или 8, которая дополнительно включает метформин, пиоглитазон, сульфонилмочевину или их фармацевтически приемлемую соль. 10. Фармацевтическая композиция по п.7 или 8, которая дополнительно включает метформин или его фармацевтически приемлемую соль и сульфонилмочевину или ее фармацевтически приемлемую соль. 11. Применение кристаллической формы II бензоата линаглиптина по любому из пп.1-5 для получения фармацевтической композиции, предназначенной для применения в зонах с климатом типа Af илиAm согласно классификации климата по Кппену-Гейгеру. 12. Способ получения фармацевтической композиции, по п.7, который включает стадию смешивания кристаллической формы II бензоата линаглиптина по любому из пп.1-5 по крайней мере с одним фармацевтически пригодным эксципиентом. 13. Способ по п.12, в котором смешивание проводят в ходе влажной грануляции. 14. Контейнер, который включает фармацевтическую композицию по любому из пп.7-10, при этом контейнер изготовлен из материала, который характеризуется проницаемостью для водяного пара, определенной согласно стандарту DIN 53122, а именно от 1,0 до 5000 гм-2 сут-1. 15. Контейнер по п.14, который представляет собой блистерную упаковку, включающую пероральную лекарственную форму, при этом блистерная упаковка изготовлена из поливинилхлорида, полистирола, полиамида, полиэтиленвинилацетата, целлофана и/или ацетата целлюлозы.
МПК / Метки
МПК: A61K 31/522, C07D 473/04
Метки: линаглиптина, форма, бензоата, полиморфная
Код ссылки
<a href="https://eas.patents.su/11-23330-polimorfnaya-forma-benzoata-linagliptina.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфная форма бензоата линаглиптина</a>
Предыдущий патент: Способ синтеза 3-(2-бром-4,5-диметоксифенил)пропаннитрила и применение в синтезе ивабрадина и его фармацевтически приемлемых кислотно-аддитивных солей
Следующий патент: Композиции антител к vegfr-3
Случайный патент: 2-фенил-1-[4-(2-аминоэтокси)бензил]индол в комбинации с эстрогенами