Непептидные антагонисты брадикинина и фармацевтические композиции на их основе
Номер патента: 10913
Опубликовано: 30.12.2008
Авторы: Росси Кристина, Джолитти Алессандро, Феличетти Патриция, Финчам Кристофер Инго, Куартара Лаура, Маджи Карло Альберто
Формула / Реферат
1. Соединения общей формулы (I)
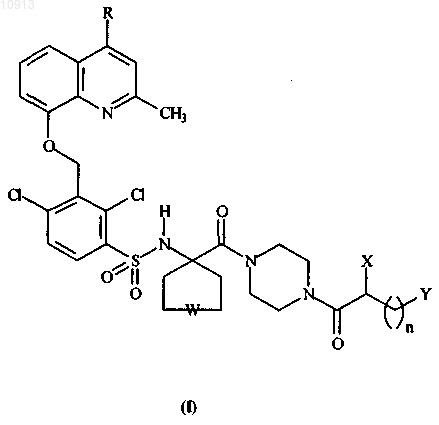
где R представляет собой водород или метил;
W означает одинарную связь или атом кислорода;
n=3;
X представляет собой водород или аминогруппу -NR1R2, где R1 и R2 независимо могут представлять собой водород или группу, выбранную из метила, этила, н-пропила, изопропила;
Y представляет собой четвертичную аммониевую группу -NR3R4R5, где R3, R4, R5 независимо могут представлять собой группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила, изобутила,
н-пентила; и
их фармацевтически приемлемые соли, энантиомеры и смеси энантиомеров.
2. Соли соединений общей формулы (I) с неорганическими или органическими кислотами, выбранными из соляной, бромоводородной, йодисто-водородной, серной, фосфорной, уксусной, трифторуксусной, пропионовой, щавелевой, яблочной, малеиновой, янтарной, малоновой, аспарагиновой, глутаминовой кислот.
3. Соединения по п.1 или 2, где
W означает одинарную связь;
n=3;
X выбран из водорода или группы -NH2;
Y представляет собой четвертичную аммониевую группу -N(CH3)3+;
другие заместители такие, как определено в п.1.
4. Соединения по п.1 или 2, где
R выбран из водорода или метила;
W означает атом кислорода;
n=3;
X выбран из водорода или группы -NH2;
Y представляет собой четвертичную аммониевую группу -N(CH3)3+;
другие заместители такие, как определено в п.1.
5. Следующее соединение по п.3:
{4-(S)-амино-5-[4-[1-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]циклопентанкарбонил]пиперазин-1-ил]-5-оксопентил}триметиламмонийхлорида дигидрохлорид.
6. Следующие соединения по п.4:
{4-(S)-амино-5-[4-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]-5-оксопентил}триметиламмонийхлорида дигидрохлорид;
{4-(S)-амино-5-[4-[4-[2,4-дихлор-3-(2-метилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]-5-оксопентил}триметиламмонийхлорида дигидрохлорид;
{5-[4-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил]бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил)-5-оксопентил}триметиламмония трифторацетат.
7. Фармацевтические композиции, содержащие в качестве активного ингредиента соединение по пп.1-6 вместе с фармацевтически приемлемыми эксципиентами.
8. Применение соединения по пп.1-6 для приготовления фармацевтических композиций для лечения всех состояний, в которые вовлечена активация брадикининовых B2-рецепторов.
9. Применение соединения по п.8 для приготовления фармацевтических композиций для лечения воспалительных, аллергических и аутоиммунных состояний.
10. Применение соединения по п.8 для приготовления фармацевтических композиций для лечения астмы и хронического бронхита, аллергического, вазомоторного и вирусного ринита, хронического обструктивного заболевания легких (ХОЗЛ), ревматоидного артрита, хронических воспалительных заболеваний кишечника (болезни Крона и неспецифического язвенного колита), гломерулонефрита, псориаза, сыпи, острого и хронического цистита, цирроза печени, гломерулопатий и легочного фиброза, атеросклероза, острой и хронической боли, септического, аллергического и посттравматического шока, гепаторенального синдрома при циррозе печени, гипотензии, алопеции, рака и антиангиогенных заболеваний.
Текст
010913 Область изобретения Настоящее изобретение относится к непептидным соединениям, содержащим четвертичную аммониевую группу, обладающим активностью специфичных антагонистов брадикининового рецептора B2, к содержащим их фармацевтическим композициям и к применению их для лечения всех состояний, в которые вовлечена активация брадикининового B2-рецептора. Предшествующий уровень техники Брадикинин (BK) относится к кининам и образует вместе с каллидином и T-кинином подгруппу кининов, присутствующих у млекопитающих. Как медиаторы боли и воспаления, кинины играют важную роль в центральной и периферической нервной системе. В частности, брадикинин представляет собой нонапептид(H-Arg1-Pro2-Pro3-Gly4-Phe5-Ser6-Pro7-Phe8-Arg9-OH),продуцируемый организмом в физиопатологических состояниях. Существуют два типа кининовых рецепторов: B1 и B2. Основным характерным признаком рецептора B1 является то, что он является более индуцибельным, нежели конститутивным. Он экспрессируется в тканях в воспалительных и стрессовых состояниях. С другой стороны, B2 представляет собой конститутивный рецептор, который в нормальном состоянии присутствует во всех тканях и действует как медиатор во время воспалительного процесса. Брадикинин и каллидин высвобождаются из их белковых предшественников (известных как кининогены) протеолитическими ферментами, называемыми кининогеназами. Среди них главную роль играют калликреины, которые, однако, сразу после высвобождения предшественником могут оказывать свое действие только в течение короткого промежутка времени, поскольку они быстро разрушаются рядом циркулирующих ферментов и мембранами, определяемых в общем как кининазы. Одна из этих кининаз расщепляет брадикинин по C-концевому аргинину с образованием в результате des-Arg-BK, который действует как агонист B1-рецептора. Активация брадикининовых B1- и B2-рецепторов вызывает релаксацию васкулярных мышц с последующей гипотензией; увеличение сосудистой проницаемости; сокращение гладких мышц кишечника и дыхательных путей; стимуляцию ноцицептивных нейронов; изменение ионной эпителиальной секреции; продуцирование оксида азота и высвобождение цитокинов лейкоцитами и эйкозаноидами из различных типов клеток. Отсюда следует, что соединения-антагонисты BK-рецепторов можно рассматривать как новый класс лекарственных средств, активных, по общему мнению, при различных расстройствах. Возможными терапевтическими показаниями к применению указанных антагонистов являются воспалительные, аллергические и аутоиммунные расстройства, такие как астма и хронический бронхит(также вызванный раздражителями), аллергический, вазомоторный и вирусный ринит, обструктивное заболевание легких (ХОЗЛ), ревматоидный артрит, хронические воспалительные заболевания кишечника(болезнь Крона и неспецифический язвенный колит), гломерулонефрит, псориаз, сыпь, острый и хронический цистит; дегенеративные расстройства, характеризующиеся фиброзом, такие как цирроз печени,гломерулопатии и легочный фиброз, атеросклероз; благодаря своей аналгетической активности в лечении как острой, так и хронической боли, например, при ожогах, цефалии, укусах насекомых, хронической боли у пациентов, страдающих раком; при расстройствах сердечно-сосудистого аппарата, таких как септический, аллергический и посттравматический шок, и гепаторенального синдрома при циррозе печени; в качестве противоопухолевых и антиангиогенных средств; при лечении гипотензии и алопеции. Из литературы известны различные пептидные и непептидные антагонисты брадикининовогоB2-рецептора. В WO 03103671 раскрыто большое семейство соединений, обладающих антагонистической активностью в отношении брадикининового B2-рецептора. Соединения по настоящему изобретению, хотя и подпадают под общую формулу соединений, раскрытых в WO 03103671, не описаны или не охарактеризованы в указанном документе. Подробное описание изобретения Настоящее изобретение относится к непептидным соединениям, демонстрирующим высокую аффинность и антагонистическую активность по отношению к рецептору B2, имеющим общую формулу где R представляет собой водород или метил;W означает одинарную связь или атом кислорода;X представляет собой водород или аминогруппу -NR1R2, где R1 и R2 независимо могут представлять собой водород или группу, выбранную из метила, этила, н-пропила, изопропила;Y представляет собой четвертичную аммониевую группу -NR3R4R5, где R3, R4, R5 независимо могут представлять собой группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила, изобутила,н-пентила; и их солям с фармацевтически приемлемыми кислотами. Предпочтительны соли соединений формулы (I) с неорганическими или органическими кислотами,выбранными из соляной, бромоводородной, йодисто-водородной, серной, ортофосфорной, уксусной,трифторуксусной, пропионовой, щавелевой, яблочной, малеиновой, янтарной, малоновой, аспарагиновой, глутаминовой кислот. Кроме того, так как соединения формулы (I) имеют хиральный центр, изобретение также охватывает два энантиомера или их смеси в любом соотношении, включая рацемические смеси. Соединения общей формулы (I) обладают как in vivo, так и in vitro антагонистической активностью в отношении B2-рецептора, более высокой по сравнению со сходными по структуре аналогами, описанными в WO 03103671. Предпочтительны соединения общей формулы (I), гдеX - водород или группа -NH2;Y - четвертичная аммониевая группа -N(CH3)3+; другие заместители такие, как определено выше. Особенно предпочтительны соединения (I), гдеR представляет собой водород или метил;X представляет собой водород или группу -NH2;Y представляет собой четвертичную аммониевую группу -N(CH3)3+. Соединения по настоящему изобретению могут быть получены общеизвестными способами синтеза. Предпочтительно соединения общей формулы (I), как они определены выше, получают конденсацией в присутствии подходящего агента конденсации промежуточного соединения общей формулы (II),полученного, как описано в WO 03103671 или его производным, где карбоксильная группа активирована подходящим образом. Способ синтеза иллюстрируется на схеме 1. Соединение формулы (2) получают, как описано в J. Med. Chem., 2001, 44, 1674-1689, бромированием соответствующего производного толуола, которое, в свою очередь, получено, как описано в J. Fluorine Chemistry, 2000, 101:85-89. Первая стадия включает образование сульфонамидной связи в результате конденсации промежуточных соединений (2) и (3) с получением соединения (4). Эту реакцию проводят при комнатной температуре, предпочтительно в ацетонитриле/воде (2:1), в присутствии гидрокарбоната натрия (NaHCO3). Указанная реакция происходит с обменом хлора и брома в положении бензила: полученную смесь продуктов непосредственно используют на следующей стадии. В результате реакции смеси галогеновых производных с дизамещенным гидроксихинолином (5) в присутствии карбоната калия (K2CO3) и йодида калия (KI) в ацетоне при кипячении с обратным холодильником образуется сложноэфирное производное(6). Соединение формулы (5), т.е. 2,4-диметил-8-гидроксихинолин, в котором R4=R5=CH3, получают так, как описано в WO 9640639. Метиловый эфир формулы (6) подвергают гидролизу в основных условиях до карбоновой кислоты(7), которую подвергают конденсации с Boc-пиперазином (8) с получением промежуточного соединения(9). Указанную реакцию конденсации проводят по известной для пептидного синтеза методике с использованием гидроксибензотриазола для активации карбоксильной группировки, агента конденсации, такого как 1-этил-3-(3'-диметилпропил)карбодиимид, и третичного амина, а именно диизопропилэтиламина,3 экв. в пересчете на агент конденсации. Соединение (II) получают путем отщепления группы Boc от промежуточного соединения (9) с использованием раствора соляной кислоты (4 н.) в диоксане и выделения свободного амина вместо гидрохлорида. Производное (11) получают конденсацией промежуточного соединения (10) с аминокислотой (11) по методике, описанной для получения соединения (9) из соединения (7). Любая присутствующая группаBoc может быть удалена из промежуточного соединения (11) с использованием раствора соляной кислоты (4 н.) в диоксане с получением в результате конечного соединения. В случае, когда триалкиламмониевая группа отсутствует в каком-либо из коммерчески доступных промежуточных соединений, она может быть синтезирована, начиная с соответствующего амина с использованием известных методик (Rapoportet al., J. Org. Chem., 1977, 42:139-141; Chen et al., J. Biochem., 1978, 56:150-152). Соединения по изобретению используют в лечении всех тех расстройств, при которых необходимо блокировать или ослабить активацию брадикининового рецептора. Они особенно подходят для лечения воспалительных, аллергических и аутоиммунных расстройств, таких как астма и хронический бронхит,аллергический, вазомоторный и вирусный ринит, хроническое обструктивное заболевание легких(ХОЗЛ), ревматоидный артрит, хронические воспалительные заболевания кишечника (болезнь Крона и-3 010913 неспецифический язвенный колит), гломерулонефрит, псориаз, сыпь, острый и хронический цистит,цирроз печени, гломерулопатии и легочный фиброз, атеросклероз, острая и хроническая боль, септический, аллергический и посттравматический шок, гепаторенальный синдром при циррозе печени, гипотензия, алопеция, или в качестве противоопухолевых и антиангиогеннных средств. Для применения в терапии готовят подходящие препараты соединений по изобретению вместе с фармацевтически приемлемыми носителями/эксципиентами. Предпочтительны фармацевтические формы, подходящие для перорального введения, такие как таблетки, капсулы, гранулы, порошки, растворы,суспензии, сиропы и т.д. Эти фармацевтические препараты могут быть приготовлены общепринятыми способами с использованием ингредиентов, известных в данной области, таких как лиганды, разрыхлители, смазывающие вещества, наполнители, стабилизаторы, разбавители, красители, корригенты, увлажнители и другие эксципиенты, известные специалистам в данной области техники. Препараты для перорального введения также включают формы с длительным высвобождением, такие как таблетки или гранулы с энтеросолюбильной оболочкой. Твердые композиции для перорального введения могут быть приготовлены традиционными способами смешивания, наполнения или прессования. Жидкие препараты для перорального введения могут быть приготовлены в форме, например, водных или масляных суспензий или растворов, эмульсий, сиропов или могут быть приготовлены в виде сухого продукта для разведения перед применением в воде или другом подходящем носителе. Дозировка может быть в диапазоне, зависящем от возраста и общего состояния пациента, природы и тяжести заболевания или расстройства и пути и типа введения. Как правило, в случае перорального введения пациенту - взрослому человеку соединения по настоящему изобретению обычно вводят в суммарной суточной дозировке в диапазоне от 1 до 1000 мг, предпочтительно от 5 до 300 мг разовой дозой или разделенными дозами. Приведенные ниже примеры более подробно иллюстрируют изобретение. Пример 1. 4-(S)-Амино-5-[4-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]-5-оксопентилтриметиламмонийхлорида дигидрохлорид.(Соединение общей формулы (I), где R=CH3, W=-O-, X=NH2, n=3, Y=N(CH3)3+Cl-). Это соединение синтезируют путем синтеза, проиллюстрированным на схеме 2. Схема 2-4 010913 Промежуточное соединение (2). 2,4-Дихлор-3-бромметил-бензолсульфонилхлорид. К 10 мл хлорсульфоновой кислоты по каплям добавляют 4,8 мл 2,6-дихлортолуола в течение 2 ч при перемешивании магнитной мешалкой при комнатной температуре. После окончания добавления смесь нагревают при 40C в течение 2 ч с получением пурпурного раствора, который охлаждают и осторожно выливают в смесь лед-вода (0,5 л) при энергичном перемешивании. Выделившееся белое твердое вещество отфильтровывают, растирают, промывают водой, сушат над KOH и очищают промыванием н-гексаном с добавлением 200 мл растворителя при сильном перемешивании. Смесь фильтруют, твердое вещество отбрасывают, а растворитель выпаривают досуха с получением 2,4-дихлор-3-метилбензолсульфонилхлорида в виде белого кристаллического твердого вещества. Выход: 85%. Чистота по результатам ЖХВД: 86% (30% Б, 3%/мин; время удерживания Rt=19,7 мин). 1H-ЯМР (CDCl3):(м.д.) 2,6 (s, 3H), 7,5 (d, 1H), 7,95 (d, 1H). МС-ЭРИ(+) (масс-спектрометрия с электрораспылительной ионизацией с регистрацией положительных ионов): m/z 260 [М+Н]+. Это промежуточное соединение бромируют в следующих условиях: 20 ммоль 2,4-дихлор-3-метилбензолсульфонилхлорида растворяют в ацетонитриле. При перемешивании при комнатной температуре добавляют 2 экв. NBS до полного растворения NBS. В конце добавляют 0,1 экв. азо-бисизобутиронитрила (AIBN) и эту смесь нагревают при 70C в течение приблизительно 6 ч. Раствор упаривают, остаток переносят в этилацетат, промывают H2O и 5% NaHCO3, сушат над сухим Na2SO4 и фильтруют. Органическую фазу упаривают до получения вязкой, слегка окрашенной жидкости, которую переносят в петролейный эфир. Остаток фильтруют и из раствора получают соединение (2') в виде слегка окрашенного кристаллического твердого вещества. Чистота по результатам ЖХВД: 95% (от 50% Б до 5%/мин, Rt=18,72). 1CH3OH, охлаждают до -60C и по каплям добавляют SOCl2 (3 экв.) при перемешивании. После окончания добавления смесь оставляют нагреваться до комнатной температуры, затем постепенно нагревают до закипания с получением прозрачного раствора (приблизительно 2 ч), который охлаждают, остаток фильтруют и концентрируют в вакууме. Выход 80%. Чистота (ЯМР): 85%. 1H-ЯМР (ДМСО-d6):(м.д.) 1,91-2,04 (m, 4H), 3,78 (s, 3H), 3,60-3,85 (m, 4H), 9,00 (s, 3H). МС-ЭРИ(+): m/z 160,1 [М+Н]+. Промежуточное соединение (4'). Метиловый эфир 4-(3-бромметил-2,4-дихлорбензолсульфониламино)тетрагидропиран-4-карбоновой кислоты. Промежуточное соединение (3') (1,1 экв.) растворяют в воде вместе с 4 экв. K2CO3. Этот раствор добавляют к раствору 1 экв. (10 ммоль) промежуточного соединения (2) в ацетонитриле и перемешивают при комнатной температуре до образования осадка (4 ч). Растворитель выпаривают и остаток растворяют в этилацетате и 0,1 М HCl (1/1). Органическую фазу отделяют и сушат над Na2SO4. Растворитель выпаривают, полученное твердое вещество промывают циклогексаном с получением белого твердого вещества, в котором хлор/бромпроизводные присутствуют в соотношении 10/1. Выход: 60%. Чистота по результатам ЖХВД: 88% (20% Б при 3%/мин; Rt=14,11 (Br) и 14,47 (Cl. 1H-ЯМР (CDCl3):(м.д.) 1,81-1,99 (m, 2H), 2,07-2,25 (m, 2H), 3,49-3,71 (m, 7H), 4,81 (s, 1,5H, [Br]),4,94 (s, 0,3H, [Cl]), 5,30 (brs, 1H), 7,47-7,53 (m, 1H), [7,49 (d, J=8,5 Гц, X=Br), 7,51 (d, J=8,5 Гц, X=Cl)],7,91-7,98 (m, 1H), [7,94 (d, J=8,5 Гц, X=Br), 7,96 (d, J=8,5 Гц, Х=Cl)]. Промежуточное соединение (6'). Метиловый эфир 4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. Хинолин (5') (0,48 ммоль) и LiOH (2,5 экв.) смешивают при комнатной температуре в атмосфере азота в метилэтилкетоне (МЭК). Смесь выдерживают при перемешивании в атмосфере азота в течение 90 мин. Промежуточное соединение (4) растворяют в смеси МЭК/сухой ДМФ (2/1) (42 мл, 12 мл/ммоль) и этот раствор, содержащий хинолин, по каплям при перемешивании добавляют к реакционной смеси. Перемешивание продолжают в течение 16 ч. Реакционную смесь концентрируют в вакууме и остаток растворяют в этилацетате (50 мл, 100 мл/ммоль). Органическую фазу промывают (350 мл) буферным раствором pH 4,2, сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением желтого масла. Выход: 33%. Чистота по результатам ЖХВД: 77% (20% Б, 3%/мин; Rt=9,54). 1(m, 2H), 3,60 (s, 3H), 5,57 (s, 2H), 7,30 (s, 1H), 7,39 (d, 1H), 7,50 (dd, 1H), 7,67 (d, 1H), 7,78 (d, 1H), 8,02 (d,1H), 8,77 (bs, 1H). МС-ЭРИ(+): m/z 553,1 [М+Н]+. Промежуточное соединение (7'). 4-[2,4-Дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбоновая кислота. Промежуточное соединение формулы (6') растворяют в ТГФ и в этот раствор добавляют 10 экв. 1 МLiOH в воде. Смесь перемешивают в течение 4 ч при 40C, затем растворитель выпаривают. Остаток растворяют в воде и добавляют 0,1 М HCl до pH 4. Водную фазу экстрагируют дихлорметаном и органическую фазу сушат над Na2SO4. Растворитель выпаривают с получением желтого твердого остатка. Выход: 90%. Чистота по результатам ЖХВД: 99% (20% Б, 3%/мин; Rt=7,72). 1(m, 2H), 5,58 (s, 2H), 7,30 (s, 1H), 7,37 (d, 1H), 7,46 (t, 1H), 7,67 (d, 1H), 7,75 (d, 1H), 8,03 (d, 1H), 8,64 (bs,1H). МС-ЭРИ(+): m/z 539,1 [М+Н]+. Промежуточное соединение (9'). 4-трет-Бутоксикарбонил-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8 илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил. Промежуточное соединение (7') (1,3 ммоль) и HOBt (1,1 экв.) суспендируют в 50 мл сухого ДМФ в круглодонной колбе емкостью 100 мл в атмосфере азота. Смесь охлаждают до 4C и в нее добавляютEDCI [1-этил-3-(3'-диметилпропил)карбодиимид]. При перемешивании добавляют HCl (1,1 экв.). Перемешивание при 4C продолжают в течение 1 ч, затем добавляют DIPEA (2 экв.) и Boc-пиперазин (1 экв.) и эту смесь оставляют нагреваться до комнатной температуры при перемешивании. Через 12 ч растворитель выпаривают, остаток растворяют в 40 мл ДХМ и органическую фазу промывают рассолом (20 мл) и сушат над Na2SO4. Растворитель выпаривают с получением масла, которое очищают на колонке 70 гVarian Mega Bond (основная флэш-система) (этилацетат, Rf=0,50) с получением желтого твердого вещества. Выход: 96%. Чистота по результатам ЖХВД: 98% (20% Б, 3% Б/мин, Rt=11,14). 1H-ЯМР (CDCl3):(м.д.) 1,45 (s, 9H), 1,55-1,80 (m, 2H), 2,05-2,20 (m, 4H), 2,56 (s, 3H), 2,64 (s, 3H),3,38-3,90 (m, 10H), 5,58 (s, 2H), 7,10 (s, 1H), 7,30 (s, 1H), 7,37 (d, 1H), 7,46 (t, 1H), 7,67 (d, 1H), 7,75 (d, 1H),8,03 (d, 1H), 8,64 (bs, 1H). МС-ЭРИ(+): m/z 707,2 [М+Н]+. Промежуточное соединение (1'). 4-[2,4-Дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонилпиперазин-1-ил. К 0,62 ммоль промежуточного соединения (9') добавляют 10 мл смеси HCl/диоксан 4 М и эту смесь перемешивают в течение 3 ч. Растворитель выпаривают и остаток подвергают сублимационной сушке с получением гидрохлорида (1') в виде желтого твердого вещества. Выход: 98%. Чистота по результатам ЖХВД: 92% (20% Б, 3%/мин; Rt=5,34). 1(m, 8H), 8,95 (d, 1H). МС-ЭРИ(+): m/z 609,1 [M+H]+. Промежуточное соединение (10'). (4-трет-Бутоксикарбониламино-4-карбоксибутил)триметиламмоний. 10 ммоль Boc-Orn-OH суспендируют в метаноле (20 мл) и в эту суспензию добавляют 44 ммоль изомочевины. Колбу закрывают пробкой и выдерживают при перемешивании при комнатной температуре в течение 2 дней. Полученный раствор анализируют методом ТСХ (элюент: CHCl3/CH3OH/NH4OH 40/54/6; Boc-Orn-OH Rf=0,29; (10') Rf: 0,11, детектирование KMnO4). Метанол выпаривают в вакууме и остаток суспендируют в 150 мл воды и фильтруют. Круглодонную колбу и твердое вещество промывают водой (250 мл) и все водные фракции промывок объединяют, затем концентрируют в вакууме (40 мл). Полученное твердое вещество (4,068 г) суспендируют в воде(500 мл), объединяют, концентрируют в вакууме для удаления CH3CN, подвергают сублимационной сушке и в конце упаривают с 150 мл абсолютного этанола с получением 442 мг белого высокогигроскопичного твердого вещества. Выход: 16%. 1-6 010913 Промежуточное соединение (11'). 4-(S)-трет-Бутоксикарбониламино-5-[4-[4-[2,4-дихлор-3-(2,4 диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]5-оксопентилтриметиламмонийхлорид. Промежуточное соединение (10'), 1,2 ммоль, растворяют в ДМФ и в этот раствор добавляют дициклогексилкарбодиимид (1,2 экв.) и HOBt (1,2 экв.). Смесь перемешивают в течение 30 мин, затем в нее добавляют диизопропиламинометилполистирол (1,5 экв.) и промежуточное соединение (1') (1 экв.). Смесь перемешивают в течение 24 ч. Смолу отфильтровывают, растворитель выпаривают и остаток растворяют в воде и этилацетате. Водную фазу отделяют и подвергают сублимационной сушке. Неочищенный продукт очищают препаративной ЖХВД (колонка Vydac 218TP, C18, 25050 мм, скорость потока 60 мл/мин, градиент с 10 до 70% CH3CN/0,l% ТФУ в течение 120 мин, УФ-детектор при 240 нм, сбор с 55 до 75 мин) с получением, после сублимационной сушки, промежуточного соединения (11') в виде белого твердого вещества. Выход: 46%. Чистота по результатам ЖХВД: 98% (20% Б, 3%/мин; Rt=7,68). 1H-ЯМР (ДМСО-d6):(м.д.) 1,4 (s, 9H), 1,8-1,45 (m, 6H), 1,95-1,85 (m, 2H), 2,81 (m, 6H), 3,08 (s, 9H),3,70-3,18 (m, 7H), 4,01-3,56 (5H, m), 4,57-4,45 (m, 1H), 5,59 (s, 2H), 7,25 (d, 1H), 7,90-7,43 (m, 4H), 8,02 (d,1H), 8,85 (s, 1H). МС-ЭРИ(+): m/z 863,2 [М+Н]+. 4-(S)-Амино-5-[4-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]-5-оксопентилтриметиламмонийхлорида дигидрохлорид. К 0,45 ммоль соединения (11') добавляют 10 мл смеси HCl/диоксан 4 М. Смесь перемешивают в течение 6 ч, растворитель выпаривают и остаток подвергают сублимационной сушке с получением конечного соединения в виде белого твердого вещества. Выход: 87%. Чистота по результатам ЖХВД: 98% (20% Б, 3%/мин; Rt=5,14). 1H-ЯМР (ДМСО-d6):(м.д.) 8,90 (s, 1H), 8,48 (s, 3H), 8,02 (d, 1H), 7,95-7,63 (m, 3H), 5,59 (s, 2H),4,57-4,45 (m, 1H), 3,97-3,24 (m, 10H), 3,08 (s, 9H), 2,95-2,61 (m, 5H), 1,97-1,72 (m, 8H), 1,42 (s, 4H). ЖХВД: tR=5,88 мин. МС: [М]+ 747,2. Биологическая активность. Для оценки аффинности к B2-рецептору соединений по настоящему изобретению проводили исследования связывания с B2-рецептором человека, экспрессированного в клетках яичника китайского хомячка (CHO), следуя методике, описанной Bellucci et al., Br. J. Pharmacol. 2003, 140:500-506; показатели связывания выражены в виде pKi. Антагонистическую активность (выраженную в виде pA2) оценивают по ингибированию индуцированной брадикинином продукции инозитолов в клетках CHO, трансфицированных B2-рецептором человека, по методике, описанной Bellucci et al., Br. J. Pharmacol. 2003, 140:500-506. Активность соединений по настоящему изобретению in vivo оценивали по эффективности ингибирования BK-индуцированного бронхоспазма у морской свинки (Tramontana et al., J. Pharmacol. Exp.Therap., 296:1051-1057, 2001), измеряя в.т. дозу (в.т. - внутритрахеальное введение) (в нмоль/кг), которая ингибировала бронхоконстрикцию на 80% в течение по меньшей мере 210 мин. Предпочтительные соединения по настоящему изобретению сравнивали со сходными по структуре соединениями, раскрытыми в WO 03103671. Неожиданно было обнаружено, что соединения по изобретению обладают активностью in vivo и in vitro, более высокой по сравнению с близкими по структуре аналогами из WO 03103671. Как тест на антагонистическую активность на клетках, трансфицированных рецептором человека, так и тест in vivo в значительной степени позволяют прогнозировать будущую дозу для терапевтического применения у людей. Сокращения в.т. - внутритрахеальное введение; в.в. -внутривенное введение; экв. - эквивалент; ДХМ - дихлорметан;DIPEA - диизопропилэтиламин; ЖХВД - жидкостная хроматография высокого давления; ТСХ - тонкослойная хроматография; ЯМР - ядерный магнитный резонанс; ЭРИ - электрораспылительная ионизация; МС - масс-спектрометрия; КФХ - колоночная флэш-хроматография; ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) где R представляет собой водород или метил;W означает одинарную связь или атом кислорода;X представляет собой водород или аминогруппу -NR1R2, где R1 и R2 независимо могут представлять собой водород или группу, выбранную из метила, этила, н-пропила, изопропила;Y представляет собой четвертичную аммониевую группу -NR3R4R5, где R3, R4, R5 независимо могут представлять собой группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила, изобутила,н-пентила; и их фармацевтически приемлемые соли, энантиомеры и смеси энантиомеров. 2. Соли соединений общей формулы (I) с неорганическими или органическими кислотами, выбранными из соляной, бромоводородной, йодисто-водородной, серной, фосфорной, уксусной, трифторуксусной, пропионовой, щавелевой, яблочной, малеиновой, янтарной, малоновой, аспарагиновой, глутаминовой кислот. 3. Соединения по п.1 или 2, гдеX выбран из водорода или группы -NH2;Y представляет собой четвертичную аммониевую группу -N(CH3)3+; другие заместители такие, как определено в п.1. 4. Соединения по п.1 или 2, гдеR выбран из водорода или метила;X выбран из водорода или группы -NH2;Y представляет собой четвертичную аммониевую группу -N(CH3)3+; другие заместители такие, как определено в п.1. 5. Следующее соединение по п.3: 4-(S)-амино-5-[4-[1-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]циклопентанкарбонил]пиперазин-1-ил]-5-оксопентилтриметиламмонийхлорида дигидрохлорид. 6. Следующие соединения по п.4: 4-(S)-амино-5-[4-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]-5-оксопентилтриметиламмонийхлорида дигидрохлорид; 4-(S)-амино-5-[4-[4-[2,4-дихлор-3-(2-метилхинолин-8-илоксиметил)бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил]-5-оксопентилтриметиламмонийхлорида дигидрохлорид; 5-[4-[4-[2,4-дихлор-3-(2,4-диметилхинолин-8-илоксиметил]бензолсульфониламино]тетрагидропиран-4-карбонил]пиперазин-1-ил)-5-оксопентилтриметиламмония трифторацетат. 7. Фармацевтические композиции, содержащие в качестве активного ингредиента соединение по пп.1-6 вместе с фармацевтически приемлемыми эксципиентами. 8. Применение соединения по пп.1-6 для приготовления фармацевтических композиций для лечения всех состояний, в которые вовлечена активация брадикининовых B2-рецепторов. 9. Применение соединения по п.8 для приготовления фармацевтических композиций для лечения-9 010913 воспалительных, аллергических и аутоиммунных состояний. 10. Применение соединения по п.8 для приготовления фармацевтических композиций для лечения астмы и хронического бронхита, аллергического, вазомоторного и вирусного ринита, хронического обструктивного заболевания легких (ХОЗЛ), ревматоидного артрита, хронических воспалительных заболеваний кишечника (болезни Крона и неспецифического язвенного колита), гломерулонефрита, псориаза,сыпи, острого и хронического цистита, цирроза печени, гломерулопатий и легочного фиброза, атеросклероза, острой и хронической боли, септического, аллергического и посттравматического шока, гепаторенального синдрома при циррозе печени, гипотензии, алопеции, рака и антиангиогенных заболеваний.
МПК / Метки
МПК: A61K 31/47, A61P 29/00, C07D 215/26
Метки: антагонисты, фармацевтические, основе, брадикинина, непептидные, композиции
Код ссылки
<a href="https://eas.patents.su/11-10913-nepeptidnye-antagonisty-bradikinina-i-farmacevticheskie-kompozicii-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Непептидные антагонисты брадикинина и фармацевтические композиции на их основе</a>
Предыдущий патент: Способ получения производных 2-оксо-1-пирролидина внутримолекулярным аллилированием
Следующий патент: Насос, в частности шламовый насос
Случайный патент: Способ предотвращения остеопороза












