Новый способ синтеза и новая кристаллическая форма агомелатина и фармацевтические композиции, которые её содержат
Номер патента: 8473
Опубликовано: 29.06.2007
Авторы: Дамьен Жерар, Гонсалес-Бланко Исаак, Томино Жилль, Шапюи Женевьев, Суви Жан-Клод, Орва Стефан
Формула / Реферат
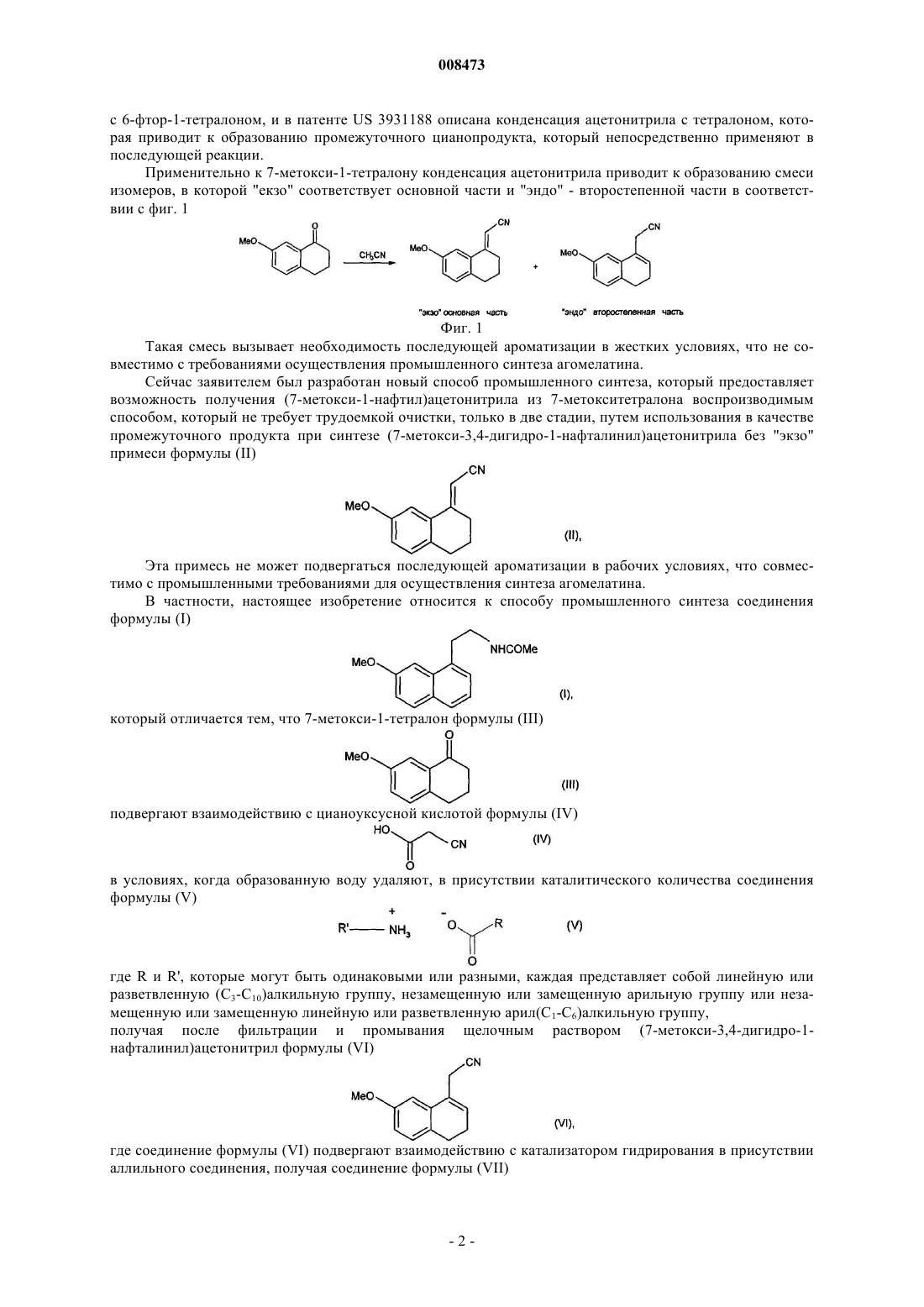
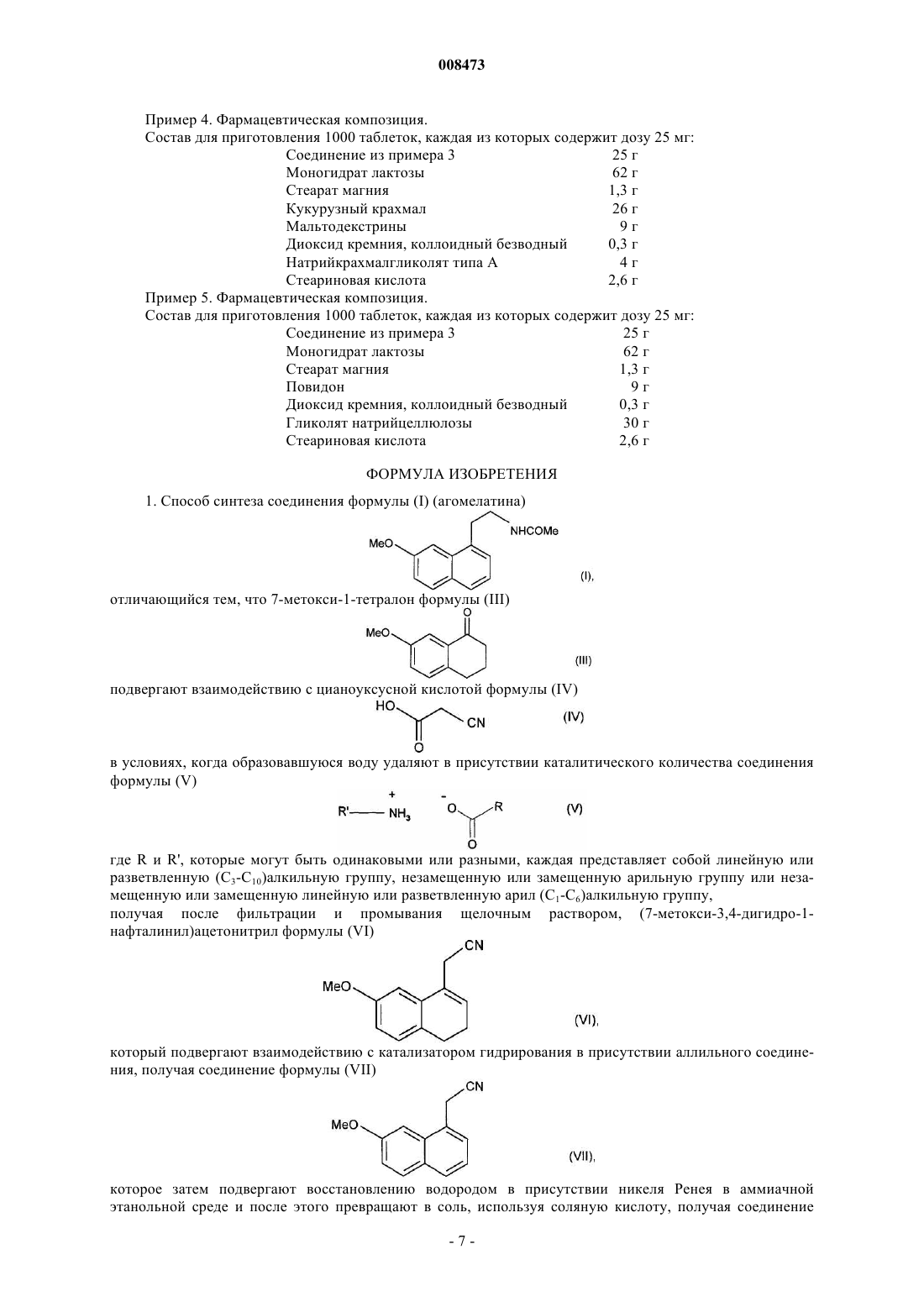
1. Способ синтеза соединения формулы (I) (агомелатина)
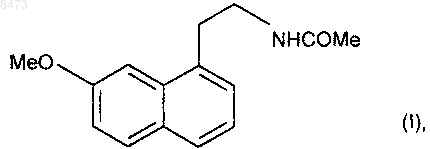
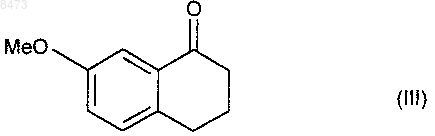
отличающийся тем, что 7-метокси-1-тетралон формулы (III)
подвергают взаимодействию с цианоуксусной кислотой формулы (IV)
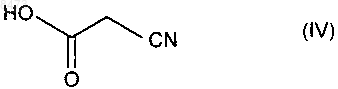
в условиях, когда образовавшуюся воду удаляют в присутствии каталитического количества соединения формулы (V)
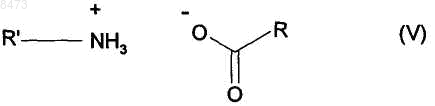
где R и R', которые могут быть одинаковыми или разными, каждая представляет собой линейную или разветвленную (С3-С10)алкильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную линейную или разветвленную арил (С1-С6)алкильную группу,
получая после фильтрации и промывания щелочным раствором, (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрил формулы (VI)
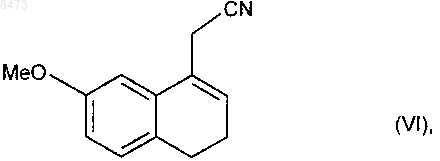
который подвергают взаимодействию с катализатором гидрирования в присутствии аллильного соединения, получая соединение формулы (VII)
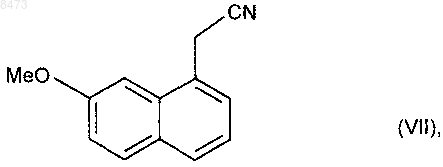
которое затем подвергают восстановлению водородом в присутствии никеля Ренея в аммиачной этанольной среде и после этого превращают в соль, используя соляную кислоту, получая соединение формулы (VIII)
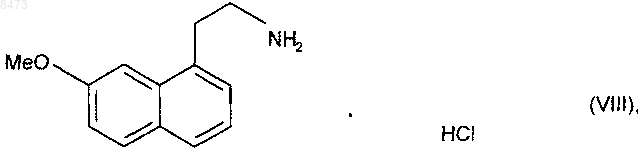
которое последовательно подвергают воздействию ацетата натрия и затем уксусного ангидрида, получая соединение формулы (I), которое выделяют в виде твердого вещества, причем
под арилом подразумевают фенильную, нафтильную или бифенильную группу,
термин "замещенный", охватывающий термины "арил" и "арилалкил", обозначает, что ароматическая часть этих групп может быть замещена 1-3 одинаковыми или разными группами, выбранными из линейного или разветвленного (С1-С6)алкила, гидрокси и линейного или разветвленного (С1-С6)алкокси,
"аллильное соединение" понимают как любую молекулу, содержащую от 3 до 10 атомов углерода, которая может дополнительно содержать 1-5 атомов кислорода, и содержащую по крайней мере одну группу -СН2-СН=СН2.
2. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (III) в соединение формулы (VI) осуществляют с нагреванием в колбе с обратным холодильником с толуолом.
3. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R представляет собой гексильную группу.
4. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R' представляет собой бензильную группу.
5. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор, который применяется для превращения соединения формулы (III) в соединение формулы (VI), представлен формулой (Va)
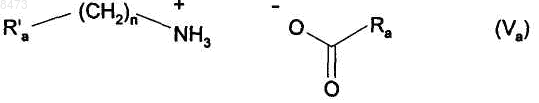
в которой R'a представляет собой фенильную группу, незамещенную или замещенную одной или несколькими линейными или разветвленными (С1-С6)алкильными группами, n представляет собой 0 или 1, и Ra представляет собой линейную (С3-С10)алкильную группу.
6. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор, который применяется для превращения соединения формулы (III) в соединение формулы (VI), представляет собой гептаноат бензиламмония формулы (IX)
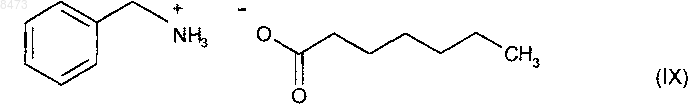
7. Соединение формулы (VI), которое представляет собой (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрил, в качестве промежуточного продукта при синтезе агомелатина.
8. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (VI) в соединение формулы (VII) осуществляют с нагреванием в колбе с обратным холодильником с толуолом.
9. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор гидрирования, который применяют для превращения соединения формулы (VI) в соединение формулы (VII), представляет собой палладий.
10. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор гидрирования, который применяют для превращения соединения формулы (VI) в соединение формулы (VII),представляет собой 5% палладий на угле.
11. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что количество катализатора гидрирования, который применяют для превращения соединения формулы (VI) в соединение формулы (VII), составляет 5% по весу катализатора относительно веса субстрата.
12. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (VII) в соединение формулы (VIII) осуществляют при 40шС.
13. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (VIII) в соединение формулы (I) осуществляют в этаноле.
14. Способ синтеза агомелатина, исходя из соединения формулы (VI), отличающийся тем, что соединение формулы (VI) получают способом в соответствии с любым из пп.1-6 и подвергают ароматизации, затем восстановлению и после этого сочетанию с уксусным ангидридом.
15. Способ синтеза агомелатина, исходя из соединения формулы (VII), отличающийся тем, что соединение формулы (VII) получают путем способа синтеза в соответствии с любым из пп.1-6 и 8-11 и подвергают восстановлению и после этого сочетанию с уксусным ангидридом.
16. Способ синтеза агомелатина, исходя из соединения формулы (VIII), отличающийся тем, что соединение формулы (VIII) получают путем способа синтеза в соответствии с любым из пп.1-6 и 8-12 и подвергают сочетанию с уксусным ангидридом.
17. Кристаллическая форма II агомелатина формулы (I)
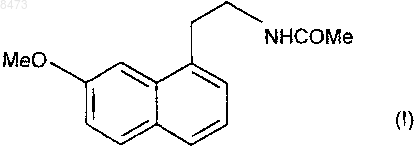
которая характеризуется следующими параметрами кристаллической решетки, полученными при помощи дифрактометра Bruker AXS D8 с высокой разрешающей способностью, имеющего 2q угловой интервал 3-90ш, шаг 0,01ш и 30 с на шаг:
моноклинная кристаллическая решетка
параметры решетки: а=20,0903 Е, b=9,3194 Е, с=15,4796 Е, b=108,667ш;
пространственная группа: P21/n;
число молекул в элементарной ячейке: 8;
объем элементарной ячейки: V элементарной ячейки=2746,742 Е3;
плотность: d=1,13 г/см3.
18. Фармацевтическая композиция, которая содержит в качестве активного компонента кристаллическую форму II агомелатина в соответствии с п.17 в сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными носителями для применения в приготовлении лекарственных средств для лечения расстройств мелатонинэргической системы.
19. Фармацевтическая композиция, которая содержит в качестве активного компонента кристаллическую форму II агомелатина в соответствии с п.17 в сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными носителями для применения в приготовлении лекарственных средств для лечения нарушений сна, стресса, тревоги, сезонных аффективных расстройств или тяжелых депрессий, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний, меланхолии, нарушений аппетита, ожирения, бессонницы, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным и патологическим старенихь, мигрени, потери памяти, болезни Альцгеймера, нарушений мозгового кровообращения, а также расстройств половой функции в качестве ингибиторов овуляции, иммуномодуляторов и для лечения злокачественных новообразований.
Текст
008473 Настоящее изобретение относится к способу промышленного синтеза агомелатина, или Настоящее изобретение также относится к кристаллической форме II агомелатина, способу ее получения и фармацевтических композиций, которые ее содержат. Агомелатин, или N-[2-(7-метокси-1-нафтил)этил]ацетамид, обладает ценными фармакологическими свойствами. Действительно, он имеет двойственное свойство, с одной стороны, являясь агонистом рецепторов мелатонинэргической системы, а с другой стороны - антагонистом 5-НТ 2C рецептора. Эти свойства задействованы в его активности центральной нервной системе и, в частности, при лечении тяжелых депрессий, сезонных аффективных расстройств, нарушений сна, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, нарушений аппетита и ожирения. Агомелатин, его получение и терапевтическое применение описаны в заявке на европейский патент ЕР 0447285. В связи с ценными фармацевтическими свойствами этого соединения является важным получать его при помощи эффективного способа промышленного синтеза, который легко заменимый в промышленном масштабе и обеспечивает получение агомелатина с высоким выходом и очень хорошей степенью очистки. Также важной является возможность получения агомелатина с точно определенной кристаллической формой, полностью воспроизводимой, что обеспечивает ценные свойства для фильтрации и облегчает приготовление лекарственного средства. В заявке на патент ЕР 0447285 описано получение агомелатина посредством восьми стадий, исходя из 7-метокси-1-тетралона, что обеспечивает в среднем выход меньше чем 30%. В этом способе предусматривается взаимодействие этилбромацетата с последующей ароматизацией и омылением, что приводит к образованию соответствующей кислоты, которую потом превращают в ацетамид и затем дегидратируют, получая (7-метокси-1-нафтил)ацетонитрил, который после этого восстанавливают, и затем конденсируют ацетилхлорид. В частности, получение (7-метокси-1-нафтил)ацетонитрила осуществляют при помощи шести стадий реакций, и при смещении к осуществлению способа в промышленном масштабе быстро выявляются трудности его выполнения, вызванные в большинстве случаев сложностями воспроизводимости первой стадии, которая предусматривает воздействие этилбромацетата на 7-метокси-1-тетралон в соответствии с реакцией Реформатского с получением этил(7-метокси-3,4-дигидро-1(2H)-нафталинилиден)этаноата. Кроме того,последующая стадия ароматизации этил(7-метокси-3,4-дигидро-1(2H)нафталинилиден)этаноата очень часто осуществляется не полностью, что приводит к образованию после омыления смеси продуктов, которую сложно очистить. В литературе описано получение (7-метокси-1-нафтил)ацетонитрила в три стадии, исходя из 7-метокси-1-тетралона, путем обработки LiCH2CN с последующим дегидрированием с DDQ (2,3-хлор 5,6-дициано-1,5-бензохинон) и, в заключение, дегидратацией в кислой среде (Synthetic Communication,2001, 34 (1), 621-629). Общий выход является посредственным (76%), однако, и в особенности применение DDQ в реакции дегидрирования и нагревание в колбе с обратным холодильником с бензолом, которые необходимы на третьей стадии, не соответствует промышленным требованиям относительно затрат и окружающей среды. Сейчас заявителем был разработан новый способ промышленного синтеза, который приводит к получению агомелатина чистоты, совместимой с его применением в качестве фармацевтически активного компонента, и этот способ воспроизводим и не требует трудоемкой очистки. Альтернативно по отношению к трудностям, которые встречаются при осуществлении способа, описанного в заявке на патент ЕР 0447285, синтез осуществляют путем прямой конденсации цианосоединения с 7-метокси-1-тетралоном. Также необходимо, чтобы соединение,полученное при конденсации, быстро могло быть подвергнуто ароматизации, что приводит к получению(7-метокси-1-нафтил)ацетонитрила, не требует жестких условий и обеспечивает реагенты, совместимые с промышленными требованиями относительно используемых затрат и окружающей среды. Очевидно, что (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрил будет являться идеальным промежуточным продуктом для синтеза, который соответствует требованиям для осуществления прямого синтеза из 7-метокси-1-тетралона, и представляет собой очень хороший субстрат для стадии ароматизации. Реакции прямой конденсации тетралонов с ацетонитрилом или соединениями ацетонитрила описаны в литературе. В частности, в патенте US 3992403 описана конденсация цианометилфосфоната-1 008473 с 6-фтор-1-тетралоном, и в патенте US 3931188 описана конденсация ацетонитрила с тетралоном, которая приводит к образованию промежуточного цианопродукта, который непосредственно применяют в последующей реакции. Применительно к 7-метокси-1-тетралону конденсация ацетонитрила приводит к образованию смеси изомеров, в которой "екзо" соответствует основной части и "эндо" - второстепенной части в соответствии с фиг. 1 Фиг. 1 Такая смесь вызывает необходимость последующей ароматизации в жестких условиях, что не совместимо с требованиями осуществления промышленного синтеза агомелатина. Сейчас заявителем был разработан новый способ промышленного синтеза, который предоставляет возможность получения (7-метокси-1-нафтил)ацетонитрила из 7-метокситетралона воспроизводимым способом, который не требует трудоемкой очистки, только в две стадии, путем использования в качестве промежуточного продукта при синтезе (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрила без "экзо" примеси формулы (II) Эта примесь не может подвергаться последующей ароматизации в рабочих условиях, что совместимо с промышленными требованиями для осуществления синтеза агомелатина. В частности, настоящее изобретение относится к способу промышленного синтеза соединения формулы (I) подвергают взаимодействию с цианоуксусной кислотой формулы (IV) в условиях, когда образованную воду удаляют, в присутствии каталитического количества соединения формулы (V) где R и R', которые могут быть одинаковыми или разными, каждая представляет собой линейную или разветвленную (С 3-С 10)алкильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную линейную или разветвленную арил(С 1-C6)алкильную группу,получая после фильтрации и промывания щелочным раствором (7-метокси-3,4-дигидро-1 нафталинил)ацетонитрил формулы (VI) где соединение формулы (VI) подвергают взаимодействию с катализатором гидрирования в присутствии аллильного соединения, получая соединение формулы (VII) которое затем подвергают восстановлению с водородом в присутствии никеля Ренея в аммиачной этанольной среде и после этого превращают в соль, используя соляную кислоту, получая соединение формулы (VIII) которое последовательно подвергают воздействию ацетата натрия и затем уксусного ангидрида, получая соединение формулы (I), которое выделяют в виде твердого вещества, причем под арилом подразумевают фенильную, нафтильную или бифенильную группу,термин "замещенный", охватывающий термины "арил" и "арилалкил", обозначает, что ароматическая часть этих групп может быть замещена 1-3 одинаковыми или разными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила, гидрокси и линейного или разветвленного (С 1-С 6)алкокси,"аллильное соединение" понимают как любую молекулу, содержащую от 3 до 10 атомов углерода,которая может дополнительно содержать 1-5 атомов кислорода, и содержащую по крайней мере одну группу -СН 2-СН=СН 2. Более предпочтительно в реакции превращения соединения формулы (III) в соединение формулы(VI) образованную воду удаляют путем перегонки. Предпочтительно применять в реакции растворитель,который имеет температуру кипения выше, чем температура кипения воды, или такую же, и наиболее предпочтительно, чтобы он образовывал азеотропную смесь с водой, такой как, например, ксилол,толуол, анизол, этилбензол, тетрахлорэтилен, циклогексен или мезитилен. Предпочтительно превращение соединения формулы (III) в соединение формулы (VI) осуществляют с нагреванием в колбе с обратным холодильником с толуолом или ксилолом и более предпочтительно с нагреванием в колбе с обратным холодильником с толуолом. В реакции превращения соединения формулы (III) в соединение формулы (VI) предпочтительно одна из групп R или R' применяемого катализатора представляет собой линейную или разветвленную(С 3-С 10)алкильную группу, а другая представляет собой арильную или арилалкильную группу. Более предпочтительно, применяемый катализатор представлен формулой (Va) в которой R'a представляет собой фенильную группу, незамещенную или замещенную одной или несколькими линейными или разветвленными (С 1-С 6)алкильными группами, n представляет собой 0 или 1,и Ra представляет собой линейную (С 3-С 10)алкильную группу. Предпочтительно R'a представляет собой незамещенную или замещенную фенильную группу, более предпочтительно незамещенную фенильную группу. Предпочтительно группа Ra представляет собой гексильную группу. Предпочтительным значением для n является 1. Предпочтительный катализатор, который применяется для превращения соединения формулы (III) в соединение формулы (VI) в способе согласно изобретению, представляет собой гептаноат бензиламмония формулы (IX) Предпочтительно соединение формулы (VI) получают после фильтрации и промывания раствором неорганического или органического основания, такого как NaOH, KОН, Са(ОН)2, Sr(OH)2 или NH4OH, и более предпочтительно раствором гидроокиси натрия. Предпочтительно превращение соединения формулы (VI) в соединение формулы (VII) осуществляют с нагреванием в колбе с обратным холодильником с толуолом или ксилолом и более предпочтительно с нагреванием в колбе с обратным холодильником с толуолом. Катализатор, который предпочтительно используется для превращения соединения формулы (VI) в соединение формулы (VII), представляет собой катализатор в виде оксида или на подложке, такой как,например, палладий, платина, никель, Al2O3, и более предпочтительно палладий. Предпочтительно используют 1-20% палладия на угле и наиболее предпочтительно 5 или 10% палладия на угле. Предпочти-3 008473 тельно палладий на угле используют в количестве в интервале от 1 до 10 вес.% катализатора относительно веса субстрата и более предпочтительно 5%. Акцептор водорода, который предпочтительно используется в реакции для превращения соединения формулы (VI) в соединение формулы (VII), представляет собой аллильное соединение и более предпочтительно аллилакрилат или аллилглицидильный простой эфир. Предпочтительный аллилакрилат в способе в соответствии с изобретением представляет собой аллилметакрилат. Предпочтительно превращение соединения формулы (VII) в соединение формулы (VIII) в соответствии со способом по изобретению осуществляют при температуре от 20 до 40 С, более предпочтительно от 30 до 40 С и наиболее предпочтительно при 40 С. Предпочтительно превращение соединения формулы (VIII) в соединение формулы (I) осуществляют в спиртовой среде и более предпочтительно в этанольной среде. Этот способ представляет особый интерес в связи со следующими основаниями: он приводит к получению исключительно "эндо" соединения формулы (VI) в промышленном масштабе. Этот результат является совершенно неожиданным, принимая во внимание тот факт, что в литературе для реакций такого типа наиболее часто описано получение "экзо/эндо" смесей (Tetrahedron,1966, 22, 3021-3026). Этот результат обеспечивается применением в качестве катализатора реакции соединения формулы (V) вместо ацетатов аммония, которые в настоящее время применяются в таких реакциях (Bull. Soc. Chim. Fr., 1949, 884-890); степень превращения соединения формулы (III) в соединение формулы (VI) является очень высокой, более 97%, в отличие от наблюдаемой при использовании уксусной кислоты, для которой она не превышает 75%; применение катализатора гидрирования в присутствии аллильного соединения для превращения соединения формулы (VI) в соединение формулы (VII) полностью совместимо с промышленными требованиями относительно затрат и окружающей среды в отличие от хинонов, которые используются в настоящее время; более того, он обеспечивает получение исключительно соединения формулы (VII), в частности без соответствующего восстановленного продукта формулы (X) в промышленном масштабе; в заключение, наблюдаемые степени превращения соединения формулы (VI) в соединение формулы (VII) являются высокими, превышающими 90%; гидрирование соединения формулы (VII) в присутствии никеля Ренея в аммиачной этанольной среде описано в J. Med. Chem., 1994, 37 (20). 3231-3239, однако требуемые условия являются сложными для применения в промышленном масштабе: реакцию осуществляют при 60 С в течение 15 ч, и окончательный выход составляет менее 90%. Кроме того, принципиальным недостатком такой реакции является сопутствующее образование "бис" соединения формулы (XI) и сложность регулирования степени превращения этой примеси. Способ, разработанный заявителем, обеспечивает получение соединения формулы (VIII), в котором примесь присутствует в количестве до 4% в экспериментальных условиях, которые совместимы с промышленными требованиями, так как реакцию осуществляют в интервале от 30 до 40 С, достигая выхода,который превышает 90%, и химической чистоты, превышающей 99,5%; стадию амидирования осуществляют в спиртовой среде и более предпочтительно в этанольной среде, обеспечивая очень легкое выделение соединения формулы (I) в приемлемом количественном выходе,и этот результат является совершенно неожиданным, так как реакция этого типа плохо совместима с таким растворителем, для которого ожидается конкурентное потребление уксусного ангидрида. Соединение формулы (VI), полученное способом в соответствии с изобретением, является новым и пригодно в качестве промежуточного продукта при синтезе агомелатина, для этого его подвергают ароматизации, затем восстановлению и после этого сочетанию с уксусным ангидридом. Изобретение также относится к кристаллической форме II агомелатина, полученной в соответствии со способом, описанным выше. В действительности, важным является возможность получения точно определенной и полностью воспроизводимой кристаллической формы. В предшествующем уровне техники описано получение агомелатина ЕР 0447285 и Yous et al.-4 008473 описана Tinant et al. Acta Cryst, 1994, С 50, 907-910. Сейчас заявителем был разработан новый способ получения агомелатина в точно определенной,полностью воспроизводимой кристаллической форме, что обеспечивает ценные свойства для фильтрации и облегчает приготовление лекарственного средства. В частности, настоящее изобретение относится к кристаллической форме II агомелатина, которая характеризуется следующими параметрами, полученными из порошковой диаграммы, полученной при помощи дифрактометра Bruker AXS D8 с высокой разрешающей способностью, имеющего 2 угловой интервал 3-90, шаг 0,01 и 30 с на шаг: моноклинная кристаллическая решетка параметры решетки: а=20,0903 , b=9,3194 , с=15,4796 , =108,667; пространственная группа: P21/n; число молекул в элементарной ячейке: 8; объем элементарной ячейки: Vэлементарной ячейки=2746,742 3; плотность: d=1,13 г/см 3. Преимущество такой полученной кристаллической формы состоит главным образом в быстрой и эффективной фильтрации, а также в приготовлении лекарственных средств, которые имеют постоянный и воспроизводимый состав, что составляет особые преимущества, если лекарственные препараты применяются для перорального введения. Форма, полученная таким образом, является достаточно стабильной для длительного хранения без применения специальных условий, таких как температура, освещенность, влажность и концентрация кислорода. При фармакологическом исследовании формы, полученной таким образом, было показано, что она обладает значительной активностью по отношению к центральной нервной системе и по отношению к микроциркуляции, что дает возможность утверждать, что кристаллическая форма II агомелатина пригодна для лечения стресса, нарушений сна, тревоги, тяжелых депрессий, сезонных аффективных расстройств, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний, меланхолии, нарушений аппетита, ожирения,бессонницы, болей, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным и патологическим старением, мигрени,потери памяти, болезни Альцгеймера и нарушений мозгового кровообращения. Учитывая другую сферу действия, также возможно применять кристаллическую форму II агомелатина для лечения расстройств половой функции, поскольку она обладает свойствами ингибировать овуляцию и иммуномодулирующими свойствами, а также для лечения злокачественных новообразований. Кристаллическая форма II агомелатина предпочтительно применяется для лечения тяжелых депрессий, сезонных аффективных расстройств, нарушений сна, патологии сердечно-сосудистой системы, бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, нарушений аппетита и ожирения. Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента кристаллическую форму II агомелатина совместно с одним или более подходящими,инертными, нетоксичными наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, гранулы, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций,суспензии для питья и распадающиеся пасты. Полезная дозировка может адаптироваться в зависимости от природы и тяжести расстройства, пути введения, а также от возраста и веса пациента. Дозировка находится в диапазоне от 0,1 мг до 1 г в сутки на одно или больше введений. Примеры, представленные ниже, приведены с целью иллюстрации и никоим образом не ограничивают изобретение. Пример 1. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Стадия А. (7-Метокси-3,4-дигидро-1-нафталинил)ацетонитрил. В реактор объемом 670 л вносили 85,0 кг 7-метокси-1-тетралона, 60,3 кг цианоуксусной кислоты и 15,6 кг гептановой кислоты в толуоле в присутствии 12,7 кг бензиламина. Смесь нагревали с обратным холодильником. После того как все исходные вещества исчезали, раствор охлаждали и фильтровали. Полученный осадок промывали толуолом, и после этого полученный фильтрат промывали 2 н. раствором гидроокиси натрия и затем водой до тех пор, пока он не становился нейтральным. После удаления растворителя путем выпаривания полученное твердое вещество перекристаллизовывали из смеси этанол/вода (80/20), получая указанный в заглавии продукт при выходе 90% и с химической чистотой, превышающей 99%. Точка плавления: 48-50 С.-5 008473 Стадия В. (7-Метокси-1-нафтил)ацетонитрил. В реактор объемом 670 л вносили 12,6 кг 5% палладия на угле в толуоле, который нагревали с обратным холодильником; затем добавляли 96,1 кг (7-метокси-3,4-дигидро-1-нафталинил)ацетонитрила,растворенного в толуоле, а также 63,7 кг аллилметакрилата. Дальше реакцию проводили в колбе с обратным холодильником, и затем осуществляли парофазную хроматографию. После того как все исходные вещества исчезали, реакционную смесь охлаждали до температуры окружающей среды и затем фильтровали. После удаления толуола путем выпаривания полученный твердый остаток перекристаллизовывали из смеси этанол/вода (80/20), получая указанный в заглавии продукт при выходе 91% и с химической чистотой, превышающей 99%. Точка плавления: 83 С. Стадия С. Гидрохлорид 2-(7-метокси-1-нафтил)этанамина. В реактор объемом 1100 л вносили 80,0 кг соединения, полученного на стадии В, 24,0 кг никеля Ренея и 170 л гидроокиси аммония. Смесь перемешивали под давлением водорода 30 бар, затем доводили до 40 С. После того как все исходные вещества исчезали, растворитель выпаривали, полученный остаток повторно растворяли в этилацетате и добавляли 41,5 л 11 н. раствора соляной кислоты. После фильтрации полученный осадок промывали этилацетатом и затем высушивали в сушильном шкафу, получая указанный в заглавии продукт при выходе 95,3% и с химической чистотой, превышающей 99,5%. Точка плавления: 243 С. Стадия D. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. 173 кг соединения, полученного на стадии С, и 66 кг ацетата натрия в этаноле вносили в реактор объемом 1600 л. Смесь перемешивали, и затем добавляли 79 кг уксусного ангидрида; реакционную смесь нагревали с обратным холодильником и добавляли 600 л воды. Реакционную смесь оставляли для возвращения температуры до температуры окружающей среды, и полученный осадок отфильтровывали и промывали смесью этанол/вода 35/65, получая указанный в заглавии продукт при выходе 92,5% и с химической чистотой, превышающей 99%. Точка плавления: 108 С. Пример 2. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Стадия А. (7-Метокси-3,4-дигидро-1-нафталинил)ацетонитрил. В реактор объемом 670 л вносили 85,0 кг 7-метокси-1-тетралона, 60,3 кг цианоуксусной кислоты и 15,6 кг гептановой кислоты в толуоле в присутствии 11,0 кг анилина. Смесь нагревали с обратным холодильником. После того как все исходные вещества исчезали, раствор охлаждали и фильтровали. Полученный осадок промывали толуолом, и после этого полученный фильтрат промывали 2 н. раствором гидроокиси натрия и затем водой до тех пор, пока он не становился нейтральным. После удаления растворителя путем выпаривания полученное твердое вещество перекристаллизовывали из смеси этанол/вода(80/20), получая указанный в заглавии продукт при выходе 87% и с химической чистотой, превышающей 99%. Точка плавления: 48-50 С. Стадия В. (7-Метокси-1-нафтил)ацетонитрил. Методика соответствует описанной на стадии В примера 1. Точка плавления: 83 С. Стадия С. Гидрохлорид 2-(7-метокси-1-нафтил)этанамина. Методика соответствует описанной на стадии С примера 1. Точка плавления: 243 С. Стадия D. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Методика соответствует описанной на стадии D примера 1. Точка плавления: 108 С. Пример 3. Кристаллическая форма II N-[2-(7-метокси-1-нафтил)этил]ацетамида. Регистрацию данных осуществляли при помощи дифрактометра Bruker AXS D8 с высокой разрешающей способностью, имеющего следующие параметры: 2 угловой интервал 3-90, шаг 0,01 и 30 с на шаг. Порошок N-[2-(7-метокси-1-нафтил)этил]ацетамида, полученный в примере 1, помещали на передающую закрепленную подложку. Источником рентгеновских лучей являлась медная трубка(CuKl=1,54056 ). Установка включала передний монохроматор (кристалл Ge(lll и полупроводниковый детектор с энергетической разрешающей способностью (MXP-D1, Moxtec-SEPH). Соединение хорошо кристаллизовали: ширина луча на половине высоты составляла порядка 0,07 (2). Таким образом были определены следующие параметры: моноклинная кристаллическая решетка параметры решетки: а=20,0903 , b=9,3194 , с=15,4796 , =108,667; пространственная группа: P21/n; число молекул в элементарной ячейке: 8; объем элементарной ячейки: Vэлементарной ячейки=2746,742 3; плотность: d=1,13 г/см 3.-6 008473 Пример 4. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит дозу 25 мг: Соединение из примера 3 25 г Моногидрат лактозы 62 г Стеарат магния 1,3 г Кукурузный крахмал 26 г Мальтодекстрины 9 г Диоксид кремния, коллоидный безводный 0,3 г Натрийкрахмалгликолят типа А 4 г Стеариновая кислота 2,6 г Пример 5. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит дозу 25 мг: Соединение из примера 3 25 г Моногидрат лактозы 62 г Стеарат магния 1,3 г Повидон 9 г Диоксид кремния, коллоидный безводный 0,3 г Гликолят натрийцеллюлозы 30 г Стеариновая кислота 2,6 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединения формулы (I) (агомелатина) подвергают взаимодействию с цианоуксусной кислотой формулы (IV) в условиях, когда образовавшуюся воду удаляют в присутствии каталитического количества соединения формулы (V) где R и R', которые могут быть одинаковыми или разными, каждая представляет собой линейную или разветвленную (С 3-С 10)алкильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную линейную или разветвленную арил (С 1-С 6)алкильную группу,получая после фильтрации и промывания щелочным раствором, (7-метокси-3,4-дигидро-1 нафталинил)ацетонитрил формулы (VI) который подвергают взаимодействию с катализатором гидрирования в присутствии аллильного соединения, получая соединение формулы (VII) которое затем подвергают восстановлению водородом в присутствии никеля Ренея в аммиачной этанольной среде и после этого превращают в соль, используя соляную кислоту, получая соединение которое последовательно подвергают воздействию ацетата натрия и затем уксусного ангидрида, получая соединение формулы (I), которое выделяют в виде твердого вещества, причем под арилом подразумевают фенильную, нафтильную или бифенильную группу,термин "замещенный", охватывающий термины "арил" и "арилалкил", обозначает, что ароматическая часть этих групп может быть замещена 1-3 одинаковыми или разными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила, гидрокси и линейного или разветвленного (С 1-С 6)алкокси,"аллильное соединение" понимают как любую молекулу, содержащую от 3 до 10 атомов углерода,которая может дополнительно содержать 1-5 атомов кислорода, и содержащую по крайней мере одну группу -СН 2-СН=СН 2. 2. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (III) в соединение формулы (VI) осуществляют с нагреванием в колбе с обратным холодильником с толуолом. 3. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R представляет собой гексильную группу. 4. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что R' представляет собой бензильную группу. 5. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор, который применяется для превращения соединения формулы (III) в соединение формулы (VI),представлен формулой (Va) в которой R'a представляет собой фенильную группу, незамещенную или замещенную одной или несколькими линейными или разветвленными (С 1-С 6)алкильными группами, n представляет собой 0 или 1, и Ra представляет собой линейную (С 3-С 10)алкильную группу. 6. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор, который применяется для превращения соединения формулы (III) в соединение формулы (VI), представляет собой гептаноат бензиламмония формулы (IX) 7. Соединение формулы (VI), которое представляет собой (7-метокси-3,4-дигидро-1 нафталинил)ацетонитрил, в качестве промежуточного продукта при синтезе агомелатина. 8. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (VI) в соединение формулы (VII) осуществляют с нагреванием в колбе с обратным холодильником с толуолом. 9. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор гидрирования, который применяют для превращения соединения формулы (VI) в соединение формулы (VII), представляет собой палладий. 10. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что катализатор гидрирования, который применяют для превращения соединения формулы (VI) в соединение формулы (VII), представляет собой 5% палладий на угле. 11. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что количество катализатора гидрирования, который применяют для превращения соединения формулы (VI) в соединение формулы (VII), составляет 5% по весу катализатора относительно веса субстрата. 12. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (VII) в соединение формулы (VIII) осуществляют при 40 С. 13. Способ синтеза соединения формулы (I) в соответствии с п.1, отличающийся тем, что превращение соединения формулы (VIII) в соединение формулы (I) осуществляют в этаноле. 14. Способ синтеза агомелатина, исходя из соединения формулы (VI), отличающийся тем, что соединение формулы (VI) получают способом в соответствии с любым из пп.1-6 и подвергают ароматизации, затем восстановлению и после этого сочетанию с уксусным ангидридом. 15. Способ синтеза агомелатина, исходя из соединения формулы (VII), отличающийся тем, что соединение формулы (VII) получают путем способа синтеза в соответствии с любым из пп.1-6 и 8-11 и подвергают восстановлению и после этого сочетанию с уксусным ангидридом.-8 008473 16. Способ синтеза агомелатина, исходя из соединения формулы (VIII), отличающийся тем, что соединение формулы (VIII) получают путем способа синтеза в соответствии с любым из пп.1-6 и 8-12 и подвергают сочетанию с уксусным ангидридом. 17. Кристаллическая форма II агомелатина формулы (I) которая характеризуется следующими параметрами кристаллической решетки, полученными при помощи дифрактометра Bruker AXS D8 с высокой разрешающей способностью, имеющего 2 угловой интервал 3-90, шаг 0,01 и 30 с на шаг: моноклинная кристаллическая решетка параметры решетки: а=20,0903 , b=9,3194 , с=15,4796 , =108,667; пространственная группа: P21/n; число молекул в элементарной ячейке: 8; объем элементарной ячейки: V элементарной ячейки=2746,742 3; плотность: d=1,13 г/см 3. 18. Фармацевтическая композиция, которая содержит в качестве активного компонента кристаллическую форму II агомелатина в соответствии с п.17 в сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными носителями для применения в приготовлении лекарственных средств для лечения расстройств мелатонинэргической системы. 19. Фармацевтическая композиция, которая содержит в качестве активного компонента кристаллическую форму II агомелатина в соответствии с п.17 в сочетании с одним или несколькими фармацевтически приемлемыми, инертными, нетоксичными носителями для применения в приготовлении лекарственных средств для лечения нарушений сна, стресса, тревоги, сезонных аффективных расстройств или тяжелых депрессий, патологии сердечно-сосудистой системы, патологии пищеварительной системы,бессонницы и утомления вследствие нарушения суточного ритма организма в связи с перелетом через несколько часовых поясов, шизофрении, острых тревожных состояний, меланхолии, нарушений аппетита, ожирения, бессонницы, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с естественным и патологическим старением, мигрени, потери памяти, болезни Альцгеймера, нарушений мозгового кровообращения, а также расстройств половой функции в качестве ингибиторов овуляции, иммуномодуляторов и для лечения злокачественных новообразований.
МПК / Метки
МПК: A61K 31/165, C07C 255/37, C07C 231/10, C07C 233/17, C07C 231/06
Метки: форма, синтеза, способ, новая, агомелатина, композиции, содержат, новый, кристаллическая, фармацевтические, которые
Код ссылки
<a href="https://eas.patents.su/10-8473-novyjj-sposob-sinteza-i-novaya-kristallicheskaya-forma-agomelatina-i-farmacevticheskie-kompozicii-kotorye-eyo-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ синтеза и новая кристаллическая форма агомелатина и фармацевтические композиции, которые её содержат</a>
Предыдущий патент: Способ и устройство для бурения подземных формаций
Следующий патент: Альфа-кристаллическая форма ранелата стронция, способ ее получения и фармацевтические композиции, которые ее содержат
Случайный патент: Устройство для взятия проб толстокишечных клеток