β-карболиновые фармацевтические композиции
Формула / Реферат
1. Фармацевтическая композиция, включающая активное соединение, имеющее структурную формулу
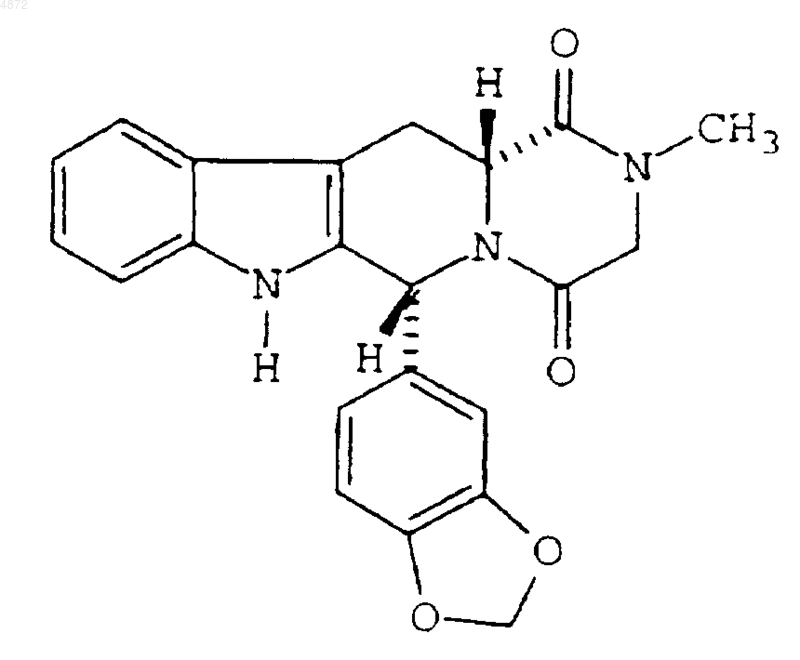
и представленное в виде свободного лекарственного средства, от 50 до 85 мас.% водорастворимого разбавителя, смазывающее вещество, от 1 до 5 мас.% гидрофильного связующего, выбранного из группы, состоящей из производного целлюлозы, повидона и их смесей, и дезинтегрирующее средство, выбранное из группы, состоящей из натриевой соли кроскармеллозы, кросповидона и их смесей.
2. Композиция по п.1, отличающаяся тем, что она дополнительно включает микрокристаллическую целлюлозу.
3. Композиция по п.1, отличающаяся тем, что она дополнительно включает смачивающий агент.
4. Композиция по п.1, отличающаяся тем, что активное соединение присутствует в количестве от 0,5 до 10 мас.%.
5. Композиция по п.1, отличающаяся тем, что водорастворимый разбавитель выбран из группы, состоящей из сахара, полисахарида, полиола, циклодекстрина и их смесей.
6. Композиция по п.3, отличающаяся тем, что водорастворимый разбавитель выбран из группы, состоящей из лактозы, сахарозы, декстрозы, декстрата, мальтодекстрина, маннита, ксилита, сорбита, циклодекстрина и их смесей.
7. Композиция по п.1, отличающаяся тем, что смазывающее вещество присутствует в количестве от 0,25 до 2 мас.%.
8. Композиция по п.1, отличающаяся тем, что смазывающее вещество выбрано из группы, состоящей из талька, стеарата магния, стеарата кальция стеариновой кислоты, коллоидного диоксида кремния, силиката кальция крахмала, минерального масла, воска, глицерилбегената, полиэтиленгликоля, бензоата натрия, ацетата натрия, стеарилфумарата натрия гидрогенизированных растительных масел и их смесей.
9. Композиция по п.1, отличающаяся тем, что производное целлюлозы выбрано из группы, состоящей из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы и их смесей.
10. Композиция по п.1, отличающаяся тем, что дезинтегрирующее средство присутствует в количестве от 3 до 10 мас.%.
11. Композиция по п.2, отличающаяся тем, что микрокристаллическая целлюлоза присутствует в количестве от 5 до 40 мас.%.
12. Композиция по п.3, отличающаяся тем, что смачивающий агент присутствует в количестве от 0,1 до 5 мас.%.
13. Композиция по п.12, отличающаяся тем, что смачивающий агент выбран из группы, состоящей из лаурилсульфата натрия, докузата натрия, этоксилированного касторового масла, полигликолизированного глицерида, ацетилированного моноглицерида, эфира сорбитана и жирных кислот, полоксамера, эфира полиоксиэтиленсорбитана и жирных кислот, полиоксиэтилена, моноглицерида и его этоксилированных производных, диглицерида и его этоксилированных производных и их смесей.
14. Композиция по п.13, отличающаяся тем, что смачивающий агент выбран из группы, состоящей из лаурилсульфата натрия, полисорбата 80 и их смесей.
15. Композиция по п.1, отличающаяся тем, что активное соединение представлено в виде частиц свободного лекарственного средства, по меньшей мере 90% которых имеют размер меньше чем 40 мк.
16. Композиция по п.1, отличающаяся тем, что активное соединение представлено в виде частиц свободного лекарственного средства, по меньшей мере 90% которых имеют размер меньше чем 10 мк.
17. Композиция по п. 1, отличающаяся тем, что она включает
(a) от 1 до 4 мас.% активного соединения;
(b) от 50 до 75 мас.% лактозы;
(c) от 0,25 до 2 мас.% стеарата магния;
(d) от 1 до 5 мас.% гидроксипропилцеллюлозы и
(e) от 3 до 10 мас.% натриевой соли кроскармеллозы.
18. Композиция по п.16, отличающаяся тем, что она дополнительно включает от 5 до 40 мас.% микрокристаллической целлюлозы.
19. Композиция по п.16, отличающаяся тем, что она дополнительно включает от 0,1 до 5 мас.% лаурилсульфата натрия.
20. Таблетка, включающая композицию по п.1, где активное соединение присутствует в количестве от 1 до 20 мг на таблетку.
21. Таблетка, включающая композицию по п.1, где активное соединение присутствует в количестве от 5 до 15 мг на таблетку.
22. Таблетка, включающая композицию по п.1, где активное соединение присутствует в количестве от 5 до 10 мг на таблетку.
23. Капсула, включающая твердую оболочку, капсулирующую композицию по п.1 в виде сухих сыпучих частиц, где активное соединение присутствует в количестве от 1 до 20 мг на капсулу.
24. Способ лечения половой дисфункции у пациента, включающий введение пациенту эффективного количества композиции по любому одному из пп.1-19.
Текст
1 Перекрестная ссылка на близкую заявку Данная заявка притязает на преимущество предварительной заявки на патент с регистрационным 60/146924, зарегистрированной 3 августа 1999. Область изобретения Настоящее изобретение относится к области фармацевтической и органической химии,включающей -карболиновые соединения, которые можно использовать при лечении различных медицинских показаний, где требуется ингибирование специфичной для цГМФ (циклический гуанозинмонофосфат) ФДЭ (фосфодиэстеразы) типа 5. Более конкретно, -карболиновые соединения изготовляют способом, обеспечивающим однородную эффективность и требуемые характеристики стабильности и биологической доступности. Предпосылки создания изобретения Биологические, физиологические и клинические действия ингибиторов специфичной для циклического гуанозин-3',5'-монофосфата фосфодиэстеразы (цГМФ-специфичная ФДЭ) предполагают их использование при различных болезненных состояниях, в которых необходима модуляция гладкой мышцы, почечной, гемостатической, воспалительной и/или эндокринной функции. цГМФ-специфичная фосфодиэстераза типа 5 (ФДЭ 5) является основным цГМФгидролизующим ферментом в васкулярной гладкой мышце, и была описана его экспрессия в пещеристом теле полового члена (Taher et al.,J. Urol., 149:285A (1993. Таким образом, ФДЭ 5 представляет собой притягивающую мишень при лечении половой дисфункции (K.J. Murray,DNP 6(3): 150-156 (1993. В патенте США 5859006 Daugan описывается класс -карболинов и их фармацевтические композиции, которые можно использовать при лечении состояний, при которых необходимо ингибирование ФДЭ 5. Кроме того, см. публикацию РСТ WO 97/03675, описывающую использование таких -карболинов для лечения половой дисфункции. Плохая растворимость многих карболинов, которые можно использовать в качестве ингибиторов ФДЭ 5, побуждает разработку препаратов совместного осаждения, как описано в патенте США 5985326 Butler. Короче говоря, были получены продукты совместного осаждения -карболинов с полимером, например фталатом гидроксипропилметилцеллюлозы,затем осадки были размолоты, смешаны с эксципиентами и смеси спрессованы в таблетки для перорального введения. Исследования, однако,показали, что появляются некоторые трудности при получении точно воспроизводимых партий продукта совместного осаждения, что делает использование продуктов совместного осаждения менее чем идеальными в фармацевтических готовых препаративных формах. 2 Кроме того, клинические исследования,включающие введение таблеток, содержащих такой продукт совместного осаждения, предварительно показали, что максимальная концентрация в крови -карболина достигается спустя время от 3 до 4 ч с еще точно не определенным средним временем начала терапевтического действия. При использовании для лечения половой дисфункции, такой как мужская эректильная дисфункция или нарушение женского полового возбуждения, для индивидуумов, для которых предпочтительны немедленные действия,желательным является более быстрое достижение максимальной концентрации в крови вместе с большей перспективой быстрого начала терапевтического эффекта. В соответствии с этим в данной области продолжает оставаться потребность в пероральных дозированных лекарственных формах -карболинов и их фармацевтических композициях, которые можно использовать при лечении состояний, для которых ингибирование -карболинов является полезным. Краткое изложение сущности изобретения Настоящее изобретение предлагает фармацевтические композиции, включающие соединение структурной формулы (I) названное (6R-транс)-6-(1,3-бензодиоксол-5-ил)2,3,6,7,12,12 а-гексагидро-2-метилпиразино[1',2': 1,6]пиридо[3,4-b]индол-1,4-дионом и альтернативно названное (6R,12 аR)-2,3,6,7,12,12 а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дионом,и его фармацевтически приемлемые соли и сольваты, где соединение предпочтительно представлено как свободное лекарственное средство в смеси с разбавителем, смазывающим веществом, гидрофильным связующим, выбранным из группы, состоящей из производного целлюлозы, повидона и их смеси, дезинтегрирующего средства, выбранного из группы, состоящей из кросповидона, натриевой соли кроскармеллозы и их смеси и, необязательно, микрокристаллической целлюлозы и/или смачивающего агента. Готовая препаративная форма,необязательно, дополнительно включает второй разбавитель. Наиболее предпочтительная фармацевтическая композиция настоящего изобретения включает: (а) приблизительно от 1 до приблизительно 5 и более предпочтительно приблизительно от 2 до приблизительно 4 мас.% соединения структурной формулы (I), представленно 3 го в виде свободного лекарственного средства;(b) приблизительно от 50 до приблизительно 85 мас.% и предпочтительно приблизительно от 50 до приблизительно 75 мас.% лактозы; (с) приблизительно от 0,25 до приблизительно 2 мас.% стеарата магния; (d) приблизительно от 1 до приблизительно 5 мас.% гидроксипропилцеллюлозы; (е) приблизительно от 3 до приблизительно 15 мас.% натриевой соли кроскармеллозы; (f) приблизительно от 0 до приблизительно 40 мас.% микрокристаллической целлюлозы и(g) приблизительно от 0 до приблизительно 5 мас.% лаурилсульфата натрия. Настоящее изобретение далее относится к использованию таких композиций для лечения половой дисфункции, например мужской эректильной дисфункции и нарушения женского возбуждения. Композиции можно вводить перорально в виде прессованной таблетки или в виде сухих, свободно сыпучих частиц, капсулированных в твердой оболочке, например желатиновой капсуле. Подробное описание изобретения Для целей раскрытого и заявленного здесь изобретения следующие термины и аббревиатуры имеют следующие значения. Термин лечение приводится для включения профилактики, снижения, прекращения или движения в обратном направлении развития или серьезности состояния или симптома, которое подвергают лечению. Как таковое, настоящее изобретение включает, при необходимости,как терапевтическое, так и/или профилактическое введение. Термин эффективное количество означает количество фармацевтической готовой препаративной формы, которое эффективно при лечении представляющего интерес состояния или симптома. Эффективное количество соединения структурной формулы (I) для лечения половой дисфункции у мужчин является количеством, достаточным для обеспечения и поддержания эрекции, способной гарантировать проникновение внутрь партнера. Эффективное количество соединения структурной формулы(I) для лечения женской половой дисфункции,особенно женского нарушения полового возбуждения, является количеством, достаточным для усиления способности пациента достигать или поддерживать возбужденное состояние. Термин свободное лекарственное средство относится к твердым частицам, состоящим по существу из соединения структурной формулы (I), в противоположность соединению,встроенному однородно в полимерный продукт совместного осаждения. Термин смазывающее вещество относится к фармацевтически приемлемым агентам,которые обычно используют в данной области в качестве смазывающих агентов или средств,придающих скольжение, при получении твердых фармацевтических готовых препаративных 4 форм. Репрезентативные смазывающие вещества включают, но не ограничиваются ими, агенты, такие как тальк, стеарат магния, стеарат кальция, стеариновую кислоту, коллоидный диоксид кремния, силикат кальция, крахмал,минеральное масло, воск, глицерилбегенат, полиэтиленгликоль, бензоат натрия, ацетат натрия,стеарилфумарат натрия и гидрогенизированные растительные масла. Смазывающее вещество,предпочтительно, выбирают из группы, состоящей из стеарата магния, стеарилфумарата натрия и стеариновой кислоты. Наиболее предпочтительно, когда смазывающим веществом является стеарат магния. Термин сольват относится к одной или нескольким молекулам растворенного вещества,ассоциированным с молекулой растворителя,например к соединению структурной формулы(I), ассоциированному с молекулой воды или уксусной кислоты. Термин твердая пероральная дозированная лекарственная форма используют в общем смысле для указания на твердые фармацевтические продукты, вводимые перорально. Термин твердые пероральные дозированные лекарственные формы принимается специалистом в данной области для включения таких форм, как,например, таблетки и капсулы. Термин водорастворимый разбавитель относится к соединениям, в типичном случае используемым в готовой препаративной форме фармацевтических средств для создания массы для изготовления таблетки практического размера. Водорастворимые разбавители включают,но не ограничиваются ими, сахара (включая лактозу, сахарозу и декстрозу), полисахариды(включая декстраты и мальтодекстрин), полиолы (включая маннит, ксилит и сорбит) и циклодекстрины. Термин смачивающие агенты относится к анионогенным катионогенным и неионогенным поверхностно-активным веществам. Неограничивающие репрезентативные смачивающие агенты включают лаурилсульфат натрия, докузат натрия (т.е. бис-(2-этилгексил)натрийсульфосукцинат), этоксилированное касторовое масло полигликолизированные глицериды, ацетилированные моноглицериды, эфиры сорбитана и жирных кислот, полоксамеры, эфиры полиоксиэтиленсорбитана и жирных кислот, производные полиоксиэтилена, моноглицериды и их этоксилированные производные и диглицериды и их этоксилированные производные. Поверхностно-активным веществом предпочтительно является лаурилсульфат натрия или эфир полиоксиэтиленсорбитана и жирной кислоты, конкретно, полисорбат 80. Номенклатура, описывающая размер частиц, обычно обозначается здесь как d90. Например, d90 40 означает, что по меньшей мере 90% частиц имеют размер меньше чем 40 микрон (мк). 5 Как указано ранее, настоящее изобретение предлагает фармацевтические композиции, содержащие соединение структурной формулы (I),как описано в патенте США 5859006 Daugan,и его фармацевтически приемлемые сольваты. Предпочтительный растворитель, подходящий для получения соединения структурной формулы (I), включает уксусную кислоту. Заявителями обнаружено, что однородность, стабильность и биологическая доступность дозы повышается посредством приготовления препарата из (6R-транс)-6-(1,3-бензодиоксол-5-ил)-2,3,6,7,12,12 а-гексагидро-2-метилпиразино[1',2':1,6]пиридо[3,4-b]индол-1,4 диона (т.е. соединения структурной формулы(I), называемого здесь также соединением А) в качестве активного соединения с конкретной комбинацией фармацевтических эксципиентов. Готовые препаративные формы настоящего изобретения включают смеси активного соединения с водорастворимым разбавителем, смазывающим веществом, гидрофильным связующим,натриевой солью кроскармеллозы или кросповидоном в качестве дезинтегрирующего средства и, необязательно, микрокристаллической целлюлозой и/или смачивающим агентом. Общее количество активного соединения А в фармацевтических композициях составляет приблизительно от 0,1 до приблизительно 45%,предпочтительно приблизительно от 0,5 до приблизительно 10 мас.% от готовой препаративной формы. В более предпочтительном осуществлении активное соединение присутствует в количестве приблизительно от 1 до приблизительно 4% и очень предпочтительно приблизительно от 2 до приблизительно 4 мас.% готовой препаративной формы. Соединение структурной формулы (I) можно получить в соответствии с принятыми методиками, такими как методики,описанные в патенте США 5859006 Daugan,включенном здесь в качестве ссылки. Было также обнаружено, что в зависимости от размера частиц активного соединения повышается биологическая доступность и возможность оперирования с настоящими композициями. Таким образом, размер частиц соединения структурной формулы (I) до приготовления из него композиции регулируют размалыванием исходного соединения (в виде кристаллов,аморфного осадка или их смеси), так чтобы по меньшей мере 90% частиц имели размер частиц меньше чем приблизительно 40 мк (d90 = 40) и предпочтительно меньше чем приблизительно 30 мк. Более предпочтительно по меньшей мере 90% частиц имеют размер меньше чем приблизительно 25 мк, еще более предпочтительно меньше чем приблизительно 15 мк и наиболее предпочтительно меньше чем приблизительно 10 мк. Способы определения размера частиц хорошо известны в данной области. Можно использовать следующий неограничивающий спо 004872 6 соб, описанный в патенте США 4605517,включенном здесь в качестве ссылки. В частности, лазерный рассеивающий анализ распределения размера частиц проводят на небольшом образце материала с уменьшенным размером частиц, который суспендируют приблизительно в 180 мл раствора диспергатора. Образец добавляют к диспергатору до достижения приемлемого уровня затемнения лазерного луча, в данной точке измеряют распределение размера частиц. До суспендирования образца получают раствор диспергатора посредством приготовления раствора 0,1% Спана 80 (олеат сорбитана) в циклогексане, который предварительно насыщают указанным соединением. Раствор диспергатора фильтруют через микропористый мембранный фильтр 0,2 мк для получения требуемого, не содержащего частицы суспендирующего диспергатора. Проводят измерения, как минимум, в трех повторностях, чтобы а) обеспечить получение более достоверных измерений и b) проверить эквивалентный отбор образца суспендированного материала. Результаты автоматически регистрируют и демонстрируют графически для получения зависимости кумулятивного % заниженного размера от диаметра и процента частоты от диаметра образца. Из этих данных получают величину диаметра среднего эквивалентного сферического объема и d90 (величина 90% заниженного размера) вместе со стандартным отклонением от распределения, вычисленного,как указано выше. Водорастворимый разбавитель присутствует в композиции в количестве, достаточном для обеспечения массы, адекватной композиции, и для изготовления таблеток. Предпочтительным водорастворимым разбавителем является лактоза, присутствующая в количестве приблизительно от 50 до приблизительно 85% и предпочтительно приблизительно от 50 до приблизительно 85 мас.%. Гидрофильное связующее применяют в количестве, достаточном для действия его в качестве адгезива для фиксации совместно соединения А и эксципиентов в таблетке. Гидрофильное связующее присутствует также в порошкообразной готовой препаративной форме, введенной в твердую желатиновую оболочку. В композициях в виде сухих порошков гидрофильное связующее облегчает изготовление порошков и возможность манипулирования с ними и повышает стабильность активного соединения. Предпочтительным гидрофильным связующим является производное целлюлозы, в том числе, например, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза. Другие гидрофильные производные целлюлозы включают, но не ограничиваются ими, гидроксиэтилцеллюлозу и гидроксибутилметилцеллюлозу. Другим неограничивающим гидрофильным связующим является повидон. Количество гид 7 рофильного связующего, присутствующего в композиции, предпочтительно составляет от приблизительно 1 до приблизительно 5 мас.% от композиции. Хотя связующие, такие как повидон, обеспечивают подходящие адгезивные характеристики, было обнаружено, что связующее является важным в отношении стабильности карболинового соединения. Гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза обеспечивают приемлемую адгезию, хотя и позволяют избежать окислительную нестабильность, являющуюся признаком повидона, и, таким образом, являются предпочтительными связующими. Натриевая соль кроскармеллозы и кросповидон содействуют дезинтеграции композиции и особенно таблетированной дозированной лекарственной формы после введения и при контакте с водой. Натриевая соль кроскармеллозы и кросповидон особенно выгодны, когда их используют в количестве приблизительно от 3 до приблизительно 15%, и особенно приблизительно от 3 до приблизительно 10 мас.% от композиции. Натриевая соль кроскармеллозы,известная также как сшитая натриевая соль карбоксиметилцеллюлозы, является предпочтительным дезинтегрирующим средством. Кросповидон является сшитым повидоном. Смазывающее вещество используют в количестве, достаточном для снижения трения стенок штампа во время прессования композиции в таблетки. Смазывающим веществом предпочтительно является стеарат магния, присутствующий в количестве приблизительно от 0,25 до приблизительно 2,0 мас.% от композиции. Смазывающее вещество облегчает также возможность оперирования с сухой порошкообразной формой композиции. Микрокристаллическая целлюлоза присутствует в настоящих композициях в количестве от 0 до приблизительно 40 мас.%. Микрокристаллическая целлюлоза может осуществлять несколько функций в композиции, например,кроме функции водорастворимого разбавителя,функцию дезинтегрирующего средства и/или второго разбавителя. Если необходимо, смачивающие агенты применяют в количестве, достаточном для снижения межфазного натяжения между частицами лекарственного средства и растворяющей средой (например, желудочным соком) и тем самым усиливают растворение и абсорбцию лекарственного средства. Поверхностно-активным веществом предпочтительно является лаурилсульфат натрия или эфир полиоксиэтиленсорбитана и жирной кислоты, особенно, полисорбат 80, в количестве от 0 до приблизительно 5 и предпочтительно приблизительно от приблизительно 0,1 до приблизительно 5 мас.% от композиции. 8 Дополнительные необязательные ингредиенты, такие как красящие агенты или корригенты, можно вводить в композицию в количестве,достаточном для осуществления их предполагаемой функции без неблагоприятного воздействия на композицию либо в виде порошка, либо таблеток, изготовленных с использованием указанной композиции. В предпочтительных осуществлениях относительные проценты компонентов (по массе) композиции следующие. Количество,мас.% Соединение структурной формулы (1) от 1 до 4 Лактоза (разбавитель) от 50 до 85 Гидрофильное связующее от 1 до 5 Натриевая соль кроскармеллозы(дезинтегрирующее средство) от 3 до 15 Лаурилсульфат натрия (смачивающий агент) от 0 до 5 Микрокристаллическая целлюлоза (разбавитель/дезинтегриот 0 до 40 рующее средство) Стеарат магния (смазывающее вещество) от 0,25 до 2 Готовые препаративные формы настоящего изобретения можно получить различными методиками, принятыми в данной области. Такие методики включают, например, мокрое гранулирование с последующей сушкой, размалыванием и прессованием в таблетки с покрытием пленкой или без покрытия, сухое гранулирование с последующим размалыванием, прессованием в таблетки с покрытием пленкой или без покрытия, сухое смешивание с последующим прессованием в таблетки с покрытием пленкой или без покрытия, получение формованных таблеток; мокрое гранулирование, сушку и наполнение в желатиновые капсулы, наполнение сухой смеси в желатиновые капсулы или наполнение суспензии или раствора в желатиновые капсулы. Композиции обычно имеют идентифицирующие маркеры, которые наносят не способом печати или печатают на поверхности. Кроме повышенного растворения и абсорбции in vivo другим важным физическим свойством является стабильность. Настоящее изобретение предлагает композиции с повышенной стабильностью по сравнению с предшествующими композициями. Конкретная доза соединения А, введенного в соответствии с настоящим изобретением, определяется конкретными обстоятельствами данного случая, включающими, например, путь введения, дозированную лекарственную форму,состояние пациента и патологическое состояние, подвергаемое лечению. Типичная суточная доза содержит уровень дозы приблизительно от 1 до приблизительно 20 мг/день соединения структурной формулы (I). Предпочтительная суточная доза обычно составляет приблизитель 9 но от 1 до приблизительно 10 мг/день, особенно приблизительно от 5 до приблизительно 10 мг таблеток или капсул, вводимых один раз в день. Наиболее предпочтительной дозированной формой является таблетка. Можно использовать несколько доз для достижения общей дозы вплоть до 20 мг/день соединения структурной формулы (I). Выбор уровня дозы определяется штатным врачом больницы. Одной пригодной для использования дозированной лекарственной формой является твердая капсула, содержащая порошкообразную форму готовой препаративной формы в твердой растворимой оболочке. В соответствии с настоящим изобретением твердые капсулы являются твердой дозированной лекарственной формой, в которой сухие, сыпучие частицы лекарственной готовой препаративной формы заполнены в твердый контейнер или оболочку,включающую желатин, крахмал или другие материалы для капсулирования, хорошо известные специалистам в данной области. Желатин обладает необычными свойствами, которые делают желатин основным материалом для изготовления твердых оболочек капсул. Другим примером пригодного для использования материала для капсул является картофельный крахмал. Твердые капсулы обеспечивают некоторые преимущества над другими твердыми дозированными лекарственными формами, такими как таблетки. Например, многие пациенты предпочитают капсулы, поскольку капсулы легче поддаются проглатыванию. Таким образом, кроме форм таблеток часто делают доступными формы капсул лекарственного средства. Твердая капсула имеет твердую оболочку,полностью окружающую сухую готовую препаративную форму. В типичном случае сухую лекарственную композицию добавляют в первую секцию капсулы, затем вторую секцию капсулы плотно надвигают на открытый конец первой секции, чтобы окружить лекарственную композицию. Размер и форму твердой оболочки можно изменить, но в типичном случае она является цилиндрической формой с закругленными концами. Размер капсулы связан с уровнем дозы лекарственного средства, капсулированного оболочкой, и с конкретной лекарственной композицией. Пероральную дозированную лекарственную форму в виде твердой капсулы в типичном случае получают так, чтобы оболочка разрывалась или растворялась с высвобождением заключенной в нее лекарственной композиции в течение от пяти до десяти минут после проглатывания. Изготовление твердой оболочки и капсул проводят по способам, хорошо известным в данной области. Следующие примеры композиций являются только иллюстративными и не предназначаются для ограничения объема настоящего изобретения. В частности, следующие примеры 10 относятся к таблеткам, но идентичные композиции в виде сухих сыпучих частиц или порошка можно использовать в твердой капсуле. Пример 1. Порцию 1 соединения А получают с использованием струйной мельницы плоскопараллельного типа 12 дюймов, работающей со скоростью подачи сырья от 28 до 30 кг/ч с достаточным давлением размалывания для получения материала, имеющего d90 4 мк. Следующий состав используют для получения конечной дозированной лекарственной формы, т.е. таблетки, обеспечивающей 10,0 мг соединения А из материала порции 1. Ингредиент Количество,мг Компоненты для грануляции Соединение A (d90 4) 10,0 Моногидрат лактозы 153,8 Моногидрат лактозы (высушен распылением) 25,0 Гидроксипропилцеллюлоза 4,0 Натриевая соль кроскармеллозы 9,0 Гидроксипропилцеллюлоза (EF) 1,75 Лаурилсульфат натрия 0,7 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,5 Натриевая соль кроскармеллозы 7,0 Стеарат магния (растительный) 1,25 Всего 250 мг Для изготовления таблеток используют очищенную воду USP. Воду удаляют во время обработки, в конечном продукте остаются минимальные уровни воды. Таблетки изготовляют с использованием способа мокрой грануляции. Последовательное описание способа следующее. Соединение А и эксципиенты надежно просеивают. Селективный ингибитор ФДЭ 5 (т.е. соединение А) смешивают в сухом состоянии с моногидратом лактозы (высушен распылением),гидроксипропилцеллюлозой, натриевой солью кроскармеллозы и моногидратом лактозы. Образовавшуюся порошкообразную смесь гранулируют с водным раствором гидроксипропилцеллюлозы и лаурилсульфата натрия с использованием гранулятора Powrex или другого подходящего гранулятора с высоким сдвигом. Для достижения требуемой конечной точки можно добавить дополнительное количество воды. Для рассредоточения продукта мокрой грануляции и ускорения сушки можно использовать мельницу. Продукт мокрой грануляции сушат с использованием либо сушильной установки с псевдоожиженным слоем, либо сушильной печи. После того как материал высушен, его можно просеять для исключения любых больших агломератов. Микрокристаллическую целлюлозу, натриевую соль кроскармеллозы и стеарат магния надежно просеивают и добавляют к сухим, сор 11 тированным по размеру гранулам. Указанные эксципиенты и сухой продукт грануляции смешивают до достижения однородности с использованием барабанного бункера, ленточновинтовой мешалки или другого подходящего смешивающего устройства. Процесс смешивания можно разделить на две фазы: (а) микрокристаллическую целлюлозу, натриевую соль кроскармеллозы и высушенный продукт грануляции добавляют в смеситель и смешивают с последующим (b) добавлением стеарата магния к указанному продукту грануляции и второй фазы смешивания. Смешанный продукт грануляции затем прессуют в таблетки с использованием ротационной таблеточной машины. Сердцевины таблеток, если необходимо, для образования пленки можно покрыть водной суспензией смеси подходящего цвета в чане для покрытия (например,Acella Cota). Покрытые таблетки можно слегка припудрить тальком для улучшения характеристик оперирования с таблетками. Таблетки можно заполнить в пластиковые контейнеры (30 таблеток/контейнер) и сопроводить листовкой-вкладышем, описывающим безопасность и эффективность соединения. Пример 2. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 5 мг соединения А из материала порции 1. Ингредиент Количество,мг Компоненты для грануляции Соединение A (d90 4) 5,0 Моногидрат лактозы 109,655 Моногидрат лактозы (высушен 17,50 распылением) Гидроксипропилцеллюлоза 2,80 Натриевая соль кроскармелло 6,30 зы Гидроксипропилцеллюлоза 1,225(EF) Лаурилсульфат натрия 0,49 Наружные порошки Микрокристаллическая целлю 26,25 лоза (Granular-102) Натриевая соль кроскармелло 4,90 зы Стеарат магния (растительный) 0,88 Всего 175 мг Пример 3. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 2,5 мг соединения А. Ингредиент Компоненты для грануляции Соединение А Моногидрат лактозы 12 Моногидрат лактозы (высушен распылением) 12,50 Гидроксипропилцеллюлоза 2,00 Натриевая соль кроскармеллозы 4,50 Гидроксипропилцеллюлоза(EF) 0,875 Лаурилсульфат натрия 0,35 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 18,75 Натриевая соль кроскармеллозы 3,5 Стеарат магния (растительный) 0,63 Всего 125 мг Пример 4. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Моногидрат лактозы (высушен распылением) 25,00 Гидроксипропилцеллюлоза 4,00 Натриевая соль кроскармеллозы 9,0 Гидроксипропилцеллюлоза(EF) 1,75 Лаурилсульфат натрия 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеариновая кислота (порошок) 3,75 Всего 252,5 мг Пример 5. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,00 Моногидрат лактозы 153,80 Маннит 25,00 Гидроксипропилцеллюлоза 4,00 Натриевая соль кроскармеллозы 9,00 Гидроксипропилцеллюлоза 13 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,25 Всего 250 мг Пример 6. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Моногидрат лактозы (высушен распылением) 25,00 Повидон 4,00 Натриевая соль кроскармеллозы 9,00 Повидон 1,75 Лаурилсульфат натрия 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,25 Всего 250 мг Пример 7. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Моногидрат лактозы (высушен распылением) 25,00 Повидон 4,00 Натриевая соль кроскармеллозы 9,00 Повидон 1,75 Полисорбат 80 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,25 Всего 250 мг Пример 8. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы, 004872 14 таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 157,80 Моногидрат лактозы (высушен распылением) 25,00 Натриевая соль кроскармеллозы 9,00 Гидроксипропилметилцеллюлоза 1,75 Лаурилсульфат натрия 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,25 Всего 250 мг Пример 9. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Сахароза 25,00 Гидроксипропилцеллюлоза 4,00 Натриевая соль кроскармеллозы 9,00 Гидроксипропилметил целлюлоза (EF) 1,75 Лаурилсульфат натрия 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,25 Всего 250 мг Пример 10. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Моногидрат лактозы (высушен распылением) 25,00 Гидроксипропилцеллюлоза 4,00 Натриевая соль кроскармеллозы 9,00 15 Гидроксипропилметилцеллюлоза (EF) 1,75 Лаурилсульфат натрия 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 37,50 Натриевая соль кроскармеллозы 7,00 Стеарилфумарат натрия 1,25 Всего 250 мг Пример 11. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Моногидрат лактозы (высушен распылением) 25,00 Гидроксипропилцеллюлоза 4,00 Натриевая соль кроскармеллозы 9,00 Гидроксипропилцеллюлоза 1,75(EF) Лаурилсульфат натрия 0,70 Наружные порошки Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,25 Всего 212,50 мг Пример 12. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы,таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 153,80 Моногидрат лактозы (высушен распылением) 25,00 Гидроксипропилцеллюлоза 4,00 Кросповидон 27,00 Гидроксипропилцеллюлоза(EF) 1,75 Лаурилсульфат натрия 0,70 Наружные порошки Микрокристаллическая целлюлоза (Granular-102) 19,50 Кросповидон 7,00 Стеарат магния (растительный) 1,25 Всего 250 мг Пример 13. Посредством аналогичных методик следующий состав используют для получения конечной дозированной лекарственной формы, 004872 16 таблетки, обеспечивающей 10 мг соединения А,без покрытия пленкой. Ингредиент Количество, мг Компоненты для грануляции Соединение А 10,0 Моногидрат лактозы 154,50 Моногидрат лактозы (высушен распылением) 25,00 Гидроксипропилцеллюлоза 4,00 Натриевая соль кроскармеллозы 9,00 Гидроксипропилцеллюлоза(EF) 1,75 Наружные порошки Микрокристаллическая цел 37,50 люлоза (Granular-102) Натриевая соль кроскармеллозы 7,00 Стеарат магния (растительный) 1,75 Всего 250 мг Предпочтительные принципы осуществления и режимы операции настоящего изобретения были описаны в приведенном выше описании. Изобретение, которое предназначается здесь для защиты, однако, не должно истолковываться как ограничиваемое описанными конкретными формами, поскольку они являются иллюстративными, а не ограничительными. Специалистами в данной области могут быть сделаны варианты и изменения, не выходящие за пределы сущности данного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая активное соединение, имеющее структурную формулу и представленное в виде свободного лекарственного средства, от 50 до 85 мас.% водорастворимого разбавителя, смазывающее вещество,от 1 до 5 мас.% гидрофильного связующего,выбранного из группы, состоящей из производного целлюлозы, повидона и их смесей, и дезинтегрирующее средство, выбранное из группы,состоящей из натриевой соли кроскармеллозы,кросповидона и их смесей. 2. Композиция по п.1, отличающаяся тем,что она дополнительно включает микрокристаллическую целлюлозу. 3. Композиция по п.1, отличающаяся тем,что она дополнительно включает смачивающий агент. 4. Композиция по п.1, отличающаяся тем,что активное соединение присутствует в количестве от 0,5 до 10 мас.%. 5. Композиция по п.1, отличающаяся тем,что водорастворимый разбавитель выбран из группы, состоящей из сахара, полисахарида,полиола, циклодекстрина и их смесей. 6. Композиция по п.3, отличающаяся тем,что водорастворимый разбавитель выбран из группы, состоящей из лактозы, сахарозы, декстрозы, декстрата, мальтодекстрина, маннита,ксилита, сорбита, циклодекстрина и их смесей. 7. Композиция по п.1, отличающаяся тем,что смазывающее вещество присутствует в количестве от 0,25 до 2 мас.%. 8. Композиция по п.1, отличающаяся тем,что смазывающее вещество выбрано из группы,состоящей из талька, стеарата магния, стеарата кальция стеариновой кислоты, коллоидного диоксида кремния, силиката кальция крахмала,минерального масла, воска, глицерилбегената,полиэтиленгликоля, бензоата натрия, ацетата натрия, стеарилфумарата натрия гидрогенизированных растительных масел и их смесей. 9. Композиция по п.1, отличающаяся тем,что производное целлюлозы выбрано из группы,состоящей из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы и их смесей. 10. Композиция по п.1, отличающаяся тем,что дезинтегрирующее средство присутствует в количестве от 3 до 10 мас.%. 11. Композиция по п.2, отличающаяся тем,что микрокристаллическая целлюлоза присутствует в количестве от 5 до 40 мас.%. 12. Композиция по п.3, отличающаяся тем,что смачивающий агент присутствует в количестве от 0,1 до 5 мас.%. 13. Композиция по п.12, отличающаяся тем, что смачивающий агент выбран из группы,состоящей из лаурилсульфата натрия, докузата натрия, этоксилированного касторового масла,полигликолизированного глицерида, ацетилированного моноглицерида, эфира сорбитана и жирных кислот, полоксамера, эфира полиоксиэтиленсорбитана и жирных кислот, полиоксиэтилена, моноглицерида и его этоксилированных производных, диглицерида и его этоксилированных производных и их смесей. 18 14. Композиция по п.13, отличающаяся тем, что смачивающий агент выбран из группы,состоящей из лаурилсульфата натрия, полисорбата 80 и их смесей. 15. Композиция по п.1, отличающаяся тем,что активное соединение представлено в виде частиц свободного лекарственного средства, по меньшей мере 90% которых имеют размер меньше чем 40 мк. 16. Композиция по п.1, отличающаяся тем,что активное соединение представлено в виде частиц свободного лекарственного средства, по меньшей мере 90% которых имеют размер меньше чем 10 мк. 17. Композиция по п. 1, отличающаяся тем,что она включает(e) от 3 до 10 мас.% натриевой соли кроскармеллозы. 18. Композиция по п.16, отличающаяся тем, что она дополнительно включает от 5 до 40 мас.% микрокристаллической целлюлозы. 19. Композиция по п.16, отличающаяся тем, что она дополнительно включает от 0,1 до 5 мас.% лаурилсульфата натрия. 20. Таблетка, включающая композицию по п.1, где активное соединение присутствует в количестве от 1 до 20 мг на таблетку. 21. Таблетка, включающая композицию по п.1, где активное соединение присутствует в количестве от 5 до 15 мг на таблетку. 22. Таблетка, включающая композицию по п.1, где активное соединение присутствует в количестве от 5 до 10 мг на таблетку. 23. Капсула, включающая твердую оболочку, капсулирующую композицию по п.1 в виде сухих сыпучих частиц, где активное соединение присутствует в количестве от 1 до 20 мг на капсулу. 24. Способ лечения половой дисфункции у пациента, включающий введение пациенту эффективного количества композиции по любому одному из пп.1-19.
МПК / Метки
МПК: A61P 15/10, A61K 31/495
Метки: композиции, фармацевтические, beta;-карболиновые
Код ссылки
<a href="https://eas.patents.su/10-4872-beta-karbolinovye-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">β-карболиновые фармацевтические композиции</a>
Предыдущий патент: Устойчивые композиции 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил) бензо[b] тиофена и его солей
Следующий патент: Способ определения присутствия антигена папилломатозного пальцевидного дерматита в образце сыворотки жвачного животного
Случайный патент: Устройство для хранения и транспортировки конусовидных преформ пластмассовых контейнеров














