Способы получения и промежуточные соединения для получения противораковых соединений
Номер патента: 4654
Опубликовано: 24.06.2004
Авторы: Лехнер Ричард Шелтон, Сантафьянос Динос Пол, Норрис Тимоти
Формула / Реферат
1. Способ получения соединения формулы 1
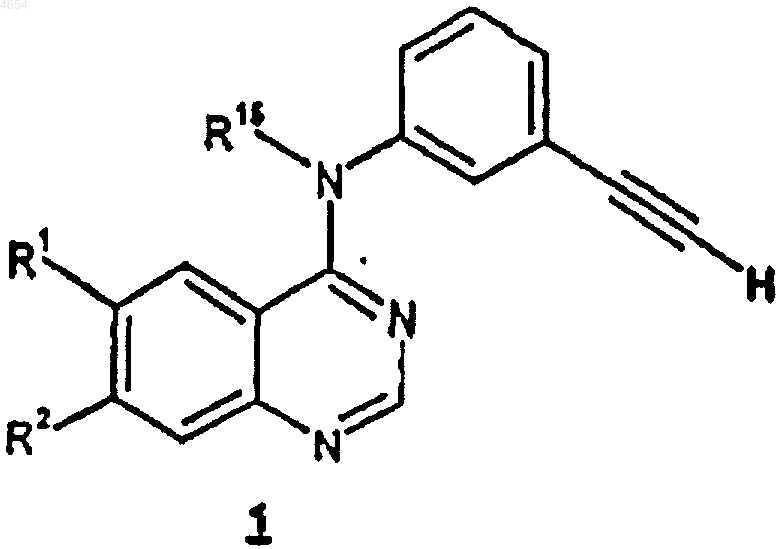
или фармацевтически приемлемых солей и сольватов указанного соединения,
где R1 и R2, каждый независимо, выбраны из C1-C10алкила и C1-C10алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-C6алкокси;
R15 представляет собой H или C1-C10алкил;
который включает обработку соединения формулы 2
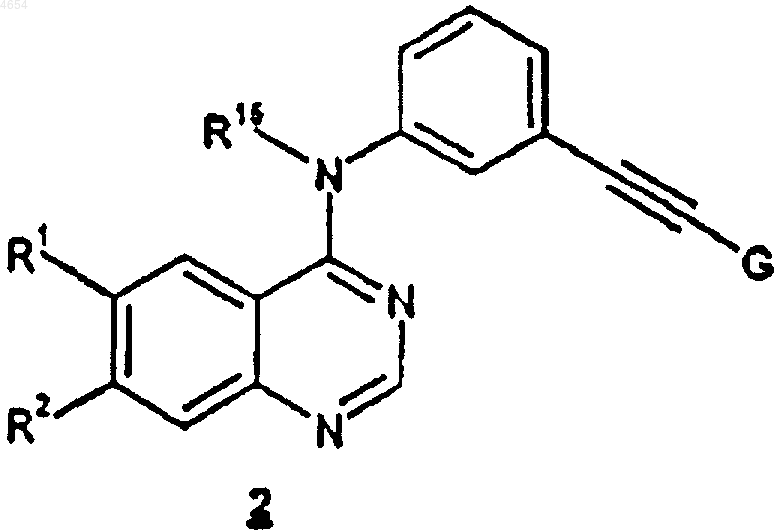
где R15, R1 и R2 определены как указано выше, а G является блокирующей группой -C(OH)R3R4;
R3, R4 и R5, каждый независимо, представляют собой C1-C6алкил;
гидроксидом щелочного или щелочно-земельного металла в растворителе, содержащем замещенный гидроксилом C1-C10алкил.
2. Способ по п.1, где указанный растворитель является вторичным спиртом, а указанный гидроксид щелочного или щелочно-земельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия.
3. Способ по п.2, где указанный растворитель является бутан-2-олом, или изопропанолом, или смесью этих двух растворителей, а указанный гидроксид щелочного металла является гидроксидом натрия.
4. Способ получения соединения формулы 1

или фармацевтически приемлемых солей и сольватов указанного соединения,
где R1 и R2, каждый независимо, выбраны из C1-C10алкила и C1-C10алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-C6алкокси;
R15 представляет собой H или C1-C10алкил;
который включает обработку соединения формулы 2
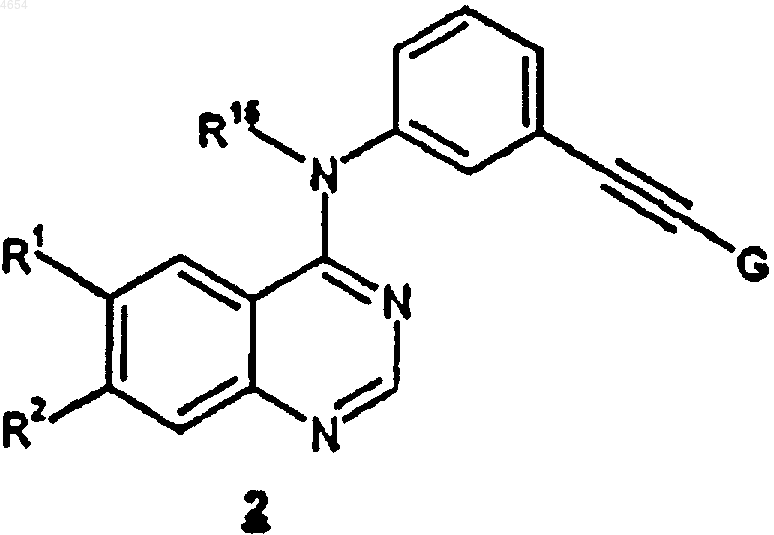
где R15, R1 и R2 определены как указано выше, а G является блокирующей группой -SiR3R4R5;
R3, R4 и R5, каждый независимо, представляют собой C1-C6алкил;
тетра-(C1-C6алкил)аммонийфторидным соединением в апротонном растворителе.
5. Способ по п.4, где указанное тетра-(C1-C6алкил)аммонийфторидное соединение является фторидом тетра-(н-бутил)аммония, а указанный апротонный растворитель выбирают из тетрагидрофурана, диэтилового эфира, диметоксиэтана, толуола, дихлорметана, хлороформа и смеси двух или более из вышеназванных растворителей.
6. Способ по любому из предшествующих пунктов, где как R1, так и R2 являются 2-метоксиэтокси, а R15 является H.
7. Способ получения промежуточного соединения, предназначенного для использования в способах по пп.1 и 4, имеющего формулу 2
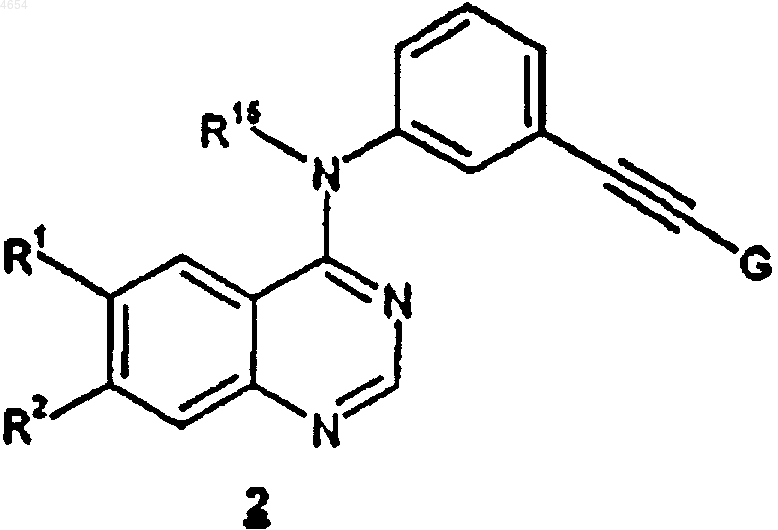
где R1 и R2, каждый независимо, выбраны из C1-C10алкила и C1-C10алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-C6алкокси;
R15 представляет собой H или C1-C10алкил и
G является группой -C(OH)R3R4 или -SiR3R4R5;
R3, R4 и R5, каждый независимо, представляют собой C1-C6алкил;
включающий обработку соединения формулы 3
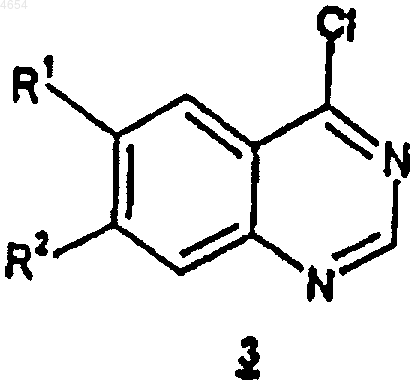
соединением формулы 4
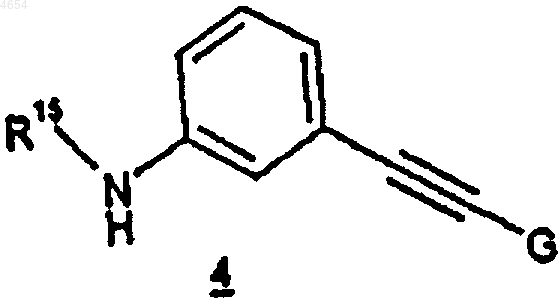
8. Способ по п.7, где соединение формулы 3 обрабатывают соединением формулы 4 в органическом растворителе, выбранном из диметилформамида, диметилсульфоксида, тетрагидрофурана, ацетонитрила и смеси двух или более из вышеназванных растворителей.
9. Способ по п.8, где указанный растворитель является ацетонитрилом, как R1, так и R2 являются 2-метоксиэтокси, а R15 является H.
10. Способ получения соединения формулы 6 или 7
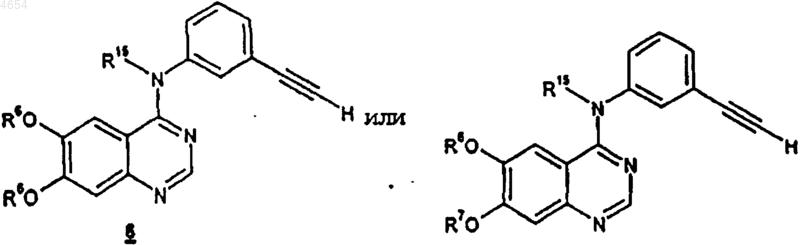
или их фармацевтически приемлемых солей и сольватов,
где R6 является C1-C10алкилом или -(CH2)mO(CH2)nCH3;
R7 представляет собой C1-C10алкил,
где вышеуказанные группы R7 необязательно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогена, нитро, трифторметила, трифторметокси, (C1-C6алкил)сульфонила, C1-C6алкила, C1-C6алкокси, C6-C10арилокси и C6-C10арилсульфонила;
каждый m независимо является целым числом от 1 до 6, а n является целым числом от 0 до 3;
R15 представляет собой H или C1-C10алкил;
который включает обработку соединения формулы 8
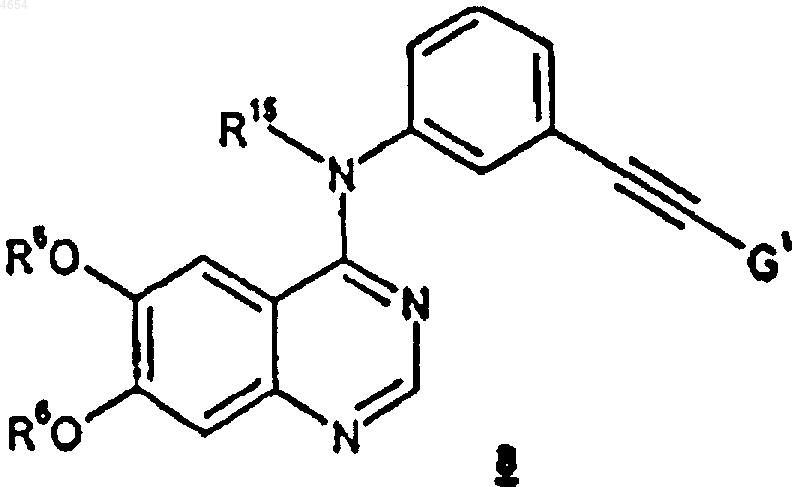
где R6 и R15 определены как указано выше,
G1 представляет собой -C(OH)R3R4 и
R3 и R4, каждый независимо, представляют собой C1-C6алкил;
первичным или вторичным спиртом формулы R7-OH, где R7 является C1-C10алкилом, и вышеназванные группы R7 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, нитро, трифторметила, трифторметокси, (C1-C6алкил) сульфонила, C1-C6алкила, C1-C6алкокси, C6-C10арилокси и C6-C10арилсульфонила;
в присутствии гидроксида щелочного металла или щелочно-земельного металла.
11. Способ по п.10, где указанный гидроксид щелочного металла или щелочно-земельного металла выбирается из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия.
12. Способ по п.11, где указанный гидроксид щелочного или щелочно-земельного металла является гидроксидом натрия, R6 является 2-метоксиэтилом, R15 является H и указанный спирт формулы R7-OH является вторичным спиртом.
13. Способ по п.1, где R1 и R2 оба являются 2-метоксиэтокси, R15 является H, указанный растворитель является первичным спиртом, а указанный гидроксид щелочного или щелочно-земельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия.
14. Способ по п.13, где указанный растворитель является бутан-1-олом, или изопропанолом, или смесью этих двух растворителей, а указанный гидроксид щелочного металла является гидроксидом натрия.
15. Способ по п.10, где R6 и R7 оба являются 2-метоксиэтилом, R15 является H, а указанный гидроксид щелочного или щелочно-земельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия.
16. Соединение формулы 2
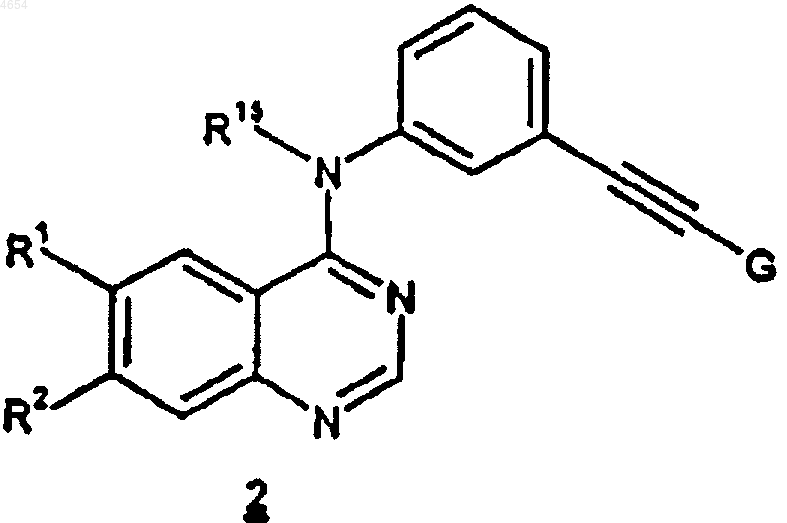
где R1 и R2, каждый независимо, выбраны из C1-C10алкила и C1-C10алкокси, причхь указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-C6алкокси;
G является блокирующей группой, выбранной из -C(OH)R3R4 и -SiR3R4R5;
R3, R4 и R5, каждый независимо, представляет собой C1-C6алкил и
R15 представляет собой H или C1-C10алкил.
Текст
1 Предпосылки создания изобретения Настоящее изобретение относится к способам получения и промежуточным веществам для получения соединений, которые применимы для лечения заболеваний, обусловленных гиперпролиферацией, таких как различные виды рака, у млекопитающих. Патент Соединенных Штатов 5747498, который опубликован 5 мая 1998 г. и упомянут здесь для сведения во всей его полноте, относится к новым сериям хиназолиновых производных, включая [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина гидрохлорид, которые являются ингибиторами семейства еrbВ онкогенных и протоонкогенных белковых тирозинкиназ, таких как рецепторы эпидермального фактора роста (РЭФР), и поэтому применимы для лечения заболеваний, обусловленных пролиферацией, таких как разновидности рака у людей. Заявка на предварительный патент США на изобретение, озаглавленная Безводный N-(3-этинилфениламино)-6,7-бис(2 метоксиэтокси)-4-хиназолинаминмезилат и его моногидрат, зарегистрированная 29 апреля 1998 г., авторами которой названы Т. Norris, D.Raggon, досье поверенного PC 10074, которая упомянута здесь для сведения во всей полноте,относится к N-(3-этинилфениламино)-6,7-бис(2 метоксиэтокси)-4-хиназолинаминмезилату, безводному и его гидратным формам, которые обладают таким же противораковым действием,что и соответствующая гидрохлоридная соль,упомянутая выше. Данное изобретение относится к способам получения и промежуточным соединениям для получения противораковых соединений, о которых говорится в патенте Соединенных штатов и в патентной заявке, упомянутых выше. Краткое описание изобретения Настоящее изобретение относится к способу получения соединений формулыR3, R4 и R5, каждый независимо, представляют собой C1-С 6 алкил; либо (а) гидроксидом щелочного или щелочно-земельного металла в растворителе, содержащем замещенный гидроксилом C1 С 10 алкил, когда G является -C(OH)R3R4, либо (b) тетра-(C1-С 6 алкил)аммонийфторидным соединением в апротонном растворителе, когда G представляет собой -SiR3R4R5. При предпочтительном осуществлении,когда G представляет собой -C(OH)R3R4, указанный растворитель является вторичным спиртом, таким как бутан-2-ол или изопропанол, а указанный гидроксид щелочного или щелочноземельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия,гидроксида кальция, гидроксида магния и гидроксида калия, наиболее предпочтителен гидроксид натрия. При другом предпочтительном осуществлении, когда G представляет собой -SiR3R4R5,указанное тетра(C1-С 6 алкил)аммонийфторидное соединение является тетра-(н-бутил)аммонийфторид, а указанный апротонный растворитель выбирают из тетрагидрофурана (ТГФ), диэтилового эфира, диметоксиэтана (ДМЭ), толуола,дихлорметана, хлороформа и смесей из двух или более из вышеназванных растворителей,наиболее предпочтителен ТГФ. Настоящее изобретение относится также к способу получения соединения формулы 2, описанного выше, который включает обработку соединения формулы 3 где R1 и R2 определены как указано выше, соединением формулы 4 и фармацевтически приемлемых солей и сольватов указанных соединений, у которыхR1 и R2, каждый независимо, выбираются из C1-С 10 алкила и C1-С 10 алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-С 6 алкокси;R15 представляет собой Н или C1-С 10 алкил; который включает обработку соединения формулы 2 где G и R15 определены как указано для соединения формулы 2. При предпочтительном осуществлении вышеназванного способа соединение формулы 3 обрабатывают соединением формулы 4 в органическом растворителе, таком как диметилформамид (ДМФ), диметилсульфоксид (ДМСО),ТГФ, ацетонитрил (MeCN) или смеси двух или более указанные выше растворителей, более предпочтительно, в ацетонитриле. 3 Настоящее изобретение относится также к способу получения соединений формулы 6 и 7 и их фармацевтически приемлемых солей и сольватов, у которых R15 определен, как указано выше, R6 является C1-С 10 алкилом илиR7 представляет собой C1-С 10 алкил, где вышеуказанные группы R7 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, нитро, трифторметила, трифторметокси, (C1-С 6 алкил)сульфонила, C1-С 6 алкокси, C6-С 10 арилокси и C6-С 10 арилсульфонила; каждый m, независимо, является целым числом от 1 до 6, а n является целым числом от 0 до 3; который включает обработку соединения формулы 8 где G1 представляет собой -C(OH)R3R4 и R15, R6,R3 и R4 определены, как указано выше, первичным или вторичным спиртом формулы R7-OH,где R7 определен как указано выше, в присутствии гидроксида щелочного металла или щелочно-земельного металла, как, например, гидроксид натрия, гидроксид лития, гидроксид цезия,гидроксид кальция, гидроксид магния или гидроксид калия, наиболее предпочтительно, гидроксида натрия. При предпочтительном осуществлении вышеуказанной реакции R6 является 2 метоксиэтокси, а указанный спирт формулы R7OH, предпочтительно, является вторичным спиртом. Вышеуказанные соединения формул 1, 6 и 7 применимы при лечении заболеваний, обусловленных гиперпролиферацией, таких как разновидности рака, у млекопитающих. Настоящее изобретение относится также к промежуточным при получении соединений формулы 1 соединениям формулы 2, как описано выше. Термин галоген, как он используется в данном описании, если не указано иначе, включает фтор, хлор, бром или йод. Предпочтительными галогеновыми группами являются фтор,хлор и бром. Термин алкил, как он используется в данном описании, если не указано иначе, включает предельные одновалентные углеводородные радикалы, имеющие составные части с прямой, разветвленной цепью или циклические 4 составные части, или же сочетание вышеуказанных составных частей. В отношении указанной алкильной группы понятно, что для того,чтобы указанная алкильная группа включала циклические составные части, необходимо, чтобы она содержала, по меньшей мере, три атома углерода. Термин арил, как он используется в данном описании, если не указано иначе, включает органический радикал, получаемый из ароматического углеводорода путем удаления одного атома водорода, такой как фенил или нафтил. Термин 4-10-членный гетероцикл, как он используется в данном описании, если не указано иначе, включает ароматические и неароматические гетероциклические группы, содержащие один или более гетероатомов, каждый из которых выбирается из О, S и N, где каждая гетероциклическая группа имеет от 4 до 10 атомов в своей кольцевой системе. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в своей кольцевой системе, но ароматические гетероциклические группы должны иметь, по меньшей мере, 5 атомов в их кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы и кольцевые системы, замещенные, одним или более, оксозаместителями. Примером 4-членной гетероциклической группы является азетидинил (производный от азетидина). Примером 5-членной гетероциклической группы является тиазолил, и примером 10 членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил,тетрагидротиопиранил, пиперидино, морфолино,тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Нпиранил, иоксанил, 1,3-диоксоланил, пиразолинил,дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3,1,0] гексанил, 3-азабицикло[4,1,0]-гептанил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил,фталазинил, пиридазинил, триазинил, изоиндолил,птеридинил, пуринил, оксадиазолил, тиадиазолил,фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеназванные группы, как производные от соединений,перечисленных выше, могут присоединяться по С или, где это возможно, присоединяться по N. Например, группа, производная от пиррола, может 5 быть пиррол-1-илом (присоединяется по атому N) или пиррол-3-илом (присоединяется по атому С). Выражение фармацевтически приемлемая(ые) соль(и), как оно используется в данном описании, если не указано иначе, включает соли кислотных и основных групп, которые могут присутствовать в соединениях данного изобретения. Соединения, полученные в соответствии с данным изобретением, которые по своей природе являются основными, способны к образованию широкого разнообразия солей с различными неорганическими и органическими кислотами. Кислотами, которые могут использоваться для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений, являются те,которые образуют нетоксичные соли присоединения кислот, т.е. соли, содержащие фармакологически приемлемые анионы, например такие, как гидрохлорид, гидробромид, гидройодид, нитрат,сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат,глютамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Соединения, полученные в соответствии с данным изобретением, которые включают основной остаток,такой как аминогруппа, могут образовывать фармацевтически приемлемые соли с разными аминокислотами, в дополнение к кислотам, упомянутым выше. Те соединения, полученные согласно настоящему изобретению, которые являются по природе кислотными, способны к образованию солей с основаниями с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных и щелочно-земельных металлов и, в частности, кальциевые, магниевые, натриевые и калиевые соединения данного изобретения. Соединения, полученные по данному изобретению, имеют центры асимметрии, и поэтому существуют в разных энантиомерных и диастереомерных формах. Это изобретение относится также ко всем оптическим изомерам и стереоизомерам соединений, получаемым по данному изобретению, и их смесям. Соединения формулы 1 могут также существовать в виде таутомеров. Это изобретение относится и к использованию таких таутомеров и их смесей. Предмет изобретения также включает меченные изотопами соединения, полученные по данному изобретению, и их фармацевтически приемлемые соли, которые идентичны соединениям, приведенным в формуле 1, но с учетом того факта, что в этих соединениях один или более атомов заменены атомами, имеющими атомную массу или массовое число, отличные от атомной массы или массового числа, обычно находимых для природных атомов. Примеры изотопов, кото 004654 6 рые могут быть включены в соединения этого изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора,такие как 2H, 3H, 13 С, 14 С, 15N, 18 О, 17 О, 35S, 18F и 36Cl, соответственно. Соединения, полученные по данному изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеназванные изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые меченные изотопами соединения данного изобретения, например, те, в которые включены радиоактивные изотопы, такие как 3H и 14 С, применимы в испытаниях по распределению лекарственных препаратов и/или субстратов в тканях. Меченные тритием, т.е. 3H и углеродом-14, т.е. 14 С, изотопы особенно предпочтительны из-за легкости их получения и детектируемости. Кроме того, замещение более тяжелыми изотопами, такими как дейтерии, т.е. 2H может давать определенные терапевтические преимущества,являющиеся результатом большей метаболической стабильности, например повышенный период полураспада in vivo или сниженная требуемая дозировка, и, следовательно, могут быть предпочтительными при некоторых обстоятельствах. Меченные изотопами соединения формулы 1 этого изобретения и их пролекарства могут быть, в общем, получены путем выполнения методик, раскрываемых в схемах и/или в примерах и препаративных примерах ниже, путем замены не меченного изотопом реагента доступным меченым изотопом реагентом. Подробное описание изобретения Схема 1 Способы данного изобретения могут быть описаны со ссылками на схемы 1-2, выше. В реакциях, описанных ниже, все реакции проводятся при атмосферном давлении и комнатной температуре (примерно 20-25 С), если не оговорены иные условия. Кроме того, если не указано иначе, заместители R1-R10, R15 и G1 определены как указано выше. На схеме 1 соединения формулы 1 могут быть получены путем вначале обработки исходного соединения формулы 5, которое может быть получено способом, известным квалифицированным специалистам, тионилхлоридом в безводном дихлорметане при температуре дефлегмации (примерно 38-42 С при атмосферном давлении) с получением соединения формулы 3. Соединение формулы 2 может быть получено путем обработки соединения формулы 3 соединением формулы 4 в органическом растворителе, таком как ДМФА, ДМСО, ТГФ,MeCN или смеси двух или более вышеназванных растворителей, предпочтительно MeCN,при температуре в интервале от 50 С до температуры дефлегмации, предпочтительно при температуре дефлегмации. Вышеприведенные сокращения определены как указано в кратком описании изобретения, изложенном выше. Соединение формулы 1 может быть получено путем взаимодействия соединения формулы 2 с гидроксидом щелочного металла или щелочноземельного металла в растворителе, содержащем C1-С 10 алкил, замещенный, по меньшей мере, одной гидроксильной группой, когда G представляет собой -C(OH)R3R4, или с тетра(C1-С 6 алкил)аммонийфторидным соединением в апротонном растворителе, когда G представляет собой -SiR3R4R5. Когда G представляет собой-C(OY)R3R4, растворитель, предпочтительно,является вторичным спиртом, таким как бутан 2-ол или изопропанол, указанный гидроксид щелочного или щелочно-земельного металла может быть выбран из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия, предпочтительно, гидроксида натрия, и 8 реакция, предпочтительно, протекает при температуре в интервале от примерно 100 до примерно 150 С. Когда G представляет собой-SiR3R4R5, тетра-(C1-C6 алкил)аммонийфторидное соединение, предпочтительно, является тетра(н-бутил)аммонийфторидом, апротонный растворитель может быть выбран из ТГФ, диэтилового эфира, ДМЭ, толуола, дихлорметана, хлороформа и смесей из двух или более вышеуказанных растворителей, предпочтительно, ТГФ,и реакция, предпочтительно, проводится при температуре в интервале от примерно комнатной температуры до примерно 70 С. Противораковые соединения формулы 1 могут быть превращены в фармацевтически приемлемые соли, как описано ниже. В схеме 2 противораковые соединения формул 6 и 7 могут быть получены путем взаимодействия промежуточного соединения формулы 8 с первичным или вторичным спиртом формулы R7-OH, где R7 определен как указано выше, в присутствии гидроксида щелочного металла или щелочно-земельного металла, такого как гидроксид натрия, гидроксид лития, гидроксид цезия, гидроксид кальция, гидроксид магния или гидроксид калия, предпочтительно,гидроксида натрия, при температуре в интервале от примерно 100 до примерно 150 С. Использование вторичного спирта формулы R7-OH будет сводить к минимуму превращение в асимметричный аналог формулы 7, тогда как использование первичного спирта формулы R7-ОН будет повышать относительную концентрацию асимметричного аналога формулы 7. Таким образом, в зависимости от аналога, который является предпочтительным, может быть предпочтительным вторичный или первичный спирт. Соединения формул 6 и 7 могут быть разделены различными методами, такими как хроматография, которые известны квалифицированным специалистам. Соединения формул 6 и 7 могут быть превращены в фармацевтически приемлемые соли, как описано ниже. Некоторые соединения, полученные согласно данному изобретению, упомянутые выше, могут иметь асимметричные атомы углерода. Соединения, содержащие смесь изомеров по одному или более центрам, будут существовать как диастереомерные смеси, которые могут быть разделены на их отдельные диастереомеры на основе их физико-химических различий методами, известными квалифицированным специалистам, например хроматографией или дробной кристаллизацией. Все такие изомеры,включая диастереомерные смеси, рассматриваются как часть этого изобретения. Соединения, названные выше, которые являются по природе основными, способны к образованию широкого круга различных солей с разными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения мле 9 копитающим, часто на практике желательно сначала выделить соединение данного изобретения из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнюю снова в соединение свободное основание путем обработки щелочным реагентом, и затем превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений согласно настоящему изобретению легко получаются путем обработки основного соединения с, по существу, эквивалентным количеством избранной минеральной или органической кислоты в среде водного растворителя или в соответствующем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получают желаемую твердую соль. Желаемая кислая соль может быть также осаждена из раствора свободного основания в органическом растворителе путем добавления раствора соответствующей минеральной или органической кислоты. Те соединения, названные выше, которые являются по природе кислотными, способны к образованию солей с основаниями, образуемых различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочно-земельных металлов и, в частности, соли натрия и калия. Все эти соли получают по стандартным методикам. Химическими основаниями, которые используются в качестве реагентов для получения фармацевтически приемлемых солей с основаниями согласно настоящему изобретению, являются те,которые образуют нетоксичные соли с кислотными соединениями данного изобретения. Такие нетоксичные соли с основаниями включают соли, которые являются производными таких фармакологически приемлемых катионов, как натрий, калий, кальций и магний и т.д. Эти соли могут быть легко получены путем обработки соответствующих кислотных соединений водным раствором, содержащим алкоксид желаемого щелочного металла или его гидроксид, и затем выпариванием полученного раствора досуха, предпочтительно под пониженным давлением. Альтернативно, они могут быть получены путем смешивания растворов в низших алканолах кислотных соединений и алкоксида желаемого щелочного металла или его гидроксида вместе и затем выпаривания полученного раствора досуха таким же образом, что и ранее. В том и другом случае, предпочтительно, используются стехиометрические количества реагентов для обеспечения полноты протекания реакции и максимальных выходов желаемого конечного продукта. Представленные ниже примеры дополнительно иллюстрируют способы и промежуточные соединения данного изобретения, хотя по 004654 10 нятно, что объем данного изобретения не ограничивается следующими примерами. Пример 1. Получение 3-[(триметилсилил) этинил]нитробензола. Смесь 1-бром-3-нитробензола (10,0 г,49,45 ммоль) и триметилсилилацетилена (8,4 мл, 59,34 ммоль) обрабатывали триэтиламином(33 мл), получая небольшое количество белого осадка. Полученную смесь обрабатывали дихлорбис(трифенилфосфон)палладием II (7 мг,0,01 ммоль) и йодидом меди (I) (8,5 мг, 0,04 ммоль) и нагревали до 80-85 С (температура масляной бани) в течение 4 ч. Полученной в результате ярко-желтой смеси давали остыть до комнатной температуры, и твердое вещество удаляли фильтрованием при помощи триэтиламина (33 мл). Прозрачный желтый раствор концентрировали выпариванием и сушили в вакууме при комнатной температуре в течение ночи с получением продукта, указанного в заголовке (11,11 г, 102%) в виде темно-коричневого масла. Анализ методом газовой хроматографии/масс-спектроскопии показал, что конечное соединение было 100% чистоты, m/е 219(М+Н)+. Пример 2. Получение 3-[(триметилсилил) этинил]анилина. Смесь нитросоединения, 3-[(триметилсилил)этинил]нитробензола, полученного, как описано выше (0,86 г, 3,92 ммоль) в 2-пропаноле (30 мл) дегазировали с помощью азота и обрабатывали 5% платиной на окиси алюминия(268 мг). Смесь встряхивали в атмосфере водорода (30 фунт/дюйм 2, 2,06105 н/м 2, 2,05 атм) во встряхивающем устройстве Парра в течение 22 ч. Реакционную смесь фильтровали через невысокий слой целита (диатомовая земля) и концентрировали выпариванием с получением масла, которое сушили в вакууме в течение ночи с получением продукта, указанного в заголовкеH (300 МГц; CDCl3) 0,24 (9H, с), 3,56 (2 Н,шир.с), 6,62 (1 Н, ддд, J=1,0, 2,3; 8,0), 6,78 (1 Н, т,J=2,2), 6,87 (1H, дт, J=7,7; 1,2), 7,07 (1 Н, т,J=7,8); C (75,5 МГц; СDСl3) 93,4, 105,4, 115,6,118,2, 122,4, 123,8, 129,2, 146,2; m/e 190(M+H)+. Пример 3. Получение 6,7-бис(2-метоксиэтокси)-N-[3-[(триметилсилил)этинил]фенил]-4 хиназолинамина моногидрохлорида. 4-Хлор-6,7-бис(2-метоксиэтокси)хиназолин (942 мг, 3,01 ммоль) обрабатывали раствором анилина (645 мг, 3,41 ммоль) в 2-пропаноле(14 мл) и нагревали при температуре дефлегмации в течение 2,5 ч. Смеси давали остыть до комнатной температуры и перемешивали в течение 1 ч. Твердое вещество собирали фильтрованием, промывали 2-пропанолом (5 мл) и сушили в вакууме в течение ночи с получением продукта, указанного в заголовке (1,33 г, 88%) в виде белого твердого вещества.(2 Н, м), 7,75 (1 Н, д, J=7,8), 7,88 (1 Н, с), 8,20 (1 Н,с), 8,42 (1 Н, с); m/е 466 (M+H)+. Пример 4. Получение N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамин,моногидрохлорид. Густую суспензию силильного соединения, а именно 6,7-бис(2-метоксиэтокси)-N-[3[(триметилсилил)этинил]фенил]-4-хиназолинамина моногидрохлорида, полученного выше(1,22 г, 2,43 ммоль) в тетрагидрофуране (6,1 мл) обрабатывали 1 М раствором тетра-н-бутиламмонийфторида в тетрагидрофуране (2,6 мл,2,55 ммоль) и перемешивали при комнатной температуре в течение 1 ч. Раствор обрабатывали 2-пропанолом (12,2 мл) и концентрировали выпариванием. Масло в 2-пропаноле (20 мл) обрабатывали концентрированной соляной кислотой (0,2 мл), получая осадок. Смесь перемешивали при комнатной температуре в течение 1 ч. Твердое вещество собирали фильтрованием,промывали 2-пропанолом (2 мл) и сушили в вакууме с получением соединения, указанного в заголовке (747 мг, 72%) в виде не совсем белого твердого вещества (т.пл. 226-229 С).(225 мл) нагревали с обратным холодильником в течение 5 ч. Смесь охлаждали до 5-10 С и перемешивали в течение 1 ч. Твердое вещество собирали фильтрованием, промывали ацетонитрилом (15 мл) и сушили в вакууме в течение ночи с получением продукта, указанного в заголовке (23,4 г, 100%) в виде белого твердого вещества. 12 ремешивали вместе при комнатной температуре для образования смеси. Показатель рН смеси доводили до рН 10-12 с помощью 50% водного раствора гидроксида натрия с получением двух прозрачных слоев. Органический слой отделяли от водного слоя и упаривали под пониженным давлением до объема 190 мл. После периода грануляции на ледяной бане образовывались кристаллы продукта, указанного в заголовке,которые отфильтровывали и сушили с получением продукта (15,13 г, 86%) .(1 Н, с); m/е 452 (М+H)+. Пример 7. Получение N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина,моногидрохлорида. 4-[3-6,7-Бис(2-метоксиэтокси)-4-хиназолинил]амино]фенил]-2-метил-3-бутин-2-ола моногидрохлорид, полученный, как описано выше (32,34 г, 66,3 ммоль), воду (300 мл) и бутан-1-ол (600 мл) перемешивали вместе при комнатной температуре до образования смеси. Показатель рН смеси доводили до рН 10-12 с помощью 50% водного раствора гидроксида натрия с получением двух прозрачных слоев. Органический слой отделяли от водного слоя и упаривали при атмосферном давлении так, что вода удалялась из раствора в бутан-1-оле в виде азеотропной смеси. Конечный объем бутан-1 ольного раствора составлял 300 мл. К осушенному азеотропной перегонкой бутан-1-ольному раствору добавляли безводный твердый гидроксид натрия (0,13 г, 3,3 ммоль), и полученную смесь нагревали с обратным холодильником при 115-120 С в течение 24 ч. Бутан-1-ол (150 мл) удаляли путем отгонки и концентрированную реакционную смесь охлаждали до 15-25 С. К охлажденному концентрату добавляли концентрированную соляную кислоту (6,1 мл) и бутан-1-ол (60 мл) и смесь гранулировали в течение ночи при 20-25 С до наступления кристаллизации. Кристаллы продукта, указанного в заголовке, выделяли фильтрованием и сушили под пониженным давлением при 45-50 С для удаления бутан-1-ола. Выход (21,0 г, 73,7%). Чистота по ВЭЖХ 96,5%. Пример 8. Получение соли N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина и метансульфоновой кислоты. 4-[3-6,7-Бис(2-метоксиэтокси)-4-хиназолинил]амино]фенил]-2-метил-3-бутин-2-ола моногидрохлорид, полученный выше (32,34 г,66,3 ммоль), воду (300 мл) и бутан-1-ол (600 мл) перемешивали вместе при комнатной температуре до образования смеси. Показатель рН смеси доводили до рН 10-12 с помощью 50% водного раствора гидроксида натрия с получением двух прозрачных слоев. Органический слой отделяли от водного слоя и упаривали при атмосферном давлении, так что вода удалялась из 13 бутан-1-ольного раствора в виде азеотропной смеси. Конечный объем бутан-1-ольного раствора составлял 300 мл. К осушенному азеотропной перегонкой бутан-1-ольному раствору добавляли безводный твердый гидроксид натрия (0,13 г, 3,3 ммоль), и полученную смесь нагревали с обратным холодильником при 115120 С в течение 24 ч. Реакционную смесь охлаждали до 15-25 С и добавляли метансульфоновую кислоту (4,6 мл), и смесь гранулировали в течение ночи при 20-25 С до наступления кристаллизации. Кристаллы продукта, названного в заголовке, отделяли фильтрованием, промывали бутан-1-олом (25 мл) и сушили под пониженным давлением при 45-50 С для удаления бутан-1-ола. Выход (29,16 г, 90%). Чистота по ВЭЖХ 96,7%. Пример 9. Получение N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина моногидрохлорида. 4-[3-6,7-Бис(2-метоксиэтокси)-4-хиназолинил]амино]фенил]-2-метил-3-бутин-2-ол,полученный выше (20,0 г, 44,3 ммоль), безводный твердый гидроксид натрия (0,09 г, 2,2 ммоль) и бутан-2-ол (400 мл) перемешивали вместе и нагревали с обратным холодильником при 100-102 С в течение 36 ч. Реакционную смесь охлаждали до 15-25 С и добавляли концентрированную соляную кислоту (4,1 мл). Полученную смесь гранулировали в течение ночи при 20-25 С до наступления кристаллизации. Кристаллы продукта, указанного в заголовке,отделяли фильтрованием, промывали бутан-2 олом (25 мл) и сушили под вакуумом при 4550 С для удаления бутан-2-ола. Выход (17,7 г,93%). Чистота по ВЭЖХ 99,1%. Пример 10. Получение N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина моногидрохлорида. 4-[3-6,7-Бис(2-метоксиэтокси)-4 хиназолинил]амино]фенил]-2-метил-3-бутин-2 ол, полученный выше (20,0 г, 44,3 ммоль), безводный твердый гидроксид натрия (260 мг, 6,5 ммоль) и пропан-2-ол (200 мл) перемешивали вместе и нагревали в сосуде под давлением при 135-140 С в течение 23 ч. Реакционную смесь охлаждали до 60-65 С и добавляли концентрированную соляную кислоту (4,8 мл). Полученную смесь гранулировали в течение ночи при 20-25 С до наступления кристаллизации. Смесь обрабатывали водой (10 мл) и перемешивали при 58-60 С в течение 21 ч, охлаждали до 1520 С и гранулировали в течение 2 ч. Кристаллы продукта, указанного в заголовке, отделяли фильтрованием, промывали пропан-2-олом(2 х 30 мл) и сушили под вакуумом при 45-50 С для удаления пропан-2-ола. Выход (17,6 г, 92%). Пример 11. Получение N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина моногидрохлорида. 4-[3-6,7-Бис(2-метоксиэтокси)-4 хиназолинил]амино]фенил]-2-метил-3-бутин-2 004654 14 ол, полученный выше (5,0 г, 11 ммоль), безводный твердый гидроксид натрия (44 мг, 11 ммоль) и 2-метоксиэтанол (50 мл) перемешивали вместе и нагревали с обратным холодильником в течение 47 ч. Реакционную смесь охлаждали до 20-25 С и добавляли концентрированную соляную кислоту (1,1 мл). Полученную смесь гранулировали при 20-25 с в течение 1 ч до наступления кристаллизации. Кристаллы продукта, указанного в заголовке, отделяли фильтрованием, промывали 2-метоксиэтанолом(10 мл) и сушили под вакуумом при 45-50 С для удаления 2-метоксиэтанола. Выход (3,73 г,78%). Пример 12. Получение соли N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина и метансульфоновой кислоты. 4-[3-6,7-Бис(2-метоксиэтокси)-4-хиназолинил]амино]фенил]-2-метил-3-бутин-2-ол,полученный выше (20,0 г, 44,3 ммоль), безводный твердый гидроксид натрия (0,09 г, 2,2 ммоль) и бутан-2-ол (400 мл) перемешивали вместе и нагревали с обратным холодильником при 100-102 С в течение 36 ч. Реакционную смесь охлаждали до 15-25 С и добавляли метансульфоновую кислоту (5,1 г, 53,2 ммоль). Полученную смесь гранулировали в течение ночи при 20-25 С до наступления кристаллизации. Кристаллы продукта, указанного в заголовке,отделяли фильтрованием, промывали бутан-2 олом (25 мл) и сушили под пониженным давлением при 45-50 С для удаления бутан-2-ола. Выход (19,45 г, 90%). Чистота по ВЭЖХ 98,5%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы 1 или фармацевтически приемлемых солей и сольватов указанного соединения,где R1 и R2, каждый независимо, выбраны из C1 С 10 алкила и C1-С 10 алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-С 6 алкокси;R15 представляет собой Н или C1-С 10 алкил; который включает обработку соединения формулы 2 где R15, R1 и R2 определены как указано выше, aG является блокирующей группой -С(OH)R3R4;R3, R4 и R5, каждый независимо, представляют собой C1-С 6 алкил; гидроксидом щелочного или щелочноземельного металла в растворителе, содержащем замещенный гидроксилом C1-С 10 алкил. 2. Способ по п.1, где указанный растворитель является вторичным спиртом, а указанный гидроксид щелочного или щелочно-земельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия. 3. Способ по п.2, где указанный растворитель является бутан-2-олом, или изопропанолом, или смесью этих двух растворителей, а указанный гидроксид щелочного металла является гидроксидом натрия. 4. Способ получения соединения формулы 1 или фармацевтически приемлемых солей и сольватов указанного соединения,где R1 и R2, каждый независимо, выбраны из C1 С 10 алкила и C1-С 10 алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-С 6 алкокси;R15 представляет собой Н или C1-С 10 алкил; который включает обработку соединения формулы 2 где R15, R1 и R2 определены как указано выше, aG является блокирующей группой -SiR3R4R5;R3, R4 и R5, каждый независимо, представляют собой C1-С 6 алкил; тетра-(C1-С 6 алкил)аммонийфторидным соединением в апротонном растворителе. 5. Способ по п.4, где указанное тетра-(C1 С 6 алкил)аммонийфторидное соединение является фторидом тетра-(н-бутил)аммония, а указанный апротонный растворитель выбирают из тетрагидрофурана, диэтилового эфира, диметоксиэтана, толуола, дихлорметана, хлороформа и смеси двух или более из вышеназванных растворителей. 6. Способ по любому из предшествующих пунктов, где как R1, так и R2 являются 2 метоксиэтокси, а R15 является Н. 7. Способ получения промежуточного соединения, предназначенного для использования в способах по пп.1 и 4, имеющего формулу 2 где R1 и R2, каждый независимо, выбраны из C1 С 10 алкила и C1-С 10 алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-С 6 алкокси;R3, R4 и R5, каждый независимо, представляют собой C1-С 6 алкил; включающий обработку соединения формулы 3 8. Способ по п.7, где соединение формулы 3 обрабатывают соединением формулы 4 в органическом растворителе, выбранном из диметилформамида, диметилсульфоксида, тетрагидрофурана, ацетонитрила и смеси двух или более из вышеназванных растворителей. 9. Способ по п.8, где указанный растворитель является ацетонитрилом, как R1, так и R2 являются 2-метоксиэтокси, а R15 является Н. 10. Способ получения соединения формулы 6 или 7 или их фармацевтически приемлемых солей и сольватов,где R6 является C1-С 10 алкилом или -(СН 2)mO(CH2)n СН 3;R7 представляет собой C1-С 10 алкил,где вышеуказанные группы R7 необязательно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогена,нитро, трифторметила, трифторметокси, (C1-С 6 алкил)сульфонила, C1-С 6 алкила, C1-С 6 алкокси,C6-С 10 арилокси и C6-С 10 арилсульфонила; каждый m независимо является целым числом от 1 до 6, a n является целым числом от 0 до 3; который включает обработку соединения формулы 8 где R6 и R15 определены как указано выше,G1 представляет собой -С(OH)R3R4 иR3 и R4, каждый независимо, представляют собой C1-С 6 алкил; первичным или вторичным спиртом формулы R7-OH, где R7 является C1-С 10 алкилом, и вышеназванные группы R7 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, нитро, трифторметила, трифторметокси, (C1-С 6 алкил) сульфонила, C1 С 6 алкила, C1-С 6 алкокси, C6-С 10 арилокси и C6 С 10 арилсульфонила; в присутствии гидроксида щелочного металла или щелочно-земельного металла. 11. Способ по п.10, где указанный гидроксид щелочного металла или щелочноземельного металла выбирается из гидроксида натрия, гидроксида лития, гидроксида цезия,гидроксида кальция, гидроксида магния и гидроксида калия. 12. Способ по п.11, где указанный гидроксид щелочного или щелочно-земельного металла является гидроксидом натрия, R6 является 2-метоксиэтилом, R15 является Н и указанный спирт формулы R7-OH является вторичным спиртом. 13. Способ по п.1, где R1 и R2 оба являются 2-метоксиэтокси, R15 является Н, указанный растворитель является первичным спиртом, а 18 указанный гидроксид щелочного или щелочноземельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия,гидроксида кальция, гидроксида магния и гидроксида калия. 14. Способ по п.13, где указанный растворитель является бутан-1-олом, или изопропанолом, или смесью этих двух растворителей, а указанный гидроксид щелочного металла является гидроксидом натрия. 15. Способ по п.10, где R6 и R7 оба являются 2-метоксиэтилом, R15 является Н, а указанный гидроксид щелочного или щелочноземельного металла выбирают из гидроксида натрия, гидроксида лития, гидроксида цезия,гидроксида кальция, гидроксида магния и гидроксида калия. 16. Соединение формулы 2 где R1 и R2, каждый независимо, выбраны из C1 С 10 алкила и C1-С 10 алкокси, причем указанные алкил и алкокси необязательно имеют до 2 заместителей, независимо выбранных из гидрокси и C1-С 6 алкокси;
МПК / Метки
МПК: C07D 239/94
Метки: противораковых, соединений, промежуточные, способы, получения, соединения
Код ссылки
<a href="https://eas.patents.su/10-4654-sposoby-polucheniya-i-promezhutochnye-soedineniya-dlya-polucheniya-protivorakovyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения и промежуточные соединения для получения противораковых соединений</a>
Предыдущий патент: Фотоотверждаемые силоксановые сополимеры для изготовления внутриглазных линз
Следующий патент: Пуриновые производные
Случайный патент: Безопочная формовочная машина














