Кристаллическая форма кальций (3s)тетрагидро-3-фуранил(1s,2r)-3-[[(4-аминофенил)сульфонил](изобу- тил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамата
Номер патента: 3191
Опубликовано: 27.02.2003
Авторы: Армитидж Айан Гордон, Сингх Хардев, Серл Эндрю Дейвид
Формула / Реферат
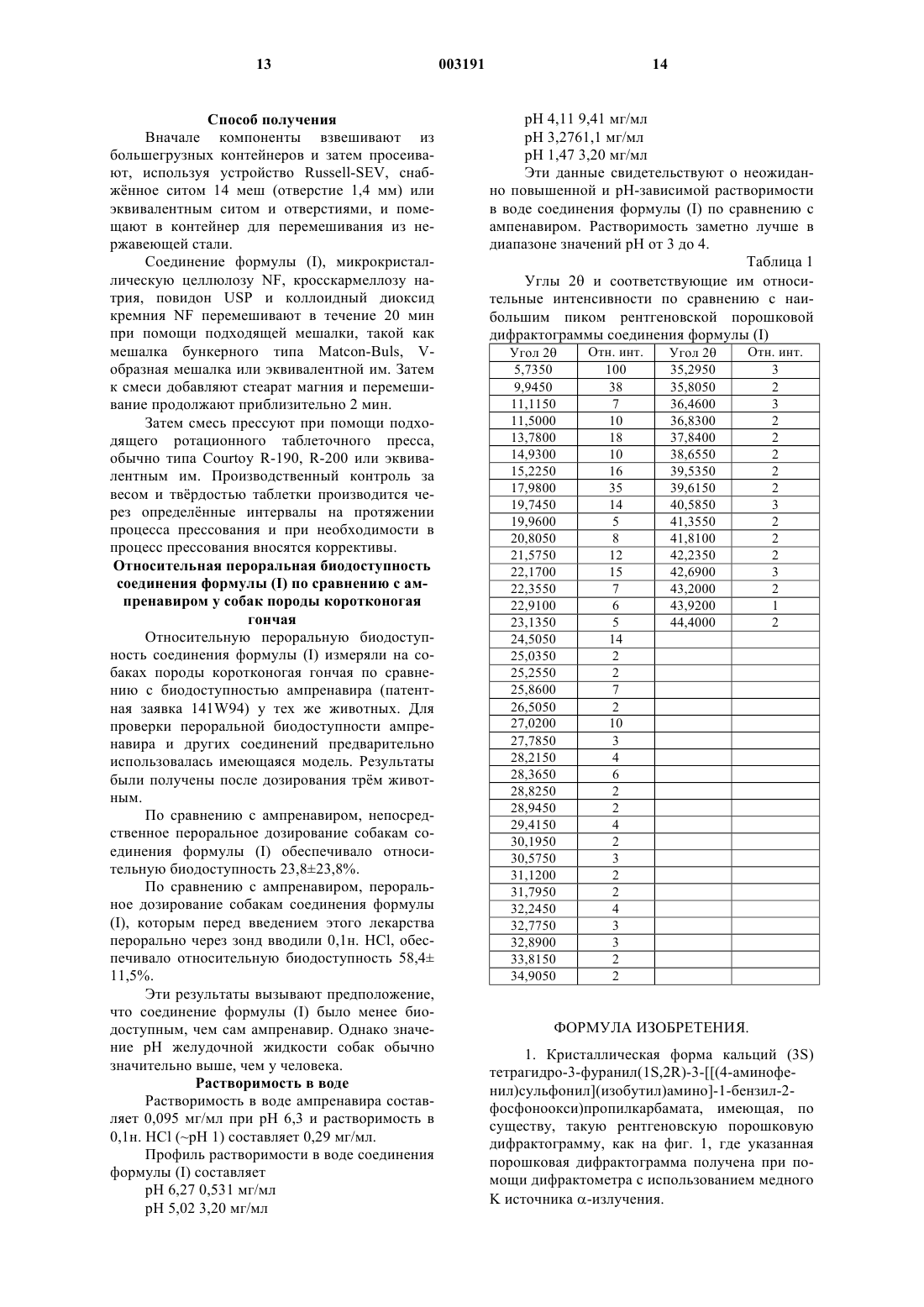
1. Кристаллическая форма кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-[[(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2-фосфоноокси)пропилкарбамата, имеющая, по существу, такую рентгеновскую порошковую дифрактограмму, как на фиг. 1, где указанная порошковая дифрактограмма получена при помощи дифрактометра с использованием медного K источника a-излучения.
2. Кристаллическая форма кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-[[(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2-фосфоноокси)пропилкарбамата, характеризующаяся рентгеновской порошковой дифрактограммой, выраженной величинами углов 2q и полученной при помощи дифрактометра с использованием медного K источника a-излучения, где указанная порошковая дифрактограмма имеет пики, которые могут иметь место при следующих приблизительных значениях углов 2q: 5,735, 9,945, 11,500, 13,780, 14,930, 15,225, 17,980, 19,745, 21,575, 22,170, 24,505 и 27,020 градусов.
3. Кристаллическая форма кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-[[(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2-фосфоноокси)пропилкарбамата, характеризующаяся рентгеновской порошковой дифрактограммой, выраженной величинами углов 2q и относительных интенсивностей (отн. инт.) и полученной при помощи дифрактометра с использованием медного K источника a-излучения:
| Угол 2q | Отн. инт. |
| 5,7350 | 100 |
| 9,9450 | 38 |
| 11,1150 | 7 |
| 11,5000 | 10 |
| 13,7800 | 18 |
| 14,9300 | 10 |
| 15,2250 | 16 |
| 17,9800 | 35 |
| 19,7450 | 14 |
| 19,9600 | 5 |
| 20,8050 | 8 |
| 21,5750 | 12 |
| 22,1700 | 15 |
| 22,3550 | 7 |
| 22,9100 | 6 |
| 23,1350 | 5 |
| 24,5050 | 14 |
| 25,0350 | 2 |
| 25,2550 | 2 |
| 25,8600 | 7 |
| 26,5050 | 2 |
| 27,0200 | 10 |
| 27,7850 | 3 |
| 28,2150 | 4 |
| 28,3650 | 6 |
| 28,8250 | 2 |
| 28,9450 | 2 |
| 29,4150 | 4 |
| 30,1950 | 2 |
| 30,5750 | 3 |
| 31,1200 | 2 |
| 31,7950 | 2 |
| 32,2450 | 4 |
| 32,7750 | 3 |
| 32,8900 | 3 |
| 33,8150 | 2 |
| 34,9050 | 2 |
| 35,2950 | 3 |
| 35,8050 | 2 |
| 36,4600 | 3 |
| 36,8300 | 2 |
| 37,8400 | 2 |
| 38,6550 | 2 |
| 39,5350 | 2 |
| 39,6150 | 2 |
| 40,5850 | 3 |
| 41,3550 | 2 |
| 41,8100 | 2 |
| 42,2350 | 2 |
| 42,6900 | 3 |
| 43,2000 | 2 |
| 43,9200 | 1 |
| 44,4000 | 2 |
4. Фармацевтическая композиция, включающая кристаллическое соединение по любому из пп.1-3 вместе, по меньшей мере, с одним фармацевтически приемлемым разбавителем или носителем.
5. Способ получения соединения формулы (I)
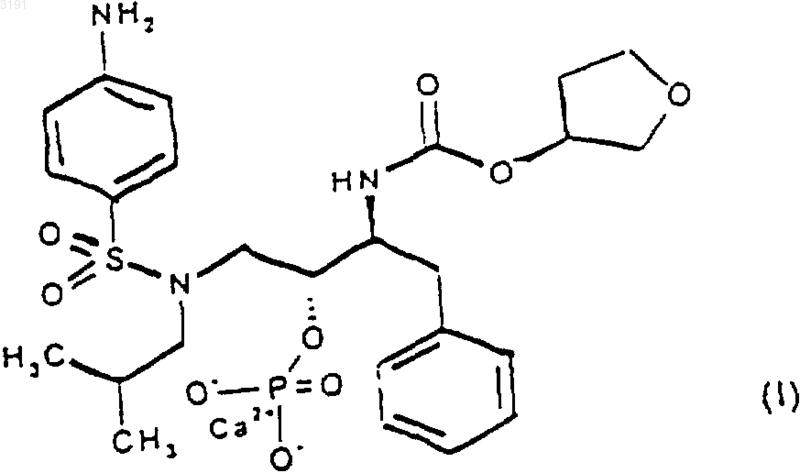
при котором I) осуществляют взаимодействие соединения формулы (II)
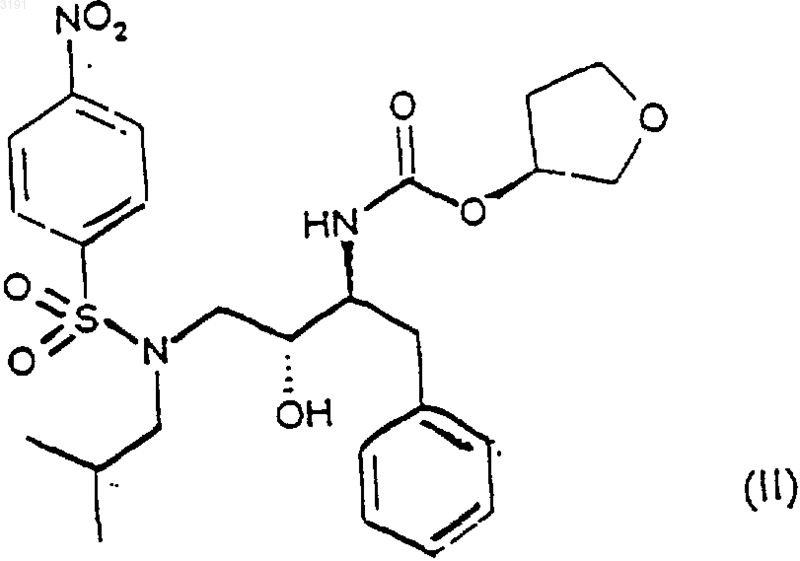
с фосфорилирующим агентом,
II) восстанавливают полученное соединение восстановителем в подходящем растворителе и
III) добавляют к полученному соединению источник ионов кальция в присутствии подходящего растворителя.
6. Способ получения соединения формулы (I)
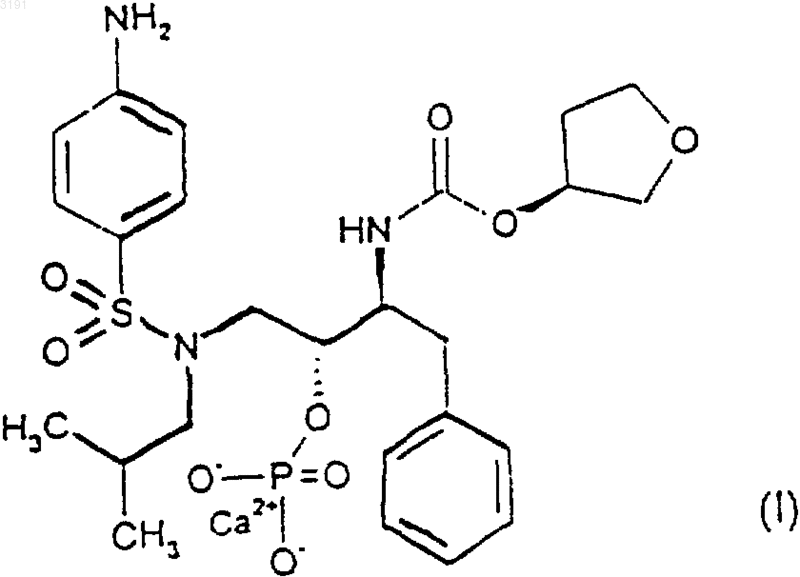
при котором растворяют соединение формулы (III)

в подходящем растворителе и добавляют к этому раствору воду и источник ионов кальция.
7. Способ получения соединения формулы (I)
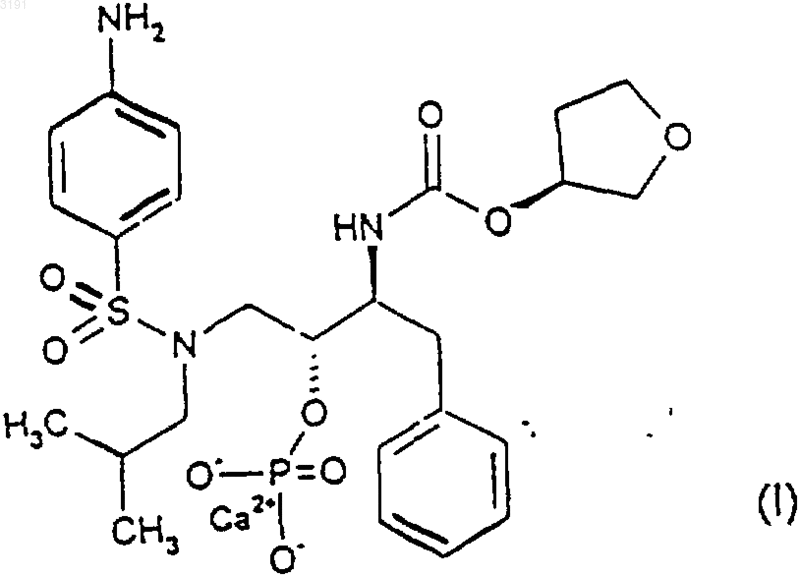
при котором восстанавливают соединение формулы (IV)
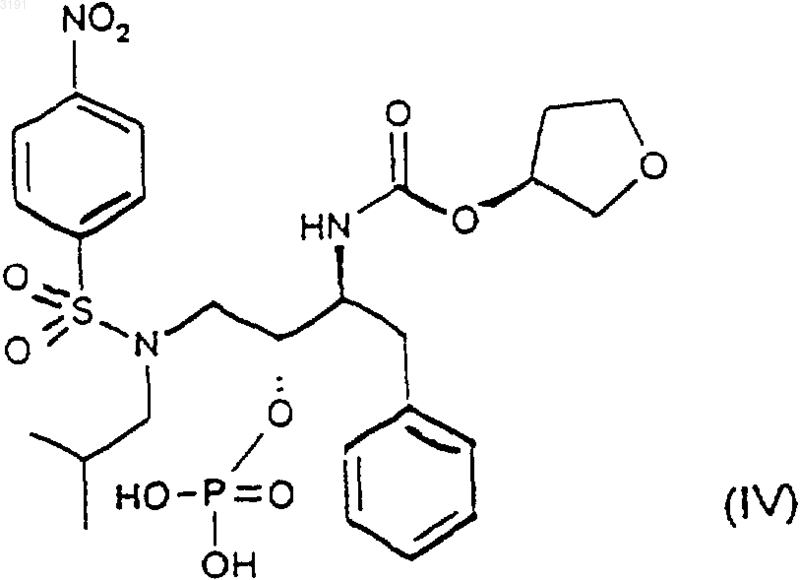
в присутствии подходящего восстановителя в подходящхь растворителе с последующим добавлением воды и источника ионов кальция.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к кристаллической форме антивирусного соединения кальций (3S) тетрагидро-3-фуранил(1S,2R)-3(4-аминофенил)сульфонил](изобутил)амино]1-бензил-2-(фосфоноокси)пропилкарбамата, к фармацевтическим композициям, содержащим ее, к ее применению для лечения ретровирусных инфекций и к способам ее получения. Вирускодированные протеазы, которые имеют значение для вирусной репликации, необходимы для процессинга предшественников вирусных белков. Подавление процессинга предшественников вирусных белков ингибирует образование инфекционных вирионов. Соответственно ингибиторы вирусной протеазы могут применяться для предотвращения или лечения хронических и острых вирусных инфекций. Новое антивирусное соединение (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил) сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамат, описанное в публикации международной заявки PCT/US 98/04595,обладает ингибирующей активностью в отношении аспартил протеазы ВИЧ и наиболее пригодно для ингибирования вирусов ВИЧ-1 и ВИЧ-2. Кроме того, по сравнению с ингибитором протеазы ВИЧ [3S-[3R(1R,2S)-[3-(4 аминофенил)сульфонил](2-метилпропил)амино]-2-гидрокси-1-фенилметил)пропил]тетрагидро-3-фураниловым эфиром(ампренавир,141W94), (3S) тетрагидро-3-фуранил (1S,2R)-3(4-аминофенил)сульфонил](изобутил)амино]1-бензил-2-(фосфоноокси)пропилкарбамат обладает повышенной растворимостью в диапазоне значений рН среды желудочно-кишечного тракта. Ампренавир, который обладает низкой растворимостью, таким образом доступен в виде раствора в гелевых капсулах и оказывает значительную лекарственную нагрузку. Обладая повышенной растворимостью, этот новый ингибитор ВИЧ протеазы, таким образом, способен снижать ощущаемую лекарственную нагрузку формы и может быть приготовлен в виде таблетки. Однако попытки обнаружить стабильную кристаллическую форму (3S) тетрагидро-3 фуранил(1S,2R)-3-(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси) пропилкарбамата, подходящую для приготовления препарата, вызвали затруднения. Был получен ряд солей фосфорной кислоты (например,динатриевая, дикалиевая, магниевая, цинковая,этилендиаминовая, пиперазиновая). Среди этих соединений пиперазиновая соль представляла собой кристаллическое тврдое вещество, но имела практический недостаток, связанный с вероятной токсичностью предполагаемой дозы. Неожиданно было установлено, что кальциевая соль, кальций (3S) тетрагидро-3-фуранил 2 карбамат, имеет стабильную кристаллическую форму. Дальнейшее подробное изучение показало, что эта соль обладает полезными свойствами, которые позволяют е использовать для включения в препарат в форме таблетки. Таким образом, данное соединение по настоящему изобретению обеспечивает возможность уменьшения нагрузки лекарственной формы,вызываемую некоторыми ингибиторами ВИЧ протеазы. Структура кальций (3S) тетрагидро-3 фуранил(1S,2R)-3-(4-аминофенил)сульфонил] Было установлено, что соединение формулы (I) может быть получено в кристаллической форме, проявляя особенно хорошие фармацевтические свойства. Подробное описание изобретения В соответствии с первым аспектом настоящего изобретения предлагается соединение формулы (I) в кристаллической форме, именуемое в настоящем документе форма (I). Настоящее изобретение относится к форме(I) соединения формулы (I) в кристаллической форме. Обычно форма (I) содержит приблизительно от 4 до 5 молей воды. Однако в любой порции, содержащей форму (I) соединения формулы (I), также могут быть иные сольватированные кристаллические формы соединения формулы (I). Как показано на чертеже, тврдая форма (I) соединения формулы (I) может быть охарактеризована рентгеновской порошковой дифрактограммой. Дифракционные кривые получали при помощи дифрактометра Philiips PW1800 (серияDY701) и Сu К источника -излучения. Интенсивности рентгеновских лучей измеряли с приращением 0,02 с 4-секундными интервалами,используя сцинтилляционный счтчик, в диапазоне углов 2 от 2 до 45. Характеристика интенсивности дифракционных пиков формы (I) может иметь место при следующих приблизительных значениях углов 2 (при использовании медного К источника -излучения): 5,735, 9,945,11,500, 13,780, 14,930, 15,225, 17,980, 19,745,21,575, 22,170, 24,505 и 27,020. Дополнительные сведения представлены в табл. 1. Специалистам в данной области техники понятно, что соединение формулы (I) может находиться в форме сольвата, например гидрата. В соответствии с дальнейшим аспектом, в настоящем изобретении предлагается способ получения соединения формулы (I) в кристаллической форме, при котором осуществляют взаимодействие соединения формулы (II) с фосфорилирующим агентом, например с оксихлоридом фосфора, пентахлоридом фосфора или дибензилхлорфосфатом, в присутствии основания, например пиридина, триэтиламина или диизопропилэтиламина, и возможно в присутствии растворителя, например метилизобутилкетона или дихлорметана, с последующим восстановлением, обычно натриевой соли, полученной в водном растворе при добавлении бикарбоната натрия, карбоната натрия или гидроксида натрия, при помощи восстановителя, например муравьиной кислоты или водорода с катализатором палладий/ или платина/углерод, в присутствии подходящего растворителя, например воды, этилацетата, изопропанола, ацетона, метанола, промышленного денатурата или в смеси двух или более чем двух вышеупомянутых растворителей; с последующим добавлением воды и источника ионов кальция, например ацетата кальция, хлорида кальция или гидроксида кальция, возможно в присутствии дополнительного растворителя, выбранного из вышеприведнного списка. В дальнейшем аспекте в настоящем изобретении также предлагается способ получения соединения формулы (I), при котором растворяют соединение формулы (III) в подходящем растворителе, например изопропаноле. метаноле или промышленном денатурате, и добавляют к раствору воду и источник ионов кальция, например ацетат кальция, хлорид кальция или гидроксид кальция. В дальнейшем аспекте в настоящем изобретении также предлагается способ получения соединения формулы (I), при котором восстанавливают соединение формулы (IV), обычно натриевой соли, полученной в водном растворе при добавлении бикарбоната натрия, карбоната натрия или гидроксида натрия в присутствии подходящего восстановителя,например муравьиной кислоты или водорода с катализатором палладий/ или платина/углерод, в присутствии подходящего растворителя, например воды, этилацетата, изопропанола, ацетона,метанола, промышленного денатурата или в смеси двух или более чем двух вышеупомянутых растворителей; с последующим добавлением воды и источника ионов кальция, например,ацетата кальция, хлорида кальция или гидроксида кальция, возможно в присутствии дополнительного растворителя, выбранного из вышеприведнного списка. Специалистам в данной области техники понятно, что после каждой стадии может производиться выделение и очистка по стандартным методикам, таким как те, что подробно описаны в примерах настоящего документа. Полученное таким образом соединение формулы (I) возможно может быть далее очищено перекристаллизацией из соответствующего растворителя, например из промышленного денатурата, ацетона, метанола или изопропанола и их смесей с водой, предпочтительно из смеси промышленного денатурата и воды. Дальнейшая возможная стадия очистки может осуществляться путем нагревания взвеси продукта в воде до температуры в диапазоне от 70 до 99 С, предпочтительно от 85 до 97 С,наиболее предпочтительно от 90 до 95 С, в течение периода времени приблизительно от 2,5 до 6 ч, предпочтительно в течение от 3 до 5 ч,наиболее предпочтительно в течение 4 ч, с последующим охлаждением до температуры окружающей среды и получением тврдого вещества. Соединение формулы (II) может быть получено любым способом, известным в данной области техники, но предпочтительно способами, описанными в патентной заявке WO 94/05639, включенной сюда посредством ссылки. Соединение формулы (III) может быть получено при взаимодействии соединения формулы (II) с фосфорилирующим агентом, например оксихлоридом фосфора, пентахлоридом фосфора или дибензилхлорфосфатом, в присутствии основания, например пиридина, триэтиламина или диизопропилэтиламина, и возможно в присутствии растворителя, например метилизобутилкетона или дихлорметана, с последующим восстановлением, обычно натриевой соли, по 5 лученной в водном растворе при добавлении бикарбоната натрия, карбоната натрия или гидроксида натрия, при помощи восстановителя,например муравьиной кислоты или водорода с катализатором палладий/ или платина/углерод, в присутствии подходящего растворителя, например воды, этилацетата, изопропанола, метанола,ацетона, промышленного денатурата или смеси двух или более чем двух вышеприведнных растворителей. Соединение формулы (IV) может быть получено при взаимодействии соединения формулы (II) с фосфорилирующим агентом, например,оксихлоридом фосфора или пентахлоридом фосфора, в присутствии основания, например пиридина, триэтиламина или диизопропилэтиламина, и возможно в присутствии растворителя, например метилизобутилкетона или дихлорметана. Предпочтительным фосфорилирующим агентом является оксихлорид фосфора. Предпочтительным основанием является пиридин. Предпочтительным растворителем является метилизобутилкетон. Предпочтительным восстановителем является водород с катализатором палладием на углероде, с дозировкой палладия 5-10%. Предпочтительным растворителем является смесь промышленного денатурата и воды. В настоящем изобретении также предлагается соединение формулы (I) для применения в лекарственной терапии, например, для лечения вирусных заболеваний у животных, например у человека. Это соединение особенно полезно для лечения заболеваний, вызываемых ретровирусами, такими как ВИЧ-инфекции, например синдром приобретенного иммунодефицита(СПИД, AIDS) и СПИД-ассоциированный комплекс (ARC), а также заболеваний, вызванных гепатитом В и гепатитом С. В дополнение к применению в лекарственной терапии человека, соединение формулы (I) может вводиться другим животным для лечения вирусных заболеваний, например другим млекопитающим. В настоящем изобретении также предлагается способ лечения вирусных инфекций, в частности ретровирусной инфекции, такой как ВИЧ-инфекция, у животного, например у млекопитающего, такого как человек, при котором этому животному вводят эффективное антивирусное количество соединения формулы (I). В настоящем изобретении также предлагается применение соединения формулы (I) для получения лекарства для лечения вирусной инфекции, в частности ретровирусной инфекции,такой как ВИЧ-инфекция. Соединение формулы (I), которое также упоминается в настоящем документе как активный ингредиент, может вводиться любым путм, соответствующим состоянию, которое нужно лечить, однако, предпочтительным путм 6 введения является пероральный. Понятно, однако, что предпочтительный путь введения может изменяться в зависимости от, например, состояния реципиента. Для каждого из приведнных выше применений и показаний требуемые количества активного ингредиента (как определено выше) будут зависеть от ряда факторов, включая серьзность состояния, которое нужно лечить, и особенности реципиента и, в конечном итоге,определяются решением лечащего врача или ветеринара. Однако в целом для каждого из этих применений и показаний подходящая эффективная доза будет находиться в диапазоне от 0,1 до 150 мг на килограмм веса тела реципиента в сутки, преимущественно в диапазоне от 0,5 до 70 мг на килограмм веса тела в сутки, предпочтительно в диапазоне от 0,5 до 50 мг на килограмм веса тела в сутки (если иное особо не оговорено, все веса активного ингредиента рассчитываются относительно свободного основания соединения формулы (I. Желаемую дозу предпочтительно представляют в виде одной,двух, трх, четырх или более субдоз, которые вводятся в течение суток с соответствующими интервалами. Эти субдозы могут вводиться в виде стандартных лекарственных форм, например, содержащих приблизительно от 25 до 2000 мг, предпочтительно приблизительно 50, 100,150, 200, 250, 300, 450, 500, 570, 750 или 1000 мг активного ингредиента на стандартную лекарственную форму. Если есть возможность вводить активный ингредиент самостоятельно, предпочтительно,чтобы он был представлен в виде фармацевтического препарата. Этот препарат включает в себя определенный выше активный ингредиент вместе с одним или более чем одним фармацевтически приемлемым эксципиентом и возможно другие терапевтические ингредиенты. Эксципиент(ы) должны быть "приемлемы" в смысле совместимости с другими ингредиентами состава и не причинять вред их реципиенту. Препараты включают в себя такие, которые подходят для перорального введения и без затруднений могут быть представлены в виде стандартной лекарственной формы, приготовленной любым из способов, которые хорошо известны в области фармации. Такие способы включают в себя стадию объединения активного ингредиента с носителем, который объединяет один или более чем один вспомогательные ингредиенты. В целом, препараты готовят равномерным и полным объединением активного ингредиента с жидкими носителями или с тонкоизмельчнными тврдыми веществами или с обоими и затем, при необходимости, приданием продукту определнной формы. Препараты по настоящему изобретению,подходящие для перорального введения, могут быть представлены в виде дискретных единиц,таких как капсулы, крахмальные облатки, саше 7 гранул или таблетки (такие как таблетки для глотания, диспергируемые или жевательные таблетки), каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или в неводной жидкости, или в виде жидкой эмульсии типа масло-в-воде или в виде эмульсии типа водав-масле. Активный ингредиент может также быть представлен в виде болюса, лекарственной кашицы или пасты. Таблетка может быть изготовлена прессованием или формованием возможно с одним или более чем с одним вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящей машине активного ингредиента в сыпучей форме, такой как порошок или гранулы, возможно смешанной со связывающим, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного соединения,увлажннного инертным жидким разбавителем. Такие таблетки могут иметь покрытие или быть шероховатыми, и могут быть составлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение заключнного активного ингредиента. Активный ингредиент может быть также представлен в виде препарата, содержащего частицы активного ингредиента, размер которых измеряется микрометрами или нанометрами, причем этот препарат может содержать другие фармацевтические агенты и возможно может быть преобразован в твердую форму. Предпочтительными стандартными лекарственными формами являются те, которые содержат суточную дозу или унифицированную суточную субдозу активного ингредиента (которая в настоящем документе приведена выше) или их соответствующую фракцию. Следует иметь в виду, что в дополнение к особо упомянутым выше ингредиентам препарат по настоящему изобретению может включать в себя другие, обычные на практике агенты в зависимости от типа данного препарата, например, препараты, которые подходят для перорального введения, могут включать в себя корригенты или агенты, маскирующие вкус. Следует далее иметь в виду, что соединение формулы (I) может быть объединено с одним или более чем с одним другим ВИЧантивирусным агентом, например с ингибиторами обратной транскриптазы (RTI), ингибиторами ненуклеозидной обратной транскриптазы(NNRTI) и другими ингибиторами ВИЧ протеаз. Примеры подходящих RTI включают в себя азидотимидин, диданозин (ddl), зальцитабин(L-743,726 или DMP-266) и хиноксалины, такие как изопропил (2S)-7-фтор-3,4-дигидро-2-этил-3-оксо 1-(2 Н)-хиноксалинкарбоксилат (HBY 1293) илиHBY 097. Примеры подходящих ингибиторов ВИЧ протеаз включают в себя те, которые описаны в патентных заявках WO 94/05639, WO 95/24385,WO 94/13629, WO 92/16501, WO 95/16688,WO/US 94/13085, WO/US 94/12562, US 93/59038, ЕР 541168, WO 94/14436, WO 95/09843, WO 95/32185, WO 94/15906, WO 94/15608, WO 94/04492, WO 92/08701, WO 95/32185 и в патенте США 5,256,783, в частности (S)-N-S)-1R)-2-3S,4S,8S)-3-(третбутилкарбамоил)октагидро-2-(1 Н)-изохинолил)1-гидроксиэтил)фенэтил)-2-хиналдаминосукцинамида монометансульфонат (сахинавир),N-(2(R)-гидрокси-1(S)инданил)-2(R)-(фенилметил)-4(S)-гидрокси-5-[1-[4-(3-пиридилметил)2(S)-(N-трет-бутилкарбамоил)пиперазинил пентанамид (индинавир), 10-гидрокси-2-метил 5-(1-метилэтил)-1-[2-(1-метилэтил)-4-тиазолил]3,6-диоксо-8,11-bis(фенилметил)-2,4,7,12-тетраазатридекан-13-овая кислота,5-тиазолилметиловый эфирRTI, NNRTI и/или ингибиторами ВИЧ-протеаз особенно полезно при лечении СПИДа и связанных с ним клинических состояний, таких как СПИД-ассоциированный комплекс (ARC), прогрессирующая генерализованная лимфоденопатия (PGL), саркома Капоши, тромбоцитопеническая пурпура, СПИД-зависимые неврологические состояния, такие как комплекс СПИДзависимого слабоумия, рассеянный склероз или тропический парапарез, и также анти-ВИЧ антитело-положительные и ВИЧ-положительные состояния, включая такие состояния у пациентов, не обнаруживающих симптомов заболевания. Следующие примеры предназначены только для пояснения и ни в коей мере не ограничивают пределы изобретения. Пример 1. Получение кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил)(3S) тетрагидро-3-фуранил(1S,2R)-3-(4 аминофенил)сульфонил](изобутил)амино]-1 бензил-2-(фосфоноокси)пропилкарбамат (10 г) растворяли в промышленном денатурате (60 мл) и нагревали до 50 С. Затем медленно добавляли раствор ацетата кальция (2,43 г) в воде (60 мл),что приводило к образованию белого кристаллического осадка. Смесь оставляли медленно охлаждаться до 20 С. Тврдое вещество отфильтровывали, промывали смесью промышленный денатурат/вода(1:1,225 мл) и водой (25 мл), затем сушили в вакууме при 20 С с получением указанного в заголовке соединения в виде белых микрокристаллических игл (7,52 г). ЯМР (растворитель 0,1 н. DCl в D2O) 0,80,9 млн-1 (m, 6H), 1,2-1,3 млн-1 (m, 0,5 Н), 1,852,2 млн-1 (m, 2,5H), 2,6-2,75 млн-1 (m, 1H, J=13,0 Гц), 2,9-3,2 млн-1 (m, 3 Н), 3,34 (m, 1H), 3,42 млн-1 (d, 1H, J=10,8 Гц), 3,55-3,9 млн-1 (m, 4 Н),4,2-4,3 млн-1 (m, 1H, J=10,3 Гц), 4,55 млн-1 (m,1H), 4,8-5,0 млн-1 (m, 1H маскируется сигналомHOD), 7,3-7,4 млн-1 (m, 5 Н), 7,6-7,7 млн-1 (m, 2 Н,J=8,3 Гц), 8,0-8,1 млн-1 (d, 2H, J=8,8 Гц) Содержание этанола по ЯМР 2,7% мас./мас. Температура плавления 282-284 С (с разл.) Пример 2. Получение кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил) сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамат (I) из (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-нитрофенил)сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамата (IV). Раствор(68 мл) и воде (17 мл) обрабатывали катализатором 10% палладием на углероде (3,4 г). Эту смесь перемешивали в атомосфере водорода при температуре окружающей среды в течение 3 ч. Катализатор отфильтровывали, промывая промышленным денатуратом (34 мл). Фильтрат нагревали до 50 С и медленно добавляли раствор ацетата кальция (4,45 г) в воде (85 мл), что приводило к образованию белого кристаллического осадка. Смесь оставляли медленно охлаждаться до 20 С. Тврдое вещество отфильтровывали, промывали смесью промышленный денатурат/вода (1:2, 225 мл), затем сушили в вакууме при 20 С с получением указанного в заголовке соединения в виде белых микрокристаллических игл (14,04 г). ЯМР (растворитель 0,1 н. DCl в D2O) 0,650,75 млн-1 (m, 6H), 1,1-1,2 млн-1 (m, 0,5 Н), 1,7 003191HOD), 7,3-7,4 млн-1 (m, 5H), 7,6 млн-1 (m, 2H, J= 8,3 Гц), 7,9 млн-1 (d, 2H, J=8,3 Гц). Смещение сигналов в верхнюю часть поля обусловлено потерей синхронизации. Содержание этанола по ЯМР 3,4% мас./мас. Содержание воды по данным анализа по Карлу Фишеру составляет 11,1% мас./мас. Пример 3. Получение кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил) сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамата (I) из (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-нитрофенил)сульфонил](изобутил)амино]-1-бензил-2-(гидрокси) пропилкарбамата (II). К суспензии (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-нитрофенил)сульфонил](изобутил)амино]-1-бензил-2-(гидрокси)пропилкарбамата (300 г) в пиридине (450 мл) и метилизобутилкетоне (1500 мл) добавляли оксихлорид фосфора (69 мл). После перемешивания при 2530 С в течение 2,5 ч добавляли оксихлорид фосфора (7 мл). Спустя 1 ч полученную суспензию добавляли к 6 М соляной кислоте (500 мл). Затем смесь нагревали при 50-55 С в течение 2 ч и далее охлаждали. Фазы разделяли и водную фазу экстрагировали метилизобутилкетоном(600 мл). Объединнные органические растворы промывали водой (2600 мл). Раствор в метилизобутилкетоне концентрировали до приблизительно 600 мл в вакууме и затем добавляли воду (1500 мл) и бикарбонат натрия (94 г). После перемешивания в течение 20 мин фазы разделяли и водный раствор промывали этилацетатом (3200 мл). Водный раствор обрабатывали катализатором 10% палладием на углероде (30 г), оставляли в вакууме на 5 мин, обрабатывали промышленным денатуратом (1200 мл), затем перемешивали в атмосфере водорода при температуре ниже 30 С в течение 2,5 ч. Катализатор отфильтровывали, промывая промышленным денатуратом (600 мл). Фильтрат нагревали до 40-50 С и в течение 20 мин добавляли раствор моногидрата ацетата кальция (99,5 г) в воде (300 мл), затем полученную суспензию перемешивали при 4050 С в течение 30 мин, далее охлаждали до температуры окружающей среды в течение 30 мин. Продукт отфильтровывали и промывали смесью промышленный денатурат/вода (1:1, 2600 мл), затем сушили в вакууме при 35-40 С с получением указанного в заголовке соединения в виде белых микрокристаллических игл(d, 1 Н, J=10,8 Гц), 3,55-3,9 млн-1 (m, 4 Н), 4,2-4,3 млн-1 (m, 1 Н, J=10,3 Гц), 4,55 млн-1 (m, 1 Н), 4,85,0 млн-1 (m, 1H маскируется сигналом HOD),7,3-7,4 млн-1 (m, 5 Н), 7,6-7,7 млн-1 (m, 2 Н, J=8,3 Гц), 8,0-8,1 млн-1 (d, 2H, J=8,8 Гц). Содержание этанола по ЯМР 1,7% мас./мас. Пример 4. Перекристаллизация кальций(1S,2R)-3-(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамат (5 г, полученный аналогично тому, как было описано в любом из примеров 1, 2 или 3) суспендировали в промышленном денатурате(75 мл) и нагревали до 70 С. Смесь осветляли,пропуская через слой вспомогательного фильтрующего материала, промывая промышленным денатуратом (25 мл). Фильтрат вновь нагревали до 70 С, затем добавляли воду (15 мл). Полученную суспензию медленно охлаждали до 20 С, затем продукт отфильтровывали, промывали смесью промышленный денатурат/вода(1:1, 210 мл), далее сушили в вакууме при 20 С с получением указанного в заголовке соединения в виде белых микрокристаллических игл (4,58 г). ЯМР (растворитель 0,1 н. DCl в D2O) 0,80,9 млн-1 (m, 6H), 1,2-1,3 млн-1 (m, 0.5 Н), 1.852.2 млн-1 (m, 2.5H), 2.6-2,75 млн-1 (m, 1H, J=13.0 Гц), 2,9-3,2 млн-1 (m, 3 Н), 3,34 (m, 1H), 3,42 млн-1 (d, 1H, J=10,8 Гц), 3,55-3,9 млн-1 (m, 4H),4,2-4,3 млн-1 (m, 1H, J=10.3 Гц), 4,51 млн-1 (m,1H), 4,8-5,0 млн-1 (m, 1 Н маскируется сигналомHOD), 7,3-7.4 млн-1 (m, 5 Н), 7,6-7,7 млн-1 (m, 2 Н,J=8,3 Гц), 8.0-8,1 млн-1 (d, 2 Н, J=8.8 Гц). Содержание этанола по ЯМР 3,1% мас./мас. Температура плавления 282-284 С (с разл.) Пример 5. Получение кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил) сульфонил](изобутил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамата (I) из (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-нитрофенил)сульфонил](изобутил)амино]-1-бензил-2-(гидрокси) пропилкарбамата (II). К суспензии (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-нитрофенил)сульфонил](изобутил)амино]-1-бензил-2-(гидрокси)пропилкарбамата (37 кг) в пиридине (48,5 кг) и метилизобутилкетоне (170 л) добавляли оксихлорид фосфора (24,1 кг). После перемешивания при 25-30 С в течение 2,5 ч полученную суспензию добавляли к 2 н. соляной кислоте (120 л). Эту смесь затем нагревали при 65-70 С в течение 3 ч и далее охлаждали. Фазы разделяли и водную фазу экстрагировали метилизобутилкетоном (70 12 л). Объединнные органические растворы промывали водой (270 л). Раствор в метилизобутилкетоне концентрировали до приблизительно 70 л в вакууме и затем добавляли воду (150 л) и 32% гидроксид натрия (14,3 кг). После перемешивания в течение 15 мин, фазы разделяли и водный раствор промывали метилизобутилкетоном (334 л). Водный раствор обрабатывали катализатором 5% палладием на углероде (1,7 кг), обрабатывали промышленным денатуратом (136 л), затем перемешивали в атмосфере водорода при температуре ниже 30 С в течение 8 ч. Катализатор отфильтровывали, промывая промышленным денатуратом (170 л). Фильтрат нагревали до 40-50 С и в течение 2 ч добавляли раствор гидрата ацетата кальция (9,5 кг) в воде (136 л), затем полученную суспензию перемешивали при 40-50 С в течение 30 мин, далее охлаждали до температуры окружающей среды в течение 2 ч. Продукт отфильтровывали и промывали смесью промышленный денатурат/вода (1:1, 268 л), затем водой (268 л). Затем продукт перемешивали и нагревали с водой (340 л) в течение 4 ч при 90-95 С, далее охлаждали до 20-25 С. Тврдое вещество отфильтровывали и промывали промышленным денатуратом (334 л), затем сушили в вакууме при 35-40 С с получением указанного в заголовке соединения в виде белых микрокристаллических игл (25,8 кг). ЯМР (растворитель 0,1 н. DCl в D2O) 0,80,9 млн-1 (m, 6H), 1,2-1,3 млн-1 (m, 0,5 Н), 1,852,2 млн-1 (m, 2,5 Н), 2,6-2,7 млн-1 (m, 1H, J=13,0 Гц), 2,9-3,2 млн-1 (m, 3 Н), 3,3-3,4 млн-1 (m, 1H),3,42 млн-1 (d, 1H, J=10,8 Гц), 3,55-3,9 млн-1 (m,4H), 4,2-4,3 млн-1 (m, 1H, J=10,3 Гц), 4,5 млн-1(m, 2H, J=8,3 Гц), 8,0-8,1 млн-1 (d, 2H, J=8,8 Гц). Содержание этанола по ЯМР 1,0% мас./мас. Содержание воды по данным анализа по Карлу Фишеру составляет 10,9% мас./мас. Пример 6. Препарат в форме таблетки Ингредиент Фактически мг/таблетку Соединение формулы (I) 576,1 Микрокристаллическая целлюлоза, NF 102,2 Кроскармеллоза натрия 38,0 Повидон, USP 34,2 Коллоидный диоксид кремния, NF 1,9 Стеарат магния, NF 7,6 Итого 760 вес кальциевой соли, эквивалентный 465 мг свободной кислоты, рассчитанный с коэффициентом 1,239 13 Способ получения Вначале компоненты взвешивают из большегрузных контейнеров и затем просеивают, используя устройство Russell-SEV, снабжнное ситом 14 меш (отверстие 1,4 мм) или эквивалентным ситом и отверстиями, и помещают в контейнер для перемешивания из нержавеющей стали. Соединение формулы (I), микрокристаллическую целлюлозу NF, кросскармеллозу натрия, повидон USP и коллоидный диоксид кремния NF перемешивают в течение 20 мин при помощи подходящей мешалки, такой как мешалка бункерного типа Matcon-Buls, Vобразная мешалка или эквивалентной им. Затем к смеси добавляют стеарат магния и перемешивание продолжают приблизительно 2 мин. Затем смесь прессуют при помощи подходящего ротационного таблеточного пресса,обычно типа Courtoy R-190, R-200 или эквивалентным им. Производственный контроль за весом и тврдостью таблетки производится через определнные интервалы на протяжении процесса прессования и при необходимости в процесс прессования вносятся коррективы. Относительная пероральная биодоступность соединения формулы (I) по сравнению с ампренавиром у собак породы коротконогая гончая Относительную пероральную биодоступность соединения формулы (I) измеряли на собаках породы коротконогая гончая по сравнению с биодоступностью ампренавира (патентная заявка 141W94) у тех же животных. Для проверки пероральной биодоступности ампренавира и других соединений предварительно использовалась имеющаяся модель. Результаты были получены после дозирования трм животным. По сравнению с ампренавиром, непосредственное пероральное дозирование собакам соединения формулы (I) обеспечивало относительную биодоступность 23,823,8%. По сравнению с ампренавиром, пероральное дозирование собакам соединения формулы(I), которым перед введением этого лекарства перорально через зонд вводили 0,1 н. HCl, обеспечивало относительную биодоступность 58,4 11,5%. Эти результаты вызывают предположение,что соединение формулы (I) было менее биодоступным, чем сам ампренавир. Однако значение рН желудочной жидкости собак обычно значительно выше, чем у человека. Растворимость в воде Растворимость в воде ампренавира составляет 0,095 мг/мл при рН 6,3 и растворимость в 0,1 н. HCl (рН 1) составляет 0,29 мг/мл. Профиль растворимости в воде соединения формулы (I) составляет рН 6,27 0,531 мг/мл рН 5,02 3,20 мг/мл 14 рН 4,11 9,41 мг/мл рН 3,2761,1 мг/мл рН 1,47 3,20 мг/мл Эти данные свидетельствуют о неожиданно повышенной и рН-зависимой растворимости в воде соединения формулы (I) по сравнению с ампенавиром. Растворимость заметно лучше в диапазоне значений рН от 3 до 4. Таблица 1 Углы 2 и соответствующие им относительные интенсивности по сравнению с наибольшим пиком рентгеновской порошковой дифрактограммы соединения формулы (I) Угол 2 5,7350 9,9450 11,1150 11,5000 13,7800 14,9300 15,2250 17,9800 19,7450 19,9600 20,8050 21,5750 22,1700 22,3550 22,9100 23,1350 24,5050 25,0350 25,2550 25,8600 26,5050 27,0200 27,7850 28,2150 28,3650 28,8250 28,9450 29,4150 30,1950 30,5750 31,1200 31,7950 32,2450 32,7750 32,8900 33,8150 34,9050 ФОРМУЛА ИЗОБРЕТЕНИЯ. 1. Кристаллическая форма кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2 фосфоноокси)пропилкарбамата, имеющая, по существу, такую рентгеновскую порошковую дифрактограмму, как на фиг. 1, где указанная порошковая дифрактограмма получена при помощи дифрактометра с использованием медного 15 2. Кристаллическая форма кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2 фосфоноокси)пропилкарбамата, характеризующаяся рентгеновской порошковой дифрактограммой, выраженной величинами углов 2 и полученной при помощи дифрактометра с использованием медного K источника излучения, где указанная порошковая дифрактограмма имеет пики, которые могут иметь место при следующих приблизительных значениях углов 2: 5,735, 9,945, 11,500, 13,780, 14,930,15,225, 17,980, 19,745, 21,575, 22,170, 24,505 и 27,020 градусов. 3. Кристаллическая форма кальций (3S) тетрагидро-3-фуранил(1S,2R)-3-(4-аминофенил)сульфонил](изобутил)амино]-1-бензил-2 фосфоноокси)пропилкарбамата, характеризующаяся рентгеновской порошковой дифрактограммой, выраженной величинами углов 2 и относительных интенсивностей (отн. инт.) и полученной при помощи дифрактометра с использованием медного K источника излучения: Угол 2 Отн. инт. 5,7350 100 9,9450 38 11,1150 7 11,5000 10 13,7800 18 14,9300 10 15,2250 16 17,9800 35 19,7450 14 19,9600 5 20,8050 8 21,5750 12 22,1700 15 22,3550 7 22,9100 6 23,1350 5 24,5050 14 25,0350 2 25,2550 2 25,8600 7 26,5050 2 27,0200 10 27,7850 3 28,2150 4 28,3650 6 28,8250 2 28,9450 2 29,4150 4 30,1950 2 30,5750 3 31,1200 2 31,7950 2 32,2450 4 32,7750 3 32,8900 3 33,8150 2 16 34,9050 2 35,2950 3 35,8050 2 36,4600 3 36,8300 2 37,8400 2 38,6550 2 39,5350 2 39,6150 2 40,5850 3 41,3550 2 41,8100 2 42,2350 2 42,6900 3 43,2000 2 43,9200 1 44,4000 2 4. Фармацевтическая композиция, включающая кристаллическое соединение по любому из пп.1-3 вместе, по меньшей мере, с одним фармацевтически приемлемым разбавителем или носителем. 5. Способ получения соединения формулыI) осуществляют взаимодействие соединения формулы (II) с фосфорилирующим агентом,II) восстанавливают полученное соединение восстановителем в подходящем растворителе иIII) добавляют к полученному соединению источник ионов кальция в присутствии подходящего растворителя. 6. Способ получения соединения формулы при котором растворяют соединение формулы в подходящем растворителе и добавляют к этому раствору воду и источник ионов кальция. 7. Способ получения соединения формулы в присутствии подходящего восстановителя в подходящем растворителе с последующим добавлением воды и источника ионов кальция. при котором восстанавливают соединение формулы (IV)
МПК / Метки
МПК: A61K 31/665, C07F 9/655, A61P 31/18
Метки: тил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамата, 3s)тетрагидро-3-фуранил(1s,2r)-3-[[(4-аминофенил)сульфонил](изобу, форма, кристаллическая, кальций
Код ссылки
<a href="https://eas.patents.su/10-3191-kristallicheskaya-forma-kalcijj-3stetragidro-3-furanil1s2r-3-4-aminofenilsulfonilizobu-tilamino-1-benzil-2-fosfonooksipropilkarbamata.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая форма кальций (3s)тетрагидро-3-фуранил(1s,2r)-3-[[(4-аминофенил)сульфонил](изобу- тил)амино]-1-бензил-2-(фосфоноокси)пропилкарбамата</a>
Предыдущий патент: Азаполициклические соединения, конденсированные с арилом
Следующий патент: Способ получения аминокарбонильных производных генезеролина, обладающих селективной в отношении головного мозга антихолинэстеразной активностью
Случайный патент: Межосевой дифференциал проходной главной передачи транспортного средства