Рекомбинантная плазмидная днк pfk3, обеспечивающая синтез рекомбинантного пептида rl3, являющегося аналогом фрагмента каппа-казеина человека, рекомбинантный штамм бактерий escherichia coli xl1-blue/pfk3 и рекомбинантный пептид rl3 – аналог фрагмента каппа-казеина человека, обладающий апоптотической активностью по отношению к раковым клеткам
Номер патента: 23387
Опубликовано: 31.05.2016
Авторы: Коваль Ольга Александровна, Семенов Дмитрий Владимирович, Трошкова Галина Павловна, Рихтер Владимир Александрович, Савельева Анна Валентиновна, Потапенко Мирослава Олеговна, Фомин Александр Сергеевич, Кулигина Елена Владимировна
Формула / Реферат
1. Рекомбинантная плазмидная ДНК pFK3, обеспечивающая увеличенный выход рекомбинантного пептида RL3 с аминокислотной последовательностью SEQ ID NO: 2, который является аналогом фрагмента каппа-казеина человека и состоит из трех компонентов: N-концевой полигистидиновой последовательности MRGSHHHHHHGS, остатка метионина, введенного в конструкцию для возможности отщепления полигистидиновой последовательности, и фрагмента каппа-казеина человека с 31 по 102 а.о.; и который обладает увеличенной апоптотической активностью по отношению к раковым клеткам, причем указанная ДНК характеризуется молекулярной массой 2,41 MDa и размером 3647 п.о. и содержит в соответствии с физической и генетической картой, представленной на фиг. 2, следующие элементы:
1) фрагмент Bam HI/Hin dIII размером 258 п.о., имеющий нуклеотидную последовательность SEQ ID NO: 1, которая кодирует указанный пептид RL3 с аминокислотной последовательностью SEQ ID NO: 2;
2) фрагмент плазмидного вектора pQE30, обеспечивающий эффективную экспрессию фрагмента каппа-казеина человека и содержащий:
а) сайт инициации репликации плазмиды pBR322;
б) промотор бактериофага Т5;
в) генетический маркер AMPr - ген резистентности к ампициллину (ген β-лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli;
г) уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: Ava I (2), Eco RI (89), Ват HI (146), Hin dIII (374), Nco I (1047), Ара LI (1579), Ара LI (2077), Ара LI (3323).
2. Рекомбинантный штамм бактерии Escherichia coli XL1-Blue/pFK3, продуцирующий с увеличенным выходом рекомбинантный пептид RL3 с аминокислотной последовательностью SEQ ID NO: 2, причем штамм содержит рекомбинантную плазмидную ДНК pFK3 по п.1 и депонирован в КЭМТК ИХБФМ СО РАН под номером ЭМТК 1346.
3. Рекомбинантный пептид RL3 с аминокислотной последовательностью SEQ ID NO: 2, который является аналогом фрагмента каппа-казеина человека, имеет молекулярную массу около 10 кДа и состоит из трех компонентов: N-концевой полигистидиновой последовательности MRGSHHHHHHGS, остатка метионина, введенного в конструкцию для возможности отщепления полигистидиновой последовательности, и фрагмента каппа-казеина человека с 31 по 102 а.о., и который обладает увеличенной апоптотической активностью по отношению к раковым клеткам.
Текст
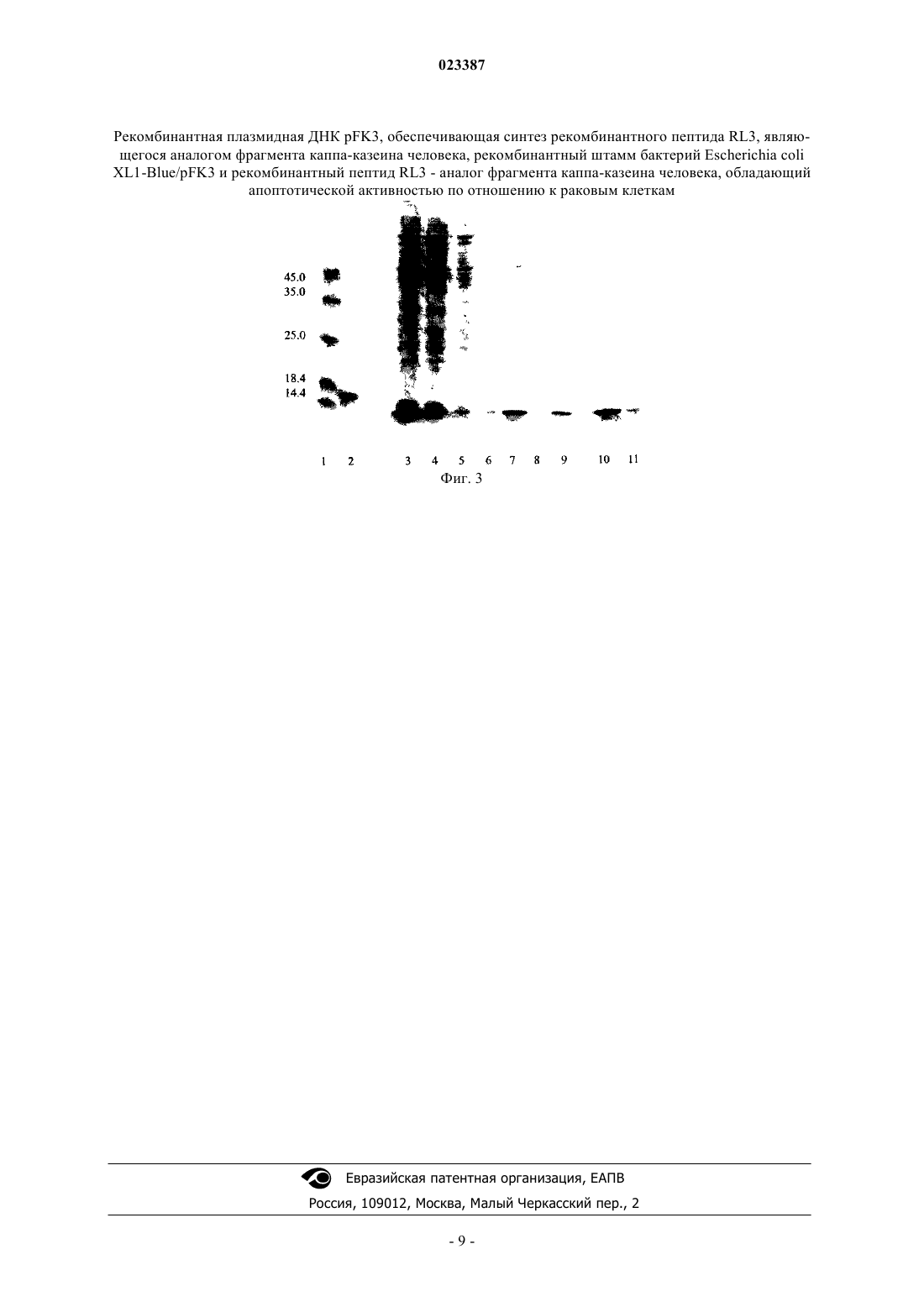
РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pFK3, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ПЕПТИДА RL3, ЯВЛЯЮЩЕГОСЯ АНАЛОГОМ ФРАГМЕНТА КАППА-КАЗЕИНА ЧЕЛОВЕКА, РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙESCHERICHIA COLI XL1-Blue/pFK3 И РЕКОМБИНАНТНЫЙ ПЕПТИД RL3 - АНАЛОГ ФРАГМЕНТА КАППА-КАЗЕИНА ЧЕЛОВЕКА, ОБЛАДАЮЩИЙ АПОПТОТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ Фомин Александр Сергеевич,Трошкова Галина Павловна, Коваль Ольга Александровна, Кулигина Елена Владимировна, Семенов Дмитрий Владимирович, Рихтер Владимир Александрович (RU) Изобретение относится к рекомбинантной плазмидной ДНК, обеспечивающей увеличенный выход рекомбинантного пептида RL3, содержащего фрагмент каппа-казеина человека, рекомбинантному штамму Escherichia coli (депонированному в КЭМТК ИХБФМ СО РАН под номером ЭМТК 1346), который продуцирует с увеличенным выходом рекомбинантный пептид RL3 - аналог каппаказенина человека, и рекомбинантному пептиду RL3, обладающему увеличенной апоптотической активностью по отношению к опухолевым клеткам, который состоит из трех компонентов:N-концевой полигистидиновой последовательности MRGSHHHHHHGS, остатка метионина,введенного в конструкцию для возможности отщепления полигистидиновой последовательности,и фрагмента каппа-казеина человека с 31 по 102 а.о. Изобретение может быть использовано в биотехнологии.(71)(73) Заявитель и патентовладелец: ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ НАУКИ ИНСТИТУТ ХИМИЧЕСКОЙ БИОЛОГИИ И ФУНДАМЕНТАЛЬНОЙ МЕДИЦИНЫ СИБИРСКОГО ОТДЕЛЕНИЯ РОССИЙСКОЙ АКАДЕМИИ НАУК (ИХБФМ СО РАН) (RU) Изобретение относится к рекомбинантной плазмидной ДНК с фрагментами каппа-казеина человека,обеспечивающей синтез рекомбинантного пептида - аналога каппа-казеина человека, обладающего апоптотической активностью по отношению к опухолевым клеткам, рекомбинантному штамму Escherichiacoli - продуценту пептида - аналога каппа-казенина человека, обладающего апоптотической активностью по отношению к опухолевым клеткам, и рекомбинантному пептиду - аналогу каппа-казенина человека,обладающему апоптотической активностью по отношению к опухолевым клеткам, и может быть использовано в биотехнологии, в частности в генетической и белковой инженерии. Одним из возможных перспективных подходов для эффективного лечения опухолей могут стать препараты, способные избирательно вызывать апоптоз в раковых клетках, не повреждая здоровые клетки организма. Известно, что молоко человека содержит белки и пептиды, вызывающие апоптотическую гибель клеток аденокарциномы молочной железы MCF-7 [1]. Один из таких проапоптотических пептидов был выделен из молока, имеет молекулярную массу 8.6 кДа, содержит установленную последовательность из 74 аминокислотных остатков, в которую входит протеолитический фрагмент каппа-казеина с 63 по 123 аминокислотный остаток, и получил название лактаптин (Патент RU 2317304 С 1. 2008) [2]. Данный пептид (лактаптин) индуцирует гибель клеток MCF-7 при минимальной концентрации 10 мкг/мл. При этом прекращается пролиферация клеточной культуры и в течение 12 ч погибает около 10% клеток. Повышение концентрации пептида в среде до 100 мкг/мл приводит к гибели 50-70% клеток аденокарциномы молочной железы MCF-7 в течение 12 ч. Однако доступность природного пептида является низкой, а стоимость получения очень высокой. Наиболее близким аналогом (прототипом) является рекомбинантный аналог (лактаптин RL2) природного пептида, сконструированный и рассчитанный на основании результатов MALDI-TOF массспектрометрии, касающихся наиболее вероятной первичной структуры природного пептида (Патент RU 2401307 С 1. 2010) [3]. Наиболее близкими аналогами (прототипами) являются также рекомбинантная плазмидная ДНКpFK2, обеспечивающая синтез рекомбинантного пептида, являющегося аналогом фрагмента каппаказеина человека, в клетках Escherichia coli, с молекулярной массой 2,1 MDa и размером 3164 п.о., содержащая: плазмидный вектор pGSDI, гидролизованный по Sail и Bglll сайтам и содержащий сайт инициации репликации плазмиды pBR322, промотор фага Т 7 и уникальные сайты рестрикции EcoRI (1595),Bglll (1613), Sail (1985), PstI (1995), Hindlll (2000), Clal (2053); Bglll-Sall фрагмент размером 372 п.о.,включающий стартовый кодон, сегмент, кодирующий фрагмент каппа-казеина человека с 24 по 134 аминокислотный остаток и олигопептид с последовательностью GGSHHHHHH, и стоп-кодон; генетические маркеры: AMPr - ген ампициллин резистентности (ген бетта-лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli, а также рекомбинантный штамм Escherichia coli XLlBlue/pFK2 - продуцент рекомбинантного пептида, аналога фрагмента каппа-казеина человека (лактаптинRL2) [3]. Первичная структура RL2 соответствует структуре фрагмента каппа-казеина человека (с 23 по 134 аминокислотный остаток) с шестью дополнительными остатками гистидина на С-конце. Рекомбинантный аналог лактаптина RL2 также индуцирует апоптоз клеток MCF-7. RL2 индуцирует диссипацию трансмембранного потенциала митохондрий клеток MCF-7 и приводит к активации инициаторных каспаз 8, 9 и эффекторной каспазы 7 [4]. Активация каскада каспаз в конечном итоге приводит к протеолитическому расщепления различных клеточных белков и вызывает широкий спектр морфологических изменений характерных для клеток, подвергающихся апоптозу. Выход белка после его очистки аффинной хроматографией на Ni-NTA агарозе составляет 150 мкг из 500 мл культуры клеток Escherichia coli. Недостатком прототипов является невысокий уровень синтеза рекомбинантного аналога (лактаптина RL2) природного пептида и его недостаточная апоптическая активность в отношении раковых клеток. Одностадийная хроматографическая очистка приводит к снижению качества пептида и ограничивает возможность его использования для промышленного производства субстанции медицинского назначения. Техническим результатом заявляемого изобретения является создание плазмиды, обеспечивающей увеличение синтеза рекомбинантного пептида, являющегося аналогом фрагмента каппа-казеина человека, и создание более продуктивного (с более высоким выходом целевого пептида) бактериального штамма-продуцента, позволяющего получать рекомбинантный пептид-аналог каппа-казеина человека, обладающего более высокой апоптотической активностью по отношению к раковым клеткам. Указанный технический результат достигается получением рекомбинантной плазмидной ДНКpFK3, обеспечивающей синтез рекомбинантного пептида RL3, являющегося аналогом фрагмента каппаказеина человека, с молекулярной массой 2,41 MDa и размером 3647 п.о., и содержащей в соответствии с физической и генетической картой, представленной на фиг. 2, следующие элементы:BamHI/HindIII - фрагмент плазмидной ДНК pFK3 размером 258 п.о., имеющий нуклеотидную последовательность и кодируемую ею аминокислотную последовательность, представленные на фиг. 1 а и состоящий из трех компонентов, кодирующих последовательность: пептида MRGSHHHHHHGS, остатка метионина, введенного в конструкцию для возможности отщепления полигистидиновой последовательности, и фрагмента каппа-казеина с 31 по 102 аминокислотный остаток; фрагмент плазмидного вектора pQE30, обеспечивающий эффективную экспрессию фрагмента каппа-казеина человека и содержащий: а) сайт инициации репликации плазмиды pBR322; б) промотор бактериофага Т 5; в) генетические маркеры: AMPr - ген ампициллин резистентности (ген -лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli; г) уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты:(3323). Указанный технический результат достигается также получением рекомбинантного штамма бактерий Escherichia coli XLl-Blue/pFK3 продуцента пептида RL3 - аналога фрагмента каппа-казеина человека,обладающего апоптотической активностью по отношению к раковым клеткам, содержащего рекомбинантную плазмидную ДНК pFK3 по п.1 формулы и депонированного в Межинститутском Центре коллективного пользования СО РАН "Коллекция экстремофильных микроорганизмов и типовых культур"(КЭМТК) ИХБФМ СО РАН под номеромЭМТК 1346 (справка о депонировании прилагается). Указанный технический результат достигается также получением рекомбинантного пептида RL3 аналога фрагмента каппа-казеина человека, имеющего молекулярную массу около 10 кДа, состоящего из остатка метионина, фрагмента каппа-казеина человека с 31 по 102 аминокислотный остаток и Nконцевой гистидиновой последовательности, обладающего апоптотической активностью по отношению к раковым клеткам, включающего аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: I, представленную на фиг. 16. Трансформация полученной плазмидой клеток Escherichia coli обеспечивает синтез рекомбинантного пептида, аналога фрагмента каппа-казеина человека, обладающего апоптотической активностью по отношению к раковым клеткам, с выходом белка до 30,6 мг на 1 л культуры клеток Escherichia coli (до 30% от суммарного содержания белка клеток). Сведения, поясняющие сущность изобретения Генно-инженерными методами получают плазмиду pFK3, несущую ген, кодирующий рекомбинантный пептид, аналог фрагмента каппа-казеина человека, созданный на основе последовательности ДНК, кодирующей фрагмент каппа-казеина человека с 31 по 102 (RL3) аминокислотный остаток и гистидиновый олигопептид. Исходным генетическим материалом для конструирования рекомбинантной плазмиды pFK3 являются: а) плазмидный вектор pQE30 [5], обеспечивающий встройку фрагмента ДНК, кодирующего фрагмент каппа-казеина человека, его экспрессию под контролем раннего промотора Т 5 ДНК-полимеразы; б) фрагмент ДНК, кодирующий фрагмент каппа-казеина с 31 по 102 аминокислотный остаток, который получают в полимеразной цепной реакции с использованием в качестве матрицы рекомбинантной плазмидной ДНК pGSDI/FK2, содержащий фрагмент каппа-казеина человека FK2 большей длины, и олигонуклеотидных праймеров, обеспечивающих наличие в амплификационном фрагменте сайтов рестрикции BamHI и Hind III: 5'TATAGGATCCATGCATGAGAATGATGAA (жирным выделен сайт эндонуклеазы рестрикцииBamHI, подчеркиванием выделен кодон, кодирующий метионин, введенный в конструкцию после нуклеотидной последовательности,кодирующей шесть остатков гистидина) и 5'TATAAAGCTTTTAGCTATTTGGCAGGTAT (жирным выделен сайт эндонуклеазы рестрикции HindIII, подчеркиванием выделен введенный терминирующий кодон). Клетки E.coli XL1-Blue, несущие ген РНК-полимеразы фага Т 5 под индуцибельным lacUV5 промотором, трансформируют сконструированной плазмидой pFK3 и выращивают в течение ночи. Ночную культуру (1/100) засевают в свежую среду YT2 с ампициллином (100 мкг/мл). Синтез РНК-полимеразы индуцируют добавлением изопропилтиогалактазида до концентрации 0,3 мМ в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят 18 ч при 30 С, после чего собирают центрифугированием при 5000g. Индуцированные клетки E.coli XL1-Blue/pFK3 используют для очистки рекомбинантного фрагмента каппа-казеина человека с помощью аффинной хроматографии. В результате получают рекомбинантный пептид RL3, аналог фрагмента каппа-казеина человека,имеющий молекулярную массу около 10 кДа, состоящий из N-концевой гистидиновой последовательности, остатка метионина и фрагмента каппа-казеина человека с 31 по 102 аминокислотный остаток. Данный пептид, включающий аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 1 (фиг. 1), обладает апоптотической активностью по отношению к раковым клеткам человека. Полученный штамм E.coli XL1-Blue/pFK3 не является зоопатогенным и фитопатогенным, депонирован в Межинститутском Центре коллективного пользования СО РАН "Коллекция экстремофильных микроорганизмов и типовых культур" (КЭМТК) ИХБФМ СО РАН и характеризуется следующими при-2 023387 знаками: Культурально-морфологические признаки: клетки мелкие, утолщенной палочковидной формы, грамотрицательные, неспороносные. Клетки хорошо растут на простых питательных средах. При росте на агаре "Difko" колонии круглые, гладкие, прижатые, мутные, блестящие, серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть. Клетки растут при температуре 37 С при оптимуме рН от 6.8 до 7. 5. Продукт, синтезируемый штаммом: рекомбинантный пептид, являющийся аналогом фрагмента каппа-казеина человека с 31 по 102 аминокислотный остаток с N-концевой гистидиновой последовательностью и обладающий апоптотической активностью по отношению к раковым клеткам. Активность (продуктивность) штамма: при культивировании в бульоне Лурия при 30 С после индукции 0,3 мМ ИПТГ уровень продукции целевого белка через 18 ч в среднем составляет 28 мг из 1 л суспензионной культуры клеток E.coli XL1-Blue/pFK3, проведено более 20 пассажей. Способ определения активности штамма: активность штамма определяется по апоптотической активности очищенного рекомбинантного пептида, аналога фрагмента каппа-казеина человека, по отношению к раковым клеткам, например, клеткам аденокарциномы молочной железы человека линии MCF-7. Способ, условия и состав сред для длительного хранения штамма: лиофилизация, низкотемпературное замораживание в бульоне Лурия, содержащем 25% глицерина. Способ, условия и состав сред для размножения: культивировать при 37 С на агаре Лурия с ампициллином (100 мкг/мл) или в бульоне Лурия с ампициллином (100 мкг/мл). Условия и состав среды для ферментации: бульон Лурия с ампициллином (100 мкг/мл), индукция ИПТГ (0,3 мМ). Генетические особенности штамма: клетки проявляют устойчивость к ампициллину (100 мкг/мл),обусловленную наличием плазмиды. Рекомендуемые условия хранения: при 4 С на минимальном агаре с ампициллином (100 мкг/мл). Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 а приведена нуклеотидная последовательность, а на фиг. 1 б - кодируемая ею аминокислотная последовательность BamHI/HindIII-фрагмента плазмиды pFK3, кодирующая фрагмент каппаказеина человека с 31 по 102 аминокислотный остаток с N-концевой гистидиновой последовательностью. На фиг. 2 представлена физическая и генетическая карта плазмиды pFK3. FK3 ген, кодирующий рекомбинантный аналог каппа-казеина человека, RBS - сайт посадки рибосом, Т 5 - промотор фага Т 5,AMPr- ген устойчивости к ампициллину; указаны некоторые сайты рестрикции. На фиг. 3 приведена электрофореграмма в 12% SDS-ПААГ белков фракций, полученных последовательным выделением аналога лактаптина RL3 аффинной хроматографией на Ni-NTA сефарозе и ионообменной хроматографией на SP-сефарозе и MacroPrep DEAE. А. Дорожки: 1 - белковые-маркеры, молекулярная масса в кДа приведена слева, 2 - рекомбинантный аналог лактаптина RL2 (17 кДа), 3 - белки супернатанта лизата клеток-продуцентов E.coli, трансформированных плазмидой pFK3 и культивированных с индукцией ИПТГ, 4 - белки, не взаимодействующие сNi-NTA сефарозой, 5 - белки, элюируемые 50 мМ имидазола, 6 - белки, элюируемые 200 мМ имидазола,7 - белки, элюируемые 6 М гуанидин-HCl с 0.1 М ЭДТА, 8 - белки, не взаимодействующие с SPсефарозой (дорожка 7), 9 - белки фракции, содержащей RL3, элюируемые с SP-сефарозы в градиенте мочевины и NaCl, 10 - белки фракции, содержащей RL3 (дорожка 9), элюируемые при нанесении на сорбент MacroPrep DEAE, 11 - белки, элюируемые в градиенте мочевины и NaCl с MacroPrep DEAE. Ниже приведены конкретные примеры выполнения изобретения. Пример 1. Технология конструирования плазмиды pFK3 На основе результатов секвенирования N-конца лактаптина, выделенного из женского молока, была выбрана аминокислотная последовательность каппа-казеина, которая с наибольшей вероятностью соответствуют последовательности природного лактаптина: ENDERPFYQKTAPYVPMYYVPNSYPYYGTNLYQRRPAIAINNPYVPRTYYANPAVVRPHAQIPQRQYLPNS (фрагмент 3); В качестве источника гена, кодирующего фрагмент каппа-казеина человека, использовали плазмидную ДНК pFK2, использованную для получения рекомбинантного аналога RL2 и содержащую нуклеотидные последовательности, кодирующие фрагмент ДНК каппа-казеина 3. Амплификацию гена, кодирующего фрагмент каппа-казеина человека, проводили методом ПЦР с использованием Taq ДНК-полимеразы (ЗАО "Биосан", ИХБФМ СО РАН), которая позволяет синтезировать продукты с частотой мутаций около 110-4 ошибок/нуклеотид. Для синтеза фрагмента ДНК, кодирующего фрагмент каппа-казеина человека, в реакционную смесь добавляли праймеры: 5'TATAGGATCCATGCATGAGAATGATGAA (жирным выделен сайт эндонуклеазы рестрикции BamHI,подчеркиванием выделен кодон, кодирующий метионин, введенный в конструкцию после нуклеотидной последовательности,кодирующей шесть остатков гистидина) и 5'TATAAAGCTTTTAGCTATTTGGCAGGTAT (жирным выделен сайт эндонуклеазы рестрикции HindIII, подчеркиванием выделен введенный терминирующий кодон), соответствующих 5'- и 3'-концу ДНК,кодирующей фрагмент каппа-казеина с 31 по 102 аминокислотный остаток, и обеспечивающих в ампли-3 023387 фикационном фрагменте наличие сайтов рестрикции BamHI и HindIII, соответственно. Реакцию проводили с использованием технологии горячего старта в амплификаторе "Mastercyclergradient" ("Eppendorf", США). Условия проведения ПЦР: предварительная денатурация - 5 мин при 95 С; 30 циклов - 15 с при 95 С, 30 с при 58 С, 20 с при 72 С; заключительная стадия - 5 мин при 72 С. Продукты амплификации, кодирующие фрагмент каппа-казеина человека, расщепляли рестриктазами BamHI и HindIII в реакционной смеси, содержащей рестрикционный буфер "TangoTM", 10 ед. активности BamHI и 20 ед. активности Hindlll. Аналогично проводили обработку рестриктазами ДНК векторной плазмиды pQE30. Реакцию вели 3 ч при 37 С. После этого ПЦР-фрагмент и линеаризованный вектор очищали электрофорезом в 1,5% агарозном геле с последующим выделением ДНК с помощью набора "GenElute Gel Extraction Kit" ("Sigma", США) в соответствии с рекомендациями производителя. Лигирование фрагмента ДНК, кодирующего фрагмент каппа-казеина человека, и векторной ДНК проводили в стандартных условиях [6]. Пример 2. Получение штамма-продуцента фрагмента каппа-казеина человека - продуктов плазмидыpFK3. Клетки Е. coli XL1-Blue трансформировали сконструированной плазмидой pFK3, имеющей фаговый промотор Т 5 под контролем двух последовательностей lac оператора, который узнается РНК полимеразой Е. coli. Трансформированные клетки E.coli выращивали в течение ночи. Ночную культуру(1/100) засевали в свежую среду YT2 с ампициллином (100 мкг/мл). Экспрессию целевого белка индуцировали добавлением изопропилтиогалактазида до концентрации 0,3 мМ в тот момент, когда культура достигает средне-логарифмической фазы роста. Индуцированные клетки растили 18 ч при температуре 30 С, после чего собирали центрифугированием при 5000g и анализировали методом электрофореза по Лэммли [7] в 12% SDS-полиакриламидном геле (ПААГ). Результаты этого анализа (электрофорез и иммуноблот в 12% SDS-ПААГ лизатов клеток E.coli XL1-Blue, трансформированных плазмидой pFK3 в присутствие индуктора ИПТГ и без него), показали наличие в индуцированной культуре клеток E.coliXL1-Blue /pFK3 дополнительного белка с молекулярной массой около 10 кДа, который отсутствовал в контрольных лизатах клеток Е. XL1-Blue/pFK3. Пример 3. Технология очистки рекомбинантного пептида, аналога фрагмента каппа-казеина человека из клеток Е.coli XLl-Blue/pFK3. Индуцированные клетки E.coli XLl-Blue/pFK3 использовали для очистки рекомбинантных фрагментов каппа-казеина человека с помощью аффинной хроматографии на Ni-NTA сефарозе (Bio-rad,США), согласно инструкции производителя. Для этого клетки E.coli осаждали из культуральной среды центрифугированием при 5000g 30 мин при температуре 4 С. Биомассу суспендировали в 5 объемах лизирующего буфера (50 мМ Na-фосфатный буфер рН 9.0, 300 мМ NaCl, 10 мМ имидазол, 1 мМ фенилметилсульфонил фторид, 10 мМ 2 меркаптоэтанол, 4 М мочевина). Клетки лизировали ультразвуком с использованием дезинтегратора УЗДН-1 У 4.2, с генератором 22 кГц (5 подходов по 30 с, 200-300 W, с охлаждением во льду в перерывах между подходами). Лизат центрифугировали 30 мин при 10000g при температуре 4 С. Супернатант наносили на хроматографическую колонку, упакованную 10 мл Ni-NTA сефарозы(Profmity IMAC, Bio-rad, США) и уравновешенную лизирующим буфером, со скоростью 1 мл/мин. Не связавшиеся с сорбентом белки элюировали лизирующим буфером. Для удаления неспецифически сорбирующихся белков E.coli проводили предварительную элюцию лизирующим буфером, содержащим 50 мМ имидазола. Аналог лактаптина элюировали лизирующим буфером, содержащим 200 мМ имидазола, а затем проводили дополнительную элюцию в денатурирующих условиях буфером, содержащим 6 М гуанидина гидрохлорида и 0,1 М ЭДТА. Полученные белковые фракции диализовали против воды (две смены по 18 ч при 5 С) и анализировали SDS электрофорезом в ПААГ по Лэммли [7] в восстанавливающих условиях. Пример такой очистки приведен на фиг. 3. Фракции, содержащие рекомбинантный пептид, аналог фрагмента каппа-казеина человека, концентрировали ионообменной хроматографией на SP-сефарозе. Определение концентрации белка в препарате рекомбинантного аналога лактаптина проводили по методу Брэдфорд [8, 9]. Для построения калибровочной кривой использовали бычий сывороточный альбумин (Serva, США). Определение концентрации белка показывает, что общий выход составляет 45,9 мг рекомбинантного аналога RL3 из 1,5 л культуры клеток Escherichia coli. Пример 4. Исследование апоптотической активности рекомби нантного пептида - аналога фрагмента каппа-казеина человека по отношению к раковым клеткам. Для оценки апоптотической активности рекомбинантного пептида - аналога фрагмента каппаказеина человека использовали клетки аденокарциномы молочной железы человека линии MCF-7 (Российская коллекция клеточных культур позвоночных, ИНЦ РАН, Санкт-Петербург). Клетки MCF-7 культивировали в среде IMDM с 10 мМ L-глутамина и 40 мкг/мл гентамицина в присутствии 10% эмбриональной сыворотки крупного рогатого скота при 37 С в атмосфере 5% СО 2 в культуральных флаконах с площадью поверхности дна 25 см 2. Подсчет количества клеток проводили в камере Горяева по стандарт-4 023387 ной методике [10]. Для анализа влияния аналогов лактаптина на жизнеспособность клеток 2,5103 клетокMCF-7 в 100 мкл среды RPMI-1640, содержащей 5% эмбриональной сыворотки теленка и 20 мМ буфераHepes, культивировали в лунках 96 луночного плоскодонного планшета в стандартных условиях (37 С,5% СО 2, 95% влажности) в течение 24 ч (экспоненциальная фаза роста, 50% монослой). К культуральной среде добавляли рекомбинантные аналоги лактаптина в 100 мкл среды с сывороткой и инкубировали 72 ч,после чего оценивали морфологические изменения клеток с помощью световой микроскопии и анализировали жизнеспособность клеток с помощью МТТ-теста [11]. Для этого содержащую препарат среду удаляли, в лунки добавляли по 100 мкл среды RPMI-1640 без сыворотки, содержащей МТТ в концентрации 0,5 мг/мл. Клетки MCF-7 инкубировали в присутствии МТТ в течение 4 ч при температуре 37 С, затем среду с МТТ удаляли. Формазан растворяли в ДМСО и определяли оптическую плотность раствора при длине волны 570 нм на планшетном сканере "Multiskan RC", ThermoLabs (США). Результаты эксперимента представлены в таблице и показывают, что инкубация MCF-7 в присутствии созданного рекомбинантного аналога каппа-казеина человека приводит к существенному снижению их жизнеспособности. Снижение жизнеспособности под действием аналога лактаптина сопровождалось морфологическими изменениями, характерными для апоптоза клеток в культуре: откреплением от пластиковой подложки, конденсацией цитоплазмы и ядер и появлением вторичных некротических клеток,окрашиваемых трипановым синим. Данные о жизнеспособности клеток MCF-7, инкубированных 48 ч в полной культуральной среде в присутствии различных концентраций рекомбинантных аналогов лактаптина RL2 и RL3. Примечание. За 100% принята жизнеспособность клеток MCF-7, инкубированных в отсутствии аналогов лактаптина. Из данных таблицы видно, что подавление жизнеспособности клеток MCF-7 под действием аналогов лактаптина снижается с уменьшением концентрации аналогов в среде. Концентрация, при которой происходит снижение жизнеспособности клеток на 50% (ИК 50), составляет 0,24 мг/мл для RL3, в то время как для RL2 эта концентрация 0,45 мг/мл. Для белка RL3 с расчетной массой 10,2 кДа это составляет 23,5 мкМ. Таким образом достигнут заявленный технический результат, а именно создана плазмида, обеспечивающая увеличение синтеза рекомбинантного пептида, являющегося аналогом фрагмента каппаказеина человека, и создан более продуктивный (с более высоким выходом целевого пептида) бактериальный штамм-продуцент, позволяющий получать рекомбинантный пептид - аналог каппа-казеина человека, обладающий более высокой апоптотической активностью по отношению к раковым клеткам. Источники научно-технической и патентной информации 1. Некипелая В.В., Семенов Д.В., Потапенко М.О., Кулигина Е.В., Кит Ю.Я., Романова И.В.,Рихтер В.А. Лактаптин - белок человеческого молока, индуцирующий апоптоз клеток аденокарциномыMCF-7 // Докл. Академии Наук. 2008. Т. 419,2, c. 268-271. 2. Власов В.В., Рихтер В.А., Семенов Д.В., Некипелая В.В., Кулигина Е.В., Потапенко М.О. Пептид, обладающий апоптотической активностью по отношению к раковым клеткам человека // Патент RU2317304. 2008. Бюл.5. 3. Тикунова Н.В., Семенов Д.В., Бабкина И.Н., Кулигина Е.В., Коваль О.А., Фомин А.С, Матвеева В.А., Матвеев А.Л., Матвеев Л.Э., Рихтер В.А. Рекомбинантная плазмидная ДНК pFK2,обеспечивающая синтез рекомбинантного пептида, являющегося аналогом фрагмента каппа-5 023387 казеина, способ получения рекомбинантного пептида и рекомбинантный пептид, аналог фрагмента каппа-казеина человека, обладающий апоптотической активностью по отношению к раковым клеткам // Патент РФПатент RU 2401307 С 1. 2010. Бюл.28. 4. Semenov D.V., Fomin A.S., Kuligina E.V., Koval O.A., Matveeva V.A., Babkina I.N., Tikunova N.V.,Richter V.A. Recombinant analogues of novel milk pro-apoptotic peptide lactaptin and their effect on culturedFifth edition. 06/2003. 6. Маниатис Т., Фрич Э., Сэмбрук Д. Молекулярное клонирование. М.: Мир, 1984. 7. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature, 1970, V. 227 (5259), p. 680-685. 8. Государственная фармакопея Российской Федерации, XII издание, Часть 1, 2007. Определение белка (ОФС 42-0053-07). 9. Bradford M.M. (1976) Anal. Biochem. 72: 248-254. 10. Use of tripan blue stain and the hemocytometer to determinate total cell counts and viable cell number.Sigma. - 1996. - P. 1702. 11. Методические указания по изучению противоопухолевой активности фармакологических веществ / Е.М. Трещалина, О.С. Жукова, Г.К. Герасимова, Н.В. Андронова, A.M. Гарин // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ; под общ. ред. Р.У. Хабриева. - 2-е изд., перераб. и доп. - М.: Медицина, 2005. - С. 637-651. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантная плазмидная ДНК pFK3, обеспечивающая увеличенный выход рекомбинантного пептида RL3 с аминокислотной последовательностью SEQ ID NO: 2, который является аналогом фрагмента каппа-казеина человека и состоит из трех компонентов: N-концевой полигистидиновой последовательности MRGSHHHHHHGS, остатка метионина, введенного в конструкцию для возможности отщепления полигистидиновой последовательности, и фрагмента каппа-казеина человека с 31 по 102 а.о.; и который обладает увеличенной апоптотической активностью по отношению к раковым клеткам, причем указанная ДНК характеризуется молекулярной массой 2,41 MDa и размером 3647 п.о. и содержит в соответствии с физической и генетической картой, представленной на фиг. 2, следующие элементы: 1) фрагмент Bam HI/Hin dIII размером 258 п.о., имеющий нуклеотидную последовательность SEQID NO: 1, которая кодирует указанный пептид RL3 с аминокислотной последовательностью SEQ ID NO: 2; 2) фрагмент плазмидного вектора pQE30, обеспечивающий эффективную экспрессию фрагмента каппа-казеина человека и содержащий: а) сайт инициации репликации плазмиды pBR322; б) промотор бактериофага Т 5; в) генетический маркер AMPr - ген резистентности к ампициллину (ген -лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli; г) уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: Ava I (2), Eco RI (89), Ват HI (146), Hin dIII (374), Nco I (1047), Ара LI (1579), Ара LI (2077), Ара LI(3323). 2. Рекомбинантный штамм бактерии Escherichia coli XL1-Blue/pFK3, продуцирующий с увеличенным выходом рекомбинантный пептид RL3 с аминокислотной последовательностью SEQ ID NO: 2, причем штамм содержит рекомбинантную плазмидную ДНК pFK3 по п.1 и депонирован в КЭМТК ИХБФМ СО РАН под номером ЭМТК 1346. 3. Рекомбинантный пептид RL3 с аминокислотной последовательностью SEQ ID NO: 2, который является аналогом фрагмента каппа-казеина человека, имеет молекулярную массу около 10 кДа и состоит из трех компонентов: N-концевой полигистидиновой последовательности MRGSHHHHHHGS, остатка метионина, введенного в конструкцию для возможности отщепления полигистидиновой последовательности, и фрагмента каппа-казеина человека с 31 по 102 а.о., и который обладает увеличенной апоптотической активностью по отношению к раковым клеткам. Фиг. 1 б Рекомбинантная плазмидная ДНК pFK3, обеспечивающая синтез рекомбинантного пептида RL3, являющегося аналогом фрагмента каппа-казеина человека, рекомбинантный штамм бактерий Escherichia coliXLl-Blue/pFK3 и рекомбинантный пептид RL3 - аналог фрагмента каппа-казеина человека, обладающий апоптотической активностью по отношению к раковым клеткам Рекомбинантная плазмидная ДНК pFK3, обеспечивающая синтез рекомбинантного пептида RL3, являющегося аналогом фрагмента каппа-казеина человека, рекомбинантный штамм бактерий Escherichia coliXL1-Blue/pFK3 и рекомбинантный пептид RL3 - аналог фрагмента каппа-казеина человека, обладающий апоптотической активностью по отношению к раковым клеткам
МПК / Метки
МПК: C07K 14/47, C12N 15/00, C12N 15/70, C12N 1/21
Метки: каппа-казеина, escherichia, фрагмента, активностью, обладающий, пептида, синтез, отношению, штамм, пептид, клеткам, днк, pfk3, обеспечивающая, бактерий, раковым, являющегося, рекомбинантная, рекомбинантного, аналог, рекомбинантный, аналогом, человека, апоптотической, плазмидная
Код ссылки
<a href="https://eas.patents.su/10-23387-rekombinantnaya-plazmidnaya-dnk-pfk3-obespechivayushhaya-sintez-rekombinantnogo-peptida-rl3-yavlyayushhegosya-analogom-fragmenta-kappa-kazeina-cheloveka-rekombinantnyjj-shtamm-bakt.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантная плазмидная днк pfk3, обеспечивающая синтез рекомбинантного пептида rl3, являющегося аналогом фрагмента каппа-казеина человека, рекомбинантный штамм бактерий escherichia coli xl1-blue/pfk3 и рекомбинантный пептид rl3 – аналог фрагмента каппа-казеина человека, обладающий апоптотической активностью по отношению к раковым клеткам</a>
Предыдущий патент: Состав для обработки семян кукурузы и люпина
Следующий патент: Огнестойкая тканевая комбинация
Случайный патент: Дверь бытового прибора и способ ее запирания