Препарат невирапина пролонгированного высвобождения
Номер патента: 18377
Опубликовано: 30.07.2013
Авторы: Сноу Гленн Чарлз, Каппола Майкл Л., Синкевич Светлана, Чэнь Фэнцин
Формула / Реферат
1. Фармацевтическая композиция в виде таблетки, которая включает 300 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде одной дозы характеризуется:
(1) средним геометрическим значением Cmax, равным от 1000 до 2300 нг/мл; и
(2) средним геометрическим значением ППК0-∞, равным от 73400 до 178100 ч (нг/мл);
значением Tmax, равным от 10 до 48 ч;
которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША (Фармакопея США) при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
2. Фармацевтическая композиция в виде таблетки, которая включает 300 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде нескольких доз характеризуется:
(1) средним геометрическим значением Cmax,ss, равным от 2300 до 3700 нг/мл; и
(2) средним геометрическим значением ППК0-24,ss, равным от 45000 до 75000 ч (нг/мл);
значением Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2, определенным при введении человеку натощак нескольких доз; и
которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
3. Фармацевтическая композиция в виде таблетки, которая включает 400 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде одной дозы характеризуется:
(1) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и
(2) средним геометрическим значением ППК0-∞, равным от 109000 до 237000 ч (нг/мл);
значением Tmax, равным от 10 до 48 ч; и
которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
4. Фармацевтическая композиция в виде таблеток, которая включает 400 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде нескольких доз характеризуется:
(1) средним геометрическим значением Cmax,ss, равным от 3100 до 4900 нг/мл; и
(2) средним геометрическим значением ППК0-24,ss, равным от 60000 до 99000 ч (нг/мл);
значением Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2, определенным при введении нескольких доз; и
которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
5. Фармацевтическая композиция по пп.1, 2, 3 или 4, обладающая профилем растворения in vitro таким, что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
6. Фармацевтическая композиция по пп.1, 2, 3 или 4, обладающая профилем растворения in vitro таким, что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
7. Фармацевтическая дозированная форма в виде таблетки, которая содержит:
(а) 400 мг безводного невирапина в матрице пролонгированного высвобождения;
(b) 270 мг гипромеллозы 2208;
(c) 400 мг моногидрата лактозы и
(d) 10 мг стеарата магния;
и таблетка получена прессованием при усилии, равном 10-25 кН.
8. Дозированная форма в виде таблетки по п.7, которая при введении человеку натощак в виде нескольких доз характеризуется:
(1) средним геометрическим значением Cmax,ss, равным от 3100 до 4900 нг/мл; и
(2) средним геометрическим значением ППК0-24,ss, равным от 60000 до 99000 ч (нг/мл);
значением Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2, когда вводится человеку натощак в виде нескольких доз; и
которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
9. Дозированная форма в виде таблетки по п.7, которая при введении человеку натощак в виде одной дозы характеризуется:
(1) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и
(2) средним геометрическим значением ППК0-∞, равным от 109000 до 237000 ч (нг/мл).
10. Дозированная форма в виде таблетки по п.9, которая при введении натощак в виде одной дозы характеризуется значением Tmax, равным от 10 до 48 ч.
11. Дозированная форма в виде таблетки по п.7, обладающая профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
12. Дозированная форма в виде таблетки по п.7, обладающая профилем растворения in vitro таким, что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
13. Дозированная форма в виде таблетки по п.7, обладающая профилем растворения in vitro таким, что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
14. Фармацевтическая дозированная форма в виде таблетки, которая содержит:
(a) 400 мг безводного невирапина в матрице пролонгированного высвобождения;
(b) 270 мг гипромеллозы 2208;
(c) 400 мг моногидрата лактозы и
(d) 10 мг стеарата магния;
где таблетка получена прессованием при усилии, равном 10-25 кН; и при введении человеку натощак в виде одной дозы характеризуется:
(1) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и
(2) средним геометрическим значением ППК0-∞, равным от 109000 до 237000 ч (нг/мл);
обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
15. Дозированная форма в виде таблетки по п.14, обладающая профилем растворения in vitro таким, что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
16. Дозированная форма в виде таблетки по п.14, обладающая профилем растворения in vitro таким, что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37°С.
Текст
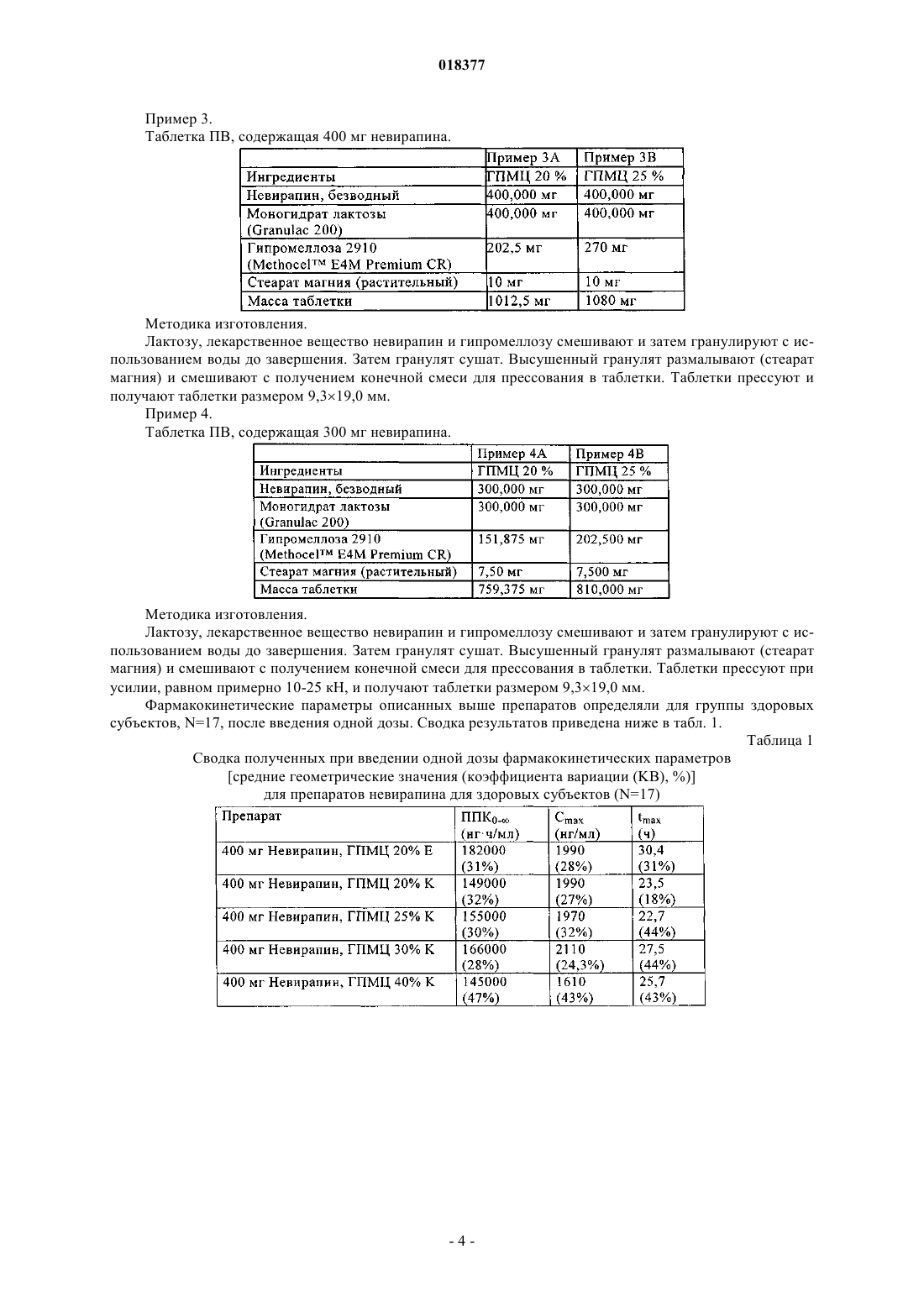
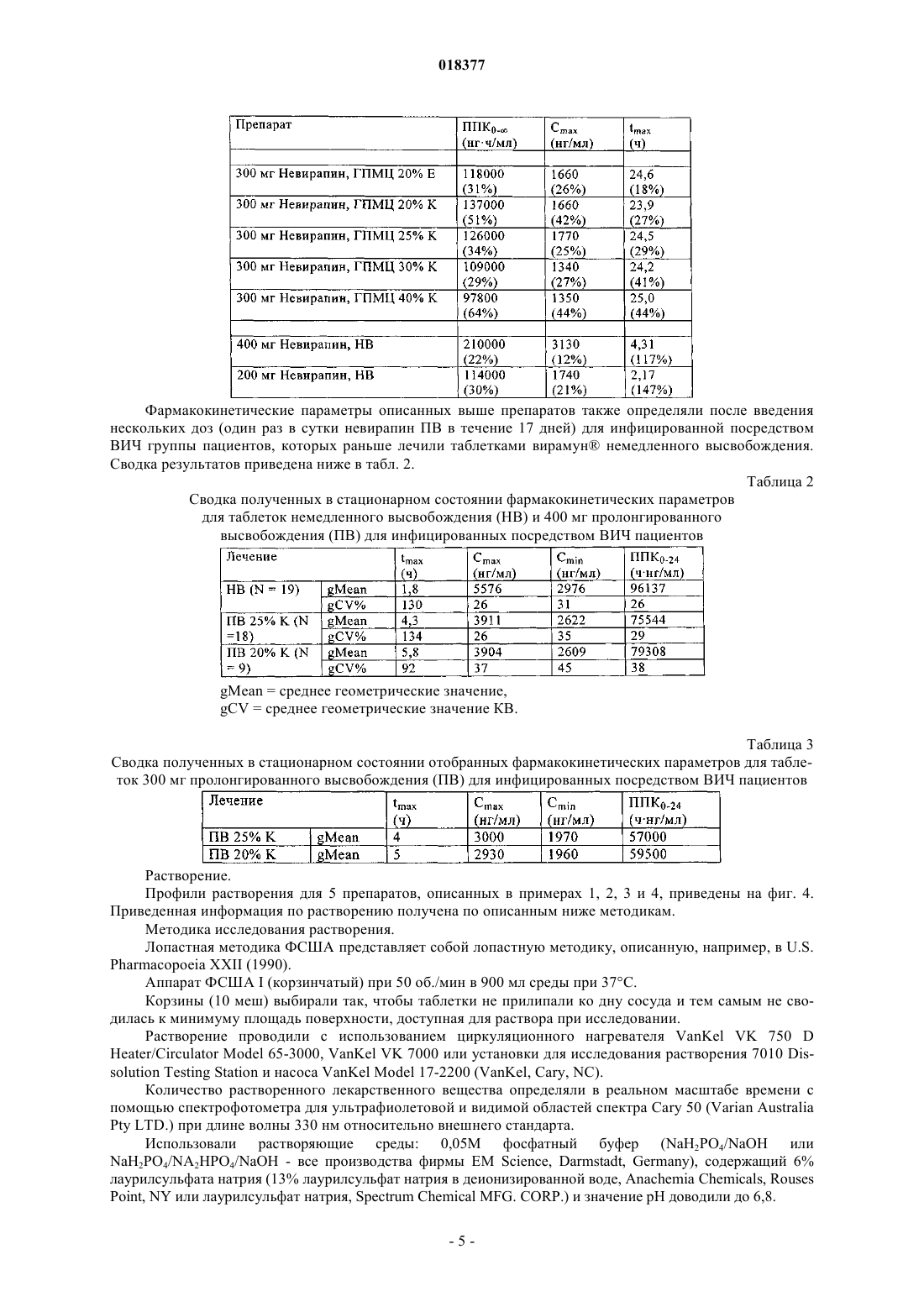
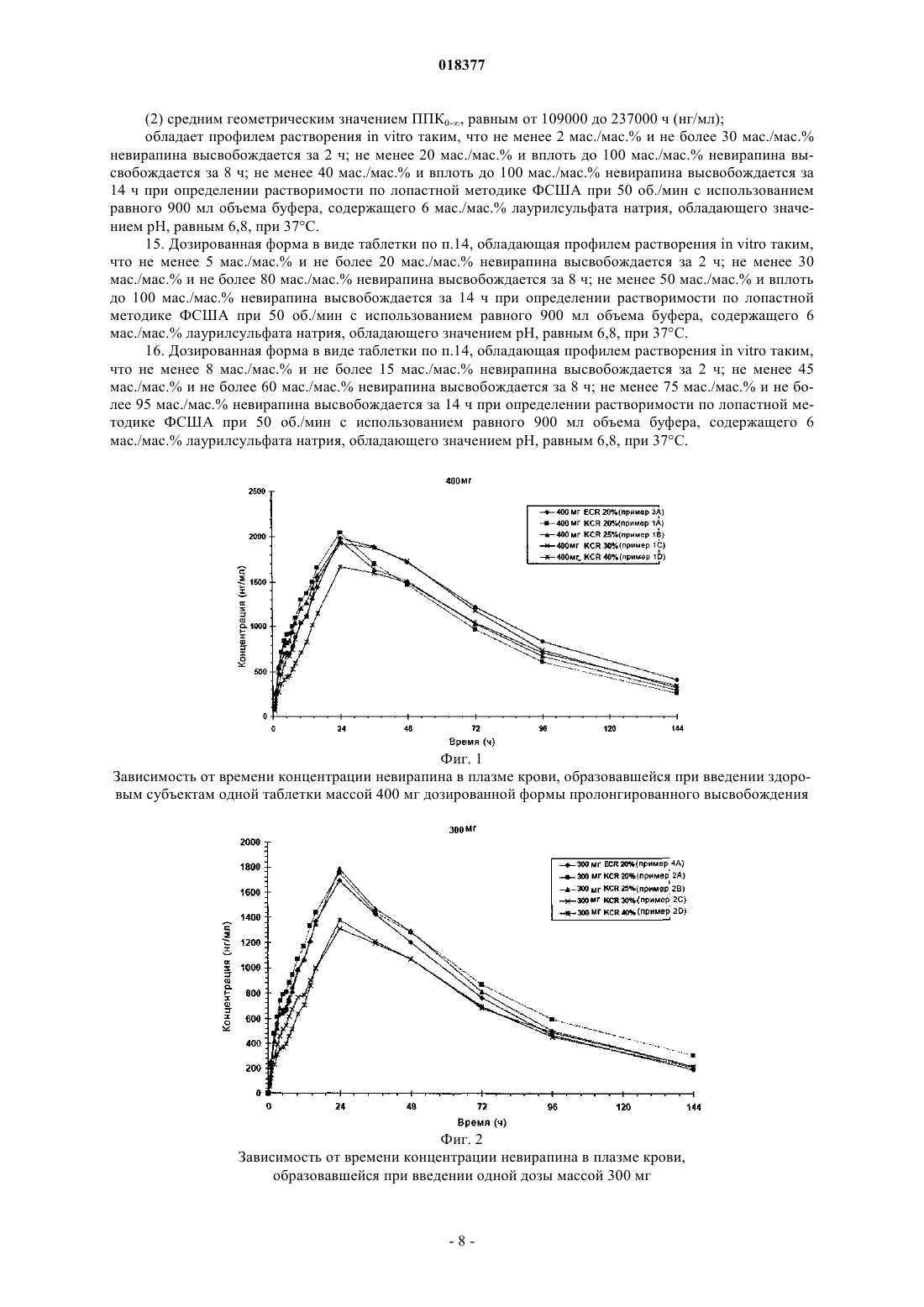
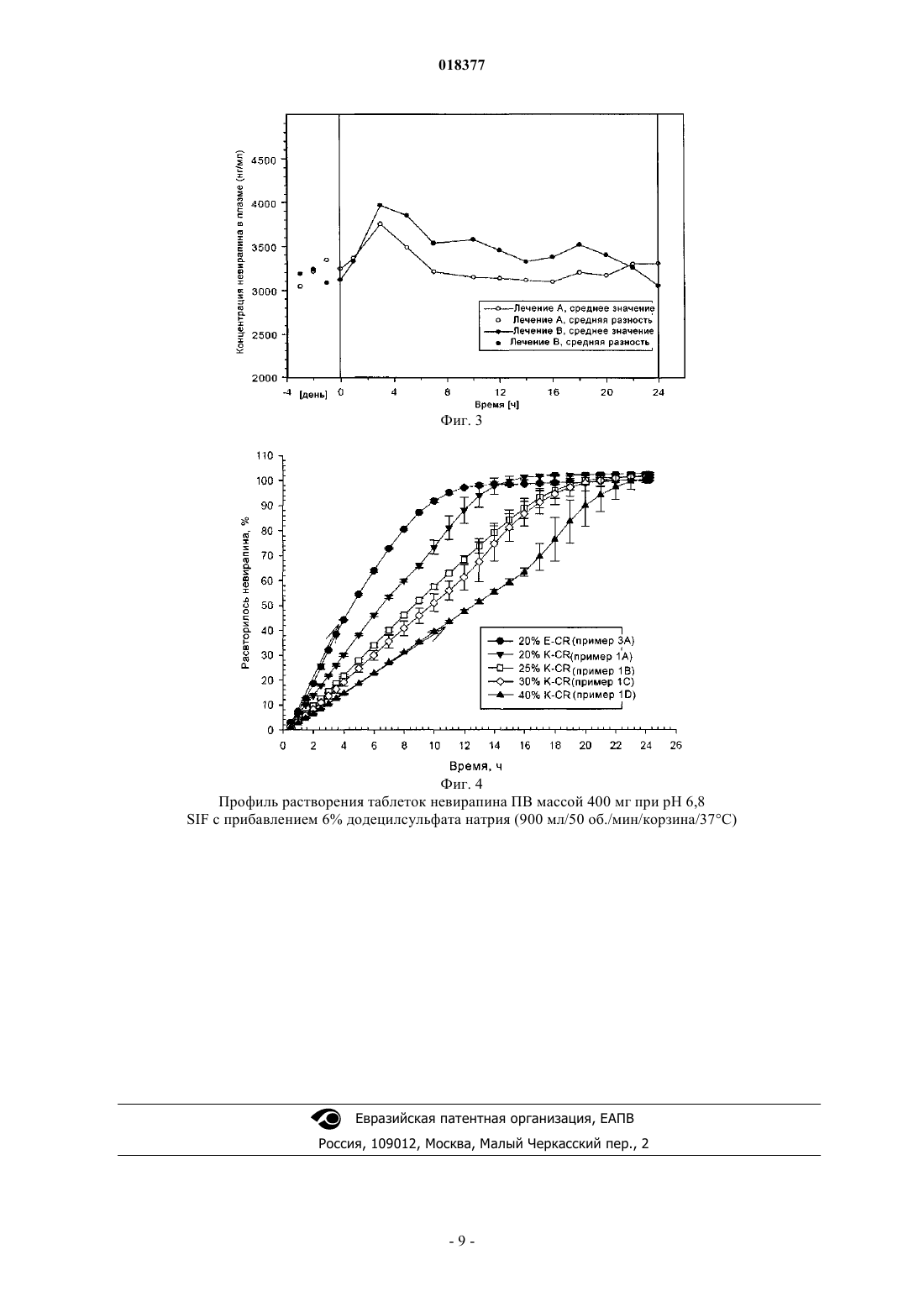
ПРЕПАРАТ НЕВИРАПИНА ПРОЛОНГИРОВАННОГО ВЫСВОБОЖДЕНИЯ В изобретении описана фармацевтическая композиция пролонгированного высвобождения,включающая невирапин.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE)(1) Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтической композиции, включающей невирапин.(2) Уровень техники Невирапин или 11-циклопропил-5,11-дигидро-4-метил-6 Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он является известным средством лечения инфицирования посредством ВИЧ-1 (вирус иммунодефицита человека, тип 1), которое действует путем специфического ингибирования обратной транскриптазы ВИЧ-1. Его синтез и применение описаны в различных публикациях, включая, в частности, патент US 5366972 и европейский патент 0429987 В 1. Таблетки вирамун, лекарственного средства, содержащего невирапин,во многих странах утверждены к применению для лечения инфицирования посредством ВИЧ-1. Имеющиеся в настоящее время в продаже таблетки вирамун представляют собой препарат немедленного высвобождения (НВ), который предназначен для введения два раза в сутки для поддержания терапевтически благоприятного содержания в крови активного ингредиента, невирапина. Для удобства пациентов и содействия соблюдению надлежащего режима дозировки давно необходим пока отсутствующий препарат пролонгированного высвобождения (ПВ) невирапина для перорального введения, который можно было бы вводить только один раз в сутки при поддержании терапевтически благоприятного содержания в крови активного ингредиента. Специалисты в области фармацевтики, знакомые с невирапином, должны понимать, что невирапин обладает физико-химическими характеристиками, которые делают сомнительной возможность приготовления препарата ПВ. Точнее, следует понимать, что препарат ПВ обычно предназначен для постепенного всасывания при прохождении через кишечник, в котором значение рН является высоким. Невирапин является слабым основанием и поэтому можно полагать, что он обладает низкой растворимостью в кишечнике (невирапин является лекарственным средством класса II в соответствии с Биофармацевтической классификационной системой). По этой причине разумно полагать, что препарат ПВ невирапина может проходить через желудочно-кишечный тракт и выводиться без существенного растворения и всасывания невирапина. Это делает препарат ПВ неприменимым. Невирапин обладает по меньшей мере еще одной особенностью, которая делает необычно сложной задачу приготовления препарата ПВ. Для обеспечения безопасности, переносимости и эффективности содержание в плазме никогда не должно быть меньше порогового значения, при котором подавляется репликация вируса, и никогда не должно повышаться до значения, при котором проявляется токсичность или непереносимость. Для невирапина различие между этими двумя значениями относительно невелико. Это означает, что значение Cmax,ss/Cmin,ss должно быть близким к 1. Безопасность/переносимость и эффективность препарата немедленного высвобождения исследована ранее и в условиях стационарного состояния после введения два раза в сутки наблюдается довольно пологий фармакокинетический (ФК) профиль (Cmax,ss/Cmin,ss = примерно 1,8). Любой препарат пролонгированного высвобождения (ПВ) должен характеризоваться отношением максимальное/минимальное значение, которое, несмотря на введение ПВ один раз в сутки, равно или даже меньше, чем отношение для препарата НВ после введения два раза в сутки. В противном случае, если отношение максимальное/минимальное значение больше, чем наблюдающееся для НВ, препарат ПВ, вероятно, будет неприменимым с точки зрения характеристики клинический риск/польза. С учетом этих довольно сложных задач в основу настоящего изобретения была положена задача разработки препарата ПВ невирапина, предназначенного для перорального введения. Краткое изложение сущности изобретения Настоящее изобретение относится к препарату пролонгированного высвобождения (ПВ) невирапина, который пригоден для введения только один раз в сутки с поддержанием терапевтически благоприятного содержания активного ингредиента в крови. Краткое описание фигур На фиг. 1 и 2 соответственно приведена зависимость от времени концентрации невирапина в плазме крови, образовавшейся при введении здоровым субъектам одной таблетки массой 400 или 300 мг дозированной формы пролонгированного высвобождения невирапина, предлагаемой в настоящем изобретении. На фиг. 3 приведена зависимость от времени стационарной концентрации невирапина в плазме крови, образовавшейся при введении один раз в сутки здоровым субъектам таблетки массой 400 мг дозированной формы пролонгированного высвобождения невирапина, предлагаемой в настоящем изобретении. На фиг. 4 приведен профиль растворения препарата пролонгированного высвобождения, предлагаемого в настоящем изобретении. Подробное описание изобретения В своем самом широком варианте осуществления препарат пролонгированного высвобождения,предлагаемый в настоящем изобретении, после введения натощак здоровому добровольцу обладает типичным фармакокинетическим профилем, который для дозированной формы, содержащей 300 мг невирапина, характеризуется следующими двумя параметрами:(a) средним геометрическим значением Cmax, равным от 1000 до 2300 нг/мл; и(b) средним геометрическим значением ППК 0- (ППК - площадь под кривой), равным от 73400 до 178100 нгч/мл); и для дозированной формы, содержащей 400 мг невирапина, характеризуется следующими двумя параметрами:(a) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и(b) средним геометрическим значением ППК 0-, равным от 109000 до 237000 нгч/мл). Препарат пролонгированного высвобождения, предлагаемый в настоящем изобретении, дополнительно характеризуется средним геометрическим значением Tmax, равным от 10 до 48 ч (также после введения разовой дозы натощак). Препарат пролонгированного высвобождения, предлагаемый в настоящем изобретении, дополнительно характеризуется следующими параметрами ФК, наблюдающимися после повторяющегося введения один раз в сутки в стационарном состоянии: для дозы, равной 300 мг:(a) средним геометрическим значением Cmax,ss, равным от 2300 до 3700 нг/мл; и(b) средним геометрическим значением ППК 0-24h,ss, равным от 45000 до 75000 нгч/мл; и для дозы, равной 400 мг:(a) средним геометрическим значением Cmax,ss, равным от 3100 до 4900 нг/мл; и(b) средним геометрическим значением ППК 0-24h,ss, равным от 60000 до 99000 нгч/мл. Указанные выше параметры ФК для случая введения множества доз определяют натощак через 24 ч после того, как содержание лекарственного средства в плазме достигло стационарного состояния. Препарат пролонгированного высвобождения, предлагаемый в настоящем изобретении, дополнительно характеризуется очень узким интервалом значений отношения Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2 для доз, равных и 300, и 400 мг, и указанный параметр определяют в стационарном состоянии. Следует отметить, что эти параметры ФК следует определять по экспериментальным данным, а не моделированным данным. Кроме того, препарат пролонгированного высвобождения, предлагаемый в настоящем изобретении,характеризуется профилем растворения in vitro, таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч, при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. В предпочтительных вариантах осуществления препарат пролонгированного высвобождения, предлагаемый в настоящем изобретении, характеризуется профилем растворения in vitro, таким, что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч, при определении растворимости по лопастной методике ФСША (Фармакопея США) при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. В более предпочтительных вариантах осуществления препарат пролонгированного высвобождения,предлагаемый в настоящем изобретении, характеризуется профилем растворения in vitro, таким, что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч, при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. Фармацевтическую композицию, предлагаемую в настоящем изобретении, можно приготовить путем объединения невирапина с обычными носителями или инертными наполнителями. Предпочтительными вариантами осуществления настоящего изобретения являются таблетки. Также предпочтительными являются варианты осуществления настоящего изобретения, которые включают матрицу пролонгированного высвобождения, которая содержит гидрофильный полимер, который обеспечивает регулируемое высвобождение невирапина. Гидрофильным полимером может быть,но не ограничивается только ими, гидроксипропилметилцеллюлоза (ГПМЦ, также известная, как гипромеллоза), гидроксипропилцеллюлоза (ГПЦ), гидроксиэтилцеллюлоза (ГЭЦ), ксантановая камедь, альгинат натрия, полиэтиленоксид и сшитые гомополимеры и сополимеры акриловой кислоты. Также можно использовать смеси указанных выше гидрофильных полимеров. Предпочтительным гидрофильным полимером является ГПМЦ (гипромеллоза), в особенности гипромеллоза 2910 ФСША, гипромеллоза 2906 ФСША или гипромеллоза 2208 ФСША или их смесь. Препарат, предлагаемый в настоящем изобретении, также необязательно может содержать другие обычные инертные наполнители, такие как наполнители, разбавители, вещества, придающие скольз-2 018377 кость, и связующие. Препарат, предлагаемый в настоящем изобретении, можно приготовить путем смешивания отдельных компонентов (лекарственное вещество невирапин, гидрофильный полимер(полимеры) и необязательно наполнитель(наполнители), разбавитель(разбавители), вещество(вещества), придающее скользкость, и связующее(связующие) с последующим гранулированием с использованием гранулирующего раствора до завершения. Затем гранулят сушат. Высушенный гранулят размалывают, объединяют со смазывающим веществом и смешивают с получением конечной смеси для прессования в таблетки. Таблетки прессуют при усилии, равном примерно 10-25 кН, предпочтительно 11-19 кН и более предпочтительно 13-17 кН и получают таблетки необходимой величины и формы, обладающие твердостью, равной примерно 11-26 кф (килофунтов), предпочтительно 16-21 кф. Препараты, включающие матрицу пролонгированного высвобождения, содержащую примерно от 20 до 25 мас.% гипромеллозы, являются предпочтительными. Наиболее предпочтительными являются препараты, содержащие гипромеллозу 2208 (MethocelK4M Premium CR). Особенно предпочтительной является фармацевтическая таблетка, такая, что каждая таблетка содержит:(c) 400 мг моногидрата лактозы и(d) 10 мг стеарата магния; и каждую таблетку прессуют при усилии, равном примерно 10-25 кН. Настоящее изобретение может быть дополнительно разъяснено с помощью приведенных ниже неограничивающих примеров, которые описывают конкретные препараты в виде таблеток. Пример 1. Таблетка ПВ, содержащая 400 мг невирапина. Национальный фармацевтический справочник США. Методика изготовления. Лактозу, лекарственное вещество невирапин и гипромеллозу смешивают и затем гранулируют с использованием воды до завершения. Затем гранулят сушат. Высушенный гранулят размалывают (стеарат магния) и смешивают с получением конечной смеси для прессования в таблетки. Таблетки прессуют при усилии, равном примерно 10-25 кН, и получают таблетки размером 9,319,0 мм. Пример 2. Таблетка ПВ, содержащая 300 мг невирапина. Методика изготовления. Лактозу, лекарственное вещество невирапин и гипромеллозу смешивают и затем гранулируют с использованием воды до завершения. Затем гранулят сушат. Высушенный гранулят размалывают (стеарат магния) и смешивают с получением конечной смеси для прессования в таблетки. Таблетки прессуют при усилии, равном примерно 10-25 кН, и получают таблетки размером 9,319,0 мм. Методика изготовления. Лактозу, лекарственное вещество невирапин и гипромеллозу смешивают и затем гранулируют с использованием воды до завершения. Затем гранулят сушат. Высушенный гранулят размалывают (стеарат магния) и смешивают с получением конечной смеси для прессования в таблетки. Таблетки прессуют и получают таблетки размером 9,319,0 мм. Пример 4. Таблетка ПВ, содержащая 300 мг невирапина. Методика изготовления. Лактозу, лекарственное вещество невирапин и гипромеллозу смешивают и затем гранулируют с использованием воды до завершения. Затем гранулят сушат. Высушенный гранулят размалывают (стеарат магния) и смешивают с получением конечной смеси для прессования в таблетки. Таблетки прессуют при усилии, равном примерно 10-25 кН, и получают таблетки размером 9,319,0 мм. Фармакокинетические параметры описанных выше препаратов определяли для группы здоровых субъектов, N=17, после введения одной дозы. Сводка результатов приведена ниже в табл. 1. Таблица 1 Сводка полученных при введении одной дозы фармакокинетических параметров[средние геометрические значения (коэффициента вариации (KB), %)] для препаратов невирапина для здоровых субъектов (N=17) Фармакокинетические параметры описанных выше препаратов также определяли после введения нескольких доз (один раз в сутки невирапин ПВ в течение 17 дней) для инфицированной посредством ВИЧ группы пациентов, которых раньше лечили таблетками вирамун немедленного высвобождения. Сводка результатов приведена ниже в табл. 2. Таблица 2 Сводка полученных в стационарном состоянии фармакокинетических параметров для таблеток немедленного высвобождения (НВ) и 400 мг пролонгированного высвобождения (ПВ) для инфицированных посредством ВИЧ пациентовgMean = среднее геометрические значение,gCV = среднее геометрические значение КВ. Таблица 3 Сводка полученных в стационарном состоянии отобранных фармакокинетических параметров для таблеток 300 мг пролонгированного высвобождения (ПВ) для инфицированных посредством ВИЧ пациентов Растворение. Профили растворения для 5 препаратов, описанных в примерах 1, 2, 3 и 4, приведены на фиг. 4. Приведенная информация по растворению получена по описанным ниже методикам. Методика исследования растворения. Лопастная методика ФСША представляет собой лопастную методику, описанную, например, в U.S.Pharmacopoeia XXII (1990). Аппарат ФСША I (корзинчатый) при 50 об./мин в 900 мл среды при 37 С. Корзины (10 меш) выбирали так, чтобы таблетки не прилипали ко дну сосуда и тем самым не сводилась к минимуму площадь поверхности, доступная для раствора при исследовании. Растворение проводили с использованием циркуляционного нагревателя VanKel VK 750 DHeater/Circulator Model 65-3000, VanKel VK 7000 или установки для исследования растворения 7010 Dissolution Testing Station и насоса VanKel Model 17-2200 (VanKel, Cary, NC). Количество растворенного лекарственного вещества определяли в реальном масштабе времени с помощью спектрофотометра для ультрафиолетовой и видимой областей спектра Cary 50 (Varian AustraliaPty LTD.) при длине волны 330 нм относительно внешнего стандарта. Использовали растворяющие среды: 0,05 М фосфатный буфер (NaH2PO4/NaOH илиNaH2PO4/NA2HPO4/NaOH - все производства фирмы ЕМ Science, Darmstadt, Germany), содержащий 6% лаурилсульфата натрия (13% лаурилсульфат натрия в деионизированной воде, Anachemia Chemicals, RousesPoint, NY или лаурилсульфат натрия, Spectrum Chemical MFG. CORP.) и значение рН доводили до 6,8. Растворение проводили с использованием корзин из нержавеющей стали 10 меш. Параметры растворения: объем среды: 900 мл температура: 37,3 С скорость вращения: 50 об./мин отбор проб: через каждые 30 мин в течение первых 4 ч, затем через каждый час (4-24 ч) длительность вращения: 15 мин при 250 об./мин встроенные фильтры: полнопоточный фильтр с отверстиями размером 10 мкм (VanKel, Сагу, NC или Quality Lab Accessories L.L.S.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция в виде таблетки, которая включает 300 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде одной дозы характеризуется:(1) средним геометрическим значением Cmax, равным от 1000 до 2300 нг/мл; и(2) средним геометрическим значением ППК 0-, равным от 73400 до 178100 ч (нг/мл); значением Tmax, равным от 10 до 48 ч; которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША (Фармакопея США) при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 2. Фармацевтическая композиция в виде таблетки, которая включает 300 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде нескольких доз характеризуется:(1) средним геометрическим значением Cmax,ss, равным от 2300 до 3700 нг/мл; и(2) средним геометрическим значением ППК 0-24,ss, равным от 45000 до 75000 ч (нг/мл); значением Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2, определенным при введении человеку натощак нескольких доз; и которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 3. Фармацевтическая композиция в виде таблетки, которая включает 400 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде одной дозы характеризуется:(1) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и(2) средним геометрическим значением ППК 0-, равным от 109000 до 237000 ч (нг/мл); значением Tmax, равным от 10 до 48 ч; и которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 4. Фармацевтическая композиция в виде таблеток, которая включает 400 мг невирапина в матрице пролонгированного высвобождения, содержащей от 20 до 25 мас.% гипромеллозы, и которая при введении человеку натощак в виде нескольких доз характеризуется:(1) средним геометрическим значением Cmax,ss, равным от 3100 до 4900 нг/мл; и(2) средним геометрическим значением ППК 0-24,ss, равным от 60000 до 99000 ч (нг/мл); значением Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2, определенным при введении нескольких доз; и которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 5. Фармацевтическая композиция по пп.1, 2, 3 или 4, обладающая профилем растворения in vitro таким, что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 6. Фармацевтическая композиция по пп.1, 2, 3 или 4, обладающая профилем растворения in vitro таким, что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 7. Фармацевтическая дозированная форма в виде таблетки, которая содержит:(а) 400 мг безводного невирапина в матрице пролонгированного высвобождения;(c) 400 мг моногидрата лактозы и(d) 10 мг стеарата магния; и таблетка получена прессованием при усилии, равном 10-25 кН. 8. Дозированная форма в виде таблетки по п.7, которая при введении человеку натощак в виде нескольких доз характеризуется:(1) средним геометрическим значением Cmax,ss, равным от 3100 до 4900 нг/мл; и(2) средним геометрическим значением ППК 0-24,ss, равным от 60000 до 99000 ч (нг/мл); значением Cmax,ss/Cmin,ss, которое находится в диапазоне от 1,1 до 2, когда вводится человеку натощак в виде нескольких доз; и которая обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 9. Дозированная форма в виде таблетки по п.7, которая при введении человеку натощак в виде одной дозы характеризуется:(1) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и(2) средним геометрическим значением ППК 0-, равным от 109000 до 237000 ч (нг/мл). 10. Дозированная форма в виде таблетки по п.9, которая при введении натощак в виде одной дозы характеризуется значением Tmax, равным от 10 до 48 ч. 11. Дозированная форма в виде таблетки по п.7, обладающая профилем растворения in vitro таким,что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 12. Дозированная форма в виде таблетки по п.7, обладающая профилем растворения in vitro таким,что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 13. Дозированная форма в виде таблетки по п.7, обладающая профилем растворения in vitro таким,что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 14. Фармацевтическая дозированная форма в виде таблетки, которая содержит:(a) 400 мг безводного невирапина в матрице пролонгированного высвобождения;(c) 400 мг моногидрата лактозы и(d) 10 мг стеарата магния; где таблетка получена прессованием при усилии, равном 10-25 кН; и при введении человеку натощак в виде одной дозы характеризуется:(1) средним геометрическим значением Cmax, равным от 1210 до 2740 нг/мл; и(2) средним геометрическим значением ППК 0-, равным от 109000 до 237000 ч (нг/мл); обладает профилем растворения in vitro таким, что не менее 2 мас./мас.% и не более 30 мас./мас.% невирапина высвобождается за 2 ч; не менее 20 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 8 ч; не менее 40 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 15. Дозированная форма в виде таблетки по п.14, обладающая профилем растворения in vitro таким,что не менее 5 мас./мас.% и не более 20 мас./мас.% невирапина высвобождается за 2 ч; не менее 30 мас./мас.% и не более 80 мас./мас.% невирапина высвобождается за 8 ч; не менее 50 мас./мас.% и вплоть до 100 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. 16. Дозированная форма в виде таблетки по п.14, обладающая профилем растворения in vitro таким,что не менее 8 мас./мас.% и не более 15 мас./мас.% невирапина высвобождается за 2 ч; не менее 45 мас./мас.% и не более 60 мас./мас.% невирапина высвобождается за 8 ч; не менее 75 мас./мас.% и не более 95 мас./мас.% невирапина высвобождается за 14 ч при определении растворимости по лопастной методике ФСША при 50 об./мин с использованием равного 900 мл объема буфера, содержащего 6 мас./мас.% лаурилсульфата натрия, обладающего значением рН, равным 6,8, при 37 С. Фиг. 1 Зависимость от времени концентрации невирапина в плазме крови, образовавшейся при введении здоровым субъектам одной таблетки массой 400 мг дозированной формы пролонгированного высвобождения Фиг. 2 Зависимость от времени концентрации невирапина в плазме крови,образовавшейся при введении одной дозы массой 300 мг Фиг. 4 Профиль растворения таблеток невирапина ПВ массой 400 мг при рН 6,8
МПК / Метки
МПК: A61K 9/20
Метки: пролонгированного, невирапина, высвобождения, препарат
Код ссылки
<a href="https://eas.patents.su/10-18377-preparat-nevirapina-prolongirovannogo-vysvobozhdeniya.html" rel="bookmark" title="База патентов Евразийского Союза">Препарат невирапина пролонгированного высвобождения</a>
Предыдущий патент: Новые хиральные промежуточные продукты, способ их получения и их применение в производстве толтеродина, фезотеродина или их активных метаболитов
Следующий патент: Замещенные производные 3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2н-пиридо[2,1-a]изохинолин-2-ола и связанные с ними способы
Случайный патент: Лиганд-модифицированные полиоксогидроксидные материалы с ионами металла, их применение и способы их получения