Способ синтеза ивабрадина и его солей присоединения с фармацевтически приемлемой кислотой
Номер патента: 16405
Опубликовано: 30.04.2012
Авторы: Лекув Жан-Пьер, Лерестиф Жан-Мишель, Серки Бернар, Дессинье Эмея, Пеглион Жан-Луис
Формула / Реферат
1. Способ синтеза соединения формулы (VI) в рацемической или оптически активной форме
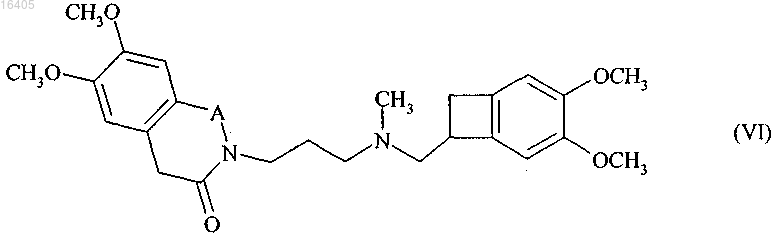
где А представляет собой Н2С-СН2 или НС=СН,
который отличается тем, что соединение формулы (VII) в рацемической или оптически активной форме
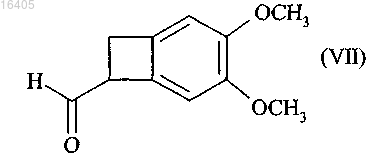
подвергают реакции восстановительного аминирования с соединением формулы (VIII)
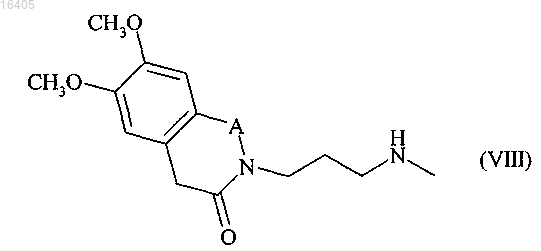
где А имеет значение, указанное выше, в присутствии восстановителя,
в органическом растворителе или смеси органических растворителей.
2. Способ синтеза по п.1, отличающийся тем, что соединение формулы (VII) находится в оптически активной форме.
3. Способ синтеза по п.2, отличающийся тем, что оптически активная форма представляет собой (S) конфигурацию.
4. Способ синтеза по п.2, отличающийся тем, что группа А представляет собой Н2С-СН2 и продукт реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), представляет собой ивабрадин формулы (I)
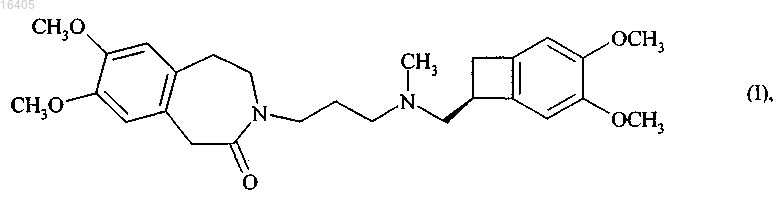
который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты, винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты.
5. Способ синтеза по п.3, отличающийся тем, что группа А представляет собой НС=СН и продукт реакции восстановительного аминирования соединения формулы (VII), имеющего (S) конфигурацию, с соединением формулы (VIII), представляет собой соединение формулы (V)
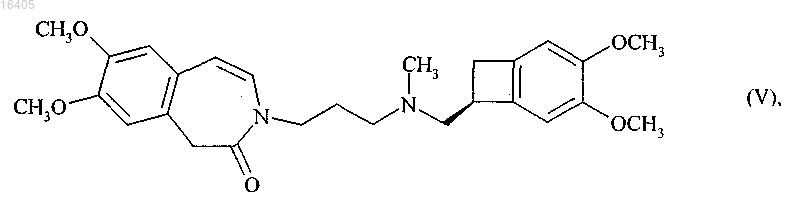
при каталитическом гидрировании которого получают ивабрадин формулы (I)

который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты, винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты.
6. Способ синтеза по п.1, отличающийся тем, что соединение формулы (VII) находится в рацемической форме и реакцию восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII) осуществляют с последующей стадией оптического разделения полученного рацемического соединения формулы (VI).
7. Способ синтеза по п.6, отличающийся тем, что А представляет собой Н2С-СН2 и продукт, полученный после стадии оптического разделения соединения формулы (VI), представляет собой ивабрадин формулы (I)

который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты, винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты.
8. Способ синтеза по п.6, отличающийся тем, что А представляет собой НС=СН и продукт, полученный после стадии оптического разделения соединения формулы (VI), представляет собой соединение формулы (V)
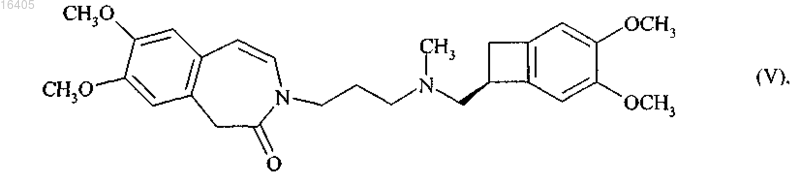
при каталитическом гидрировании которого получают ивабрадин формулы (I)

который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты, винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты.
9. Способ синтеза по любому из пп.1-8, отличающийся тем, что восстановитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), выбирают из триацетоксиборогидрида натрия, цианоборогидрида натрия и диводорода в присутствии катализатора, такого как палладий, платина, никель, рутений, родий и их производные.
10. Способ синтеза по п.9, отличающийся тем, что катализатор используется на подложке или в окисленной форме.
11. Способ синтеза по п.9, отличающийся тем, что восстановитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), представляет собой триацетоксиборогидрид натрия.
12. Способ синтеза по любому из пп.1-11, отличающийся тем, что растворитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), выбирают из тетрагидрофурана, дихлорметана, 1,2-дихлорэтана, ацетатов, этанола, метанола или изопропанола, толуола и ксилола.
13. Способ синтеза по п.12, отличающийся тем, что растворитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), представляет собой смесь тетрагидрофурана и дихлорметана.
14. Соединение формулы (VII) в рацемической или оптически активной форме
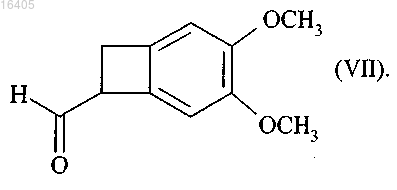
Текст
СПОСОБ СИНТЕЗА ИВАБРАДИНА И ЕГО СОЛЕЙ ПРИСОЕДИНЕНИЯ С ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ КИСЛОТОЙ Способ синтеза ивабрадина формулы (I) и его солей присоединения с фармацевтически приемлемой кислотой.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) 016405 Настоящее изобретение относится к способу синтеза ивабрадина формулы (I) или 3-3-(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метил(метил)амино]пропил 7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-она,его солей присоединения с фармацевтически приемлемой кислотой и их гидратов. Ивабрадин и его соли присоединения с фармацевтически приемлемой кислотой, и более предпочтительно его гидрохлорид, обладают чрезвычайно ценными фармакологическими и терапевтическими свойствами, в особенности брадикардическими свойствами, что делает эти соединения пригодными для лечения или профилактики различных клинических состояний ишемии миокарда, таких как стенокардия,инфаркт миокарда и ассоциированные нарушения ритма, а также различных патологий, связанных с нарушениями ритма, в особенности суправентирулярных нарушений ритма, и для лечения сердечной недостаточности. Получение и терапевтическое применение ивабрадина и его солей присоединения с фармацевтически приемлемой кислотой и более предпочтительно его гидрохлорида, описано в заявке на европейский патент ЕР 0534859. В этой патентной заявке описан синтез гидрохлорида ивабрадина, используя в качестве исходного вещества соединение формулы (II) которое разделяют, получая соединение формулы (III) которое подвергают реакции с соединением формулы (IV) получая соединение формулы (V) при каталитическом гидрировании которого получают ивабрадин, который затем превращают в его гидрохлорид. Недостаток этого способа синтеза состоит в том, что получают ивабрадин с выходом только 1%. Поскольку это соединение представляет фармацевтический интерес, то чрезвычайно важной является возможность его получения путем эффективного процесса синтеза, который обеспечивает получение ивабрадина с хорошим выходом. Настоящее изобретение относится к способу синтеза соединения формулы (VI) в рацемической или оптически активной форме где А представляет собой Н 2 С-СН 2 или НС=СН,который отличается тем, что соединение формулы (VII) в рацемической или оптически активной форме подвергают реакции восстановительного аминирования с соединением формулы (VIII) где А имеет значение, указанное выше, в присутствии восстановителя,в органическом растворителе или смеси органических растворителей. В предпочтительном варианте осуществления изобретения соединение формулы (VII) находится в оптически активной форме, и, более специфически, имеет (S) конфигурацию. Если А представляет собой Н 2 С-СН 2, то продукт восстановительного аминирования соединения формулы (VII), имеющего (S) конфигурацию, с соединением формулы (VIII), представляет собой ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. Если А представляет собой НС=СН, то продукт восстановительного аминирования соединения формулы (VII), имеющего (S) конфигурацию, с соединением формулы (VIII), представляет собой соединение формулы (V) при каталитическом гидрировании которого получают ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. В другом предпочтительном варианте осуществления изобретения соединение формулы (VII) находится в рацемической форме. Реакцию восстановительного аминирования рацемического соединения формулы (VII) с соединением формулы (VIII) в этом случае осуществляют с последующей стадией оптического разделения полученного соединения формулы (VI). Если А представляет собой Н 2 С-СН 2, то продукт, полученный после стадии оптического разделения соединения формулы (VI), представляет собой ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. Если А представляет собой НС=СН, то продукт, полученный после стадии оптического разделения соединения формулы (VI), представляет собой соединение формулы (V) при каталитическом гидрировании которого получают ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. Из восстановителей, которые могут использоваться для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), могут быть упомянуты, но не ограничиваясь только ими, соединения, образующие гидрид или диводород в присутствии катализатора. Из восстановителей, которые могут использоваться для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), могут быть упомянуты, но не ограничиваясь только ими, триацетоксиборогидрид натрия, цианоборогидрид натрия и диводород в присутствии катализатора, такого как палладий, платина, никель, рутений, родий, и их производные, в особенности на подложке или в окисленной форме. Восстановитель, который предпочтительно используют для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), представляет собой триацетоксиборогидрид натрия. Из растворителей, которые могут использоваться для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), могут быть упомянуты, но не ограничиваясь только ими, тетрагидрофуран, дихлорметан, 1,2-дихлорэтан, ацетаты, спирты, предпочтительно этанол, метанол или изопропанол, толуол и ксилол. В предпочтительном варианте осуществления изобретения, растворитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), представляет собой смесь органических растворителей. Растворитель, предпочтительно используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), представляет собой смесь тетрагидрофурана и дихлорметана. Соединение формулы (VII), в рацемической или оптически активной форме, является новым продуктом, который пригоден в качестве промежуточного соединения синтеза в химической или фармацевтической промышленности, в особенности для синтеза ивабрадина, его солей присоединения с фармацевтически приемлемой кислотой и их гидратов и, как таковые, составляет цельную часть настоящего изобретения.-3 016405 Перечень используемых сокращений: ДМФА: N,N-диметилформамид ТГФ: тетрагидрофуран ИК: инфракрасный Примеры, приведенные ниже, иллюстрируют изобретение. Точки плавления (Тпл.) определяли на блоке Kfler. Пример 1. 7,8-Диметокси-3-[3-(метиламино)пропил]-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он Растворяли 50 г (0,18 моль) 3-(7,8-диметокси-2-оксо-1,2,4,5-тетрагидро-3H-3-бензазепин-3 ил)пропионового альдегида в 625 мл метанола. Полученный раствор охлаждали до 0 С и затем добавляли 62,5 мл (0,81 моль; 4,5 эквивалента) водного 40% раствора метиламина. Перемешивали в течение 1 ч при 0 С и затем добавляли 7,5 г (0,2 моль; 1,1 эквивалент) NaBH4. Перемешивали в течение 30 мин при 0 С и затем перемешивали в течение 12 ч при температуре окружающей среды. Метанол упаривали. Остаток ресуспендировали в водном растворе хлористо-водородной кислоты (1 н.) и промывали этилацетатом. После этого водную фазу доводили до рН = 8 путем добавления 20% раствора гидроксида натрия и экстрагировали дихлорметаном. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и затем упаривали насухо, получая 52 г масла, которое очищали путем флэш-хроматографии на 1,5 кг оксида кремния (элюант = дихлорметан/этанол/NH4OH: 80/20/2). Получали 42 г ожидаемого продукта в виде белого твердого вещества. Выход = 80 % Тпл. (KB) = 68-70 С Пример 2. 7,8-Диметокси-3-[3-(метиламино)пропил]-1,3-дигидро-2H-3-бензазепин-2-он Стадия 1. трет-Бутил[3-(7,8-диметокси-2-оксо-1,2-дигидро-3H-3-бензазепин-3 ил)пропил]метилкарбамат Суспендировали 1,7 г (7,8 ммоль) 7,8-диметокси-1,3-дигидро-2H-3-бензазепин-2-она в 35 мл ДМФА и затем добавляли 374 мг (9,35 ммоль, 1,2 эквивалента) гидрида натрия (60 % суспензия в масле). Получали прозрачный светло-желтый раствор, который перемешивали в течение одного часа при 25 С. Затем по каплям добавляли 1,94 г (9,35 ммоль, 1,2 эквивалента) трет-бутил (3-хлорпропил)метилкарбамата,растворенного в 10 мл ДМФА. Все компоненты нагревали при 50 С в течение ночи и затем растворитель упаривали насухо. Остаток ресуспендировали в воде и экстрагировали дихлорметаном. Органическую фазу высушивали над MgSO4, фильтровали и затем упаривали насухо. Получали 4,2 г масла, которое очищали путем флэш-хроматографии на 200 г оксида кремния (элюант = дихлорметан/этилацетат: 80/20). Получали 2,3 г ожидаемого продукта в форме бесцветного масла. Выход = 77% ИК (чистота) : = 1685, 1659, 1155, 1102, 872, 770 см-1. Стадия 2. 7,8-Диметокси-3-[3-(метиламино)пропил]-1,3-дигидро-2H-3-бензазепин-2-он Растворяли 1,9 г (4,86 ммоль) продукта, полученного на стадии 1, в 30 мл этанола и к этому раствору добавляли 7 мл (24,3 ммоль, 5 эквивалента) HCl в этаноле (3,5 н.). Нагревали в течение ночи при 60 С и реакционную смесь упаривали насухо. Полученный остаток ресуспендировали в воде, и после этого водную фазу доводили до рН=8 путем добавления 20% раствора гидроксида натрия и экстрагировали дихлорметаном. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и затем упаривали насухо. Получали 1,1 г указанного в заглавии продукта в форме бесцветного масла. Выход = 78% ИК (чистота): = 3400, 1651, 1610, 1510, 856, 710 см-1. Пример 3. 3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбонитрил Указанное в заглавии соединение может получено путем циклизации 3-(2-бром-4,5 диметоксифенил)пропаннитрила, как описано в литературе (см. Tetrahedron 1973, 29 73-76) или согласно нижеописанной последовательности реакций: Стадия 1. 3,4-Диметокси-6-гидроксибензальдегид В трехгорлой колбе диспергировали 40,8 г хлорида алюминия в 200 мл дихлорметана при перемешивании. Раствор охлаждали до 0 С. По каплям вливали в раствор 20 г (0,101 моль) 3,4,6 триметоксибензальдегида, растворенного в 100 мл дихлорметана. Температуре позволяли повышаться снова до 19 С и перемешивали в течение 45 мин. Реакционную смесь гидролизовали с 400 г воды и льда и затем добавляли 100 мл 1 н. HCl и перемешивали в течение 30 мин. Позволяли разделиться и затем экстрагировали 200 мл дихлорметана. Органическую фазу промывали 100 мл 1 н. HCl, 100 мл воды и 100 мл насыщенного водного раствора NaCl и затем высушивали надMgSO4, фильтровали и упаривали насухо. Получали 16,4 г указанного в заглавии продукта. Выход = 77% ИК (чистота): 1625, 1146 см-1. Стадия 2. 2-Формил-4,5-диметоксифенил диметилсульфамат Растворяли 16,2 г (0,0889 моль) 3,4-диметокси-6-гидроксибензальдегида в 80 мл ДМФА. Охлаждали до 10 С и порциями добавляли 24,6 г (0,178 моль) карбоната калия. Позволяли возвратиться до температуры окружающей среды и перемешивали в течение 30 мин. Охлаждали приблизительно до 10 С и по-4 016405 каплям вливали 10,1 мл (0,093 моль) N,N-диметилсульфамоил хлорида. Позволяли возвратиться до температуры окружающей среды и перемешивали в течение 2 ч. Реакционную смесь вливали в 600 г воды и льда и перемешивали в течение 1 ч при температуре окружающей среды. Образованный осадок отфильтровали и 3 раза промывали каждый раз 50 мл воды и затем высушивали в вакууме. Получали 21,3 г указанного в заглавии продукта. Выход = 83% ИК (чистота): 1670, 1278, 1150 см-1. Стадия 3. 2-(2-Циановинил)-4,5-диметоксифенил диметилсульфамат Добавляли 3,1 г (0,0773 моль) гидрида натрия порциями к раствору при 0 С 11,9 мл (0,0736 моль) диэтил цианометилфосфоната в 400 мл ТГФ. Смесь охлаждали до -10 С и по каплям добавляли суспензию 21,3 г (0,0736 моль) 2-формил-4,5-диметоксифенил диметилсульфамата в 200 мл ТГФ. Перемешивали в течение 30 мин и гидролизовали с 600 мл раствора гидрокарбоната натрия и воды (50/50) и затем раствор два раза экстрагировали каждый раз 300 мл толуола. Органическую фазу промывали 100 мл воды и 100 мл насыщенного водного раствора NaCl и затем высушивали над MgSO4, фильтровали и упаривали насухо. Полученный остаток кристаллизовали в 80 мл простого диизопропилового эфира при температуре окружающей среды и затем фильтровали и промывали 20 мл простого диизопропилового эфира и высушивали в вакууме. Получали 18,4 г указанного в заглавии продукта. Выход = 80% ИК (чистота): 2217, 1361, 1165 см-1. Стадия 4. 2-(2-Цианоэтил)-4,5-диметоксифенил диметилсульфамат Диспергировали 6,7 г (0,177 моль) борогидрида натрия в 150 мл ТГФ. По каплям вливали суспензию 18,4 г (0,059 моль) 2-(2-циановинил)-4,5-диметоксифенил диметилсульфамата в 200 мл ТГФ. По каплям вливали 48 мл метанола. Нагревали в течение 3 ч при 50 С и затем охлаждали и добавляли 1 г(0,026 моль) борогидрида натрия. Нагревали реакционную смесь при 50 С в течение 1 ч и затем перемешивали в течение ночи при температуре окружающей среды. Гидролизовали путем вливания в реакционную смесь 60 мл водного 4 н. раствора HCl, при этом температуру поддерживали приблизительно при 20 С. Добавляли 40 г льда и 30 мл воды и затем каждый раз 200 мл этилацетата. Органическую фазу промывали водой и насыщенным водным раствором NaCl и затем высушивали над MgSO4, фильтровали и упаривали насухо. Получали 17,4 г указанного в заглавии продукта. Выход = 94% ИК (чистота): 2246 см-1. Стадия 5. 3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбонитрил В атмосфере азота смешивали вместе 5,4 мл (0,0382 моль) дважды перегнанного диизопропиламина и 60 мл ТГФ. Смесь охлаждали до -50 С и по каплям вливали 15,3 мл (0,0382 моль) 2,5 н. раствора бутиллития в гексане. Температуре позволяли повышаться снова до -5 С и перемешивали в течение 10 мин. Раствор охлаждали до -60 С и по каплям вливали в раствор 3 г (0,00954 моль) 2-(2-цианоэтил)-4,5 диметоксифенил диметилсульфамата в 35 мл ТГФ. Температуре позволяли повышаться медленно снова до -24 С, при этом наблюдали с помощью ВЭЖХ за исчезновением реагента. Реакционную смесь добавляли к смеси воды и льда и экстрагировали этилацетатом. Органические фазы последовательно промывали 1 н. раствором гидроксида натрия, водным 1 н. раствором HCl, водой и насыщенным водным раствором NaCl и затем их высушивали над MgSO4, фильтровали, и растворители упаривали. Получали 2 г остатка, который очищали путем флэш-хроматографии на 70 г оксида кремния (элюант = дихлорметан),получая в результате 0,9 г указанного в заглавии продукта в виде белого твердого вещества. Выход = 50% Тпл. (KB) = 89-91 С Пример 4. (R,S)-3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбальдегид 10 г (52,8 ммоль) 3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбонитрила растворяли в 100 мл безводного толуола. Раствор охлаждали до -78 С и затем по каплям добавляли 55 мл раствора гидрида диизобутилалюминия (1,2 М в толуоле), при этом температуру поддерживали ниже -65 С (время добавления = 45 минут). Перемешивали в течение 1 часа при -78 С при завершении добавления. Гидролиз осуществляли путем добавления по каплям 20 мл метанола. Температуре позволяли возвратиться до 30 С и затем реакционную смесь добавляли к 200 мл HCl (0,1 н.) и два раза экстрагировали простым эфиром. Органическую фазу последовательно промывали водой и насыщенным водным раствором NaCl и затем высушивали над MgSO4, фильтровали и упаривали насухо, получая 8 г указанного в заглавии продукта в виде светло-желтого масла. Выход = 79 % ИК (чистота):= 2714, 2630, 1712 см-1. Пример 5.(R,S)-3-(3-[(3,4-Диметоксибицикло[4.2.0]окта-1,3)5-триен-7-ил)метил](метил)аминопропил)-7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он 8 г (52,4 ммоль, 1,2 эквивалента) (R,S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7 карбальдегида растворяли в смеси 150 мл безводного ТГФ и 20 мл дихлорметана. Добавляли 12,8 г (43,6 ммоль) 7,8-диметокси-3-[3-(метиламино)пропил]-1,3,4,5-тетрагидро-2H-3-бензазепин-2-она и 2,48 мл(43,6 ммоль) уксусной кислоты. Все компоненты охлаждали до 0 С и перемешивали в течение 30 мин. Затем добавляли 14 г (65,6 ммоль, 1,5 эквивалента) триацетоксиборогидрида натрия. Реакция была мгновенной. Упаривали насухо. После этого остаток ресуспендировали в 1 н. растворе гидроксида натрия и экстрагировали дихлорметаном. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и упаривали насухо, получая 20 г масла, которое очищали путем флэш-хроматографии на 800 г оксида кремния (элюант = дихлорметан/этанол/NH4OH : 90/10/1). Получали 16,8 г указанного в заглавии продукта в форме бесцветного масла, которое кристаллизовалось при температуре окружающей среды. Выход = 82% Тпл. (KB) = 98-100 С Пример 6. 3-3-(7S)-3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метил(метил)аминопропил-7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он гидрохлорид 2,1 г рацемического соединения, полученного в примере 5, разделяли на колонке 60 см 60 мм, заполненной 2,1 кг фазы Chiralpak AD (гранулометрия 20 мкм). Используемый элюант представлял собой смесь этанол/ацетонитрил/диэтиламин (10/90/0,1 по объему) при скорости потока 50 мл/мин. Использовали ассоциированный ультрафиолетовый детектор при длине волны 280 нм. Получали 0,95 г энантиомера, имеющего (R) конфигурацию, в форме белой меренги, и затем получали 0,95 г энантиомера, имеющего (S) конфигурацию, также в форме белой меренги. Затем получали гидрохлорид энантиомера, имеющего (S) конфигурацию, путем осуществления методики, описанной в описании к патенту ЕР 0534859 (пример 2, стадия Е). Пример 7. 3-3-(3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил)метил](метил)аминопропил 7,8-диметокси-1,3-дигидро-2H-3-бензазепин-2-он Растворяли 1,1 г (3,78 ммоль) 7,8-диметокси-3-[3-(метиламино)пропил]-1,3-дигидро-2H-3 бензазепин-2-она в 50 мл ТГФ и 7 мл дихлорметана. Добавляли 0,69 г (4,53 ммоль, 1,2 эквивалента) 3,4 диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбальдегида и 0,22 мл уксусной кислоты. Реакционную смесь охлаждали до 0 С и добавляли 1,2 г (5,67 ммоль, 1,5 эквивалента) триацетоксиборогидрида натрия. Реакция была мгновенной. Упаривали насухо. Остаток ресуспендировали в воде и водную фазу доводили до рН=8 путем добавления 20% раствора гидроксида натрия и экстрагировали дихлорметаном. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и упаривали насухо. Получали 1,7 г масла, которое очищали путем флэш-хроматографии на 100 г оксида кремния (элюант = дихлорметан/этанол/NH4OH: 95/5/0,5), получая в результате 1,4 г указанного в заглавии продукта в форме бесцветного масла. Выход = 79% ИК (чистота): =1656, 1607, 1511, 1273, 1206, 1102, 836, 760 см-1. Пример 8. 3-3-(7S)-3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метил(метил)аминопропил-7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он гидрохлорид 1,4 г рацемического соединения, полученного в примере 7, разделяли на колонке 60 см 60 мм, заполненной 3 кг фазы Chiralpak T101 (гранулометрия 20 мкм). Используемый элюант представлял собой смесь этанол/ацетонитрил/диэтиламин (10/90/0,1 по объему) при скорости потока 100 мл/мин. Использовали ассоциированный ультрафиолетовый детектор при длине волны 280 нм. Получали 0,56 г энантиомера, имеющего (R) конфигурацию, в форме бесцветного масла, затем получали 0,62 г энантиомера, имеющего (S) конфигурацию, также в форме бесцветного масла. После этого соединение, имеющее (S) конфигурацию, гидрировали с помощью методики, описанной в патентной заявке ЕР 0534859 (пример 1, стадия D). Гидрохлорид полученного соединения готовили путем осуществления методики, описанной в патентной заявке ЕР 0534859 (пример 2, стадия Е). Пример 9. 3-3-(7S)-3,4-Диметокси 6 ицикло[4.2.0]окта-1,3,5-триен-7-ил]метил(метил)амино]пропил-7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он гидрохлорид При осуществлении обработки, как описано в примере 5, используя в качестве исходного вещества(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбальдегид и 7,8-диметокси-3-[3(метиламино)пропил]-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он, получали основание ивабрадина, которое затем превращали в его гидрохлорид согласно методике, описанной в патентной заявке ЕР 0534859(пример 2, стадия Е). Пример 10. 3-3-(7S)-3,4-Диметоксибицикло[4.2.0]окта-1,3,5-триен-7-ил]метил(метил)амино 1 пропил-7,8-диметокси-1,3,4,5-тетрагидро-2H-3-бензазепин-2-он гидрохлорид При осуществлении обработки, как описано в примере 7, используя в качестве исходного вещества(7S)-3,4-диметоксибицикло[4.2.0]окта-1,3,5-триен-7-карбальдегид и 7,8-диметокси-3-[3-(метиламино)пропил]-1,3-дигидро-2H-3-бензазепин-2-он, получали соединение, которое гидрировали путем осуществления методики, описанной в патентной заявке ЕР 0534859 (пример 1, стадия D), получая основание ивабрадина, которое затем превращали в его гидрохлорид согласно методике, описанной в патентной заявке ЕР 0534859 (пример 2, стадия Е).-6 016405 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединения формулы (VI) в рацемической или оптически активной форме где А представляет собой Н 2 С-СН 2 или НС=СН,который отличается тем, что соединение формулы (VII) в рацемической или оптически активной форме подвергают реакции восстановительного аминирования с соединением формулы (VIII) где А имеет значение, указанное выше,в присутствии восстановителя, в органическом растворителе или смеси органических растворителей. 2. Способ синтеза по п.1, отличающийся тем, что соединение формулы (VII) находится в оптически активной форме. 3. Способ синтеза по п.2, отличающийся тем, что оптически активная форма представляет собой (S) конфигурацию. 4. Способ синтеза по п.2, отличающийся тем, что группа А представляет собой Н 2 С-СН 2 и продукт реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII),представляет собой ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. 5. Способ синтеза по п.3, отличающийся тем, что группа А представляет собой НС=СН и продукт реакции восстановительного аминирования соединения формулы (VII), имеющего (S) конфигурацию, с соединением формулы (VIII), представляет собой соединение формулы (V) при каталитическом гидрировании которого получают ивабрадин формулы (I)-7 016405 который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. 6. Способ синтеза по п.1, отличающийся тем, что соединение формулы (VII) находится в рацемической форме и реакцию восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII) осуществляют с последующей стадией оптического разделения полученного рацемического соединения формулы (VI). 7. Способ синтеза по п.6, отличающийся тем, что А представляет собой Н 2 С-СН 2 и продукт, полученный после стадии оптического разделения соединения формулы (VI), представляет собой ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. 8. Способ синтеза по п.6, отличающийся тем, что А представляет собой НС=СН и продукт, полученный после стадии оптического разделения соединения формулы (VI), представляет собой соединение формулы (V) при каталитическом гидрировании которого получают ивабрадин формулы (I) который необязательно может быть превращен в его соли присоединения с фармацевтически приемлемой кислотой, выбранной из хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, молочной кислоты, пировиноградной кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, фумаровой кислоты,винной кислоты, малеиновой кислоты, лимонной кислоты, аскорбиновой кислоты, щавелевой кислоты,метансульфоновой кислоты, бензолсульфоновой кислоты и камфорной кислоты, и в их гидраты. 9. Способ синтеза по любому из пп.1-8, отличающийся тем, что восстановитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), выбирают из триацетоксиборогидрида натрия, цианоборогидрида натрия и диводорода в присутствии катализатора, такого как палладий, платина, никель, рутений, родий и их производные. 10. Способ синтеза по п.9, отличающийся тем, что катализатор используется на подложке или в окисленной форме. 11. Способ синтеза по п.9, отличающийся тем, что восстановитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы(VIII), представляет собой триацетоксиборогидрид натрия. 12. Способ синтеза по любому из пп.1-11, отличающийся тем, что растворитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы (VIII), выбирают из тетрагидрофурана, дихлорметана, 1,2-дихлорэтана, ацетатов, этанола, метанола или изопропанола, толуола и ксилола. 13. Способ синтеза по п.12, отличающийся тем, что растворитель, используемый для осуществления реакции восстановительного аминирования соединения формулы (VII) с соединением формулы(VIII), представляет собой смесь тетрагидрофурана и дихлорметана. 14. Соединение формулы (VII) в рацемической или оптически активной форме
МПК / Метки
МПК: C07C 47/47, C07D 223/16
Метки: синтеза, приемлемой, кислотой, способ, фармацевтически, присоединения, солей, ивабрадина
Код ссылки
<a href="https://eas.patents.su/10-16405-sposob-sinteza-ivabradina-i-ego-solejj-prisoedineniya-s-farmacevticheski-priemlemojj-kislotojj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза ивабрадина и его солей присоединения с фармацевтически приемлемой кислотой</a>
Предыдущий патент: Последовательное соединение электролизеров и способ работы соединенных таким образом электролизеров
Следующий патент: Узел седла шарового клапана и способ регулирования потока текучей среды через полый корпус
Случайный патент: Способ очистки щебня пути












