Стабильная полиморфная модификация флибансерина, способ её промышленного получения и её применение для получения лекарственных средств
Номер патента: 6400
Опубликовано: 29.12.2005
Авторы: Эцайя Антоине, Шнайдер Генрих, Дубини Энрика, Бомбарда Карло
Формула / Реферат
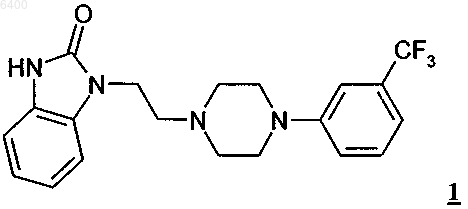
1. Кристаллическая полиморфная модификация A (форма A) флибансерина формулы 1
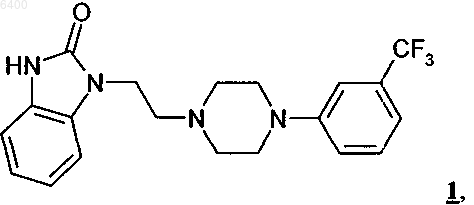
у которой эндотермический максимум при ее термическом анализе дифференциальной сканирующей калориметрией приходится на температуру 161шC.
2. Флибансерин формулы 1, включающий форму A по п.1.
3. Способ получения флибансерина формулы 1 по п.1 или 2
отличающийся тем, что на первой стадии бензимидазолон формулы 2
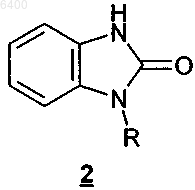
в которой R обозначает аминозащитную группу, подвергают взаимодействию с пиперазином формулы 3
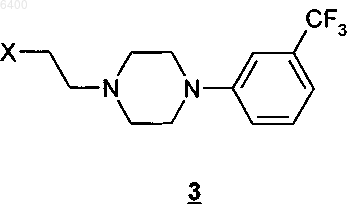
в которой X обозначает уходящую группу, выбранную из хлора, брома, иода, метансульфоната, трифторметансульфоната и пара-толуолсульфоната, в приемлемом растворителе, выбранном из группы, включающей воду, спирты, смеси воды со спиртами, полярные апротонные растворители и их смеси с водой, в присутствии приемлемого основания, и на второй стадии удаляют аминозащитную группу R в приемлемых для такого удаления условиях.
4. Способ по п.3, отличающийся тем, что взаимодействие соединения формулы 2 с соединением формулы 3 проводят при температуре, составляющей по меньшей мере 50шC.
5. Способ по п.4, отличающийся тем, что нагретую до необходимой температуры реакционную смесь выдерживают при этой температуре в течение промежутка времени, составляющего примерно от 10 мин до примерно 12 ч.
6. Полиморфная модификация A флибансерина формулы 1, получаемая способом по одному из пп.3-5.
7. Полиморфная модификация A флибансерина формулы 1 по п.1, 2 или 6 для применения в качестве лекарственного средства.
8. Применение полиморфной модификации A флибансерина формулы 1 по п.1, 2 или 6 для получения лекарственного средства, предназначенного для лечения заболеваний, при которых применение соединений, обладающих сродством к 5-HT1A- и 5-HT2-рецепорам, в терапевтически эффективных количествах оказывает эффективное терапевтическое действие.
9. Применение полиморфной модификации A флибансерина формулы 1 по п.1, 2 или 6 для получения лекарственного средства, предназначенного для лечения заболеваний, выбранных из группы, включающей депрессию, шизофрению, болезнь Паркинсона, состояния тревоги, нарушения сна, сексуальные и психические расстройства и возрастные нарушения памяти.
10. Фармацевтические композиции, содержащие в качестве действующего вещества полиморфную модификацию A флибансерина формулы 1 по п.1, 2 или 6, необязательно в смеси с одним или несколькими фармацевтическими носителями, разбавителями или эксципиентами.
Текст
006400 Настоящее изобретение относится к полиморфной модификации А флибансерина, к способу ее промышленного получения, а также к ее применению для получения лекарственных средств. Предпосылки создания изобретения Соединение 1-[2-(4-(3-трифторметилфенил)пиперазин-1-ил)этил]-2,3-дигидро-1 Н-бензимидазол-2 он (флибансерин) описано в форме его гидрохлорида в заявке ЕР-А 526434 и имеет следующую химическую структуру Флибансерин проявляет сродство (аффинность) к 5-HT1A- И 5-НТ 2-рецепторам. С учетом этого такое соединение является перспективным терапевтическим агентом, который может использоваться для лечения различных заболеваний, например депрессии, шизофрении, болезни Паркинсона, состояний тревоги, нарушений сна, сексуальных и психических расстройств, а также возрастных нарушений памяти. Очевидно, что основным предварительным условием, соблюдение которого служит необходимой предпосылкой для начала коммерческого производства фармацевтического действующего вещества и его поступления в продажу в качестве апробированного лекарственного средства, является точное определение его фармацевтической активности. Однако к фармацевтическому действующему веществу предъявляется и целый ряд различных иных требований. Подобные требования, которым должно удовлетворять фармацевтическое действующее вещество, основаны на различных параметрах, связанных с природой самого действующего вещества. В качестве примера таких параметров можно назвать, но не ограничиваясь только ими, стабильность действующего вещества в различных окружающих условиях,его стабильность в процессе приготовления лекарственного средства, а также его стабильность в конечных лекарственных препаратах. Фармацевтическое действующее вещество, используемое для получения фармацевтических препаратов или композиций, должно обладать максимально возможной степенью чистоты, а также должно оставаться стабильным при его длительном хранении в различных окружающих условиях. Обязательное соблюдение этого требования обусловлено необходимостью исключить применение лекарственных препаратов, в которых наряду с собственно действующим веществом присутствуют, например, продукты его разложения. В этих случаях лекарственный препарат может содержать действующее вещество в количестве, которое меньше указанного производителем. Важное значение имеет далее равномерное распределение действующего вещества в лекарственной композиции и, в частности, при необходимости его введения в низкой дозировке. Обеспечить равномерное распределение действующего вещества в лекарственной композиции можно за счет уменьшения крупности его частиц до приемлемого уровня, например, измельчением. Поскольку при получении лекарственного препарата следует по возможности практически полностью исключить разложение фармацевтического действующего вещества, сопутствующее его измельчению (или микронизации), несмотря на наличие жестких условий, необходимых для проведения этого процесса, обязательным требованием, которому должно удовлетворять действующее вещество, является его высокая стабильность в процессе измельчения. Получение гомогенной фармацевтической композиции с постоянно воспроизводимым заданным содержанием в ней действующего вещества возможно только при достаточно высокой его стабильности в процессе его измельчения. Другая проблема, которая может возникать в процессе измельчения действующего вещества при получении требуемой фармацевтической композиции, связана с сопровождающим подобный процесс подводом энергии к кристаллам и с приложением к их поверхности механической нагрузки. При определенных условиях указанные факторы могут приводить к полиморфным изменениям, к превращению кристаллической структуры в аморфную или к изменению кристаллической решетки. Поскольку для получения фармацевтической композиции требуемого фармацевтического качества необходимо обеспечить наличие у кристаллов действующего вещества всегда одной и той же морфологии, к стабильности и свойствам кристаллического действующего вещества с учетом этого аспекта также предъявляются повышенные требования. Стабильность фармацевтического действующего вещества в фармацевтических композициях имеет далее важное значение для установления срока годности конкретного лекарственного средства, который определяется как промежуток времени, в течение которого лекарственное средство можно без какоголибо риска вводить в организм. По этой причине наличие у действующего вещества, входящего в состав указанных лекарственных средств, высокой стабильности при различных условиях хранения является еще одним преимуществом и для пациента, и для производителя. Помимо рассмотренных выше требований, предъявляемых к фармацевтическим действующим веществам, в целом следует учитывать и тот факт, что любое изменение твердофазного состояния фармацевтической композиции, позволяющее улучшить ее физическую и химическую стабильность, обеспечивает достижение существенных преимуществ перед обладающими меньшей стабильностью формами-1 006400 того же самого лекарственного средства. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача получить новую стабильную кристаллическую форму флибансерина, которая удовлетворяла бы указанным выше строгим требованиям, предъявляемым к фармацевтическим действующим веществам. Подробное описание изобретения При создании изобретения неожиданно было установлено, что флибансерин в виде свободного основания в определенной полиморфной модификации удовлетворяет указанным выше требованиям. При создании изобретения было установлено также, что в зависимости от выбора условий, которые можно использовать в процессе синтеза флибансерина, он образуется в виде свободного основания в различных кристаллических модификациях, а именно в полиморфных модификациях А и В. Так, в частности, было установлено, что возможность целенаправленного получения подобных различных модификаций определяется соответствующим выбором технологических условий проведения процесса синтеза флибансерина. Помимо этого неожиданно было установлено, что полиморфная модификация А, которую можно получать в кристаллической форме за счет выбора особых условий проведения реакции, удовлетворяет указанным выше строгим требованиям и тем самым позволяет решить положенную в основу изобретения задачу. В соответствии с этим в настоящем изобретении предлагается полиморфная модификация А флибансерина. Температура плавления этой полиморфной модификации А флибансерина составляет около 161 С (при определении с помощью дифференциальной сканирующей калориметрии (ДСК) при скорости нагрева 10 К/мин). Полиморфная модификация В является менее стабильной модификацией флибансерина с температурой плавления около 120 С (при определении с помощью ДСК при скорости нагрева 10 К/мин). В отличие от полиморфной модификации В, которая проявляет меньшую стабильность под воздействием,например, механической нагрузки в процессе измельчения, полиморфная модификация А удовлетворяет вышеупомянутым требованиям к стабильности фармацевтического действующего вещества. Еще одним объектом настоящего изобретения является способ получения полиморфной модификации А флибансерина в промышленном масштабе. Этот предлагаемый в изобретении способ проиллюстрирован на схеме 1. Схема 1 В соответствии с этой схемой бензимидазолон формулы 2 подвергают в щелочных реакционных условиях в приемлемом растворителе взаимодействию с производным пиперазина формулы 3 с получением соединения формулы 1. Группа R в соединении формулы 2 обозначает аминозащитную группу. Такой защитной группой может служить любая из групп, которые обычно используются для защиты функциональной аминогруппы. В качестве примера подобных защитных групп можно назвать алкил,замещенный алкил, гетерозамещенный алкил, ненасыщенный алкил, алкилзамещенные гетероатомы,замещенный либо незамещенный фенил, замещенный либо незамещенный бензил, а также алкоксикарбонильные и арилоксикарбонильные группы. Предпочтительными защитными группами являются бутил,1,1-дифенилметил, метоксиметил, бензилоксиметил, трихлорэтоксиметил, пирролидинометил, цианометил, пивалоилоксиметил, аллил, 2-пропенил, трет-бутилдиметилсиллил, метоксигруппу, тиометил, 4 метоксифенил, бензил, 4-метоксибензил, 2,4-диметоксибензил, 2-нитробензил,трет-бутоксикарбонил,бензилоксикарбонил, феноксикарбонил, 4-хлорфеноксикарбонил, 4-нитрофеноксикарбонил, метоксикарбонил и этоксикарбонил. Среди этих защитных групп наиболее предпочтительными являются третбутоксикарбонил, этоксикарбонил, метоксикарбонил, бензилоксикарбонил, феноксикарбонил и 2 пропенил, при этом последняя из указанных групп является наиболее предпочтительной. X в соединении формулы 3 обозначает уходящую группу, выбранную их хлора, брома, иода, метансульфоната, трифторметансульфоната и трет-толуолсульфоната. Предпочтительно X представляет собой хлор, бром или иод,из которых хлор является наиболее предпочтительным. В качестве соответствующих растворителей для проведения реакции можно использовать воду, спирты, смеси воды со спиртами, а также полярные апротонные растворители и их смеси с водой. Предпочтительными для проведения реакции растворителями являются диметилформамид, диметилсульфоксид, ацетонитрил, тетрагидрофуран, диоксан, метанол,этанол, изопропанол и смеси одного или нескольких указанных растворителей с водой. Наиболее предпочтительно использовать хорошо смешивающиеся с водой растворители. Предпочтительно при этом-2 006400 использовать в качестве растворителя смесь воды с одним из таких спиртов, как метанол, этанол или изопропанол. В предпочтительном варианте в качестве растворителя используют смесь воды и изопропанола. В качестве основания можно использовать карбонаты щелочных или щелочно-земельных металлов, таких как литий, натрий, калий и кальций, т.е. карбонат натрия, карбонат лития, карбонат калия и карбонат кальция, предпочтительным из которых является карбонат калия. Помимо этого в качестве основания можно также использовать гидрокарбонаты лития, натрия и калия. В другом предпочтительном варианте можно также использовать гидроксиды щелочных или щелочно-земельных металлов, таких как литий, натрий, калий, магний и кальций, при этом более предпочтительно использовать растворы гидроксида натрия, гидроксида калия, гидроксида лития и гидроксида кальция в спиртах или в воде. Наиболее предпочтительным основанием является гидроксид натрия. Основание предпочтительно добавлять к реакционной смеси в виде его водного раствора, предпочтительно в виде его концентрированных водных растворов, например с концентраций от 30 до 50% в отношении массы к объему. В предпочтительном варианте используют водный раствор гидроксида натрия с концентрацией примерно 45% в отношении массы к объему. Соединения формул 2 и 3 подвергают взаимодействию между собой с молярном соотношении от 1:1 до 1:2, предпочтительно от 1:1,1 до 1:1,5. Как указано выше, предпочтительной для проведения реакции в соответствии с предлагаемым в изобретении способом смесью растворителей является смесь воды и изопропанола. В такой смеси массовое соотношение между водой и изопропанолом предпочтительно составляет от 10:1 до 1:1, более предпочтительно от 8:1 до 3:1, наиболее предпочтительно от 7:1 до 5:1. На моль соединения формулы 2 вышеуказанную смесь растворителей используют в количестве примерно от 2 до 10 кг, предпочтительно от 3 до 8 кг, наиболее предпочтительно от 4 до 7 кг. В предпочтительном варианте реакцию проводят с использованием в качестве основания водного раствора гидроксида натрия с концентрацией примерно 45% в отношении массы к объему. На моль соединения формулы 2 такой раствор гидроксида натрия используют в количестве примерно от 0,1 до 1,5 кг, предпочтительно от 0,2 до 1,0 кг, наиболее предпочтительно от 0,3 до 0,6 кг. Реакционную смесь, состоящую из соединений формул 2, 3 и основания, растворенных в приемлемом растворителе из числа указанных выше, предпочтительно нагревают до температуры по меньшей мере 50 С. В предпочтительном варианте реакцию проводят в интервале температур от 60 С до температуры кипения используемого растворителя. Наиболее предпочтительно проводить реакцию в интервале температур от 70 до 90 С. Реакционную смесь выдерживают при указанной температуре в течение промежутка времени, составляющего от примерно 10 мин до примерно 12 ч, предпочтительно от примерно 15 мин до примерно 6 ч, более предпочтительно от примерно 30 мин до примерно 3 ч. Наиболее предпочтительная длительность выдержки реакционной смеси при вышеуказанной температуре составляет примерно от 45 до 60 мин. На следующей стадии удаляют защитную группу R. Условия удаления защитной группы зависят от выбора группы R. Так, например, если R обозначает бензил, то такую защитную группу удаляют гидрированием в уксусной кислоте в присутствии приемлемого катализатора (например Pd на угле) или же ее удаляют обработкой водной НВr. В том же случае, если R обозначает метоксикарбонил, этоксикарбонил,феноксикарбонил или 4-нитрофеноксикарбонил, такую защитную группу можно удалять, например, обработкой водными растворами щелочей, такими как (водный) раствор NaOH или (водный) раствор KОН. Если же R обозначает трет-бутоксикарбонил, то его можно удалять, например, в водной НСl или НВ 2. Если R обозначает 2-пропенил, который является предпочтительной защитной группой, то в этом случае его удаляют в кислой реакционной среде. В наиболее предпочтительном варианте 2-пропенильную группу удаляют обработкой сильной минеральной кислотой, предпочтительно кислотой, выбранной из группы, включающей бромисто-водородную кислоту, хлористо-водородную кислоту и серную кислоту, более предпочтительно обработкой хлористо-водородной кислотой. Хлористо-водородную кислоту можно добавлять к реакционной смеси в газообразном виде или же в виде ее водных растворов, при этом ее добавление в виде водных растворов является предпочтительным. Хлористо-водородную кислоту особо предпочтительно добавлять в виде ее концентрированного раствора (примерно 36%-ного в отношении массы к объему). На моль соединения формулы 2 следует добавлять по меньшей мере один моль хлористо-водородной кислоты. Добавляемое к реакционной смеси количество концентрированной хлористоводородной кислоты (36%-ной в отношении массы к объему) предпочтительно составляет от 50 до 500 г,более предпочтительно от 80 до 250 г, на моль соединения формулы 2. На моль используемого соединения формулы 2 наиболее предпочтительно добавлять примерно от 120 до 160 г концентрированной водной хлористо-водородной кислоты (36%-ной в отношении массы к объему). При необходимости к реакционной смеси можно добавлять дополнительное количество воды. По завершении реакции примерно от 30 до 70%, предпочтительно от 35 до 60%, растворителя удаляют путем его отгонки при температуре примерно от 70 до 90 С. Затем значение рН остатка добавлением водного гидроксида натрия (45%-ного в отношении массы к объему) устанавливают при температуре от 60 до 80 С примерно на 5-9, предпочтительно примерно на 6-8. После этого значение рН добавлением водного гидроксида натрия (45%-ного в отношении массы к объему) устанавливают при температуре примерно от 40 до 55 С примерно на 8-9. Затем реакционную смесь охлаждают до температуры примерно 20-40 С, предпочтительно примерно 3035 С, и центрифугируют. Полученный в результате остаток промывают водой в количестве примерно от-3 006400 100 до 750 мл, предпочтительно от 200 до 500 мл, наиболее предпочтительно от примерно 300 до 400 мл,на моль используемого соединения формулы 2 и изопропанолом (в количестве примерно от 50 до 250 г,предпочтительно от примерно 100 до 200 г, на моль соединения формулы 2), а затем вновь промывают водой до полного удаления хлоридов. Полученный таким путем продукт при необходимости можно подвергать дополнительной очистке. Предпочтительно такую очистку проводить путем кристаллизации соединения формулы 1, например из ацетона. Еще одним объектом настоящего изобретения является полиморфная модификация А флибансерина, получаемая описанным выше способом. Ниже способ получения полиморфной модификации А флибансерина проиллюстрирован на примере ее синтеза. Следует, однако, отметить, что в этом примере рассмотрен только один из возможных вариантов осуществления изобретения, не ограничивающий его объем. Пример. В реактор, содержащий 2500 кг воды и 200 кг 45%-ного водного гидроксида натрия, загружают 375 кг 1-[(3-трифторметил)фенил]-4-(2-хлорэтил)пиперазина. Затем при перемешивании добавляют 169,2 кг 1-(2-пропенил)-1,3-дигидробензимидазол-2 Н-она, 780 кг изопропанола, 2000 кг воды и 220 кг 45%-ного водного гидроксида натрия. Реакционную смесь нагревают до 75-85 С и добавляют 160 кг концентрированной соляной кислоты и 200 кг воды. Реакционную смесь перемешивают при постоянной температуре в течение примерно 45 мин. Осадок, полученный после отгонки смеси воды и изопропанола (около 3000 кг), охлаждают до температуры приблизительно 65-75 С и его значение рН устанавливают на 6,5-7,5 добавлением 125 кг 45%-ного водного гидроксида натрия. После охлаждения остатка до температуры примерно 45-50 С его значение рН устанавливают на 8-9 добавлением примерно 4 кг 45%-ного водного гидроксида натрия. Затем реакционную смесь охлаждают до 30-35 С и центрифугируют. Полученный в результате остаток промывают 340 л воды и 126 л изопропанола, а затем водой до полного удаления хлоридов. Влажный продукт сушат в вакууме при 45-55 С, получая 358 кг сырого флибансерина в виде его полиморфной модификации А. Полученный таким путем сырой продукт загружают в реактор, содержащий 1750 кг ацетона, и полученную смесь при перемешивании нагревают с обратным холодильником. Затем полученный раствор фильтруют и фильтрат концентрируют перегонкой. Далее в течение примерно 1 ч температуру поддерживают на уровне 0-5 С, после чего выпавшее в осадок твердое вещество отделяют фильтрацией и сушат при 55 С в течение по меньшей мере 12 ч. Окончательный выход чистого флибансерина в полиморфной модификации А составляет 280 кг. Характеристики описанной выше полиморфной модификации А флибансерина определяли с помощью ДСК (дифференциальная сканирующая калориметрия). По данным ДСК-анализа эндотермический максимум для полиморфной модификации А флибансерина приходится на температуру примерно 161 С. Для определения характеристик полиморфной модификации А флибансерина с помощью ДСК использовали систему Mettler ТА 3000, оснащенную процессором ТС 10-А и ячейкой DSC 20. Данные получали при скорости нагрева 10 К/мин. Характеристики полиморфной модификации А флибансерина определяли также рентгеновской порошковой дифрактометрией. Порошковую рентгенограмму полиморфной модификации А получали с использованием следующих условий. Оборудование: дифрактометр Philips PW 1800/10, оснащенный цифровым компьютером MicroVax 2000 Установочные параметры Рентгеновское излучение: тип трубки: Сu (длинная острая фокусировка) длины волн : K1 = 1,54060 , K2= 1,54439 соотношение интенсивностей (2/1): 0,500 начальный угол [2]: 2,000 конечный угол [2]: 60,000 шаг сканирования [2]: 0,020 максимальная интенсивность [с]: 7310,250 режим сканирования: непрерывный минимальная ширина пика у вершины: 0,00 максимальная ширина пика у вершины: 1,00 базовая ширина пика: 2,00 минимальная значимость: 0,75 количество пиков: 69 Генератор высокое напряжение: 50 кВ сила тока на трубке: 30 мА Порошковая рентгенограмма, полученная для полиморфной модификации А, представлена на прилагаемом к описанию чертеже. Соответствующие этой рентгенограмме значения приведены ниже в таблице. С учетом фармацевтической эффективности флибансерина еще одним объектом настоящего изобретения является применение полиморфной модификации А флибансерина в качестве лекарственного средства. Следующим объектом настоящего изобретения является применение полиморфной модификации А-5 006400 флибансерина для получения фармацевтической композиции, предназначенной для лечения заболеваний,при которых применение соединений, обладающих сродством к 5-HT1A- И 5-НТ 2-рецепторам, может оказывать эффективное терапевтическое действие. Еще одним объектом настоящего изобретения является применение полиморфной модификации А флибансерина для получения фармацевтической композиции, предназначенной для лечения заболеваний,выбранных из группы, включающей депрессию, шизофрению, болезнь Паркинсона, состояния тревоги,нарушения сна, сексуальные и психические расстройства, а также возрастные нарушения памяти. Настоящее изобретение относится, в частности, к применению полиморфной модификации А флибансерина для получения лекарственного средства, предназначенного для лечения расстройств полового влечения. В предпочтительном варианте настоящее изобретение относится к применению полиморфной модификации А флибансерина для получения лекарственного средства, предназначенного для лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение, потерю полового влечения, отсутствие полового влечения, снижение полового влечения, подавление полового влечения, потерю либидо, нарушение либидо и фригидность. Наиболее предпочтительным является согласно изобретению применение полиморфной модификации А флибансерина для получения лекарственного средства, предназначенного для лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение, потерю полового влечения, отсутствие полового влечения, снижение полового влечения и подавление полового влечения. В особо предпочтительном варианте изобретение относится к применению полиморфной модификации А флибансерина для получения лекарственного средства, предназначенного для лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение и потерю полового влечения. Упомянутый выше терапевтический эффект от применения полиморфной модификации А флибансерина может в одинаковой степени проявляться и при лечении мужчин, и при лечении женщин. Однако в соответствии еще с одним объектом настоящего изобретения в нем предлагается применение полиморфной модификации А флибансерина для получения лекарственного средства, предназначенного для лечения сексуальной дисфункции у женщин. Положительный эффект от применения полиморфной модификации А флибансерина можно наблюдать вне зависимости от того, является ли то или иное расстройство или нарушение врожденным или же приобретенным, а также вне зависимости от его этиологии (обусловлено ли оно органическими факторами, к которым относятся и физические, и индуцированные лекарствами факторы, психогенными факторами, сочетанием органических факторов, к которым относятся и физические, и индуцированные лекарствами факторы, и психогенных факторов или же не установленными факторами). В изобретении предлагаются также фармацевтические композиции, которые помимо одного или нескольких фармацевтических носителей, разбавителей или эксципиентов содержат в качестве действующего вещества полиморфную модификацию А флибансерина. Для фармацевтического применения полиморфную модификацию А флибансерина можно включать в состав обычного фармацевтического препарата в твердой или жидкой форме либо в виде спрея. Предлагаемая в изобретении фармацевтическая композиция может быть представлена в форме, пригодной для перорального, ректального или парентерального введения либо для назальной ингаляции, при этом к предпочтительным лекарственным формам относятся, например, капсулы, таблетки, таблетки с покрытием, ампулы, суппозитории и назальный спрей. Действующее вещество можно заделывать в обычно используемые в фармацевтических композициях эксципиенты или носители, такие, например, как тальк, гуммиарабик, лактоза, желатин, стеарат магния, кукурузный крахмал, водные или неводные наполнители, поливинилпиррлидон, полусинтетические глицериды жирных кислот, бензалконийхлорид, фосфат натрия, ЭДТК и полисорбат 80. Фармацевтические композиции предпочтительно получать в виде рассчитанных на одно введение в организм лекарственных форм, каждая из которых содержит действующее вещество в унифицированной разовой дозе. Содержание действующего вещества в каждой лекарственной форме, рассчитанной на одно введение в организм, может составлять от 0,01 до 100 мг, предпочтительно от 0,1 до 50 мг. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая полиморфная модификация А (форма А) флибансерина формулы 1 у которой эндотермический максимум при ее термическом анализе дифференциальной сканирующей-6 006400 калориметрией приходится на температуру 161 С. 2. Флибансерин формулы 1, включающий форму А по п.1. 3. Способ получения флибансерина формулы 1 по п.1 или 2 отличающийся тем, что на первой стадии бензимидазолон формулы 2 в которой X обозначает уходящую группу, выбранную из хлора, брома, иода, метансульфоната, трифторметансульфоната и пара-толуолсульфоната, в приемлемом растворителе, выбранном из группы,включающей воду, спирты, смеси воды со спиртами, полярные апротонные растворители и их смеси с водой, в присутствии приемлемого основания, и на второй стадии удаляют аминозащитную группу R в приемлемых для такого удаления условиях. 4. Способ по п.3, отличающийся тем, что взаимодействие соединения формулы 2 с соединением формулы 3 проводят при температуре, составляющей по меньшей мере 50 С. 5. Способ по п.4, отличающийся тем, что нагретую до необходимой температуры реакционную смесь выдерживают при этой температуре в течение промежутка времени, составляющего примерно от 10 мин до примерно 12 ч. 6. Полиморфная модификация А флибансерина формулы 1, получаемая способом по одному из пп.3-5. 7. Полиморфная модификация А флибансерина формулы 1 по пп.1, 2 или 6 для применения в качестве лекарственного средства. 8. Применение полиморфной модификации А флибансерина формулы 1 по пп.1, 2 или 6 для получения лекарственного средства, предназначенного для лечения заболеваний, при которых применение соединений, обладающих сродством к 5-НТ 1 А- и 5-НТ 2-рецепорам, в терапевтически эффективных количествах оказывает эффективное терапевтическое действие. 9. Применение полиморфной модификации А флибансерина формулы 1 по пп.1, 2 или 6 для получения лекарственного средства, предназначенного для лечения заболеваний, выбранных из группы,включающей депрессию, шизофрению, болезнь Паркинсона, состояния тревоги, нарушения сна, сексуальные и психические расстройства и возрастные нарушения памяти. 10. Фармацевтические композиции, содержащие в качестве действующего вещества полиморфную модификацию А флибансерина формулы 1 по пп.1, 2 или 6, необязательно в смеси с одним или несколькими фармацевтическими носителями, разбавителями или эксципиентами.
МПК / Метки
МПК: A61P 25/00, A61K 31/495, C07D 403/06
Метки: стабильная, получения, промышленного, применение, способ, флибансерина, лекарственных, средств, полиморфная, модификация
Код ссылки
<a href="https://eas.patents.su/9-6400-stabilnaya-polimorfnaya-modifikaciya-flibanserina-sposob-eyo-promyshlennogo-polucheniya-i-eyo-primenenie-dlya-polucheniya-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Стабильная полиморфная модификация флибансерина, способ её промышленного получения и её применение для получения лекарственных средств</a>
Предыдущий патент: Способ получения изоцианатов арилсульфоновой кислоты
Следующий патент: Замедлитель горения полимерных материалов
Случайный патент: Буровой двигатель в сборе












