Новые производные индолина, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 5620
Опубликовано: 28.04.2005
Авторы: Лавиелль Жильбер, Миллан Марк, Мюллер Оливье, Гобер Ален
Формула / Реферат
1. Соединения формулы (I)
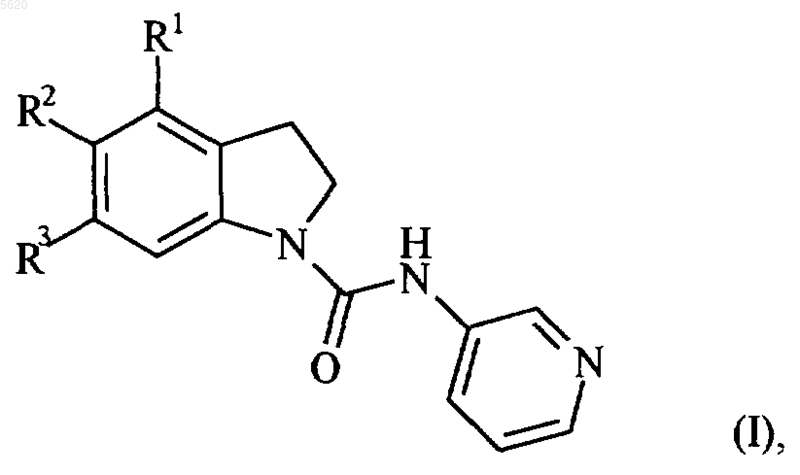
в которой R1 и R2 вместе образуют бензокольцо, необязательно замещенное атомом галогена или алкильной группой, алкоксигруппой, цианогруппой, нитрогруппой, гидроксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой или трифторметильной группой, и R3 обозначает атом водорода, или
R1 обозначает атом водорода и R2 и R3 вместе образуют бензокольцо, необязательно замещенное атомом галогена или алкильной группой, алкоксигруппой, цианогруппой, нитрогруппой, гидроксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой или трифторметильной группой,
их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием,
при этом понимают, что термин "алкил" обозначает линейную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, термин "алкокси" обозначает линейную или разветвленную алкилоксигруппу, содержащую от 1 до 6 атомов углерода.
2. Соединения формулы (I) по п.1, в которой R1 и R2 вместе образуют бензокольцо, которое незамещено или замещено группой, выбранной из метоксигруппы или цианогруппы, и R3 обозначает атом водорода, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединение формулы (I) по п.1 или 2, которое представляет собой N-(3-пиридил)-1,2-дигидро-3H-бензо[e]индол-3-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединение формулы (I) по п.1 или 2, которое представляет собой 7-метокси-N-(3-пиридил)-1,2-дигидро-3H-бензо[e]индол-3-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединение формулы (I) по п.1 или 2, которое представляет собой 6-циано-N-(3-пиридил)-1,2-дигидро-3H-бензо[e]индол-3-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединение формулы (I) по п.1, которое представляет собой N-(3-пиридил)-2,3-дигидро-1H-бензо[f]индол-1-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Способ получения соединения формулы (I), по п.1, отличающийся тем, что в качестве исходного вещества используют бензоиндол формулы (II)
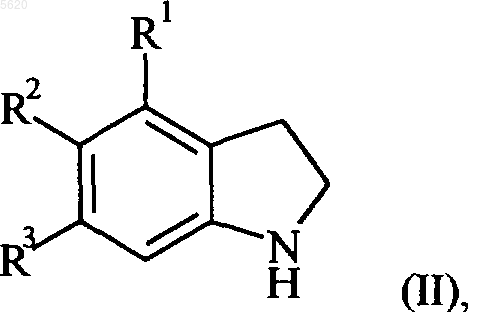
в которой R1, R2 и R3 принимают значения, указанные для формулы (I), который конденсируют, при нагревании, с соединением формулы (III)
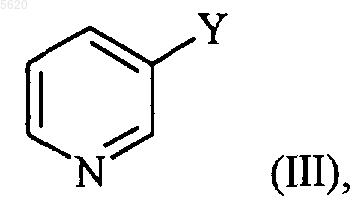
в которой Y обозначает группу -N=C=O или -C(O)-N3,
с получением соединения формулы (I),
которое, при необходимости, можно очистить согласно обычной методике очистки,
которое разделяют на его изомеры (диастереоизомеры и энантиомеры) по обычной методике разделения,
которое, при желании, преобразуют в его соли присоединения с фармацевтически приемлемой кислотой или основанием,
понимают, что индолин формулы (II) получают известными способами, например, начиная с соответствующего производного нитронафтилацетонитрила.
8. Фармацевтическая композиция, включающая как активный ингредиент по крайней мере одно соединение по любому из пп.1-6, самостоятельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителелями.
9. Фармацевтическая композиция по п.8, включающая по крайней мере один активный ингредиент по любому из пп.1-6, для использования в производстве медикаментов 5-HT2C антагонистов.
10. Фармацевтическая композиция по п.8, включающая по крайней мере один активный ингредиент по любому из пп.1-6, для применения в производстве медикаментов для использования при лечении депрессии, беспокойства, импульсивных расстройств, шизофрении, болезни Паркинсона, мигрени, когнитивных расстройств, расстройств либидо и половых дисфункций, расстройств сна и расстройств аппетита, таких как булимия и анорексия.
Текст
005620 Настоящее изобретение касается новых производных индолина, обладающих свойствами 5-НТ 2 С антагониста, способа их получения и фармацевтических композиций, содержащих их. Рецепторы 5-НТ 2 С приводят в действие ингибиторный контроль над допаминергической и норадренергической передачей (Neuropharmacology, 1997, 36, 609, J. Psychopharmacol. 2000, 14 (2), 114-138). Предполагается, что 5-НТ 2C антагонисты являются полезными при лечении многочисленных патологий центральной нервной системы (ЦНС). Можно отметить некоторые из этих расстройств, при этом данный перечень не будет полностью исчерпывающим, такие как беспокойство (Br. J. Pharmacol., 1996, 117, 427),депрессия (Pharmacol. Biochem. Behav., 1988, 29, 819-820), импульсивные расстройства (Biol. Psych.,1993, 33, 3-14), половые дисфункции (J. Pharmacol., 1997, 11, 72), болезнь Паркинсона (Drug News Perspect., 1999, 12, 477), мигрень (Life Sci., 1994, 54, 641-644), когнитивные расстройства (Neurosci.Biobehav. Rev., 1999, 23, 1111-1125), расстройства сна (Neuropharmacology, 1994, 33, (3/4), 467-471), шизофрения (Neurosci. Lett., 1996, 181, 65) и расстройства аппетита, такие как булимия и анорексия (BritishJ. Pharmacol., 1998, 123, 1707-1715). Настоящее изобретение касается новых производных индолина, которые отличаются от соединений, описанных в заявках WO 9529177 и WO 9748699, не только отсутствием пиридилокси заместителя на 3-пиридиламинокарбонильной группе индолина, но также, особенно, наличием бензогруппы, присоединенной к индолиновой группе. Неожиданно оказалось, что такие структурные изменения обеспечивают соединения изобретения фармакологическими активностями, которые явно превосходят фармакологические активности соединений описанных в заявках WO 9529177 и WO 9748699. Найдено, что соединения изобретения являются особенно активными при пероральном пути применения. Таким образом, использование бензоиндолинового радикала, в соединениях изобретения, сделало возможным значительное улучшение фармакологических свойств. В частности, настоящее изобретение касается соединений формулы (I)R1 и R2 вместе образуют бензокольцо, необязательно замещенное атомом галогена или алкильной группой, алкоксигруппой, цианогруппой, нитрогруппой, гидроксигруппой, аминогруппой, алкиламино группой, диалкиламиногруппой или трифторметильной группой, и R3 обозначает атом водорода,илиR1 обозначает атом водорода, и R2 и R3 вместе образуют бензокольцо, необязательно замещенное атомом галогена или алкильной группой, алкоксигруппой, цианогруппой, нитрогруппой, гидроксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой, или трифторметильной группой,их энантиомеров и диастереоизомеров, а также их солей присоединения с фармацевтически приемлемой кислотой или основанием,при этом понимают, что- термин "алкил" обозначает линейную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода,- термин "алкокси" обозначает линейную или разветвленную алкилоксигруппу, содержащую от 1 до 6 атомов углерода. Среди фармацевтически приемлемых кислот можно отметить соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями изобретения являются те, в которых R1 и R2 вместе образуют бензокольцо, которое незамещено или замещено группой, выбранной из метоксигруппы или цианогруппы, и R3 обозначает атом водорода. Среди предпочтительных соединений изобретения можно особенно отметить N-(3-пиридил)-1,2 дигидро-3H-бензо[е]индол-3-карбоксамид,7-метокси-N-(3-пиридил)-1,2-дигидро-3H-бензо[е]индол-3 карбоксамид, 6-циано-N-(3-пиридил)-1,2-дигидро-3H-бензо[е]индол-3-карбоксамид и N-(3-пиридил)-2,3 дигидро-1H-бензо[f]индол-1-карбоксамид.-1 005620 Настоящее изобретение касается также способа получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества используют бензоиндол формулы (II) в которой R1, R2 и R3 принимают значения, указанные для формулы (I), который конденсируют, при нагревании, с соединением формулы (III) в которой Y обозначает группу -N=C=O или -C(O)-N3, с получением соединения формулы (I),которое, при необходимости, можно очистить согласно обычной методике очистки,которое, при желании, разделяют на его изомеры (диастереоизомеры и энантиомеры) по обычной методике разделения,которое, при желании, преобразуют в его соли присоединения с фармацевтически приемлемой кислотой или основанием,следует понимать, что индолин формулы (II) получают согласно известным методикам, например,начиная с соответствующего соединения нитронафтилацетонитрила. Настоящее изобретение касается также фармацевтических композиций, включающих как активный ингредиент по крайней мере одно соединение формулы (I), самостоятельно или в комбинации с одним или более инертным, нетоксичным, фармацевтически приемлемым эксципиентом или носителем. Среди фармацевтических композиций, согласно изобретению, можно особенно отметить те, которые являются подходящими для перорального, парентерального, назального или трансдермального применения, таблетки или драже, сублингвальные таблетки, желатиновые капсулы, пилюли, свечи, кремы,мази, кожные гели и т.д. Необходимую дозировку изменяют в зависимости от возраста и веса пациента, природы и серьезности расстройства, а также способа применения, который может быть пероральным, назальным, ректальным или парентеральным. В основном, единица дозы составляет от 0,05 до 500 мг за 1-3 прима в сутки. Следующие примеры иллюстрируют, но никак не ограничиваются, изобретение. Структуры описанных соединений определили обычными спектроскопическими и спектрометрическими методами. Использованные исходные материалы - известные продукты или получены согласно известным методикам. Получение 1: Стадия А: (2-Нитро-1-нафтил)ацетонитрил Получают раствор 53,5 г (0,477 моль) трет-бутанолята калия в 400 мл диметилформамида. Полученный раствор охлаждают до -10 С и к нему в течение приблизительно 1 ч добавляют раствор 40 г 4 хлорфеноксиацетонитрила (0,24 моль) и 37 г 2-нитронафталина (0,213 моль) в 200 мл диметилформамида. Через 2 ч при -5 С смесь выливают в 4 л воды, содержащей 1 л концентрированной соляной кислоты,и водную фазу экстрагируют дихлорметаном (3 х 500 мл). Органическую фазу промывают 300 мл воды,высушивают над сульфатом магния, отфильтровывают и затем упаривают растворитель. Получают 65 г продукта. 65 г полученного продукта перекристаллизовывают из смеси циклогексан/этилацетата: 50/50. Стадия В: 3H-Бензо[е]индол 33 г (2-нитро-1-нафтил)ацетонитрила (0,155 моль), растворнного в 630 мл этилового спирта, содержащего 10% воды и 6,3 мл чистой уксусной кислоты, гидрируют при комнатной температуре и под давлением 4 бар (1 бар = 105 Па = 0,986923 атм) водорода, с использованием 19 г 10%-ого палладия-науглероде. После того, как поглощение прекратилось, катализатор отфильтровывают, концентрируют растворитель в вакууме и затем остаток переносят в 250 мл дихлорметана; органическую фазу промывают 100 мл 0,1N раствора гидроксида калия и затем органическую фазу высушивают над сульфатом магния,отфильтровывают и концентрируют. Остаток очищают хроматографированием на кремнеземе с использованием, в качестве элюанта,смеси циклогексан/этилацетат: 80/20. Стадия С: 2,3-дигидро-1H-бензо[е]индол 10 г (0,06 моль) соединения, полученного на предыдущей стадии, растворяют в 50 мл тетрагидрофурана. К полученному раствору при 0 С, добавляют 120 мл комплекса боран/ТГФ в виде 1 М раствора в тетрагидрофуране и затем 120 мл трифторуксусной кислоты. Через 30 мин добавляют при 0 С 6 мл воды,-2 005620 затем смесь перемешивают в течение 15 мин и концентрируют досуха. Остаток переносят в 200 мл дихлорметана и промывают 200 мл 1N раствора гидроксида натрия. Органическую фазу высушивают над сульфатом магния, отфильтровывают и концентрируют. Получение 2: 2,3-дигидро-1H-бензо[f]индол Протокол эксперимента восстановления 1H-бензо[f]индола такой же как в получении 1, стадия С. Синтез исходного вещества 1H-бензо[f]индола описан в литературе [Tetrahedron, 49, 33., 7353 (1993);Heterocycles, 24, 7, 1845, (1986)]. Получение 3: 2,3-дигидро-1H-бензо[е]индол-6-карбонитрил Стадия А: N-(5-Циано-2-нафтил)ацетамид К 25 г N-(5,6,7,8-тетрагидронафт-2-ил)ацетамида, охлажденного до 0 С, последовательно добавляют 70 мл чистого триметилсилилцианида и затем 30 г дихлордицианохинона в 70 мл дихлорметана. После 3 ч при комнатной температуре снова добавляют раствор 60 г дихлордицианохинона в 140 мл дихлорметана. Перемешивают при 20 С в течение 12 ч и затем нагревают при 60 С в течение 8 ч. После нейтрализации насыщенным раствором гидрокарбоната натрия органическую фазу отделяют и промывают водой. Остаток, полученный после концентрирования, очищают хроматографированием на силикагеле с использованием в качестве элюанта смеси циклогексан/этилацетат: 80/20. Стадия В: N-(1-Бром-5-циано-2-нафтил)ацетамид К раствору 50 г (0,238 моль) продукта, синтезированного на предыдущей стадии, в 500 мл дихлорметана и 25 мл пиридина, охлажденному до -5 С, добавляют 39,8 г брома растворенного в 200 мл дихлорметана. Затем смесь интенсивно перемешивают в течение 4 ч при комнатной температуре; после этого разбавляют 500 мл дихлорметана, органическую фазу дважды промывают 300 мл воды, высушивают и концентрируют. Остаток перекристаллизовывают из смеси дихлорметан/метанол: 50/50. Стадия С: 6-Амино-5-бром-1-нафтонитрил Смесь 12,5 г (0,043 моль) продукта, синтезированного на предыдущей стадии, 3,6 г гидроксида натрия, 195 мл метанола и 65 мл воды нагревают при 80 С в течение 6 ч. После упаривания метанола водную фазу дважды экстрагируют дихлорметаном, с последующим высушиванием и упариванием. Остаток перекристаллизовывают из смеси дихлорметан/метанол. Стадия D: Этил 1-бром-5-циано-2-нафтилкарбамат К раствору 33 г (0,133 моль) продукта, синтезированного на предыдущей стадии, в 200 мл пиридина при 0 С добавляют 19 мл этилхлорформиата. После 1 ч при 5 С упаривают растворитель, остаток переносят в 500 мл дихлорметана, органическую фазу промывают 3 раза по 100 мл 0,1N раствором соляной кислоты, затем 200 мл 10%-ого раствора гидрокарбоната натрия и наконец один раз водой. Остаток, полученный в результате упаривания, перекристаллизовывают из смеси дихлорметан/метанол. Стадия Е: Этил 5-циано-1-[(триметилсилил)этинил]-2-нафтилкарбамат В стальном реакторе смешивают 14,1 г (0,044 моль) продукта, синтезированного на предыдущей стадии, 11 мл триметилсилилацетилена, 13 мл триэтиламина, 670 мг йодида меди (I) и 1,54 г дихлорбис(трифенилфосфин)палладия. Потом реактор закрывают и реакционную смесь нагревают при 80 С в течение 4 ч. Разбавляют 200 мл дихлорметана и 100 мл воды, смесь отфильтровывают, органическую фазу отделяют, высушивают и упаривают растворитель в вакууме. Полученный остаток очищают хроматографированием на силикагеле, с использованием, в качестве элюанта, смеси циклогексан/этилацетат: 90/10, с последующей кристаллизацией из того же растворителя. Стадия F: 3 Н-Бензо[е]индол-6-карбонитрил К раствору 2,74 г натрия в 280 мл сухого этанола добавляют 10 г (0,0297 моль) продукта, синтезированного на предыдущей стадии, и смесь нагревают с обратным холодильником в течение одного часа. После упаривания растворителя остаток переносят в 200 мл дихлорметана и органическую фазу промывают 200 мл воды. После упаривания остаток очищают хроматографированием на силикагеле с использованием в качестве элюанта смеси циклогексан/этилацетат: 80/20. Стадия G: 2,3-дигидро-1H-бензо[е]индол-6-карбонитрил Протокол эксперимента восстановления 3H-бензо[е]индол-6-карбонитрила такой же как в получении 1, стадия С. Получение 4: 7-Метокси-2,3-дигидро-1H-бензо[е]индол Стадия А: Оксим 6-метокси-3,4-дигидро-1(2 Н)-нафталинона 100 г (0,57 моль) 6-метокси-1-тетралона растворяют в 2,5 л смеси этанол/вода: 80/20. Затем в полученную смесь добавляют, при комнатной температуре, 85 г (1,04 моль) ацетата натрия и 43 г (0,62 моль) гидрохлорида гидроксиламина. Суспензию нагревают с обратным холодильником в течение 4 ч. Затем разбавляют 5 л воды и экстрагируют диэтиловым эфиром, промывают водой, высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя получают 99 г твердого вещества бежевого цвета. Стадия В: 2-Амино-6-метокси-3,4-дигидро-1(2 Н)-нафталинон 50 г (0,26 моль) продукта, синтезированного на предыдущей стадии, растворяют в 185 мл пиридина,затем при комнатной температуре добавляют 54,9 г (0,29 моль) пара-толуолсульфонилхлорида. Через 24 ч смесь выливают на лед и отфильтровывают осадок. Затем осадок переносят в дихлорметан и промыва-3 005620 ют водой; органическую фазу высушивают над сульфатом магния и отфильтровывают. После упаривания растворителя получают 89 г твердого вещества желтого цвета (промежуточный продукт 1).7,48 г (0,32 моль) натрия добавляют к смеси толуол/этанол: 720/148 мл. После растворения разбавляют 940 мл толуола и быстро добавляют 117 г (0,34 моль) промежуточного продукта 1. Через 24 ч при комнатной температуре отфильтровывают пара-толуолсульфонат натрия, промывают толуолом, и затем органический раствор выливают в 10%-ый раствор соляной кислоты (1,1 л). Разделяют, экстрагируют один раз водой и затем упаривают водную фазу. Остаток переносят в этанол и отфильтровывают осадок. Получают 46,5 г твердого вещества бежевого цвета в виде гидрохлорида. Стадия С: N-Этил-N'-(6-метокси-1-оксо-1,2,3,4-тетрагидро-2-нафтил) мочевина При 0 С 4,77 г (0,044 моль) этилхлорформиата выливают в 5 г (0,022 моль) 2-амино-6-метокси-3,4 дигидро-2H-нафталин-1-она, растворнного в пиридине. После двух часов при комнатной температуре упаривают пиридин, остаток переносят в дихлорметан, затем органическую фазу промывают 0,1N раствором соляной кислоты и после этого насыщенным раствором гидрокарбоната натрия и водой; высушивают над сульфатом магния, отфильтровывают и упаривают растворитель. Получают 5,48 г твердого вещества оранжевого цвета. Стадия D: N-Этил-N'-(6-метокси-1,2,3,4-тетрагидро-2-нафтил) мочевина При 60 С и при атмосферном давлении, гидрируют 98 г (0,37 моль) продукта, полученного на предыдущей стадии С и растворнного в 1,5 л этилового спирта, используя 10 г 5%-ого палладия-науглероде. После того, как поглощение прекратилось, отфильтровывают катализатор и концентрируют растворитель в вакууме. Получают 88,2 г масла. Стадия Е: N-Этил-N'-(6-метокси-2-нафтил)мочевина 7,42 г (0,0298 моль) продукта, синтезированного на предыдущей стадии, растворяют в 100 мл толуола. Добавляют 13,51 г (0,0595 моль) дихлордицианохинона и нагревают с обратным холодильником в течение 30 мин. При комнатной температуре отфильтровывают осадок, промывают толуолом и затем упаривают растворитель. Остаток очищают хроматографированием на силикагеле, при этом используют,в качестве элюанта, чистый дихлорметан. Получают 4 г твердого вещества серого цвета. Стадия F: 6-метокси-2-нафтиламин 3,5 г продукта, синтезированного на предыдущей стадии, растворяют в 65 мл этанола, затем добавляют раствор гидроксида калия в 65 мл воды. После нагревания с обратным холодильником в течение 4 ч при комнатной температуре образованный осадок отфильтровывают. Переносят сырой продукт в дихлорметан и промывают водой до нейтральной реакции; высушивают над сульфатом магния, отфильтровывают осадок и затем упаривают растворитель. Получают 2,02 г твердого вещества оранжевого цвета. Стадия G: 1-иод-6-метокси-2-нафтиламин 28,2 г (0,16 моль) продукта, синтезированного на предыдущей стадии, растворяют в смеси дихлорметан/метанол: 1500/620 мл. К полученному раствору при комнатной температуре добавляют 56,7 г (0,16 моль) дихлорйодата бензилтриметиламмония и 21,2 г (0,212 моль) карбоната кальция. Через 30 мин отфильтровывают нерастворимый осадок, затем органическую фазу переносят с помощью 10%-ого раствора бисульфита натрия и экстрагируют диэтиловым эфиром. Высушивают над сульфатом магния, отфильтровывают и упаривают. Остаток очищают хроматографированием на силикагеле, с использованием, в качестве элюанта, смеси циклогексан/этилацетат: 70/30. Стадия Н: Этил 1-иод-6-метокси-2-нафтилкарбамат Преобразование 1-иод-6-метокси-2-нафтиламина проводят, применяя метод, описанный в получении 3, стадия D. Стадия I: Этил 6-метокси-1-[(триметилсилил)этинил]-2-нафтилкарбамат Преобразование этил 1-иод-6-метокси-2-нафтилкарбамата проводят, применяя метод, описанный в получении 3, стадия Е. Стадия J: 7-Метокси-3 Н-бензо[е]индол Преобразование соединения предыдущей стадии проводят, применяя метод, описанный в получении 3, стадия F. Стадия К: 7-Метокси-2,3-дигидро-1 Н-бензо[е]индол Протокол эксперимента восстановления 7-метокси-3H-бензо[е]индола такой же как в получении 1,стадия С. Пример 1: N-(3-Пиридил)-1,2-дигидро-3H-бензо[е]индол-3-карбоксамид 1,92 г (0,013 моль) никотиноил азида растворяют в 250 мл толуола и нагревают с обратным холодильником в течение 30 мин. Затем охлаждают до 15 С и быстро добавляют раствор 2,4 г (0,013 моль) продукта, синтезированного в получении 1. Через несколько минут сформированный осадок отфильтровывают, диэтиловым эфиром придают ему форму пасты и перекристаллизовывают остаток из 130 мл этанола. Кристаллы отфильтровывают. Точка плавления: 183-186 С. Пример 2: Гидрохлорид-N-(3-пиридил)-2,3-дигидро-1H-бензо[f]индол-1-карбоксамида Протокол эксперимента такой же как в примере 1, начиная с продукта получения 2. Точка плавления: 235-240 С.-4 005620 Пример 3: Гидрохлорид 6-циано-N-(3-пиридил)-1,2-дигидро-3H-бензо[е]индол-3-карбоксамида Протокол эксперимента такой же как в примере 1, начиная с продукта получения 3. Точка плавления: 265 С с разложением. Пример 4: Гидрохлорид 7-метокси-N-(3-пиридил)-1,2-дигидро-3H-бензо[е]индол-3-карбоксамида Протокол эксперимента такой же как в примере 1, начиная с продукта получения 4. Точка плавления:270 С с разложением. Фармакологическое изучение Пример 5: Измерение внеклеточных концентраций допамина и норадреналина в лобном кортикальном слое крысы, находящейся в сознании Метод: Диализ. Хирургическое вмешательство выполняют под пентобарбитал-вызванной анестезией (60 мг/кг, внутрибрюшинно). Крыс помещают в стереотаксический прибор Копфа (Kopf) и катетерный зонд(СМА Microdialysis АВ, Stockholm, Sweden) внедряют в лобный кортикальный слой с координатами: переднезадний: + 2,2, латеральный:0,6, вентральное отклонение: - 0,2. Крыс помещают в отдельные клетки и оставляют отходить от анестезии на 5 дней. В день диализа, зонд Cuprophan CMA/11 (длина: 4 мм; наружный диаметр: 0,24 мм) вводят в направитель и перфузируют при 1 л/мин раствором 147,2 мМNaCl, 4 мМ КСl и 2,3 мМ СаСl2 с рН 7,3, доведнным с помощью фосфатного буфера. Через два часа после имплантации, образцы диализата собирают каждые 20 мин в течение 4 ч. Три образца для определения базового уровня собирают перед применением лекарства. Хроматография. Допамин (DA) и норадреналин (NA) одновременно измеряют следующим образом: 20 л образца диализата разбавляют 20 л мобильной фазы (75 мМ NaH2PO4, 20 М EDTA, 1 мМ декансульфоната натрия, 17,5% метанола, 0,01% триэтиламин, рН: 5,70) и 33 л анализируют методом HPLC(HPLC - жидкостная хроматография высокого давления), используя, для разделения, обратно-фазную колонку (Hypersil С 18, 150 х 4,6 мм; размер частиц 5 м), регулируемую с помощью термореле, при 43 С и, для количественного анализа, кулонометрический детектор (ESA5014, Coulochem II, ESA, Chelmsford,USA). Потенциал первого электрода равен - 90 мВ (восстановление) и потенциал второго равен + 280 мВ(окисление). Скорость потока мобильной фазы равна 2 мл/мин. Пределы чувствительности для DA и NA равны 0,1 и 0,2 пг, соответственно. Результаты: Соединение примера 1 (40,0 мг/кг, перорально) вызывает существенное увеличение внеклеточных концентраций DA и NA в диализатах, собранных из лобного кортикального слоя крыс, находящихся в сознании. Данные выражают как среднееС.Э.М Уровни DA и NA выражают относительно средних значений до применения лекарства. Через 30 мин после применения эффекты лекарства сравнивают (непарный t тест) с эффектами, полученными на животных, обработанных растворителем.versus лекарство = + 118,216,7. Пример 6: Испытание эрекции полового члена после применения Ro 60-0175 (1,25 мг/кг, подкожно) на крысе Метод: Это испытание позволяет оценить возможности фармакологических агентов ингибировать эрекцию полового члена, вызванную применением селективного 5-НТ 2C агониста, Ro 60-0175. Следовательно,ингибирование может спрогнозировать антагонистическую активность в отношении 5-НТ 2 С рецепторов. Крыс мужского пола, породы Уистар (Wistar) (Iffa-Credo, L'Arbresle, France), весящих 120-140 г, в день эксперимента помещают отдельно в плексигласовых коробках для наблюдения (7,5 х 18 х 30 см) сразу после применения соединения или носителя. Тридцать минут спустя, к животным применяют Ro 60-0175-5 005620 Пример 7: Тест социального взаимодействия на крысе Метод: Это испытание позволяет оценить потенциальную транквилизаторную активность соединений. Крыс мужского пола, породы Sprague-Dawley (Charles River, Saint-Aubin-les-Elbeuf, France), весящих 240260 г, по прибытии изолируют в индивидуальных клетках в течение 5 дней в слабо освещенном помещении для содержания животных (3-10 лк). В заключительный день проводят испытание, которое состоит в размещении животных по парам, которые согласовывают по весу ( 5 г), в ярко освещенном вольере (300 лк) в течение 10 мин. Измеряют время, потраченное животными на взаимодействие друг с другом (наведение лоска, ухаживания, ). Соединение или носитель применяют к животным за 1 ч до испытания,каждая пара получает ту же самую обработку. Транквилизаторный эффект соединения выражается в увеличении продолжительности взаимодействия по сравнению с теми животными, к которым применялся носитель.n: количество крыс Сравнение относительно носителя (испытание Даннетта):р 0,05. Пример 8: Тест Фогеля, конфликтный Метод: Испытание проводят в прозрачной пластиковой клетке (32 х 25 х 30 см), расположенной в звукоизолированном и проветриваемом помещении. Клетка имеет хромированное стальное дно. Металлический конец бутылочки, содержащей напиток, входит в клетку на высоте 6 см от металлического дна. Дно и конец бутылочки соединены электрическими проводами с прибором "Анксиометром (Anxiometer)"(Columbus Instruments, Ohio, USA), который записывает лизания животного и управляет применением электрошоков. В течение 4 дней до проведения теста, крысы (крысы Вистара, мужского пола, весящие 250-270 г)(по 3 в клетке) имеют доступ к напитку в течение только одного часа в сутки. В день перед испытанием,животных изолируют в клетки на решетках, без еды и питья, сразу же после их последнего часа доступа к напитку. Испытание проводят на 5-ый день. В день испытания, животное кормят через зонд (перорально) или растворителем (суспензия дистиллированной воды + Твин 80) (контроль) или соединением за 30 мин до помещения в клетку для испытаний. Процедура начинается, как только животное произвело 20 лизаний и получило первый удар электрошоком (между металлическим концом бутылочки и металлическим дном), (постоянный поток, продолжительность 0,5 с, интенсивность 0,3 мА). Впоследствии, животное получает удар электрошоком каждый раз, как сделает 20 лизаний в течение 3 мин. Животных, не сделавших сеанс первых 20 лизаний до конца 5 мин, извлекают из испытания. Результаты - количества лизаний, произведнных животным в течение 3 мин испытания.n: количество крыс Сравнение относительно носителя (испытание Даннетта):р 0,05.-6 005620 Пример 9: Фармацевтическая композиция Формула для получения 1000 таблеток, каждая из которых содержит 10 мг активного ингредиента Соединение примера 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой R1 и R2 вместе образуют бензокольцо, необязательно замещенное атомом галогена или алкильной группой, алкоксигруппой, цианогруппой, нитрогруппой, гидроксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой или трифторметильной группой, и R3 обозначает атом водорода, илиR1 обозначает атом водорода и R2 и R3 вместе образуют бензокольцо, необязательно замещенное атомом галогена или алкильной группой, алкоксигруппой, цианогруппой, нитрогруппой, гидроксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой или трифторметильной группой,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием,при этом понимают, что термин "алкил" обозначает линейную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, термин "алкокси" обозначает линейную или разветвленную алкилоксигруппу, содержащую от 1 до 6 атомов углерода. 2. Соединения формулы (I) по п.1, в которой R1 и R2 вместе образуют бензокольцо, которое незамещено или замещено группой, выбранной из метоксигруппы или цианогруппы, и R3 обозначает атом водорода, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединение формулы (I) по п.1 или 2, которое представляет собой N-(3-пиридил)-1,2-дигидро 3H-бензо[е]индол-3-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединение формулы (I) по п.1 или 2, которое представляет собой 7-метокси-N-(3-пиридил)-1,2 дигидро-3H-бензо[е]индол-3-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединение формулы (I) по п.1 или 2, которое представляет собой 6-циано-N-(3-пиридил)-1,2 дигидро-3H-бензо[е]индол-3-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединение формулы (I) по п.1, которое представляет собой N-(3-пиридил)-2,3-дигидро-1Hбензо[f]индол-1-карбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Способ получения соединения формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют бензоиндол формулы (II) в которой R1, R2 и R3 принимают значения, указанные для формулы (I), который конденсируют, при нагревании, с соединением формулы (III) в которой Y обозначает группу -N=C=O или -C(O)-N3,с получением соединения формулы (I),которое, при необходимости, можно очистить согласно обычной методике очистки,которое разделяют на его изомеры (диастереоизомеры и энантиомеры) по обычной методике разделения,-7 005620 которое, при желании, преобразуют в его соли присоединения с фармацевтически приемлемой кислотой или основанием,понимают, что индолин формулы (II) получают известными способами, например, начиная с соответствующего производного нитронафтилацетонитрила. 8. Фармацевтическая композиция, включающая как активный ингредиент по крайней мере одно соединение по любому из пп.1-6, самостоятельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями. 9. Фармацевтическая композиция по п.8, включающая по крайней мере один активный ингредиент по любому из пп.1-6, для использования в производстве медикаментов 5-НТ 2C антагонистов. 10. Фармацевтическая композиция по п.8, включающая по крайней мере один активный ингредиент по любому из пп.1-6, для применения в производстве медикаментов для использования при лечении депрессии, беспокойства, импульсивных расстройств, шизофрении, болезни Паркинсона, мигрени, когнитивных расстройств, расстройств либидо и половых дисфункций, расстройств сна и расстройств аппетита, таких как булимия и анорексия.
МПК / Метки
МПК: C07D 401/12, A61K 31/435
Метки: новые, композиции, производные, получения, индолина, фармацевтические, способ, содержащие
Код ссылки
<a href="https://eas.patents.su/9-5620-novye-proizvodnye-indolina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные индолина, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Композиция, включающая камптотецин и производное пиримидина, для лечения рака
Следующий патент: Гетероциклические соединения в качестве ингибиторов транспортера глицина
Случайный патент: Полый профиль, используемый при изготовлении трубы












