Пероральная комплексная композиция, содержащая сложный эфир жирной кислоты омега-3 и ингибитор hmg-coa редуктазы
Номер патента: 23405
Опубликовано: 31.05.2016
Авторы: Йоон Еун Дзин, Воо Дзонг Соо, Ким Йонг Ил, Шин Йоон Суб, Им Хо Таек, Парк Дзае Хиун
Формула / Реферат
1. Пероральная комплексная композиция, которая содержит:
(a) сердцевину в виде мягкой капсулы, содержащую сложные эфиры жирной кислоты омега-3, которые содержат этиловые эфиры эйкозапентаеновой кислоты и докозагексановой кислоты в количестве 70-95 мас.% в расчете на общую массу сердцевины;
(b) первый покровный слой, который наносят на сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество, выбранное из группы, состоящей из ацетатцеллюлозы, поливинилацетата, этилцеллюлозы, сополимеров (метил)акриловой кислоты, и присутствующее в количестве от 15 до 75 мас.% в расчете на общее количество первого покровного слоя; и
(c) второй покровный слой, нанесенный на первый покровный слой, который содержит:
(i) розувастатин или его фармацевтически приемлемую соль и
(ii) поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь.
2. Пероральная комплексная композиция по п.1, где сложные эфиры жирной кислоты омега-3 присутствуют в количестве от 100 до 2000 мг.
3. Пероральная комплексная композиция по п.1, где розувастатин или его фармацевтически приемлемая соль присутствует в количестве от 1 до 50 мг.
4. Пероральная комплексная композиция по п.1, где поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь присутствуют в количестве от 25 до 85 мас.% в расчете на общее количество второго покровного слоя.
5. Пероральная комплексная композиция по п.1, которая демонстрирует скорость высвобождения розувастатина или его фармацевтически приемлемой соли 80% или более в 0,05 М цитратном буфере в течение 10 мин.
6. Способ получения пероральной комплексной композиции по п.1, который содержит следующие этапы:
(1) получение сердцевины в виде мягкой капсулы, содержащей сложные эфиры жирной кислоты омега-3, которые содержат этиловые эфиры эйкозапентаеновой кислоты и докозагексановой кислоты в количестве 70-95 мас.% в расчете на общую массу сердцевины;
(2) формирование первого покровного слоя, который наносят на сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество, выбранное из группы, состоящей из ацетатцеллюлозы, поливинилацетата, этилцеллюлозы, сополимеров (метил)акриловой кислоты, и присутствующее в количестве от 15 до 75 мас.% в расчете на общее количество первого покровного слоя;
(3) формирование второго покровного слоя на первом покровном слое, который содержит:
(i) розувастатин или его фармацевтически приемлемую соль и
(ii) поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь.
Текст
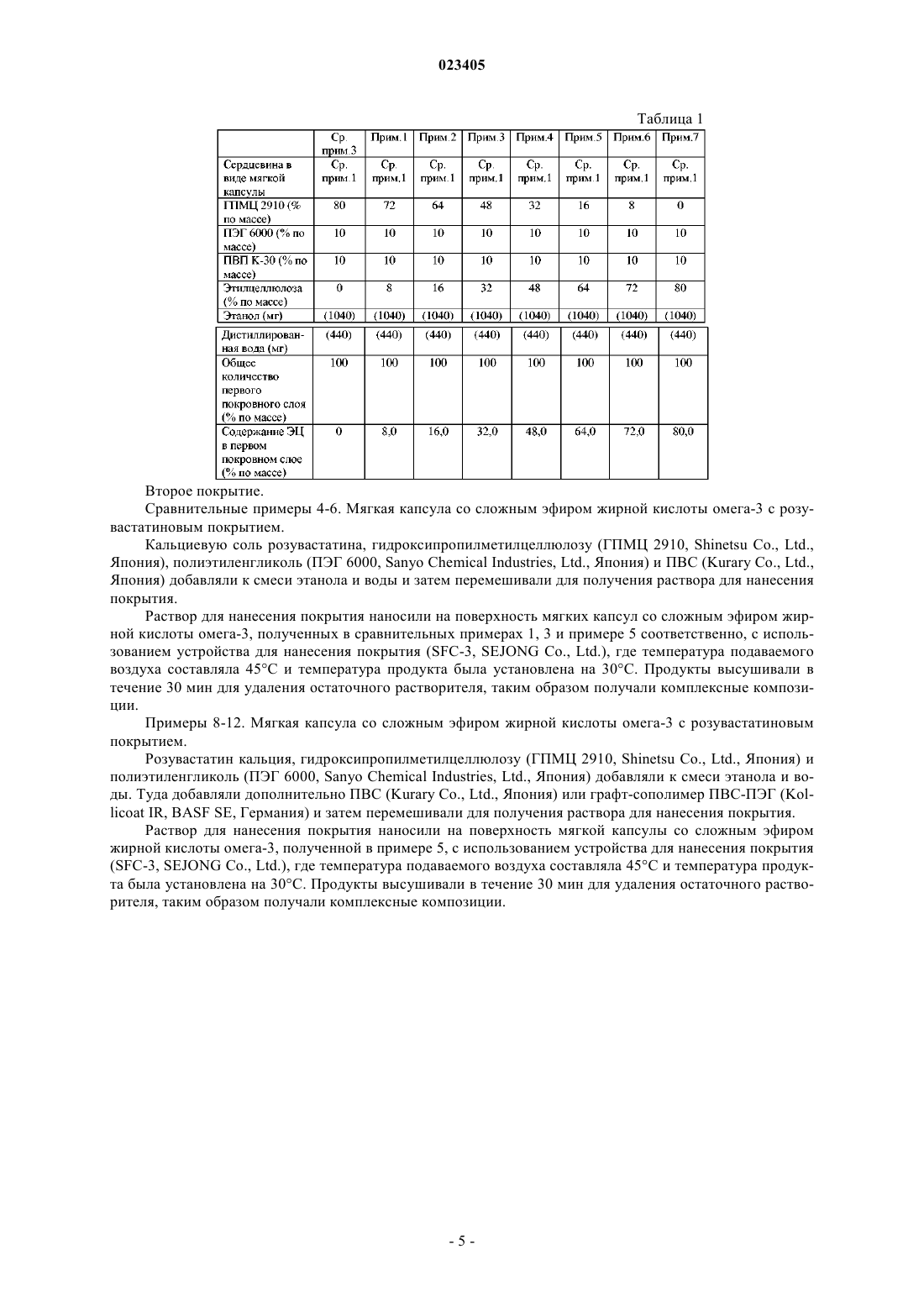
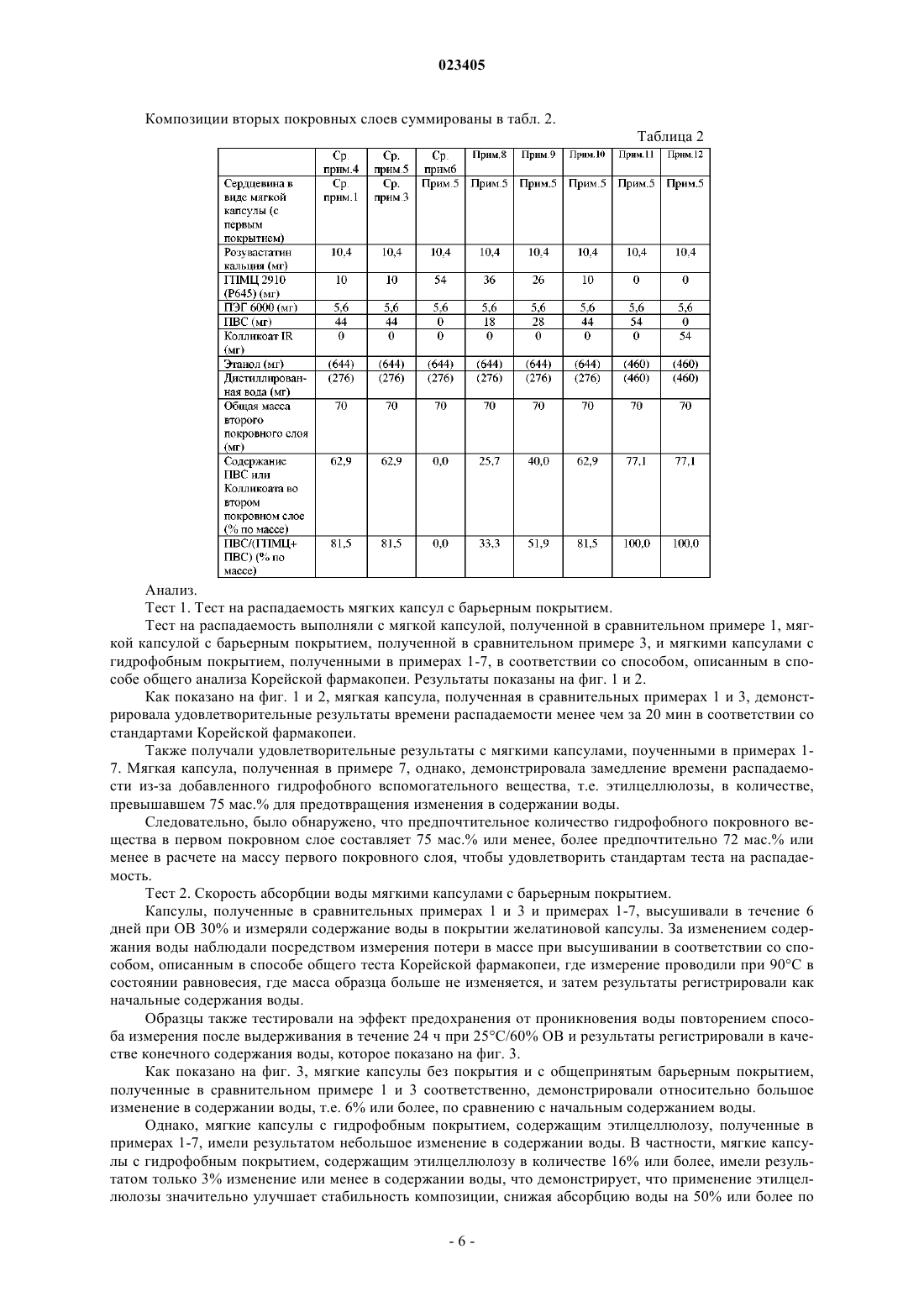
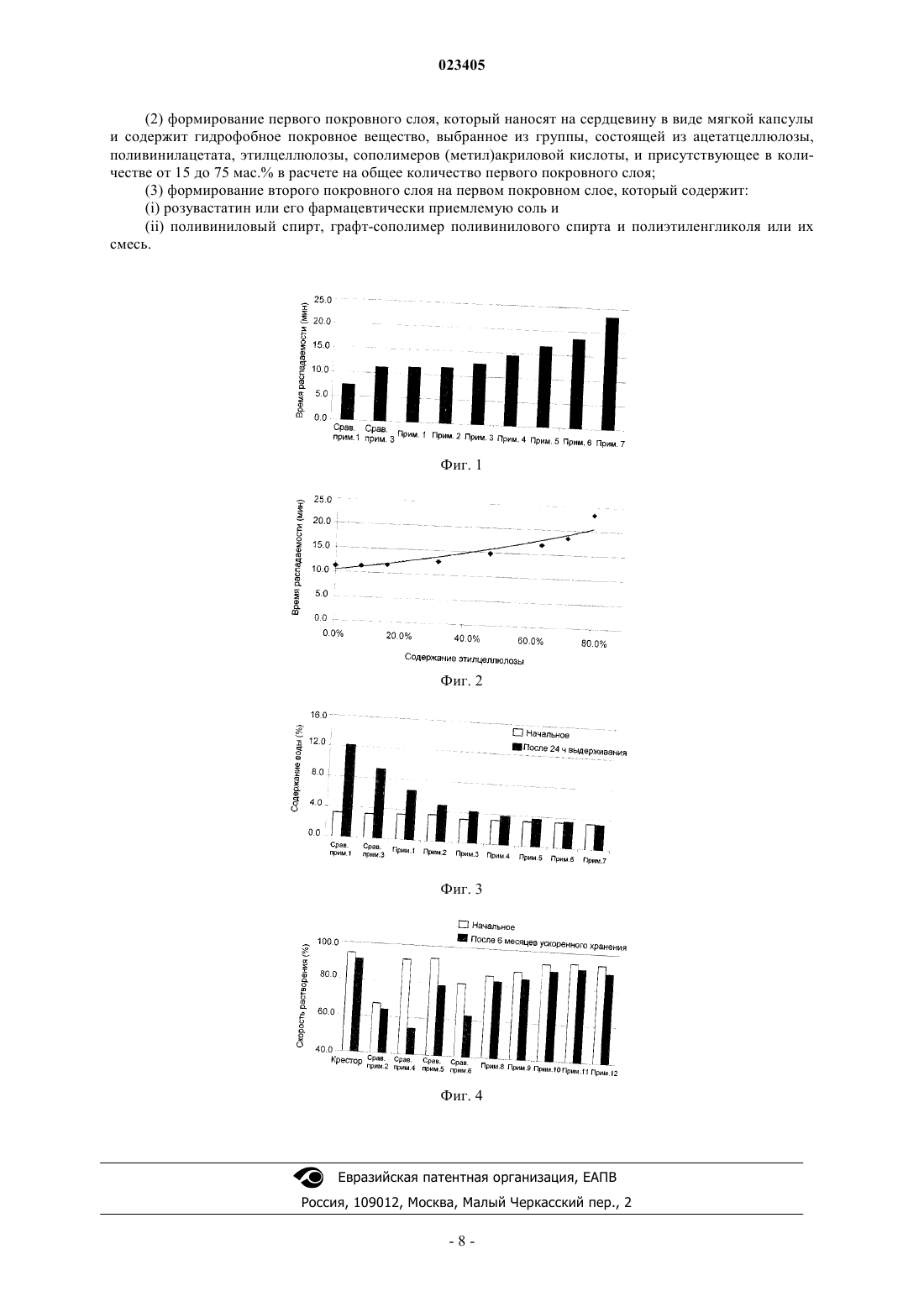
ПЕРОРАЛЬНАЯ КОМПЛЕКСНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СЛОЖНЫЙ ЭФИР ЖИРНОЙ КИСЛОТЫ ОМЕГА-3 И ИНГИБИТОР HMG-COA РЕДУКТАЗЫ Изобретение относится к пероральной композиции, которая содержит сердцевину в виде мягкой капсулы, содержащую сложные эфиры жирной кислоты омега-3, которые содержат этиловые эфиры эйкозапентаеновой кислоты и докозагексановой кислоты в количестве 70-95 мас.% сердцевины; первый покровный слой, который наносят на указанную сердцевину и содержит гидрофобное покровное вещество, выбранное из ацетатцеллюлозы, поливинилацетата,этилцеллюлозы, сополимеров (метил)акриловой кислоты и присутствующее в количестве от 15 до 75 мас.% первого покровного слоя; и второй покровный слой, нанесенный на первый покровный слой, который содержит розувастатин или его фармацевтически приемлемую соль и поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь. Изобретение также относится к способу получения данной композиции. Изобретение обеспечивает улучшенную скорость высвобождения розувастатина, проявляя отсутствие свойства замедленного высвобождения. Область техники, к которой относится изобретение Настоящее изобретение относится к пероральной комплексной композиции, содержащей сложные эфиры жирной кислоты омега-3 и ингибитор HMG-CoA редуктазы. Уровень техники, предшествующий изобретению Морские жиры, также обычно называемые рыбьи жиры, являются основными источниками жирных кислот омега-3, т.е. эйкозапентаеновой кислоты (ЭПК) и докозагексановой кислоты (ДГК), которые модулируют липидный метаболизм. Жирные кислоты омега-3 могут без каких-либо нежелательных побочных эффектов повышать сывороточный холестерин липопротеинов высокой плотности (ЛПВП), при этом снижая сывороточные триглицериды (ТГ), систолическое и диастолическое давление крови, частоту сердечных сокращений и активацию комплекса фактора свертывания крови VII и фосфолипидов. Доступными в настоящее время лекарственными средствами с жирными кислотами омега-3 являются этиловые эфиры жирной кислоты омега-3 (далее в этом документе именуемые "сложные эфиры жирной кислоты омега-3"), эти-этерифицированный концентрат жирных кислот омега-3, т.е. полиненасыщенных жирных кислот из ДГК и ЭПК-содержащих рыбьих жиров, и продается под торговым названием ОМАКОР. Такие сложные эфиры жирной кислоты омега-3 обычно изготавливают в форме капсулы, такой как желатиновая капсула, как раскрыто в патентах США 5502077, 5656667 и 5698594. Помимо продуктов естественной ферментации, мевастатина и ловастатина (МЕВАКОР; см. патент США 4231938), существуют различные типы синтезированных и полусинтезированных ингибиторовHMG-CoA редуктазы, включая симвастатин (ЗОКОР; см. патент США 4444784), натриевую соль правастатина (ПРАВАХОЛ; см. патент США 4346227), натриевую соль флувастатина (ЛЕСКОЛ; см. патент США 5354772), кальциевую соль аторвастатина (ЛИПИТОР; см. патент США 5273995), натриевую соль церивастатина (также известную как ривастатин; см. патент США 5177080),кальциевую соль розувастатина (КРЕСТОР; см. патент Кореи 105431) и кальциевую соль питавастатина (ЛИВАРО; см. патент Кореи 101149). Такие ингибиторы HMG-CoA редуктазы содержат 3 гидроксилактоны или соответствующие дигидроксикислоты с раскрытым кольцом, и их часто называют"статины". Статины обычно используются для поддержания уровней холестерина в нормальном диапазоне. Статины могут ингибировать HMG-CoA редуктазу, которая регулирует синтез холестерина, тем самым замедляя выработку холестерина, или могут снижать сывороточный холестерин липопротеинов низкой плотности (ЛПНП) повышающим регулированием ЛПНП рецепторов в печени. Таким образом,главная функция статинов заключается в уменьшении холестерина ЛПНП. Известно, что статины снижают риск коронарной болезни сердца (КБС) на одну треть и еще обладают ограниченными эффектами на ТГ и сывороточный ЛПВП. Пациенты с гиперхолестеринемией и смешанной дислипидемией демонстрируют высокие уровни ЛПНП и ТГ. Эффективным является использование фармацевтической комбинации сложных эфиров жирной кислоты омега-3 и статинов, потому что она подходит для лечения высоких уровней как ЛПНП,так и ТГ. Следовательно, разработка фармацевтической комбинации сложных эфиров жирной кислоты омега-3 и статинов может быть пригодна для лечения гиперлипидемии за счет повышения сывороточного ЛПВП и одновременного снижения уровней ЛПНП и ТГ. В связи с этим имело место большое количество исследований комбинированного состава сложных эфиров жирной кислоты омега-3. Например, в публикации патента США 2007/0212411 раскрыты комбинированные составы ОМАКОР осуществлением последовательно полимерного барьерного покрытия, лекарственного покрытия и верхнего покрытия. Примеры активных фармацевтических ингредиентов, которые могут быть использованы для покрытий,включают в себя симвастатин, фенофибрат, правастатин, пропранолол, эналаприл и приоглитазон. Патентные публикации Кореи 2007-0038553, 2007-0108945 и 2009-0086078 раскрывают фармацевтические композиции со смешиванием напрямую сложных эфиров жирной кислоты омега-3 со статинами, однако их лекарственная стабильность не может быть гарантирована при смешивании напрямую. Также патентные публикации Кореи 2007-0108945 и 2007-0083715 относятся к фармацевтическим композициям, содержащим статины или их микрокапсулы. Композиции составляются в виде мягкой капсулы, смешиваются с маслами жирной кислоты омега-3, которые вызывают замедленное высвобождение статина, так что скорость растворения статина намного ниже, чем у доступных для приобретения в настоящее время статиновых лекарственных средств. В настоящее время не существует доступного лекарственного средства с пероральной композицией,содержащего сложные эфиры жирной кислоты омега-3 и ингибитор HMG-CoA редуктазы, имеющего такую же скорость растворения статина, как у доступных для приобретения статиновых лекарственных средств. Следовательно, имеет место потребность в разработке комплексной композиции, содержащей сложные эфиры жирной кислоты омега-3 и ингибиторы HMG-CoA редуктазы, которые являются фармацевтически стабильными; имеющими такие же скорость растворения и эффективность, как доступные для приобретения статиновые лекарственные средства; и не проявляющими свойств замедленного высвобождения даже после длительного хранения. Сущность изобретения Соответственно задача настоящего изобретения заключается в предоставлении пероральной комплексной композиции, содержащей сложные эфиры жирной кислоты омега-3 и розувастатин или его фармацевтически приемлемую соль, которая проявляет улучшенную скорость высвобождения розувастатина и не демонстрирует свойство отсроченного высвобождения даже после долговременного хранения. Другая задача настоящего изобретения заключается в предоставлении способа получения пероральной комплексной композиции. В соответствии с одним аспектом настоящего изобретения предоставлена пероральная комплексная композиция, которая содержит: (а) сердцевину в виде мягкой капсулы, содержащую сложные эфиры жирной кислоты омега-3; (b) первый покровный слой, который заключает в себе сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество; и (с) второй покровный слой, нанесенный на первый покровный слой, который содержит (i) розувастатин или его фармацевтически приемлемую соль и (ii) поливиниловый спирт (ПВС), графт-сополимер поливинилового спирта и полиэтиленгликоля(ПВС-ПЭГ) или их смесь. В соответствии с другой задачей настоящего изобретения предоставлен способ получения пероральной комплексной композиции, который содержит этапы: (1) получения сердцевины в виде мягкой капсулы, содержащей сложные эфиры жирной кислоты омега-3; (2) формирования первого покровного слоя, который заключает в себе сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество; и (3) формирования второго покровного слоя на первом покровном слое, который содержит (i) розувастатин или его фармацевтически приемлемую соль и (ii) ПВА, графт-сополимер ПВС-ПЭГ или их смесь. Краткое описание чертежей Вышеприведенные и другие задачи, и особенности настоящего изобретения станут очевидными из последующего описания изобретения в сочетании с сопровождающими чертежами, которые демонстрируют соответственно: фиг. 1 - время распадаемости капсул, полученных в сравнительных примерах 1, 3 и примерах 1-7; фиг. 2 - время распадаемости в расчете на количество этилцеллюлозы в капсулах, полученных в сравнительном примере 3 и примерах 1-7; фиг. 3 - изменения в содержании воды в капсуле, полученной в сравнительных примерах 1, 3 и примерах 1-7; фиг. 4 - изменения в скоростях растворения розувастатина в капсулах, полученных в сравнительных примерах 2, 4, 5 и примерах 8-12. Подробное описание изобретения Пероральная комплексная композиция по изобретению характеризуется содержанием следующего:(а) сердцевина в виде мягкой капсулы, содержащая сложные эфиры жирной кислоты омега-3; (b) первый покровный слой, который заключает в себе сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество; и (с) второй покровный слой, нанесенный на первый покровный слой, который содержит ингредиенты: (i) розувастатин или его фармацевтически приемлемую соль и (ii) ПВС, графтсополимер ПВС-ПЭГ или их смесь. Далее в этом документе компоненты, содержащиеся в пероральной комплексной композиции по настоящему изобретению, описаны подробно.(а) Сердцевина в виде мягкой капсулы. Сердцевина в виде мягкой капсулы с комплексной композицией в соответствии с настоящим изобретением содержит сложные эфиры жирной кислоты омега-3 в качестве первого активного фармацевтического ингредиента. В одном варианте осуществления настоящего изобретения сложные эфиры жирной кислоты омега-3 могут содержать этиловые эфиры ЭПК и ДГК в количестве 80 мас.% или более, предпочтительно по меньшей мере 40 мас.% этилового эфира ЭПК и по меньшей мере 34 мас.% этилового эфира ДГК. Предпочтительно сложные эфиры жирной кислоты омега-3 могут содержать этиловый эфир жирной кислоты омега-3 в количестве 90 мас.% или более. Количество сложных эфиров жирной кислоты омега-3, представленных в сердцевине в виде мягкой капсулы, может составлять от 100 до 2000 мг. В предпочтительном варианте осуществления настоящего изобретения количество сложного эфира жирной кислоты омега-3 может составлять от 70 до 95 мас.% в расчете на общую массу сердцевины в виде мягкой капсулы, но не ограничено ими. Также сердцевина в виде мягкой капсулы может быть получена обычным для производства мягких капсул образом посредством использования обычных веществ для мягких капсул, например желатина.(b) Первый покровный слой. В пероральной комплексной композиции по настоящему изобретению первый покровный слой содержит гидрофобное покровное вещество, которое инкапсулирует сердцевину в виде мягкой капсулы для того, чтобы предотвратить воздействие изменения в содержании воды внутри сердцевины в виде мягкой капсулы на скорость растворения содержащего розувастатин второго покровного слоя и увеличение свя-2 023405 занных с ним веществ. Когда розувастатин нанесен непосредственно на сердцевину в виде мягкой капсулы, содержащей сложный эфир жирной кислоты омега-3, то содержание воды в капсуле может действовать на содержание розувастатина, снижать его скорость растворения и увеличивать связанные с ним вещества. В данном изобретении, однако, первый покровный слой, содержащий гидрофобное покровное вещество, применен между содержащей сложный эфир жирной кислоты омега-3 сердцевиной в виде мягкой капсулы и содержащим розувастатин вторым покровным слоем, минимизируя влияние содержания воды, также как и других видов потенциального риска. Примеры гидрофобного покровного вещества могут включать ацетат целлюлозы, поливинилацетат,этилцеллюлозу и сополимеры (метил)акриловой кислоты, т.е. Эудрагит, предпочтительно этилцеллюлозу. Количество использованного гидрофобного покровного вещества может быть основано на общем количестве первого покровного слоя, от 15 до 75 мас.%, предпочтительно от 16 до 75 мас.%, более предпочтительно от 16 до 72 мас.%. Если количество использованного гидрофобного покровного вещества меньше 15 мас.%, то изменение в содержании воды становится больше, вызывая ухудшение устойчивости при хранении посредством снижения содержания розувастатина и скорости растворения, также как и увеличение связанных с ним веществ. Первый покровный слой может дополнительно содержать общепринятые покровные вещества, такие как гидроксипропилметилцеллюлоза (ГПМЦ) и гидроксипропилцеллюлоза (ГПЦ), которые обычно используются в фармацевтической области. В дополнение, первый покровный слой может дополнительно содержать другие фармацевтически приемлемые добавки, такие как разрыхлители, разбавители, стабилизаторы, связующие вещества и модификаторы скольжения, при условии, что они не воздействуют отрицательно на скорость распадаемости капсулы. Первый покровный слой может быть получен растворением или диспергированием гидрофобного покровного вещества в воде, этаноле или их смеси, предпочтительно в смешанном растворителе, для получения раствора для нанесения покрытия и затем нанесения раствора на поверхность сердцевины в виде мягкой капсулы. Первый покровный слой может быть нанесен на сердцевину в виде мягкой капсулы в количестве 2 мас.ч. или более, предпочтительно от 4 до 10 мас.ч. в расчете на 100 ч. от массы сердцевины в виде мягкой капсулы.(с) Второй покровный слой. В пероральной комплексной композиции по настоящему изобретению второй покровный слой содержит ингредиенты: (i) розувастатин или его фармацевтически приемлемую соль в качестве второго активного фармацевтического ингредиента и (ii) ПВС, графт-сополимер ПВС-ПЭГ или их смесь в качестве покровного вещества, которое позволяет быстрое высвобождение розувастатина при растворении и также предотвращает отсроченное высвобождение розувастатина после хранения. Второй покровный слой может быть получен растворением или диспергированием указанных ингредиентов (i) и (ii) в воде, этаноле или их смеси, предпочтительно в смешанном растворителе, для получения раствора для нанесения покрытия, с последующим нанесением раствора на поверхность первого покровного слоя. Количество ингредиента (i), примененного во втором покровном слое, может составлять от 1 до 50 мг, и количество примененного ингредиента (ii) может составлять от 25 до 85 мас.%, предпочтительно от 25 до 80 мас.% в расчете на общее количество второго покровного слоя. Второй покровный слой может дополнительно содержать ГПМЦ, поливинилпирролидон (ПВП) или их смесь и может также содержать другие фармацевтически приемлемые добавки, такие как щелочные стабилизаторы, если требуется. Второй покровный слой может быть нанесен на первый покровный слой в количестве от 3 до 30 мас.ч., предпочтительно от 5 до 20 мас.ч. в расчете на 100 ч. от массы сердцевины в виде мягкой капсулы. Настоящее изобретение также предоставляет способ получения пероральной комплексной композиции по настоящему изобретению, который содержит этапы: (1) получения сердцевины в виде мягкой капсулы, содержащей сложные эфиры жирной кислоты омега-3; (2) формирования первого покровного слоя, который заключает в себе сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество; и (3) формирования второго покровного слоя на первом покровном слое, который содержит ингредиенты (i) розувастатин или его фармацевтически приемлемую соль и (ii) ПВС, графт-сополимер ПВС-ПЭГ или их смесь. В частности, способ получения пероральной комплексной композиции по настоящему изобретению может содержать следующие этапы: (1) приготовление сердцевины в виде мягкой капсулы, содержащей сложные эфиры жирной кислоты омега-3, обычным для производства мягких капсул способом; (2) формирование первого покровного слоя, заключающего в себе сердцевину в виде мягкой капсулы, растворением гидрофобного покровного вещества в подходящем растворителе для барьерного покрытия, например в смеси этанола и воды, нанесение раствора для нанесения покрытия на сердцевину в виде мягкой капсулы и затем высушивание раствора; и (3) формирование второго покровного слоя на первом покров-3 023405 ном слое растворением ингредиентов (i) и (ii) с щелочными стабилизаторами и/или другими фармацевтически приемлемыми добавками в подходящем растворителе, например в смеси этанола и воды, нанесение раствора для нанесения покрытия на поверхность первого покровного слоя и затем высушивание раствора. Комплексная композиция по настоящему изобретению может быть получена в капсульной форме и может быть введена перорально. Пероральная комплексная композиция по настоящему изобретению может демонстрировать скорость высвобождения розувастатина или его фармацевтически приемлемой соли 80% или более в 0,05 М цитратном буфере в течение 30 мин, предпочтительно в течение 10 мин; и отсутствие отсроченного высвобождения после срока хранения 6 месяцев при 40 С при относительной влажности (ОВ) 75%. Результаты вышеуказанного теста показывают хорошую скорость растворения и устойчивость при хранении, и,следовательно, возможно их использование в композитных формах. Пероральная комплексная композиция по настоящему изобретению содержит как сложные эфиры жирной кислоты омега-3, так и розувастатин в качестве активных фармацевтических ингредиентов, которые могут повышать уровень сывороточных ЛПВП, при этом снижая как ЛПНП, так и ТГ уровни. Таким образом, она может быть использована для эффективного предотвращения или лечения гипертриглицеридемии, гиперхолестеринемии, коронарно-артериальных болезней сердца (КАБС), дислипидемии и повышенных уровней сывороточного холестерина ЛПНП, и она также может быть использована для предотвращения или лечения сердечно-сосудистых заболеваний. Примеры Следующие примеры предоставлены для иллюстрации предпочтительных вариантов осуществления настоящего изобретения, и подразумевается, что они не ограничивают объем настоящего изобретения. Приготовление сердцевины в виде мягкой капсулы. Сравнительный пример 1. Мягкая капсула, содержащая сложный эфир жирной кислоты омега-3. Мягкую капсулу изготовили, используя 1000 мг масел, содержащих сложные эфиры жирной кислоты омега-3, с применением общепринятого способа производства мягкой желатиновой капсулы. Сравнительный пример 2. Мягкая капсула, содержащая сложные эфиры жирной кислоты омега-3 и розувастатин. Мягкую капсулу изготовили, повторяя процедуры сравнительного примера 1, за исключением применения гомогенной смеси 1000 мг масел, содержащих сложные эфиры жирной кислоты омега-3 и 10 мг розувастатина. Первое покрытие. Сравнительный пример 3. Мягкая капсула со сложным эфиром жирной кислоты омега-3 с общепринятым барьерным покрытием. В соответствии с ингредиентами, описанными в табл. 1, гидроксипропилметилцеллюлозу (ГПМЦ 2910, Shinetsu Co. Ltd., Япония), полиэтиленгликоль (ПЭГ 6000, Sanyo Chemical Industries, Ltd., Япония) и поливинилпирролидон (ПВП К-30, BASF SE, Германия) добавляли к смеси этанола и воды и затем перемешивали для получения раствора для нанесения покрытия. Раствор для нанесения покрытия наносили на поверхность сердцевины в виде мягкой капсулы, полученной в сравнительном примере 1, с использованием устройства для нанесения покрытия (SFC-30,SEJONG Co., Ltd.), где температура подаваемого воздуха составляла 45 С и температура продукта была установлена на 30 С. Продукт высушивали в течение 30 мин для удаления остаточного растворителя,таким образом получали мягкую капсулу с барьерным покрытием. Примеры 1-7. Мягкая капсула со сложным эфиром жирной кислоты омега-3 с гидрофобным барьерным покрытием. В соответствии с ингредиентами, описанными в табл. 1, мягкую капсулу с гидрофобным барьерным покрытием готовили повторением процедуры сравнительного примера 3, за исключением добавления этилцеллюлозы (Dow Chemical Company, США) в качестве гидрофобного покровного вещества. Композиции мягких капсул и барьерные покрытия суммированы в табл. 1. Второе покрытие. Сравнительные примеры 4-6. Мягкая капсула со сложным эфиром жирной кислоты омега-3 с розувастатиновым покрытием. Кальциевую соль розувастатина, гидроксипропилметилцеллюлозу (ГПМЦ 2910, Shinetsu Co., Ltd.,Япония), полиэтиленгликоль (ПЭГ 6000, Sanyo Chemical Industries, Ltd., Япония) и ПВС (Kurary Co., Ltd.,Япония) добавляли к смеси этанола и воды и затем перемешивали для получения раствора для нанесения покрытия. Раствор для нанесения покрытия наносили на поверхность мягких капсул со сложным эфиром жирной кислоты омега-3, полученных в сравнительных примерах 1, 3 и примере 5 соответственно, с использованием устройства для нанесения покрытия (SFC-3, SEJONG Co., Ltd.), где температура подаваемого воздуха составляла 45 С и температура продукта была установлена на 30 С. Продукты высушивали в течение 30 мин для удаления остаточного растворителя, таким образом получали комплексные композиции. Примеры 8-12. Мягкая капсула со сложным эфиром жирной кислоты омега-3 с розувастатиновым покрытием. Розувастатин кальция, гидроксипропилметилцеллюлозу (ГПМЦ 2910, Shinetsu Co., Ltd., Япония) и полиэтиленгликоль (ПЭГ 6000, Sanyo Chemical Industries, Ltd., Япония) добавляли к смеси этанола и воды. Туда добавляли дополнительно ПВС (Kurary Co., Ltd., Япония) или графт-сополимер ПВС-ПЭГ (Kollicoat IR, BASF SE, Германия) и затем перемешивали для получения раствора для нанесения покрытия. Раствор для нанесения покрытия наносили на поверхность мягкой капсулы со сложным эфиром жирной кислоты омега-3, полученной в примере 5, с использованием устройства для нанесения покрытия(SFC-3, SEJONG Co., Ltd.), где температура подаваемого воздуха составляла 45 С и температура продукта была установлена на 30 С. Продукты высушивали в течение 30 мин для удаления остаточного растворителя, таким образом получали комплексные композиции. Композиции вторых покровных слоев суммированы в табл. 2. Таблица 2 Анализ. Тест 1. Тест на распадаемость мягких капсул с барьерным покрытием. Тест на распадаемость выполняли с мягкой капсулой, полученной в сравнительном примере 1, мягкой капсулой с барьерным покрытием, полученной в сравнительном примере 3, и мягкими капсулами с гидрофобным покрытием, полученными в примерах 1-7, в соответствии со способом, описанным в способе общего анализа Корейской фармакопеи. Результаты показаны на фиг. 1 и 2. Как показано на фиг. 1 и 2, мягкая капсула, полученная в сравнительных примерах 1 и 3, демонстрировала удовлетворительные результаты времени распадаемости менее чем за 20 мин в соответствии со стандартами Корейской фармакопеи. Также получали удовлетворительные результаты с мягкими капсулами, поученными в примерах 17. Мягкая капсула, полученная в примере 7, однако, демонстрировала замедление времени распадаемости из-за добавленного гидрофобного вспомогательного вещества, т.е. этилцеллюлозы, в количестве,превышавшем 75 мас.% для предотвращения изменения в содержании воды. Следовательно, было обнаружено, что предпочтительное количество гидрофобного покровного вещества в первом покровном слое составляет 75 мас.% или менее, более предпочтительно 72 мас.% или менее в расчете на массу первого покровного слоя, чтобы удовлетворить стандартам теста на распадаемость. Тест 2. Скорость абсорбции воды мягкими капсулами с барьерным покрытием. Капсулы, полученные в сравнительных примерах 1 и 3 и примерах 1-7, высушивали в течение 6 дней при ОВ 30% и измеряли содержание воды в покрытии желатиновой капсулы. За изменением содержания воды наблюдали посредством измерения потери в массе при высушивании в соответствии со способом, описанным в способе общего теста Корейской фармакопеи, где измерение проводили при 90 С в состоянии равновесия, где масса образца больше не изменяется, и затем результаты регистрировали как начальные содержания воды. Образцы также тестировали на эффект предохранения от проникновения воды повторением способа измерения после выдерживания в течение 24 ч при 25 С/60% ОВ и результаты регистрировали в качестве конечного содержания воды, которое показано на фиг. 3. Как показано на фиг. 3, мягкие капсулы без покрытия и с общепринятым барьерным покрытием,полученные в сравнительном примере 1 и 3 соответственно, демонстрировали относительно большое изменение в содержании воды, т.е. 6% или более, по сравнению с начальным содержанием воды. Однако, мягкие капсулы с гидрофобным покрытием, содержащим этилцеллюлозу, полученные в примерах 1-7, имели результатом небольшое изменение в содержании воды. В частности, мягкие капсулы с гидрофобным покрытием, содержащим этилцеллюлозу в количестве 16% или более, имели результатом только 3% изменение или менее в содержании воды, что демонстрирует, что применение этилцеллюлозы значительно улучшает стабильность композиции, снижая абсорбцию воды на 50% или более по сравнению с покрытиями без этилцеллюлозы. Дополнительно, может быть обнаружено, что предпочтительное количество гидрофобного покровного вещества, использованного в первом покровном слое, составляет от 15 до 75 мас.%, более предпочтительно от 16 до 75 мас.%, наиболее предпочтительно от 16 до 72 мас.% в расчете на массу первого покровного слоя. Тест 3. Скорость растворения розувастатина. Тест растворения розувастатина выполняли с Крестор (AstraZeneca plc, UK) в качестве контрольного лекарственного средства и комплексными композициями, полученными в сравнительных примерах 2, 4-6 и примерах 8-12. Тест проводили на основе способа с использованием лопастной мешалки в Корейской фармакопее при 50 об/мин с использованием 900 мл буфера 0,05 М лимонной кислоты в качестве среды для растворения и среды собирали после 10 мин, затем измеряли их начальные скорости растворения. Также образцы хранили в герметизированных сосудах из ПЭНД в течение шести месяцев при условиях ускоренного хранения (40 С/75% ОВ) и измеряли их скорости растворения. Результаты показаны на фиг. 4. Как показано на фиг. 4, комплексная композиция, полученная в сравнительном примере 2, имела низкую скорость растворения розувастатина с начального измерения. Комплексные композиции, полученные в сравнительных примерах 4 и 5, имели достаточные начальные скорости растворения 80% или более, но скорости ухудшались после шести месяцев ускоренного хранения. Также комплексная композиция, полученная в сравнительном примере 6, которая не содержит одно из ПВС или графт-сополимера ПВС-ПЭГ, имела низкую скорость растворения по сравнению с комплексными композициями примеров 8-12. С другой стороны, комплексные композиции, полученные в примерах 8-12, где первый покровный слой содержит гидрофобное покровное вещество, т.е. этилцеллюлозу, в количестве от 16 до 72 мас.%, и второй покровный слой содержит ПВС или графт-сополимер ПВС-ПЭГ с розувастатином, имели начальные скорости растворения 80% или более. Также комплексные композиции проявляли малое высвобождение или отсутствие отсроченного высвобождения даже после 6 месяцев ускоренного хранения, демонстрируя фармацевтически стабильные скорости растворения. Соответственно по результатам может быть обнаружено, что комплексная композиция по настоящему изобретению обладает эффективностью invivo. Несмотря на то что изобретение было описано посредством вышеприведенных конкретных вариантов осуществления, необходимо осознавать, что специалистом в данной области могут быть внесены различные модификации и изменения в изобретение, и они также попадут в объем изобретения, как это определяется прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пероральная комплексная композиция, которая содержит:(a) сердцевину в виде мягкой капсулы, содержащую сложные эфиры жирной кислоты омега-3, которые содержат этиловые эфиры эйкозапентаеновой кислоты и докозагексановой кислоты в количестве 70-95 мас.% в расчете на общую массу сердцевины;(b) первый покровный слой, который наносят на сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество, выбранное из группы, состоящей из ацетатцеллюлозы, поливинилацетата, этилцеллюлозы, сополимеров (метил)акриловой кислоты, и присутствующее в количестве от 15 до 75 мас.% в расчете на общее количество первого покровного слоя; и(c) второй покровный слой, нанесенный на первый покровный слой, который содержит:(i) розувастатин или его фармацевтически приемлемую соль и(ii) поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь. 2. Пероральная комплексная композиция по п.1, где сложные эфиры жирной кислоты омега-3 присутствуют в количестве от 100 до 2000 мг. 3. Пероральная комплексная композиция по п.1, где розувастатин или его фармацевтически приемлемая соль присутствует в количестве от 1 до 50 мг. 4. Пероральная комплексная композиция по п.1, где поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь присутствуют в количестве от 25 до 85 мас.% в расчете на общее количество второго покровного слоя. 5. Пероральная комплексная композиция по п.1, которая демонстрирует скорость высвобождения розувастатина или его фармацевтически приемлемой соли 80% или более в 0,05 М цитратном буфере в течение 10 мин. 6. Способ получения пероральной комплексной композиции по п.1, который содержит следующие этапы:(1) получение сердцевины в виде мягкой капсулы, содержащей сложные эфиры жирной кислоты омега-3, которые содержат этиловые эфиры эйкозапентаеновой кислоты и докозагексановой кислоты в количестве 70-95 мас.% в расчете на общую массу сердцевины;(2) формирование первого покровного слоя, который наносят на сердцевину в виде мягкой капсулы и содержит гидрофобное покровное вещество, выбранное из группы, состоящей из ацетатцеллюлозы,поливинилацетата, этилцеллюлозы, сополимеров (метил)акриловой кислоты, и присутствующее в количестве от 15 до 75 мас.% в расчете на общее количество первого покровного слоя;(3) формирование второго покровного слоя на первом покровном слое, который содержит:(i) розувастатин или его фармацевтически приемлемую соль и(ii) поливиниловый спирт, графт-сополимер поливинилового спирта и полиэтиленгликоля или их смесь.
МПК / Метки
МПК: A61K 9/28, A61K 31/20, A61K 47/48, A61K 9/48
Метки: редуктазы, омега-3, эфир, hmg-cоa, сложный, ингибитор, пероральная, жирной, композиция, содержащая, кислоты, комплексная
Код ссылки
<a href="https://eas.patents.su/9-23405-peroralnaya-kompleksnaya-kompoziciya-soderzhashhaya-slozhnyjj-efir-zhirnojj-kisloty-omega-3-i-ingibitor-hmg-coa-reduktazy.html" rel="bookmark" title="База патентов Евразийского Союза">Пероральная комплексная композиция, содержащая сложный эфир жирной кислоты омега-3 и ингибитор hmg-coa редуктазы</a>
Предыдущий патент: Способ лечения немелкоклеточного рака легких
Следующий патент: Антитела к гепцидину и варианты их применения
Случайный патент: Фосфолипазы, кодирующие их нуклеиновые кислоты и способы их получения и применения