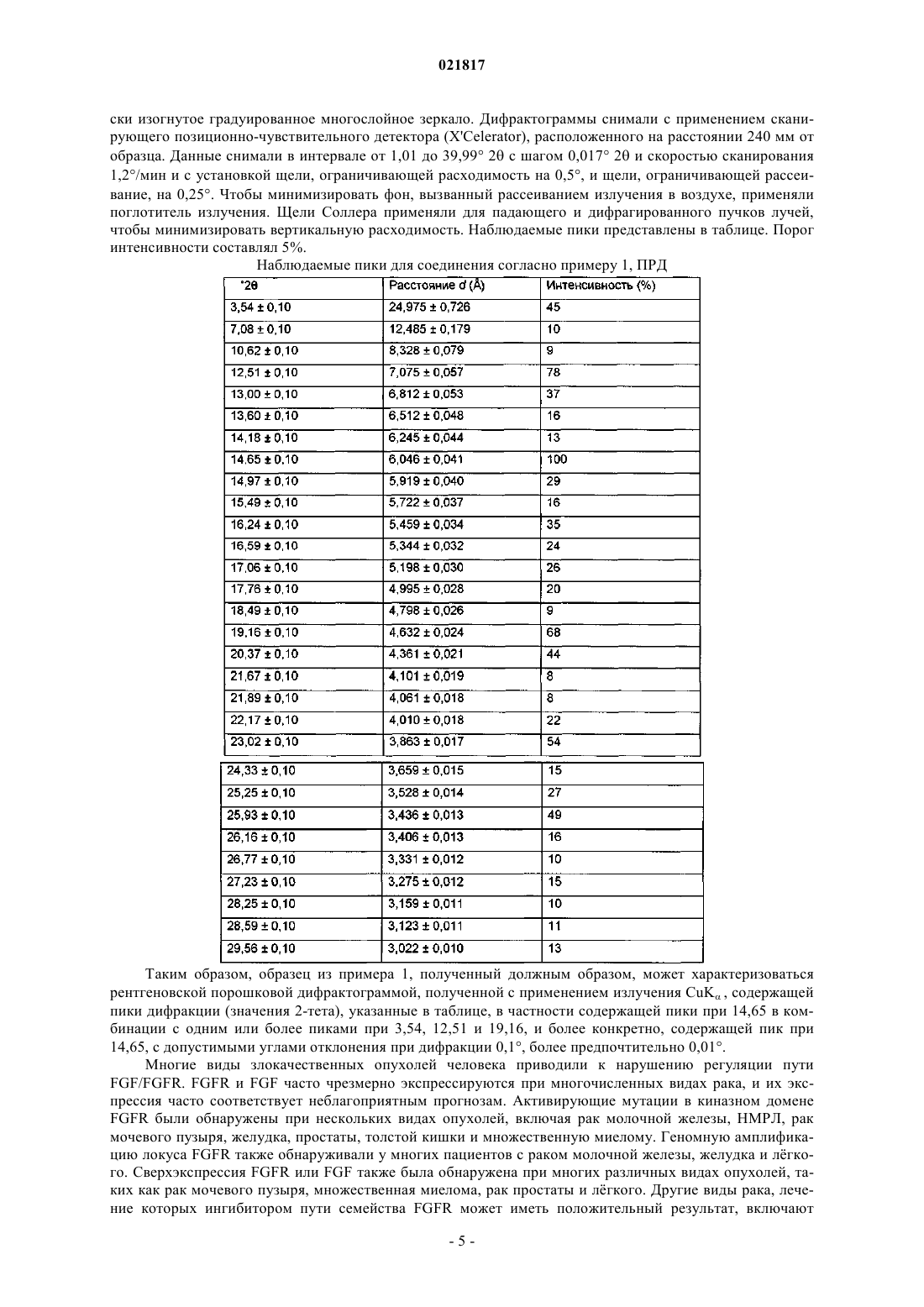
Кристаллический (r)-(e)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4-ил)этокси)-1h-индазол-3-ил)винил)-1h-пиразол-1-ил)этанола моногидрат
Формула / Реферат
1. Соединение, представляющее собой кристаллический (R)-(E)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4-ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанола моногидрат, характеризующееся рентгеновской порошковой дифрактограммой (Cu излучение, l=1,54059 Å), содержащей пик при 14,65 (2θ±0,1°), пик при 3,54 (2θ±0,1°), пик при 12,51 (2θ±0,1°), пик при 19,16 (2θ±0,1°).
2. Фармацевтическая композиция для лечения рака, содержащая соединение по п.1 в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем.
Текст
В изобретении предложен кристаллический (R)-(E)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4 ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанола моногидрат, подходящий для применения для лечения рака, а также фармацевтическая композиция для лечения рака, содержащая указанное соединение. Дисероад Бенджамин Алан (US) Лыу Т.Н. (RU)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Фактор роста фибробластов (FGF) известен в качестве важного медиатора многих физиологических процессов, таких как морфогенез в ходе развития и ангиогенез. Семейство рецепторов фактора роста фибробластов (FGFR) состоит из четырх представителей (FGFR1-FGFR4), которые представляют собой гликопротеины, состоящие из внеклеточных иммуноглобулиноподобных (Ig-подобных) доменов, гидрофобного трансмембранного участка и цитоплазматического участка, содержащего тирозинкиназный домен. Связывание FGF приводит к димеризации FGFR с последующим аутофосфорилированием рецептора и активацией нисходящих сигнальных путей. Активация рецептора является достаточной для рекрутирования и активации специфических нисходящих сигнальных партнров, участвующих в регуляции различных процессов, таких как рост клеток, метаболизм клеток и выживаемость клеток. Таким образом,сигнальный путь FGF/FGFR оказывает плейотропное действие на множество биологических процессов,важных для пролиферации, миграции, инвазии опухолевых клеток и ангиогенеза. Винилиндазолы известны в данной области техники в качестве средств для лечения рака. См., например, WO 2002/10137 и WO 2003/101968. Ингибиторы FGFR также известны в данной области техники. См., например, WO 2002/022598. В PCT/US2010/033487 предложена аморфная форма (R)-(E)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4 ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанола, которая является низкокристаллической и подходит для применения в качестве ингибитора FGFR. В настоящем изобретении предложен кристаллический (R)-(E)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4 ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанола моногидрат, характеризующийся рентгеновской порошковой дифрактограммой (Cu излучение, =1,54059 ), содержащей пик при 14,65 (20,1), пик при 3,54 (20,1), пик при 12,51 (20,1), пик при 19,16 (20,1), который является сильным ингибитором FGFR и может обеспечивать преимущества по сравнению с известной ранее формой, а именно: удобство в обращении при использовании в тврдом состоянии в больших масштабах,простоту очистки путм кристаллизации и превосходную термодинамическую устойчивость в условиях фармацевтической переработки и хранения. В настоящем изобретении также предложены фармацевтические композиции для лечения рака, содержащие соединение согласно настоящему изобретению в комбинации с одним или более фармацевтически приемлемыми носителями, разбавителями или наполнителями. Указанные виды рака выбраны из группы, состоящей из рака молочной железы, рака лгкого, рака мочевого пузыря, рака желудка, рака поджелудочной железы, рака простаты, рака толстой кишки, множественной миеломы ОМЛ, рака печени, меланомы, рака головы и шеи, рака щитовидной железы, почечно-клеточного рака, глиобластомы и рака яичка. Для специалиста в данной области техники будет понятно, что все соединения согласно настоящему изобретению способны образовывать соли. Указанные соединения согласно настоящему изобретению представляют собой амины и, следовательно, реагируют с любой из неорганических и органических кислот с образованием фармацевтически приемлемых солей присоединения кислот. Такие фармацевтически приемлемые соли присоединения кислот и общая методика их получения хорошо известны в данной области техники. См., например, P. Stahl et al., Handbook of Pharmaceutical Salts: Properties, Selection AndUse (VCHA/Wiley-VCH, 2008); S.M. Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences,vol. 66, No. 1, January 1977. В настоящем описании термин "выделенный" означает кристаллический (R)-(E)-2-(4-(2-(5-(1-(3,5 дихлорпиридин-4-ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанол, чистота которого составляет 99%. Соединения согласно настоящему изобретению могут быть получены, по существу, как показано в примерах получения и примерах ниже. Названия в следующих примерах получения и примерах получены с применением инструмента получения наименований Struct=Name в ChemDraw Ultra 10.0. Пример получения 1. 1-(3,5-Дихлорпиридин-4-ил)этанол. В 3-горлую круглодонную колбу вместимостью 12 л добавляют тетрагидрофуран (ТГФ, 3 л) и диизопропиламин (ДИПА, 315 мл, 2,24 моль), после чего смесь охлаждают до -78C. Медленно добавляют нбутиллитий (1,6 М в гексане, 1400 мл, 2,24 моль). После того как указанное добавление завершено и температура стабилизировалась на отметке -78C, медленно добавляют раствор 3,5-дихлорпиридина(296,7 г, 2,00 моль), который сразу же образует раствор жлтого цвета, который, в свою очередь, превращается в суспензию цвета ржавчины. После того как указанное добавление завершено и температура стабилизировалась на отметке -78C, медленно добавляют ацетальдегид (230 мл, 4,05 моль) в ТГФ(600 мл). Продолжают перемешивание при -78C. Через 3 ч баню с сухим льдом удаляют и начинают гасить реакцию путм добавления по каплям насыщенного водного раствора хлорида аммония (1 л). Обеспечивают нагревание реакционной смеси до комнатной температуры (КТ) в течение ночи при перемешивании. Полученную смесь разбавляют метил-трет-бутиловым эфиром (МТБЭ, 2 л), насыщенным водным раствором хлорида аммония (1 л) и водой (2 л). Разделяют и промывают органические вещества с применением насыщенного водного раствора хлорида натрия (рассола). Водную фазу подвергают экс-1 021817 тракции с применением МТБЭ (1,5 л). Органические слои объединяют, сушат над сульфатом натрия,фильтруют и концентрируют под вакуумом. Остаток подвергают очистке путм хроматографии на силикагеле [25% этилацетат (ЭА) в гексане] с получением указанного в заголовке соединения в виде масла красного цвета. Выход составляет 352 г (90%). МС (ЭР) m/z 192 [М+1]+. Пример получения 2.(S)-1-(3,5-Дихлорпиридин-4-ил)этанол. Смесь стереоизомеров, полученную на этапе 1, разделяют на колонке CHIRALPAK AD-H при элюировании смесью 90% гептана/10% этанола. Пик 2 соответствует целевому энантиомеру. Для установления абсолютной конфигурации растворяют образец продукта в CDCl3 (конечная концентрация 100 мг/мл). Получают спектр колебательного кругового дихроизма (ККД) и инфракрасный (ИК) спектр с разрешением 4 см-1 с применением ККД спектрометра ChirallR FT (BioTools Inc) с детектором ИК-излучения, снабжнным окнами из BaF2, при толщине слоя 100 мм. ККД и ИК снимают в течение 6 ч с применением 150 мкл образца. Указанные данные представляют без сглаживания или дополнительной обработки. Получают частоты колебаний и интенсивности поглощений и ККД путм оптимизации низкоэнергетического конформера по методу Гаусса при B3PW91/6-31G уровне на кластере Linux и симулируют соответствующие спектры с применением полосы колебательного кругового дихроизма лоренцевой формы шириной 6 см-1. Приведнный выше анализ показывает, что продукт представляет собой(S)-1-(3,5-Дихлорпиридин-4-ил)этилметансульфонат. Растворяют (S)-1-(3,5-дихлорпиридин-4-ил)этанол (5,02 г, 26,14 ммоль) в дихлорметане (ДХМ,100 мл) и охлаждают колбу на ледяной бане. Добавляют триэтиламин (ТЭА, 3,5 мл, 25,11 ммоль) с последующим добавлением по каплям метансульфонилхлорида (2,2 мл, 28,42 ммоль). Ледяную баню удаляют и оставляют реакционную смесь нагреваться до КТ. Через 4 ч гасят указанную реакцию водой(100 мл) и разделяют слои. Водный слой подвергают экстракции ДХМ (50 мл), а затем смесью 20% изопропилового спирта (ИПС)/хлороформа (50 мл). Органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют под вакуумом. Выход составляет 7,15 г (100%). МС (ЭР) m/z 270 [М+1]+. Пример получения 4. 4-Йод-1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1H-пиразол. В 3-горлой колбе вместимостью 1 л, снабжнной магнитной мешалкой, трубкой для ввода азота и датчиком внутренней температуры, растворяют 2-(2-бромэтокси)тетрагидро-2 Н-пиран (34 г, 156 ммоль) в ацетонитриле (АЦН, 400 мл). Добавляют 4-йодпиразол (29,34 г, 149,74 ммоль) с последующим добавлением карбоната цезия (73,4 г, 223,02 ммоль). Перемешивают полученную смесь при КТ в течение 18 ч. Фильтруют реакционную смесь через целит (CELITE), промывают отфильтрованный осадок АЦН и концентрируют фильтрат до получения масла золотистого цвета. Применяют без дополнительной очистки. Выход составляет 47,819 г (99%). МС (ЭР) m/z 323 [М+1]+. Пример получения 5. 5-(трет-Бутилдиметилсилилокси)-1H-индазол. В реакционный сосуд вместимостью 10 л загружают N,N-диметилформамид (ДМФА, 2,50 л),5-гидроксииндазол (150,20 г, 1,12 моль) и 1H-имидазол (114,35 г, 1,68 моль). Полученную смесь охлаждают до 0C и добавляют трет-бутилдиметилхлорсилан (253,16 г, 1,68 моль) в течение 0,5 ч. Полученную смесь перемешивают при 18C в течение 3 ч. В реакцию медленно добавляют воду (2,5 л) с применением ледяной бани с температурой 5C для поддержания внутренней температуры на уровне примерно 20C. Смесь перемещают в делительную воронку и подвергают экстракции ЭА (22,5 л). Экстракты объединяют и промывают водой (32,5 л) и рассолом. Органические растворы сушат над безводным сульфатом натрия, фильтруют и выпаривают до получения масла красного цвета. Указанное масло пропускают через наполнитель из силикагеля и элюируют с применением элюента (от 0 до 30% ЭА в гексане) с получением указанного в заголовке соединения в виде масла оранжевого цвета, кристаллизуется. Выход составляет 300 г (100%). МС (ЭР) m/z 249 [М+1]+.N-йодсукцинимид (298,89 г, 1,33 моль) порциями в течение 0,5 ч. Смесь перемешивают при КТ в течение 3 ч, чтобы обеспечить полное превращение по данным жидкостной хроматографии с массспектрометрией (ЖХ-МС) и тонкослойной хроматографии (ТСХ). Далее смесь охлаждают до 10C и гасят водой (2,5 л). Смесь перемещают в делительную воронку и водный слой подвергают экстракции ДХМ (2,5 л). Объединнные органические экстракты промывают 10% водным раствором тиосульфата натрия (5 л) и рассолом. Органический раствор сушат над сульфатом магния, фильтруют и концентрируют под вакуумом с получением указанного в заголовке соединения в виде тврдого вещества оранжевого цвета. Выход составляет 388 г (90%). МС (ЭР) m/z 375 [М+1]+. Пример получения 7. 5-(трет-Бутилдиметилсилилокси)-3-йод-1-(тетрагидро-2 Н-пиран-2-ил)-1H-индазол. Раствор 5-(трет-бутилдиметилсилилокси)-3-йод-1H-индазола (387,00 г, 1,08 моль) в ДХМ (2,50 л) и ТГФ (1,00 л) охлаждают до 10C в реакционном сосуде вместимостью 10 л, снабженном рубашкой. К полученной смеси добавляют метансульфоновую кислоту (14,0 мл, 216,02 ммоль) с последующим добавлением 3,4-дигидро-2 Н-пирана (296 мл, 3,24 моль) в течение 0,5 ч, наблюдая незначительный экзотермический эффект. Смесь перемешивают при КТ в течение 3 ч. Реакционную смесь охлаждают до 10C и реакцию гасят насыщенным водным раствором бикарбоната натрия (2 л). Смесь разбавляют водой (2 л) и водный слой подвергают экстракции ДХМ (2 л). Объединнные органические экстракты промывают водой (2 л) и рассолом. Органическую смесь сушат над безводным сульфатом натрия, фильтруют и концентрируют под вакуумом. Остаток элюируют через слой силикагеля с применением элюента(Е)-1-(Тетрагидро-2 Н-пиран-2-ил)-3-(2-(1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1H-пиразол-4 ил)винил)-1H-индазол-5-ол. Смесь 5-(трет-бутилдиметилсилилокси)-3-йод-1-(тетрагидро-2 Н-пиран-2-ил)-1H-индазола (14 г,30,54 ммоль) в ДМФА (150 мл) барботируют азотом в течение 10 мин в 3-горлой круглодонной колбе вместимостью 500 мл, снабжнной магнитной мешалкой, датчиком температуры и холодильником с перегородками. К полученному раствору добавляют трибутиламин (ТБА, 6,7 г, 36,1 ммоль) и 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолан (7,0 г, 43,18 ммоль) и продолжают барботирование в течение 10 мин. К полученной смеси добавляют хлорид бис-(трифенилфосфин)палладия(II) (0,45 г,0,63 ммоль) и продолжают барботировать в течение дополнительных 0,5 ч. Смесь нагревают до 95-100C в течение 18 ч. Далее охлаждают реакционную смесь до температуры ниже 40C и загружают 4-йод-1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1H-пиразол (9,8 г, 30,42 ммоль). К полученной смеси добавляют октагидрат гидроксида бария (19,3 г, 60,3 ммоль) и воду (13 мл) и продолжают барботирование в течение 10 мин. В реакционную смесь добавляют комплекс хлорид[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) и ДХМ (1,3 г, 1,56 ммоль) и продолжают барботирование в течение 0,5 ч. Смесь нагревают до 95C в атмосфере азота в течение 3 ч. Смесь разбавляют ЭА и фильтруют через целит (Celite). Целит промывают рассолом (400 мл) и разделяют слои фильтрата. Органический слой промывают рассолом и объединнные водные слои подвергают экстракции ЭА. Органические растворы объединяют и концентрируют до получения масла коричневого цвета. Указанное масло растворяют в ДХМ (100 мл) и добавляют к наполнителю из силикагеля. Наполнитель промывают с применением элюента (50% ЭА в гексане с последующим применением 70% ЭА в гексане) с получением масла светло-коричневого цвета. Растирают в порошок с применением МТБЭ (100 мл) с получением указанного в заголовке соединения в виде тврдого вещества. Выход составляет 5 г (37%). МС (ЭР) m/z 439 [М+1]+. Пример получения 9. 5-R)-1-(3,5-Дихлорпиридин-4-ил)этокси)-1-(тетрагидро-2 Н-пиран-2-ил)-3-Е)-2-(1-(2-(тетрагидро 2 Н-пиран-2-илокси)этил)-1H-пиразол-4-ил)винил)-1H-индазол. В 3-горлой круглодонной колбе вместимостью 250 мл, снабжнной датчиком внутренней температуры, обратным холодильником, трубкой для ввода азота и магнитной мешалкой, суспендируют(Е)-1-(тетрагидро-2 Н-пиран-2-ил)-3-(2-(1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1H-пиразол-4 ил)винил)-1H-индазол-5-ол (10,0 г, 22,83 ммоль) и карбонат цезия (7,88 г, 23,94 ммоль) в АЦН (92 мл),после чего нагревают суспензию до 60C. К указанной суспензии добавляют (S)-1-(3,5-дихлорпиридин-4 ил)этилметансульфонат (7,03 г, 26,02 ммоль) и перемешивают в течение ночи. Реакционную смесь охла-3 021817 ждают до КТ, фильтруют и тврдую фазу промывают АЦН. Фильтрат концентрируют и остаток подвергают очистке путм хроматографии на силикагеле (2-4% (2 М аммиака в метаноле)/ДХМ). Фракции продукта объединяют и концентрируют под вакуумом с получением пены белого цвета. Выход составляет 12,5 г (86%). МС (ЭР) m/z 612 [М+1]+. Пример получения 10 (аморфная форма). В 3-горлую круглодонную колбу вместимостью 250 мл, снабжнную капельной воронкой, отверстием для ввода азота, датчиком внутренней температуры и магнитной мешалкой, загружают метанол(57 мл) и охлаждают на ледяной бане. К полученному раствору медленно через капельную воронку добавляют ацетилхлорид (20 мл, 281,03 ммоль). К раствору через капельную воронку добавляют 5-R)-1(3,5-дихлорпиридин-4-ил)этокси)-1-(тетрагидро-2 Н-пиран-2-ил)-3-Е)-2-(1-(2-(тетрагидро-2 Н-пиран-2 илокси)этил)-1H-пиразол-4-ил)винил)-1H-индазол (7,1 г, 11,59 ммоль), растворнный в метаноле (40 мл). После завершения добавления удаляют ледяную баню, смесь нагревают до КТ и перемешивают в течение 4 ч. Реакционную смесь концентрируют под вакуумом с получением пены жлтого цвета. Жлтую пену растворяют в метаноле (10 мл) и медленно добавляют к насыщенному водному раствору бикарбоната натрия (120 мл). Полученную смесь перемешивают при КТ в течение 30 мин. Смесь фильтруют,тврдое вещество промывают водой (100 мл) и сушат под вакуумом. Указанное тврдое вещество перекристаллизовывают из горячего ЭА/метанола/гексана с получением указанного в заголовке соединения в виде тврдого вещества белого цвета. Выход составляет 2,1 г (41%). МС (ЭР) m/z 444 [М+1]+. Пример 1. Получение формы 1 моногидрата (R)-(Е)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4-ил)этокси)-1Hиндазол-3-ил)винил)-1H-пиразол-1-ил)этанола. Реакционный сосуд продували азотом и загружали в него (R)-(E)-2-(4-(2-(5-(1-(3,5-дихлорпиридин 4-ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанол и смесь растворителей, состоящую из 11% воды/ацетонитрила. Полученную суспензию нагревали до внутренней температуры 66-68C с получением раствора. Указанный раствор медленно охлаждали до 56-58C, затем вносили затравку с применением суспензии, представляющей собой затравочные кристаллы в смеси 11% воды/ацетонитрила, и медленно перемешивали. Сначала реакционную смесь охлаждали до 48-50C, а затем до 19-20C. Продукт выделяли путм фильтрования при наличии потока азота с относительной влажностью по меньшей мере 80%,пропускаемого через тврдую "лепшку". Затем уровень влажности в потоке азота последовательно снижали до 40% и продолжали сушку, что приводило к получению указанного в заголовке соединения. Следует отметить, что затравочный кристалл получали аналогично, а именно: реакционный сосуд продували азотом и загружали в него (R)-(Е)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4-ил)этокси)-1H-индазол-3 ил)винил)-1H-пиразол-1-ил)этанол и смесь растворителей, состоящую из 11% воды/ацетонитрила. Полученную суспензию нагревали до внутренней температуры 70C с получением раствора. Затем указанный раствор медленно охлаждали, обеспечивали кристаллизацию, кристаллы фильтровали и сушили. Полученное соединение представляет собой сильный ингибитор FGFR и по сравнению с указанным соединением в предшествующей форме может обладать предпочтительными свойствами, а именно превосходной обрабатываемостью тврдых веществ в больших масштабах, легкостью очистки путм кристаллизации и термодинамической устойчивостью в условиях фармацевтической обработки и хранения. Соединение согласно примеру 1, ПРД. Дифрактограмму ПРД снимали с применением дифрактометра PANalytical X'Pert Pro MPDPW3040 Pro с излучением CuK (=1,54059(напряжение: 45 кВ и сила тока: 40 мА, полученным с применением источника с длинным острым фокусом Optix. Образец помещали между плнками толщиной 3 мкм, анализировали геометрию пропускания и вращали со скоростью 1 об/с, чтобы оптимизировать статистические данные по ориентации. Перед проведением анализа анализировали образец кремния(стандартный эталонный материал NIST 640 с), чтобы установить положение пика кремния 111. Для указанного материала анализировали одну дифрактограмму PANalytical и результат предпочтительной ориентации и статистического описания частиц оценивали путем сравнения воспроизведнной дифрактограммы ПРД с анализом монокристалла. Для фокусировки рентгеновского излучения CuK источника так, чтобы указанное излучение проходило через образец и попадало на детектор, применяли эллиптиче-4 021817 ски изогнутое градуированное многослойное зеркало. Дифрактограммы снимали с применением сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца. Данные снимали в интервале от 1,01 до 39,99 2 с шагом 0,017 2 и скоростью сканирования 1,2/мин и с установкой щели, ограничивающей расходимость на 0,5, и щели, ограничивающей рассеивание, на 0,25. Чтобы минимизировать фон, вызванный рассеиванием излучения в воздухе, применяли поглотитель излучения. Щели Соллера применяли для падающего и дифрагированного пучков лучей,чтобы минимизировать вертикальную расходимость. Наблюдаемые пики представлены в таблице. Порог интенсивности составлял 5%. Наблюдаемые пики для соединения согласно примеру 1, ПРД Таким образом, образец из примера 1, полученный должным образом, может характеризоваться рентгеновской порошковой дифрактограммой, полученной с применением излучения CuK , содержащей пики дифракции (значения 2-тета), указанные в таблице, в частности содержащей пики при 14,65 в комбинации с одним или более пиками при 3,54, 12,51 и 19,16, и более конкретно, содержащей пик при 14,65, с допустимыми углами отклонения при дифракции 0,1, более предпочтительно 0,01. Многие виды злокачественных опухолей человека приводили к нарушению регуляции путиFGF/FGFR. FGFR и FGF часто чрезмерно экспрессируются при многочисленных видах рака, и их экспрессия часто соответствует неблагоприятным прогнозам. Активирующие мутации в киназном доменеFGFR были обнаружены при нескольких видах опухолей, включая рак молочной железы, НМРЛ, рак мочевого пузыря, желудка, простаты, толстой кишки и множественную миелому. Геномную амплификацию локуса FGFR также обнаруживали у многих пациентов с раком молочной железы, желудка и лгкого. Сверхэкспрессия FGFR или FGF также была обнаружена при многих различных видах опухолей, таких как рак мочевого пузыря, множественная миелома, рак простаты и лгкого. Другие виды рака, лечение которых ингибитором пути семейства FGFR может иметь положительный результат, включаютFGF и FGFR также являются важнейшими регуляторами ангиогенеза, особенно во время роста опухоли. Ось FGF/FGFR также играет важную роль в увеличении других стромальных клеток опухоли, таких как ассоциированные с раком фибробласты. Повышающая регуляция FGF также приводит к устойчивости к антиангиогенной терапии и другим видам химиотерапии. Наконец, низкомолекулярные ингибиторыFGFR демонстрировали противоопухолевую активность в нескольких доклинических моделях опухолей и в настоящее время изучаются в клинических условиях. В своей совокупности FGF/FGFR путь имеет существенное значение для нескольких важных клеточных процессов в раковых клетках. Согласно указанным причинам способы лечения, основанные на таргетинге сигнальной системы FGFR и/или FGF,могут действовать как непосредственно на клетки опухоли, так и на опухолевый ангиогенез. Продукт 10 испытывали, по существу, как описано ниже, проводя следующие анализы: ферментный анализ FGFR1 (связывание на фильтрах), ферментный анализ FGFR3 (связывание на фильтрах), клеточный анализ FGF9-индуцированной p-ERK в КТ-112 (в присутствии БСА) и клеточные анализыAlphaScreen SureFire обнаружения фосфорилирования ERK (Thr202/Tyr204) в эндотелиальных клетках пупочной вены человека (ЭКПВЧ). Указанные анализы демонстрируют, что продукт 10 представляет собой ингибитор пути семейства FGFR и обладает противораковой активностью. Таким образом, результаты, полученные для применением аморфной формы (R)-(Е)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4 ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанола, являются показательными в отношении результатов, полученных для соединения согласно настоящему изобретению. Кристаллические формы указанного соединения тем не менее являются предпочтительными, поскольку по сравнению с известной ранее формой могут обеспечивать удобство в обращении при использовании в тврдом виде в больших масштабах, простоту очистки путм кристаллизации и превосходную термодинамическую устойчивость в условиях фармацевтической переработки и хранения. Ферментный анализ FGFR1 и FGFR3 (связывание на фильтрах). Киназу FGFR1 или FGFR3 (0,15 нг/мкл FGFR1 человека или 0,32 нг/мкл FGFR3 человека) выдерживали в 50 мкл буферного раствора, содержащего 10 ммоль 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (ГЭПЭС) с рН 7,5, 8 ммоль трис-(гидроксиметил)аминометана (трис-HCl) с рН 7,5,5,0 ммоль дитиотреитола (ДТТ), 10,0 мкмоль аденозинтрифосфата (АТФ), 10 ммоль MnCl2, 150 ммольNaCl, 0,01% TRITON X-100, 0,5 мкКи 33 Р-АТФ и 0,05 мкг/мкл поли(Glu-Tyr). Реакцию проводили в объме 50 мкл при КТ в течение 30 мин, а затем гасили путм добавления 130 мкл 10% Н 3 РО 4. Реакционную смесь (120 мкл) перемещали в 96-луночный планшет с размером пор 1,0 мкм с фильтром из стекловолокна, выдерживали при КТ в течение 20-30 мин, а затем трижды промывали на TITPETEK Zoom с применением 0,5% Н 3 РО 4. Перед добавлением 40 мкл MicroScint 20 (Packard) лунки подвергали воздушной сушке, а затем подсчитывали на счтчике Wallac Micobeta. Для осуществления соединением ингибирования обеспечивали указанное соединение в виде растворов 10 ммоль исходного продукта в диметилсульфоксиде (ДМСО). Указанное соединение последовательно разбавляли 20% ДМСО в соотношении 1:3 для получения 10 точек кривой концентрация-эффект и разбавляли в соотношении 1:5 (от 20 мкмоль до конечной концентрации 0,001 мкмоль в 4% ДМСО) в реакционном планшете перед добавлением реакционной смеси в планшет с фильтром для определения активности соединения. Контрольные лунки содержали только 4% ДМСО, тогда как основные данные устанавливали на основе контрольных лунок, содержащих 0,1 моль этилендиаминтетрауксусной кислоты (ЭДТА). Процент ингибирования для каждой из 10 концентраций вычисляли исходя из контрольных лунок на каждом планшете, и данные зависимости эффекта от 10 значений концентрации впоследствии анализировали с применением программы ActivityBase (IDBS), используя логистическое уравнение с 4 параметрами, и абсолютные значенияIC50 устанавливали исходя из кривой, полученной в результате подбора. Минимально значимые отношения (MCR) для установленной IC50 в ферментных анализах FGFR1 и FGFR3 составляли 1,38 и 1,47 соответственно. В ходе указанных анализов было установлено, что IC50 продукта 10 для FGFR1 и FGFR3 составляла 0,0077 и 0,0064 мкмоль соответственно. Указанные данные демонстрируют, что продукт 10 является сильным ингибитором ферментов FGFR1 и FGFR3.FGF9-индуцированная p-ERK с БСА. Клетки RT112 раковой опухоли мочевого пузыря человека высеивали при плотности 5000 клеток/лунку в 100 мкл RPMI 1640 (Gibco 11875-085) с добавлением 10% фетальной бычьей сыворотки(ФБС, Gibco 10082-147) и 1% раствора пенициллина/стрептомицина (Gibco 15140-122) в 96-луночные планшеты CELLBIND (Corning 3340) и выдерживали в течение ночи при 37C. На следующее утро среду для роста удаляли и заменяли на 100 мкл RPMI 1640 с добавлением 20 мг/мл альбумина бычьей сыворотки (БСА). После 3 ч выдерживания при 37C в каждую лунку добавляли 20 мкл соединений, разбавленных в три этапа, в RPMI 1640 с 20 мг/мл БСА в 6% ДМСО. Это давало 10 точек кривой дозаэффект в диапазоне 10-0,005 мкмоль в 1% ДМСО. Выдерживание продолжали в течение 1 ч при 37C. Клетки стимулировали с применением 50 мкл раствора 50 мкг/мл FGF9 (RD Systems 273-F9) в бессывороточной RPMI с получением конечной концентрации FGF9 500 нг/мл. Клетки фиксировали путм добавления 30 мкл 25% раствора формальдегида в фосфатно-солевом буфере (ФСБ) (конечная концентрация формальдегида 3,7%) и выдерживали в течение 30 мин при КТ. Клетки трижды промывали ФСБ с последующим добавлением 100 мкл охлажднного метанола и выдерживали в течение 30 мин при -20C. Метанол удаляли и клетки обрабатывали ФСБ, содержащим 0,1% TPITON X-100 (ФСБТ), трижды промывали ФСБ и выдерживали 15 мин при КТ. Затем клетки выдерживали в течение ночи при 4C при осторожном встряхивании в 50 мкл раствора первичных антител к р-р 44/42 MAPK (Cell Signaling 9101S) в ФСБ в соотношении 1:400 с добавлением 2% БСА, 0,01% коктейля ингибиторов фосфатазы 1 (SigmaP2850), 0,01% коктейля ингибиторов фосфатазы 2 (Sigma P5726) и 0,01% коктейля ингибиторов протеаз(Sigma P8340). На следующее утро планшеты дважды промывали ФСБТ и дважды ФСБ с последующим выдерживанием в течение 1 ч при КТ в темноте в 80 мкл раствора вторичных антител козы против IgGH+L кролика, конъюгированных с Alexa Fluor 488, (Bvitrogen A11034) в ФСБ в соотношении 1:1000 с 1% БСА и 0,1% коктейля ингибиторов фосфатазы 1, 0,01% коктейля ингибиторов фосфатазы 2 и 0,01% коктейля ингибиторов протеаз. Клетки трижды промывали ФСБ с последующим добавлением 100 мкл раствора пропидиййодида (ПИ) (молекулярный зонд Р-3566) в ФСБ в соотношении 1:200, а затем выдерживали в темноте в течение 1 ч. Количество p-ERK-положительных клеток и общее количество клеток в каждой лунке определяли при помощи ACUMEN EXPLORER (TTP LabTech Ltd) с применением оптического фильтра 500-530 нмоль и 575-640 нмоль для Alexa 488 и ПИ соответственно. Значения общей средней интенсивности pERK на лунку при применении Alexa 488 впоследствии преобразовывали в процент ингибирования с применением значений, полученных исходя из минимального (10 мкмоль положительного контрольного соединения в ДМСО) и максимального (только ДМСО) контроля, оборудованного на одном и том же планшете. Проценты ингибирования и данные зависимости эффекта от 10 значений концентрации впоследствии анализировали с применением сигмоидального уравнения доза-эффект с 4 параметрами и относительные значения IC50 устанавливали исходя из полученной кривой. Минимально значимое отношение (MCR) для IC50, установленной в ходе анализа FGF9, индуцированного p-ERK с БСА, составляло 2,7. В ходе указанного анализа было установлено, что IC50 продукта 10 составляла 0,0004 мкмоль. Указанные данные демонстрируют, что продукт 10 является сильным ингибиторомFGF9-индуцированного фосфорилирования ERK в раковых клетках человека. Определение фосфорилирования ERK (Thr202/Tyr204) в эндотелиальных клетках пупочной вены человека (ЭКПВЧ) с применением AlphaScreen SureFire. Влияние соединения на ингибирование рецептора FGF 1 определяли путм мониторинга фосфорилирования ERK (pERK) в ответ на стимуляцию основного фактора роста фибробластов (b-FGF) в эндотелиальных клетках пупочной вены человека (ЭКПВЧ). Уровни полученной pERK измеряли с применением системы AlphaScreen SureFire (TGR Biosciences, TGRES50K). Данный анализ носит гомогенный характер и проводится с применением "сэндвич"-иммунного связывания фосфорилированного анализируемого образца с последующим обнаружением с применением гранул AlphaScreen, покрытых антителами, (Perkin Elmer) для образования усиленного сигнала. ЭКПВЧ извлекали и сохраняли в среде для роста, состоящей из основной среды для эндотелиальных клеток (Clonetics, СС-3132) с добавлением 10% ФБС, 0,4% экстракта бычьего мозга, 0,1% гидрокортизона, 0,1% сульфата гентамицина, амфотерицина-В и 0,1% эпидермального фактора роста, рекомбинация человека до 7 пассажей. Клетки брали для анализа с применением стандартных процедур, а затем пересчитывали. Клетки (20000/лунка) высевали в 100 мкл среды для роста в 96-луночных планшетах с покрытием из поли-D-лизина (BD, 354640). Планшеты выдерживали в течение ночи при 37C, 5% СО 2. В день проведения анализа клетки выдерживали в 100 мкл бессывороточной ОЭК (основной для эндотелиальных клеток) среды, содержащей 1,5% ФБС и 20 мг/мл БСА, в течение 3 ч при 37C, 5% СО 2,затем обрабатывали 20 мкмоль соединения, разбавленного в три этапа, в минимальной среде в течение 1 ч при 37C. Это давало 10 точек кривой концентрации-эффекта в диапазоне 10-0,005 мкмоль в 1% ДМСО. После 1 ч обработки соединения клетки стимулировали с применением 50 мкл b-FGF (Sigma,F0291, конечная концентрация b-FGF 50 нг/мл) при 37C в течение 15 мин. В лунках, содержащих клетки и 50 мкл стимулятора b-FGF, вырабатывался максимальный сигнал, а в лунках, содержащих клетки с 10 мкмоль положительного контрольного соединения и 50 мкл стимулятора b-FGF, вырабатывался минимальный сигнал. Затем среду удаляли, в каждую лунку добавляли 50 мкл 1 SureFire буфера для лизиса (часть комплекта SureFire TGR Biosciences) и выдерживание продолжали при КТ в течение 10 мин при осторожном встряхивании. Для обнаружения pERK 6 мкл лизата и 10 мкл реакционной смеси(60 частей рабочего буферного раствора/10 частей активирующего буферного раствора/по 0,6 частей гранул донора и акцептора, Perkin Elmer, 6760617R) перемещали в 384-луночный планшет proxiplate(Perkin Elmer, 6006280). Указанный планшет герметизировали и выдерживали при КТ в течение 2 ч при осторожном встряхивании, а затем прочитывали на спектрофотометре для прочтения планшетов PerkinElmer EnVision, снабжнном TurboModule, с применением стандартных параметров настройкиAlphaScreen (Ех 680 нм и Em520-620 нм). Показатели излучения преобразовывали в процент ингибирования,установленный исходя из максимального (только ДМСО) и минимального (10 мкмоль положительного контрольного соединения в ДМСО) контроля на каждом планшете, а затем данные при 10 значениях концентрации соединения подставляли в логистическое уравнение с четырьмя параметрами с применением Activitybase 4,0 и устанавливали значение IC50. Минимально значимое отношение (MCR) для IC50,установленной в результате анализа, в ходе которого осуществляли AlphaScreen SureFire обнаружение фосфорилирования ERK (Thr202/Tyr204), составляло 2,1. В ходе указанного анализа было установлено, что IC50 продукта 10 составляла 0,0006 мкмоль. Указанные данные демонстрируют, что продукт 10 является сильным ингибитором b-FGF-индуцированного фосфорилирования ERK в эндотелиальных клетках пупочной вены человека. Соединение согласно настоящему изобретению предпочтительно готовят в виде фармацевтической композиции, вводимой различными способами. Наиболее предпочтительно такие композиции представляют собой композиции для перорального или внутривенного введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области. См., например, Remington: TheScience And Practice Of Pharmacy (D. Troy et al., eds., 21st Ed., Lippincott WilliamsWilkins, 2005). Соединение согласно настоящему изобретению, как правило, эффективно в широком диапазоне доз. Например, суточные дозы обычно находятся в диапазоне от примерно 0,5 до примерно 100 мг/кг массы тела. В некоторых случаях уровни доз ниже нижнего предела вышеуказанного диапазона могут быть более чем достаточными, тогда как в других случаях могут быть применены ещ большие дозы, не вызывая каких-либо опасных побочных эффектов, и, следовательно, вышеуказанный диапазон доз в любом случае не предназначен для ограничения объма настоящего изобретения. Следует понимать, что фактически вводимое количество соединения будет определять врач с учтом соответствующих обстоятельств, включая заболевание, подлежащее лечению, выбранный способ введения, вводимое действующее соединение или соединения, возраст, вес и восприимчивость конкретного пациента и тяжесть симптомов у пациента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой кристаллический (R)-(E)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4 ил)этокси)-1H-индазол-3-ил)винил)-1H-пиразол-1-ил)этанола моногидрат, характеризующееся рентгеновской порошковой дифрактограммой (Cu излучение, =1,54059 ), содержащей пик при 14,65(20,1), пик при 3,54 (20,1), пик при 12,51 (20,1), пик при 19,16 (20,1). 2. Фармацевтическая композиция для лечения рака, содержащая соединение по п.1 в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем.
МПК / Метки
МПК: A61P 35/00, A61K 31/4439, C07D 401/14
Метки: моногидрат, кристаллический, r)-(e)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4-ил)этокси)-1h-индазол-3-ил)винил)-1h-пиразол-1-ил)этанола
Код ссылки
<a href="https://eas.patents.su/9-21817-kristallicheskijj-r-e-2-4-2-5-1-35-dihlorpiridin-4-iletoksi-1h-indazol-3-ilvinil-1h-pirazol-1-iletanola-monogidrat.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллический (r)-(e)-2-(4-(2-(5-(1-(3,5-дихлорпиридин-4-ил)этокси)-1h-индазол-3-ил)винил)-1h-пиразол-1-ил)этанола моногидрат</a>
Предыдущий патент: Разветвленный поликарбонат
Следующий патент: Варианты хвостовой части редокс-активных лекарственных средств для лечения митохондриальных болезней и модуляция биомаркера энергетического обмена q10
Случайный патент: Ингибиторы клеточной адгезии